Свойства ацетилена получение ацетилена: Ацетилен: свойства и все характеристики
alexxlab | 13.07.2023 | 0 | Разное
Лабораторный опыт 19 Ацетилен, его получение и свойства Химия Рудзитис Г.Е., Фельдман Ф.Г. 9 класс – Рамблер/класс
Лабораторный опыт 19 Ацетилен, его получение и свойства Химия Рудзитис Г.Е., Фельдман Ф.Г. 9 класс – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания “Останкино”?
Поделитесь решением
Ацетилен, его получение и свойства
1.
Наблюдение. Происходит бурная реакция с выделением газа.
2. Газоотводную трубку опустите до дна в другую пробирку с 2—3 мл бромной
воды.
Наблюдение. Бромная вода постепенно обесцвечивается.
3. Затем получающийся газ пропустите через 2—3 мл сильно разбавленного раствора перманганата калия.
Наблюдение. Раствор постепенно обесцвечивается.
4. Когда эти опыты сделаны, выходящий из трубок газ подожгите.
Наблюдение. Газ горит сильно коптящим пламенем.
5. В пламя вдувайте воздух.
Наблюдение. Пламя становится более светящимся и не коптит.
Задания. 1. Почему ацетилен обесцвечивает бромную воду и перманганат калия? 2. Почему ацетилен горит сильно коптящим пламенем? 3. Почему в ацетиленовом пламени не образуется копоть, если через него продувать воздух? 4. Напишите уравнения соответствующих реакций.
ответы
Ацетилен, его получение и свойства
1. Ацетилен обесцвечивает бромную воду, так
Ацетилен обесцвечивает бромную воду, так
как вступает в реакцию бромирования:
Образуется тетрабромэтан, что доказывает непредельность ацетилена.
Ацетилен обесцвечивает перманганат калия за
счет того, что ацетилен восстанавливает перманганат калия:
2. Ацетилен содержит в процентном отношении
очень большое количество углерода, в результате
неполного сгорания образуется большое количество
частиц сажи (копоть).
3. Если в ацетиленовое пламя вдувать воздух,
происходит полное сгорание ацетилена без образования твердых частиц копоти. Пламя становится
бесцветным.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых).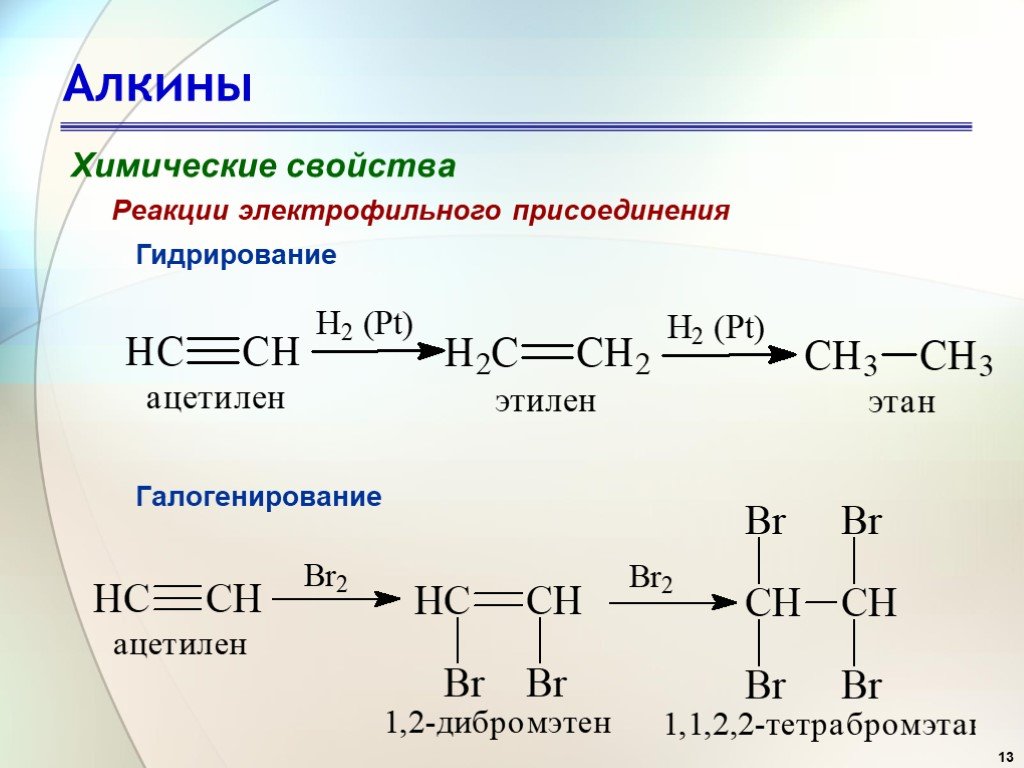 ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Ацетилен физически и химические свойства
Ацетилен относится к органическим соединениям, ненасыщенным углеводородам — алкинам. В обычных условиях ацетилен представляет собой бесцветный газ. Очень горюч. Имеет формулу C2H2, то есть молекула ацетилена — это два атома углерода и два атома водорода, причём связь между углеродными атомами тройная.
Синтез ацетилена
В лабораторных условиях газ ацетилен получают, воздействуя водой на углеродистый кальций. Впервые эту реакцию провёл в 1860-х годах химик Вёлер. Ещё один способ получить молекулу ацетилена — дегидрировать две метановые молекулы, нагревая их до 1400 °C и выше.
Промышленный способ синтезировать ацетилен — гидролизовать углеродистый кальций, при этом ацетилен получают в чистом виде; или подвергнуть термическому разложению углеводородное сырьё.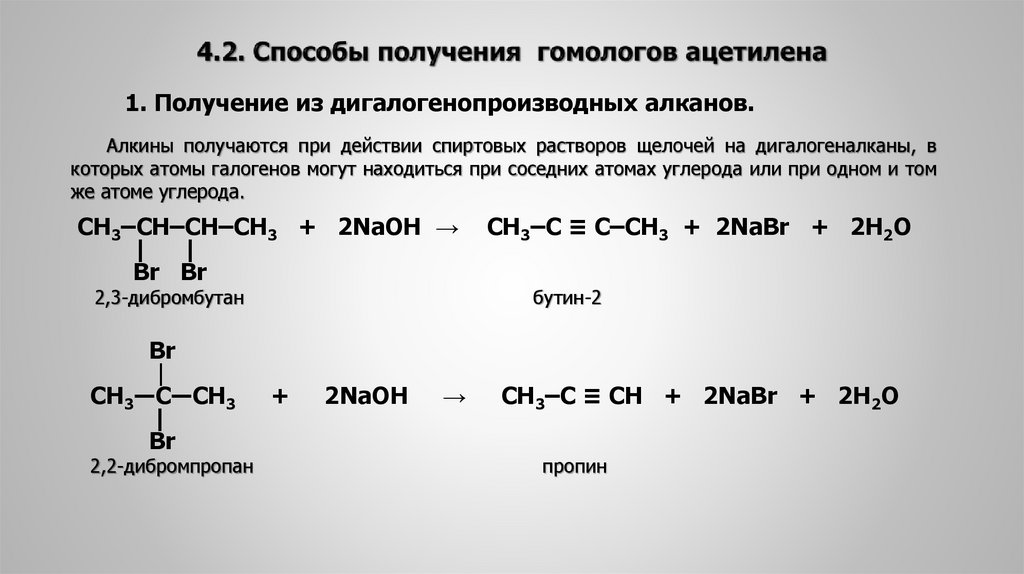
Существует несколько видов термического разложения для получения ацетилена. Используемый в качестве сырья метан:
- нагревают до 1600 °C в электродуговой печи — электрокрекинг;
- обрабатывают ионизированным газом — аргоном или водородом;
- пропускают через нагретую до 1400 °C насадку — регенеративный пиролиз;
- смешивают с кислородом и нагревают смесь до 1600 °C или до 2000 °C — окислительный или гомогенный пиролиз, соответственно.
На термическое разложение тратится меньше энергии, чем на гидролиз, но полученный ацетилен нужно очищать.
Физические характеристики ацетилена
Чистый газ ацетилен летуч и не пахнет. Баллоны для него содержат пористый наполнитель. Ацетон и другие пропитки такого наполнителя дают узнаваемый запах.
Обращаться с ацетиленом нужно осторожно. Он может взорваться от удара, от нагрева до 500 °C, а при сжатии до двух атмосфер — и без нагрева. В открытом воздухе ацетилен загорается и от пламени, и от любых искр, поэтому перевозят и используют ацетилен только в защищённых баллонах.
Химические характеристики ацетилена
Ацетилен при окислении даёт высокотемпературное пламя — до 3150 °C. Сгорая, газ даёт так много тепла благодаря тройной связи углеродных атомов.
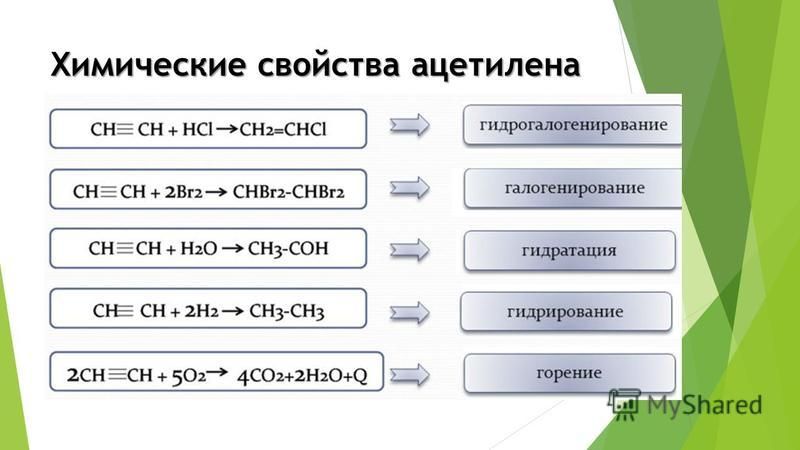
Известные химические реакции ацетилена:
- с водой образует этаналь, катализируется ртутными солями;
- обесцвечивает раствор марганцовки, водный раствор брома;
- с аммиачными растворами меди и серебра образует взрывоопасные соединения;
- полимеризируется в сложные органические соединения при 500 °C, катализируется графитом;
- проявляет свойства кислоты, образует взрывоопасный осадок с серебряными солями и одновалентной медью.
Чистый ацетилен закипает при –83 °C. Чтобы его химические свойства не привели к взрыву, ацетилен хранят только в специальных условиях, берегут от удара, от нагрева, от контакта с серебром и медью.
Требования безопасности и гигиены труда
Техника безопасности при работе с Ацетиленом
Применение ацетилена
История открытия ацетилена
ацетиленовая формула – подготовка, свойства, использование и данные.
 , в качестве альтернативы, он также определяется как простейший углеводород. Ацетилен более известен как этилен. Химическая формула этина также известна как молекулярная формула этина. Химическая формула соединения представлена как C2h3. Химическое название C2h3 предполагает, что это соединение состоит из углерода и водорода. Связь между двумя атомами углерода и водородом представляет собой тройную связь. Это делает его ненасыщенным химическим соединением. Ацетилен — бесцветный газ без запаха в чистом виде, но из-за сложности обращения с ним в коммерческих целях используют в жидком состоянии. Они являются основным компонентом топлива и служат строительным блоком для многих химических соединений.
, в качестве альтернативы, он также определяется как простейший углеводород. Ацетилен более известен как этилен. Химическая формула этина также известна как молекулярная формула этина. Химическая формула соединения представлена как C2h3. Химическое название C2h3 предполагает, что это соединение состоит из углерода и водорода. Связь между двумя атомами углерода и водородом представляет собой тройную связь. Это делает его ненасыщенным химическим соединением. Ацетилен — бесцветный газ без запаха в чистом виде, но из-за сложности обращения с ним в коммерческих целях используют в жидком состоянии. Они являются основным компонентом топлива и служат строительным блоком для многих химических соединений.В статье рассматриваются химическая формула этилена или ацетилена, структурная формула этилена, химические и физические свойства, а также химическая реакция, в которую они вовлечены.
Формула этина
Формула этина включает формула этина и структурная формула этина.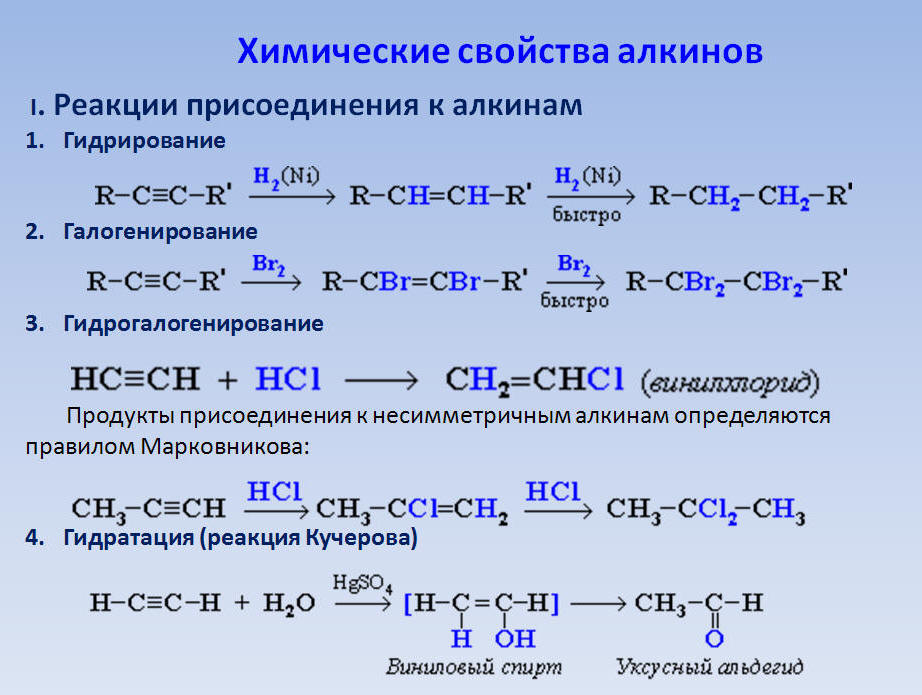 Химическая формула ацетилена может быть представлена как C2h3. химическое название C2h3 предполагает, что это соединение является простейшим углеводородом. Его также называют алкином. Отличительной особенностью ацетилена является наличие тройной связи между двумя атомами углерода, которую можно представить в структурной формуле этилена. Тройная связь находится под углом 180 градусов, что придает ему прямую форму. Угол между двумя атомами углерода в структурной формуле ацетилена представляет собой валентный угол между ними. Название ацетилена или этина по классификации ИЮПАК — ацетилен. Структурная формула этилена может быть представлена следующим образом:
Химическая формула ацетилена может быть представлена как C2h3. химическое название C2h3 предполагает, что это соединение является простейшим углеводородом. Его также называют алкином. Отличительной особенностью ацетилена является наличие тройной связи между двумя атомами углерода, которую можно представить в структурной формуле этилена. Тройная связь находится под углом 180 градусов, что придает ему прямую форму. Угол между двумя атомами углерода в структурной формуле ацетилена представляет собой валентный угол между ними. Название ацетилена или этина по классификации ИЮПАК — ацетилен. Структурная формула этилена может быть представлена следующим образом:
[Изображение будет загружено в ближайшее время]
Как представлено в структурной формуле этина, это также указывает на то, что химическое соединение представляет собой симметричную молекулу.
Получение ацетилена (этина)
Ацетилен может быть получен с использованием различных подготовительных методов. Ацетилен также производится как побочный продукт. Исторически ацетилен производился как побочный продукт производства этилена путем крекинга углеводородов. Методы производства этина перечислены ниже.
Ацетилен также производится как побочный продукт. Исторически ацетилен производился как побочный продукт производства этилена путем крекинга углеводородов. Методы производства этина перечислены ниже.
Производится путем частичного сжигания метана.
Образуется как побочный продукт переработки при производстве этилена
Гидролиз химического карбида является широко используемым промышленным методом получения ацетилена.
Производится дегидрогалогенированием алкилдигалогенидов.
Они также производятся из вицинальных дигалогенидов
Получение из карбида кальция
Поскольку это наиболее часто используемый метод промышленного производства этина, необходимо иметь представление о нем. Этот метод включает гидролиз карбида кальция. Единственным критическим требованием является высокая температура около 2000 ° C для производства карбида кальция. Химическая реакция, участвующая в производстве, может быть представлена следующим образом
Этот метод включает гидролиз карбида кальция. Единственным критическим требованием является высокая температура около 2000 ° C для производства карбида кальция. Химическая реакция, участвующая в производстве, может быть представлена следующим образом
CaC2 + 2h3O → Ca(OH)2 + C2h3
Химические свойства
Химические свойства ацетилена включают формулу ацетилена, молекулярную массу, валентный угол, реакции соединения, молекулярную массу соединения и Эмпирическая формула ацетилена. Химические свойства соединения дают представление о реакциях соединения, существуют следующие химические свойства ацетилена, которые перечислены ниже.
Формула ацетилена или эмпирическая формула ацетилена может быть представлена как C2h3
Молекулярная масса соединения составляет 26,04 г/моль.
Количество доноров водородной связи: 0
Количество акцепторов водородной связи: 0
Нет вращающейся связи.

Они являются ненасыщенными органическими соединениями из-за тройной связи, представленной в структурной формуле этина.
Валентный угол составляет 180 градусов.
Химическое соединение относится к категории симметричных соединений.
Химическое название C2h3 предполагает, что соединение представляет собой алкин.
Сопряженная кислота ацетилена представляет собой этиниум.
Физические свойства
Физические свойства органических соединений определяются на основе молекулярной формулы ацетилена. Физические свойства соединения включают температуру плавления, температуру кипения, плотность, внешний вид и кристаллическую структуру. Некоторые из физических свойств упоминаются ниже.
Некоторые из физических свойств упоминаются ниже.
Температура кипения соединения составляет -119 °F при 760 мм ртутного столба или, альтернативно, может быть определена как -84,7 °C
Органическое соединение обычно (чисто) находится в газообразном состоянии Ацетилен представляет собой бесцветный газ
Чистая форма соединения не имеет запаха, тогда как промышленно производимая жидкая форма имеет слабый запах эфира.
Ацетилен не имеет температуры плавления, так как при естественном атмосферном давлении он не может существовать в жидком состоянии.
Температура плавления при минимальном атмосферном давлении 1,27 атм составляет -80,8 °C.

Растворим в воде и мало растворим в этаноле, сероуглероде; растворим в ацетоне, бензоле, хлороформе.
Молекулярная форма соединения на основе молекулярной формулы этина определяется как линейная структура.
Плотность ацетилена 1,1772 г/л или 1,1772 кг/м3
Химическая реакция
Ацетилен участвует в следующих химических реакциях. Винилирование, гидратация, гидрогалогенирование, присоединение к формальдегиду, карбонилирование, металлоорганическая химия и кислотно-основные реакции.
Использование
Ацетилен является очень реакционноспособным соединением и использовался в качестве основного компонента топлива в течение очень долгого времени. Сообщается также, что он используется во взрывчатых веществах. Существуют следующие виды использования химического соединения ацетилена:
Существуют следующие виды использования химического соединения ацетилена:
Они используются при сварке.
Используется в портативном освещении.
Используется в производстве пластмасс и производных акриловой кислоты.
Используется в процессе радиоуглеродного датирования
Используется в производстве полиацетилена, который считается первым природным полупроводником.
Заключение
Ацетилен, также известный как этин, является органическим соединением, его можно определить как алкин. Формула ацетилена (эмпирическая формула ацетилена) может быть представлена как C2h3. химическое соединение может быть получено с использованием нескольких методов, наиболее часто используемым методом является гидролиз карбида кальция. Еще одним коммерчески важным методом производства является частичное сжигание метана. Сопряженной кислотой соединения является этиний. В своем естественном состоянии это химическое соединение представляет собой бесцветный газ без запаха, но из-за сложности обращения с ним в коммерческих целях они используются в виде жидкостей.
Еще одним коммерчески важным методом производства является частичное сжигание метана. Сопряженной кислотой соединения является этиний. В своем естественном состоянии это химическое соединение представляет собой бесцветный газ без запаха, но из-за сложности обращения с ним в коммерческих целях они используются в виде жидкостей.
Ацетилен — Энциклопедия Нового Света
| Ацетилен | |
|---|---|
| | |
| Предпочтительное название ИЮПАК | Ацетилен |
| Систематическое название | Этин |
| Химическая формула | C 2 H 2 |
| Молекулярная масса | 26,0373 г/моль |
| Номер CAS | 74-86-2 |
| Плотность | 1,09670 кг/м 3 газ |
| Температура самовоспламенения | 305 °С |
| Максимальная температура горения | 3300 °С |
| Температура плавления | -84 °С |
| Точка кипения | -80,8 °С |
| УЛЫБКИ | С#С |
| NFPA 704 | 4 3
|
| ПабХим | 6326 |
| ЭИНЕКС | 200-816-9 |
| Отказ от ответственности и ссылки | |
Ацетилен (систематическое название: этин ) представляет собой углеводород, принадлежащий к группе алкинов.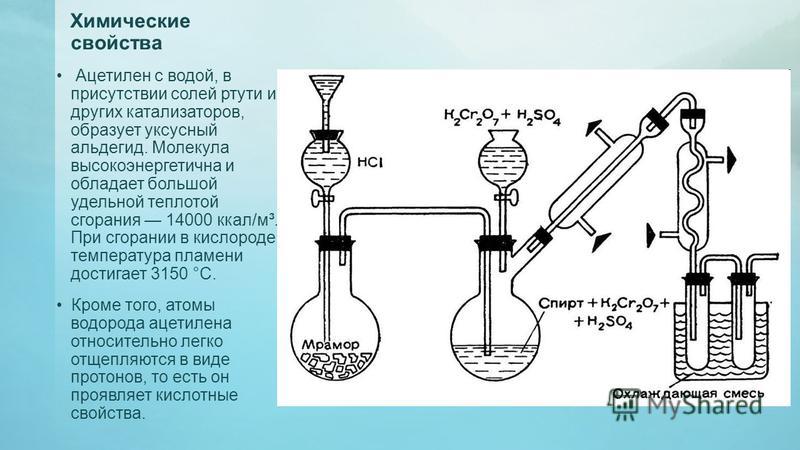 Он считается самым простым из всех алкинов, так как состоит из двух атомов водорода и двух атомов углерода. Ацетилен является ненасыщенным органическим соединением, поскольку его четыре атома связаны тройной ковалентной связью.
Он считается самым простым из всех алкинов, так как состоит из двух атомов водорода и двух атомов углерода. Ацетилен является ненасыщенным органическим соединением, поскольку его четыре атома связаны тройной ковалентной связью.
Содержание
- 2 Подготовка
- 3 Химические свойства
- 3.1 Структура
- 3.2 Реакции
- 3.3 Химия Реппе
- 4 варианта использования
- 5 Безопасность и обращение
- 5.1 Сжатие
- 5.2 Токсическое воздействие
- 5.3 Пожароопасность
- 5.4 Несовместимости
- 6 Другие значения
- 7 Естественное явление
- 8 См. также
- 9 Примечания
- 10 Каталожные номера
- 11 Внешние ссылки
- 12 кредитов
Открытие
Ацетилен был открыт в 1836 году Эдмундом Дэви, который определил его как «новый карбюратор водорода». Он был заново открыт в 1860 году французским химиком Марселлином Бертело, который и придумал название «ацетилен». Лауреат Нобелевской премии Густав Дален был ослеплен взрывом ацетилена.
Лауреат Нобелевской премии Густав Дален был ослеплен взрывом ацетилена.
Препарат
Основным сырьем для производства ацетилена являются карбонат кальция (известняк) и уголь. Карбонат кальция сначала превращается в оксид кальция, а уголь — в кокс, затем они вступают в реакцию друг с другом с образованием карбида кальция и монооксида углерода:
- CaO + 3C → CaC 2 + CO
Карбид кальция (или ацетилид кальция) и вода затем реагируют любым из нескольких способов с получением ацетилена и гидроксида кальция. Эта реакция была открыта Фридрихом Вёлером в 1862 году.
- CaC 2 + 2H 2 O → Ca(OH) 2 + C 2 H 2
Для синтеза карбида кальция требуется чрезвычайно высокая температура ~20 градусов Цельсия,
, поэтому реакция осуществляется в электродуговой печи. Эта реакция была важной частью промышленной революции в химии, которая произошла в результате высвобождения огромного количества дешевой гидроэлектроэнергии из Ниагарского водопада на рубеже девятнадцатого века.
Ацетилен также можно производить путем частичного сжигания метана с кислородом или путем крекинга углеводородов.
Бертело смог получить ацетилен из метилового спирта, этилового спирта, этилена или эфира, пропустив любой из них в виде газа или пара через раскаленную трубку. Бертло также обнаружил, что ацетилен образуется при искровом разряде через смесь цианогена и водорода. Он также смог образовать ацетилен напрямую, соединив чистый водород с углеродом с помощью электрического разряда угольной дуги.
Химические свойства
Структура
Тройная связь углерод-углерод оставляет атомы углерода с двумя sp-гибридными орбиталями для сигма-связи, помещая все четыре атома на одну прямую с углами связи CCH 180°.
Реакции
При температуре выше 400 °C (673 K) (что довольно мало для углеводорода) начинается пиролиз ацетилена. Основными продуктами являются димер винилацетилена (C 4 H 4 ) и бензол. При температуре выше 900 °C (1173 K) основным продуктом будет сажа.
Используя ацетилен, Бертло был первым, кто показал, что алифатическое соединение может образовывать ароматическое соединение, когда он нагревал ацетилен в стеклянной трубке для получения бензола с некоторым количеством толуола. Бертело окислил ацетилен, получив уксусную и щавелевую кислоты. Он обнаружил, что ацетилен можно восстановить с образованием этилена и этана.
Полимеризация ацетилена с катализаторами Циглера-Натта позволяет получить полиацетиленовые пленки. Полиацетилен, цепь молекул углерода с чередующимися одинарными и двойными связями, был первым открытым органическим полупроводником; реакция с йодом дает чрезвычайно проводящий материал.
Reppe chemistry
Вальтер Реппе также обнаружил, что ацетилен может реагировать при высоких давлениях с катализаторами на основе тяжелых металлов с образованием важных для промышленности химических веществ:
- Реакция ацетилена со спиртами, цианистым водородом, хлористым водородом или карбоновыми кислотами с образованием виниловых соединений:
- С альдегидами для получения этинилдиолов.

Используется в промышленности для производства 1,4-бутиндиола из формальдегида и ацетилена:
- HCCH + CH 2 O → CH 2 (OH)CCCH 2 OH
- С монооксидом углерода для получения акриловой кислоты или эфиров акриловой кислоты, которые можно использовать для производства акрилового стекла.
- Циклизация с получением бензола и циклооктатетраена:
Применение
Приблизительно 80% ежегодно производимого в США ацетилена используется в химическом синтезе. Остальные 20 процентов используются в основном для кислородно-ацетиленовой газовой сварки и резки из-за высокой температуры пламени; при сгорании ацетилена с кислородом образуется пламя с температурой более 3300 ° C (6000 ° F) с выделением 11,8 кДж / г. Оксиацетилен является самым горячим горючим топливным газом. (Только твердое топливо может производить химическое пламя с более высокой температурой. )
)
Ацетилен также используется в ацетиленовой («карбидной») лампе, которая когда-то использовалась шахтерами (не путать с лампой Дэви), в старинных автомобилях и до сих пор иногда используется спелеологами. В этом контексте ацетилен образуется при капании воды из верхней камеры лампы на гранулы карбида кальция (CaC 2 ) в основании лампы.
В прошлом несколько городов использовали ацетилен для освещения, в том числе Тата в Венгрии, где он был установлен 24 июля 1897 года, и Северный Петертон, Англия, в 189 году.8.
В наше время ацетилен иногда используется для науглероживания (то есть закалки) стали, когда объект слишком велик, чтобы поместиться в печь.
Ацетилен был предложен в качестве углеродного сырья для молекулярного производства с использованием нанотехнологий. Поскольку это не происходит естественным образом, использование ацетилена может ограничить неконтролируемое самовоспроизведение.
Ацетилен используется для улетучивания углерода при радиоуглеродном датировании. Углеродистый материал в археологическом образце прореагировал в небольшой специализированной исследовательской печи с металлическим литием с образованием карбида лития (также известного как ацетилид лития). Затем карбид может реагировать с водой, как обычно, с образованием газообразного ацетилена, который подается в масс-спектрометр для определения изотопного соотношения углерода 14 к углероду 12.
Углеродистый материал в археологическом образце прореагировал в небольшой специализированной исследовательской печи с металлическим литием с образованием карбида лития (также известного как ацетилид лития). Затем карбид может реагировать с водой, как обычно, с образованием газообразного ацетилена, который подается в масс-спектрометр для определения изотопного соотношения углерода 14 к углероду 12.
Будущее
Ожидается, что использование ацетилена будет постепенно увеличиваться в будущем по мере разработки новых приложений. Одним из новых применений является преобразование ацетилена в этилен для использования в производстве различных полиэтиленовых пластиков. В прошлом небольшое количество ацетилена производилось и тратилось впустую как часть процесса крекинга с водяным паром, используемого для производства этилена. Новый катализатор, разработанный Phillips Petroleum, позволяет преобразовывать большую часть этого ацетилена в этилен для повышения выхода продукции при снижении общих затрат. [1]
[1]
Безопасность и обращение
Сжатие
Из-за тройной углерод-углеродной связи газообразный ацетилен принципиально нестабилен и будет разлагаться в результате экзотермической реакции при любом сильном сжатии. Ацетилен может взорваться с чрезвычайной силой, если давление газа превышает примерно 100 кПа (≈14,5 фунтов на квадратный дюйм) в виде газа или в жидкой или твердой форме, поэтому его транспортируют и хранят растворенным в ацетоне или диметилформамиде (ДМФА), содержащемся в металлический баллон с пористым наполнением (агамассан), что делает его безопасным при транспортировке и использовании.
По всему миру действуют строгие правила перевозки баллонов с опасным газом. Использование растворенного ацетилена быстро сокращается из-за благоприятных процессов беспламенной сварки.
Токсическое воздействие
Вдыхание ацетилена может вызвать головокружение, головную боль и тошноту. [2] Он также может содержать токсичные примеси: Спецификация товаров Ассоциации сжатых газов для ацетилена установила систему классификации для выявления и количественного определения содержания фосфина, арсина и сероводорода в товарных сортах ацетилена, чтобы ограничить воздействие этих примесей.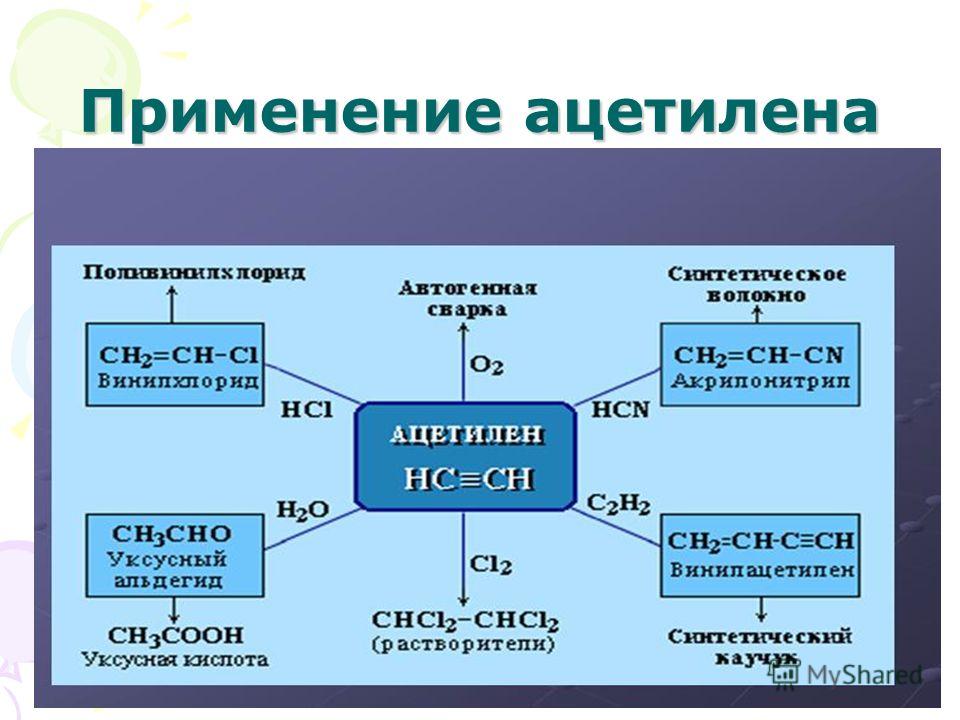 . [3] Сера, фосфор и мышьяк являются переносчиками из сырья для синтеза кокса, углерод в нечистой форме и различные органические примеси можно ожидать при термическом крекинге источника углеводородов.
. [3] Сера, фосфор и мышьяк являются переносчиками из сырья для синтеза кокса, углерод в нечистой форме и различные органические примеси можно ожидать при термическом крекинге источника углеводородов.
В то время как примеси в ацетилене могут быть токсичными и даже смертельными, чистый ацетилен имеет очень низкую токсичность (не считая «наркотических» эффектов). До 80 процентов ( против / против ) ацетилен вводили хирургическим пациентам в качестве общего анестетика. Торговое название ацетилена было «нарцилен». Он использовался в изрядных количествах экспериментально в Германии в их бедных 1920-х годов, возможно, на несколько тысяч больных. С медицинской точки зрения ацетилен считался почти таким же безопасным, как закись азота, и обладал немного более высокой эффективностью, что позволяло использовать в смеси более высокое процентное содержание кислорода; он примерно на 50 процентов мощнее. Однако от использования смесей ацетилена и кислорода отказались после нескольких взрывов газа в легких пациентов. Ожидается, что энергия этих взрывов превысит любой из горючих ингаляционных анестетиков из-за нестабильности тройной связи (циклопропан был бы почти таким же плохим). Было высказано предположение, что такой внутренний взрыв грудной клетки не мог произойти с воздушными смесями (без очищенного кислорода).
Ожидается, что энергия этих взрывов превысит любой из горючих ингаляционных анестетиков из-за нестабильности тройной связи (циклопропан был бы почти таким же плохим). Было высказано предположение, что такой внутренний взрыв грудной клетки не мог произойти с воздушными смесями (без очищенного кислорода).
Согласно литературным источникам, ацетилен редко подвергался злоупотреблению в манере, сходной со злоупотреблением закисью азота. Такое злоупотребление может привести к смерти нарушителя из-за токсичности вышеупомянутых примесей фосфина, арсина и сероводорода. Поскольку газ загружается (поглощается) в резервуары, пропитанные ацетоном над твердой матрицей, часть ацетона выходит с газом, что еще больше способствует отравлению. Движущая сила этого оскорбительного поведения лучше понята с точки зрения анестезирующих свойств ацетилена и вызывающего привыкание поведения.
Примеси в ацетилене легко обнаруживаются по запаху. Чистый ацетилен — бесцветный газ без запаха. Характерный чесночный запах технического ацетилена объясняется наличием примесей. Примеси, которые могут присутствовать, включают: дивинилсульфид, аммиак, кислород, азот, фосфин, арсин, метан, диоксид углерода, монооксид углерода, сероводород, винилацетилен, дивинилацетилен, диацетилен, пропадиен, гексадиен, бутадиенилацетилен и метилацетилен.
Примеси, которые могут присутствовать, включают: дивинилсульфид, аммиак, кислород, азот, фосфин, арсин, метан, диоксид углерода, монооксид углерода, сероводород, винилацетилен, дивинилацетилен, диацетилен, пропадиен, гексадиен, бутадиенилацетилен и метилацетилен.
Опасность возгорания
Смеси с воздухом, содержащие от 3 до 82 процентов ацетилена, взрывоопасны при воспламенении. Минимальная температура воспламенения составляет 335 °С. [2] Большая часть химической энергии ацетилена содержится в тройной связи , а не ; то есть он больше, чем у трех разветвленных углерод-углеродных связей, но не допускается из-за промежутков между его партнером углеродом и всеми другими атомами углерода, также защищенными от заряда.
Несовместимости
- бром, хлор, медь, ртуть, серебро.
Другие значения
Иногда множественное число «ацетилены» может относиться к классу органических химических соединений, известных как алкины, которые содержат группу -C≡C-.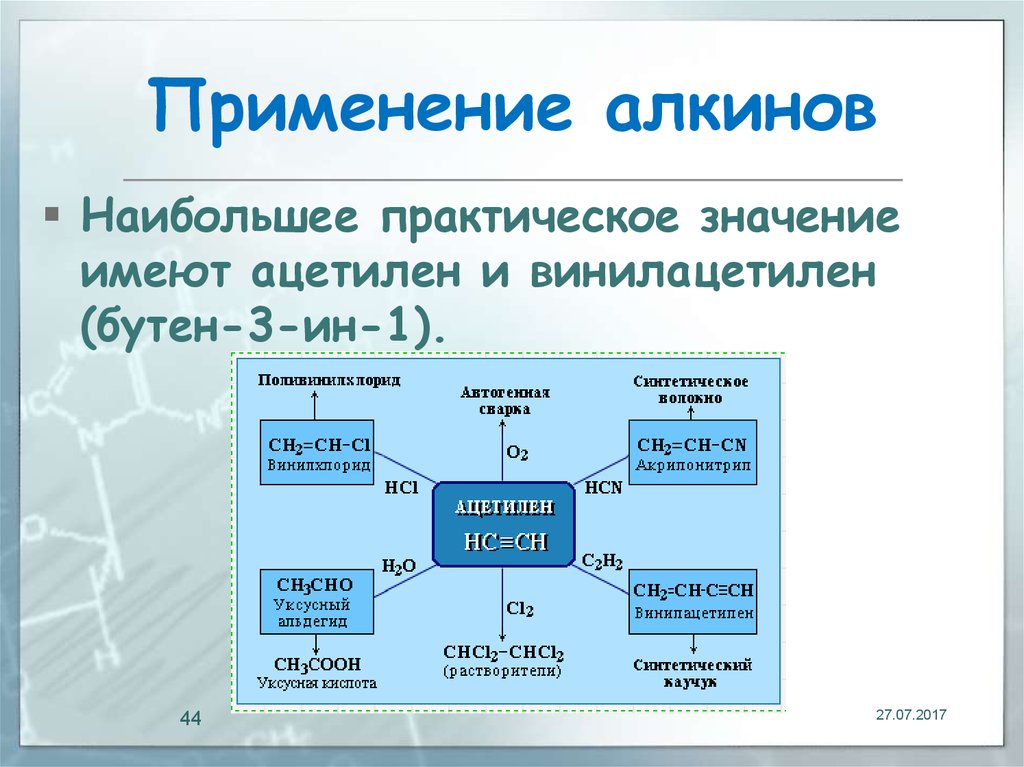
Встречается в природе
Ацетилен — умеренно распространенное химическое вещество во Вселенной, часто связанное с атмосферами газовых гигантов. Одно любопытное открытие ацетилена произошло на Энцеладе, крошечном спутнике Сатурна. Считается, что природный ацетилен образуется либо в результате каталитического разложения углеводородов с длинной цепью, либо при температуре ≥ 1770 кельвинов. Поскольку крайне маловероятно, что последний существует на таком крошечном удаленном теле, это открытие потенциально указывает на каталитические реакции внутри Луны, что делает ее многообещающим местом для поиска пребиотической химии. [4]
См. также
- Алкин
- Углеводород
Примечания
- ↑ Ацетилен: производство продуктов Производство продуктов . Проверено 7 июня 2018 г.
- ↑ 2.0 2.1 Джеффри Дейл Мьюир (редактор), Опасности в химической лаборатории (Лондон: Королевский институт химии, 1971, ISBN 978-0854040148).
- ↑ Ацетлиен Compressed Gas Association Inc. Проверено 7 июня 2018 г.
- ↑ Джон Спенсер и Дэвид Гринспун, «Планетарная наука: внутри Энцелада» Nature 445(7126) (2007):376-377.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Макмерри, Джон. Органическая химия . 6-е изд. Бельмонт, Калифорния: Брукс/Коул, 2004. ISBN 0534420052
- Моррисон, Роберт Т. и Роберт Н. Бойд. Органическая химия . 6-е изд. Энглвуд Клиффс, Нью-Джерси: Прентис Холл, 19 лет.92. ISBN 0136436692
- Мьюир, Джеффри Дейл (ред.). Опасности в химической лаборатории . Лондон: Королевский химический институт, 1971. ISBN 978-0854040148 .
- Соломонс, Т. В. Грэм и Фрайл, Крейг Б. Органическая химия . 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Внешние ссылки
Все ссылки получены 13 апреля 2021 г.
- Ацетилен, принципы его получения и использования , доступен бесплатно через Project Gutenberg
- Стандарты безопасности и гигиены труда: ацетилен OSHA, Министерство труда США.

Авторы
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Ацетилен история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Ацетилена»
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.

