Свойства аргон: Газ аргон — свойства, сферы применения, температура плавления и замерзания, технический состав, давление
alexxlab | 01.06.2023 | 0 | Разное
Аргон – свойства, характеристики – сайт АО «ГРАСИС»
Запрос на оборудование
В атмосфере содержится около 0,9% аргона. Аргон, который, как и азот, представляет собой нейтральный бесцветный газ, существует в природе только в составе атмосферного воздуха. Он не пригоден для поддержания жизни, однако незаменим в некоторых технологических процессах благодаря высокому уровню химической инертности и относительной простоте извлечения.
| Внешний вид простого вещества | |
|---|---|
| Инертный газ без цвета, вкуса и запаха | |
| Свойства атома | |
| Имя, символ, номер | Аргон / Argon (Ar), 18 |
| Атомная масса (молярная масса) | 39,948 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Радиус атома | 71пм |
| Химические свойства | |
| Ковалентный радиус | |
| Радиус иона | 154 пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 1519,6(15,75) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
Плотность (при н. у.) у.) | (при 186 °C) 1,40 г/см3 |
| Температура плавления | 83,8 K |
| Температура кипения | 87,3 K |
| Теплота испарения | 6,52 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 24,2 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 A |
| Температура Дебая | 85 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,0177 Вт/(м·К) |
История открытия
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г. ). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Основное применение
Пищевая отрасль
В контролируемой среде аргон может во многих процессах использоваться в качестве замены для азота. Высокая растворимость (в два раза превышающая растворимость азота) и определенные молекулярные характеристики обеспечивают его особые свойства при хранении овощей. При определенных условиях он способен замедлять метаболические реакции и значительно сокращать газообмен.
Высокая растворимость (в два раза превышающая растворимость азота) и определенные молекулярные характеристики обеспечивают его особые свойства при хранении овощей. При определенных условиях он способен замедлять метаболические реакции и значительно сокращать газообмен.
Производство стекла, цемента и извести
При использовании для заполнения ограждений с двойным глазурованием аргон обеспечивает превосходную тепловую изоляцию.
Металлургия
Аргон используется для предупреждения контакта и последующего взаимодействия между расплавленным металлом и окружающей атмосферой.
Использование аргона позволяет оптимизировать такие производственные процессы как перемешивание расплавленных веществ, продувка поддонов реакторов для предупреждения повторного окисления стали и обработка стали узкого применения в вакуумных дегазаторах, включая вакуумно-кислородное обезуглероживание, окислительно-восстановительных процессы и процессы открытого сжигания. Однако наибольшую популярность аргон приобрел в процессах аргоно-кислородного обезуглероживания нерафинированной высокохромистой стали, позволяя минимизировать окисление хрома.
Лабораторные исследования и анализы
В чистом виде и в соединениях с другими газами аргон используется для проведения промышленных и медицинских анализов и испытаний в рамках контроля качества.
В частности аргон выполняет функцию газовой плазмы в эмиссионной спектрометрии индуктивно-связанной плазмой (ICP), газовой подушки в атомно-абсорбционной спектроскопии в графитной печи (GFAAS) и газа-носителя в газовой хроматографии с использованием различных газоанализаторов.
В соединении с метаном аргон используется в счетчиках Гейгера и детекторах рентгеновского флуоресцентного анализа (XRF), где он выполняет функцию гасящего газа.
Сварка, резка и нанесение покрытия
Аргон используется в качестве защитной среды в процессах дуговой сварки, при поддуве защитного газа и при плазменной резке.
Аргон предупреждает окисление сварных швов и позволяет сократить объем дыма, сбрасываемого в процессе сварки.
Электроника
Сверхчистый аргон служит в качестве газа-носителя для химически активных молекул, а также в качестве инертного газа для защиты полупроводников от посторонних примесей (например, аргон обеспечивает необходимую среду для выращивания кристаллов силикона и германия).
В ионном состоянии аргон используется в процессах металлизации напылением, ионной имплантации, нормализации и травления при производстве полупроводников и высокоэффективном производстве материалов.
Автомобильная и транспортная отрасль
Затаренный герметизированный аргон служит для наполнения подушек безопасности в автомобилях.
Доставка аргона | ИСТА-Техника – Москва
Аргон представляет собой одноатомный инертный газ без характерного цветового и вкусового различия. Относится к газам, которые присутствуют в земной атмосфере в естественном виде. Его содержание в химическом составе воздуха составляет 0,93% от общего объёма, уступая только кислороду и азоту. Чистый аргон в природе не встречается, его можно получить только путём выделения из воздуха. Наиболее важным свойством аргона, благодаря которому он получил обширное распространение в области пожаротушения, является его инертность. Этот газ не стремится вступать в реакцию с окружающими веществами, благодаря чему не расходуется его концентрация в воздухе подконтрольного помещения.
Области практического применения
Аргон, как и некоторые другие инертные газы, активно применяется в пожаротушении. Использование газовых систем пожаротушения оправдано в ряде случаев, поскольку традиционные водяные установки не в силах справиться с тушением возгораний, возникающих на объектах определённого характера.
К помещениям, которые рекомендуется защищать от пожаров при помощи аргона, относятся:
-
обособленные участки производственных цехов с работающим электрооборудованием;
-
специальные помещения с высокотехнологичной электроникой — серверные, майнинговые фермы, вычислительные центры;
-
архивные помещения предприятий, организаций и фондов;
-
выставочные комплексы и музейные хранилища;
-
закрытые складские помещения.

Требования к размещению
Правила пожарной безопасности предъявляют высокие требования к хранению и размещению аргона. Для газообразных огнетушащих веществ предусмотрены специализированные ёмкости — баллоны, в которые газ закачивается в сжатом состоянии. Заправка баллонов аргоном производится перед монтажом системы, давление в них регулярно проверяется. Технические требования устанавливают срок годности заправленного баллона в течение двух лет с момента запуска в эксплуатацию. По истечении данного срока необходимо перезаправить баллон.
Кроме того, правилами установлено, что аргон в баллонах не допускается размещать в пределах жилых и административных объектов. Для их установки требуется спроектировать и построить обособленное помещение на уровне подвального, полуподвального или цокольного этажа. Поэтому первым этапом внедрения аргонового пожаротушения является проектирование установки. Проект должен быть разработан аттестованной организацией и согласован с профильными ведомствами в установленном порядке.
Влияние на здоровье человека
Повышенная концентрация аргона в воздухе может вызвать негативные последствия для человека. Вплоть до смертельного исхода из-за удушья. Но принцип работы аргоновых систем пожаротушения исключает подобные ситуации. Это объясняется тем, что огнетушащая концентрация аргона в воздухе ниже, чем предельно допустимая. За счёт этого использование установок газового пожаротушения допускается на объектах с постоянным присутствием людей.
Компания «ИСТА-Техника» предлагает обширный выбор материалов и комплектующих для газового и других видов пожаротушения. Аргон входит в число наиболее востребованных огнетушащих веществ, которые применяются в составе газовых установок пожаротушения. При оформлении заказа вы получаете заправку аргона в баллоны и доставку ёмкостей на объект в готовом к использованию состоянии. К нашим преимуществам относится использование материалов от надёжных российских и зарубежных производителей, гарантия качества и низкие цены на весь предлагаемый ассортимент.
Аргон | Свойства, использование, атомный номер и факты
аргон
Посмотреть все СМИ
- Ключевые люди:
- сэр Уильям Рамзи Лорд Рэлей
- Похожие темы:
- химический элемент благородный газ воздух аргон-40
См. все связанные материалы →
аргон (Ar) , химический элемент, инертный газ группы 18 (благородные газы) периодической таблицы, наиболее распространенный на Земле и наиболее часто используемый в промышленности из благородных газов. Был выделен газообразный аргон без цвета, запаха и вкуса (1894) с воздуха британскими учеными лордом Рэлеем и сэром Уильямом Рамзи. Генри Кавендиш, исследуя атмосферный азот («флогистированный воздух»), в 1785 г. пришел к выводу, что не более 1/120 части азота может быть каким-либо инертным компонентом. Его работа была забыта, пока лорд Рэлей более века спустя не обнаружил, что азот, полученный путем удаления кислорода из воздуха, всегда примерно на 0,5 процента более плотный, чем азот, полученный из химических источников, таких как аммиак.
По распространенности в космосе аргон занимает примерно 12-е место среди химических элементов. Аргон составляет 1,288 % атмосферы по весу и 0,934 % по объему и содержится в горных породах. Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента земного аргона соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется.
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Аргон выделяют в больших масштабах фракционной перегонкой жидкого воздуха. Он используется в газонаполненных электрических лампочках, радиолампах и счетчиках Гейгера. Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Газообразный аргон конденсируется в бесцветную жидкость при -185,8 °C (-302,4 °F) и в кристаллическое твердое вещество при -189,4 °C (-308,9 °F). Газ нельзя сжижать под давлением выше температуры -122,3 ° C (-188,1 ° F), и в этот момент для его сжижения требуется давление не менее 48 атмосфер. При 12 ° C (53,6 ° F) 3,94 объема газообразного аргона растворяются в 100 объемах воды. Электрический разряд в аргоне при низком давлении выглядит бледно-красным, а при высоком давлении — сине-стальным.
При 12 ° C (53,6 ° F) 3,94 объема газообразного аргона растворяются в 100 объемах воды. Электрический разряд в аргоне при низком давлении выглядит бледно-красным, а при высоком давлении — сине-стальным.
Самая внешняя (валентная) оболочка аргона имеет восемь электронов, что делает ее чрезвычайно стабильной и, таким образом, химически инертной. Атомы аргона не соединяются друг с другом; также не наблюдалось их химического соединения с атомами любого другого элемента. Атомы аргона были механически захвачены в подобных клеткам полостях среди молекул других веществ, как, например, в кристаллах льда или органического соединения гидрохинона (называемого клатратами аргона).
| атомный номер | 18 | |||
|---|---|---|---|---|
| атомный вес | [39,792, 9004 39,963] | 44 температура плавления | −189,2 °C (−308,6 °F) | |
| температура кипения | -185,7 °C (-302,3 °F) | |||
| плотность (1 атм, 0 °C) | 1,784 г/л | |||
| степень окисления | 8 | 043 | электрон конфиг. | 1 с 2 2 с 2 2 р 6 3 с р 63 9 4 6 |
Редакторы Британской энциклопедииЭта статья была последний раз переработанный и обновленный Эриком Грегерсеном.
Аргон (Ar) – применение, химические и физические свойства
Дата последнего обновления: 14 апреля 2023 г.
•
Всего просмотров: 442,5 тыс.0003
Аргон — благородный газ. Благородные газы – это 7 элементов в группе 18 (VIII A) периодической таблицы (Периодическая таблица представляет собой диаграмму, показывающую, как химические элементы связаны друг с другом). Инертные газы также называют инертными газами, потому что элементы группы 18 (VIII A) реагируют с очень небольшим количеством других элементов. На самом деле ни одно соединение аргона никогда не производилось.
Английский химик по имени Джон Уильям Струтт, более известный как лорд Рэлей (1842–1919), химик Уильям Рамзи (1852–1919). 16) открыл аргон в 1894 году. Это был первый выделенный вид благородных газов.
16) открыл аргон в 1894 году. Это был первый выделенный вид благородных газов.
Рэлей и Рамзи нашли аргон фракционной перегонкой жидкого воздуха. Фракционная перегонка — это метод медленного нагревания жидкого воздуха. Когда воздух нагревается, различные элементы снова превращаются из жидкости в газ. Часть воздуха, которая снова превращается в газ при температуре -185,86°C (-302,55°F), представляет собой аргон.
Обозначение: Ar
Атомный номер: 18
Атомная масса: 39,948
Семейство: Группа 18 (VIII A) Благородный газ
Произношение: AR-gon
Аргон используется для производства инертного слоя для некоторых промышленных операций. Инертная газовая оболочка предотвращает взаимодействие любых химических веществ в процессе работы с кислородом и другими веществами, присутствующими в воздухе. Аргон также используется при создании «неоновых» ламп и в лазерах.
Открытие и наименование аргона:
Аргон был открыт в 1894 году. Однако английский ученый Генри Кавендиш (1731-1810) предсказал существование аргона за 200 лет до открытия аргона. Когда Кавендиш попытался удалить кислород и азот из воздуха, он обнаружил, что осталось очень небольшое количество газа. Он правильно догадался, что в воздухе находится еще один элемент, но не смог определить, что это было.
Однако английский ученый Генри Кавендиш (1731-1810) предсказал существование аргона за 200 лет до открытия аргона. Когда Кавендиш попытался удалить кислород и азот из воздуха, он обнаружил, что осталось очень небольшое количество газа. Он правильно догадался, что в воздухе находится еще один элемент, но не смог определить, что это было.
Когда Рамзи повторил эксперименты Кавендиша в 1890-х годах, он тоже обнаружил в воздухе крошечное количество неизвестного газа. Но у Рамзи было преимущество перед Кавендишем: он мог использовать спектроскопию, которой во времена Кавендиша не существовало. Спектроскопия — это процесс, при котором испускаемый свет анализируется путем нагревания элемента.
Спектр (множественное число: спектры) элемента, который состоит из ряда цветных линий и отличается для каждого элемента.
Рамзи изучил спектр неизвестного газа. Он получил ряд линий, не принадлежащих ни одному другому элементу. Он был убежден, что открыл новый элемент. Тем временем Рэлей проделывал ту же работу почти в то же время. Он сделал свое открытие примерно в то же время, что и Рамзи. Оба ученых решили сделать свое заявление вместе. Название аргон происходит от греческого слова Аргос, «ленивый». Название основано на неспособности аргона реагировать с чем-либо.
Тем временем Рэлей проделывал ту же работу почти в то же время. Он сделал свое открытие примерно в то же время, что и Рамзи. Оба ученых решили сделать свое заявление вместе. Название аргон происходит от греческого слова Аргос, «ленивый». Название основано на неспособности аргона реагировать с чем-либо.
Открытие аргона поставило перед химиками проблему. Аргон был первым благородным газом, открытым ученым. Куда должен идти этот элемент в таблице Менделеева? В то время периодическая таблица заканчивалась группой 17 (VIIА) справа. Рамзи предположил, что периодическую таблицу, возможно, придется расширить. Рамзи предложил добавить в таблицу целую новую группу. Эта группа будет помещена справа от группы 17 (VIIА) в периодической таблице.
Предложение Рамзи было принято, но оно создало еще одну интересную новую проблему для химиков. Если в периодической таблице существовала совсем новая группа, то где были другие элементы, принадлежавшие этой группе? К счастью, у химиков было хорошее представление о том, как могут выглядеть эти неизвестные элементы. Все элементы в одной группе очень похожи друг на друга. Химики начали искать более неактивные газы. В течение следующих пяти лет они нашли оставшихся членов группы и добавили к ним: гелий, криптон, неон, радон и ксенон.
Все элементы в одной группе очень похожи друг на друга. Химики начали искать более неактивные газы. В течение следующих пяти лет они нашли оставшихся членов группы и добавили к ним: гелий, криптон, неон, радон и ксенон.
Физические свойства:
Аргон — бесцветный благородный газ без вкуса и запаха. Благородный газ аргон имеет плотность 1,784 грамма на литр. Когда мы сравниваем плотность аргона с плотностью воздуха, она составляет около 1,29 грамма на литр. Аргон меняет свое состояние с газообразного на жидкое при температуре -185,86°C (-302,55°F). Затем он меняет свое состояние с жидкого на твердое при температуре -189,3 °C (-308,7 °F). В редких случаях и в экстремальных условиях он образует слабые, сложные структуры.
Встречается в природе:
Содержание аргона в атмосфере составляет около 0,93 процента. Аргон также содержится в земной коре в количестве около 4 частей на миллион.
Извлечение:
Благородный газ Аргон можно получить из жидкого воздуха путем фракционной перегонки. Аргон также можно получить путем нагревания газообразного азота из атмосферы с горячим магнием или кальцием. Магний или кальций смешиваются с азотом, образуя нитрид:
Небольшое количество аргона всегда встречается в виде примеси с газообразным азотом. Он остается позади, потому что не вступает в реакцию с магнием или кальцием.
Аргон также может встречаться в скважинах с природным газом. При очистке природного газа некоторое количество аргона может быть извлечено в качестве побочного продукта реакции.
Изотопы:
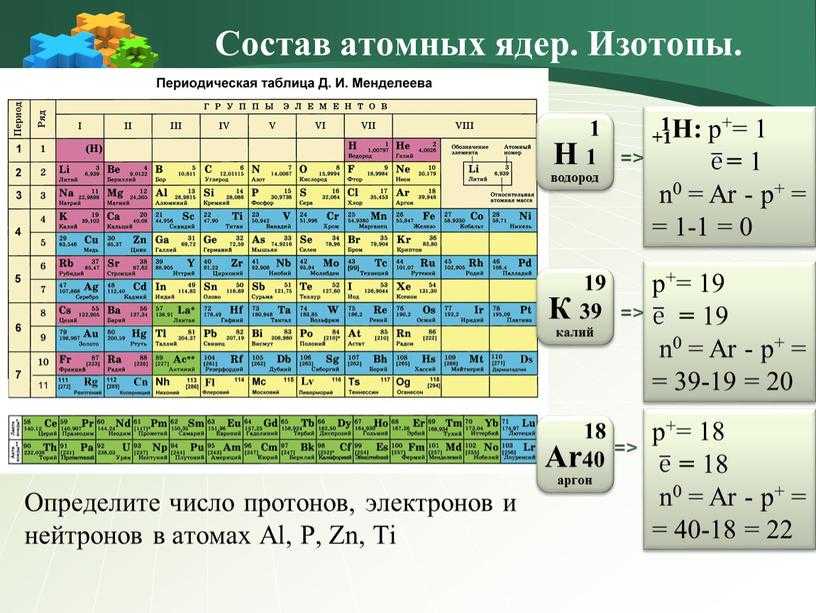
Три изотопа аргона существуют в природе. Это изотопы аргон-36, аргон-38 и аргон-40. Изотопы образуют два или более из элемента. Изотопы отличаются друг от друга в зависимости от их массового числа. Массовое число пишется справа от названия элемента и является массовым числом. Массовое число представлено количеством протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждое изменение представляет собой изотоп элемента.
Массовое число представлено количеством протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого элемента может варьироваться. Каждое изменение представляет собой изотоп элемента.
Радиоактивный изотоп — это изотоп, который распадается на части и испускает какую-либо форму радиации. Радиоактивные изотопы образуются, когда маленькие частицы обстреливают атомы. Эти частицы впиваются в атомы и делают их радиоактивными элементами.
Никакие радиоактивные изотопы аргона не имеют практического применения. Однако для определения возраста очень старых пород можно использовать один нерадиоактивный изотоп. Этот метод датирования и определения возраста горных пород описан в статье о калии.
Применение:
Благородный газ Аргон используется в ситуациях, когда материалы необходимо защитить от кислорода или других газов.
 Хорошим примером является лампа накаливания, состоящая из металлического провода внутри колбы из прозрачного стекла. Через провод должен проходить электрический ток, который заставляет его сильно нагреваться и излучать свет.
Хорошим примером является лампа накаливания, состоящая из металлического провода внутри колбы из прозрачного стекла. Через провод должен проходить электрический ток, который заставляет его сильно нагреваться и излучать свет.Кислород очень легко соединяется с горячим металлом; эта реакция образует соединение металла и кислорода. Это соединение не очень хорошо проводит электрический ток, поэтому лампочка может перестать излучать свет.
Аргон, тем не менее, используется для предотвращения этого. Поскольку аргон инертен, он не вступает в реакцию с горячей проволокой, оставляя металл горячим в течение длительного периода времени. Лампочка перестанет светить только тогда, когда металл сломается. Тогда это больше не может проводить электрический ток.
Аргон также можно использовать при сварке. Сварка – это процесс, при котором два металла соединяются друг с другом.
 В большинстве этих случаев два металла нагреваются до очень высоких температур. По мере того, как они становятся все горячее и горячее, они сливаются воедино.
В большинстве этих случаев два металла нагреваются до очень высоких температур. По мере того, как они становятся все горячее и горячее, они сливаются воедино.Однако, когда металл нагревается, они начинают реагировать с кислородом. В этой реакции образуется составной компонент металла и кислорода. Становится трудно объединить эти два металла, если они образовали соединения, но введение аргона в сварочную среду улучшает их соединение.
Аргон также может использоваться в аргоновых лазерах и аргоновых лазерах на красителях. Лазер — это устройство, излучающее очень яркий свет одного цвета (частоты). Аргоновый лазер используется для лечения кожных заболеваний. Лазер излучает сине-зеленый свет на пораженный участок кожи тела. Энергия лазера поглощается гемоглобином (кровью) и преобразуется в тепло. (Гемоглобин — это белковый пигмент эритроцитов в нашем организме). Кровеносные сосуды повреждаются, но затем закупориваются, что приводит к их разложению и реабсорбции в организме человека.



 Хорошим примером является лампа накаливания, состоящая из металлического провода внутри колбы из прозрачного стекла. Через провод должен проходить электрический ток, который заставляет его сильно нагреваться и излучать свет.
Хорошим примером является лампа накаливания, состоящая из металлического провода внутри колбы из прозрачного стекла. Через провод должен проходить электрический ток, который заставляет его сильно нагреваться и излучать свет. В большинстве этих случаев два металла нагреваются до очень высоких температур. По мере того, как они становятся все горячее и горячее, они сливаются воедино.
В большинстве этих случаев два металла нагреваются до очень высоких температур. По мере того, как они становятся все горячее и горячее, они сливаются воедино.