Свойства меди химия: Медь, свойства, соединения, сплавы, производство, применение
alexxlab | 21.02.2023 | 0 | Разное
Интересные факты о меди | Металлургический портал MetalSpace.ru
Факт 2: Польские ученые установили, что в тех водоемах, где присутствует медь, карпы отличаются крупными габаритами. В прудах или озерах, где меди нет, быстро развивается грибок, который поражает карпов. В отличие от карпов, акулы терпеть не могут этот элемент, точнее его серное соединение – сульфат меди. Широкие эксперименты по проверке этого «антиакульего» препарата были проведены в США в начале второй мировой войны, когда от торпед и бомб тонуло немало кораблей, и нужда в надежном средстве защиты от акул была велика.
Факт 3: Все знают, что статуя Свободы в Нью-Йорке изготовлена из меди. Конечно же, этот памятник медный не целиком. Для отлива статуи была использована 31 тонна меди. При этом общий вес стальной конструкции составляет 125 тонн, а толщина медного покрытия статуи – 2,57 мм. Одно время бытовало мнение, что медь, из которой был отлит этот всемирно известный памятник, была добыта на Урале, однако, эта версия не нашла подтверждения. Официально признано, что американская статуя Свободы сделана из норвежской меди.
Официально признано, что американская статуя Свободы сделана из норвежской меди.
Факт 4: Пожалуй, самое древнее сооружение из меди, обнаруженное археологами – это части водопровода, обнаруженные в Пирамиде Хеопса. Эти медные трубы, смонтированные более пяти тысяч лет назад, до сих пор находятся в рабочем состоянии! Древние египтяне недаром использовали именно медь для водопровода, они очень серьезно относились к личной гигиене. В V веке до нашей эры Геродот описывал: «Египтяне пьют только из медных сосудов, которые чистят ежедневно».
Факт 5: Очень полезное применение меди, основанное на ее коррозионной устойчивости, нашли шведские ученые, по настоянию которых, особо опасные радиоактивные отходы подвергаются захоронению в специальных медных капсулах, толщина стенки которых составляет 5 см. Полностью разрушить такую капсулу сквозная коррозия сможет только через 500-700 тысяч лет!
Факт 6: Медь встречается в природе как в соединениях, так и в самородном виде. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Медь как полезное ископаемое, в природе очень редко встречается в виде самородков. На сегодняшний день, самой крупной такой находкой считается самородок, обнаруженный в Северной Америке на территории США массой 420 тонн.
Медь как полезное ископаемое, в природе очень редко встречается в виде самородков. На сегодняшний день, самой крупной такой находкой считается самородок, обнаруженный в Северной Америке на территории США массой 420 тонн.
Факт 7: Медная руда стала виновником аварии, которую потерпело норвежское грузовое судно «Анатина». Трюмы теплохода, направлявшегося к берегам Японии, были заполнены медным концентратом. Внезапно прозвучал сигнал тревоги: судно дало течь. Оказалось, что коварную шутку с моряками сыграл их груз: медь, содержащаяся в концентрате, образовала со стальным корпусом «Анатины» неплохую гальваническую пару, а испарения морской воды послужили электролитом. Возникший гальванический ток разъел обшивку судна до такой степени, что в ней появились пробоины, куда и хлынула океанская вода.
Факт 8: Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
Факт 9: Медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %
Факт 10: Медь является природным антибактериальным средством, и «тормозит» распространение бактерий в воде и воздухе из систем, изготовленных из нее. Таким же образом, латунные дверные ручки и поручни в общественных зданиях могут помочь свести к минимуму риск бактериальной передачи.
Факт 11: Полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Факт 12: В разнообразных областях техники широко используются сплавы с использованием меди, самыми распространёнными являются бронза и латунь.
Факт 13: Медь является одним из важнейших участников метаболических процессов в организме человека и входит практически во все органы и ткани, поэтому она привлекает внимание биомедицины. Группой известных лабораторий Ирландии и Франции был разработан состав, который при соприкосновении с кожей активизирует жизненно важные процессы в организме человека. Этим составом обрабатываются нити джинсов Gold Vision – 3000 Classic. Модель была создана знаменитыми французскими кутюрье. Уникальность этих джинсов состоит в “медном поясе”, “усиленных” медью карманах и гульфике, а также в использовании медных клепок и пуговиц. Таким образом формируется “медный корсет”, который создает условия для улучшения физиологических функций организма.
Факт 14: Инструменты изготовленые из меди или медных сплавов не вызывают искру, и, таким образом, используются везде, где есть опасность взрыва.
Факт 15: Медное покрытие применяется для изготовления скальпеля хирурга и проводит электричество для нагрева лезвия, делая, таким образом, прибор самостоятельного прижигания.
Факт 16: В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Факт 17: Многие народы приписывают меди целебные свойства. Непальцы, например, считают медь священным металлом, который способствует сосредоточению мыслей, улучшает пищеварение и лечит желудочно-кишечные заболевания (больным дают пить воду из стакана, в котором лежат несколько медных монет). Один из самых больших и красивых непальских храмов носит название «Медный».
Факт 18: Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Факт 19: В организме взрослого человека содержится до 80 мг меди.
Факт 20: По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
ПОДЕЛИСЬ ИНТЕРЕСНОЙ ИНФОРМАЦИЕЙ
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Цельработы
Ознакомление с основными соединениями меди; изучение свойств и способов получения меди и ее соединений.
Краткиетеоретическиесведения
Медь имеет порядковый номер 29 в периодической системе элементов. Электронная конфигурация валентного уровня 3d104s1 обуславливает пере-
менную валентность I и II. Стандартный электродный потенциал Å0Cu / Cu2+ = 0,34
Вопределяет ее окислительно-восстановительные свойства.
Вприроде медь находится в самородном состоянии, но основное со-
держание меди сосредоточено в виде минералов (халькозина, Сu2S, ковелина, CuS, куприта, Cu2O, и других) в составе полиметаллических руд. Количество меди в земной коре оценивают в пределах 0,01 вес.%.
Промышленная переработка руд с целью извлечения металлической меди включает несколько процессов – это измельчение руды, обогащение (гравитационные и флотационные методы), переработка концентрата.
Cu2S + O2 = 2Cu + SO2
CuS + 2O2 = CuSO4 | CuSO4 + SO2 + 2h3O = Cu + 2h3SO4 |
Для получения чистого металла сырую медь очищают методом аффинажа (процесс получения чистого металла из сырого путем удаления примесей). В последней стадии при рафинировании меди используют либо пирометаллургический процесс
2Cu2O + Cu2S = 6Cu + SO2
либо электролитическое рафинирование меди
CuSO4 ‘ Cu2+ + SO 24− h3O ‘ H+ + OH– катод (–) Сu2+ + 2ē → Cu↓
анод (+) 4OH– – 4ē → O2↑ + 2h3O
Химия. Лаб. практикум | -191- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Краткие теоретические сведения
В лаборатории медь получают аналогично промышленному процессу электролитического рафинирования, приведенному выше, или восстановлением меди из раствора медного купороса порошком железа:
CuSO4 + Fe → FeSO4 + Cu
Чистая медь – металл красноватого цвета. Она обладает хорошими тепло- и электропроводящими свойствами.
Она обладает хорошими тепло- и электропроводящими свойствами.
В химическом отношении медь – малоактивный металл. Однако с галогенами она реагирует уже при комнатной температуре, например:
Cu + Br2 = CuBr2
С кислородом медь взаимодействует в присутствии воды:
2Cu + O2 + 2h3O = 2Cu(OH)2
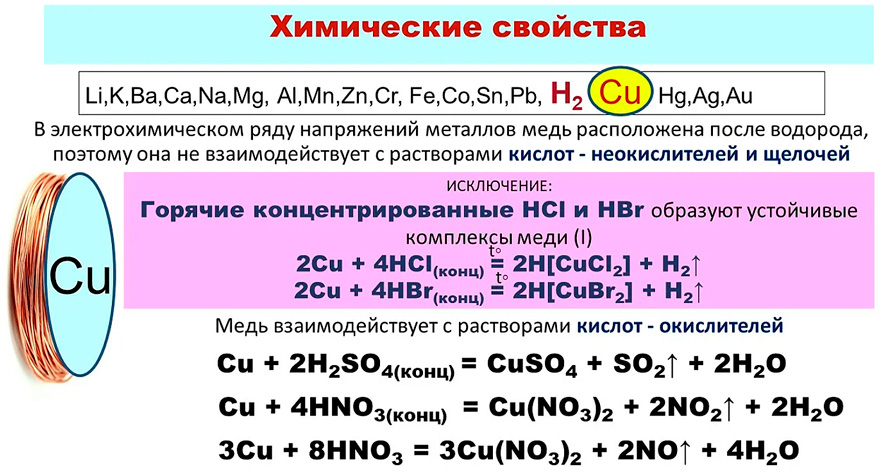
Концентрированная соляная кислота и разбавленная серная кислота на медь не действуют. Эти кислоты не взаимодействуют с металлами, которые стоят в ряду напряжений после водорода, поскольку их окислительные свойства соответствуют потенциалу Ен/н+.
Концентрированная h3SO4 при нагревании взаимодействует с медью вследствие окисляющих свойств атома серы (степень окисления +6) вкислоте:
Cu + 2h3SO4(конц) = CuSO4 + SO2 + 2h3O
В азотной кислоте (энергичный окислитель) медь легко окисляется с получением солей меди и азотсодержащих газообразных продуктов. Чем ниже концентрация кислоты, тем выше степень восстановления азота в газообразных продуктах:
2Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4h3O Cu + 4HNO3(конц) = Сu(NO3)2 + 2NO2 + 2h3O
Медь растворяется в водном растворе аммиака только в присутствии кислорода. Этот сложный процесс приводит к комплексному соединению:
Этот сложный процесс приводит к комплексному соединению:
Cu + 4Nh5OH + 1/2O2 = [Cu(Nh4)4](OH)2 + 3h3O
Гидроксид тетраамминмеди (II)
Оксид меди (I) в лаборатории получают обработкой растворов солей меди (II) растворами щелочей в присутствии глюкозы. В ходе этой реакции глюкоза выступает в роли восстановителя – альдегидная группа глюкозы окисляется до карбоксильной группы глюконовой кислоты:
Химия. Лаб. практикум | -192- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Краткие теоретические сведения
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
2Cu(OH)2 + C6h22O6 = Cu2O + C6h22O7 + 2h3O
Глюкоза Глюконовая кислота
Закись меди в присутствии кислорода при 1025 °С превращается в окись меди:
2Сu2O + O2 → 4CuO
Гидроксид меди (I) получают обработкой солей меди (I) щелочью при комнатной температуре:
CuCl + KOH = CuOH + KCl
При кипячении CuOH теряет воду и переходит вкрасный оксид меди(I):
2СuOH → Cu2O + h3O
Оксид меди (II) CuO получают нагреванием металлической меди выше 80 °С или нагреванием (50 °С) водной суспензии Cu(OH)2, а также прокаливанием нитрата меди (II):
Cu + 1/2O2 = CuO
Cu(OH)2 = CuO + h3O
Cu(NO3)2 = CuO + 2NO2 + 1/2O2
В отличие от металлической меди, оксид меди (II) взаимодействует с HCl и разбавленной h3SO4 с образованием соответствующих солей меди (II):
CuO + 2HCl = CuCl2 + h3O СuO + h3SO4 = CuSO4 + h3O
Гидроксид меди (II) образуется в виде аморфного осадка синего цвета при обработке растворов солей меди (II) растворами щелочей при обычной температуре:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
При нагревании гидроксид меди (II) отщепляют молекулу воды, превращаясь в оксид меди (II):
Cu(OH)2 = CuO + h3O
Трудно растворимое в воде соединение Cu(OH)2 растворяется в кислотах с образованием простых солей, а в растворах щелочей – комплексных соединений:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2h3O
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4]
Тетрагидроксокупрат(II) натрия
Химия. | -193- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Краткие теоретические сведения
Действие на раствор медного купороса щелочью приводит к гидроксиду меди. Добавление к гидроксиду меди (II) глицерина образует комплексное соединение глицерат меди ярко-синего цвета:
|
|
| Ch3 |
| OH | O |
| h3C |
|
|
|
|
| ||||
Ch3 |
| OH | | |
|
| Cu | | | | |
|
|
| ||||||
2CH |
| OH +Cu(OH)2 → CH |
| O | HO |
| HC +2h3O | |
|
|
| ||||||
Ch3 |
| OH | | |
|
| | | | | |
|
|
| ||||||
|
|
| Ch3 |
| OH | HO |
| h3C |
|
|
|
|
| ||||
В промышленности на основе меди получают многочисленные сплавы, в частности различные латуни и бронзы.
Вопросы для подготовки к лабораторной работе
1.Укажите положение меди в периодической системе элементов и напишите ее электронную формулу. Почему медь может проявлять различные степени окисления?
2.Охарактеризуйте свойства меди, указав отношение металлической меди к воздуху, воде и кислотам.
3.Приведите примеры оксидов и гидроксидов меди, укажите их
свойства.
4.Пользуясь таблицей стандартных электродных потенциалов, установите, можно ли Fe2+-ионами восстановить Cu2+-ион до свободного металла.
5.Как определить наличие ионов Cu2+ в растворе? Приведите примеры реакций.
Экспериментальнаячасть
Опыт 1
Получениемедиэлектролизомсульфатамеди(II)
Налейте в электролизер 0,2 н. раствор CuSO4. Опустите графитовые электроды и присоедините к источнику постоянного тока. Через 2-3 мин наблюдайте на одном из электродов появление красного налета меди, а на другом – выделение кислорода.
раствор CuSO4. Опустите графитовые электроды и присоедините к источнику постоянного тока. Через 2-3 мин наблюдайте на одном из электродов появление красного налета меди, а на другом – выделение кислорода.
Опыт 2 Взаимодействиемедискислотами
Опыт выполняется в вытяжном шкафу!
Химия. Лаб. практикум | -194- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Экспериментальная часть
Втри пробирки внесите по 10 капель разбавленных растворов кислот:
впервую – серной, во вторую – соляной, в третью – азотной. В каждую пробирку бросьте немного тонких медных стружек. Наблюдайте в третьей пробирке выделение газа NO.
Втри пробирки внесите по 5–7 капель концентрированных растворов кислот (в первую – серной, во второй – соляной, в третью – азотной) и слег-
ка нагрейте на водяной бане. Наблюдайте выделение бесцветного газа SO2 c резким запахом серы в первой пробирке и красно-бурого газа NO2 – в третьей.
Опыт 3
Получениеираспадгидроксидамеди(I)
К1-2 мл 0,2 н. раствора CuSO4 прилейте 4-5 мл 2 н. раствора щелочи
иглюкозы. Смесь хорошо перемешайте и затем нагрейте. Объясните образование желто-оранжевого осадка и его последующее превращение при более сильном нагревании в красный осадок. Составьте уравнения реакций, имея в виду, что глюкоза превращается в глюконовую кислоту:
O | O |
// | // |
Ch3OH – (CHOH)4 – C → Ch3OH – (CHOH)4 – C | |
\ | \ |
H | OH |
Опыт 4
Получениеоксидамеди(II) иисследованиеегосвойств
К 2-3 мл горячего 5 %-го раствора гидроксида натрия прилейте горячий 0,2 н. раствор CuSO4 до полноты осаждения оксида меди (II). Отметьте цвет выпавшего осадка гидроксида меди (II). Нагрейте содержимое пробирки до изменения цвета осадка при превращении гидроксида меди (II) в оксид.
Полученный оксид меди (II) разлейте на две пробирки. В одну пробирку прибавьте 5-6 капель 2 н. серной кислоты, в другую – столько же соляной. Наблюдайте в обоих случаях появление окраски раствора.
Опыт 5
Получениегидроксидамеди(II) иисследованиеегосвойств
В пробирку внесите 5–7 капель 0,2 н. раствора CuSO4 и добавьте такой же объем раствора натриевой щелочи.
Полученный гидроксид меди (II) разделите на две части. К одной части добавьте разбавленный раствор кислоты, к другой – концентрированный раствор гидроксида натрия. Что наблюдается? К каким гидроксидам по своим свойствам относится гидроксид меди (II)?
Химия. Лаб. практикум | -195- |
ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
Экспериментальная часть
Опыт 6 Получениеглицератамеди
В пробирку налейте 2 мл 2 н. раствора гидроксида натрия и добавьте немного 0,2 н. раствора CuSO4 до выпадения осадка. К осадку прилейте глицерин и взболтайте. Наблюдайте растворение осадка и появление ярко-синей окраски раствора. Напишите уравнение реакций.
К осадку прилейте глицерин и взболтайте. Наблюдайте растворение осадка и появление ярко-синей окраски раствора. Напишите уравнение реакций.
Контрольныевопросыизадачи
1.Пользуясь рядом напряжений металлов, укажите, может ли медь при обычных условиях вытеснять водород из разбавленных кислот. В какой разбавленной кислоте металлическая медь растворяется? Напишите уравнение реакции и укажите, какое свойство кислоты при этом проявляется?
2.Какую степень окисления проявляют атомы меди в соединениях? Дайте объяснение. Приведите примеры.
3.Что произойдет при действии на медь серной кислоты: а) разбавленной; б) концентрированной при кипячении?
4.Напишите уравнение реакции образования карбоната гидроксомеди
(CuOH)2CO3, зеленый налет которого образуется на поверхности изделий из меди под действием паров воды, кислорода и диоксида углерода, находящихся в воздухе.
5.В каких реакциях проявляется непрочность гидроксидов меди и чем она объясняется?
6.Гидроксид меди (II) растворим в разбавленных кислотах и в растворе аммиака. Напишите в молекулярном и ионном виде соответствующие уравнения.
Напишите в молекулярном и ионном виде соответствующие уравнения.
7.Основный характер какого гидроксида более выражен: CuOH или Cu(OH)2? Ответ мотивируйте.
8.Сколько литров 92 %-го раствора h3SO4 потребуется для получения 20 кг медного купороса при действии серной кислоты на медь?
9.Вычислите, сколько миллилитров 2 н. раствора HNO3 потребуется для растворения 20 г Cu(OH)2?
Химия. Лаб. практикум | -196- |
Введение в химические свойства меди
13 декабря 2022 г. 13 декабря 2022 г. | 12:08
Медь — один из наиболее широко используемых и универсальных элементов в мире. Он известен своей ковкостью, пластичностью, электропроводностью и коррозионной стойкостью. Но многие люди не знают, что медь также обладает широким спектром химических свойств, которые делают ее незаменимым элементом во многих отраслях промышленности. Давайте подробнее рассмотрим некоторые химические свойства меди.
Давайте подробнее рассмотрим некоторые химические свойства меди.
Химия меди
Медь — это переходный металл с атомным номером 29 и символом Cu в периодической таблице. Он имеет относительно низкую температуру плавления, что позволяет легко работать с ним в твердом виде. Медь также имеет две распространенные степени окисления, +1 и +2, что делает ее полезной для промышленных процессов и предметов повседневного обихода, таких как украшения и посуда.
Медь легко реагирует с кислородом воздуха или воды с образованием либо оксида меди (CuO), либо гидроксида меди (Cu(OH)2). Эту реакцию можно использовать в гальванике или других промышленных процессах, требующих защиты от коррозии или нанесения покрытия на металлические поверхности. Кроме того, медь может реагировать с серной кислотой с образованием сульфата меди (CuSO4), который затем можно использовать в качестве альгицида или инсектицида в сельском хозяйстве.
Другим важным химическим свойством меди является ее способность образовывать сплавы с другими металлами, такими как цинк, алюминий, никель, олово, железо, кремний и марганец. Эти сплавы прочны, но легки по сравнению с чистой медью и используются во всем, от ювелирных изделий до судостроительных материалов. Медные сплавы особенно полезны для применений, требующих жаропрочных материалов, поскольку они имеют более высокую температуру плавления, чем чистая медь.
Эти сплавы прочны, но легки по сравнению с чистой медью и используются во всем, от ювелирных изделий до судостроительных материалов. Медные сплавы особенно полезны для применений, требующих жаропрочных материалов, поскольку они имеют более высокую температуру плавления, чем чистая медь.
Химические свойства меди
1. Медь — химический элемент с символом Cu (от латинского: cuprum) и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет розовато-оранжевый цвет.
2. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морских изделий и монет, и константан, используемый в тензодатчики и термопары для измерения температуры.
3. Медь является одним из немногих металлов, которые могут встречаться в природе в металлической форме, пригодной для непосредственного использования (самородные металлы). Это привело к очень раннему использованию человеком в нескольких регионах, начиная с ок. 8000 г. до н.э. Тысячи лет спустя это был первый металл, выплавленный из сульфидных руд, c. 5000 г. до н.э.; первый металл, отлитый в форме в форме, c. 4000 г. до н.э.; и первый металл, который будет целенаправленно сплавлен с другим металлом, оловом, для создания бронзы, c. 3500 г. до н.э.
Это привело к очень раннему использованию человеком в нескольких регионах, начиная с ок. 8000 г. до н.э. Тысячи лет спустя это был первый металл, выплавленный из сульфидных руд, c. 5000 г. до н.э.; первый металл, отлитый в форме в форме, c. 4000 г. до н.э.; и первый металл, который будет целенаправленно сплавлен с другим металлом, оловом, для создания бронзы, c. 3500 г. до н.э.
4. В римскую эпоху медь в основном добывалась на Кипре, отсюда и произошло название металла cyprium (кипрский металл), позже сокращенное до cuprum. Его соединения были известны древним, и Плиний ошибочно приписывает его первооткрывателю Герою Александрийскому разработку усовершенствованного метода отливки его в тонкие листы. 1830 ° C (3356 ° F) г. примерно к 2600 г. до н.э. Затем они могли с большой точностью отливать медь в фигурные предметы к ок. 2400 г. до н.э. К 1200 г. до н.э. они разработали методы холодной обработки кованой меди, чтобы ее можно было производить в гораздо больших размерах, чем раньше. 0005
0005
6. Основное развитие металлургии меди произошло в конце 19 века, когда были разработаны электротермические процессы, которые значительно повысили чистоту, которую можно было достичь, и в то же время снизили производственные затраты. Металлурги, работающие в этой новой области, обнаружили, что когда они добавили небольшое количество других элементов в расплавленную медь, это изменило некоторые ее свойства полезным образом. Этот процесс стал известен как легирование. , добавление всего 1% серебра к меди увеличивает ее электропроводность на 20%. Другой пример: добавление марганца увеличивает прочность, но снижает пластичность. Наконец, добавление цинка ничего не меняет в отношении того, насколько хорошо полученный сплав проводит электричество, но делает его более стойким. к коррозии..
8. Поскольку для каждого применения предъявляются разные требования к прочности, жесткости, электропроводности или коррозионной стойкости сплава, сегодня используется более 400 различных медных сплавов.
Медь делает ее отличным выбором для самых разных применений, включая электропроводку, водопроводные трубы, изготовление ювелирных изделий и многое другое. Его способность образовывать сплавы с другими металлами делает его еще более универсальным, а его низкая температура плавления облегчает придание ему различных форм, когда это необходимо. Понимание этих свойств имеет важное значение для студентов-химиков или тех, кто хочет узнать больше об этом универсальном металлическом элементе!
суровый джайн
Pipingmart — это портал B2B, специализирующийся на металлических, промышленных и трубопроводных изделиях. Кроме того, мы делимся последней информацией и информацией о материалах, продуктах и различных типах марок, чтобы помочь предприятиям, которые занимаются этим бизнесом.
Теги: Медь
медь-химия
медь-химияМедь
| Обозначение: Cu Группа №: 1B Название группы: Переходный металл Атомный номер: 29 Масса #: 64 Атомная масса: 63,546 Электронная конфигурация: |
Физический Свойства:
Точка кипения: 2567°C
Точка плавления: 1083 C
Плотность: (при 20°С) 8,96 г/мл
Радиоактивность: нет
Цвет: красный/оранжевый
Запах: запах железа
Твердость: средняя
Хрупкость: низкая
Пластичность: высокая
Доктиль: высокий
Электричество: высокое
Нагрев: высокий
Химическая промышленность Свойства: (Нажмите здесь для демонстрации!! )
Медь устойчива к коррозии и не заржавеет.
 Если воздух вокруг котла часто влажный,
изменит свой первоначальный красновато-оранжевый цвет на красновато-коричневый.
Со временем он покрывается зеленой пленкой под названием «патина», которая останавливает все
дальнейшая коррозия. Например, Статуя Свободы сделана из
медь, и он позеленел из-за всего смога и загрязнения в
Нью-Йорк.
Если воздух вокруг котла часто влажный,
изменит свой первоначальный красновато-оранжевый цвет на красновато-коричневый.
Со временем он покрывается зеленой пленкой под названием «патина», которая останавливает все
дальнейшая коррозия. Например, Статуя Свободы сделана из
медь, и он позеленел из-за всего смога и загрязнения в
Нью-Йорк. Нерастворим в воде и не реагирует на воздух. Химические соединения меди уничтожают вредных насекомых и помочь улучшить почву. Их также можно найти в пигментах красок и защитить материалы от коррозии. В небольших количествах медь жизненно важны для всех растений и животных.
История:
Медь была одной из первых металлов, найденных человеком. Впервые он был добыт в 1709 году и является самым большим Масштаб добычи начался в 1845 году. Было добыто более 7 000 лет и был первым металлом, использованным для изготовления инструментов и приспособлений. Римляне впервые назвали его Кипр. Кипр был островом, где они впервые получили первую поставку меди.
 Они использовали медь
для инструментов и украшений. Позже была обнаружена бронза из сплава меди.
и они сделали из него мечи и монеты.
Они использовали медь
для инструментов и украшений. Позже была обнаружена бронза из сплава меди.
и они сделали из него мечи и монеты. Когда-то был Бронзовый Возраст. Все было сделано из бронзы. Древние кельты носили бронзы много, и современные кельты, которые делают это, следуют за изношенным временем шаги. Названия пошли от cuprium, cuprum и остались как Английское название меди. Коренные американцы также использовали его для изготовления инструментов. и украшения.
Использование:
Около 1/2 запаса меди в США используется для электрического оборудования. Электротехническая промышленность является одним из крупнейших потребителей меди. Используется для изготовления электрических проводка. Медь можно использовать для изготовления посуды, если ей придать форму. и покрыт оловом. Он используется для изготовления пенни и других монет. Он используется в посуде, холодильниках и радиаторах.
Сульфат меди используется в качестве сельскохозяйственный яд и очиститель.
 Соединения меди широко используются
в аналитической химии в тестах на сахар. Латунь, еще одна медь
сплав, используется для изготовления музыкальных инструментов. Он также используется в декоративных
металлоконструкции, небольшие винты и несколько водопроводных кранов. Бронза используется
для производства олимпийских металлов. Медь можно использовать для лепки/формовки
изделия из металла, такие как сантехника, скобяные изделия и станки.
Он также используется в транспортной отрасли. Его можно использовать в
электрические двигатели/генераторы, радиоприемники и телевизоры, а также компьютеры.
Соединения меди широко используются
в аналитической химии в тестах на сахар. Латунь, еще одна медь
сплав, используется для изготовления музыкальных инструментов. Он также используется в декоративных
металлоконструкции, небольшие винты и несколько водопроводных кранов. Бронза используется
для производства олимпийских металлов. Медь можно использовать для лепки/формовки
изделия из металла, такие как сантехника, скобяные изделия и станки.
Он также используется в транспортной отрасли. Его можно использовать в
электрические двигатели/генераторы, радиоприемники и телевизоры, а также компьютеры. Поскольку медь пластична, 4 медный стержень толщиной в дюйм можно нагреть, свернуть и вытянуть в круглую проволоку тоньше человеческого волоса. Его также можно свернуть в листы толщиной 1/500 дюйма.
Чистая медь изначально мягкий, но при обработке его можно затвердеть. Медные сплавы могут быть тверже и прочнее чистой меди. Сплавы обладают высоким сопротивлением, но они используются для электрических целей.


 Лаб. практикум
Лаб. практикум