Свойства меди свойства железа: Чем отличаются медь и железо
alexxlab | 28.06.2023 | 0 | Разное
Исследования сплавов железа | Металлургический портал MetalSpace.ru
Сплавы железа и меди изучали Ринман, Дэвид Мюшет, Штенгель и Карстен. Сплавы изготавливались «прямым» сплавлением меди с чугуном, сварочным железом и сталью (в тиглях) во всех пропорциях. Исследователи пришли к выводу о вредном влиянии меди на свойства стали и сварочного железа (красноломкость), и о положительном влиянии меди на свойства литейного чугуна в количестве до 5 % (здесь и далее – % по массе).
Одновременно исследовалось влияние железа на свойства бронзы и латуни. В 1779 г. Уильяму Керу был выдан патент на способ получения латуни, содержащей 54 % меди, 40 % цинка и 6 % железа. Сплав приготовлялся в тиглях с использованием древесного угля под слоем флюса из зелёного стекла. Сначала сплавлялись медь и сварочное железо, затем под слой шлака добавлялся цинк. Подобные патенты выдавались неоднократно впоследствии вплоть до середины XIX в. в разных странах Европы. Наибольшее распространение железная (белая) латунь нашла в Германии, где она называлась Aich-Metall, и использовалась для обшивки судов.
Большой интерес учёных эпохи Революции в естествознании вызвал вольфрам. В металлическом состоянии он был получен братьями Элюар в Испании в 1783 г. Элюары провели широкие исследования по изучению сплавов вольфрама, которые они получали в тиглях «с угольной набойкой». В тигли помещали оксиды вольфрама и исследуемые металлы, в том числе – чугун.
Впоследствии к изучению сплавов вольфрама присоединился Бертье. Ему удалось получить сплавы с содержанием вольфрама до 37 %. Кроме того Бертье исследовал тройную систему, включавшую железо, марганец и вольфрам. Высокотемпературная обработка в угольном тигле шихты, состоявшей из руд изучаемых металлов, позволила получить сплав, включавший 16 % железа, 6 % марганца и 78 % вольфрама.
Усилия многих исследователей были подытожены английским инженером Окслендом, который в 1857 г. взял патент на получение железо-вольфрамовых сплавов. В тексте патента можно прочитать следующее: «Вольфрам, восстановленный из волчеца (вольфрамовой руды) углеродом, может быть смешан с рудой в доменной печи, или с чугуном в вагранке, в количестве до 30 %. Сплав чугуна и вольфрама может быть применён в металлургической технике… Хорошую литую сталь можно получить, прибавляя к ней от 0,5 до 25 % вольфрама. Сплавы железа с вольфрамом могут быть очищены и превращены в литую сталь обыкновенным способом цементования». Фактически мы видим описание полного технологического цикла получения и применения ферросплава, используемого для легирования стали.
Сплав чугуна и вольфрама может быть применён в металлургической технике… Хорошую литую сталь можно получить, прибавляя к ней от 0,5 до 25 % вольфрама. Сплавы железа с вольфрамом могут быть очищены и превращены в литую сталь обыкновенным способом цементования». Фактически мы видим описание полного технологического цикла получения и применения ферросплава, используемого для легирования стали.
Запатентованная Окслендом технология получения и применения «ферровольфрама» была реализована в промышленном масштабе в Австрии (её внедрение приписывается профессору Майеру из Леобена) в 1859 г. Спустя 5 лет вольфрамовую сталь производили несколько предприятий Австрии и Германии (её использовали для изготовления снарядов и холодного оружия). В 1864 г. Зиверт опубликовал состав стали, выплавляемой на сталелитейном заводе в Бохуме. Она содержала от 1 до 3 % вольфрама и около 1 % углерода.
Велер, Реле, Карстен, Гохштеттер изучали влияние титана на свойства стали и чугуна. Было рекомендовано получать титанистую сталь, содержащую до 1 % титана из чугуна, в который титан попадал из природно-легированных руд. Впоследствии, в период 1859-61 гг. Роберт Мюшет взял 13 патентов на различные способы получения и применения титановых сплавов железа, включая производство «ферротитана» (тигельным способом) с последующим его использованием для получения легированной стали.
Впоследствии, в период 1859-61 гг. Роберт Мюшет взял 13 патентов на различные способы получения и применения титановых сплавов железа, включая производство «ферротитана» (тигельным способом) с последующим его использованием для получения легированной стали.
Исследования сплавов железа с кобальтом, молибденом и хромом проводились Бертье и Смитом. Сплавы получались тигельной плавкой гематитовой железной руды с оксидами и рудами исследуемых металлов. Содержание в сплаве кобальта достигало 55 %. Были установлены высокие магнитные свойства железокобальтовых сплавов. В отношении сплавов с молибденом Бертье отмечал, что их получение и свойства аналогичны сплавам вольфрама.
Бертье также впервые получил и исследовал сталь, содержащую до 17 % хрома, и установил её высокую стойкость к действию кислот. Бертье получал хромсодержащую сталь тигельным способом, используя шихту, состоящую из гематитовой и хромовой руды (хромистого железняка), древесного угля и известняка, «который насыщал кремнезём и глинозём минералов». Смит в лаборатории Лондонской горной школы провел классические модельные эксперименты, сплавляя в угольном тигле химически чистые гематит и оксид хрома. Он получил широкую гамму сплавов, в которых содержание хрома изменялось в пределах от 4 до 77 %, а железа, соответственно, от 96 до 23 %.
Смит в лаборатории Лондонской горной школы провел классические модельные эксперименты, сплавляя в угольном тигле химически чистые гематит и оксид хрома. Он получил широкую гамму сплавов, в которых содержание хрома изменялось в пределах от 4 до 77 %, а железа, соответственно, от 96 до 23 %.
Подробные и методически выверенные исследования сплавов железа были выполнены выдающимся физиком Майклом Фарадеем и его коллегой Штодартом. Их результаты опубликованы в научном издании «TheQuarterlyJournalofscience» за 1820 г. Фарадей и Штодарт изучали влияние на свойства стали, сварочного железа и чугуна никеля, золота, серебра, платины, родия, палладия, иридия, алюминия. Сплавы получали свариванием пакетов, полученных из скрученной проволоки чистых металлов. Содержание легирующих элементов доводили до 10 %. Для получения больших количеств легированной стали и чугуна (при изготовлении холодного оружия или отливки небольших колоколов) использовали лигатуры, приготовленные в тиглях, и содержащие около 5 % легирующих металлов.
Была получена сталь, содержащая до 10 % никеля, и установлена её высокая стойкость к коррозии и «высокая магнитная сила». Для получения сплавов железа и алюминия в тигли помещали боксит (глинозём), хлориды железа, натрия и калия. Кристаллизовавшийся продукт обрабатывали слабой соляной кислотой. Получали сплав, содержащий от 20 до 80 % алюминия, который затем использовали для легирования железа в процессе пудлингования и при выплавке дамасской стали тигельным способом. Выплавленная сталь, по словам Фарадея, обладала хорошими свойствами, особенно с добавлением платины. На основе полученных данных Фарадей, Бертье и их последователи объясняли свойства булата наличием посторонних примесей в стали: Фарадей – алюминия, платины и серебра, Бертье – хрома.
В это же время на Урале были открыты месторождения платины, и министр финансов и Главноуправляющий Корпуса горных инженеров граф Егор Францевич Канкрин поручил горному ведомству повторить опыты Фарадея по сплавлению стали c платиной. Эта работа была поручена управляющему Златоустовским горным округом Павлу Петровичу Аносову, у которого к тому времени был уже солидный опыт по изучению качественных восточных клинков и который проводил исследования по получению булатной стали. Опыты заняли более года, в результате была получена сталь достаточно высокого качества, имеющая узоры, которые, однако, были отличны от булатных. В июне 1829г. из Златоуста в Горный департамент поступили две сабли и один клинок, изготовленные из этой стали.
Эта работа была поручена управляющему Златоустовским горным округом Павлу Петровичу Аносову, у которого к тому времени был уже солидный опыт по изучению качественных восточных клинков и который проводил исследования по получению булатной стали. Опыты заняли более года, в результате была получена сталь достаточно высокого качества, имеющая узоры, которые, однако, были отличны от булатных. В июне 1829г. из Златоуста в Горный департамент поступили две сабли и один клинок, изготовленные из этой стали.
Следующие два года Аносов посвятил опытам по изучению влияния различных легирующих добавок на свойства стали. Помимо платинистых сталей, которые он изучал особенно тщательно, были изучены стали с добавками золота, серебра, марганца, хрома и титана. Аносовым были подробно описаны свойства сталей с различным содержанием этих элементов. Многие из них улучшали свойства стали, некоторые давали узоры, однако булата получить не удавалось.
Таким образом, в период Революции в естествознании усилиями исследователей многих стран была создана научная база и сформированы представления о влиянии легирующих элементов на качество стали, сварочного железа и чугуна.
ПОДЕЛИСЬ ИНТЕРЕСНОЙ ИНФОРМАЦИЕЙ
Химия d-элементов (медь, серебро, цинк, хром, марганец, железо) – HIMI4KA
ЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29Cu 1s22s22p63s23p63d104s1, наиболее устойчивые степени окисления +2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:
Полученную медь называют черновой (содержание меди 95–98%). Затем медь подвергают электролитическому рафинированию для получения меди высокой чистоты. Металл малой активности, в ряду напряжений металлов медь расположена после водорода. Ее химические свойства:
Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:
Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:
Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:
Серебро находится в пятом периоде, группе IБ. Его электронная формула 1s22s22p63s23p63d104s24p64d105s1. В промышленности серебро получают комплексной переработкой полиметаллических руд. Химические реакции, характерные для серебра:
Оксид серебра Ag2O — термически нестабильный, типичный основный оксид. Его химические свойства:
Его химические свойства:
Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30Zn 1s22s22p63s23p63d104s2. В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:
Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:
Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:
Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:
Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24Cr 1s22s22p63s23p63d54s1. Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:
Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:
Его характерные химические реакции:
Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:
Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:
Марганец расположен в четвертом периоде, группе VIIБ, Периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p63d54s2. Характерные степени окисления марганца +2, +4, +6 и +7. В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:
Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:
MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:
Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.
Разлагается уже при температуре 55 °С, при ударе может взорваться.
Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26Fe 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:
Характерные для железа химические реакции:
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
Введение в органическую химию →
← Водород
Железо и медь – Сравнение – Свойства
В этой статье проводится сравнение основных тепловых и атомных свойств железа и меди, двух сопоставимых химических элементов из периодической таблицы. Он также содержит основные описания и применения обоих элементов. Железо против меди.
Сравните железо с другим элементом
Сравните медь с другим элементом
Железо и медь – об элементах
Железо
Железо — металл первого переходного ряда. По массе это самый распространенный элемент на Земле, образующий большую часть внешнего и внутреннего ядра Земли. Это четвертый по распространенности элемент в земной коре. Его изобилие на скалистых планетах, таких как Земля, связано с его обильным образованием в результате синтеза звезд большой массы.
Медь
Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Источник: www.luciteria.com
Железо и медь – Применение
Железо
Железо используется во многих отраслях, таких как электроника, производство, автомобилестроение, строительство и строительство. Железо является наиболее широко используемым из всех металлов, на его долю приходится более 90% мирового производства металлов. Его низкая стоимость и высокая прочность часто делают его предпочтительным материалом для противостояния нагрузкам или передачи сил, например, для изготовления машин и станков, рельсов, автомобилей, корпусов кораблей, бетонных арматурных стержней и несущих конструкций зданий. . Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для изготовления стали. Стали представляют собой сплавы железа с углеродом, которые могут содержать заметные концентрации других легирующих элементов. Добавление небольшого количества неметаллического углерода к железу меняет его большую пластичность на большую прочность. Из-за своей очень высокой прочности, но все же значительной ударной вязкости, а также способности сильно изменяться при термической обработке сталь является одним из наиболее полезных и распространенных сплавов железа в современном использовании. Существуют тысячи сплавов с различным составом и/или термической обработкой. Механические свойства чувствительны к содержанию углерода, которое обычно составляет менее 1,0 мас.%.
. Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для изготовления стали. Стали представляют собой сплавы железа с углеродом, которые могут содержать заметные концентрации других легирующих элементов. Добавление небольшого количества неметаллического углерода к железу меняет его большую пластичность на большую прочность. Из-за своей очень высокой прочности, но все же значительной ударной вязкости, а также способности сильно изменяться при термической обработке сталь является одним из наиболее полезных и распространенных сплавов железа в современном использовании. Существуют тысячи сплавов с различным составом и/или термической обработкой. Механические свойства чувствительны к содержанию углерода, которое обычно составляет менее 1,0 мас.%.
Медь
Исторически сложилось так, что сплав меди с другим металлом, например оловом, для получения бронзы впервые начали практиковать примерно через 4000 лет после открытия плавки меди и примерно через 2000 лет после того, как «природная бронза» стала широко использоваться. Древняя цивилизация находится в бронзовом веке либо путем производства бронзы путем выплавки собственной меди и сплавления с оловом, мышьяком или другими металлами. Основными областями применения меди являются электрические провода (60%), кровля и водопровод (20%), а также промышленное оборудование (15%). Медь используется в основном в чистом виде, но когда требуется большая твердость, ее вводят в такие сплавы, как латунь и бронза (5% от общего использования). Медь и сплавы на ее основе, включая латуни (Cu-Zn) и бронзы (Cu-Sn), широко используются в различных промышленных и общественных целях. Некоторые из распространенных применений латунных сплавов включают бижутерию, замки, петли, шестерни, подшипники, гильзы для боеприпасов, автомобильные радиаторы, музыкальные инструменты, электронную упаковку и монеты. Бронза или бронзоподобные сплавы и смеси использовались для изготовления монет в течение более длительного периода. до сих пор широко используется для пружин, подшипников, втулок, направляющих подшипников автомобильных трансмиссий и аналогичных фитингов, и особенно распространен в подшипниках небольших электродвигателей.
Древняя цивилизация находится в бронзовом веке либо путем производства бронзы путем выплавки собственной меди и сплавления с оловом, мышьяком или другими металлами. Основными областями применения меди являются электрические провода (60%), кровля и водопровод (20%), а также промышленное оборудование (15%). Медь используется в основном в чистом виде, но когда требуется большая твердость, ее вводят в такие сплавы, как латунь и бронза (5% от общего использования). Медь и сплавы на ее основе, включая латуни (Cu-Zn) и бронзы (Cu-Sn), широко используются в различных промышленных и общественных целях. Некоторые из распространенных применений латунных сплавов включают бижутерию, замки, петли, шестерни, подшипники, гильзы для боеприпасов, автомобильные радиаторы, музыкальные инструменты, электронную упаковку и монеты. Бронза или бронзоподобные сплавы и смеси использовались для изготовления монет в течение более длительного периода. до сих пор широко используется для пружин, подшипников, втулок, направляющих подшипников автомобильных трансмиссий и аналогичных фитингов, и особенно распространен в подшипниках небольших электродвигателей. Латунь и бронза являются распространенными конструкционными материалами в современной архитектуре и в основном используются для кровли и облицовки фасадов из-за их внешнего вида.
Латунь и бронза являются распространенными конструкционными материалами в современной архитектуре и в основном используются для кровли и облицовки фасадов из-за их внешнего вида.
Железо и медь – сравнение в таблице
| Элемент | Железо | Медь |
| Плотность | 7,874 г/см3 | 8,92 г/см3 |
| Предел прочности при растяжении | 540 МПа | 210 МПа |
| Предел текучести | 50 МПа | 33 МПа |
| Модуль упругости Юнга | 211 ГПа | 120 ГПа |
| Шкала Мооса | 4,5 | 3 |
| Твердость по Бринеллю | 490 МПа | 250 МПа |
| Твердость по Виккерсу | 608 МПа | 350 МПа |
| Точка плавления | | 1084,62 °С |
| Точка кипения | 2861 °С | 2562 °С |
| Теплопроводность | 80,2 Вт/мК | 401 Вт/мК |
| Коэффициент теплового расширения | 11,8 мкм/мК | 16,5 мкм/мК |
| Удельная теплоемкость | 0,44 Дж/г К | 0,38 Дж/г К |
| Теплота плавления | 13,8 кДж/моль | 13,05 кДж/моль |
| Теплота испарения | 349,6 кДж/моль | 300,3 кДж/моль |
Медь: определение, состав, типы, свойства и применение
Медь — это химический элемент, который также является металлом. Его ключевые свойства заключаются в том, что он обладает отличной электропроводностью, высокой теплопроводностью и хорошей коррозионной стойкостью. Он также пластичен и имеет интересный красновато-коричневый цвет. Сочетание этих свойств приводит к широкому применению меди в инженерных и эстетических целях.
Его ключевые свойства заключаются в том, что он обладает отличной электропроводностью, высокой теплопроводностью и хорошей коррозионной стойкостью. Он также пластичен и имеет интересный красновато-коричневый цвет. Сочетание этих свойств приводит к широкому применению меди в инженерных и эстетических целях.
Что такое медь?
Медь — химический элемент, номер 29 в периодической таблице элементов. Символ медного элемента — Cu, от латинского « cuprum ». Это пластичный металл красновато-коричневого цвета. Он широко применяется благодаря высокой тепло- и электропроводности.
Какова история меди?
История меди восходит к 8700 г. до н.э. Медный кулон, обнаруженный в Северном Ираке, датируется примерно этой датой и в настоящее время считается самым старым предметом из меди. Медь была важнейшим металлом во многих древних цивилизациях, но общепризнано, что медь открыли жители Месопотамии (в Северном Ираке). Фактически, доисторический период — это медный век между 5500 г. до н.э. и 4000 г. до н.э., обычно называемый эпохой энеолита от греческих слов, обозначающих медь (халкос) и камень (литос).
до н.э. и 4000 г. до н.э., обычно называемый эпохой энеолита от греческих слов, обозначающих медь (халкос) и камень (литос).
Медь является одним из немногих металлов, которые могут встречаться в природе в естественной металлической форме. Это отличается от большинства металлов, которые необходимо извлекать с помощью металлургии из руды. В местах, где встречается самородная медь, технологии металлургии не были необходимы тем цивилизациям, чтобы начать работать с медью для изготовления оружия и украшений.
Какой другой термин для меди?
Другим термином для меди является латинское слово cuprum , которое дает меди ее символ Cu в периодической таблице элементов. Латинское название меди произошло от острова Кипр, так как в древние времена остров был основным источником меди. Купрум был «металлом Кипра».
Из чего сделана медь?
Медь — химический элемент. Он состоит только из атомов одного типа — его нельзя разложить на более простые вещества. Атом меди имеет атомный номер 29, что означает, что его атомное ядро содержит 29 протонов.
Атом меди имеет атомный номер 29, что означает, что его атомное ядро содержит 29 протонов.
Медь добывается из природных руд — либо сульфидной руды (например, халькопирит), либо руды оксида меди. Эти руды добываются, дробятся и перерабатываются для производства меди. Эти медные руды находятся в некоторых частях Северной и Южной Америки (таких странах, как Чили и Перу), а также в таких районах, как Уральские горы в России, а также в Замбии и Демократической Республике Конго в Африке.
Какие существуют процессы производства меди?
Различные процессы получения меди описаны ниже:
1. Горнодобывающая промышленность
Добыча медных руд обычно осуществляется в крупных карьерах. Это открытые ступенчатые ямы в земле, которые постепенно углубляются. Для взрыва породы используются взрывчатые вещества, а полученные валуны транспортируются для дробления на более мелкие части для обработки.
В соответствии с двумя распространенными типами медной руды существует два основных процесса очистки. Для окисленных руд используется гидрометаллургический процесс. Измельченная руда складывается в кучу, и раствор для кислотного выщелачивания просачивается через кучу. Это создает насыщенный раствор для выщелачивания. Пирометаллургический процесс используется для сульфидных руд. Извлечение руды осуществляется пенной флотацией и сгущением в зависимости от плотности частиц.
Для окисленных руд используется гидрометаллургический процесс. Измельченная руда складывается в кучу, и раствор для кислотного выщелачивания просачивается через кучу. Это создает насыщенный раствор для выщелачивания. Пирометаллургический процесс используется для сульфидных руд. Извлечение руды осуществляется пенной флотацией и сгущением в зависимости от плотности частиц.
3. Очистка
Для окисленных руд используется гидрометаллургия. Это означает, что продуктивный выщелачивающий раствор направляется в процесс экстракции растворителем для концентрирования меди в растворе. Затем этот раствор направляют на электролиз, где электричество используется для осаждения твердой меди. Для сульфидных руд используется пирометаллургия, что означает, что плавильный завод используется для производства сырой меди. Затем его дополнительно очищают электрорафинированием.
4. Легирование
Медные сплавы производятся путем сначала плавления легирующего материала, а затем плавления меди для добавления к нему. Затем расплавленную смесь отливают и дают ей остыть и затвердеть.
Затем расплавленную смесь отливают и дают ей остыть и затвердеть.
5. Электрорафинирование
Электрорафинирование меди включает электролитическое растворение нечистого медного материала в растворе. Чистая медь электрохимически осаждается на электроде путем подачи электрического тока через раствор. Это удаляет примеси из меди для достижения более высокой чистоты. Однако этот процесс является дорогостоящим и требует очень большого потребления электроэнергии.
Каковы характеристики меди?
Металлическая медь имеет основные характеристики, заключающиеся в том, что она является отличным электрическим и тепловым проводником. Он также податлив и пластичен, что означает, что его можно относительно легко согнуть. Это упрощает работу, например, с гибкими кабелями. Еще одной ключевой характеристикой металлической меди является ее коррозионная стойкость, особенно в воде и морской воде. Наконец, медь имеет то преимущество, что она эстетически привлекательна, поскольку она имеет красновато-коричневый цвет и ее можно полировать.
Какого цвета медь?
Медь обычно имеет красновато-коричневый цвет. Однако чистая медь до окисления на самом деле имеет розовый цвет, но образование коричневого оксида меди происходит так быстро, что любая легкодоступная медь будет обычной красновато-коричневой. Медь также может иметь зеленый оттенок (например, на Статуе Свободы) — это карбонат меди.
Как выглядит медь?
Медь выглядит как красновато-коричневый блестящий металл. Медь может быть переработана во множество различных практических форм, таких как провода, показанные на рис. 1 ниже, а также водопроводные трубы и электроника:
Какие бывают виды меди?
Медь доступна в различных типах для различных применений. Свойства и области применения каждой марки меди зависят от чистоты меди и от того, какие легирующие элементы (если таковые имеются) включены. Ниже перечислены различные типы меди:
1. Медная проволока
Медная проволока обладает отличной электропроводностью.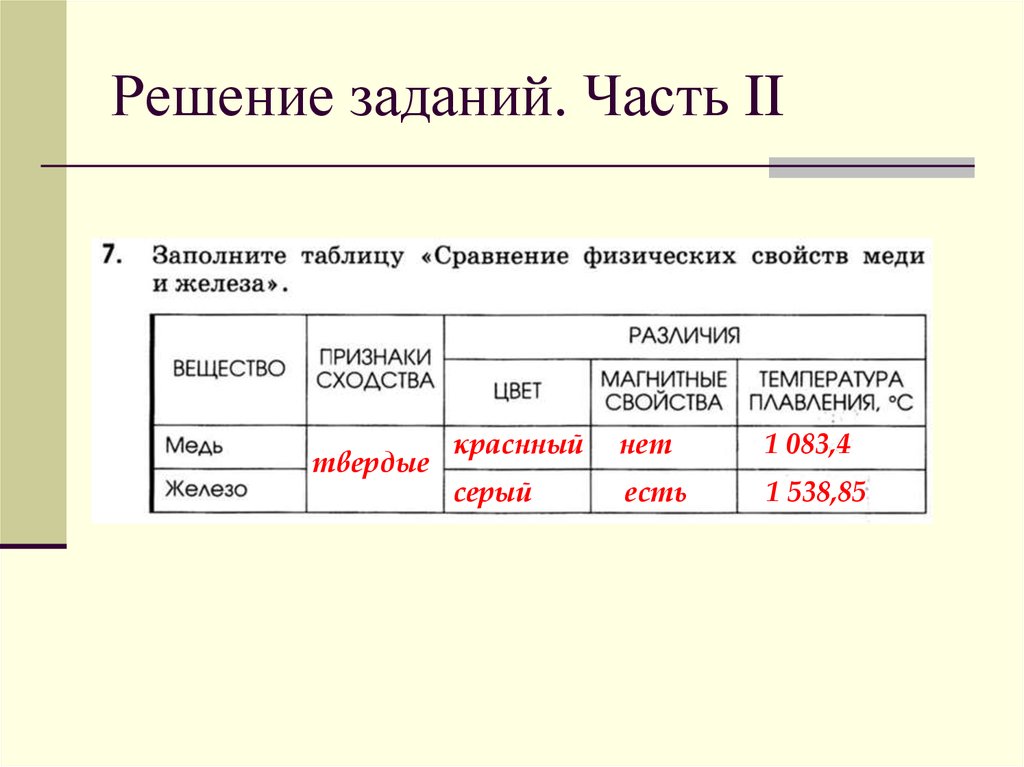 Это наиболее распространенный проводник для большинства электрических применений. Он используется для больших токов в промышленности, а также для бытового использования, вплоть до проводки в вашем доме для розеток и освещения.
Это наиболее распространенный проводник для большинства электрических применений. Он используется для больших токов в промышленности, а также для бытового использования, вплоть до проводки в вашем доме для розеток и освещения.
2. Медные трубы
Медные трубы широко используются в бытовых системах питьевой воды из-за их коррозионной стойкости и, следовательно, долговечности. За последние несколько десятилетий в большинстве стран мира стало стандартом использование медных труб для сантехники. Трубы доступны в различных диаметрах и датчиках (толщина стенок). Высокая стоимость меди и появление улучшенных материалов для пластиковых труб означает, что медь становится менее популярной.
3. Медные сплавы
Двумя наиболее распространенными медными сплавами являются латунь (легированная цинком) и бронза (легированная оловом). Латунь обычно применяется более широко. Из него изготавливают сантехнику, музыкальные инструменты и предметы декора. Добавление цинка придает сплаву более высокую прочность и пластичность. Бронза имеет очень схожие характеристики с медью, такие как высокая теплопроводность, отличная пластичность и устойчивость к коррозии в морской воде. Поэтому бронза используется для подшипников и втулок, а также для судовых крыльчаток.
Бронза имеет очень схожие характеристики с медью, такие как высокая теплопроводность, отличная пластичность и устойчивость к коррозии в морской воде. Поэтому бронза используется для подшипников и втулок, а также для судовых крыльчаток.
4. Чистая медь
Чистая медь специально подготовлена для обеспечения минимального количества примесей, максимизируя тепловые и электрические свойства меди. Чистая медь имеет тенденцию быть более мягкой и менее прочной, чем медь с добавками или незначительными легирующими материалами. Он идеально подходит для прецизионных электрических компонентов, для которых идеальна его электропроводность и низкое тепловое расширение.
5. Наночастицы меди
Наночастицы меди представляют собой очень маленькие частицы меди или материалов на ее основе, размер которых находится в диапазоне 1–100 нм. Было обнаружено, что поведение наночастиц отличается от поведения объемных материалов. В случае наночастиц меди они проявляют очень высокую каталитическую активность в промышленных химических реакциях, вероятно, из-за их большого отношения площади поверхности к объему. Кроме того, наночастицы меди показали отличные противомикробные эффекты.
Кроме того, наночастицы меди показали отличные противомикробные эффекты.
6. Медь для механической обработки
Медь для механической обработки содержит небольшое количество (<1%) других легирующих элементов для улучшения обрабатываемости меди. Затем из меди свободной механической обработки можно будет легче изготовить такие предметы, как сварочные сопла и жала паяльника.
7. Медные листы и пластины
Медные листы представляют собой тонкие листы меди (около 2 мм или менее), а пластины более толстые (толщиной до 12 мм). Как правило, они доступны в различных сортах меди. Листы очень податливы и могут быть сформированы в различные компоненты.
8. Бескислородная медь
Бескислородная медь плавится в ванне с гранулированным графитом для исключения кислорода. Это самая чистая из доступных медей с минимальным количеством примесей из-за неокислительных условий. Его высокая электропроводность и низкое содержание летучих примесей делают его пригодным для использования в высоковакуумной электронике.
9. Электролитическая медь
Электролитическая медь очищается путем электролиза в растворе для удаления примесей. Этот сорт меди высокой чистоты обладает высокой электропроводностью и поэтому используется в различных электрических компонентах, таких как шины и обмотки.
Каковы свойства меди?
Свойства различных типов меди показаны в Таблице 1:
Свойства каждого сорта аналогичны, но их различия приводят к различным применениям.
Каковы физические свойства меди?
Физические свойства различных типов меди показаны в таблице 2 ниже:
Физические свойства зависят от процентного содержания меди в материале, а также легирующих элементов
Каковы химические свойства меди?
Химические свойства меди в первую очередь зависят от степени ее окисления. Обычно существуют две степени окисления: Cu+ и Cu2+. В таблице 3 ниже приведены некоторые химические свойства распространенных соединений и условия для меди:
Эти свойства могут различаться для каждого конкретного соединения меди (например, оксалаты, сульфиты и сульфаты). Применения меди можно найти в повседневном обществе. Ниже приведены некоторые распространенные примеры:
Применения меди можно найти в повседневном обществе. Ниже приведены некоторые распространенные примеры:
1. Электроника
Медь широко используется в электронике, так как обладает отличной электропроводностью. Это позволяет проводить токи по медным поперечным сечениям меньшего размера по сравнению с алюминием, что позволяет использовать меньший объем и меньшие размеры компонентов.
2. Архитектура
Медь используется в архитектуре для придания эстетичного внешнего вида. Он использовался для облицовки крыш и стен, а также водосточных желобов и водостоков.
3. Сантехника
Медные трубы широко используются для водопровода в домашних хозяйствах благодаря очень хорошей коррозионной стойкости.
4. Транспорт
Медь широко используется в современных транспортных средствах из-за большого количества электрических кабелей, используемых для сложной электроники. По мере роста доли рынка электромобилей все большее количество меди используется для таких элементов, как электродвигатели. Это связано с превосходной электропроводностью меди, уступающей только серебру.
Это связано с превосходной электропроводностью меди, уступающей только серебру.
5. Возобновляемые источники энергии
Медь используется на рынке возобновляемых источников энергии различными способами. Например, ветряные турбины используют медь в генерирующих турбинах. Солнечные фотоэлектрические панели также требуют меди для соединений и кабелей.
6. Медицинское оборудование
Медь используется в качестве покрытия медицинского оборудования благодаря своим антибактериальным свойствам. Таким образом, снижается риск инфицирования пациентов.
7. Электропроводка
Медь широко используется в электропроводке из-за ее превосходной электропроводности. Поперечное сечение меди, необходимое для эффективной передачи определенного тока, меньше, чем у других доступных материалов, таких как алюминий.
8. Чеканка монет
Медь исторически использовалась в монетах по ряду причин: она податлива и поэтому легко штампуется, но при этом достаточно прочна, чтобы выжить в обращении. Он также обладает антимикробными свойствами и коррозионной стойкостью.
Он также обладает антимикробными свойствами и коррозионной стойкостью.
9. Промышленное оборудование
Медь по-разному используется в промышленном оборудовании. Помимо электрических приложений, таких как двигатели и кабели, он также используется в теплообменниках, таких как конденсаторы охлаждения. Он также может применяться для обеспечения особой химической стойкости.
Каковы преимущества меди?
Медь имеет ряд очевидных преимуществ, которые перечислены ниже:
- Обладает превосходной электропроводностью, уступая только серебру, что делает ее наиболее широко используемым проводником для электрических и электронных компонентов во всем мире.
- Обладает очень хорошей теплопроводностью, поэтому используется в теплообменниках, таких как конденсаторы в холодильных установках и кондиционерах.
- Обладает коррозионной стойкостью, особенно при работе с водой и морской водой, что привело к его широкому использованию в водопроводно-канализационных системах.

- Пластичен и относительно легко сгибается. С ним легко работать как в сантехнических системах, так и в кабелях.
- Обладает противомикробным действием, что может быть очень полезно при транспортировке воды, а также в медицинских целях для защиты здоровья пациентов.
Какова польза меди для здоровья?
Медь — микроэлемент, необходимый для здоровья человека в очень малых количествах. Медь играет важную роль в организме, способствуя усвоению железа, участвуя в производстве эритроцитов, а также в производстве коллагена. Считается, что он улучшает функцию иммунной системы.
Необходимы дополнительные исследования, но есть некоторые признаки того, что медь может улучшить остеопороз (низкая плотность костей), и есть недоказанные теории о том, что медные браслеты можно использовать для облегчения боли в суставах при артрите.
Группы продуктов, которые содержат медь, включают листовую зелень, цельные зерна, орехи и семена. Конкретными продуктами с высоким содержанием меди являются устрицы, грибы шиитаке, сладкий картофель и темный шоколад.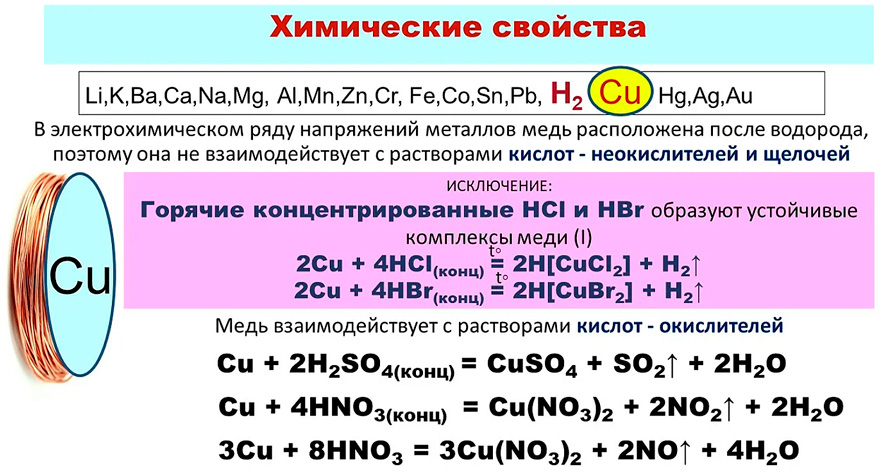
Каковы ограничения меди?
Медь имеет ряд ограничений, некоторые из которых перечислены ниже:
- Относительно дорога по сравнению с потенциальными альтернативными материалами, такими как: алюминий (электрические кабели) или пластмассы (водопроводы).
- Относительно тяжелый по сравнению с такими материалами, как алюминий, поэтому для воздушных проводов может быть нецелесообразным.
- Окисляется, особенно при высоких температурах, поэтому имеет ограниченный срок службы на воздухе.
- Представляет опасность поражения электрическим током по сравнению с альтернативной технологией передачи сигнала по оптоволокну.
- Токсичен в больших количествах, поэтому его нельзя применять там, где может происходить регулярное попадание меди в организм, например, в посуде.
Легко ли ржавеет медь?
Медь технически не ржавеет, так как ржавчина представляет собой оксид железа, а в меди нет железа. Тем не менее, медь подвержена некоторой ограниченной поверхностной коррозии. Медь обычно считается устойчивой к коррозии. Он естественно имеет красновато-коричневый цвет, что связано с образованием пассивирующей пленки оксида меди на поверхности металла. Со временем на поверхности образуется зеленый карбонат меди, поскольку оксид меди реагирует с водой и углекислым газом в воздухе.
Медь обычно считается устойчивой к коррозии. Он естественно имеет красновато-коричневый цвет, что связано с образованием пассивирующей пленки оксида меди на поверхности металла. Со временем на поверхности образуется зеленый карбонат меди, поскольку оксид меди реагирует с водой и углекислым газом в воздухе.
Является ли медь ядовитой для человека?
Да, медь может быть ядовита для человека в значительных концентрациях. Медь является важным микроэлементом для здоровья человека, но при избытке меди возникает ряд осложнений. Высокая концентрация меди в крови связана с болезнью Альцгеймера и некоторыми видами рака, такими как рак груди и легких. Острое отравление медью встречается очень редко, но может произойти при поглощении больших количеств меди. Это может быть фатальным, поскольку начинает происходить отказ таких органов, как печень и почки.
Является ли медь металлом?
Да, медь — это металл. Он также считается тяжелым металлом из-за его относительно высокой плотности. Для получения дополнительной информации см. наше руководство по металлоидам.
Для получения дополнительной информации см. наше руководство по металлоидам.
В чем разница между медью и металлом?
Медь является одним из более чем 90 элементарных металлов. Медь — это металл, но многие металлы сильно отличаются от меди. Другие металлы отличаются по цвету; большинство металлов белые или серые, но медь красновато-коричневая. Другие металлы могут отличаться по своим физическим и химическим свойствам — они более твердые и хрупкие, чем медь, и обычно они не так легко проводят тепло или электричество.
В чем разница между медью и алюминием?
Медь и алюминий — два разных металла с разными свойствами. Наиболее очевидным визуальным отличием является цвет: медь — красновато-коричневая, а алюминий — тусклый серебристо-серый. Медь имеет более высокую прочность на растяжение, чем алюминий, и лучшую электрическую и тепловую проводимость.
В чем разница между медью и латунью?
Латунь представляет собой сплав преимущественно меди и цинка. Таким образом, латунь отличается от меди тем, что включает в себя другие металлы. Латунь может включать другие металлы, такие как олово, свинец, алюминий или марганец, в меньших количествах для достижения определенных свойств.
Таким образом, латунь отличается от меди тем, что включает в себя другие металлы. Латунь может включать другие металлы, такие как олово, свинец, алюминий или марганец, в меньших количествах для достижения определенных свойств.
Резюме
В этой статье представлена медь, объясняется, что это такое, и обсуждаются различные области применения меди. Чтобы узнать больше о меди, свяжитесь с представителем Xometry.
Xometry предоставляет широкий спектр производственных возможностей и других дополнительных услуг для всех ваших потребностей в прототипировании и производстве. Посетите наш веб-сайт, чтобы узнать больше или запросить бесплатное предложение без каких-либо обязательств.
Заявление об отказе от ответственности
Содержание, представленное на этой веб-странице, предназначено только для информационных целей. Xometry не делает никаких заявлений и не дает никаких гарантий, явных или подразумеваемых, в отношении точности, полноты или достоверности информации.


