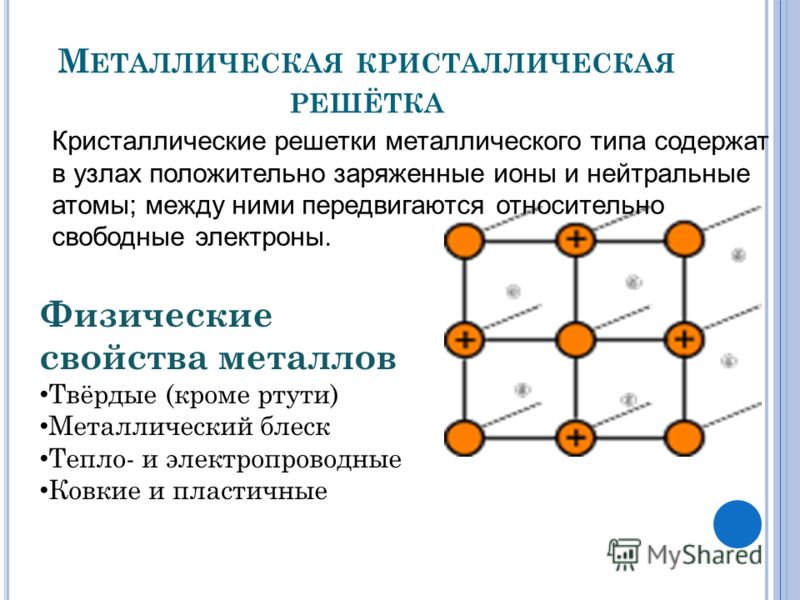
Свойства металлической кристаллической решетки: Типы кристаллических решёток — урок. Химия, 8 класс.
alexxlab | 07.03.1988 | 0 | Разное
Типы кристаллических решеток и свойства веществ
- Зотина Ирина Михайловна, учитель химии
Разделы: Химия
Ключевые слова: химия, ЕГЭ
По характеру структуры кристаллические решетки всех веществ относят к одному из четырех основных типов:
а) молекулярная решетка,
б) атомная,
в) ионная,
г) металлическая.
В основу этой классификации положен род структурных частиц (молекулы-атомы-ионы), находящихся в узлах кристаллической решетки.
Молекулярная решеткаВ узлах молекулярной решетки находятся полярные или неполярные молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Молекулы в кристалле способны совершать незначительные колебания различного характера. Вещества с молекулярным типом решетки, например, органические вещества, кристаллы инертных газов и большинства неметаллов, сухой лед (СО2 тверд.) обладают малой твердостью, низкими температурами плавления и кипения. Эти характеристики объясняются тем, что при приложении незначительной энергии межмолекулярные связи разрываются и кристалл разрушается с образованием отдельных молекул, что и наблюдается при плавлении и при испарении кристаллов. Внутри отдельных молекул атомы связаны значительно более прочными связями (ковалентными полярными или неполярными). Эти связи разрушаются при более высокой температуре, и молекулы распадаются на составляющие их атомы (происходит термическая диссоциация).
Молекулы в кристалле способны совершать незначительные колебания различного характера. Вещества с молекулярным типом решетки, например, органические вещества, кристаллы инертных газов и большинства неметаллов, сухой лед (СО2 тверд.) обладают малой твердостью, низкими температурами плавления и кипения. Эти характеристики объясняются тем, что при приложении незначительной энергии межмолекулярные связи разрываются и кристалл разрушается с образованием отдельных молекул, что и наблюдается при плавлении и при испарении кристаллов. Внутри отдельных молекул атомы связаны значительно более прочными связями (ковалентными полярными или неполярными). Эти связи разрушаются при более высокой температуре, и молекулы распадаются на составляющие их атомы (происходит термическая диссоциация).
В узлах атомной кристаллической решетки находятся атомы. Роль сил межмолекулярного взаимодействия здесь играют достаточно прочные ковалентные связи. Выделить из общей массы атомов один невозможно.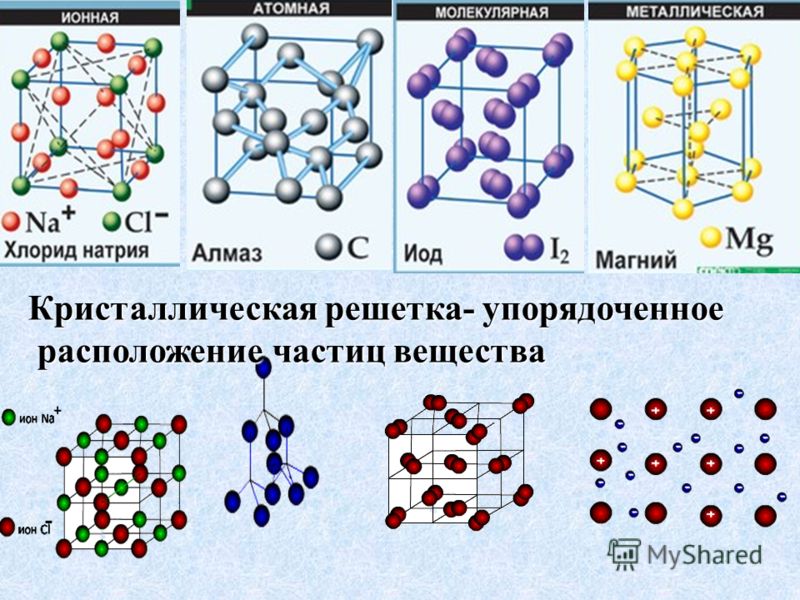 Вещества с атомным типом кристаллической решетки (алмаз, бор, кремний, карборунд SiC, нитрид алюминия и другие) характеризуются очень большой твердостью, иногда сочетающейся с хрупкостью, нерастворимостью в обычных растворителях, очень высокими температурами плавления и кипения. Все связи в кристалле равноценны. При разрыве этих связей, достигаемом лишь при высокой температуре, кристалл диссоциирует на отдельные атомы: плавление, кипение и термическая диссоциация практически совпадают.
Вещества с атомным типом кристаллической решетки (алмаз, бор, кремний, карборунд SiC, нитрид алюминия и другие) характеризуются очень большой твердостью, иногда сочетающейся с хрупкостью, нерастворимостью в обычных растворителях, очень высокими температурами плавления и кипения. Все связи в кристалле равноценны. При разрыве этих связей, достигаемом лишь при высокой температуре, кристалл диссоциирует на отдельные атомы: плавление, кипение и термическая диссоциация практически совпадают.
В узлах ионной кристаллической решетки находятся чередующиеся положительные и отрицательные ионы, связанные между собой силами кулоновского взаимодействия. Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
В узлах металлической решетки находятся положительно заряженные ионы металлов, окруженные электронами. Эти электроны, связанные отчасти с ионами силами электростатического взаимодействия, являются «полусвободными», иначе говоря «не прикреплены» к отдельным ионам, а более или менее свободно перемещаются между ними. Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия. Прочность и температуры плавления и кипения у металлов не всегда имеют промежуточные значения между этими же свойствами у веществ с атомными и ионными решетками. Это зависит от природы металла. Интересно, что заряд ионов в металлах не всегда отвечает номеру группы периодической системы, в которой металл находится.
Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия. Прочность и температуры плавления и кипения у металлов не всегда имеют промежуточные значения между этими же свойствами у веществ с атомными и ионными решетками. Это зависит от природы металла. Интересно, что заряд ионов в металлах не всегда отвечает номеру группы периодической системы, в которой металл находится. Например, в кристаллической решетке алюминия ионы имеют средний заряд +2. Это можно объяснить двумя способами:
Например, в кристаллической решетке алюминия ионы имеют средний заряд +2. Это можно объяснить двумя способами:
а) все атомы алюминия отдали по два электрона в «электронный газ»;
б) все атомы отдали по три электрона, но в среднем одна треть образовавшихся ионов Al+3 снова образует «атомы», поэтому средний заряд всех структурных частиц +2.
Таким образом, металлическое состояние в упрощенном представлении подобно атомарному ввиду его суммарной электронейтральности; это сосуществование и взаимосвязь «атомов»-ионов-электронов.
Типы кристаллических решеток и свойства веществ№ | Структурные частицы кристалла | Характер связи между структурными частицами кристалла | Характер связи в молекулах | Примеры кристаллических веществ | Характерные свойства | |
1. | Молекулярная | Полярные молекулы – диполи | 1. Электростатическое взаимодействие диполей. | Ковалентные полярные | HF, H2O, HCl, H2S, PCl3, NH3 (твердые) | Межмолекулярное взаимодействие средней силы. |
| Неполярные молекулы | Силы Ван-дер-Ваальса (слабые) | Ковалентные неполярные и ковалентные полярные | H2, Cl2, O2, N2, F2, СО2, SO3 (образованы молекулами симметричного строения) | Межмолекулярное взаимодействие слабое. Растворимы в неполярных растворителях, очень малая термическая устойчивость, очень слабая электропроводность, легкая летучесть (очень низкие температуры плавления и кипения), очень слабые механические свойства. | ||
2. | Атомная | Атомы | Ковалентные связи | – | C, Si, SiC, AlN, ВеО (образованы элементами, среднее арифметическое номеров групп которых равно 4) | Нерастворимы в обычных растворителях, термически устойчивы, неэлектропроводны, температуры плавления и кипения очень высокие; твердые, но хрупкие, прочность связей между частицами очень высокая. |
3. | Ионная | Ионы: катионы, анионы | 1. Электростатическое взаимодействие. | – | CsF, KCl, CaF2, CsH, NaF, ВаCl 2 | Растворимы в полярных растворителях, термическая устойчивость высокая, большая электропроводность в растворах и расплавах, высокие температуры плавления; вещества твердые, но хрупкие, прочность связей между частицами высокая. |
4. | Металлическая | Катионы, «атомы», электроны | 1. Электростатическое притяжение ионов и электронов. | – | Na, K, Cu, Zn, Fe, Pt, Pb | Растворимы в расплавленных металлах, термическая устойчивость различная, электропроводность высокая, температуры плавления и кипения лежат в широких пределах; вещества пластичные, твердость, как и прочность связей между частицами, различная. |
Кристаллическая решетка
Твердые кристаллы можно представить как трехмерные конструкции, в которых четко повторяется один и тот же элемент структуры во всех направлениях. Геометрически правильная форма кристаллов обусловлена их строго закономерным внутренним строением. Если центры притяжения атомов, ионов или молекул в кристалле изобразить в виде точек, то получим трехмерное регулярное распределение таких точек, которое называется кристаллической решеткой, а сами точки — узлы кристаллической решетки. Определенная внешняя форма кристаллов является следствием их внутренней структуры, которая связана именно с кристаллической решеткой.
Кристаллическая решетка — это воображаемый геометрический образ для анализа строения кристаллов, который представляет собой объемно-пространственную сетчатую структуру, в узлах которой располагаются атомы, ионы или молекулы вещества.
Для характеристики кристаллической решетки используют следующие параметры:
- Энергия кристаллической решетки Екр [КДж / моль] — это энергия, выделяющаяся при образовании 1 моля кристалла из микрочастиц (атомов, молекул, ионов), которые находятся в газообразном состоянии и удалены друг от друга на такое расстояние, что исключается возможность их взаимодействия.
- Константа кристаллической решетки d [A0] — наименьшее расстояние между центрами двух частиц в соседних узлах кристаллической решетки, соединенных химической связью.
- Координационное число — количество ближайших частиц, окружающих в пространстве центральную частицу и сочетаются с ней химической связью.
Основой кристаллической решетки является элементарная ячейка, которая повторяется в кристалле бесконечное количество раз.
Элементарная ячейка — это наименьшая структурная единица кристаллической решетки, которая обнаруживает все свойства ее симметрии.
Упрощенно элементарную ячейку можно определить как малую часть кристаллической решетки, которая еще выявляет характерные особенности ее кристаллов. Признаки элементарной ячейки описываются с помощью трех правил Бреве :
- симметрия элементарной ячейки должна соответствовать симметрии кристаллической решетки;
- элементарная ячейка должна иметь максимальное количество одинаковых ребер а, b, с и одинаковых углов между ними a, b, g. ;
- при условии соблюдения первых двух правил элементарная ячейка должна занимать минимальный объем.
Для описания формы кристаллов используют систему трех кристаллографических осей а, b, с, которые отличаются от обычных координатных осей тем, что они являются отрезками определенной длины, углы между которыми a, b, g могут быть как прямыми, так и непрямыми.
Модель кристаллической структуры: а) кристаллическая решетка с выделенной элементарной ячейкой; б) элементарная ячейка с обозначениями гранных угловФорму кристалла изучает наука геометрическая кристаллография, одним из основных положений которой является закон постоянства гранных углов: для всех кристаллов данного вещества углы между соответствующими гранями всегда остаются одинаковыми.
Если взять большое количество элементарных ячеек и заполнить ими плотно друг к другу определенный объем, сохраняя параллельность граней и ребер, то образуется монокристалл идеальной строения. Но на практике чаще всего встречаются поликристаллов, в которых регулярные структуры существуют в определенных пределах, по которым ориентация регулярности резко меняется.
В зависимости от соотношения длин ребер а, b, с и углов a, b, g между гранями элементарной ячейки различают семь систем — так называемых сингоний кристаллов. Однако элементарная ячейка может быть построенной и таким образом, что она имеет дополнительные узлы, которые размещаются внутри ее объема или на всех ее гранях — такие решетки называются соответственно объемноцентрированными и гранецентрированными. Если дополнительные узлы находятся только на двух противоположных гранях (верхний и нижний), то это базоцентрированная решетка. С учетом возможности дополнительных узлов существует всего 14 типов кристаллических решеток.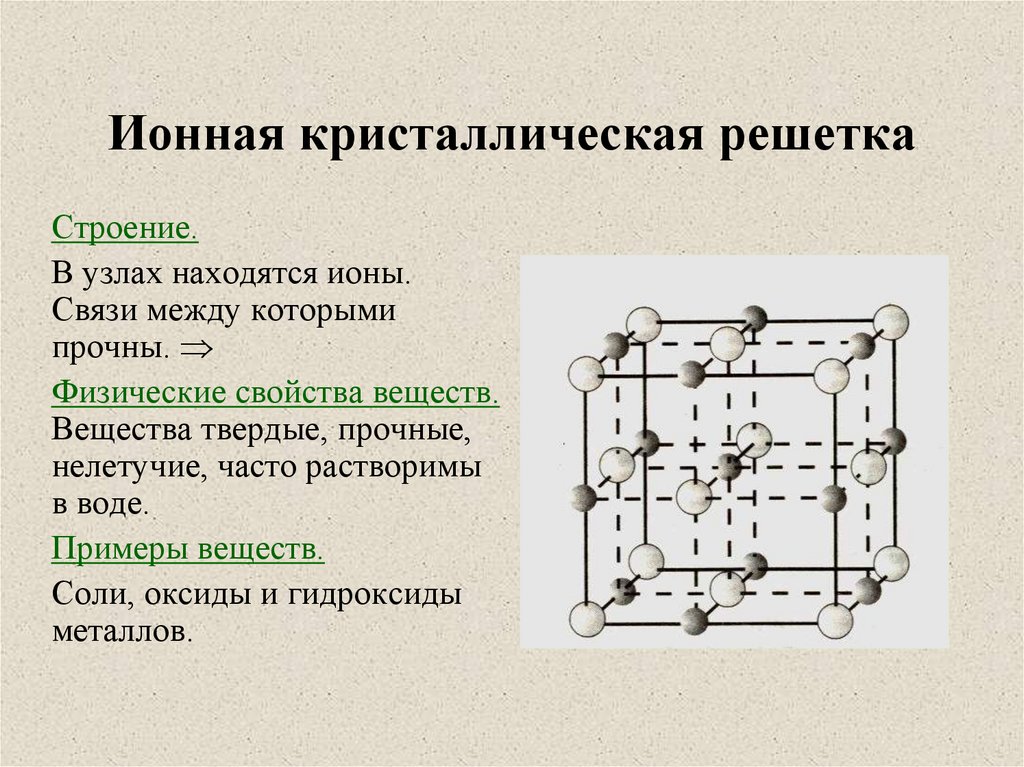
Внешняя форма и особенности внутреннего строения кристаллов определяются принципом плотной «упаковки»: наиболее устойчивой, а потому и наиболее вероятной структурой будет такая, которая соответствует наиболее плотному расположению частиц в кристалле и в которой остается наименьшее по объему свободное пространство.
В зависимости от природы частиц, содержащихся в узлах кристаллической решетки, а также от природы химических связей между ними, различаются четыре основных типа кристаллических решеток.
Ионные решетки
Ионные решетки построены из разноименных ионов, расположенных в узлах решетки и связанные силами электростатического притяжения. Поэтому структура ионной кристаллической решетки должна обеспечить ее электронейтральность. Ионы могут быть простыми (Na+, Cl—) или сложными (NH4+, NO3—). Вследствие ненасыщенности и ненаправленности ионной связи ионные кристаллы характеризуются большими координационными числами. Так, в кристаллах NaCl координационные числа ионов Na+ и Cl— равна 6, а ионов Cs+ и Cl— в кристалле CsCl — 8, поскольку один ион Cs+ окружен восемью ионами Cl—, а каждый ион — Cl — соответственно восемью ионами Cs+. Ионные кристаллические решетки образуются большим количеством солей, оксидов и оснований.
Так, в кристаллах NaCl координационные числа ионов Na+ и Cl— равна 6, а ионов Cs+ и Cl— в кристалле CsCl — 8, поскольку один ион Cs+ окружен восемью ионами Cl—, а каждый ион — Cl — соответственно восемью ионами Cs+. Ионные кристаллические решетки образуются большим количеством солей, оксидов и оснований.
Вещества с ионными кристаллическими решетками имеют сравнительно высокую твердость, они достаточно тугоплавкие, нелетучие. В отличие от металлов ионные соединения очень хрупкие, поэтому даже небольшой сдвиг в кристаллической решетке приближает друг к другу одноименно заряженные ионы, отталкивания между которыми приводит к разрыву ионных связей и как следствие — к появлению в кристалле трещин или к его разрушению. В твердом состоянии вещества с ионной кристаллической решеткой относятся к диэлектрикам и не проводят электрический ток. Однако при расплавлении или растворении в полярных растворителях нарушается геометрически правильная ориентировка ионов относительно друг друга, сначала ослабляются, а затем разрушаются химические связи, поэтому меняются и свойства..jpg) Как следствие, электрический ток начинают проводить как расплавы ионных кристаллов, так и их растворы.
Как следствие, электрический ток начинают проводить как расплавы ионных кристаллов, так и их растворы.
Атомные решетки
Эти решетки построены из атомов, соединенных между собой ковалентной связью. Они, в свою очередь, делятся на три типа: каркасные, слоистые и цепочечные структуры.
Каркасную структуру имеет, например, алмаз — одно из самых твердых веществ. Благодаря sp3 -гибридизации атома углерода строится трехмерная решетка, которая состоит исключительно из атомов углерода, соединенных ковалентными неполярными связями, оси которых размещаются под одинаковыми валентными углами (109,5o).
Каркасная структура атомной кристаллической решетки алмазаСлоистые структуры можно рассматривать как огромные двумерные молекулы. Для слоистых структур присущи ковалентные связи внутри каждого слоя и слабое вандерваальсовское взаимодействие между соседними слоями.
Слоистые структуры атомных кристаллических решеток: а) CuCl2 ; б) PbO.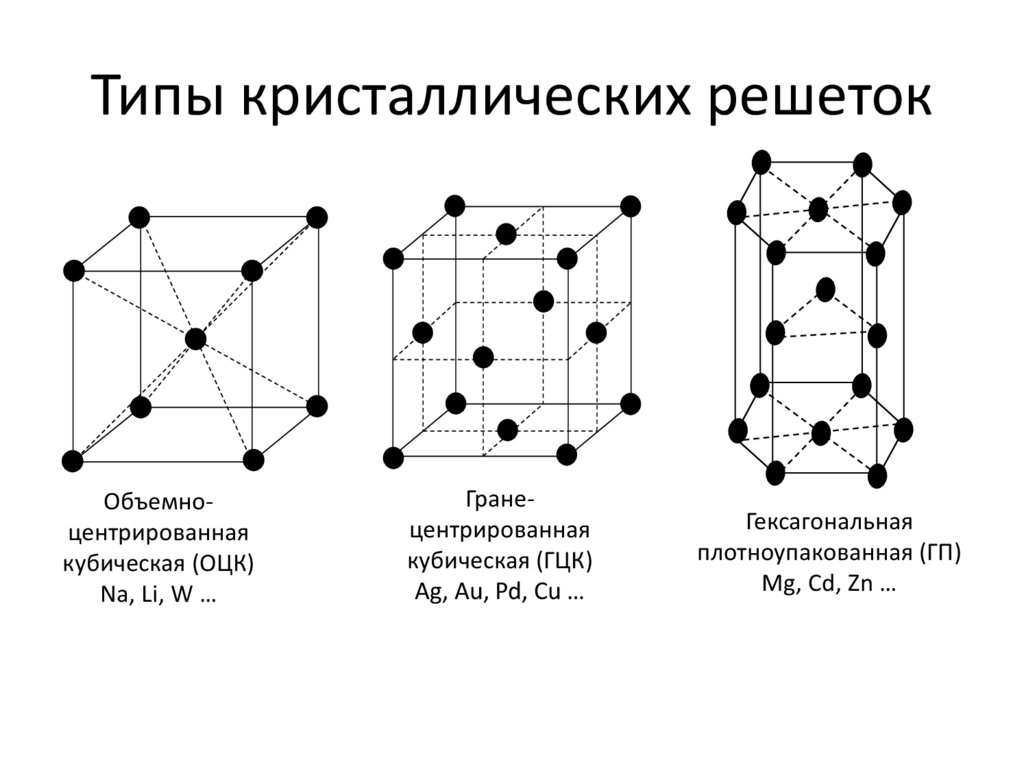 На моделях с помощью очертаний параллелепипедов выделены элементарные ячейки
На моделях с помощью очертаний параллелепипедов выделены элементарные ячейкиКлассическим примером вещества со слоистой структурой является графит, в котором каждый атом углерода находится в состоянии sp2 -гибридизации и образует в одной плоскости три ковалентные s-связи с тремя другими атомами С. Четвертые валентные электроны каждого атома углерода являются негибридизированными, за их счет образуются очень слабые вандерваальсовские связи между слоями. Поэтому при приложении даже небольшого усилия, отдельные слои легко начинают скользить друг вдоль друга. Этим объясняется, например, свойство графита писать. В отличие от алмаза графит хорошо проводит электричество: под воздействием электрического поля нелокализованные электроны могут перемещаться вдоль плоскости слоев, и, наоборот, в перпендикулярном направлении графит почти не проводит электрического тока.
Слоистая структура атомной кристаллической решетки графита
Цепочечные структуры характерны, например, для оксида серы (SO3)n , киновари HgS, хлорида бериллия BeCl2, а также для многих аморфных полимеров и для некоторых силикатных материалов, таких, как асбест.
Веществ с атомной строением кристаллических решеток сравнительно немного. Это, как правило, простые вещества, образованные элементами IIIА- и IVA-подгрупп (Si, Ge, B, C). Нередко соединения двух разных неметаллов имеют атомные решетки, например, некоторые полиморфные модификации кварца (оксид кремния SiO2 ) и карборунда (карбид кремния SiC).
Все атомные кристаллы отличаются высокой прочностью, твердостью, тугоплавкостью и нерастворимостью практически ни в одном растворителе. Такие свойства обусловлены прочностью ковалентной связи. Вещества с атомной кристаллической решеткой имеют широкий диапазон электрической проводимости от изоляторов и полупроводников до электронных проводников.
Атомные кристаллические решетки некоторых полиморфных модификации карборунда — карбида кремния SiCМеталлические решетки
Эти кристаллические решетки содержат в узлах атомы и ионы металлов, между которыми свободно движутся общие для них всех электроны (электронный газ), которые образуют металлическую связь. Особенность кристаллических решеток металлов заключается в больших координационных числах (8-12), которые свидетельствуют о значительной плотность упаковки атомов металлов. Это объясняется тем, что «остовы» атомов, лишены внешних электронов, размещаются в пространстве как шарики одинакового радиуса. Для металлов чаще всего встречаются три типа кристаллических решеток: кубическая гранецентрированная с координационным числом 12 кубическая объемноцентрированная с координационным числом 8 и гексагональная, плотной упаковки с координационным числом 12.
Особенность кристаллических решеток металлов заключается в больших координационных числах (8-12), которые свидетельствуют о значительной плотность упаковки атомов металлов. Это объясняется тем, что «остовы» атомов, лишены внешних электронов, размещаются в пространстве как шарики одинакового радиуса. Для металлов чаще всего встречаются три типа кристаллических решеток: кубическая гранецентрированная с координационным числом 12 кубическая объемноцентрированная с координационным числом 8 и гексагональная, плотной упаковки с координационным числом 12.
Особые характеристики металлического связи и металлических решеток обусловливают такие важнейшие свойства металлов, как высокие температуры плавления, электро- и теплопроводность, ковкость, пластичность, твердость.
Металлические кристаллические решетки: а) кубическая объемноцентрированная (Fe, V, Nb, Cr) б) кубическая гранецентрированная (Al, Ni, Ag, Cu, Au) в) гексагональная (Ti, Zn, Mg, Cd)Молекулярные решетки
Молекулярные кристаллические решетки содержат в узлах молекулы, соединенные между собой слабыми межмолекулярными силами — вандерваальсовскими или водородными связями. Например, лед состоит из молекул воды, удерживающихся в кристаллической решетке водородными связями. К тому же типу относятся кристаллические решетки многих веществ, переведенных в твердое состояние, например: простые вещества Н2, О2, N2, O3, P4, S8, галогены (F2, Cl2, Br2, I2), «сухой лед» СО2, все благородные газы и большинство органических соединений.
Например, лед состоит из молекул воды, удерживающихся в кристаллической решетке водородными связями. К тому же типу относятся кристаллические решетки многих веществ, переведенных в твердое состояние, например: простые вещества Н2, О2, N2, O3, P4, S8, галогены (F2, Cl2, Br2, I2), «сухой лед» СО2, все благородные газы и большинство органических соединений.
Поскольку силы межмолекулярного взаимодействия слабее, чем силы ковалентной или металлической связи, молекулярные кристаллы имеют небольшую твердость; они легкоплавкие и летучие, нерастворимые в воде и не проявляют электропроводности.
Глава 1. Кристаллическое строение и свойства металлов
Характерные
свойства металлов, например высокие
прочность, пластичность,
электро- и теплопроводность и другие,
обусловлены их строением на межатомном
и внутриатомном уровнях.
Металлы
являются телами кристаллическими. Это
означает, что атомы в занимаемом
ими пространстве расположены строго
упорядоченно, находясь в
определенных местах на вполне определенных
расстояниях друг от друга. При этом
атомы не перемещаются друг относительно
друга, т. е. они имеют постоянных соседей.
Находясь на своих местах, атомы вследствие
термокинетического
эффекта совершают колебания частотой
10
В ряде случаев под влиянием локальных тепловых процессов атомы кристаллических тел все же могут перемещаться между соседями в другие положения. Такие перемещения составляют суть явления, называемого диффузией. Диффузия однородных атомов между соседями называется самодиффузией.
Таким образом, сущность кристаллического строения металлов заключается в упорядоченном расположении в них атомов друг относительно друга.
Если
соединить атомы воображаемыми линиями
в трех взаимно перпендикулярных
направлениях, то получится пространственная
кристаллическая решетка. Ее наименьшим
структурным образованием является
элементарная ячейка,
контур которой представляет какое-нибудь
составленное из атомов геометрическое
тело, например куб или шестигранную
призму. Ячейки, примыкая
друг к другу и многократно повторяясь,
образуют более крупные образования —
зерна или кристаллиты.
Ее наименьшим
структурным образованием является
элементарная ячейка,
контур которой представляет какое-нибудь
составленное из атомов геометрическое
тело, например куб или шестигранную
призму. Ячейки, примыкая
друг к другу и многократно повторяясь,
образуют более крупные образования —
зерна или кристаллиты.
Ориентировка ячеек в соседних зернах металла различна, а в пределах каждого зерна одинакова. Поэтому в кристаллической решетке зерен существует ближний и дальний порядок. Ближний означает постоянство ближних атомов-соседей у каждого атома, а дальний — удаленных.
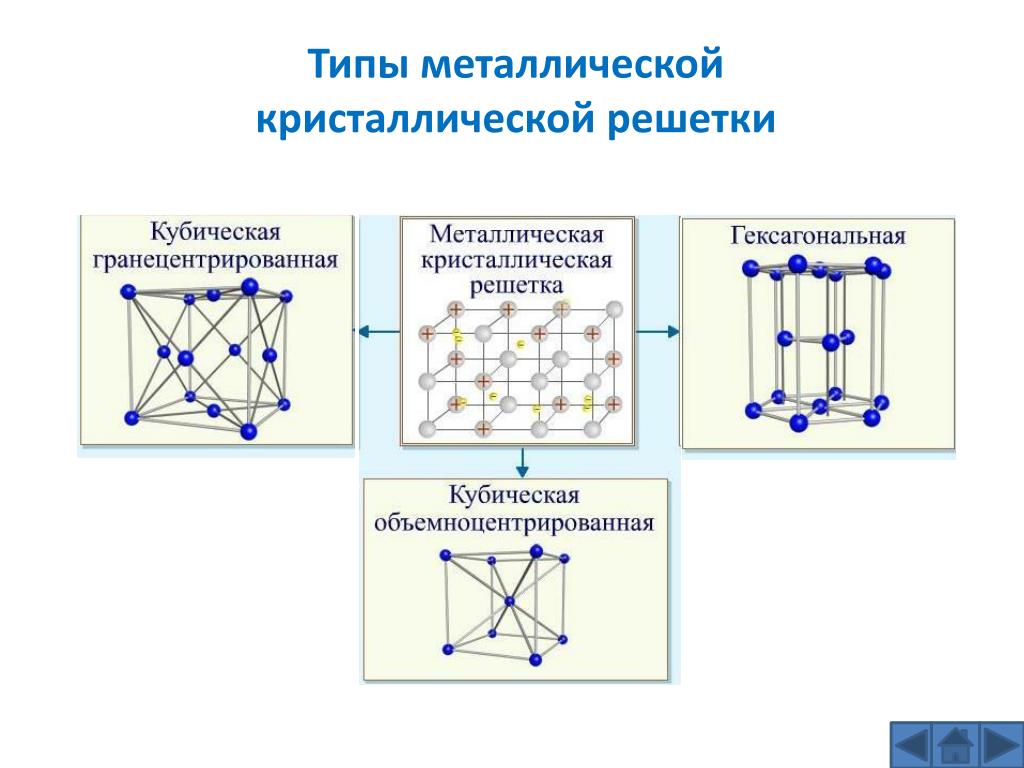
Наиболее
простой кристаллической решеткой у
металлов является кубическая,
имеющая две разновидности: кубическую
объемно-центрированную
(ОЦК) и кубическую гранецентрированную
(ГЦК) (рис. 1.1, а, б). У
обоих типов этих решеток основу ячеек
составляют восемь атомов, образующих
куб и находящихся в его вершинах.
Остальные атомы находятся
или в центре объема куба (один атом на
пересечении диагоналей в решетке
ОЦК), или в центре каждой из его граней
(шесть атомов в решетке
ГЦК). Кристаллические решетки ОЦК имеют
альфа-железо, хром, ванадий,
вольфрам, молибден, бета-титан и другие
металлы. Решетку ГЦК
имеют гамма-железо, алюминий, медь,
никель, свинец и некоторые другие
металлы.
Кристаллические решетки ОЦК имеют
альфа-железо, хром, ванадий,
вольфрам, молибден, бета-титан и другие
металлы. Решетку ГЦК
имеют гамма-железо, алюминий, медь,
никель, свинец и некоторые другие
металлы.
Другой разновидностью кристаллических решеток у металлов является гексагональная плотноупакованная решетка (ГПУ) (рис. 1.1, в). Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. ГПУ решетку имеют альфа-титан, магний, цинк, кадмий, бериллий и другие металлы.
В ячейках кристаллической решетки всех типов атомы касаются друг друга внешними слоями электронных оболочек. Межатомные силы сцепления, обеспечивающие морфологическую целостность кристаллической решетки, создаются электромагнитным взаимодействием, обусловленным наличием у атомов валентных электронов.
У
металлов, находящихся в твердом состоянии,
валентные электроны, освобождаясь
от своих атомов, движутся между атомами,
которые становятся
положительно заряженными ионами. Принадлежащие всему зерну и образующие
электронный «газ» свободные электроны,
взаимодействуя с положительными
ионами, обеспечивают целостность
кристаллической решетки. Такая
межатомная связь в кристаллической
решетке получила название металлической. Она может
существовать как между одноименными
атомами в чистых металлах, так и между
разнородными — в сплавах.
Принадлежащие всему зерну и образующие
электронный «газ» свободные электроны,
взаимодействуя с положительными
ионами, обеспечивают целостность
кристаллической решетки. Такая
межатомная связь в кристаллической
решетке получила название металлической. Она может
существовать как между одноименными
атомами в чистых металлах, так и между
разнородными — в сплавах.
Прочность металла зависит от плотности упаковки era кристаллической решетки и особенностей строения его атомов (особенно валентного и подвалентного слоев электронной оболочки).
Плотность упаковки решетки, главным образом, определяется числом атомов, приходящихся на одну ячейку решетки, и расстоянием между ними (например, у ОЦК два атома на ячейку, а у ГЦК — четыре).
Наиболее
характерным расстоянием является
параметр решетки, который равен расстоянию
между ближайшими атомами, составляющими
грань кристаллической
ячейки (см. рис. 1.1,
а, б, в). У ОЦК
и ГЦК решеток этот параметр
одинаков по всем трем направлениям в
пространстве, а у ГПУ — . Параметры
кристаллических решеток металлов
составляют от 0,2 до 0,7 нм (1нм
= м).
У ОЦК
и ГЦК решеток этот параметр
одинаков по всем трем направлениям в
пространстве, а у ГПУ — . Параметры
кристаллических решеток металлов
составляют от 0,2 до 0,7 нм (1нм
= м).
Следует помнить, что сила взаимодействия между атомами уменьшается из-за их тепловых колебаний. Результирующая сила взаимодействия тем меньше, чем выше температура.
Металлическая химическая связь – характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Содержание
- Схема образования металлической связи на примерах
- Характерные кристаллические решетки
- Физические свойства металлической связи
- Сходства и отличия металлической химической связи от ионной
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Me — ne⁻ ⇆ Me,
здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность — большинство металлов можно гнуть и ковать.

Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
 Каркас металлической решетки формируют исключительно катионы.
Каркас металлической решетки формируют исключительно катионы.Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Предыдущая
ХимияБензол – характеристика вещества, химические и физические свойства
Следующая
ХимияХимический элемент йод – формула, строение и свойства
понятие, виды, основные характеристики :: SYL.
 ru
ru
Белый – лучший выбор: какие цвета заставят выглядеть наряд женщины за 50 дороже
Бульон поможет превратить картофельное пюре в шедевр
Футболки с рукавами ¾: одежда, визуально уменьшающая широкую спину
Юлия Высоцкая рассказала об использовании необычных косметологических процедур
Поливаем обильно. Осенняя подкормка для увеличения плодородия почвы
Как вписать в сезонный образ главный принт осени – гусиные лапки: стильные фишки
Кексик с кабачком. Готовим выпечку с кокосом и лаймом
Положительное восприятие: почему именно принт в горох самый привлекательный
Как вписать в комфортный осенний образ балетки – хит этого сезона
Яркие пятна на чистом лице: тренд обещает стать главным в этом сезоне
Автор Ольга Иванова
Металлы и их значение для человеческой цивилизации
С древнейших времен металлы играют огромную роль в развитии человечества. Внедрение их в повседневную жизнь произвело настоящую революцию как в способах обработки материалов, так и в восприятии человеком окружающей действительности. Современная промышленность и сельское хозяйство, транспорт и инфраструктура невозможны без применения металлов, использования их полезных качеств и свойств. Эти качества, в свою очередь, определяются внутренней структурой данного класса химических соединений, в основе которой лежит кристаллическая решетка.
Внедрение их в повседневную жизнь произвело настоящую революцию как в способах обработки материалов, так и в восприятии человеком окружающей действительности. Современная промышленность и сельское хозяйство, транспорт и инфраструктура невозможны без применения металлов, использования их полезных качеств и свойств. Эти качества, в свою очередь, определяются внутренней структурой данного класса химических соединений, в основе которой лежит кристаллическая решетка.
Понятие и сущность кристаллической решетки
С точки зрения внутреннего устройства любое вещество может находиться в одном из трех состояний – жидком, газообразном и твердом. При этом именно последнее характеризуется наибольшей устойчивостью, что обусловлено тем, что кристаллическая решетка подразумевает не только четкое расположение атомов или молекул в строго определенных местах, но и необходимость приложения достаточно большой силы, чтобы связи между этими элементарными частицами разорвать.
Особенности ионной решетки
Структура любого вещества, находящегося в твердом состоянии, обязательно предполагает периодическую повторяемость молекул и атомов сразу в трех измерениях. При этом в зависимости от того, что находится в узловых пунктах, кристаллическая решетка может быть ионной, атомной, молекулярной и металлической. Что касается первой разновидности, то здесь базовыми компонентами служат разнополярно заряженные ионы, между которыми возникают и действуют так называемые кулоновские силы. При этом сила взаимодействия находится в прямой зависимости от радиусов заряженных частиц.
При этом в зависимости от того, что находится в узловых пунктах, кристаллическая решетка может быть ионной, атомной, молекулярной и металлической. Что касается первой разновидности, то здесь базовыми компонентами служат разнополярно заряженные ионы, между которыми возникают и действуют так называемые кулоновские силы. При этом сила взаимодействия находится в прямой зависимости от радиусов заряженных частиц.
Металлическая кристаллическая решетка
Такая решетка представляет собой сложную систему, состоящую из катионов металла, в пространстве между которыми перемещаются отрицательно заряженные электроны. Именно наличие этих элементарных частиц придает решетке устойчивость и твердость, ибо они служат своеобразными компенсаторами для положительно заряженных катионов.
Сила и слабость атомной решетки
Достаточно интересной с точки зрения строения является атомная кристаллическая решетка. Уже из названия можно сделать вывод, что в ее узлах располагаются атомы, удерживающиеся за счет ковалентных связей. Многие ученые в последние годы относят данный тип взаимодействия к семейству неорганических полимеров, так как строение данной молекулы во многом определяется валентностью входящих в ее состав атомов.
Многие ученые в последние годы относят данный тип взаимодействия к семейству неорганических полимеров, так как строение данной молекулы во многом определяется валентностью входящих в ее состав атомов.
Основные характеристики молекулярной решетки
Молекулярная кристаллическая решетка является наименее устойчивой из всех представленных. Все дело в том, что уровень взаимодействия находящихся в ее узлах молекул крайне низкий, а энергетический потенциал определяется целым рядом факторов, основную роль в которых играют дисперсионные, индукционные и ориентационные силы.
Влияние кристаллической решетки на свойства объектов
Таким образом, кристаллическая решетка во многом определяет свойства того или иного вещества. Например, атомные кристаллы плавятся при чрезвычайно высокой температуре и обладают повышенной твердостью, а вещества с металлической решеткой являются прекрасными проводниками электрического тока.
Похожие статьи
- Типы кристаллических решеток.
 Типы кристаллических решеток металлов
Типы кристаллических решеток металлов - Что такое легированная сталь – состав, свойства, марки, ГОСТ, назначение, обработка
- Кристаллические и аморфные тела: строение и свойства
- Химические и физические свойства неметаллов
- Основные механические свойства твердых тел
- Строение газообразных, жидких и твердых тел кратко
- Чем металлы отличаются от неметаллов – особенности, свойства и характеристики
Также читайте
Цель | сформировать понятие о кристаллическом и аморфном состоянии твёрдых тел, кристаллической решётке; познакомить с типами кристаллических решёток, их взаимосвязи с видами химической связи и их влиянием на физические свойства веществ. | ||||||||||||||||||||||||||||
Тип урока | урок открытия новых знаний | ||||||||||||||||||||||||||||
Методы обучения | Частично-поисковый, проблемный | ||||||||||||||||||||||||||||
Формы обучения | Индивидуальная, групповая, индивидуальная | ||||||||||||||||||||||||||||
Основные понятия | Аморфные, кристаллические вещества, кристаллическая решетка, виды кристаллических решеток: молекулярная, атомная, металлическая, ионная. | ||||||||||||||||||||||||||||
Образовательные ресурсы | Учебник «Химия»; О. | ||||||||||||||||||||||||||||
Планируемые образовательные результаты | |||||||||||||||||||||||||||||
Предметные | Метапредметные | Личностные | |||||||||||||||||||||||||||
Знать: определения изученных понятий: «аморфные вещества», «кристаллические вещества», «кристаллическая решетка», «ионная кристаллическая решётка», «атомная кристаллическая решётка», «молекулярная кристаллическая решётка», «металлическая кристаллическая решётка» Уметь: устанавливать причинно-следственные связи между строением атома, химической связью и типом кристаллической решётки химических соединений; характеризовать атомные, молекулярные, ионные и металлические кристаллические решётки; характеризовать свойства веществ с атомной, ионной, металлической и молекулярной кристаллическими решётками; приводить примеры веществ с разными типами кристаллической решётки | Познавательные – использовать знаково-символические средства для решения задач; создавать обобщения, устанавливать аналогии, осуществлять классификацию, делать выводы; проводить наблюдение; моделировать объекты; составлять на основе текста таблицы, в том числе с применением средств ИКТ. Регулятивные – формулировать цель урока и ставить задачи, необходимые для её достижения; планировать свою деятельность и прогнозировать её результаты; работать по плану, сверять свои действия с целью и, при необходимости, корректировать ошибки самостоятельно; оформлять отчёт с описанием эксперимента, его результатов и выводов. Коммуникативные – строить речевые высказывания в устной форме; выражать и аргументировать свою точку зрения; сотрудничество учащихся между собой, работа в группах; взаимоконтроль, умение слышать, слушать и понимать партнера, планировать учебное сотрудничество с учителем и сверстниками. | Личностные – формирование умения грамотного обращения с веществами в химической лаборатории и в быту; понимание значимости естественно-научных знаний в повседневной жизни, технике, медицине, для решения практических задач; формирование целостного мировоззрения, соответствующее современному уровню развития науки и общественной практики. | |||||||||||||||||||||||||||
№ п/п | Этап урока | Деятельность учителя | Деятельность учащихся | Результат или формируемые способы деятельности | Продолжительность этапа | ||||||||||||||||||||||||
1 | Организационный этап | Приветствие. Создает благоприятную эмоциональную атмосферу, проверяет готовность к уроку | Подготовка класса к работе | Личностные (смыслообразование) Регулятивные (оценка, саморегуляция) | 1 мин. | ||||||||||||||||||||||||
2 | Постановка цели и задач урока. Мотивация учебной деятельности учащихся | Ведет эвристический диалог и организует деятельность учеников по определению цели урока и её достижения. Какие области применения кристаллов вы можете назвать? Как вы думаете, почему кристаллы применяются по-разному? Почему у кристаллов разные свойства? Вопрос: Какие цели вы поставили бы перед собой при изучении данного вопроса, что нам необходимо узнать? По итогам беседы учитель и ученики совместно формулируют цель урока: «Изучить типы кристаллических решёток» Цели урока, после ответов учащихся (показ слайдов презентации) | Включаются в эвристический диалог. Совместно определяют тему и цель урока. | Личностные (смыслообразование) Познавательные (постановка и решение проблемы, логические универсальные действия) Регулятивные (прогнозирование) | 5 мин. | ||||||||||||||||||||||||
3 | Актуализация знаний | Организует деятельность учащихся по определению связи изученного ранее на уроках физики и химии с новой темой Группа 1, 2 Обсудите в группах, от чего зависит агрегатное состояние воды, и составьте кластер. Группа 3,4 Обсудите в группах, от чего зависит одинаковое агрегатное состояние железа, поваренной соли, кварцевого песка, и составьте кластер. «Кристаллические вещества имеют чёткую температуру плавления и, главное, характеризуются правильным расположением частиц в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки. Типы кристаллических решеток зависят от частиц, которые расположены в узлах кристаллической решетки». (3,4,5,6) | Отвечает на вопросы учителя, работая в группе. Записывают определения основных понятий по теме урока | познавательные: умение структурировать знания; общеучебные: поиск и выделение необходимой информации, применение методов информационного поиска; смысловое чтение и выбор чтения в зависимости от цели; логические: построение логической цепи рассуждений, анализ, синтез коммуникативные: умение выражать свои мысли, осуществляют контроль, коррекцию и оценку своих действий; регулятивные: самостоятельно анализируют условия достижения цели на основе учета выделенных учителем ориентиров действия Личностные (смыслообразование, формирование у учащихся бережного отношения к своему здоровью) | 10 мин. | ||||||||||||||||||||||||
4 | Первичное усвоение новых знаний Физминутка | Организует учащихся на выполнение практической работы, координирует работу в группах, предлагает планы работы групп. Лабораторная работа Используйте учебник Подготовьте рассказ о кристаллической решетке выданного вещества 1 группа Цель: познакомиться с типами кристаллических решеток. 1. Какие кристаллические решетки называются ионными? 2. Исследуйте макет кристаллической решетки хлорида натрия. 3. Заполните таблицу №1 4. Сделайте вывод, какими свойствами обладают вещества с ионной кристаллической решеткой. 5. Какие вещества имеют ионную кристаллическую решетку? 2 группа Цель: познакомиться с типами кристаллических решеток. 1. Какие кристаллические решетки называются атомными? 2. 3. Заполните таблицу №1 4. Сделайте вывод, какими свойствами обладают вещества с атомной кристаллической решеткой. 5. Какие вещества имеют атомную кристаллическую решетку? 3 группа Цель: познакомиться с типами кристаллических решеток. 1. Какие кристаллические решетки называются металлическими? 2. Исследуйте макет кристаллической решетки железа. 3. Заполните таблицу №1 4. Сделайте вывод, какими свойствами обладают вещества с металлической кристаллической решеткой. 5. Какие вещества имеют металлическую кристаллическую решетку? 4 группа Цель: познакомиться с типами кристаллических решеток. 1. Какие кристаллические решетки называются молекулярными? 2. Исследуйте макет кристаллической решетки воды. 3. Заполните таблицу №1 4. Сделайте вывод, какими свойствами обладают вещества с молекулярной кристаллической решеткой. 5. Делает вывод. Показ слайдов (7-8-9-10-11) – Как вы думаете, влияет ли тип кристаллической решётки на физические свойства вещества? (Да) Повторяют движения используя тренажер для глаз Базарнова В.Ф. | Выполняют практическую работу в группе, делают выводы. Работают с учебником по предложенному плану, заполняют таблицу, делают вывод, составляют рассказ. В конце самостоятельной лабораторной работы внимательно слушают выступления представителей от каждой из 4 групп по одному из типов кристаллических решёток, остальные дополняют, корректируют ответы. Существует следующая закономерность: Если известно строение веществ, то можно предсказать их свойства или наоборот: если известны свойства веществ, то можно определить их строение. | 5 мин. | |||||||||||||||||||||||||
5 | Первичная проверка понимания | Организует деятельность учащихся по обсуждению результатов работы в группах | Представляют результаты выполненной работы (рассказ), слушают и заполняют таблицу в тетради. Сравнивают данные таблицы и устанавливают причинно-следственные связи | Познавательные (поиск и выделение необходимой информации и структурирование знаний, анализ объектов с целью выделения признаков, постановка и решение проблемы, логические универсальные действия) Коммуникативные (сотрудничество в поиске информации) Личностные (смыслообразование) | 5 мин. | ||||||||||||||||||||||||
6 | Первичное осмысление и закрепление изученного | Даёт тестовое задание по изученной теме. вариант 1 1. Вещества с атомной кристаллической решеткой 1) очень твердые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах 4) проводят электрический ток в расплавах 2. Молекулярное строение имеет 1) алмаз 2) азот 3) кремний 4) поваренная соль 3. 1) атомная 2) ионная 3) молекулярная 4) металлическая 4. Молекулярный тип кристаллической решетки реализуется в строении: 1) NaCl 2) SiO2 3) Н2О 4) Ba(NO3)2 5. Найти соответствие
вариант 2 1. Вещества с молекулярной кристаллической решеткой 1) очень твердые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах 4) проводят электрический ток в расплавах 2. 1) алмаз 2) азот 3) кремний 4) поваренная соль 3. У веществ с высокой теплопроводностью кристаллическая решетка 1) атомная 2) ионная 3) молекулярная 4) металлическая 4. Атомный тип кристаллической решетки реализуется в строении: 1) NaCl 2) SiO2 3) Н2О 4) Ba(NO3)2 5. Найти соответствие
Предлагает провести взаимоконтроль и оценить деятельность друг друга по данным критериям. Побуждает к высказыванию учащимися своего мнения о результатах урока. | Выполняют тест. Проводят взаимоконтроль и оценивают ответ одноклассника. Вариант1: 1)1, 2)2,3)3,4)3. 2 Задание :1-в,2-б,3-а,4-а Вариант 2 1)2, 2)4, 3)4, 4)2 2 задание: 1)а, 2)а3)б 4)в КРИТЕРИЙ ОЦЕНИВАНИЯ “5” – 7- 8 – правильных ответов; “4” –5- 6 правильных ответов; “3” –4- 3 правильных ответов; “2” – 2 и меньше правильных ответов Формулируют конечный результат своей работы на уроке. Определяют значимость урока для себя лично. | познавательные: общеучебные: умение структурировать знания; оценка процесса и результатов деятельности. коммуникативные умение выражать свои мысли. регулятивные: волевая саморегуляция; оценка – выделение и осознание обучающимися того, что уже усвоено, прогнозирование | 15 мин. | ||||||||||||||||||||||||
7 | Информация о домашнем задании, инструктаж по его выполнению | Предлагает разноуровневые домашние задания по выбору, 1 уровень (для всех): параграф 23 упр.1,4 ,5 2 уровень смоделировать кристаллическую решетку любого вещества; составить синквейн на тему «кристалл», «решётка» | записывают задание в дневник | Личностные (самоопределение) Регулятивные (оценка, саморегуляция) | 2 мин. | ||||||||||||||||||||||||
8 | Рефлексия (подведение итогов занятия) | предлагает заполнить таблицу:
просит обучающихся поделится впечатлениями об уроке: -что узнали нового интересного на уроке? – что произвело большее впечатление? | Делают выводы Осуществляют самооценку собственной деятельности | Познавательные (общеучебные универсальные действия, логические универсальные действия) Регулятивные (коррекция) Личностные (самоопределение) | 2 мин. | ||||||||||||||||||||||||
Тип решетки | Виды частиц в узлах решетки | Вид связи между частицам | Примеры веществ | Наиболее характерные физические свойства | Практическое значение физических свойств | ||||||||||||||||||||||||
Ионная | Ионы: катионы и анионы | Ионная | Соли, оксиды и гидроксиды типичных металлов | Тугоплавкие, нелетучие, твердые, многие хорошо растворимы в воде и проводят электрический ток в растворе и расплаве | Производство металлов методом электролиза из растворов или расплавов их солей | ||||||||||||||||||||||||
Атомная | Атомы | Ковалентная | Алмаз, кремний, бор, кварц (оксид кремния) | Твердые, нерастворимые, тугоплавкие, как вещества с ионной кристаллической решеткой, но часто в превосходной степени – очень твердые, очень прочные и т. | Изготовление режущих и сверлящих инструментов из данных веществ | ||||||||||||||||||||||||
Молекулярная | Молекулы | Между молекулами существуют слабые силы межмолекулярного притяжения, а вот внутри молекул-прочная ковалентная связь | При обычных условиях газы или жидкости, или твердые вещества с низкой температурой плавления: органические вещества (нафталин), вода, углекислый газ и др. | Легкоплавкие, летучие, в твердом виде хрупкие, способны к возгонке, имеют малую твердость | «Сухой лёд», нафталин | ||||||||||||||||||||||||
Металлическая | Атом-ионы | Металлическая | Металлы и сплавы | Ковкие, пластичные, тягучие, электро- и теплопроводные, имеют металлический блеск и т.д. | Изготовление изделий различной формы, электропроводников, нагревательных элементов и т. | ||||||||||||||||||||||||
6.4: Кристаллические структуры металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 183327
- Химия 310
- Penn State University via Wikibook
Кристаллическая природа металлов
Все металлические элементы (кроме Cs, Ga и Hg) при комнатной температуре представляют собой твердые кристаллические вещества. Подобно ионным твердым телам, металлы и сплавы имеют очень сильную тенденцию к кристаллизации, независимо от того, получены ли они термической обработкой или другими методами, такими как восстановление в растворе или гальваническое покрытие. Металлы легко кристаллизуются, и трудно получить стекловидный металл даже при очень быстром охлаждении. Расплавленные металлы имеют низкую вязкость, и одинаковые (по существу, сферические) атомы могут очень легко упаковываться в кристалл. Однако стеклообразные металлы можно получить путем быстрого охлаждения сплавов, особенно если составляющие их атомы имеют разные размеры. Различные атомы не могут упаковаться в простую элементарную ячейку, что иногда делает кристаллизацию достаточно медленной для образования стекла.
Расплавленные металлы имеют низкую вязкость, и одинаковые (по существу, сферические) атомы могут очень легко упаковываться в кристалл. Однако стеклообразные металлы можно получить путем быстрого охлаждения сплавов, особенно если составляющие их атомы имеют разные размеры. Различные атомы не могут упаковаться в простую элементарную ячейку, что иногда делает кристаллизацию достаточно медленной для образования стекла.
Кубический корпус |
ГПУ (слева) и ГЦК (справа) плотная упаковка сфер |
Кристаллические структуры
Большинство металлов и сплавов кристаллизуются в одной из трех очень распространенных структур: объемно-центрированной кубической (ОЦК), гексагональной плотноупакованной (ГПУ) или кубической плотноупакованной (ГЦК, также называемой гранецентрированной кубической, ГЦК) ). Во всех трех структурах координационное число атомов металла (т. е. число эквидистантных ближайших соседей) достаточно велико: 8 для ОЦК и 12 для ГПУ и ГПУ. Мы можем сравнить это с низкими координационными числами (то есть с низкими валентностями — например, 2 для O, 3 для N или 4 для C), обнаруженными у неметаллов. В ОЦК структуре ближайшие соседи находятся в углах куба, окружающего атом металла в центре. В ГПУ- и ПЦП-структурах атомы упаковываются подобно сложенным друг на друга пушечным ядрам или бильярдным шарам в слоях с шестикоординатным расположением. У каждого атома также есть еще шесть ближайших соседей из слоев выше и ниже. Последовательность укладки ABCABC… в решетке ccp и ABAB… в hcp. В обоих случаях можно показать, что сферы заполняют 74% объема решетки. Это наибольшая объемная доля, которой можно заполнить решетку из равных сфер.
Во всех трех структурах координационное число атомов металла (т. е. число эквидистантных ближайших соседей) достаточно велико: 8 для ОЦК и 12 для ГПУ и ГПУ. Мы можем сравнить это с низкими координационными числами (то есть с низкими валентностями — например, 2 для O, 3 для N или 4 для C), обнаруженными у неметаллов. В ОЦК структуре ближайшие соседи находятся в углах куба, окружающего атом металла в центре. В ГПУ- и ПЦП-структурах атомы упаковываются подобно сложенным друг на друга пушечным ядрам или бильярдным шарам в слоях с шестикоординатным расположением. У каждого атома также есть еще шесть ближайших соседей из слоев выше и ниже. Последовательность укладки ABCABC… в решетке ccp и ABAB… в hcp. В обоих случаях можно показать, что сферы заполняют 74% объема решетки. Это наибольшая объемная доля, которой можно заполнить решетку из равных сфер.
Атомы в металлических кристаллах имеют тенденцию собираться в плотные структуры, которые эффективно заполняют пространство. Простая квадратная упаковка (выше), на которой основана простая кубическая структура, неэффективна и поэтому редко встречается среди металлических кристаллических структур. Структуры, ориентированные на тело или лицо, заполняют пространство более эффективно и чаще.
Простая квадратная упаковка (выше), на которой основана простая кубическая структура, неэффективна и поэтому редко встречается среди металлических кристаллических структур. Структуры, ориентированные на тело или лицо, заполняют пространство более эффективно и чаще.
Периодические тенденции в структуре и поведении металлов
Вспомните, где мы находим металлические элементы в периодической таблице – везде, кроме правого верхнего угла. Это означает, что по мере того, как мы спускаемся по группе p-блока (скажем, группа IVA, группа углерода, или группа VA, группа азота), свойства элементов постепенно меняются от неметаллов к металлоидам и металлам. Углеродная группа прекрасно иллюстрирует этот переход. Начиная сверху, углерод имеет две стабильные аллотропные формы — графит и алмаз. В каждом из них валентность атомов углерода точно удовлетворяется за счет образования четырех электронных парных связей с соседними атомами. В графите у каждого атома углерода есть три ближайших соседа, поэтому имеется две одинарные связи и одна двойная связь. В алмазе есть четыре ближайших соседа, расположенных в вершинах тетраэдра, и поэтому с каждым из них связана одинарная связь.
В алмазе есть четыре ближайших соседа, расположенных в вершинах тетраэдра, и поэтому с каждым из них связана одинарная связь.
Два элемента, расположенные прямо под углеродом (кремний и германий) в периодической таблице, также имеют структуру алмаза (напомним, что эти элементы не могут легко образовывать двойные связи друг с другом, поэтому для Si или Ge не существует аллотропа графита). Хотя алмаз является хорошим изолятором, кремний и германий являются полупроводниками (то есть металлоидами). Механически они тверды, как алмаз. Подобно углероду, каждый атом Si и Ge удовлетворяет своей валентности, равной четырем, образуя одинарные связи с четырьмя ближайшими соседями.
Следующим элементом после германия является олово (Sn). Олово имеет две аллотропные формы: одну со структурой алмаза и одну со слегка искаженной ОЦК-структурой. Последний имеет металлические свойства (металлический блеск, ковкость) и проводимость примерно в 10 9 раз выше, чем Si. Наконец, свинец (Pb), элемент под Sn, имеет структуру ccp и также является металлическим. Обратите внимание на изменения координационного числа и проводящих свойств:
Обратите внимание на изменения координационного числа и проводящих свойств:
| Элемент | Структура | Координ. нет. | Проводимость |
|---|---|---|---|
| С | графит, алмаз | 3, 4 | полуметалл, изолятор |
| Си | алмаз | 4 | полупроводник |
| Ге | алмаз | 4 | полупроводник |
| Сн | алмаз, искаженный bcc | no.”> 4, 8 | полупроводник, металл |
| Пб | куб.см | 12 | металл |
Элементы C, Si и Ge подчиняются правилу октетов, и мы можем легко идентифицировать связи электронных пар в их структурах. Sn и Pb, с другой стороны, принимают структуры с высокими координационными числами. Они не имеют достаточного количества валентных электронов для создания электронных парных связей с каждым соседом (это общая черта металлов). В этом случае происходит то, что валентные электроны становятся «размазанными» или делокализованными по всем атомам в кристалле. Лучше всего думать о связи в металлах как о кристаллическом расположении положительно заряженных ядер с «морем» общих валентных электронов, склеивающих структуру. Поскольку электроны не локализованы в какой-либо конкретной связи между атомами, они могут двигаться в электрическом поле, поэтому металлы хорошо проводят электричество. Другой способ описать связь в металлах — ненаправленная. То есть ближайшие соседи атома окружают его во всех направлениях, а не в нескольких конкретных направлениях (как в углах тетраэдра, как мы обнаружили для алмаза). С другой стороны, неметаллы (изоляторы и полупроводники) имеют направленную связь. Поскольку связь является ненаправленной, а координационные числа высоки, относительно легко деформировать координационную сферу (т. Е. Разорвать или растянуть связи), чем в случае неметалла. Вот почему такие элементы, как Pb, гораздо более пластичны, чем C, Si или Ge.
Другой способ описать связь в металлах — ненаправленная. То есть ближайшие соседи атома окружают его во всех направлениях, а не в нескольких конкретных направлениях (как в углах тетраэдра, как мы обнаружили для алмаза). С другой стороны, неметаллы (изоляторы и полупроводники) имеют направленную связь. Поскольку связь является ненаправленной, а координационные числа высоки, относительно легко деформировать координационную сферу (т. Е. Разорвать или растянуть связи), чем в случае неметалла. Вот почему такие элементы, как Pb, гораздо более пластичны, чем C, Si или Ge.
Эта страница под названием 6.4: Кристаллические структуры металлов распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Chemistry 310 (Wikibook) посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами Платформа LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Химия 310 Студенты
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- source@https://en.wikibooks.org/wiki/Introduction_to_Inorganic_Chemistry
Решетчатые структуры в кристаллических твердых телах
Результаты обучения
- Описать расположение атомов и ионов в кристаллических структурах
- Вычисление ионных радиусов с использованием размеров элементарной ячейки
- Объясните использование рентгеновской дифракции для определения кристаллических структур
Более 90% природных и искусственных твердых тел являются кристаллическими. Большинство твердых тел образуются с регулярным расположением их частиц, потому что общее притяжение между частицами максимизируется, а общая межмолекулярная энергия минимизируется, когда частицы упаковываются наиболее эффективно. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне.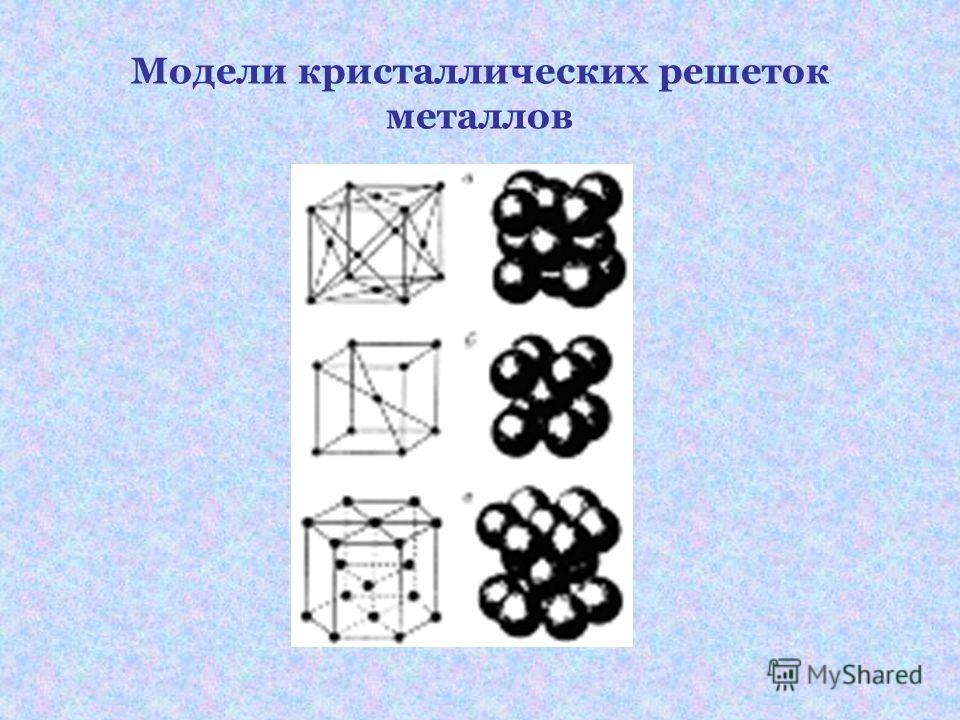 В этом модуле мы рассмотрим некоторые детали структуры металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
В этом модуле мы рассмотрим некоторые детали структуры металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Структуры металлов
Мы начнем обсуждение кристаллических тел с рассмотрения элементарных металлов, относительно простых, поскольку каждый из них содержит только один тип атома. Чистый металл представляет собой кристаллическое твердое вещество, в котором атомы металла плотно упакованы в повторяющуюся структуру. Некоторые свойства металлов в целом, такие как их ковкость и пластичность, в значительной степени обусловлены наличием одинаковых атомов, расположенных в регулярном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения. В следующих разделах мы рассмотрим сходства и различия четырех наиболее распространенных геометрических форм кристаллов металлов.
Элементарные ячейки металлов
Структуру кристаллического твердого тела, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая называется элементарной ячейкой . Элементарная ячейка состоит из точек решетки, которые представляют собой расположение атомов или ионов. Затем вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Элементарная ячейка состоит из точек решетки, которые представляют собой расположение атомов или ионов. Затем вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Рисунок 1. Элементарная ячейка показывает расположение точек решетки, повторяющихся во всех направлениях.
Начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Самый простой способ сделать это — создать слои, в которых сферы в одном слое находятся непосредственно над сферами в нижнем слое, как показано на рисунке 2. Такое расположение называется простой кубической структурой 90 240 9.0241 , а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.
Рисунок 2. Когда атомы металла расположены в виде сфер в одном слое непосредственно над или под сферами в другом слое, структура решетки называется простой кубической. Обратите внимание, что сферы соприкасаются.
В простой кубической структуре сферы не упакованы так плотно, как могли бы быть, и они «заполняют» только около 52% объема контейнера. Это относительно неэффективная схема, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано на Рисунке 3, твердое тело с таким типом расположения состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом непосредственно над ним в слое выше; и один атом непосредственно под ним в слое ниже. Количество других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, называется ее 9.0240 координационный номер . Таким образом, для атома полония в простой кубической матрице координационное число равно шести.
Рисунок 3. Атом в простой кубической решетке контактирует с шестью другими атомами, поэтому его координационное число равно шести.
В простой кубической решетке элементарная ячейка, которая повторяется во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано на рисунке 4. Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина ребра эта ячейка равна двум атомным радиусам или одному атомному диаметру. Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся внутри нее. Поскольку атом в углу простой кубической элементарной ячейки содержится всего в восьми элементарных ячейках, только одна восьмая часть этого атома находится внутри конкретной элементарной ячейки. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из своих восьми «углов», в одной простой кубической элементарной ячейке имеется [латекс]8 \times \frac{1}{8}=1[/латекс] атома.
Рисунок 4. Элементарная ячейка простой кубической решетки содержит одну восьмую атома в каждом из восьми углов, поэтому всего она содержит один атом.
Пример 1:
Расчет атомного радиуса и плотности металлов, часть 1Длина ребра элементарной ячейки альфа-полония составляет 336 пм.
- Определите радиус атома полония.
- Определить плотность альфа-полония.
Показать раствор
Проверьте свои знания
Длина ребра элементарной ячейки для никеля 0,3524 нм. Плотность никеля 8,90 г/см 3 . Кристаллизуется ли никель в виде простой кубической структуры? Объяснять.
Показать решение
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек. Сейчас мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которую мы уже видели), объемно-центрированной кубической элементарной ячейке и гранецентрированной кубической элементарной ячейке — все они показаны на рисунке 5. (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек. Более сложные геометрии мы оставляем в этом модуле позже.)
(Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек. Более сложные геометрии мы оставляем в этом модуле позже.)
Рисунок 5. Кубические элементарные ячейки металлов показывают (на верхних рисунках) расположение узлов решетки и (на нижних рисунках) атомы металла, находящиеся в элементарной ячейке.
Некоторые металлы кристаллизуются в виде кубической элементарной ячейки с атомами во всех углах и атомом в центре, как показано на рисунке 6. Это называется объемно-центрированным кубическим (ОЦК) телом . Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре. Элементарная ячейка ОЦК содержит два атома: одну восьмую атома в каждом из восьми углов ([латекс]8\times \frac{1}{8}=1[/латекс] атом из углов) плюс один атом из центр. Любой атом в этой структуре касается четырех атомов в слое над ним и четырех атомов в слое под ним. Таким образом, атом в ОЦК-структуре имеет координационное число восемь.
Таким образом, атом в ОЦК-структуре имеет координационное число восемь.
Рисунок 6. В объемно-центрированной кубической структуре атомы в определенном слое не соприкасаются друг с другом. Каждый атом касается четырех атомов в слое над ним и четырех атомов в слое под ним.
Атомы в ОЦК упакованы намного эффективнее, чем в простой кубической структуре, занимая около 68% всего объема. Изоморфные металлы со структурой ОЦК включают K, Ba, Cr, Mo, W и Fe при комнатной температуре. (Элементы или соединения, которые кристаллизуются с одинаковой структурой, называются изоморфный .)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в виде кубической элементарной ячейки с атомами во всех углах и в центрах каждой грани, как показано на рисунке 7. Это расположение называется гранецентрированным кубическим (ГЦК) телом . Элементарная ячейка ГЦК содержит четыре атома: одну восьмую часть атома в каждом из восьми углов ([латекс]8\times \frac{1}{8}=1[/латекс] атом из углов) и половину атома на каждой из шести граней ([латекс]6\times \frac{1}{2}=3[/латекс] атома с граней). Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в одинаковых точках решетки, они имеют одинаковое окружение.
Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в одинаковых точках решетки, они имеют одинаковое окружение.
Рисунок 7. Гранецентрированное кубическое твердое тело имеет атомы в углах и, как следует из названия, в центрах граней его элементарных ячеек.
Атомы в схеме ГЦК упакованы как можно плотнее, при этом атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковкой (CCP) . В CCP есть три повторяющихся слоя шестиугольно расположенных атомов. Каждый атом контактирует с шестью атомами в своем слое, с тремя в верхнем слое и с тремя в нижнем слое. В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12. Тот факт, что расположения FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле имеют одну и ту же структуру, показано на рисунке 8.
Рисунок 8. Расположение CCP состоит из трех повторяющихся слоев (ABCABC…) шестиугольно расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже. Повернув нашу перспективу, мы можем увидеть, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине грани) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированная кубическая компоновка.
Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже. Повернув нашу перспективу, мы можем увидеть, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине грани) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированная кубическая компоновка.
Поскольку более плотная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом. Мы обнаруживаем два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональная плотнейшая упаковка (HCP) , показанная на рисунке 9. Оба состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (В) помещается на первый слой (А), так что каждый атом во втором слое находится в контакте с тремя атомами в первом слое. Третий слой расположен одним из двух способов. В ГПУ атомы в третьем слое находятся непосредственно над атомами в первом слое (т. е. третий слой также относится к типу А), а укладка состоит из чередующихся плотноупакованных слоев типа А и типа В (т. е. ABABAB⋯). В CCP атомы в третьем слое не выше атомов ни в одном из первых двух слоев (т. е. третий слой относится к типу C), а укладка состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т. е. ABCABCABC⋯). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационными числами 12. Металлы, которые кристаллизуются в ГПУ-структуре, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в ГПУ-структуре, включают Ag. , Al, Ca, Cu, Ni, Pb и Pt.
Третий слой расположен одним из двух способов. В ГПУ атомы в третьем слое находятся непосредственно над атомами в первом слое (т. е. третий слой также относится к типу А), а укладка состоит из чередующихся плотноупакованных слоев типа А и типа В (т. е. ABABAB⋯). В CCP атомы в третьем слое не выше атомов ни в одном из первых двух слоев (т. е. третий слой относится к типу C), а укладка состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т. е. ABCABCABC⋯). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационными числами 12. Металлы, которые кристаллизуются в ГПУ-структуре, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в ГПУ-структуре, включают Ag. , Al, Ca, Cu, Ni, Pb и Pt.
Рис. 9. В обоих типах плотнейшей упаковки атомы упакованы максимально компактно. Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Кубическая плотнейшая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Пример 2:
Расчет атомного радиуса и плотности металлов, часть 2Кальций кристаллизуется в гранецентрированной кубической структуре. Длина ребра его элементарной ячейки составляет 558,8 пм.
- Каков атомный радиус Са в этой структуре?
- Рассчитайте плотность Ca.
Показать раствор
Проверьте свои знанияСеребро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки составляет 409 пм.
- Каков атомный радиус Ag в этой структуре?
- Рассчитайте плотность Ag.
Показать решения
Как правило, элементарная ячейка определяется длинами трех осей ( a , b и c ) и углами (α, β и γ) между ними, как показано на рисунке 10. Оси определяются как длины между точками пространственной решетки. Следовательно, оси элементарных ячеек соединяют точки с одинаковыми средами.
Рисунок 10. Элементарная ячейка определяется длинами трех ее осей (a, b и c) и углами (α, β и γ) между осями.
Существует семь различных систем решетки, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, форма которых показана на рисунке 11.
Рисунок 11. Существует семь различных систем решетки и 14 различных элементарных ячеек.
Структуры ионных кристаллов
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металлов того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение к ионам противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1) когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда и (2) когда катионы и анионы контактируют друг с другом. Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением числа положительных и отрицательных ионов в соединении.
Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением числа положительных и отрицательных ионов в соединении.
Рисунок 12. Катионы могут занимать два типа отверстий между анионами: октаэдрические отверстия или тетраэдрические отверстия.
В простых ионных структурах мы обычно обнаруживаем, что анионы, которые обычно крупнее катионов, расположены в наиболее плотно упакованном массиве. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы больше, а меньшее количество электронов, притянутых к тому же ядру, делает катионы меньше по сравнению с атомами, из которых они образованы.) Меньшие катионы обычно занимают один из двух типов отверстий (или междоузлий), оставшихся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены в углах тетраэдра, поэтому отверстие называется тетраэдрическим отверстием .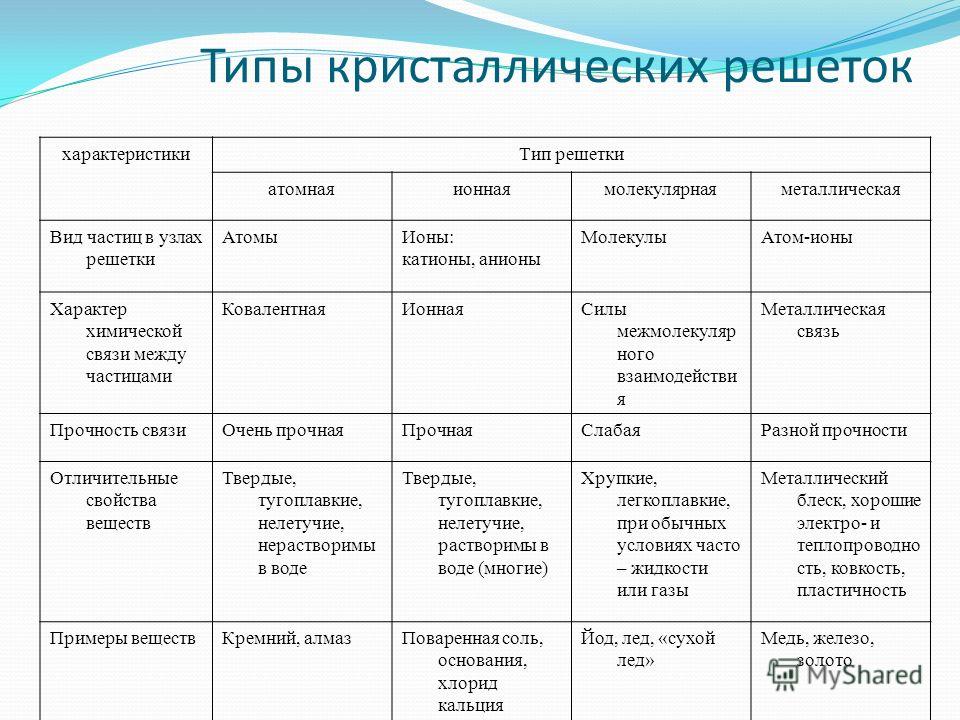 Дырка большего типа находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием . На рис. 12 показаны отверстия обоих типов.
Дырка большего типа находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием . На рис. 12 показаны отверстия обоих типов.
В зависимости от относительных размеров катионов и анионов катионы ионного соединения могут занимать тетраэдрические или октаэдрические пустоты, как показано на рисунке 13. Относительно небольшие катионы занимают тетраэдрические пустоты, а катионы большего размера занимают октаэдрические пустоты. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простая кубическая матрица. Тогда более крупные катионы могут занимать более крупные кубические отверстия, что стало возможным благодаря более открытому промежутку.
Рисунок 13. Размер катиона и форма отверстия, занятого соединением, напрямую связаны.
Для каждого аниона в массиве анионов HCP или CCP имеется по два тетраэдрических отверстия. Соединение, которое кристаллизуется в наиболее плотно упакованном массиве анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены в этом соотношении. Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 9.0384 2 S. Соединения с соотношением менее 2:1 также могут кристаллизоваться в наиболее плотно упакованном массиве анионов с катионами в тетраэдрических отверстиях, если размеры ионов подходят. Однако в этих соединениях часть тетраэдрических отверстий остается вакантной.
Соединение, которое кристаллизуется в наиболее плотно упакованном массиве анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены в этом соотношении. Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 9.0384 2 S. Соединения с соотношением менее 2:1 также могут кристаллизоваться в наиболее плотно упакованном массиве анионов с катионами в тетраэдрических отверстиях, если размеры ионов подходят. Однако в этих соединениях часть тетраэдрических отверстий остается вакантной.
Пример 3:
Заполнение тетраэдрических отверстийСульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках. Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотно упакованном массиве сульфидных ионов. Какова формула сульфида цинка?
Показать решение
Проверьте свои знания Селенид лития можно описать как плотно упакованный массив ионов селенида с ионами лития во всех тетраэдрических отверстиях. Какова формула селенида лития?
Какова формула селенида лития?
Показать решение
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1:1. Таким образом, соединения с катионами в октаэдрических отверстиях в наиболее плотно упакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Соотношения менее 1:1 наблюдаются, когда некоторые октаэдрические отверстия остаются пустыми.
Пример 4:
Стехиометрия ионных соединенийСапфир представляет собой оксид алюминия. Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических отверстий в плотно упакованном массиве оксидных ионов. Какова формула оксида алюминия?
Показать решение
Проверьте свои знания Белый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотно упакованном массиве оксидных ионов.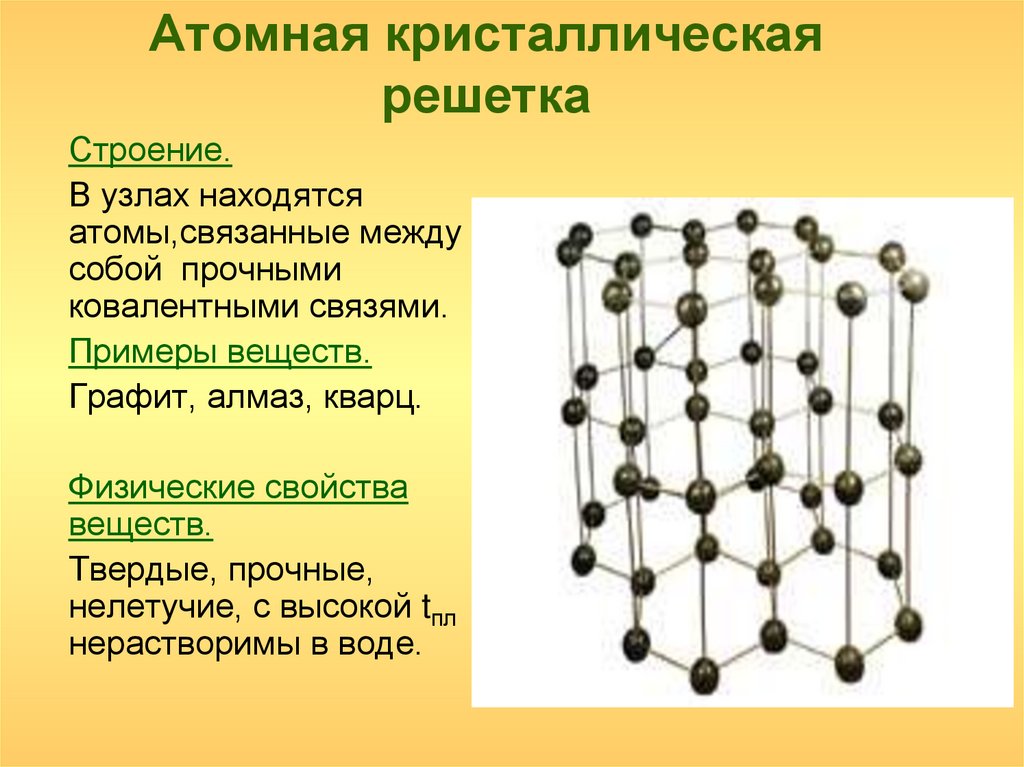 Какова формула оксида титана?
Какова формула оксида титана?
Показать решение
В простом кубическом массиве анионов имеется одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические отверстия заняты. Половина кубических отверстий занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одну и ту же структуру, когда относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) схожи.
Элементарные ячейки ионных соединений
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения для описания общих черт ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1:1, оно обычно образует простую кубическую структуру. Примером этого является хлорид цезия, CsCl (показан на рисунке 14), где Cs + и Cl – имеют радиусы 174 пм и 181 пм соответственно. Мы можем представить себе это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или как ионы цезия, образующие элементарную ячейку с ионом хлорида в центре; или как простые кубические элементарные ячейки, образованные Cs + ионов, перекрывающих элементарные ячейки, образованные ионами Cl – . Ионы цезия и ионы хлора соприкасаются по диагоналям тел элементарных ячеек. На элементарную ячейку приходится один ион цезия и один ион хлорида, что дает стехиометрию 1:1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, а CsCl не является ОЦК-структурой, поскольку ион цезия не идентичен иону хлорида.
Примером этого является хлорид цезия, CsCl (показан на рисунке 14), где Cs + и Cl – имеют радиусы 174 пм и 181 пм соответственно. Мы можем представить себе это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или как ионы цезия, образующие элементарную ячейку с ионом хлорида в центре; или как простые кубические элементарные ячейки, образованные Cs + ионов, перекрывающих элементарные ячейки, образованные ионами Cl – . Ионы цезия и ионы хлора соприкасаются по диагоналям тел элементарных ячеек. На элементарную ячейку приходится один ион цезия и один ион хлорида, что дает стехиометрию 1:1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, а CsCl не является ОЦК-структурой, поскольку ион цезия не идентичен иону хлорида.
Рисунок 14. Ионные соединения с катионами и анионами одинакового размера, такие как CsCl, обычно образуют простую кубическую структуру. Их можно описать элементарными ячейками либо с катионами по углам, либо с анионами по углам.
Их можно описать элементарными ячейками либо с катионами по углам, либо с анионами по углам.
Мы сказали, что расположение узлов решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия. В этом описании ионы цезия расположены в узлах решетки по углам ячейки, а ион хлора – в центре ячейки. Две элементарные ячейки различны, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1:1, которые значительно различаются по размеру, оно обычно кристаллизуется с элементарной ячейкой FCC, как показано на рисунке 15. Примером этого является хлорид натрия, NaCl. , с Na + и Cl – , имеющие радиусы 102 пм и 181 пм соответственно. Мы можем представить это как ионы хлорида, образующие ячейку FCC, с ионами натрия, расположенными в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям клетки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1:1, требуемую формулой NaCl.
Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1:1, требуемую формулой NaCl.
Рис. 15. Ионные соединения с анионами, которые намного больше, чем катионы, такие как NaCl, обычно образуют структуру ГЦК. Они могут быть описаны элементарными ячейками ГЦК с катионами в октаэдрических отверстиях.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке ГЦК, как показано на рисунке 16. Эта структура содержит ионы сульфида в узлах решетки ГЦК решетки. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия.) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти небольшие ионы Zn 2+ расположены в чередующиеся тетраэдрические отверстия, то есть в одной половине тетраэдрических отверстий. В элементарной ячейке четыре иона цинка и четыре сульфидных иона, что дает эмпирическую формулу ZnS.
Рисунок 16. ZnS, сульфид цинка (или цинковая обманка) образует элементарную ячейку ГЦК с ионами сульфида в узлах решетки и гораздо меньшими ионами цинка, занимающими половину тетраэдрических отверстий в структуре.
Элементарная ячейка из фторида кальция, подобная показанной на рисунке 17, также является элементарной ячейкой FCC, но в этом случае катионы расположены в узлах решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК решетки. Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора. В элементарной ячейке содержится четыре иона кальция и восемь ионов фтора, что дает соотношение кальция и фтора 1:2, как того требует химическая формула CaF 2 . Внимательное изучение рисунка 17 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических отверстий. Структура не может быть описана в терминах пространственной решетки из 90 240 90 241 точек на фторид-ионах, поскольку не все фторид-ионы имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Рисунок 17. Фторид кальция, CaF 2 , образует элементарную ячейку FCC с ионами кальция (зеленый) в узлах решетки и ионами фторида (красный), занимающими все тетраэдрические позиции между ними.
Расчет ионных радиусов
Если мы знаем длину ребра элементарной ячейки ионного соединения и положение ионов в ячейке, мы можем вычислить ионные радиусы для ионов в соединении, если мы делаем предположения об отдельных ионных формы и контакты.
Пример 5:
Расчет ионных радиусовДлина края элементарной ячейки LiCl (NaCl-подобная структура, FCC) составляет 0,514 нм или 5,14 Å. Предполагая, что ион лития достаточно мал, чтобы ионы хлорида находились в контакте, как на рисунке 15, рассчитайте ионный радиус для иона хлорида.
Примечание: Единица длины ангстрем, Å, часто используется для представления размеров в атомном масштабе и эквивалентна 10 −10 м.
Показать решение
Проверьте свои знания Длина ребра элементарной ячейки KCl (NaCl-подобная структура, FCC) составляет 6,28 Å. Предполагая анион-катионный контакт вдоль края клетки, рассчитайте радиус иона калия. Радиус иона хлорида составляет 1,82 Å.
Радиус иона хлорида составляет 1,82 Å.
Показать решение
Важно понимать, что значения ионных радиусов, рассчитанные по длинам ребер элементарных ячеек, зависят от многочисленных предположений, таких как идеальная сферическая форма ионов, которые в лучшем случае являются приблизительными. Следовательно, такие расчетные значения сами по себе являются приблизительными, и сравнения не могут быть слишком далекими. Тем не менее, этот метод оказался полезным для расчета ионных радиусов на основе экспериментальных измерений, таких как рентгеноструктурные определения.
Рентгеновская кристаллография
Размер элементарной ячейки и расположение атомов в кристалле можно определить по результатам измерений дифракции рентгеновских лучей на кристалле, называемой рентгеновской кристаллографией . Дифракция — это изменение направления движения электромагнитной волны, когда она встречает физический барьер, размеры которого сравнимы с размерами длины волны света. Рентгеновские лучи представляют собой электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Рентгеновские лучи представляют собой электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматического рентгеновского излучения попадает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла. Когда рассеянные волны, движущиеся в одном и том же направлении, сталкиваются друг с другом, они подвергаются интерференции , процессу, при котором волны объединяются, что приводит либо к увеличению, либо к уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн различны. разделены (см. рис. 18).
Рис. 18. Световые волны, занимающие одно и то же пространство, интерферируют друг с другом, образуя волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи с определенной длиной волны λ рассеиваются атомами в соседних плоскостях кристалла, разделенных расстоянием d , они могут подвергаться конструктивной интерференции, когда разница между расстояниями, пройденными двумя волнами до их объединения представляет собой целочисленный коэффициент длины волны n . Это условие выполняется, когда угол дифрагированного луча θ связан с длиной волны и межатомным расстоянием уравнением:
Это условие выполняется, когда угол дифрагированного луча θ связан с длиной волны и межатомным расстоянием уравнением:
[латекс]n{\lambda }=2d\text{sin}\theta [/latex]
Это соотношение известно как уравнение Брэгга в честь У. Х. Брэгга, английского физика, впервые объяснившего это явление. На рисунке 19 показаны два примера дифрагированных волн от одних и тех же двух плоскостей кристалла. На рисунке слева изображены волны, дифрагированные под углом Брэгга, что приводит к конструктивной интерференции, а на рисунке справа показана дифракция и другой угол, не удовлетворяющий условию Брэгга, что приводит к деструктивной интерференции.
Рисунок 19. Дифракция рентгеновских лучей, рассеянных атомами внутри кристалла, позволяет определить расстояние между атомами. Верхнее изображение изображает конструктивную интерференцию между двумя рассеянными волнами и результирующей дифрагированной волной высокой интенсивности. На нижнем изображении показаны деструктивная интерференция и дифрагированная волна низкой интенсивности.
Посетите страницу «Что такое закон Брэгга и почему он важен?» для получения более подробной информации об уравнении Брэгга и симуляторе, позволяющем исследовать влияние каждой переменной на интенсивность дифрагированной волны.
Рентгеновский дифрактометр, такой как показанный на Рисунке 20, можно использовать для измерения углов, под которыми дифрагируют рентгеновские лучи при взаимодействии с кристаллом, как описано выше. На основе таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
Рисунок 20. В дифрактометре (а) пучок рентгеновских лучей падает на кристаллический материал, создавая картину дифракции рентгеновских лучей (б), которую можно анализировать для определения кристаллической структуры.
Вы можете просмотреть расшифровку «Празднование кристаллографии — анимационное приключение» здесь (откроется в новом окне).
Пример 6:
Использование уравнения БрэггаВ дифрактометре рентгеновские лучи с длиной волны 0,1315 нм использовались для получения дифракционной картины меди. Дифракция первого порядка ( n = 1) происходила под углом θ = 25,25°. Определить расстояние между дифракционными плоскостями в меди.
Показать решение
Проверьте свои знанияКристалл с расстоянием между плоскостями, равным 0,394 нм, дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Показать решение
Портрет химика: рентгенолог-кристаллограф Розалинда Франклин
Рис. 21. На этой иллюстрации показано рентгеновское дифракционное изображение, подобное тому, которое Франклин обнаружила в своем исследовании. (кредит: Национальный институт здоровья)
Открытие структуры ДНК в 1953 Фрэнсиса Крика и Джеймса Уотсона — одно из величайших достижений в истории науки. В 1962 году они были удостоены Нобелевской премии по физиологии и медицине вместе с Морисом Уилкинсом, предоставившим экспериментальное доказательство структуры ДНК. Британский химик Розалинда Франклин внесла неоценимый вклад в это монументальное достижение благодаря своей работе по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин о структуре углей оказались полезными для британских военных действий. После переключения своего внимания на биологические системы в начале 19В 50-х годах Франклин и докторант Рэймонд Гослинг обнаружили, что ДНК состоит из двух форм: длинное тонкое волокно, образующееся при намокании (тип «В»), и короткое, широкое волокно, образующееся при высушивании (тип «А»). Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсон и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.
В 1962 году они были удостоены Нобелевской премии по физиологии и медицине вместе с Морисом Уилкинсом, предоставившим экспериментальное доказательство структуры ДНК. Британский химик Розалинда Франклин внесла неоценимый вклад в это монументальное достижение благодаря своей работе по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин о структуре углей оказались полезными для британских военных действий. После переключения своего внимания на биологические системы в начале 19В 50-х годах Франклин и докторант Рэймонд Гослинг обнаружили, что ДНК состоит из двух форм: длинное тонкое волокно, образующееся при намокании (тип «В»), и короткое, широкое волокно, образующееся при высушивании (тип «А»). Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсон и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.
Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области.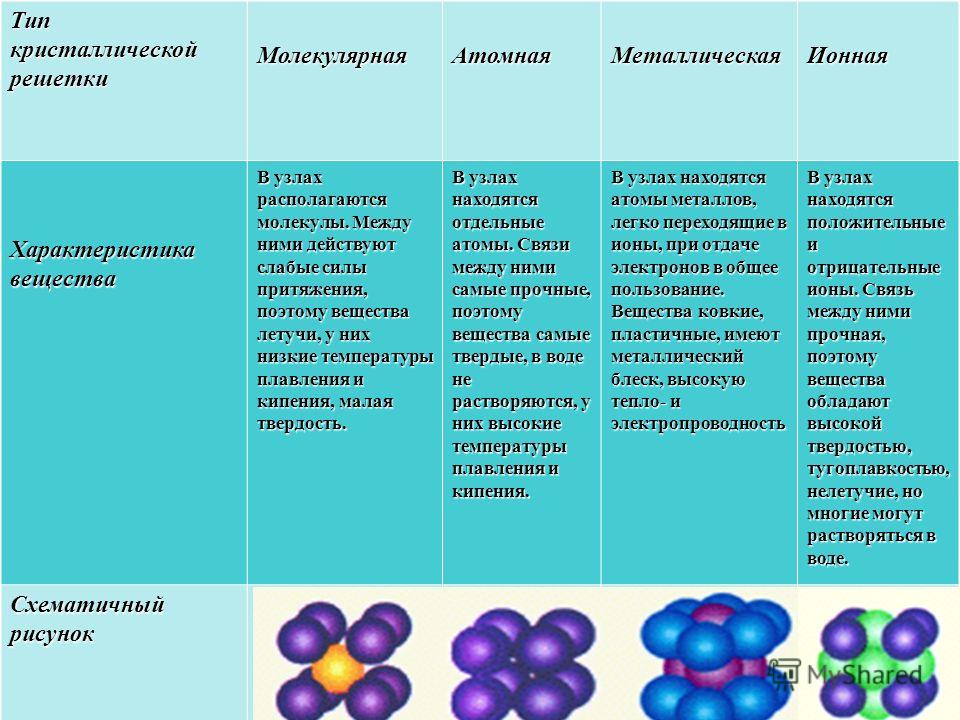 После развития рака яичников Франклин продолжала работать до самой своей смерти в 19 лет.58 лет в возрасте 37 лет. Среди многих посмертных признаний ее работы, Чикагская медицинская школа Университета медицинских наук Финча изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году и приняла изображение ее знаменитого рентгеновского дифракционного изображения. ДНК в качестве официального логотипа университета.
После развития рака яичников Франклин продолжала работать до самой своей смерти в 19 лет.58 лет в возрасте 37 лет. Среди многих посмертных признаний ее работы, Чикагская медицинская школа Университета медицинских наук Финча изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году и приняла изображение ее знаменитого рентгеновского дифракционного изображения. ДНК в качестве официального логотипа университета.
Ключевые понятия и резюме
Структуры кристаллических металлов и простых ионных соединений могут быть описаны в терминах упаковки сфер. Атомы металлов могут упаковываться в гексагональные структуры с плотнейшей упаковкой, кубические структуры с плотнейшей упаковкой, объемно-центрированные структуры и простые кубические структуры. Анионы в простых ионных структурах обычно принимают одну из этих структур, а катионы занимают пространство, остающееся между анионами. Небольшие катионы обычно занимают тетраэдрические отверстия в наиболее плотно упакованном массиве анионов. Более крупные катионы обычно занимают октаэдрические пустоты. Катионы еще большего размера могут занимать кубические отверстия в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и содержимое ячейки. Тип структуры и размеры элементарной ячейки можно определить с помощью рентгенодифракционных измерений.
Более крупные катионы обычно занимают октаэдрические пустоты. Катионы еще большего размера могут занимать кубические отверстия в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и содержимое ячейки. Тип структуры и размеры элементарной ячейки можно определить с помощью рентгенодифракционных измерений.
Ключевые уравнения
- [латекс]n{\lambda}=2d\text{sin}\theta [/latex]
Попробуйте
- Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в элементарной кубической ячейке.
- Опишите кристаллическую структуру платины, которая кристаллизуется с четырьмя эквивалентными атомами металла в элементарной кубической ячейке.
- Какое координационное число атома хрома в объемно-центрированной кубической структуре хрома?
- Какое координационное число атома алюминия в гранецентрированной кубической структуре алюминия?
- Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре.
 Какое координационное число у атома кобальта?
Какое координационное число у атома кобальта? - Металлический никель кристаллизуется в кубической плотноупакованной структуре. Какое координационное число у атома никеля?
- Вольфрам кристаллизуется в объемно-центрированной кубической элементарной ячейке с длиной ребра 3,165 Å.
- Каков атомный радиус вольфрама в этой структуре?
- Рассчитайте плотность вольфрама.
Платина - (атомный радиус = 1,38 Å) кристаллизуется в кубической плотноупакованной структуре. Вычислите длину ребра гранецентрированной кубической элементарной ячейки и плотность платины.
- Барий кристаллизуется в элементарной объемно-центрированной кубической ячейке с длиной ребра 5,025 Å.
- Каков атомный радиус бария в этой структуре?
- Рассчитайте плотность бария.
Алюминий - (атомный радиус = 1,43 Å) кристаллизуется в кубической плотноупакованной структуре. Вычислите длину ребра гранецентрированной кубической элементарной ячейки и плотность алюминия.

- Плотность алюминия 2,7 г/см 3 ; у кремния 2,3 г/см 3 . Объясните, почему Si имеет более низкую плотность, хотя в нем более тяжелые атомы.
- Свободное пространство в металле можно найти, вычитая объем атомов в элементарной ячейке из объема ячейки. Вычислите процент свободного пространства в каждой из трех кубических решеток, если все атомы в каждой из них имеют одинаковый размер и касаются своих ближайших соседей. Какая из этих структур представляет собой наиболее эффективную упаковку? То есть, что упаковывается с наименьшим количеством неиспользуемого пространства?
- Сульфид кадмия, иногда используемый художниками в качестве желтого пигмента, кристаллизуется с кадмием, занимая половину тетраэдрических отверстий в плотно упакованном массиве сульфидных ионов. Какова формула сульфида кадмия? Поясните свой ответ.
- Соединение кадмия, олова и фосфора используется в производстве некоторых полупроводников. Он кристаллизуется с кадмием, занимающим одну четверть тетраэдрических отверстий, и оловом, занимающим одну четверть тетраэдрических отверстий в плотно упакованном массиве фосфид-ионов.
 Какова формула соединения? Поясните свой ответ.
Какова формула соединения? Поясните свой ответ. - Какова формула магнитного оксида кобальта, используемого в записывающих лентах, который кристаллизуется с атомами кобальта, занимающими одну восьмую тетраэдрических отверстий и половину октаэдрических отверстий в плотно упакованном массиве оксидных ионов?
- Соединение, содержащее цинк, алюминий и серу, кристаллизуется с наиболее плотно упакованным массивом сульфид-ионов. Ионы цинка находятся в одной восьмой части тетраэдрических отверстий, а ионы алюминия — в половине октаэдрических отверстий. Какова эмпирическая формула соединения?
- Соединение таллия и йода кристаллизуется в виде простого кубического массива ионов йодида с ионами таллия во всех кубических отверстиях. Какова формула этого йодида? Поясните свой ответ.
- Какой из следующих элементов реагирует с серой с образованием твердого тела, в котором атомы серы образуют плотно упакованный массив со всеми занятыми октаэдрическими отверстиями: Li, Na, Be, Ca или Al?
- Каков массовый процент титана в рутиле, минерале, содержащем титан и кислород, если структуру можно описать как плотно упакованный массив оксидных ионов с ионами титана в половине октаэдрических отверстий? Какая степень окисления у титана?
- Объясните, почему химически сходные хлориды щелочных металлов NaCl и CsCl имеют различное строение, а химически разные NaCl и MnS имеют одинаковое строение.

- Поскольку минералы образовались из расплавленной магмы, разные ионы занимали одни и те же места в кристаллах. Вместе с магнием в минералах часто встречается литий, несмотря на различие зарядов их ионов. Предложите объяснение.
- Иодид рубидия кристаллизуется с кубической элементарной ячейкой, которая содержит ионы йодида по углам и ион рубидия в центре. Какова формула соединения?
- Один из различных оксидов марганца кристаллизуется с кубической элементарной ячейкой, которая содержит ионы марганца по углам и в центре. Оксид-ионы расположены в центре каждого края элементарной ячейки. Какова формула соединения?
- NaH кристаллизуется с той же кристаллической структурой, что и NaCl. Длина ребра кубической элементарной ячейки NaH составляет 4,880 Å.
- Рассчитайте ионный радиус H − . (Ионный радиус Li + равен 0,0,95 Å.)
- Рассчитайте плотность NaH.
- Иодид таллия (I) кристаллизуется с той же структурой, что и CsCl.
 Длина ребра элементарной ячейки TlI составляет 4,20 Å.
Длина ребра элементарной ячейки TlI составляет 4,20 Å.- Рассчитайте ионный радиус TI + . (Ионный радиус I − равен 2,16 Å.)
- Рассчитайте плотность TlI.
- Кубическая элементарная ячейка содержит ионы марганца в углах и ионы фтора в центре каждого края.
- Какова эмпирическая формула этого соединения? Поясните свой ответ.
- Какое координационное число имеет ион Mn 3+ ?
- Рассчитайте длину ребра элементарной ячейки, если радиус иона Mn 3+ равен 0,65 А.
- Рассчитайте плотность соединения.
- Какое расстояние между плоскостями кристалла, преломляющими рентгеновские лучи с длиной волны 1,541 нм под углом θ 15,55° (отражение первого порядка)?
- Дифрактометр, использующий рентгеновские лучи с длиной волны 0,2287 нм, дал дифракционный пик первого порядка для кристаллического угла θ = 16,21°. Определите расстояние между дифрагирующими плоскостями в этом кристалле.

- Металл с расстоянием между плоскостями 0,4164 нм дифрагирует рентгеновские лучи с длиной волны 0,2879 нм. Какой угол дифракции соответствует дифракционному пику первого порядка?
- Золото кристаллизуется в элементарной гранецентрированной кубической ячейке. Отражение второго порядка (n = 2) рентгеновских лучей для плоскостей, составляющих верх и низ элементарных ячеек, составляет θ = 22,20°. Длина волны рентгеновского излучения составляет 1,54 Å. Какова плотность металлического золота?
- Когда электрон в возбужденном атоме молибдена падает с L на K-оболочку, испускается рентгеновское излучение. Эти рентгеновские лучи преломляются под углом 7,75° плоскостями с расстоянием между ними 2,64 Å. Какова разница в энергии между K-оболочкой и L-оболочкой в молибдене, если предположить дифракцию первого порядка?
Показать выбранные решения
Глоссарий
объемно-центрированное кубическое (ОЦК) твердое тело: кристаллическая структура, имеющая кубическую элементарную ячейку с точками решетки по углам и в центре ячейки
элементарная объемно-центрированная кубическая ячейка: простейшая повторяющаяся единица объемно-центрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре куба
уравнение Брэгга: уравнение, связывающее углы, под которыми рентгеновские лучи преломляются атомами внутри кристалла атомов, ближайших к любому данному атому в кристалле или к центральному атому металла в комплексе
кубическая плотнейшая упаковка (CCP): кристаллическая структура, в которой плоскости плотно упакованных атомов или ионов уложены друг на друга в виде серии из трех чередующихся слоев с различными относительными ориентациями (АВС)
дифракция: перенаправление электромагнитного излучения, возникающее при столкновении с физическим барьером соответствующих размеров
гранецентрированное кубическое (ГЦК) твердое тело: кристаллическая структура, состоящая из кубической элементарной ячейки с точками решетки на углах и в центре каждой грани
элементарная гранецентрированная кубическая ячейка: простейшая повторяющаяся единица гранецентрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре каждой грани. относительные ориентации (AB)
относительные ориентации (AB)
отверстие: (также междоузлия) пространство между атомами внутри кристалла
изоморфный: имеющий такую же кристаллическую структуру элементарная ячейка) элементарная ячейка в простой кубической структуре
простая кубическая структура: кристаллическая структура с кубической элементарной ячейкой с точками решетки только в углах
пространственная решетка: все точки внутри кристалла, имеющие одинаковое окружение
тетраэдрическая дыра: тетраэдрическое пространство, образованное четырьмя атомами или ионами в кристалле
элементарная ячейка: наименьшая часть пространственной решетки, повторяющаяся в трех измерениях для вся решетка
Рентгеновская кристаллография: экспериментальная методика определения расстояний между атомами в кристалле путем измерения углов, под которыми дифрагируют рентгеновские лучи при прохождении через кристалл
Структура металлов
Структура металлов
| Структура Металлы и другие одноатомные твердые вещества | Простая кубическая упаковка | Объемно-центрированный куб Упаковка |
| Плотно упакованный Конструкции | Координационные номера и структуры металлов | физ. Свойства, обусловленные структурой металлов Свойства, обусловленные структурой металлов |
| Твердые растворы и Интерметаллические соединения | Отверстия в Плотнейшие и простые кубические структуры | Правила соотношения радиусов |
Структура Металлы и другие одноатомные твердые тела
Структуры чистых металлов легко описать, потому что атомы, образующие эти металлы, можно рассматривать как идентичные идеальные сферы. То же самое можно сказать и о структуре редкие газы (He, Ne, Ar и др.) при очень низких температурах. Все эти вещества кристаллизуются в одной из четырех основных структур: простой кубический ( SC ), объемно-центрированная кубическая ( BCC ), шестиугольная плотнейшая упаковка ( HCP ) и кубическая плотнейшая упаковка ( CCP ).
Простая кубическая упаковка
При кристаллизации твердого вещества частицы, образующие твердое
упаковать как можно плотнее. Чтобы проиллюстрировать этот принцип, давайте
попробуй представить лучший способ упаковки сфер, например, пинг-понг
шары в пустую коробку.
Чтобы проиллюстрировать этот принцип, давайте
попробуй представить лучший способ упаковки сфер, например, пинг-понг
шары в пустую коробку.
Один из подходов заключается в тщательной упаковке шариков для пинг-понга. образуют квадратную упакованную плоскость сфер, как показано на рисунке ниже.
Наклонив коробку в одну сторону, мы можем сложить вторую плоскость сферы прямо поверх первой. Результат – обычный структура, в которой простейшей повторяющейся единицей является куб из восьми сферы, как показано на рисунке ниже.
Эта структура называется простая кубическая упаковка . Каждый
сфера в этой структуре соприкасается с четырьмя одинаковыми сферами в
тот же самолет. Он также касается одной сферы на плоскости выше и одной
в самолете внизу. Каждый атом в этой структуре может образовывать связи с
его шесть ближайших соседей. Поэтому говорят, что каждая сфера имеет
a координационный номер из 6.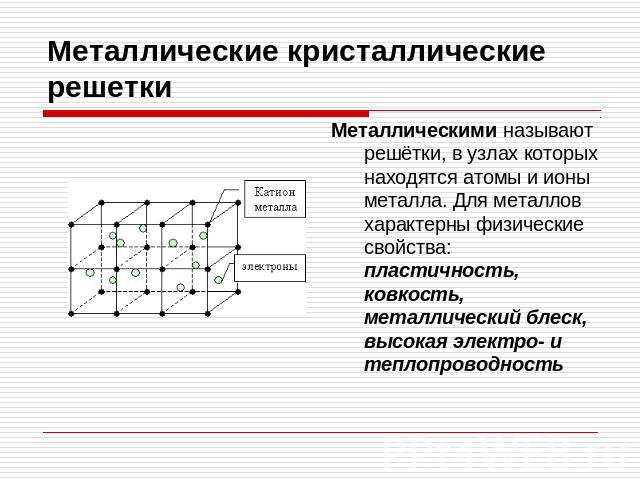
Простая кубическая структура не является эффективным способом использования пространство. Только 52% доступного пространства фактически занято сферы в простой кубической структуре. Остальное пустое место. Поскольку эта структура неэффективна, кристаллизуется только один элемент полоний. в простой кубической структуре.
Объемно-центрированный куб Упаковка
Другой подход начинается с разделения сфер, чтобы сформировать квадратно-упакованная плоскость, в которой они не совсем касаются друг друга, как показано на рисунке ниже.
Сферы во второй плоскости пакета над отверстиями в первой плоскости, как показано на рисунке ниже.
Сферы в третьей плоскости упаковываются над отверстиями во второй
самолет. Сферы в четвертой плоскости упаковываются над отверстиями в третьей. самолет и так далее. В результате получается структура, в которой
нечетные плоскости атомов одинаковы, а четные
самолеты идентичны. Это ABABABAB . . . повторяющийся
структура известна как объемно-центрированная кубическая упаковка .
самолет и так далее. В результате получается структура, в которой
нечетные плоскости атомов одинаковы, а четные
самолеты идентичны. Это ABABABAB . . . повторяющийся
структура известна как объемно-центрированная кубическая упаковка .
Эта структура называется объемно-центрированной кубической , потому что каждая сфера касается четырех сфер на плоскости выше и еще четырех на плоскости внизу, расположенные по углам куба. Таким образом, повторяющаяся единица в этой структуре представляет собой куб из восьми сфер с девятой такой же сферой в центре тела в другими словами, объемно-центрированный куб, как показано на рисунке ниже. Координационное число в этой структуре равно 8,9.0034
Осмотрите объемно-центрированный кубический кристалл ниже:
Нажмите левую кнопку мыши и
перетащите структуру. Нажмите вправо
кнопку мыши, чтобы увидеть параметры.
Нажмите вправо
кнопку мыши, чтобы увидеть параметры.
Для этой страницы требуется MDL Chime плагин. Загрузите его здесь.
Объемно-центрированная кубическая насадка является более эффективной способ использования пространства, чем простая кубическая упаковка68% пространство в этой структуре заполнено. Все металлы в Группа IA (Li, Na, K и т. д.), более тяжелые металлы группы IIA. (Ca, Sr и Ba), а также ряд ранних переходных металлов. (например, Ti, V, Cr, Mo, W и Fe) упаковываются в объемно-центрированную кубическую структура.
Плотно упакованный Структуры
Две структуры настолько эффективно упаковывают сферы, что называются наиболее плотно упакованными структурами .
Оба начинают с упаковки сфер в плоскости в
каждая сфера касается шести других, ориентированных по углам
шестигранника, как показано на рисунке ниже.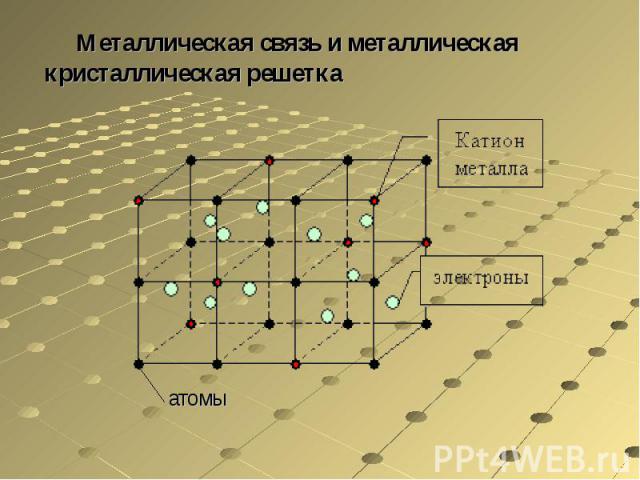
Затем формируется вторая плоскость путем упаковки сфер над треугольными отверстиями в первой плоскости, как показано на рисунок ниже.
Сферы в третьем плане могли упаковываться прямо над сферами в первой плоскости, чтобы сформировать ABABABAB . . . повторяющаяся структура. Поскольку эта структура состоит из чередование плоскостей шестиугольных плотноупакованных сфер, это называется гексагональной плотноупакованной структурой . Каждая сфера касается трех сфер на плоскости вверху, трех сфер на плоскости внизу и шесть сфер в той же плоскости, как показано на рисунок ниже. Таким образом, координационное число в шестиугольной наиболее плотно упакованная структура равна 12,
74% пространства в шестиугольном плотно упакованном
структура заполнена. Нет более эффективного способа упаковки сфер.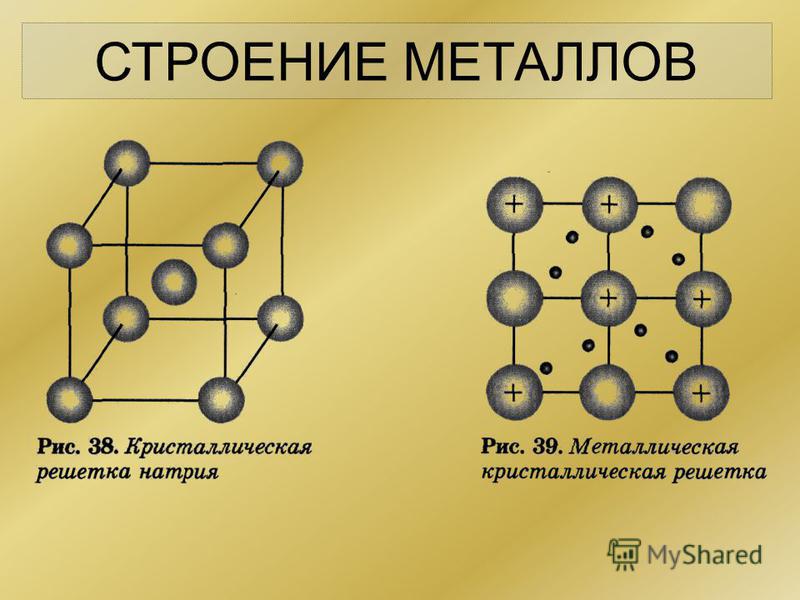 известна, и гексагональная плотнейшая структура важна
для металлов, таких как Be, Co, Mg и Zn, а также благородный газ He
при низких температурах.
известна, и гексагональная плотнейшая структура важна
для металлов, таких как Be, Co, Mg и Zn, а также благородный газ He
при низких температурах.
Существует еще один способ укладки шестигранных наиболее плотно упакованные плоскости сфер. Атомы на третьем плане может быть упакован над отверстиями в первой плоскости, которые были не используется для формирования второй плоскости. Четвертый шестиугольник Затем плотнейшая плоскость атомов упаковывается непосредственно над первый. Чистый результат – АВСАБСАВС . . . структура, который называется кубическим плотно упакованным . Каждая сфера в этом структура касается шести других в той же плоскости, трех в плоскости вверху и три в плоскости внизу, как показано на рисунке ниже. Таким образом, координационное число по-прежнему равно 12.
Разница между шестиугольным и кубическим
Плотнейшие структуры можно понять, заметив, что
атомы в первой и третьей плоскостях лежат непосредственно друг над другом
в гексагональной плотноупакованной структуре. В куб.
плотноупакованная структура, атомы в этих плоскостях ориентированы
в разных направлениях.
В куб.
плотноупакованная структура, атомы в этих плоскостях ориентированы
в разных направлениях.
Плотнейшая кубическая структура точно так же эффективен как гексагональная плотнейшая упакованная структура. (Оба используют 74% доступного пространства.) Многие металлы, в том числе Ag, Al, Au, Ca, Co, Cu, Ni, Pb и Pt кристаллизуются в кубической форме с плотнейшей упаковкой. структура. То же самое происходит со всеми редкими газами, кроме гелия, когда они газы охлаждаются до достаточно низких температур для затвердевания.
Элементарная гранецентрированная кубическая ячейка является простейшей повторяющаяся единица в кубической плотноупакованной структуре. Фактически, наличие в этой структуре гранецентрированных кубических элементарных ячеек объясняет, почему структура известна как куб плотно упакованы.
| Кубическая плотнейшая упаковка (или грань Centered-Cubic) Учебная деятельность по структуре |
Координационные номера и Структуры металлов
Координационные числа четырех структур
металлов приведены в таблице ниже.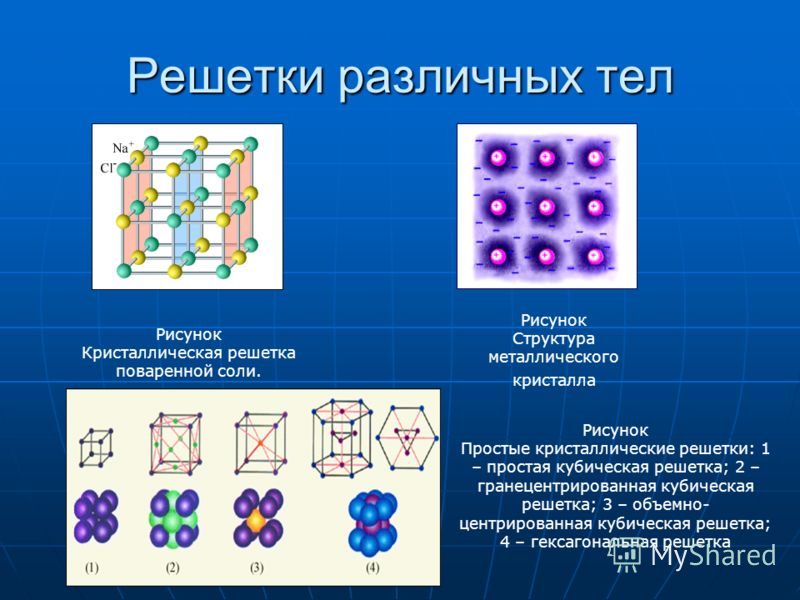 Это легко
понять, почему металлы упаковываются в гексагональные или кубические плотнейшие упаковки
структуры. Эти конструкции не только эффективно используют пространство
насколько это возможно, они также имеют максимально возможную координацию
номера, что позволяет каждому атому металла образовывать связи с
наибольшее количество соседних атомов металла.
Это легко
понять, почему металлы упаковываются в гексагональные или кубические плотнейшие упаковки
структуры. Эти конструкции не только эффективно используют пространство
насколько это возможно, они также имеют максимально возможную координацию
номера, что позволяет каждому атому металла образовывать связи с
наибольшее количество соседних атомов металла.
Координационные номера для Common Crystal Конструкции
| Структура | Координация Номер | Штабелирование Шаблон | ||
| простой кубический | 6 | АААААААА . . . | ||
| объемно-центрированный кубический | 8 | АБАБАБАБ . . . . . | ||
| шестигранник в плотной упаковке | 12 | АБАБАБАБ . . . | ||
| куб. в плотной упаковке | 12 | АВСАБСАВС . . . |
Менее очевидно, почему одна треть металлов упаковать в объемно-центрированную кубическую структуру, в которой координационное число всего 8. Популярность этой структуры можно понять, обратившись к рисунку ниже.
Координационное число объемно-центрированной кубической
структуры, приведенные в таблице выше, учитывают только те атомы, которые
действительно коснуться данного атома в этой структуре. Рисунок выше
показывает, что каждый атом также почти касается четырех соседей в
той же плоскости, пятая соседняя двумя плоскостями выше и шестая
двумя плоскостями ниже. Расстояние от каждого атома до ядра
этих ближайших атомов всего на 15% больше, чем расстояние до
ядра атомов, которых он фактически касается. Каждый атом в
Таким образом, объемно-центрированная кубическая структура может образовывать в общей сложности 14
облигации
восемь сильных связей с атомами, которых он касается, и шесть более слабых
связывается с атомами, которых он почти касается.
Расстояние от каждого атома до ядра
этих ближайших атомов всего на 15% больше, чем расстояние до
ядра атомов, которых он фактически касается. Каждый атом в
Таким образом, объемно-центрированная кубическая структура может образовывать в общей сложности 14
облигации
восемь сильных связей с атомами, которых он касается, и шесть более слабых
связывается с атомами, которых он почти касается.
Это облегчает понимание того, почему металл может предпочесть объемно-центрированную кубическую структуру шестиугольной или кубическая плотноупакованная структура. Каждый атом металла в наиболее плотно упакованные структуры могут образовывать прочные связи с 12 соседними атомы. В объемноцентрированной кубической структуре каждый атом образует всего 14 связей с соседними атомами, хотя шесть из них связи несколько слабее, чем остальные восемь.
Физические свойства которые являются результатом строения металлов
Структуры металлов можно использовать для объяснения
многие характерные физические свойства металлов.
На просьбу объяснить, почему металлы имеют характерный металлический блеск или блеск, как сказали бы многие что металлы отражают (буквально, отбрасывают) свет, который сияет на их поверхности. Фактически они могут утверждать, что свет отражается от поверхности металла, как ракетка отскакивает от стен площадки для игры в ракетбол. Что-то не так с этим Аналогия, однако. Металлы фактически поглощают значительную часть света, попадающего на их поверхность.
Часть энергии, захваченной, когда металл
поглощает свет, превращается в тепловую энергию. (Вы можете легко
продемонстрируйте это, положив руку на поверхность автомобиля
который провел несколько часов на солнце.) Остальная энергия
переизлучается металлом как «отраженный» свет. Серебряный
лучше любого другого металла отражает свет, и все же только
88% света, попадающего на поверхность серебряного зеркала,
переизлученный. Это поднимает важный вопрос: почему металлы
поглощать свет, когда другие вещества, такие как стекло в
окна автомобиля, не так ли? Свет поглощается, когда энергия этого
излучение равно энергии, необходимой для возбуждения электрона
возбужденное состояние с более высокой энергией или когда энергия может быть использована для
перемещать электрон через твердое тело. Поскольку электроны
делокализованный в металлах и песке
поэтому свободно перемещаться через твердые металлы
легко поглощают свет. Другие твердые тела, такие как стекло, не имеют
электроны, которые могут двигаться через твердое тело, поэтому они не могут поглощать
светятся так, как это делают металлы. Эти твердые вещества бесцветны и могут только
окрашиваться путем добавления примеси, в которой энергия, связанная
при возбуждении электрона с одной орбитали на другую падает в
видимая часть спектра. Обычно стекло окрашивают
добавлением небольшого количества одного из переходных металлов. кобальт
дает синий цвет, хром делает стекло зеленым, а
следы золота дают темно-красный цвет.
Поскольку электроны
делокализованный в металлах и песке
поэтому свободно перемещаться через твердые металлы
легко поглощают свет. Другие твердые тела, такие как стекло, не имеют
электроны, которые могут двигаться через твердое тело, поэтому они не могут поглощать
светятся так, как это делают металлы. Эти твердые вещества бесцветны и могут только
окрашиваться путем добавления примеси, в которой энергия, связанная
при возбуждении электрона с одной орбитали на другую падает в
видимая часть спектра. Обычно стекло окрашивают
добавлением небольшого количества одного из переходных металлов. кобальт
дает синий цвет, хром делает стекло зеленым, а
следы золота дают темно-красный цвет.
Почему металлы твердые? Неметаллы, такие как водород
и кислород являются газами при комнатной температуре, потому что эти элементы
может получить заполненную оболочку валентных электронов, разделив пары
электронов с образованием относительно небольших молекул, таких как H 2 и O 2 , которые движутся достаточно быстро на уровне комнаты
температура выхода из жидкости в газообразную фазу. Металлы не могут этого сделать. В металле недостаточно электронов
атома, чтобы позволить ему заполнить свою валентную оболочку, разделяя пары
электроны с одним или двумя ближайшими соседями. Единственный способ металл
можно получить эквивалент заполненной оболочки валентных электронов
заключается в том, что эти электроны могут быть разделены рядом
соседние атомы металла. Это возможно только при большом количестве
атомы металлов находятся близко друг к другу, поэтому металлы
твердые вещества при комнатной температуре.
Металлы не могут этого сделать. В металле недостаточно электронов
атома, чтобы позволить ему заполнить свою валентную оболочку, разделяя пары
электроны с одним или двумя ближайшими соседями. Единственный способ металл
можно получить эквивалент заполненной оболочки валентных электронов
заключается в том, что эти электроны могут быть разделены рядом
соседние атомы металла. Это возможно только при большом количестве
атомы металлов находятся близко друг к другу, поэтому металлы
твердые вещества при комнатной температуре.
Почему металлы ковкие и пластичные? Большинство металлов
упаковать либо в объемно-центрированную кубическую, либо в шестиугольную плотнейшую упаковку, либо в
кубические плотноупакованные структуры. Теоретически изменение формы
металл – это просто вопрос приложения силы, которая заставляет
атомы в одной из плоскостей скользят мимо атомов в соседней
плоскости, как показано на рисунке ниже. На практике проще
Делайте это, когда металл горячий.
Почему металлы являются хорошими проводниками тепла и электричество? Как мы уже видели, делокализация валентные электроны в металле позволяют твердому телу проводить электрический ток. Чтобы понять, почему металлы проводят тепло, вспомните что температура является макроскопическим свойством, отражающим кинетическая энергия отдельных атомов или молекул. туго упаковка атомов в металле означает, что кинетическая энергия может быть передаются от одного атома к другому быстро и эффективно.
Твердые растворы и Интерметаллические соединения
Большинство растворов, с которыми работают химики, включают
газ (например, HCl) или твердое вещество (например, NaCl), растворенное в
жидкости (например, воды). Также возможно приготовление растворов
в котором газ, жидкость или твердое тело растворяются в твердом теле.
Наиболее важным классом твердых растворов являются те, в которых
твердое вещество растворяется в другом.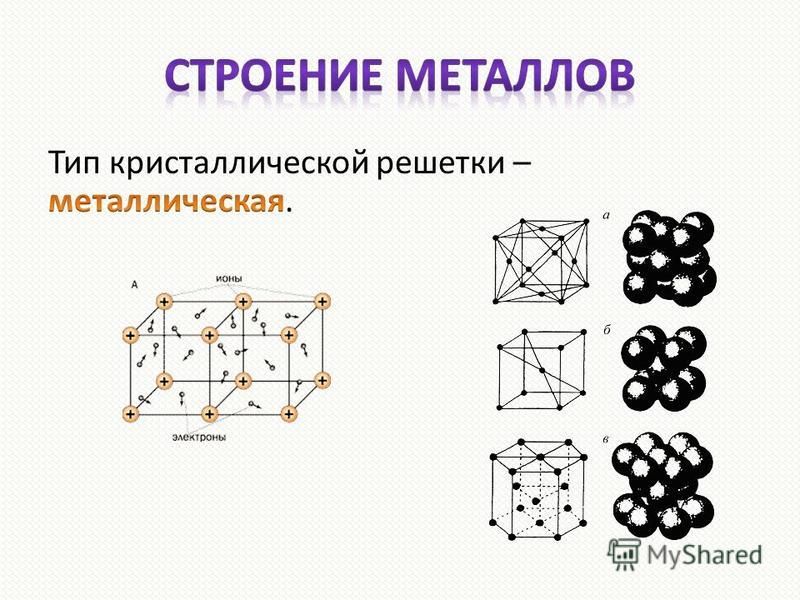 Два примера твердых растворов
это медь, растворенная в алюминии, и углерод, растворенный в железе.
Два примера твердых растворов
это медь, растворенная в алюминии, и углерод, растворенный в железе.
Растворимость одного твердого вещества в другом обычно зависит от температуры. При комнатной температуре, например, медь не растворяется в алюминии. Однако при 550°С алюминий может образуют растворы, содержащие до 5,6 % меди по массе. Алюминий металл, насыщенный медью при 550С, попытается отбрасывают атомы меди по мере охлаждения до комнатной температуры. В теории, раствор может отталкивать атомы меди, образуя поликристаллическая структура, состоящая из мелких кристаллов более или менее чистый алюминий с вкраплениями мелких кристаллов меди металл. Вместо этого атомы меди соединяются с алюминием. атомов по мере охлаждения раствора с образованием интерметаллическое соединение с формулой CuAl 2 .
CuAl 2 является прекрасным примером
разница между смесью (такой как раствор меди
растворенный в алюминии) и соединение.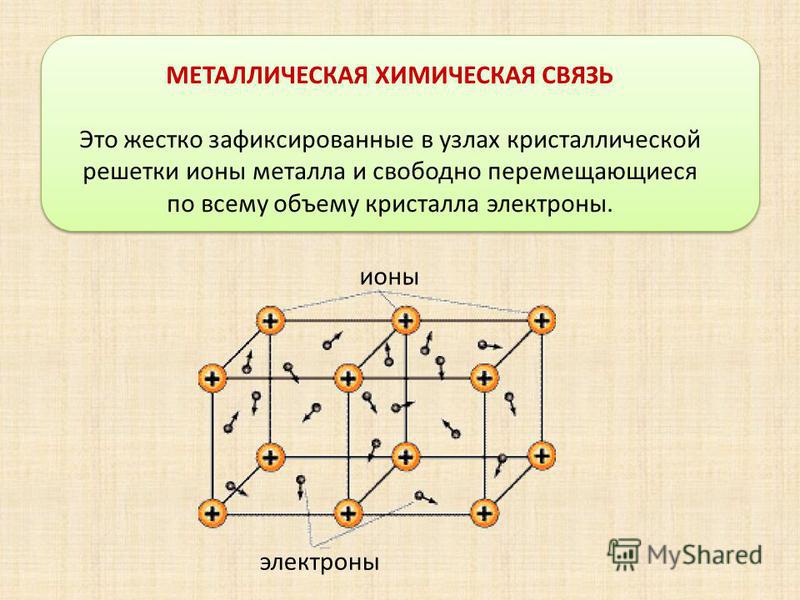 Решение может содержать
разное количество меди и алюминия. При 550С, например,
раствор может содержать от 0 до 5,6% металлической меди путем
масса. Интерметаллическое соединение имеет фиксированный состав CuAl 2 всегда 490,5% алюминия по весу.
Решение может содержать
разное количество меди и алюминия. При 550С, например,
раствор может содержать от 0 до 5,6% металлической меди путем
масса. Интерметаллическое соединение имеет фиксированный состав CuAl 2 всегда 490,5% алюминия по весу.
Интерметаллические соединения, такие как CuAl 2 являются ключом к процессу, известному как дисперсионное твердение . Металлоалюминиевые пакеты в кубической плотно упакованной структуре, в которой одна плоскость атомов может скользить мимо другой. В результате чистая металл алюминия слишком слаб, чтобы его можно было использовать в качестве конструкционного металла в автомобилей или самолетов. В результате дисперсионного твердения получаются сплавы, в пять-шесть раз прочнее алюминия и делают отличный конструкционный металл.
Первый этап дисперсионного твердения
алюминий предполагает нагрев металла до 550°С. тогда медь
добавляют с образованием раствора, который гасят холодной водой. раствор остывает так быстро, что атомы меди не могут соединиться
для образования микрокристаллов металлической меди.
раствор остывает так быстро, что атомы меди не могут соединиться
для образования микрокристаллов металлической меди.
Сравнение твердого тела с кирпичной стеной имеет один важный аспект. недостаток. Это приводит к мысли, что атомы не могут двигаться через металл. Это не совсем так. Распространение через металла может произойти, хотя это происходит медленно. В течение периода время атомы меди могут двигаться через закаленный раствор с образованием микрокристаллы CuAl 2 интерметаллическое соединение, настолько малы, что их трудно увидеть в микроскоп.
Эти частицы CuAl 2 твердые и сильный. Настолько сильно, что они препятствуют течению алюминиевого металла. что их окружает. Эти микрокристаллы CuAl 2 укрепить алюминиевый металл, мешая плоскостям пути атомы скользят мимо друг друга. В результате получается металл, который одновременно тверже и прочнее чистого алюминия.
Медь, растворенная в алюминии при высокой температуре
это пример замещающий раствор , в котором медь
атомы упаковываются в положения, обычно занимаемые атомами алюминия. Есть и другой способ приготовления твердого раствора. Атомы
одного элемента можно упаковать в отверстия междоузлия или ,
между атомами элемента-хозяина, потому что даже самый эффективный
кристаллические структуры занимают только 74% доступного пространства в
кристалл. В результате получается интерстициальный раствор .
Есть и другой способ приготовления твердого раствора. Атомы
одного элемента можно упаковать в отверстия междоузлия или ,
между атомами элемента-хозяина, потому что даже самый эффективный
кристаллические структуры занимают только 74% доступного пространства в
кристалл. В результате получается интерстициальный раствор .
Сталь при высоких температурах является хорошим примером промежуточный раствор. Сталь образуется при растворении углерода в утюг. При очень высоких температурах железо уплотняется в кубическую форму. плотно упакованная структура, которая оставляет достаточно места, чтобы позволить атомы углерода, чтобы поместиться в отверстия между атомами железа. Ниже 910C, металлические пакеты железа в объемно-центрированной кубической структуре, в в которых отверстия слишком малы, чтобы удерживать атомы углерода.
Это имеет важные последствия для
свойства стали. При температурах выше 910°С углерод легко
растворяется в железе с образованием твердого раствора, содержащего столько же
как 1% углерода по массе. Этот материал податлив и
пластичен, и его можно раскатать в тонкие листы или забить в
различные формы. Когда этот раствор охлаждается ниже 910°С, железо
переходит в объемно-центрированную кубическую структуру, а атомы углерода
отбрасываются от металла. Если дать раствору остыть
постепенно атомы углерода мигрируют через металл, образуя
соединение с формулой Fe 3 C, который выпадает в осадок
из раствора. Эти кристаллы Fe 3 C служат той же
роль в стали, которую кристаллы CuAl 2 играют в алюминии они
тормозят течение плоскостей атомов металла и тем самым заставляют
металл прочнее.
Этот материал податлив и
пластичен, и его можно раскатать в тонкие листы или забить в
различные формы. Когда этот раствор охлаждается ниже 910°С, железо
переходит в объемно-центрированную кубическую структуру, а атомы углерода
отбрасываются от металла. Если дать раствору остыть
постепенно атомы углерода мигрируют через металл, образуя
соединение с формулой Fe 3 C, который выпадает в осадок
из раствора. Эти кристаллы Fe 3 C служат той же
роль в стали, которую кристаллы CuAl 2 играют в алюминии они
тормозят течение плоскостей атомов металла и тем самым заставляют
металл прочнее.
Отверстия в плотной упаковке и простые кубические структуры
кубический, объемно-центрированный кубический, шестиугольный с плотнейшей упаковкой и кубический
плотнейшие структуры. Использование большого количества ионных твердых веществ
эти структуры тоже.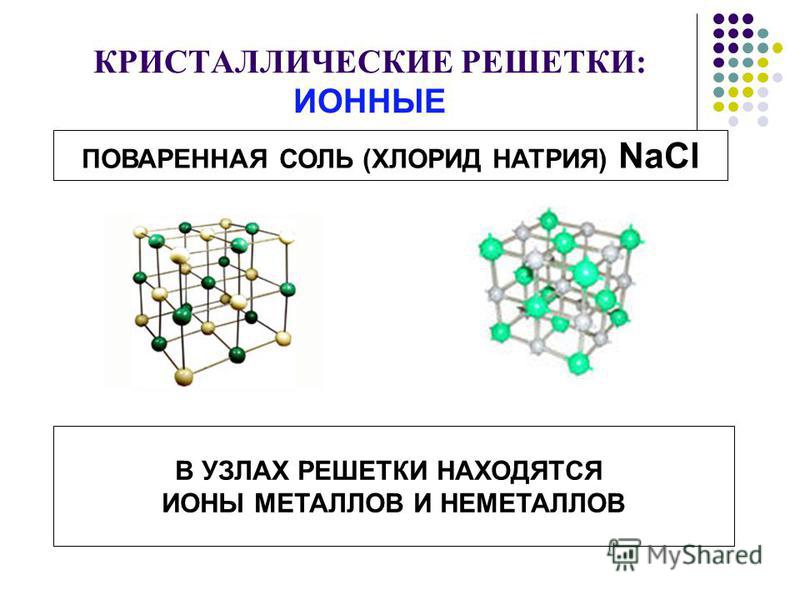
Хлорид натрия (NaCl) и сульфид цинка (ZnS), например, образуют кристаллы, которые можно рассматривать как кубические наиболее плотно упакованные массивы отрицательных ионов (Cl – или S 2-), с положительными ионами (Na + или Zn 2+ ), упакованными в дырки между наиболее плотно упакованными плоскостями отрицательных ионов. Там однако есть тонкое различие между этими структурами, потому что ионы Na + в NaCl упаковываются в разные отверстия от тех, что используются Zn 2+ ионов в ZnS.
В плотно упакованном
структура. Так называемые тетраэдрических отверстия показаны на
рисунок ниже. Сплошные линии на этом рисунке представляют собой одну плоскость
наиболее плотно упакованных атомов. Пунктирные линии обозначают секунду
плоскость атомов, которые упаковываются над отверстиями в первой плоскости.
Каждое из отверстий, отмеченных цифрами t , касается трех атомов в
первой плоскости и один атом во второй плоскости. Их называют
тетраэдрические отверстия, потому что положительные ионы, которые упаковываются в эти отверстия
окружены четырьмя отрицательными ионами, расположенными по углам
тетраэдра.
Их называют
тетраэдрические отверстия, потому что положительные ионы, которые упаковываются в эти отверстия
окружены четырьмя отрицательными ионами, расположенными по углам
тетраэдра.
октаэдрических отверстия в плотнейшей упаковке структура показана на рисунке ниже. Еще раз твердое тело линии представляют собой одну плоскость наиболее плотно упакованных атомов, а пунктирные линии соответствуют второй плоскости, которая упаковывается над отверстиями в первой плоскости. Каждое из отверстий помечено или . касается трех атомов в первой плоскости и трех атомов в второй самолет. Их называют октаэдрическими отверстиями, потому что положительные ионы, которые занимают эти отверстия, окружены шестью отрицательными ионами расположены по углам октаэдра.
Тетраэдрические отверстия очень маленькие. Самый большой
атом, который может вписаться в тетраэдрическую дырку, не искажая
тетраэдр имеет радиус всего в 0,225 раза больше радиуса атомов
которые образуют отверстие. Октаэдрические отверстия почти в два раза больше
четырехгранные отверстия. Самый большой атом, который может поместиться в
октаэдрическое отверстие имеет радиус, в 0,414 раза превышающий радиус атомов
которые образуют отверстие. Относительный размер атомов или ионов,
образуют кристалл, поэтому определяет, является ли он тетраэдрическим или
используются восьмигранные отверстия.
Октаэдрические отверстия почти в два раза больше
четырехгранные отверстия. Самый большой атом, который может поместиться в
октаэдрическое отверстие имеет радиус, в 0,414 раза превышающий радиус атомов
которые образуют отверстие. Относительный размер атомов или ионов,
образуют кристалл, поэтому определяет, является ли он тетраэдрическим или
используются восьмигранные отверстия.
Иногда положительные ионы слишком велики, чтобы их можно было упаковать либо тетраэдрические, либо октаэдрические отверстия в плотноупакованном строение отрицательных ионов. Когда это происходит, отрицательные ионы упаковываются в простую кубическую структуру, а положительные ионы упаковываются в куб. отверстия между плоскостями отрицательных ионов.
Правила соотношения радиусов
Обсуждение тетраэдра, октаэдра и
кубических отверстий в предыдущем разделе предполагает, что структура
ионного твердого тела зависит от относительного размера ионов, которые
образуют твердое тело.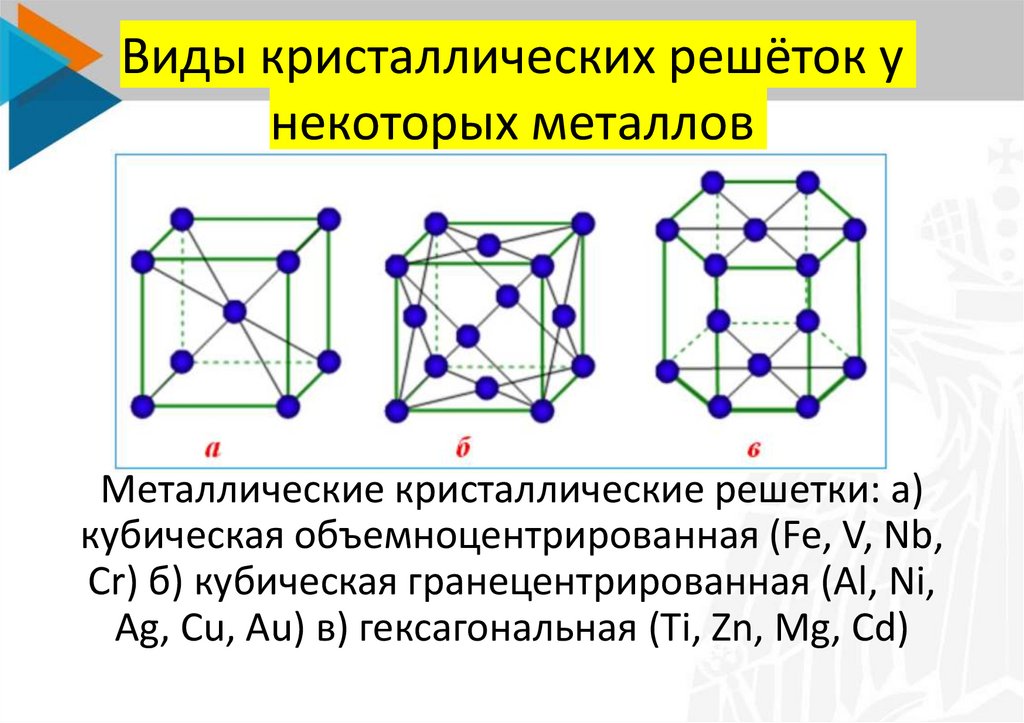 Относительный размер этих ионов дается радиус
отношение , которое представляет собой радиус положительного иона, деленный на
радиус отрицательного иона.
Относительный размер этих ионов дается радиус
отношение , которое представляет собой радиус положительного иона, деленный на
радиус отрицательного иона.
Связь между координационным числом положительных ионов в ионных твердых телах и отношение радиусов ионов приведены в таблице ниже. По мере увеличения отношения радиусов количество отрицательных ионов, которые могут упаковаться вокруг каждого положительного ион увеличивается. Когда отношение радиусов находится между 0,225 и 0,414, Положительные ионы стремятся упаковаться в тетраэдрические дырки между плоскостями отрицательные ионы в кубической или гексагональной плотноупакованной структуре. Когда отношение радиусов находится между 0,414 и 0,732, положительный ионы имеют тенденцию упаковываться в октаэдрические дырки между плоскостями отрицательных ионы в наиболее плотно упакованной структуре.
Правила соотношения радиусов
| Радиус Отношение | Координация Номер | Отверстия, в которых Упаковываются положительные ионы | ||
| 0,225 – 0,414 | 4 | четырехгранные отверстия | ||
| 0,414 – 0,732 | 6 | восьмигранные отверстия | ||
| 0,732 – 1 | 8 | кубических отверстий | ||
| 1 | 12 | плотно упакованная структура |
Из приведенной выше таблицы следует, что четырехгранные отверстия
не используются до тех пор, пока положительный ион не станет достаточно большим, чтобы коснуться всех
четыре отрицательных иона, образующих эту дырку. Как радиус
увеличивается с 0,225 до 0,414, положительный ион искажает
структуру отрицательных ионов к структуре, которая
пуристы могли бы назвать плотно упакованным .
Как радиус
увеличивается с 0,225 до 0,414, положительный ион искажает
структуру отрицательных ионов к структуре, которая
пуристы могли бы назвать плотно упакованным .
Как только положительный ион станет достаточно большим, чтобы коснуться всех шести отрицательных ионов в октаэдрическом отверстии, положительный ионы начинают упаковываться в октаэдрические дырки. Эти отверстия используются пока положительный ион не станет настолько большим, что не сможет поместиться даже в искривленное восьмигранное отверстие.
В конце концов достигнута точка
при котором положительный ион уже не может вписаться ни в
тетраэдрические или октаэдрические отверстия в плотноупакованном кристалле. Когда
отношение радиусов составляет примерно от 0,732 до 1, ионные твердые тела имеют тенденцию
кристаллизоваться в простой кубический массив отрицательных ионов с
положительные ионы, занимающие некоторые или все кубические отверстия между
эти самолеты. Когда отношение радиусов около 1, положительные ионы
могут быть включены непосредственно в позиции
плотно упакованная структура.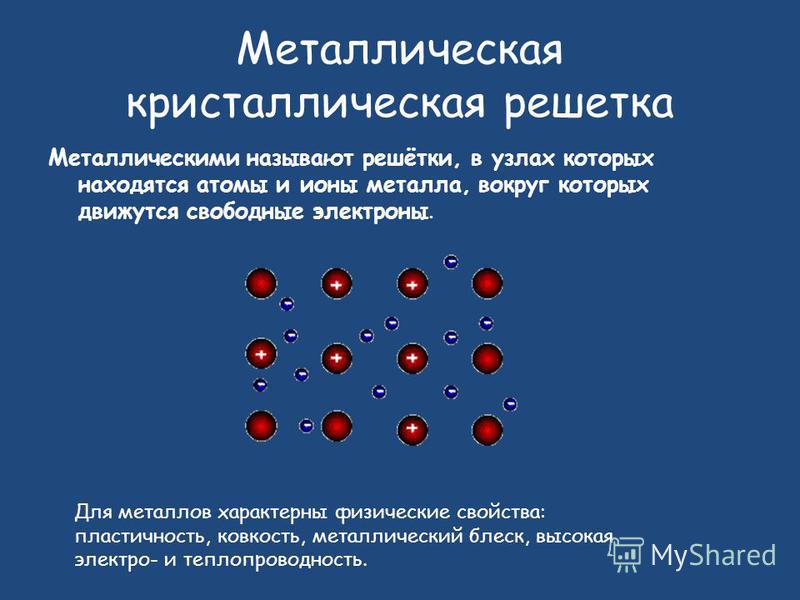
| Практическая задача 1: следующие соединения имеют аналогичные эмпирические формулы. Использовать правила отношения радиусов и таблица ионных радиусов в приложение, чтобы объяснить, почему они имеют разные структуры. (а) NaCl (б) ЦНС (в) CsCl Нажмите здесь, чтобы проверить свой ответ на практическое задание 1 |
На структуру ионных твердых тел также влияет
различия в обилии тетраэдрических и октаэдрических отверстий
в плотноупакованной структуре. Существует столько же октаэдрических
отверстия, так как есть сферы, которые образуют наиболее плотно упакованные
структура. Таким образом, если NaCl представляет собой соль 1:1, в которой Na + ионы занимают октаэдрические отверстия в плотноупакованном массиве Cl – ионов, все октаэдрические дырки в этой структуре должны быть
заполненный.
В два раза больше тетраэдрических отверстий плотно упакованная структура. Ионы Zn 2+ в ZnS поэтому занимают только половину тетраэдрических отверстий в наиболее плотно упакованный массив ионов S 2-.
кристалл | Определение, типы, структура и факты
кристалл
Посмотреть все носители
- Ключевые люди:
- Николаус Стено Ральф Уолтер Грейстоун Вайкофф Макс фон Лауэ Жорж Фридель Торберн Улоф Бергман
- Похожие темы:
- жидкокристаллический плеохроизм двойное преломление симметрия полиморфизм
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
Узнайте, как форма кристаллов определяет различные минералы в семейства
Посмотреть все видео к этой статье кристалл , любой твердый материал, в котором атомы компонентов расположены в определенном порядке и регулярность поверхности которого отражает его внутреннюю симметрию.
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако после проверки определение становится менее простым. Кусочек сливочного масла, например, после хранения в холодильнике становится твердым и явно твердым. Пролежав сутки на кухонном столе, тот же кубик становится довольно мягким, и неясно, следует ли по-прежнему считать масло твердым. Многие кристаллы ведут себя как масло в том смысле, что они тверды при низких температурах, но мягки при более высоких температурах. Они называются твердыми при всех температурах ниже их точки плавления. Возможное определение твердого тела – это объект, который сохраняет свою форму, если его не трогать. Актуальным вопросом является то, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет свою форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы измерения твердых тел
Основными единицами твердых тел являются либо атомы, либо атомы, объединившиеся в молекулы.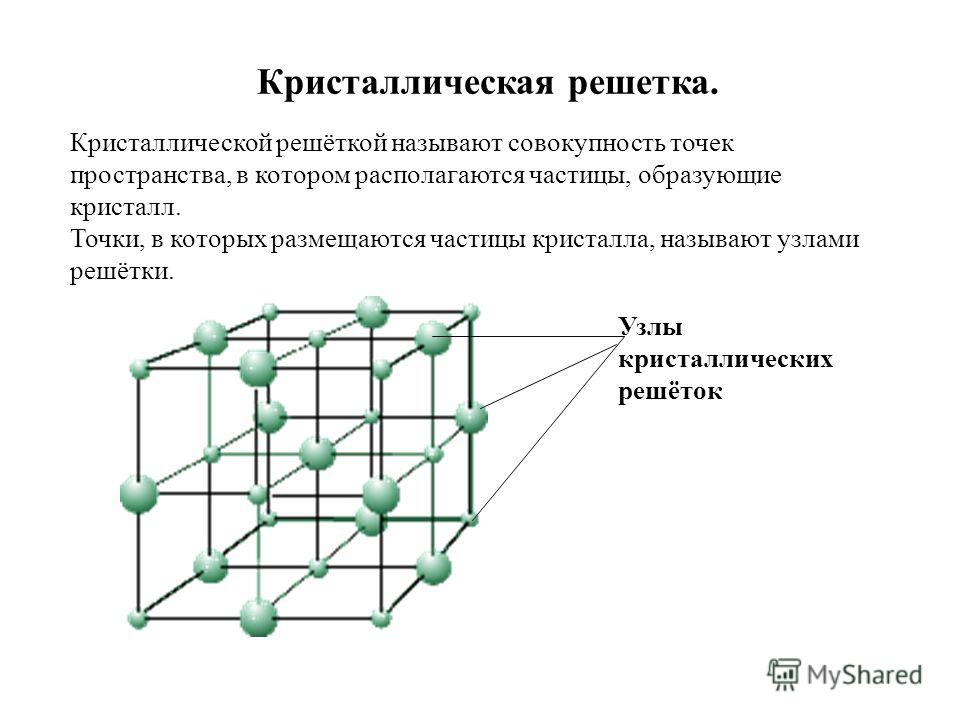 Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Все занятые оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена лишь частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо является магнитом. Ковалентная связь между двумя атомами углерода (C) является самой прочной связью в природе.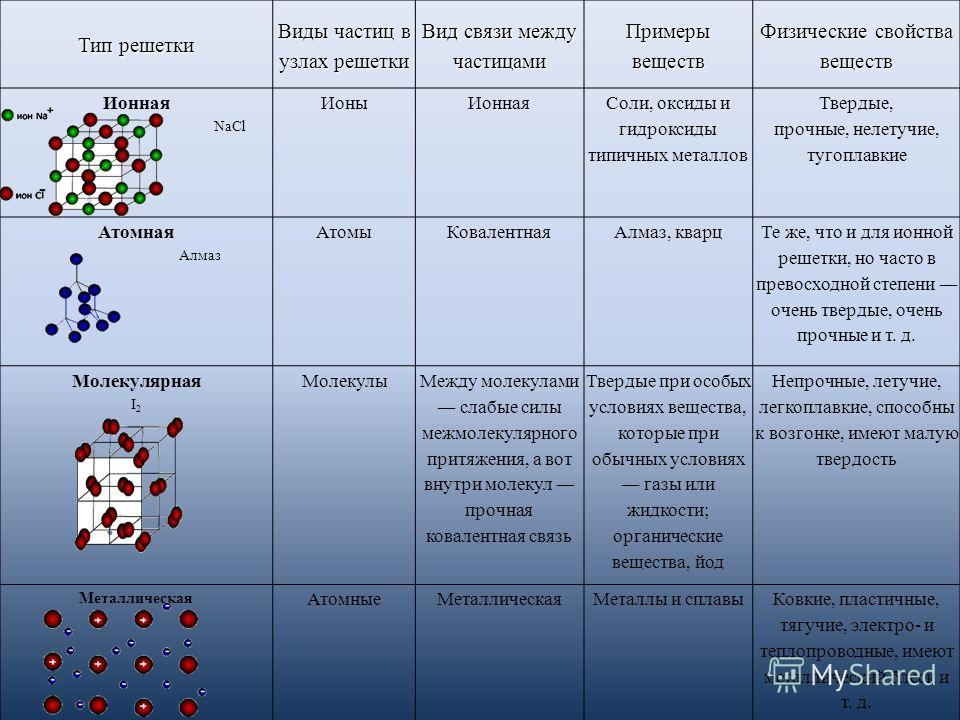 Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом.
Викторина “Британника”
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Твердое тело называется кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, место каждого атома точно известно во всем кристалле. У большинства жидкостей отсутствует дальний порядок, хотя у многих есть ближний порядок. Ближний радиус определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях первые соседние атомы расположены так же, как и в соответствующей твердой фазе. Однако на расстояниях, которые составляют много атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти специальные вещества называются жидкими кристаллами.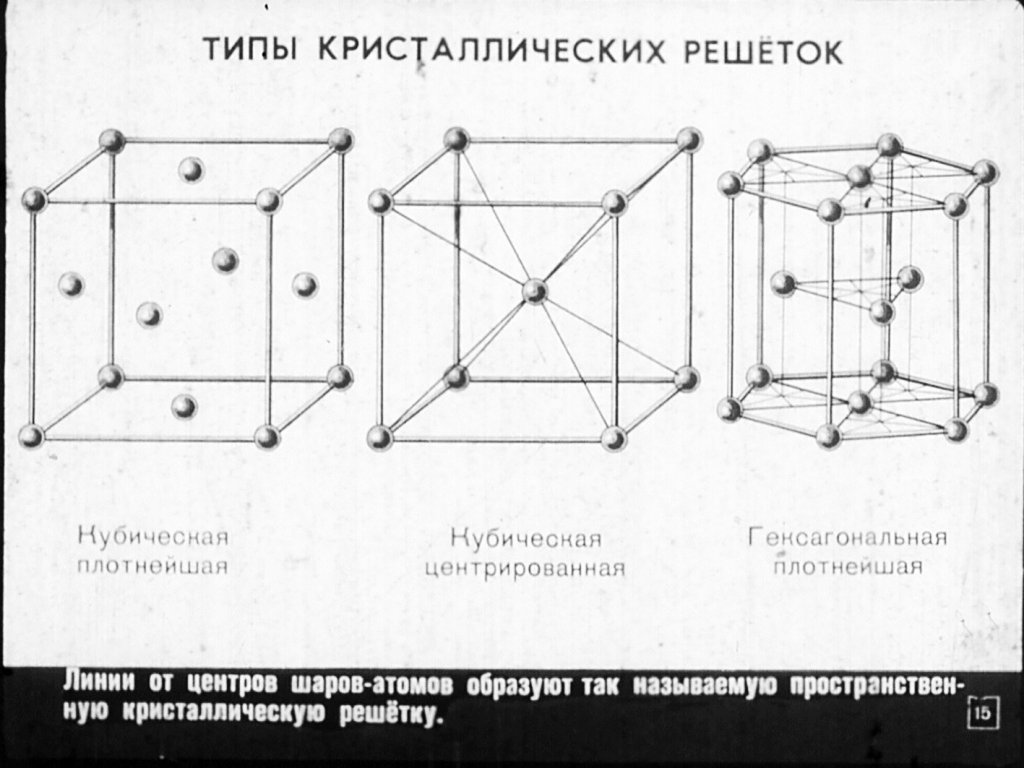 Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, имеющие ближний порядок, но не имеющие дальнего порядка, называются аморфными. Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние оказывается стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей меняются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла. На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и твердые молекулярные вещества. Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.
Монокристалл изолятора обычно прозрачен и напоминает кусок стекла. Металлы блестят, если они не заржавели. Полупроводники иногда блестят, иногда прозрачны, но никогда не ржавеют. Многие кристаллы можно отнести к одному типу твердых тел, в то время как другие имеют промежуточное поведение. Сульфид кадмия (CdS) может быть получен в чистом виде и является отличным изолятором; когда к сульфиду кадмия добавляются примеси, он становится интересным полупроводником. Висмут (Bi) кажется металлом, но количество электронов, доступных для электропроводности, такое же, как и у полупроводников. На самом деле висмут называют полуметаллом. Молекулярные твердые тела обычно представляют собой кристаллы, образованные из молекул или полимеров. Они могут быть изолирующими, полупроводниковыми или металлическими, в зависимости от типа молекул в кристалле. Постоянно синтезируются новые молекулы, и многие из них превращаются в кристаллы. Количество различных кристаллов огромно.
Структура металлов | Инженерная библиотека
На этой странице представлены главы о структуре металлов из «Справочника DOE по основам: материаловедение», DOE-HDBK-1017/1-93, Министерство энергетики США, январь 1993 г.
Другие связанные главы из «Справочника по основам Министерства энергетики: материаловедение» можно увидеть справа.
Склеивание
Расположение атомов в материале определяет поведение и свойства этого материала. Большинство материалов, используемых при строительстве ядерных реакторов, представляют собой металлы. В этой главе мы обсудим различные типы соединений, возникающих в материалах, выбранных для использования в реакторной установке. В Справочнике по химии типы склеивания обсуждаются более подробно.
Атомная связь
Материя, как мы ее знаем, существует в трех обычных состояниях. Эти три состояния – твердое, жидкое и газообразное. Атомные или молекулярные взаимодействия, происходящие внутри вещества, определяют его состояние. В этой главе мы будем иметь дело главным образом с твердыми телами, потому что твердые тела представляют наибольшую проблему в технических приложениях материалов. Жидкости и газы будут упомянуты только в сравнительных целях.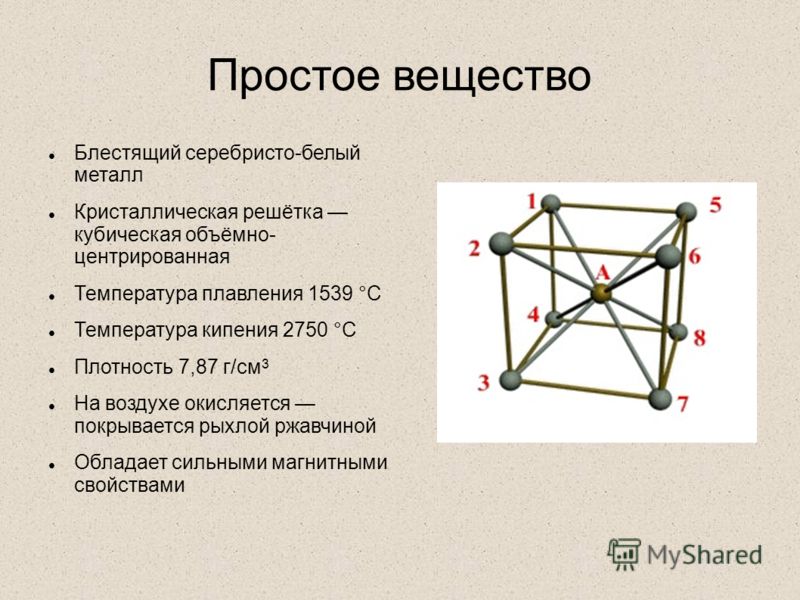
Твердое вещество удерживается вместе силами, возникающими между соседними атомами или молекулами. Эти силы возникают из-за различий в электронных облаках атомов. Другими словами, валентные электроны или электроны внешней оболочки атомов определяют их притяжение к своим соседям. Когда физическое притяжение между молекулами или атомами материала велико, материал плотно удерживается вместе. Молекулы в твердых телах тесно связаны друг с другом. Когда притяжение слабее, вещество может быть в жидкой форме и свободно течь. Газы практически не проявляют сил притяжения между атомами или молекулами, и их частицы могут свободно двигаться независимо друг от друга.
Типы связей в материале определяются тем, как силы удерживают материю вместе. Рисунок 1 иллюстрирует несколько типов облигаций, а их характеристики перечислены ниже.
- Ионная связь. В этом типе связи один или несколько электронов полностью передаются от атома одного элемента к атому другого, и элементы удерживаются вместе силой притяжения из-за противоположной полярности заряда.

- Ковалентная связь – связь, образованная общими электронами. Электроны являются общими, когда атому нужны электроны для завершения его внешней оболочки, и он может поделиться этими электронами со своим соседом. Тогда электроны входят в состав обоих атомов, и обе оболочки заполнены.
- Металлическая связь. В этом типе связи атомы не обмениваются электронами и не обмениваются электронами для связи друг с другом. Вместо этого многие электроны (примерно по одному на каждый атом) могут более или менее свободно перемещаться по металлу, так что каждый электрон может взаимодействовать со многими неподвижными атомами.
- Молекулярная связь. Когда электроны нейтральных атомов проводят больше времени в одной области своей орбиты, будет существовать временный слабый заряд. Молекула будет слабо притягивать другие молекулы. Это иногда называют ван-дер-ваальсовыми или молекулярными связями.
- Водородная связь. Эта связь похожа на молекулярную связь и возникает из-за легкости, с которой атомы водорода готовы отдать электрон атомам кислорода, фтора или азота.

Некоторые примеры материалов и их связей указаны в таблице 1.
| Материал | Бонд |
|---|---|
| Хлорид натрия | Ионный |
| Алмаз | Ковалентный |
| Натрий | Металлик |
| Сплошной H 2 | Молекулярный |
| Лед | Водород |
Тип связи определяет не только то, насколько хорошо материал удерживается вместе, но и то, какими микроскопическими свойствами обладает материал. Такие свойства, как способность проводить тепло или электрический ток, определяются свободой движения электронов. Это зависит от типа существующей связи. Знание микроскопической структуры материала позволяет нам предсказать, как этот материал будет вести себя в определенных условиях. И наоборот, материал может быть синтетически изготовлен с заданной микроскопической структурой, чтобы получить свойства, желательные для определенных технических приложений.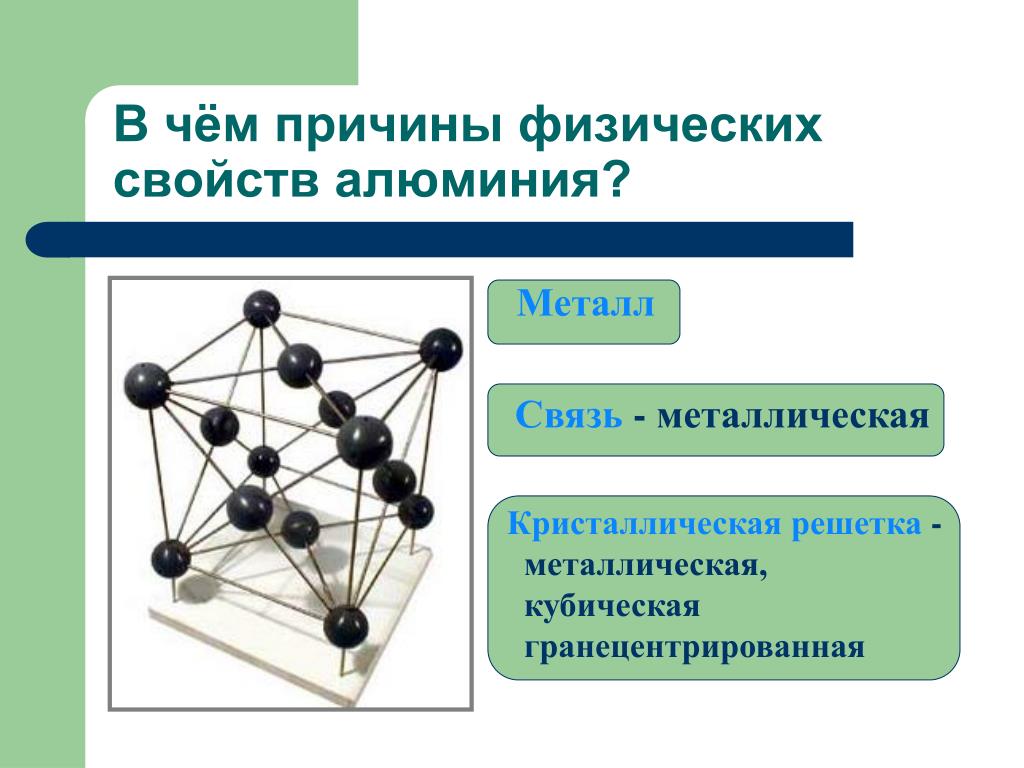
Порядок в микроструктурах
Твердые тела имеют большее межатомное притяжение, чем жидкости и газы. Однако существуют большие различия в свойствах твердых материалов, используемых в технических целях. Свойства материалов зависят от их межатомных связей. Эти же связи также определяют пространство между конфигурацией атомов в твердых телах. Все твердые тела можно разделить на аморфные и кристаллические.
Аморфный
Аморфные материалы не имеют регулярного расположения своих молекул. Такие материалы, как стекло и парафин, считаются аморфными. Аморфные материалы обладают свойствами твердых тел. Они имеют определенную форму и объем и медленно диффундируют. У этих материалов также отсутствуют четко определенные температуры плавления. Во многом они напоминают жидкости, которые очень медленно текут при комнатной температуре.
Кристаллический
В кристаллической структуре атомы расположены в трехмерном массиве, называемом решеткой. Решетка имеет правильную повторяющуюся конфигурацию во всех направлениях. Группа частиц из одной части кристалла находится в точно таком же геометрическом отношении, что и группа из любой другой части того же кристалла.
Решетка имеет правильную повторяющуюся конфигурацию во всех направлениях. Группа частиц из одной части кристалла находится в точно таком же геометрическом отношении, что и группа из любой другой части того же кристалла.
У нас есть несколько структурных калькуляторов на выбор. Здесь только несколько:
- Калькулятор луча
- Калькулятор болтовых соединений
- Распределение силы болтового соединения
- Калькулятор зажимов
- Калькулятор потери устойчивости колонны
- Калькулятор роста усталостной трещины
Общие типы решеток
Все металлы, используемые в реакторе, имеют кристаллическую структуру. Кристаллические микроструктуры организованы в виде трехмерных массивов, называемых решетками. В этой главе будут обсуждаться три наиболее распространенные решетчатые структуры и их характеристики.
Общие кристаллические структуры
В металлах и во многих других твердых телах атомы расположены в виде правильных рядов, называемых кристаллами. Кристаллическая структура состоит из атомов, расположенных по образцу, который периодически повторяется в трехмерной геометрической решетке. Силы химической связи вызывают это повторение. Именно этот повторяющийся шаблон определяет такие свойства, как прочность, пластичность, плотность (описанную в Модуле 2 «Свойства металлов»), проводимость (свойство проводить или передавать тепло, электричество и т. д.) и форму.
Кристаллическая структура состоит из атомов, расположенных по образцу, который периодически повторяется в трехмерной геометрической решетке. Силы химической связи вызывают это повторение. Именно этот повторяющийся шаблон определяет такие свойства, как прочность, пластичность, плотность (описанную в Модуле 2 «Свойства металлов»), проводимость (свойство проводить или передавать тепло, электричество и т. д.) и форму.
В целом, тремя наиболее распространенными основными структурами кристаллов, связанными с металлами, являются: (а) объемно-центрированная кубическая, (б) гранецентрированная кубическая и (в) гексагональная плотноупакованная. На рис. 2 показаны эти три шаблона.
Рис. 2: Распространенные типы решетокОбъемно-центрированная кубическая
В объемно-центрированном кубическом (ОЦК) расположении атомов элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре тела куба.
Гранецентрированный куб
В гранецентрированном кубическом расположении атомов (FCC) элементарная ячейка состоит из восьми атомов в углах куба и одного атома в центре каждой из граней куба.
Шестигранник В закрытой упаковке
В гексагональной плотноупакованной конфигурации (HCP) атомов элементарная ячейка состоит из трех слоев атомов. Верхний и нижний слои содержат по шесть атомов в углах шестиугольника и по одному атому в центре каждого шестиугольника. Средний слой содержит три атома, расположенные между атомами верхнего и нижнего слоев, отсюда и название плотная упаковка.
Большинство диаграмм структурных ячеек для ОЦК и ГЦК форм железа нарисованы так, как если бы они были одного размера, как показано на рисунке 2, но это не так. В схеме ОЦК структурная ячейка, в которой используются всего девять атомов, намного меньше.
Такие металлы, как α-железо (Fe) (феррит), хром (Cr), ванадий (V), молибден (Mo) и вольфрам (W), обладают структурой ОЦК. Эти металлы ОЦК обладают двумя общими свойствами: высокой прочностью и низкой пластичностью (что допускает остаточную деформацию). Металлы FCC, такие как γ-железо (Fe) (аустенит), алюминий (Al), медь (Cu), свинец (Pb), серебро (Ag), золото (Au), никель (Ni), платина (Pt) и торий (Th), как правило, имеют более низкую прочность и более высокую пластичность, чем металлы ОЦК.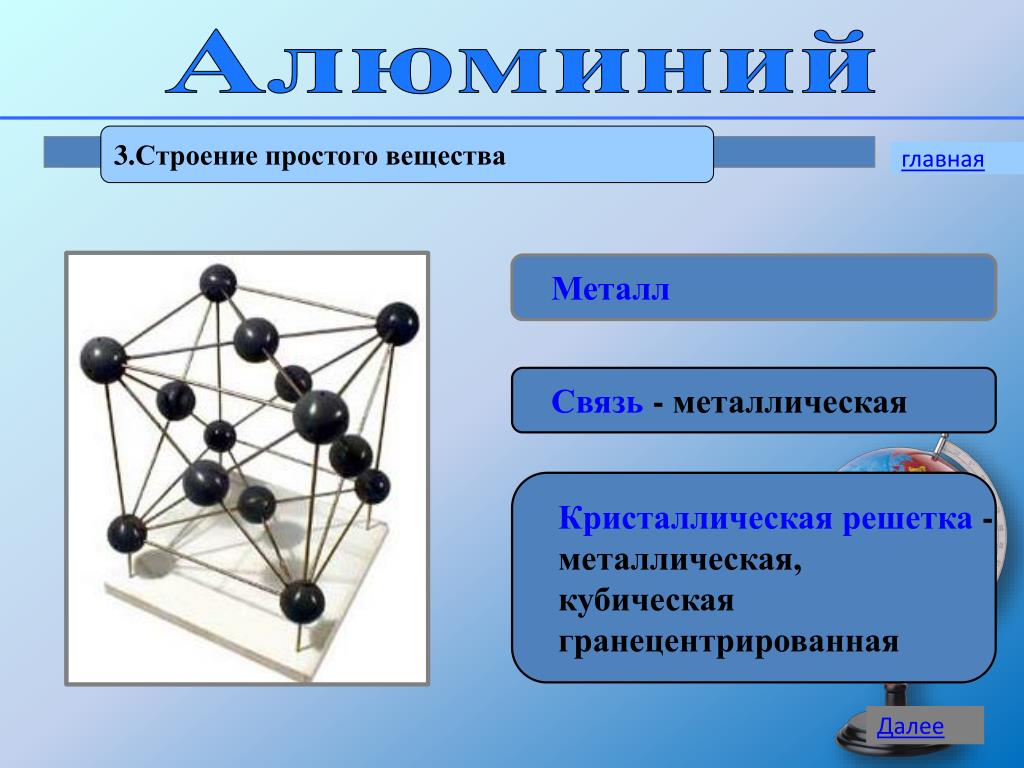 ГПУ-структуры обнаружены в бериллии (Be), магнии (Mg), цинке (Zn), кадмии (Cd), кобальте (Co), таллии (Tl) и цирконии (Zr).
ГПУ-структуры обнаружены в бериллии (Be), магнии (Mg), цинке (Zn), кадмии (Cd), кобальте (Co), таллии (Tl) и цирконии (Zr).
Зернистая структура и границы
Металлы содержат зерна и кристаллические структуры. Человеку нужен микроскоп, чтобы увидеть зерна и кристаллические структуры. Зерна и границы зерен помогают определить свойства материала.
Зернистая структура и границы
Если бы вы взяли небольшой срез обычного металла и исследовали его под микроскопом, вы бы увидели структуру, подобную той, что показана на рис. 3(а). Каждая из светлых областей называется зерном, или кристаллом, то есть областью пространства, занятой сплошной кристаллической решеткой. Темные линии, окружающие зерна, являются границами зерен. Структура зерна относится к расположению зерен в металле, при этом зерно имеет определенную кристаллическую структуру.
Граница зерна относится к внешней области зерна, которая отделяет его от других зерен. Граница зерна представляет собой область несоответствия между зернами и обычно имеет ширину от одного до трех атомов. Границы зерен разделяют разноориентированные области кристаллов (поликристаллические), в которых кристаллическая структура идентична. На рис. 3(б) представлены четыре зерна разной ориентации и границы зерен, возникающие на границах раздела между зернами.
Границы зерен разделяют разноориентированные области кристаллов (поликристаллические), в которых кристаллическая структура идентична. На рис. 3(б) представлены четыре зерна разной ориентации и границы зерен, возникающие на границах раздела между зернами.
Очень важной характеристикой металла является средний размер зерна. Размер зерна определяет свойства металла. Например, меньший размер зерна увеличивает прочность на растяжение и имеет тенденцию к увеличению пластичности. Более крупный размер зерна предпочтителен для улучшения характеристик ползучести при высоких температурах. Ползучесть – это постоянная деформация, увеличивающаяся со временем при постоянной нагрузке или напряжении. Ползучесть становится все легче с повышением температуры. Напряжение и деформация рассматриваются в Модуле 2, Свойства металлов, а ползучесть рассматривается в Модуле 5, Растительные материалы.
Рисунок 3: Зерна и границы(а) микроскопический (б) атомный
Еще одним важным свойством зерен является их ориентация. На рис. 4(а) представлено случайное расположение зерен, при котором ни одно направление внутри зерен не совпадает с внешними границами металлического образца. Эта случайная ориентация может быть получена путем поперечной прокатки материала. Если такой образец достаточно прокатать в одном направлении, в нем может образоваться ориентированная по зерну структура в направлении прокатки, как показано на рис. 4(b). Это называется предпочтительной ориентацией. Во многих случаях предпочтительная ориентация очень желательна, но в других случаях она может быть очень вредной. Например, предпочтительная ориентация урановых топливных элементов может привести к катастрофическим изменениям размеров при использовании в ядерном реакторе.
На рис. 4(а) представлено случайное расположение зерен, при котором ни одно направление внутри зерен не совпадает с внешними границами металлического образца. Эта случайная ориентация может быть получена путем поперечной прокатки материала. Если такой образец достаточно прокатать в одном направлении, в нем может образоваться ориентированная по зерну структура в направлении прокатки, как показано на рис. 4(b). Это называется предпочтительной ориентацией. Во многих случаях предпочтительная ориентация очень желательна, но в других случаях она может быть очень вредной. Например, предпочтительная ориентация урановых топливных элементов может привести к катастрофическим изменениям размеров при использовании в ядерном реакторе.
(a) Случайная (b) Предпочтительная
У нас есть несколько структурных калькуляторов на выбор. Здесь только несколько:
- Калькулятор луча
- Калькулятор болтовых соединений
- Распределение силы болтового соединения
- Калькулятор зажимов
- Калькулятор потери устойчивости колонны
- Калькулятор роста усталостной трещины
Полиморфизм
Металлы могут существовать более чем в одной форме одновременно.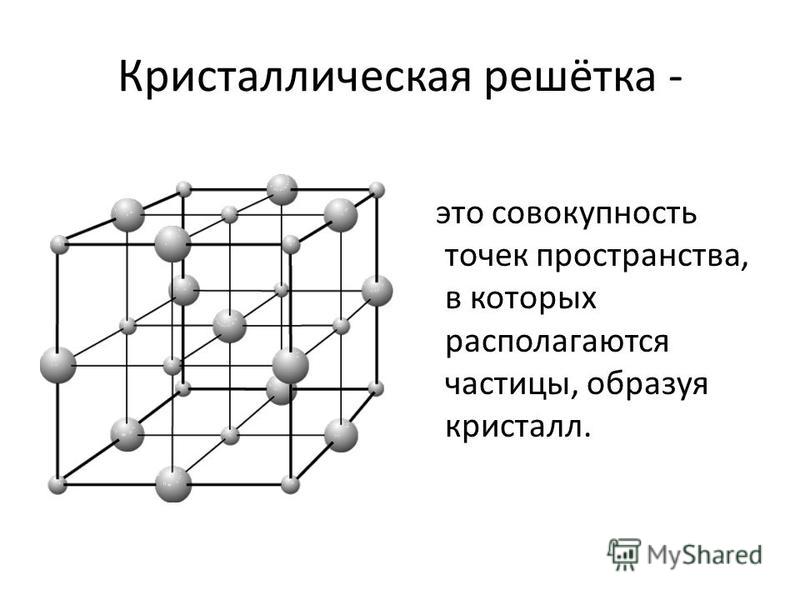 В этой главе мы обсудим это свойство металлов.
В этой главе мы обсудим это свойство металлов.
Фазы полиморфизма
Полиморфизм — это свойство или способность металла существовать в двух или более кристаллических формах в зависимости от температуры и состава. Этим свойством обладают большинство металлов и металлических сплавов. Уран — хороший пример металла, проявляющего полиморфизм. Металлический уран может существовать в трех различных кристаллических структурах. Каждая структура существует на определенной фазе, как показано на рисунке 5.
- Альфа-фаза, от комнатной температуры до 663°C
- Бета-фаза, от 663°C до 764°C
- Гамма-фаза, от 764°С до точки плавления 1133°С.
Альфа-фаза
Альфа-фаза (α) стабильна при комнатной температуре и имеет кристаллическую систему, характеризующуюся тремя неравными осями, расположенными под прямым углом.
В альфа-фазе свойства решетки различны по осям X, Y и Z. Это связано с тем, что регулярно повторяющееся состояние атомов отличается.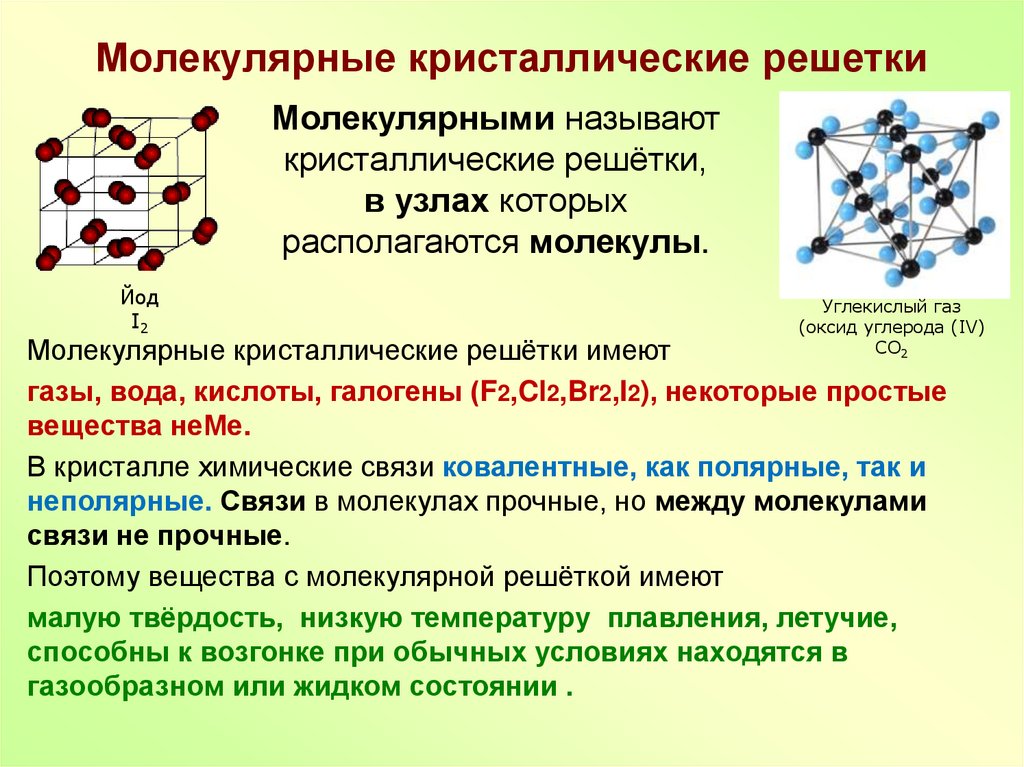 Из-за этого условия при нагревании фаза расширяется в направлениях X и Z и сжимается в направлении Y. На рис. 6 показано, что происходит с размерами (Å = ангстрем, одна стомиллионная сантиметра) элементарной ячейки альфа-урана при нагревании.
Из-за этого условия при нагревании фаза расширяется в направлениях X и Z и сжимается в направлении Y. На рис. 6 показано, что происходит с размерами (Å = ангстрем, одна стомиллионная сантиметра) элементарной ячейки альфа-урана при нагревании.
Как показано, нагревание и охлаждение альфа-фазы урана может привести к резкому изменению размеров и грубым искажениям металла. Таким образом, чистый уран не используется в качестве топлива, а только в сплавах или соединениях.
Рисунок 6: Изменение содержания альфа-урана при нагревании от 0 до 300 °CБета-фаза
Бета (β) фаза урана возникает при повышенных температурах. Эта фаза имеет тетрагональную (четыре угла и четыре стороны) структуру решетки и является достаточно сложной.
Гамма Фаза
Гамма (γ) фаза урана образуется при температурах выше тех, которые необходимы для стабильности бета фазы. В гамма-фазе структура решетки ОЦК и при нагревании расширяется одинаково во все стороны.
Дополнительные примеры
Два дополнительных примера полиморфизма перечислены ниже.
- Нагрев железа до 907°C вызывает переход железа из ОЦК (альфа, феррит) в форму ГЦК (гамма, аустенит).
- Цирконий находится в ГПУ (альфа) до 863°С, где он переходит в ОЦК (бета, цирконий) форму.
Свойства одной полиморфной формы одного и того же металла будут отличаться от свойств другой полиморфной формы. Например, гамма-железо может растворять до 1,7% углерода, тогда как альфа-железо может растворять только 0,03%.
Сплавы
Большинство материалов, используемых в проектировании конструкций или производстве компонентов, представляют собой металлы. Легирование является обычной практикой, поскольку металлические связи позволяют соединять различные типы металлов.
Сплавы
Сплав представляет собой смесь двух или более материалов, по крайней мере один из которых является металлом. Сплавы могут иметь микроструктуру, состоящую из твердых растворов, где вторичные атомы вводятся в кристаллическую решетку в качестве замещающих или внедренных атомов (более подробно обсуждаются в следующей главе и Модуле 5, Растительные материалы). Сплав также может быть кристаллом с металлическим соединением в каждой точке решетки. Кроме того, сплавы могут состоять из вторичных кристаллов, внедренных в первичную поликристаллическую матрицу. Этот тип сплава называется композитным (хотя термин «композитный» не обязательно означает, что составные материалы представляют собой металлы). Модуль 2, Свойства металлов, обсуждает, как различные элементы изменяют физические свойства металла.
Сплав также может быть кристаллом с металлическим соединением в каждой точке решетки. Кроме того, сплавы могут состоять из вторичных кристаллов, внедренных в первичную поликристаллическую матрицу. Этот тип сплава называется композитным (хотя термин «композитный» не обязательно означает, что составные материалы представляют собой металлы). Модуль 2, Свойства металлов, обсуждает, как различные элементы изменяют физические свойства металла.
Общие характеристики сплавов
Сплавы обычно прочнее чистых металлов, хотя обычно обладают меньшей электропроводностью и теплопроводностью. Прочность – важнейший критерий, по которому оценивают многие конструкционные материалы. Поэтому сплавы используются для машиностроения. Сталь, вероятно, самый распространенный конструкционный металл, является хорошим примером сплава. Это сплав железа и углерода с другими элементами, придающими ему определенные желаемые свойства.
Как упоминалось в предыдущей главе, иногда материал может состоять из нескольких твердых фаз. Прочность этих материалов повышается за счет того, что твердая структура становится формой, состоящей из двух перемежающихся фаз. Когда рассматриваемый материал представляет собой сплав, можно закалить (более подробно обсуждается в Модуле 2, Свойства металлов) металл из расплавленного состояния с образованием вкрапленных фаз. Вид и скорость закалки определяют конечную структуру твердого тела и, следовательно, его свойства.
Прочность этих материалов повышается за счет того, что твердая структура становится формой, состоящей из двух перемежающихся фаз. Когда рассматриваемый материал представляет собой сплав, можно закалить (более подробно обсуждается в Модуле 2, Свойства металлов) металл из расплавленного состояния с образованием вкрапленных фаз. Вид и скорость закалки определяют конечную структуру твердого тела и, следовательно, его свойства.
Нержавеющая сталь типа 304
Нержавеющая сталь типа 304 (содержащая 18-20% хрома и 8-10,5% никеля) используется в резервуарах реакторов для производства трития, трубопроводах технологической воды и оригинальных технологических теплообменниках. Этот сплав устойчив к большинству видов коррозии.
Состав обычных технических материалов
Большое разнообразие конструкций, систем и компонентов, используемых на ядерных объектах Министерства энергетики США, изготовлено из самых разных материалов. Многие материалы представляют собой сплавы с основным металлом из железа, никеля или циркония.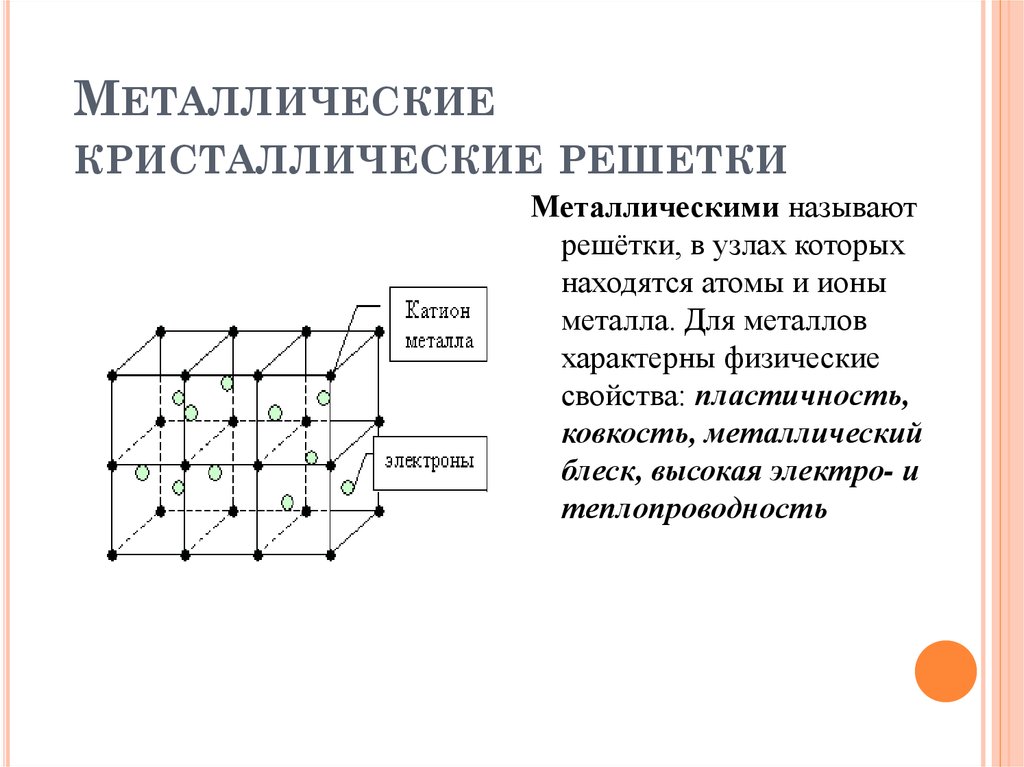 Выбор материала для конкретного применения основан на многих факторах, включая температуру и давление, которым будет подвергаться материал, устойчивость материала к определенным типам коррозии, ударную вязкость и твердость материала, а также другие свойства материала.
Выбор материала для конкретного применения основан на многих факторах, включая температуру и давление, которым будет подвергаться материал, устойчивость материала к определенным типам коррозии, ударную вязкость и твердость материала, а также другие свойства материала.
Одним из материалов, который имеет широкое применение в системах объектов Министерства энергетики, является нержавеющая сталь. Существует около 40 стандартных типов нержавеющей стали и множество других специализированных типов под различными торговыми названиями. Благодаря модификации видов и количеств легирующих элементов сталь можно адаптировать для конкретных применений. Нержавеющие стали классифицируются как аустенитные или ферритные в зависимости от их структуры решетки. Аустенитные нержавеющие стали, в том числе 304 и 316, имеют гранецентрированную кубическую структуру атомов железа с углеродом в твердом растворе внедрения. Ферритные нержавеющие стали, включая тип 405, имеют объемно-центрированную кубическую железную решетку и не содержат никеля. Ферритные стали легче сваривать и изготавливать, они менее подвержены коррозионному растрескиванию под напряжением, чем аустенитные нержавеющие стали. Они обладают лишь умеренной устойчивостью к другим типам химического воздействия.
Ферритные стали легче сваривать и изготавливать, они менее подвержены коррозионному растрескиванию под напряжением, чем аустенитные нержавеющие стали. Они обладают лишь умеренной устойчивостью к другим типам химического воздействия.
Другими металлами, которые имеют особое применение на некоторых ядерных объектах Министерства энергетики, являются инконель и циркалой. Состав этих металлов и различных типов нержавеющей стали указан в Таблице 2 ниже.
| %Fe | %С Макс. | %Cr | %Ni | % Мо | %Mn Макс. | %Si Макс. | %Zr | |
|---|---|---|---|---|---|---|---|---|
| Нержавеющая сталь 304 | Бал. | 0,08 | 19 | 10 | 2 | 1 | ||
| Нержавеющая сталь 304L | Бал. | 0,03 | 18 | 8 | 2 | 1 | ||
| Нержавеющая сталь 316 | Бал. | 0,08 | 17 | 12 | 2,5 | 2 | 1 | |
| Нержавеющая сталь 316L | Бал. | 0,03 | 17 | 12 | 2,5 | 2 | ||
| 405 Нержавеющая сталь | Бал. | 0,08 | 13 | 1 | 1 | |||
| Инконель | 8 | 0,15 | 15 | Бал. | 1 | 0,5 | ||
| Циркалой-4 | 0,21 | 0,1 | Бал. |
У нас есть несколько структурных калькуляторов на выбор. Здесь только несколько:
- Калькулятор луча
- Калькулятор болтовых соединений
- Распределение силы болтового соединения
- Калькулятор зажимов
- Калькулятор потери устойчивости колонны
- Калькулятор роста усталостной трещины
Дефекты металлов
Обсуждение порядка в микроструктурах в предыдущих главах предполагало идеализированные микроструктуры.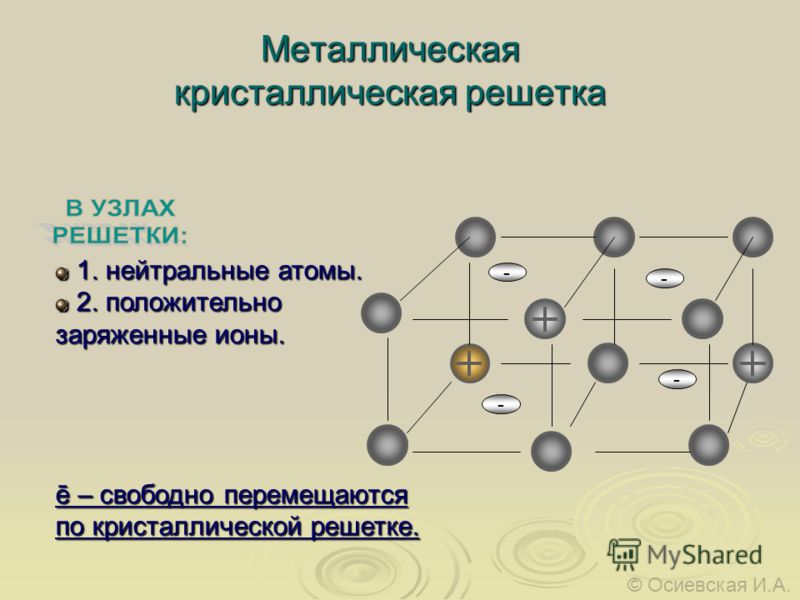 В действительности материалы не состоят из идеальных кристаллов и не свободны от примесей, изменяющих их свойства. Даже аморфные твердые тела имеют несовершенства и примеси, которые изменяют их структуру.
В действительности материалы не состоят из идеальных кристаллов и не свободны от примесей, изменяющих их свойства. Даже аморфные твердые тела имеют несовершенства и примеси, которые изменяют их структуру.
Микроскопические дефекты
Микроскопические дефекты обычно классифицируются как точечные, линейные или межфазные дефекты.
- Точечные несовершенства имеют атомарные размеры.
- Линейные несовершенства или дислокации обычно имеют длину в несколько атомов.
- Межфазные дефекты больше, чем линейные дефекты, и возникают в двумерной области.
Точечные дефекты
Точечные дефекты в кристаллах можно разделить на три основные категории дефектов. Они показаны на рисунке 7.
- Вакансионные дефекты возникают из-за отсутствия атома в позиции решетки. Дефект вакансионного типа может возникать из-за несовершенной упаковки в процессе кристаллизации или из-за повышенных тепловых колебаний атомов, вызванных повышенной температурой.

- Дефекты замещения возникают из-за примеси, присутствующей в положении решетки.
Дефекты внедрения возникают из-за примеси, расположенной в междоузлии, или из-за того, что один из атомов решетки находится в междоузельном положении, а не в его положении в решетке. Междоузлие относится к местам между атомами в структуре решетки.
Примеси внедрения, называемые модификаторами сетки, действуют как точечные дефекты в аморфных твердых телах. Наличие точечных дефектов может увеличить или уменьшить ценность материала для инженерного строительства в зависимости от предполагаемого использования.
Линейные дефекты
Линейные дефекты называются дислокациями и встречаются только в кристаллических материалах. Дислокации могут быть краевого, винтового или смешанного типа, в зависимости от того, как они искажают решетку, как показано на рис. 8. Важно отметить, что дислокации не могут заканчиваться внутри кристалла. Они должны заканчиваться на краю кристалла или другом дислокации, или же они должны замкнуться сами на себя.
Они должны заканчиваться на краю кристалла или другом дислокации, или же они должны замкнуться сами на себя.
Краевые дислокации состоят из дополнительного ряда или плоскости атомов в кристаллической структуре. Несовершенство может проходить по прямой линии через весь кристалл или идти по неправильной траектории. Он также может быть коротким, простираясь лишь на небольшое расстояние вглубь кристалла, вызывая скольжение на одно атомное расстояние вдоль плоскости скольжения (направление движения краевого дефекта).
Рисунок 8: Линейные дефекты (дислокации) Скольжение происходит, когда кристалл подвергается напряжению, и дислокация движется через кристалл, пока не достигнет края или не будет остановлена другой дислокацией, как показано на рисунке 9.. Позиция 1 показывает нормальную кристаллическую структуру. Позиция 2 показывает силу, приложенную с левой стороны, и противодействующую силу, приложенную с правой стороны. Позиции с 3 по 5 показывают, как конструкция проскальзывает. Позиция 6 показывает окончательную деформированную кристаллическую структуру. Скольжение одной активной плоскости обычно составляет порядка 1000 атомных расстояний, и для получения текучести требуется скольжение по многим плоскостям.
Позиция 6 показывает окончательную деформированную кристаллическую структуру. Скольжение одной активной плоскости обычно составляет порядка 1000 атомных расстояний, и для получения текучести требуется скольжение по многим плоскостям.
Винтовые дислокации могут быть вызваны разрывом кристалла параллельно направлению скольжения. Если проследить за винтовой дислокацией по всей цепи, она покажет схему скольжения, подобную той, что имеет винтовая резьба. Рисунок может быть как левым, так и правым. Это требует, чтобы некоторые из атомных связей непрерывно переформировывались, так что кристалл после разрушения имеет почти ту же форму, что и раньше.
Ориентация дислокаций может варьироваться от чисто краевой до чисто винтовой. В какой-то промежуточной точке они могут обладать как краевыми, так и винтовыми характеристиками. Важность дислокаций основана на легкости, с которой они могут перемещаться по кристаллам.
Межфазные дефекты
Межфазные дефекты существуют под углом между любыми двумя гранями кристалла или кристаллической формы. Эти дефекты обнаруживаются на свободных поверхностях, границах доменов, границах зерен или межфазных границах. Свободные поверхности являются границами между газами и твердыми телами. Границы доменов относятся к интерфейсам, где электронные структуры различны с обеих сторон, что приводит к тому, что каждая сторона действует по-разному, хотя с обеих сторон существует одно и то же атомное расположение. Границы зерен существуют между кристаллами с одинаковой структурой решетки, которые обладают различной пространственной ориентацией. Поликристаллические материалы состоят из множества зерен, разделенных расстоянием, обычно составляющим несколько атомных диаметров. Наконец, межфазные границы существуют между областями, где материалы находятся в разных фазах (т. е. ОЦК рядом с ГЦК-структурами).
Эти дефекты обнаруживаются на свободных поверхностях, границах доменов, границах зерен или межфазных границах. Свободные поверхности являются границами между газами и твердыми телами. Границы доменов относятся к интерфейсам, где электронные структуры различны с обеих сторон, что приводит к тому, что каждая сторона действует по-разному, хотя с обеих сторон существует одно и то же атомное расположение. Границы зерен существуют между кристаллами с одинаковой структурой решетки, которые обладают различной пространственной ориентацией. Поликристаллические материалы состоят из множества зерен, разделенных расстоянием, обычно составляющим несколько атомных диаметров. Наконец, межфазные границы существуют между областями, где материалы находятся в разных фазах (т. е. ОЦК рядом с ГЦК-структурами).
Макроскопические дефекты
Трехмерные макроскопические дефекты называются объемными дефектами. Обычно они встречаются в гораздо большем масштабе, чем микроскопические дефекты. Эти макроскопические дефекты обычно вносятся в материал во время очистки от его исходного состояния или в процессе изготовления.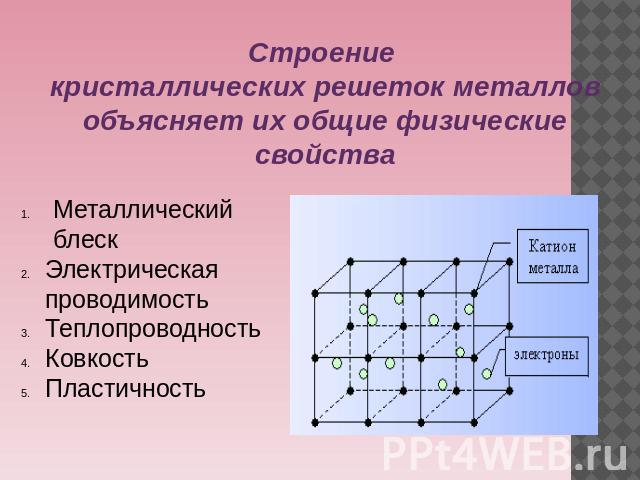
Наиболее распространенный объемный дефект возникает из-за включения посторонних частиц в основной материал. Эти частицы второй фазы, называемые включениями, редко нужны, потому что они значительно изменяют структурные свойства. Примером включения могут быть частицы оксида в чистом металле или немного глины в структуре стекла.
Другие объемные дефекты включают газовые карманы или усадочные полости, которые обычно встречаются в отливках. Эти промежутки ослабляют материал и поэтому защищаются от них во время изготовления. Обработка и ковка металлов могут вызывать трещины, которые действуют как концентраторы напряжений и ослабляют материал. Любые дефекты сварки или соединения также могут быть классифицированы как объемные дефекты.
PDH Classroom предлагает курс повышения квалификации, основанный на этой справочной странице структуры металлов. Этот курс можно использовать для выполнения кредитных требований PDH для поддержания вашей лицензии PE.
Теперь, когда вы прочитали эту справочную страницу, заработайте за это признание!
Просмотреть курс сейчас:
Просмотреть курс
Стандарты и свойства: металлургия сплавов на основе меди
Уильям Д. Нильсен-младший
Нильсен-младший
Western Reserve Manufacturing Co., Inc.
На основные свойства медных сплавов в значительной степени влияют свойства самой меди. Известно, что медь обладает определенными уникальными качествами, которые делают ее лучшим конструкционным материалом для подшипников. Это:
- Высокая теплопроводность
- Отличная пластичность и ударная вязкость в широком диапазоне температур
- Отличная коррозионная стойкость во многих различных средах
Атомная структура меди
Все три вышеуказанных качества напрямую связаны со структурой и поведением структуры меди в атомарном масштабе.
Рис. 1. Модель гранецентрированной кубической кристаллической структуры меди с одной элементарной ячейкой. Расстояние между центрами угловых атомов составляет 3,6 ангстрем (ссылка 1).
Атом меди очень похож на атом золота или серебра, которые вместе с медью составляют группу в периодической таблице элементов. Все знают об отличной электропроводности меди, которая является результатом атомной структуры меди. Внутри решетки атома меди облако свободных электронов уникально доступно для передачи электрического тока. Это же облако электронов также способствует эффективной передаче тепловой энергии.
Все знают об отличной электропроводности меди, которая является результатом атомной структуры меди. Внутри решетки атома меди облако свободных электронов уникально доступно для передачи электрического тока. Это же облако электронов также способствует эффективной передаче тепловой энергии.Твердая медь может быть описана как расположение атомов меди в гранецентрированной кубической (ГЦК) конфигурации. Атом меди находится в каждом углу и в центре каждой грани куба, как показано на рисунке 9.0240 Рисунок 1 . Это элементарная ячейка, которая повторяется в трехмерном пространстве, образуя кристаллическую структуру металла.
Атомы удерживаются на месте в структуре за счет энергии притяжения атомов между ними. Именно такое гранецентрированное кубическое расположение атомов придает меди высокую пластичность и ударную вязкость. Все металлы деформируются с помощью механизма, называемого скольжением. Когда происходит скольжение, сила, действующая на металл, заставляет атомы скользить относительно друг друга группами. В ГЦК-структуре меди это движение происходит преимущественно в любом или во всех трех направлениях вдоль определенной геометрической плоскости атомов внутри решетки, как показано на рис.0240 Рисунок 2 .
В ГЦК-структуре меди это движение происходит преимущественно в любом или во всех трех направлениях вдоль определенной геометрической плоскости атомов внутри решетки, как показано на рис.0240 Рисунок 2 .
Рис. 2. Единица ГЦК меди с удаленным угловым атомом, чтобы показать плоскость скольжения, на которой происходит предпочтительная деформация. Это место воплощает самую плотную упаковку атомов, которая возможна геометрически (ссылка 1).
Медная ячейка имеет четыре таких плоскости. Если движение может происходить в трех направлениях на всех четырех плоскостях, существует двенадцать возможностей возникновения скольжения. Оказывается, это максимальное количество возможностей для скольжения, встречающееся в любой металлической конструкции. Чем больше вероятность того, что металл может испытать существенное скольжение, тем больше вероятность того, что он деформируется, а не сломается и выйдет из строя. Следовательно, медь обладает превосходной пластичностью и ударной вязкостью, а также устойчива к усталости и ползучести. Дополнительным преимуществом является то, что медь, поскольку она является гранецентрированной структурой, не подвержена охрупчиванию при низких (минусовых) температурах; явление, обычное для других кристаллических структур.
Дополнительным преимуществом является то, что медь, поскольку она является гранецентрированной структурой, не подвержена охрупчиванию при низких (минусовых) температурах; явление, обычное для других кристаллических структур.Комбинация электронной и кристаллографической структур меди придает ей превосходную устойчивость к коррозии. Свободное электронное облако легко доступно для образования когерентных пленок на поверхности металла, которые защищают решетку от дальнейшей коррозии.
ГЦК-структура, порождающая плоскости скольжения, придает этим самым плоскостям еще одну характеристику. Атомы на плоскостях скольжения упакованы настолько плотно, насколько это возможно в любой металлической системе (, рис. 2, ). Это эффективное расположение атомов упаковывает большую часть материи в заданное пространство (похоже, пчелы это знают, когда строят соты). Ионам водорода очень трудно проникнуть через небольшие промежутки между атомами и вызвать коррозионное растрескивание под напряжением, за исключением самых агрессивных сред.
Мы видели, как медь, основной металл для отливки бронзы, если рассматривать ее в атомном масштабе, придает важные характеристики для хороших подшипниковых материалов. Но подшипники изготавливаются не из чистой меди, а из широкого спектра медных сплавов, которые сейчас доступны. Каждый из этих сплавов улучшает характеристики чистой меди и дополнительно адаптирует новый материал к конкретным условиям. Давайте рассмотрим некоторые из наиболее распространенных систем сплавов в отношении металлургии материала и его назначения в конструкции подшипников.
Литые бронзовые сплавы
Подшипниковые марки литой бронзы могут быть металлургически разделены на три категории:
- Сплавы однофазные твердые растворы
- Многофазные сплавы
- Композитные материалы
Чтобы понять характеристики различных сплавов, мы должны сначала понять, что происходит с основной структурой меди при добавлении небольшого количества легирующих металлов. Реакции происходят при затвердевании и охлаждении сплавов из расплавленного состояния.
Реакции происходят при затвердевании и охлаждении сплавов из расплавленного состояния.
Проще говоря, окончательное расположение легирующих металлов по отношению к нормальной ГЦК-решетке меди определяет свойства материала сплава.
Легирующие металлы находят свое место в решетке меди тремя основными способами:
- Замещают атомы меди в ГЦК-решетке.
- Они соединяются с медью и образуют локализованные области (фазы), где кристаллическая структура имеет форму, отличную от ГЦК-кристалла меди.
- Они отторгаются затвердевающей решеткой меди, но остаются в ловушке внутри кристаллов сплава по мере их замерзания и роста.
Результатом исследований стало графическое представление того, как реагируют простые бинарные системы сплавов. Это представление называется фазовой диаграммой. Фазовые диаграммы некоторых бинарных систем, имеющих отношение к бронзе, показывают поведение легирующих элементов, которое обычно приводит к одному из трех случаев, упомянутых ранее.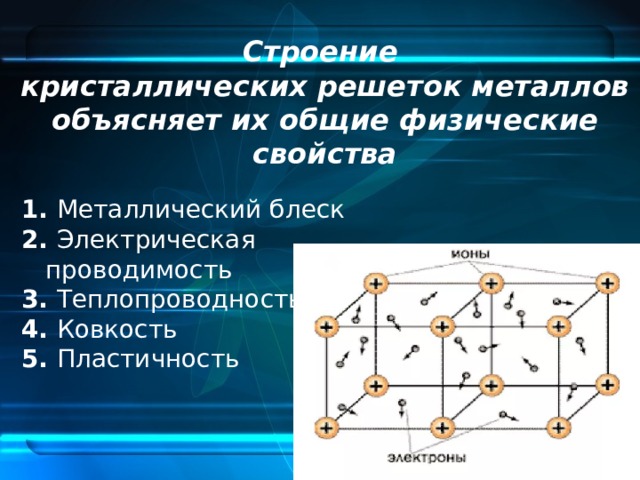 Фазовая диаграмма равновесия медь-олово ( Рисунок 3 ) иллюстрирует случаи (1) и (2).
Фазовая диаграмма равновесия медь-олово ( Рисунок 3 ) иллюстрирует случаи (1) и (2).
Рис. 3. Фазовая диаграмма равновесия медь-олово (ссылка 2).
Чемодан (1) – Замена
Рис. 4. Микроструктура однофазного (альфа) медно-оловянного сплава (88Cu-8Sn-4Zn). Структура показывает линии скольжения. Обратите также внимание на следы дельта-фазы (более темные островки) (ссылка 2).
На рисунке 3 видно, что при содержании олова менее 11 % (например, при 8 % олова) сплав по мере его охлаждения затвердевает в диапазоне температур, становясь полностью твердым, когда температура падает ниже примерно 850°C. В равновесных условиях медленного охлаждения образующаяся твердая фаза представляет собой гранецентрированный кубический кристалл (альфа-фаза). Атомы олова замещают непосредственно в решетке вместо атомов меди. Атомы олова фактически упрочняют чистую медь, потому что они напрягают решетку, то есть изменяют обычное расстояние между атомами меди.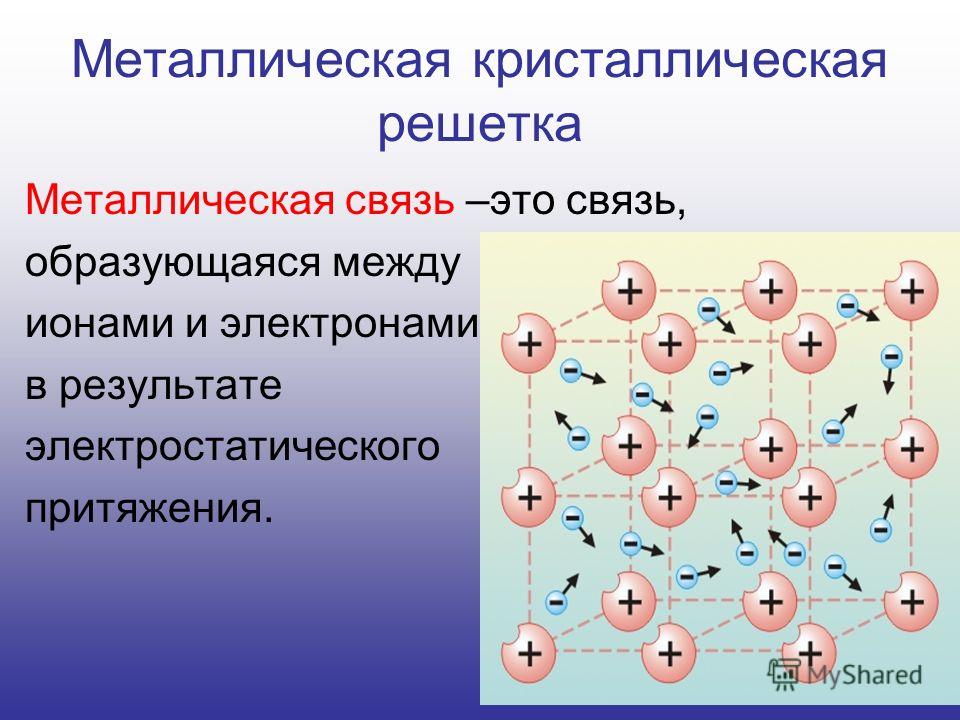 В коммерческих условиях довольно медленного затвердевания почти весь металл будет затвердевать в виде альфа-фазы ( Рисунок 4 ). Это явление замещения приводит к однофазному твердому раствору олова в меди. Кристаллическая структура, хотя и прочнее, чем у чистой меди из-за деформации решетки, все же ГЦК. Следовательно, характеристики скольжения остаются очень хорошими. Таким образом, однофазные твердые сплавы меди сохраняют высокую пластичность, несмотря на весьма значительное повышение прочности. Такие материалы находят широкое применение в условиях, когда материал может подвергаться значительному напряжению, но разрушение может привести к катастрофическим последствиям (например, фитинги в системах забортной воды ядерных реакторов).
В коммерческих условиях довольно медленного затвердевания почти весь металл будет затвердевать в виде альфа-фазы ( Рисунок 4 ). Это явление замещения приводит к однофазному твердому раствору олова в меди. Кристаллическая структура, хотя и прочнее, чем у чистой меди из-за деформации решетки, все же ГЦК. Следовательно, характеристики скольжения остаются очень хорошими. Таким образом, однофазные твердые сплавы меди сохраняют высокую пластичность, несмотря на весьма значительное повышение прочности. Такие материалы находят широкое применение в условиях, когда материал может подвергаться значительному напряжению, но разрушение может привести к катастрофическим последствиям (например, фитинги в системах забортной воды ядерных реакторов).Примером такого однофазного коммерческого сплава является сплав С, свойства которого сравниваются с медью в таблице ниже.
| С | ||
|---|---|---|
| Медь | 99,9 | 88,0 |
| Сн | – | 8,0 |
| Цинк | – | 4,0 |
Т. С., тыс.фунтов/кв.дюйм С., тыс.фунтов/кв.дюйм | 28 | 45 |
| Y.S., тыс.фунтов/кв.дюйм | 8 | 23 |
| Удлинение, % на 2 дюйма | 45 | 25 |
| Твердость, BHN | 40 | 77 |
| (Значения указаны для непрерывнолитого материала диаметром менее 3 дюймов.) | ||
Корпус (2) — многофазный
Если содержание олова увеличить до 11% и более, часть альфа-фазы трансформируется при охлаждении металла ниже 400°C. Появляется новая фаза, вкрапленная в нормальные ГЦК-альфа-кристаллы. Эта фаза, называемая дельта, может сохраняться в материале при достаточно быстром охлаждении ( Рисунок 5 ).
Рисунок 5 . Микроструктура непрерывнолитого сплава оловянной бронзы С. Обозначается дельта-фаза (ссылка 3).
Дельта-фаза (хотя все еще в основном ГЦК) содержит гораздо больше олова по отношению к меди, чем в альфа-фазе, и очень твердая и прочная, но не обладает большой пластичностью.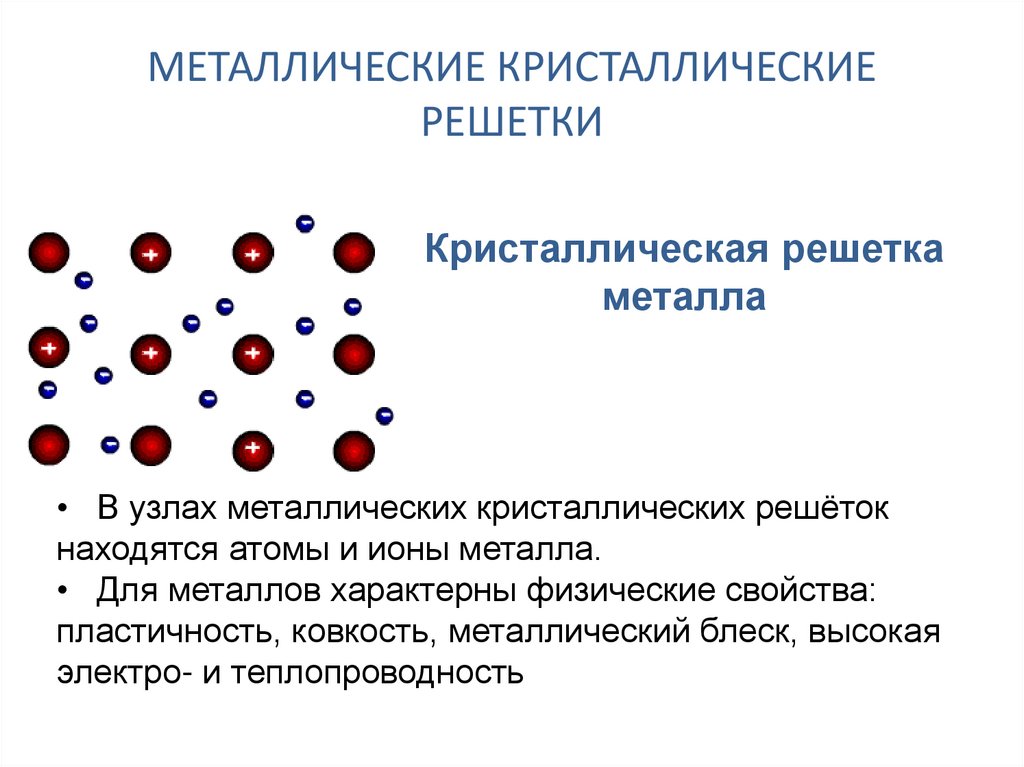 В лучших условиях он проявляется в виде мелкодисперсных островков по всей микроструктуре материала. Влияние этой второй фазы на механизм скольжения драматическое, так как плоскости скольжения закрепляются после небольших степеней движения. Но дельта-фаза также значительно повышает износостойкость материала, на что указывает значительное увеличение твердости. Популярные сплавы алюминиевой бронзы (C95400 и С95500) и марганцевые бронзы (С86300 и С86400) приобретают свою высокую прочность и твердость сходным образом, хотя действующие лица различаются. Тем не менее, свойства являются результатом дисперсии другой фазы (или фаз) в основной ГЦК-решетке, при этом почти во всех случаях дисперсная фаза намного тверже и прочнее, чем основная масса окружающего матричного материала. Эти «искусственные разрывы» в материале служат для закрепления плоскостей скольжения и ограничения их движения.
В лучших условиях он проявляется в виде мелкодисперсных островков по всей микроструктуре материала. Влияние этой второй фазы на механизм скольжения драматическое, так как плоскости скольжения закрепляются после небольших степеней движения. Но дельта-фаза также значительно повышает износостойкость материала, на что указывает значительное увеличение твердости. Популярные сплавы алюминиевой бронзы (C95400 и С95500) и марганцевые бронзы (С86300 и С86400) приобретают свою высокую прочность и твердость сходным образом, хотя действующие лица различаются. Тем не менее, свойства являются результатом дисперсии другой фазы (или фаз) в основной ГЦК-решетке, при этом почти во всех случаях дисперсная фаза намного тверже и прочнее, чем основная масса окружающего матричного материала. Эти «искусственные разрывы» в материале служат для закрепления плоскостей скольжения и ограничения их движения.
Эти материалы известны как полифазные сплавы и характеризуются более высокой прочностью, твердостью и износостойкостью, чем альфа-сплавы; но они демонстрируют гораздо меньшую пластичность, как показано в таблице ниже. В результате они лучше всего подходят для деталей поверхностей управления, где наиболее важна целостность размеров, а также для тяжелых нагрузок и ударных нагрузок при низких скоростях, например, для подшипников шасси самолета.
В результате они лучше всего подходят для деталей поверхностей управления, где наиболее важна целостность размеров, а также для тяжелых нагрузок и ударных нагрузок при низких скоростях, например, для подшипников шасси самолета.
Дополнительным свойством многофазных сплавов является то, что их свойства могут значительно изменяться в зависимости от температуры по сравнению с однофазными материалами. Такие сплавы часто поддаются термообработке. Путем манипулирования микроструктурой сплава, как показано на равновесной фазовой диаграмме, путем «замыкания» равновесия можно получить определенные свойства, которые отсутствуют в литом состоянии.
| Однофазный | Многофазный | |||
|---|---|---|---|---|
| С | С | С | С95400 | |
| Медь | 88 | 89 | 87 | 85 |
| Сн | 8 | 11 | 11 | |
| Пб | 1 | |||
| Цинк | 4 | |||
| Ал | 11 | |||
| Никель | 1 | |||
| Фе | 4 | |||
Т. С., тыс.фунтов/кв.дюйм С., тыс.фунтов/кв.дюйм | 49 | 52 | 50 | 85 |
| Y.S., тыс. фунтов на кв. дюйм | 23 | 29 | 25 | 35 |
| Удлинение, % на 2 дюйма | 25 | 18 | 20 | 18 |
| Твердость, BHN | 77 | 95 | 83 | 170 |
| (Значения для непрерывнолитого материала диаметром менее 3 дюймов, за исключением C95400, которые предназначены для литого материала.) | ||||
В любом случае, многофазные материалы, не содержащие значительного количества свинца, следует использовать только в качестве подшипников со стальными сопрягаемыми поверхностями, которые сами были закалены термической обработкой. В случае применения алюминиевой бронзы или марганцовистой бронзы часто рекомендуется, чтобы вал был хромированным или изготовлен из биметаллического материала, аналогичного тому, который используется для стальных прокатных валков.
Чемодан (3) – Композитные смеси
Рис. 6. Фазовая диаграмма равновесия медь-свинец (ссылка 2).
Наиболее широко используемые несущие материалы – это действительно композиты. Принципиально они могут иметь как однофазную, так и многофазную структуру, служащую матрицей вокруг частиц или глобул свободного свинца. Взгляд на фазовую диаграмму равновесия медь-свинец ( рис. 6 ) показывает, что свинец почти полностью отторгается решеткой меди при замерзании. Тем не менее, как инженеры-металлурги, так и литейщики приложили огромные усилия, чтобы захватить свинец между кристаллами материала на основе меди, поскольку эти кристаллы замерзают и растут, потому что полученный сплав делает очень тонкие подшипники. Типичная микроструктура, показывающая диспергированный свинец, показана на 9.0240 Рисунок 7 . В настоящее время возможно производство материала на основе меди с содержанием свинца более 30%, при этом размер частиц свинца является микроскопическим.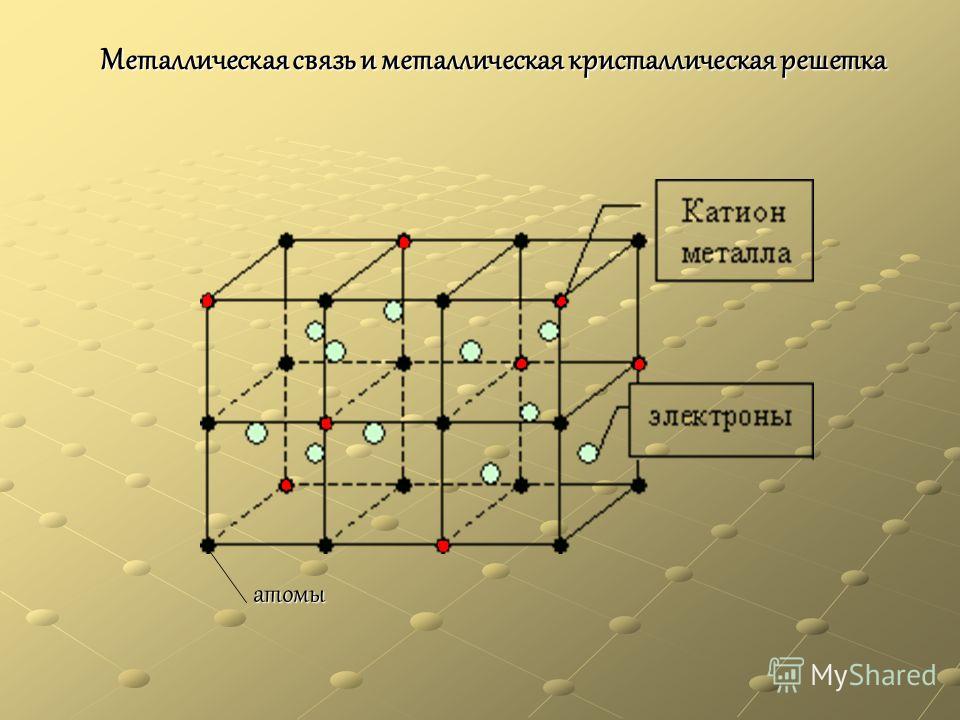 С другой стороны, если применение подшипников указывает на то, что более желательны более крупные частицы свинца, также возможно производить сплав в такой форме.
С другой стороны, если применение подшипников указывает на то, что более желательны более крупные частицы свинца, также возможно производить сплав в такой форме.
Рис. 7. Микроструктура непрерывнолитого сплава свинцово-оловянной бронзы С94100 (20% Pb). Указаны частицы свинца (ссылка 3).
Свинец выполняет три важные функции подшипника, каждая из которых служит для защиты вала и повышения производительности оборудования. Первостепенное значение имеет способность частиц свинца снижать коэффициент трения между подшипником и валом. Механизм, с помощью которого это достигается, весьма интересен. Частицы свинца могут быть срезаны с поверхности подшипника микроскопическими неровностями на поверхности вала. Стальной вал покрывается свинцом, который постепенно перераспределяется, заполняя углубления на валу. Как только это будет достигнуто, коэффициент трения снова немного возрастет, как показано в таблице ниже (ссылка 4). Это же явление имеет еще одно преимущество, заключающееся в том, что температура, возникающая в точках контакта между подшипником и сопрягаемой деталью, ограничивается температурой плавления свинца 327, С).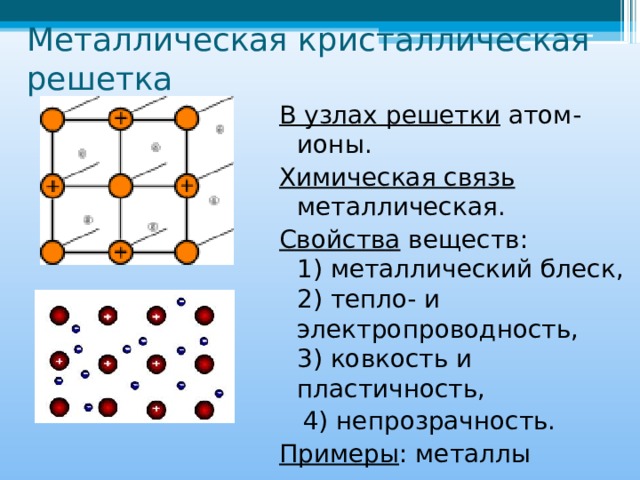 Очевидно, что это свойство свинцовых сплавов очень ценно при отсутствии смазки (плановой или случайной) или если среда эксплуатации машины сама подвержена большим перепадам температур, например на самолетах или арктической нефтепромысловой технике.
Очевидно, что это свойство свинцовых сплавов очень ценно при отсутствии смазки (плановой или случайной) или если среда эксплуатации машины сама подвержена большим перепадам температур, например на самолетах или арктической нефтепромысловой технике.
| Коэффициент трения (скольжение) | |
|---|---|
| Сталь на меди | 0,9 |
| Сталь на C94300 (23% Pb) | 0,18 |
| Сталь на C94300 после длительного использования | 0,30 |
| Сталь по стали | 1,00 |
Второй важной функцией свинца является поглощение грязи, попадающей в интерфейс, хотя этой проблемы можно избежать, по возможности используя правильно герметизированные подшипники.
В-третьих, свинцовые сплавы, имеющие несколько более низкую прочность, чем не содержащие свинца медно-оловянные сплавы, и гораздо более низкую прочность, чем медно-алюминиевые или медно-цинковые сплавы, обладают высокой степенью прилегаемости. То есть подшипник изменит свою форму, чтобы учесть неправильную центровку или вибрацию. Эта характеристика в сочетании с ранее описанными позволяет сказать, что свинцовые сплавы будут очень хорошо «прирабатываться», что особенно желательно для червячных передач, например. Свинцовые бронзы также легко поддаются механической обработке.
То есть подшипник изменит свою форму, чтобы учесть неправильную центровку или вибрацию. Эта характеристика в сочетании с ранее описанными позволяет сказать, что свинцовые сплавы будут очень хорошо «прирабатываться», что особенно желательно для червячных передач, например. Свинцовые бронзы также легко поддаются механической обработке.
Инженер должен помнить, что эти сплавы не такие прочные, как материалы, не содержащие свинец, и при этом они не обладают такой высокой устойчивостью к ударам и последующей усталости, которая приводит к выходу из строя. Однако одно утешительное соображение заключается в том, что полный отказ подшипника вряд ли приведет к разрушению вала или заклиниванию машины из-за «мягкости» этих сплавов.
Выбрав соответствующую матрицу, в которую будут отлиты частицы свинца, инженер может выбрать материал из довольно широкого диапазона прочности, совместимого с умеренными и легкими нагрузками и высокими скоростями, как показано в таблице ниже. Значения приведены для непрерывного литья диаметром менее 3 дюймов.
| C83600 | С | С | С93800 | С94300 | ||
|---|---|---|---|---|---|---|
| Медь | 85 | 83 | 80 | 78 | 70 | |
| Сн | 5 | 7 | 10 | 7 | 5 | |
| Пб | 5 | 7 | 10 | 15 | 25 | |
| Цинк | 5 | 3 | ||||
| Т.С., тыс.фунтов/кв.дюйм | 45 | 45 | 41 | 34 | 27 | |
| Y.S., тыс. фунтов на кв. дюйм | 21 | 24 | 24 | 23 | 13 | |
| Удлинение, % на 2 дюйма | 28 | 16 | 10 | 12 | 15 | |
| Твердость, BHN | 72 | 72 | 80 | 62 | 48 |
Свойства литых бронз
Давайте теперь рассмотрим семейства подшипниковых бронзовых сплавов с помощью двух таблиц, в которых сравниваются некоторые из их наиболее важных технических свойств. В таблице 1 приведены химические составы и эксплуатационные свойства. В таблице 2 указаны наиболее распространенные области применения этих материалов и их эксплуатационные качества в средах применения, в которых они находят наибольшее применение.
В таблице 1 приведены химические составы и эксплуатационные свойства. В таблице 2 указаны наиболее распространенные области применения этих материалов и их эксплуатационные качества в средах применения, в которых они находят наибольшее применение.
| Состав % | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Семейство сплавов | Медь | Сн | Пб | Цинк | Ni | Фе | Мн | Ал | ||||||||
| Красная латунь | ||||||||||||||||
| С84400 | 81 | 3 | 7 | 9 | г. | |||||||||||
| С83600 | 85 | 5 | 5 | 5 | ||||||||||||
| Оловянно-свинцовые бронзы | ||||||||||||||||
| С | 83 | 7 | 7 | 3 | ||||||||||||
| С | 80 | 10 | 10 | |||||||||||||
| Оловянные бронзы с высоким содержанием свинца | ||||||||||||||||
| С93800 | 78 | 7 | 15 | |||||||||||||
| С94300 | 70 | 5 | 25 | |||||||||||||
| Оловянные бронзы | ||||||||||||||||
| С | 88 | 8 | 4 | |||||||||||||
| С | 88 | 10 | 2 | |||||||||||||
| С | 89 | 11 | ||||||||||||||
| С | 87 | 11 | 1 | 1 | ||||||||||||
| С | 88 | 10 | 2 | |||||||||||||
| С | 84 | 10 | 2,5 | г. | 3,5 | |||||||||||
| C94700-HT** | 88 | 5 | 2 | 5 | ||||||||||||
| Алюминиевые бронзы | ||||||||||||||||
| С95400 | 85 | 4 | 11 | |||||||||||||
| C95400-HT | 85 | 4 | 11 | |||||||||||||
| С95500 | 81 | 4 | 4 | 11 | ||||||||||||
| C95500-HT | 81 | 4 | 4 | 11 | ||||||||||||
| Марганцевые бронзы | ||||||||||||||||
| С86300 | 63 | 25 | 3 | 3 | 6 | |||||||||||
| С86400 | 59 | 1 | 40 | |||||||||||||
| * БТЕ/фут2/фут/ч/F ** HT – Термическая обработка | ||||||||||||||||
| Свойства непрерывного литья (тип.) | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Семейство сплавов | T.S., тыс.фунтов/кв.дюйм | Y.S., 9 тыс.фунтов на кв. дюйм0089 | Удлин., % | БН | Обрабатываемость Индекс | Сжатие Y.S., ksi | Тепловая Электропроводность* | ||||||||
| Красная латунь | |||||||||||||||
| С84400 | 37 | 16 | 23 | 55 | 90 | 28 | 41 | ||||||||
| С83600 | 45 | 21 | 18 | 72 | 100 | 34 | 41 | ||||||||
| Оловянно-свинцовые бронзы | |||||||||||||||
| С | 45 | 24 | 16 | 72 | 100 | 30 | 33 | ||||||||
| С | 41 | 24 | 10 | 80 | 100 | 25 | 27 | ||||||||
| Оловянные бронзы с высоким содержанием свинца | |||||||||||||||
| С93800 | 34 | 23 | 12 | 62 | 100 | 23 | 30 | ||||||||
| С94300 | 27 | 13 | 15 | 48 | 100 | 20 | 36 | ||||||||
| Оловянные бронзы | |||||||||||||||
| С | 49 | 23 | 25 | 77 | 25 | 36 | 43 | ||||||||
| С | 51 | 29 | 18 | 92 | 25 | 29 | 43 | ||||||||
| С | 51 | 29 | 18 | 95 | 20 | 38 | 41 | ||||||||
| С | 49 | 26 | 17 | 80 | 30 | 32 | 42 | ||||||||
| С | 48 | 20 | 18 | 80 | 80 | 28 | 40 | ||||||||
| С | 53 | 31 | 15 | 100 | 85 | 38 | 34 | ||||||||
| C94700-HT** | 90 | 66 | 9 | 180 | 20 | 71 | 31 | ||||||||
| Свойства в литом состоянии | |||||||||||||||
| Алюминиевые бронзы | |||||||||||||||
| С95400 | 85 | 35 | 18 | 170 | 60 | 50 | 34 | ||||||||
| C95400-HT | 105 | 54 | 8 | 195 | 20 | 75 | 34 | ||||||||
| С95500 | 100 | 44 | 12 | 195 | 50 | 60 | 24 | ||||||||
| C95500-HT | 120 | 68 | 10 | 230 | 15 | 80 | 24 | ||||||||
| Марганцевые бронзы | |||||||||||||||
| С86300 | 115 | 70 | 15 | 225 | 8 | 80 | 20 | ||||||||
| С86400 | 65 | 25 | 20 | 90 | 65 | 40 | 51 | ||||||||
| *BTU/ft2/ft/hr/F **HT – Термическая обработка | |||||||||||||||
| Качественная рабочая среда подшипника | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Сплав № | Скорость | Загрузить | Окружающая среда | Твердость вала | Типичные области применения | ||||
| С94300 | (низкий) (высокий) | (нижний) | (более абразивный) (менее абразивный) | (низкий) | Топливные насосы для самолетов | ||||
| С93800 | Шахтный водяной насос, износостойкие пластины | ||||||||
| С | Высоконагруженные высокоскоростные подшипники | ||||||||
| С | Подшипники общего назначения | ||||||||
| С83600 | Подшипники вала линии глубоководных насосов, легкие шестерни | ||||||||
| С | Поршневые кольца | ||||||||
| С | Шестерни, направляющие клапанов, рабочие колеса насосов | ||||||||
| С | Шестерни, направляющие клапанов, задняя стальная замена | ||||||||
| С | Компоненты клапана, паровая арматура | ||||||||
| С | Шестерни | ||||||||
| С95400 | Поверхности управления | ||||||||
| С95500 | Поверхности управления | ||||||||
| С86300 | Гайки для прокатных станов | ||||||||
Все сплавы, показанные в таблицах, по существу являются вариациями основных материалов, которые обсуждались. В некоторых случаях для улучшения обрабатываемости может быть добавлен свинец (C
В некоторых случаях для улучшения обрабатываемости может быть добавлен свинец (C
Экономика
Несколько слов об относительной экономичности сплавов. Все компоненты сплавов подвержены влиянию мировых рынков, где уровни их цен определяются спросом, предложением, государственным контролем и спекулятивным интересом. Колебания на мировом рынке этих компонентов в конечном итоге отражаются на стоимости композитного металла для сплавов, и это также влияет на стоимость лома материала, когда он выводится из эксплуатации. Таблица 3 показывает приблизительные общие относительные значения меди и основных легирующих материалов на момент ее написания.
Колебания на мировом рынке этих компонентов в конечном итоге отражаются на стоимости композитного металла для сплавов, и это также влияет на стоимость лома материала, когда он выводится из эксплуатации. Таблица 3 показывает приблизительные общие относительные значения меди и основных легирующих материалов на момент ее написания.
| Приблизительная Относительная стоимость | Приблизительная Относительная стоимость | |||
|---|---|---|---|---|
| Первичные металлы | Вторичный лом | |||
| Медь | 1,0 | Оловянно-свинцовая бронза | 0,9 | |
| Олово | 7,8 | Оловянная бронза | 1,0 | |
| Свинец | 0,2 | Алюминиевая бронза | 0,3 | |
| Цинк | 0,5 | Марганцевая бронза | 0,3 | |
| Никель | 4,0 | |||
| Алюминий | 0,9 | Предварительно легированный слиток | ||
| С | 1,2 | |||
| С | 2,0 | |||
| С98400 | 1,2 |
Методы изготовления
Сплавы меди для подшипников доступны во многих формах, производимых различными способами. Методы производства отливок обобщены в таблице 4 .
Методы производства отливок обобщены в таблице 4 .
Изделия из форм для песка и отжига
| Метод производства | |||||
|---|---|---|---|---|---|
| Семейство сплавов | Песок | Охладитель Форма | Центробежный | Непрерывный | Кованый |
| Красная латунь | х | х | х | х | н/д |
| Оловянно-свинцовые бронзы | х | х | х | х | Х* |
| Оловянные бронзы с высоким содержанием свинца Сегрегация S=Pb может быть проблемой | С | С | С | х | н/д |
| Оловянные бронзы | х | х | х | х | Х** |
| Алюминиевые бронзы | х | х | х | х | х |
| Марганцевые бронзы | х | х | х | х | х |
| * Ограничено примерно 4% Pb ** Деформируемые сплавы C51000, C52100, C52400.  | |||||
Литье в песчаные или кокильные формы является идеальным методом производства, идеально подходящим для очень малых партий или очень мелких деталей, а иногда является обязательным для очень крупных деталей, таких как гребные винты кораблей.
Все обсуждаемые сплавы доступны в этих формах, хотя могут возникнуть проблемы с серьезной сегрегацией свинца, когда содержание свинца приближается к 16%. Можно отливать изделия самых разных размеров и сложных форм. Красные латуни, которые очень популярны в качестве материалов для сантехники, производятся этими методами, в основном в виде корпусов клапанов и фитингов.
Изделия центробежного литья
Опять же, все рассматриваемые сплавы легко производятся методом центробежного литья, за исключением оловянных бронз с высоким содержанием свинца, в которых содержание свинца приближается к 20%. Проблемы сегрегации свинца чувствительны к размеру отливки. Этим методом изготавливают очень большие втулки. Вполне вероятно, что большинство втулок с наружным диаметром более 14 дюймов. и примерно до 100 дюймов. являются центробежными отливками. Такие отливки могут изготавливаться длиной более 100 дюймов. Тем не менее, небольшие центробежные отливки также являются крупносерийными изделиями. Этим методом изготавливаются многие крупные фланцевые подшипники или заготовки зубчатых колес. Хотя малые тиражи чувствительны к объему производства, они могут быть очень экономичными. Складские дистрибьюторы поддерживают запасы полуфабрикатов центробежного литья, в основном типоразмеров и особенно сплавов С9.5400 и C
Вполне вероятно, что большинство втулок с наружным диаметром более 14 дюймов. и примерно до 100 дюймов. являются центробежными отливками. Такие отливки могут изготавливаться длиной более 100 дюймов. Тем не менее, небольшие центробежные отливки также являются крупносерийными изделиями. Этим методом изготавливаются многие крупные фланцевые подшипники или заготовки зубчатых колес. Хотя малые тиражи чувствительны к объему производства, они могут быть очень экономичными. Складские дистрибьюторы поддерживают запасы полуфабрикатов центробежного литья, в основном типоразмеров и особенно сплавов С9.5400 и C
Изделия непрерывного литья заготовок
Все сплавы доступны в виде непрерывнолитого прутка; сегрегация свинца, как правило, не является проблемой. Для некоторых отливок с очень тонкими стенками может потребоваться снять напряжение, особенно если используется сплав С95400, С95500 или С86300, чтобы предотвратить потерю зазора или допуска при изготовлении и использовании. Доступен широкий диапазон размеров сплошного, трубчатого и изготовленного на заказ прутка поперечного сечения. Диаметры варьируются от менее 0,500 дюйма до примерно 14 дюймов по внешнему диаметру и длиной до примерно 13 футов. Можно производить очень тонкостенные стержни, иногда менее 1/4 дюйма, в зависимости от наружного диаметра. Эти изделия идеально подходят для дальнейшего изготовления на станках-автоматах.
Доступен широкий диапазон размеров сплошного, трубчатого и изготовленного на заказ прутка поперечного сечения. Диаметры варьируются от менее 0,500 дюйма до примерно 14 дюймов по внешнему диаметру и длиной до примерно 13 футов. Можно производить очень тонкостенные стержни, иногда менее 1/4 дюйма, в зависимости от наружного диаметра. Эти изделия идеально подходят для дальнейшего изготовления на станках-автоматах.
Большие объемы продукции непрерывного литья значительно более экономичны, но опять же дистрибьюторы чулок берут на себя большую часть этого бремени, особенно когда речь идет о сплавах C95400, C
Кованые изделия
Деформируемые сплавы фосфористой бронзы (C51000, C52100, C52400, C54400) иногда используются в подшипниках. Эти сплавы также доступны в виде непрерывного литья в отожженном состоянии. Наружный диаметр кованой фосфористой бронзы обычно ограничен примерно 3 дюймами. и под. C54400 имеет самое высокое доступное содержание свинца, около 4%. Сплавы с более высоким содержанием свинца нельзя прессовать или прокатывать.
Сплавы с более высоким содержанием свинца нельзя прессовать или прокатывать.
Сплавы алюминия и марганцовистой бронзы также имеют деформируемые эквиваленты. Деформируемые сплавы обладают очень сильными механическими свойствами, подвергаясь тяжелой обработке путем экструзии, волочения, прокатки или ковки, и широко используются в аэрокосмической промышленности. Некоторые из этих сплавов используются в качестве сварочных материалов. Эти сплавы также доступны в различных экструдированных формах, хотя доступное разнообразие сильно зависит от количества. Термическая обработка литых сплавов обеспечивает механические свойства, аналогичные деформируемым материалам, как и непрерывное литье алюминиевых бронз. Вообще говоря, большие объемы производства необходимы для того, чтобы сделать кованые изделия экономичными, хотя дистрибьюторы на складе взяли на себя это бремя для конечного потребителя меньших количеств.
Готовые подшипники
Некоторые производители, а также многие дистрибьюторы и производители подшипников имеют запасы стандартных готовых втулок, особенно из сплава C
 Эти детали производятся серийно и легко доступны.
Эти детали производятся серийно и легко доступны.Специальные подшипники
Ряд механических цехов специализируются на производстве подшипников, особенно нестандартных конструкций и ответственных сплавов на заказ. В этих цехах работают сложные обрабатывающие центры. Используя лучшее доступное оборудование, они способны обеспечить высочайшую степень точности в производстве деталей и поддерживать высокие стандарты контроля качества материалов. Такие предприятия обслуживают те OEM-предприятия и отделы технического обслуживания крупных корпораций, которые предпочитают не производить собственные подшипники. Они обеспечивают экономичное обслуживание и хорошо осведомлены о технологии и источниках подшипниковых сплавов, которые лучше всего подходят для производства данного подшипника.
Резюме
Металлургическое машиностроение, хотя и является наукой, но и искусством. Исследования, обширный опыт и глубокое понимание свойств, которые легирующие элементы могут придавать медному основному металлу, необходимы для качественного проектирования материалов.




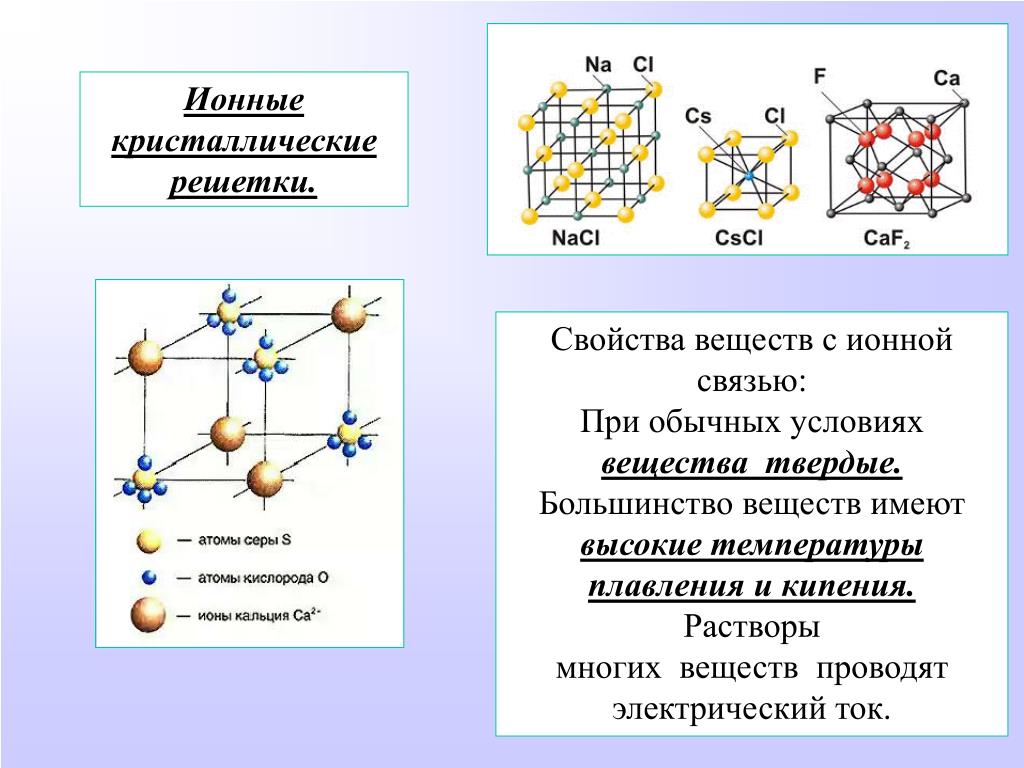


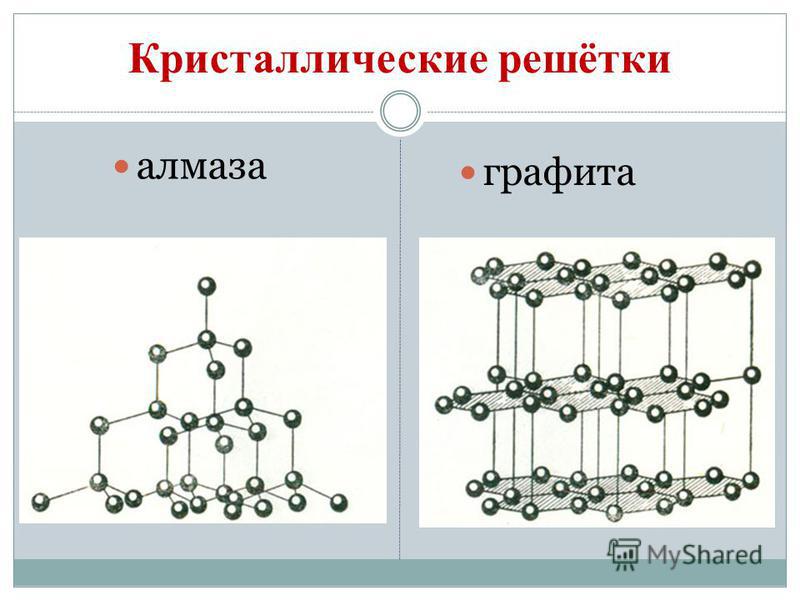
 Типы кристаллических решеток металлов
Типы кристаллических решеток металлов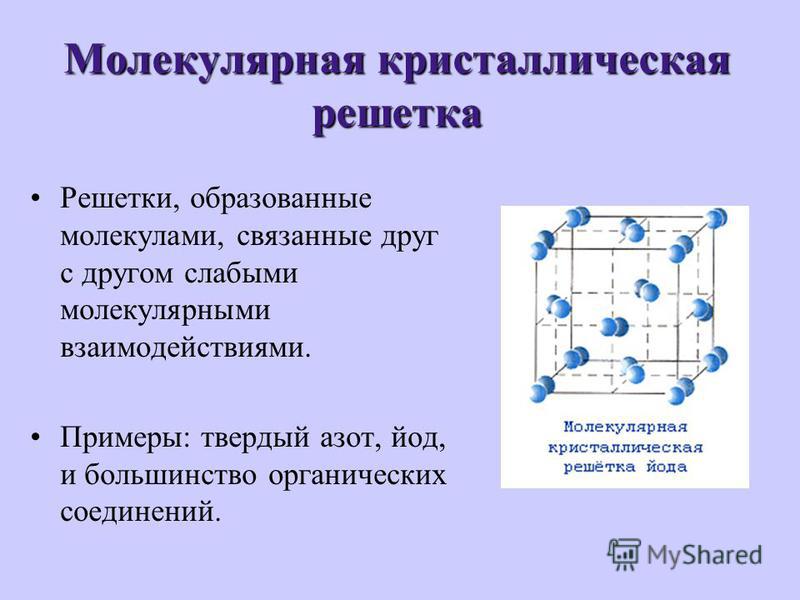
 С. Габриелян, ПСХЭ Д.И.Менделеева, модели кристаллических решёток хлорида натрия, графита, оксида углерода (IV), плакат «Типы кристаллических решёток», образцы кристаллических и аморфных тел (изделия из пластмассы, пластилин, стекло, слюда, мрамор, кварц, графит, песок, йод кристаллический, поваренная соль, сера кристаллическая, сахар, Al, Zn), карточки с заданиями, тесты.
С. Габриелян, ПСХЭ Д.И.Менделеева, модели кристаллических решёток хлорида натрия, графита, оксида углерода (IV), плакат «Типы кристаллических решёток», образцы кристаллических и аморфных тел (изделия из пластмассы, пластилин, стекло, слюда, мрамор, кварц, графит, песок, йод кристаллический, поваренная соль, сера кристаллическая, сахар, Al, Zn), карточки с заданиями, тесты.

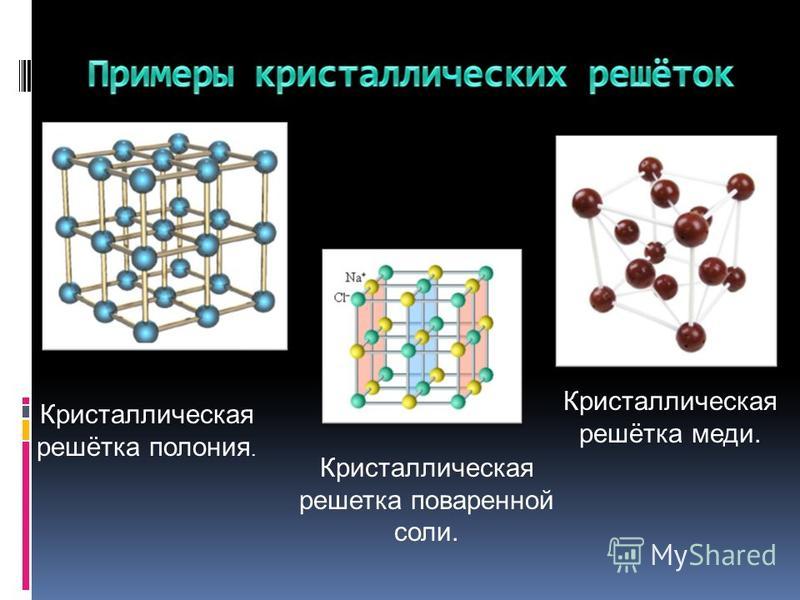
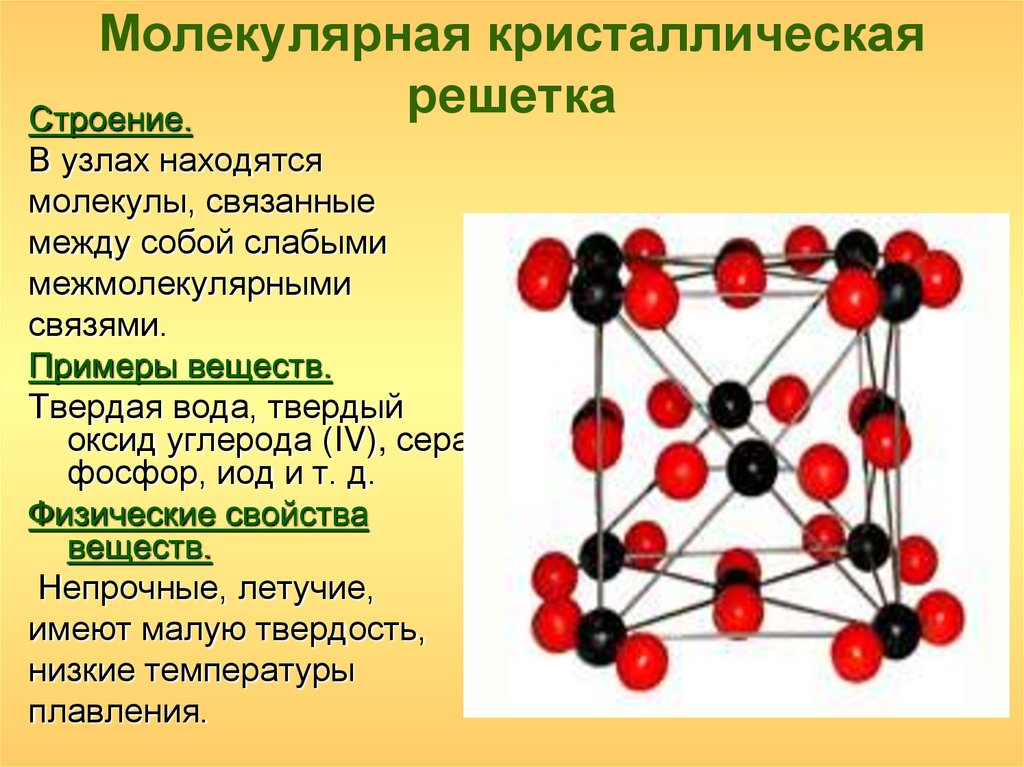
 Исследуйте макет кристаллической решетки алмаза.
Исследуйте макет кристаллической решетки алмаза. Какие вещества имеют молекулярную кристаллическую решетку
Какие вещества имеют молекулярную кристаллическую решетку Приложение.
Приложение. У веществ с низкой температурой плавления кристаллическая решетка
У веществ с низкой температурой плавления кристаллическая решетка Ионное строение имеет
Ионное строение имеет
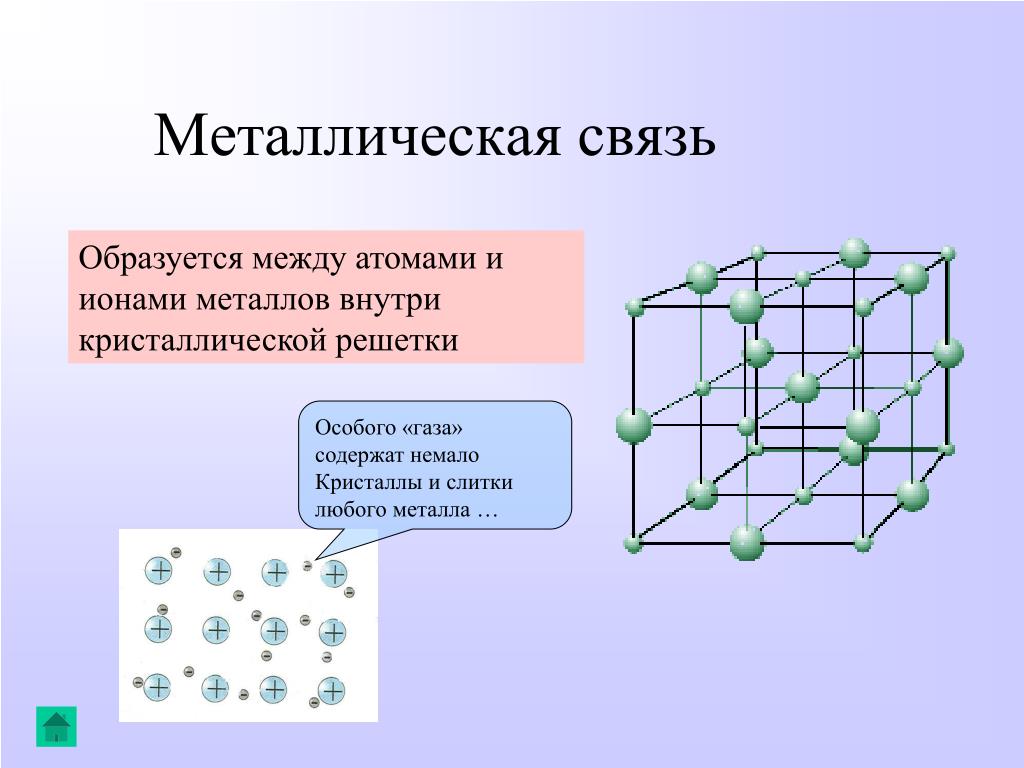

 д.
д.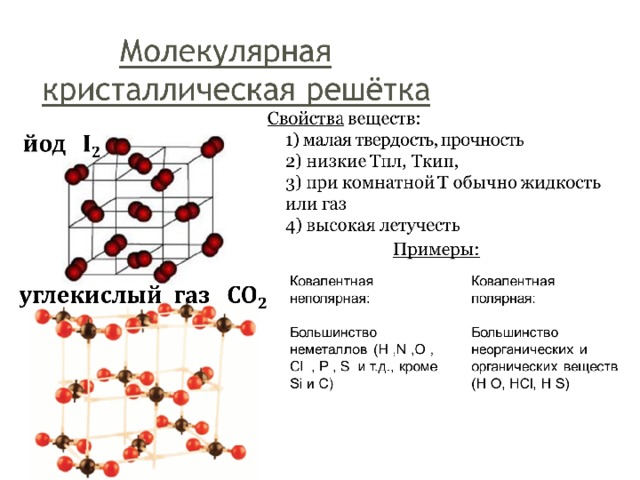 д.
д.
 Какое координационное число у атома кобальта?
Какое координационное число у атома кобальта?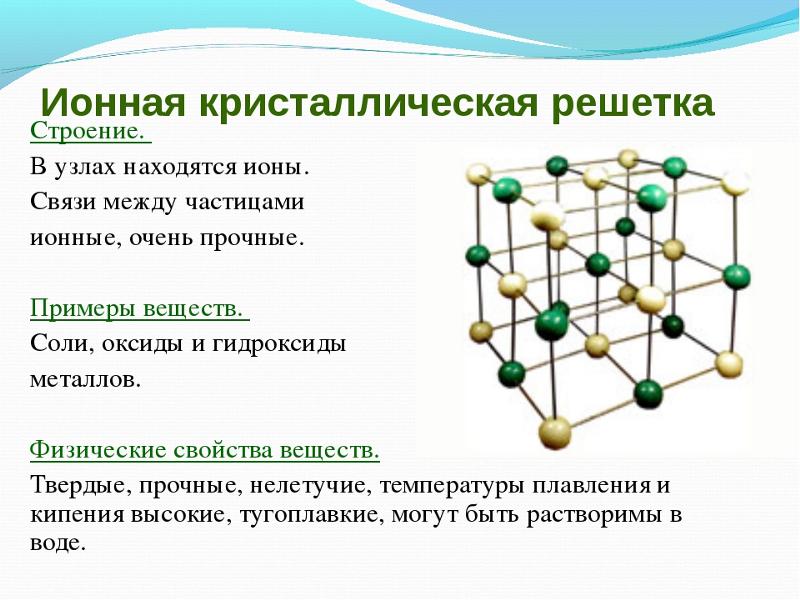
 Какова формула соединения? Поясните свой ответ.
Какова формула соединения? Поясните свой ответ.
 Длина ребра элементарной ячейки TlI составляет 4,20 Å.
Длина ребра элементарной ячейки TlI составляет 4,20 Å.