Свойства закись меди: Закись меди | это… Что такое Закись меди?
alexxlab | 17.06.2023 | 0 | Разное
Закись меди, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Окись меди
- Реактивы
Окись меди
ГОСТ 16539-71
CuO
Оксид меди(II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Оксид меди получается нагреванием металлической меди в присутствии кислорода (на воздухе) при температуре ниже 1100. Другой способ получения – нагреванием гидроксида, нитрата или карбоната меди (II). В промышленности используется взаимодействием сульфата меди с гидроксидом натрия или калия при 80-90 С или с водным раствором аммиака и разложением получившегося гидроксида натрия примерно при 200С. В зависимости от содержания примесей на оксид меди цена может меняться довольно существенно, за подробностями обращайтесь по телефонам, указанным на сайте.
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм, b = 0.34226(5) нм, c = 0.51288(6) нм, α = 90°, β = 99,54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
-
- (тетрагидроксокупрат(II) натрия).

- (тетрагидроксокупрат(II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
Применение:
CuO применяют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
Оксиды меди активно используются в гальванотехники для приготовления электролитов. Является сильным окислителем и разлагается при температуре 400 С и выше. Катализатор ряда процессов. Имеет перспективное использование как высокотемпературный сверхпроводник.
Оксид меди используется для производства эмалей, керамики, глазурей и стекол, которым она придает синие и зеленые оттенки, оксид меди используют для производства медно-рубинового стекла. Используется как химический индикатор, меняющий цвет на розовый в процессе восстановления. Окрашивает пламя в синий цвет. Добавляется в комбикорма к животным.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
- Назад
- Вперед
Свойства и применение оксида меди (меди)
Оксид меди также широко известен как оксид меди, который в основном представляет собой неорганическое соединение, состоящее из меди и кислорода. Он обладает превосходными свойствами, которые позволяют ему превзойти многие соединения меди. Они также обладают полупроводниковыми свойствами, что позволяет им иметь соответствующие приложения.
Существует множество применений оксида меди , так как существует несколько различных типов и способов его оксид меди существует. Все эти различные типы производятся после прохождения различных процессов, которые являются подлинными по своей природе. Все их возможности зависят от свойств, которые проявляют эти соединения и в конечном итоге приводят к различным применениям, каждое из которых является уникальным по своей природе.
Введение
С формулой Cu2O оксид меди или оксид меди (I) является неорганическим соединением. Один из основных оксидов меди известен как оксид меди (I) или оксид меди, а другой — оксид меди (CuO) или оксид меди (II). Это сплошной красный цвет, который входит в состав некоторых необрастающих красок. Цвет этого соединения может быть красным или желтым, он определяется размером частиц. Оксид меди (I) можно найти в виде куприта, красноватого минерала.
Это диамагнитное твердое тело. Оксиды тетраэдрические, а центры меди 2-координированы по своим координационным сферам. В некотором смысле существует сходство структуры с основными полиморфами SiO2, и обе структуры имеют взаимопроникающие решетки.
Бесцветный комплекс [Cu(Nh4)2]+ образуется при растворении оксида меди(I) в концентрированном растворе аммиака, и этот бесцветный комплекс легко превращается в синий [Cu(Nh4)4(h3O)2]2+ после окисляется на воздухе. Он дает растворы CuCl-2 при растворении в соляной кислоте. Нитрат меди (II) и сульфат меди (III), получаемые разбавленной азотной и серной кислотами. Во влажном воздухе Cu2O разлагается до оксида меди (II).
Нитрат меди (II) и сульфат меди (III), получаемые разбавленной азотной и серной кислотами. Во влажном воздухе Cu2O разлагается до оксида меди (II).
Полупроводниковые свойства
Cu2O является одним из материалов, для которых было проведено множество исследований в истории физики полупроводников, и были продемонстрированы многочисленные экспериментальные применения этого материала в полупроводниках:
-фоноритоны (” когерентная суперпозиция экситона, фотона и фонона»).
-Полупроводниковые диоды
-Полупроводники
Низшие экситоны Cu2O очень долгоживущие. Ширины линий в нэВ используются для объяснения формы линий поглощения, что является самым узким из когда-либо наблюдавшихся объемных экситонных резонансов. Низкой групповой скоростью обладают ассоциированные квадрупольные поляритоны, и они приближаются к скорости звука. Следовательно, в этой среде движение света такое же медленное, как звук, что приводит к высокой плотности поляритонов. Экситоны в основном состоянии обладают многими замечательными особенностями, и одна из них заключается в том, что все первичные механизмы рассеяния известны количественно.
Экситоны в основном состоянии обладают многими замечательными особенностями, и одна из них заключается в том, что все первичные механизмы рассеяния известны количественно.
Cu2O был веществом, для которого можно установить полностью беспараметрическую модель расширения ширины линии поглощения в зависимости от температуры, позволяющую вычислить соответствующий коэффициент поглощения. Соотношения Крамерса-Кронига неприменимы к поляритонам, и для демонстрации этого можно использовать Cu2O.
Если вы заинтересованы в автомобильных приложениях для литий-ионных аккумуляторов,
вы можете прочитать наш блог здесь .
Производство морфологических кристаллов Cu2O с различной архитектуройОсновные стратегии синтеза ограненных кристаллов Cu2O
Многие синтетические методы, такие как метод облучения, распыление, гидротермический синтез, электроосаждение и влажно-химический синтез и жидкостное восстановление могут быть использованы для получения ограненных микро-/нанокристаллов Cu2O. Наиболее широко используемый метод среди них – это метод влажной химии для управления экспозиционными гранями кристаллов Cu2O из-за универсальной возможности настройки скорости роста и зародышеобразования в различных ориентациях.
Наиболее широко используемый метод среди них – это метод влажной химии для управления экспозиционными гранями кристаллов Cu2O из-за универсальной возможности настройки скорости роста и зародышеобразования в различных ориентациях.
Закон Гиббса-Вульфа теоретически определяет равновесную форму кристалла. Грани с высокой поверхностной энергией обычно уменьшаются по сравнению с окончательным видом или исчезают в равновесных условиях, особенно для граней с высоким индексом. Однако в реальных условиях взаимодействие между кинетикой и термодинамикой приводит к открытым граням и окончательной форме кристаллов.
Термодинамическая точка зрения
Согласно термодинамической точке зрения, неотъемлемая потребность в уменьшении общей поверхностной энергии определяет изменение формы кристалла в процессе его роста. Специфическая селективная по граням адсорбция блокирующего реагента (включая неорганический ион, примесную молекулу, полимер и поверхностно-активное вещество) в системе раствор-фаза является эффективным методом выявления различных граней и снижения поверхностной энергии, что приводит к появлению неравновесной конструкции Вульфа. . Роль укупорочного реагента в адаптации морфологии кристалла предлагает руководство для рационального проектирования и синтеза микро-/нанокристаллов Cu2O с требуемыми характеристиками поверхности.
. Роль укупорочного реагента в адаптации морфологии кристалла предлагает руководство для рационального проектирования и синтеза микро-/нанокристаллов Cu2O с требуемыми характеристиками поверхности.
Способность и селективность покрывающего агента
В принципе, расстояние между двумя соседними недокоординированными атомами Cu на гранях и/или плотность недокоординированных атомов Cu определяют способность и селективность покрывающего агента на различных гранях кристалла Cu2O. Таким образом, выбор укупорочного агента важен для контроля сохранности граней кристаллов Cu2O. Благодаря разнообразию органических укупорочных агентов они играют важную роль в контроле формы кристаллов Cu2O. Например, додецилсульфат натрия (ДСН) и поли(винилпирролидон) (ПВП) с различными зарядами могут действовать как покрывающие агенты граней.
Формирование граней кристалла
Кроме того, неорганические ионы могут использоваться в качестве укупорочных агентов для формирования определенных граней кристалла, и в последние годы появились сообщения об успешном применении этого метода. Более того, поверхностные энергии открытых граней определяются пересыщением растущих частиц во время роста кристаллов в термодинамике, что обеспечивает общий способ получения конкретных высокоэнергетических поверхностей. Контролируя особенности частиц [Cu(OH)4] 2–, можно легко добиться изменения формы Cu2O, особенно от простой к сложной архитектуре.
Более того, поверхностные энергии открытых граней определяются пересыщением растущих частиц во время роста кристаллов в термодинамике, что обеспечивает общий способ получения конкретных высокоэнергетических поверхностей. Контролируя особенности частиц [Cu(OH)4] 2–, можно легко добиться изменения формы Cu2O, особенно от простой к сложной архитектуре.
Эволюция формы
Скорость роста различных граней существенно определяет эволюцию формы кристалла в процессе его зарождения и роста. Редуценты настроены на создание различных неравновесных архитектур, которые могут существенно влиять на способ роста и зародышеобразования. Хотя в кинетический контроль всегда вовлечены различные сложные факторы, остается неясной взаимосвязь между кинетическим фактором и структурой фасеток. Направленное химическое травление, основанное на кристаллографической анизотропии, широко используется для адаптации архитектуры Cu2O, что дает определенные преимущества при формировании Cu2O с определенными поверхностными атомными структурами.
Полые кристаллы Cu2O
Будучи одним из видов перспективной архитектуры, были проведены обширные исследования полых наноструктур из-за их хорошей поверхностной проницаемости для переноса массы и заряда (газа), показателя преломления, коэффициента теплового расширения, низкой плотности. , и большая площадь поверхности. Таким образом, точно настроить поведение поверхности полой структуры сложно, и полное понимание процесса роста и механизмов производства имеет значительную научную ценность.
До сих пор было предпринято огромное количество усилий для получения многочисленных полых архитектур Cu2O (например, многооболочечные сферы, нанокаркасы и наноклетки) с помощью различных механизмов роста, таких как созревание Оствальда, окислительное травление и твердофазное прекурсорное превращение (включая CuO и CuCl). В этой статье мы кратко остановились на повторяющихся механизмах и подходах к получению полых кристаллов Cu2O.
Природа кристаллов
При наличии различных межчастичных границ синтезированные полые кристаллы Cu2O в основном являются поликристаллическими. Хотя как структурная когерентность, так и дальнодействующая электронная связь одинаково важны для повышения как подвижности электронов, так и высокой проводимости. Таким образом, интеграция одиночных и полых кристаллических оболочек в кристаллы Cu2O является решением для удовлетворения спроса, но все же остается проблемой.
Хотя как структурная когерентность, так и дальнодействующая электронная связь одинаково важны для повышения как подвижности электронов, так и высокой проводимости. Таким образом, интеграция одиночных и полых кристаллических оболочек в кристаллы Cu2O является решением для удовлетворения спроса, но все же остается проблемой.
По сравнению с классическими моделями роста ориентированное прикрепление отличается, что обычно происходит до процесса созревания Оствальда для создания полой архитектуры. Например, образованию многослойных полых сфер Cu2O с монокристаллической оболочкой способствовала многослойная везикула, и это было продемонстрировано в системе CuSO4/бромид цетилтриметиламмония (CTAB)/AA/NaOH.
Пористые кристаллы Cu2O
Огромное внимание привлекли пористые наноматериалы с контролируемыми порами из-за их способности взаимодействовать с молекулами, ионами и атомами не только на поверхности, но и внутри. В этом смысле наилучшая производительность этих архитектур наблюдается в мезопористых системах. До сих пор был успешный синтез пористых материалов Cu2O, и их применение в основном связано с адсорбцией катализаторов и красителей. Таким образом, по-прежнему важно изготавливать и проектировать новые пористые наноструктуры Cu2O с хорошими характеристиками и подходящими размерами пор.
До сих пор был успешный синтез пористых материалов Cu2O, и их применение в основном связано с адсорбцией катализаторов и красителей. Таким образом, по-прежнему важно изготавливать и проектировать новые пористые наноструктуры Cu2O с хорошими характеристиками и подходящими размерами пор.
Первоначально небольшие строительные блоки наночастиц объединяются вместе во время роста кристаллов Cu2O в фазе раствора, и агрегаты часто превращаются в сравнительно стабильные структуры за счет механизма созревания для минимизации общей энергии реакционной системы, поэтому, когда вводятся некоторые полимерные или органические молекулы, есть шансы модификации поверхностных энергий строительных блоков. Таким образом, важную роль будет играть адаптация поведения агрегации строительных блоков наночастиц в управлении производством пористых наноструктур Cu2O.
Метод мягких шаблонов
Метод мягких шаблонов широко используется для проектирования пористых наносфер Cu2O. Гидроксильная группа, например, действует как закрывающий радикал, а также может вызывать модификацию способа агрегации строительных блоков, что приводит к образованию неупорядоченных пористых наносфер Cu2O. Были демонстрации сборки пористых наносфер Cu2O, управляемой β-циклодекстрином (β-CD).
Гидроксильная группа, например, действует как закрывающий радикал, а также может вызывать модификацию способа агрегации строительных блоков, что приводит к образованию неупорядоченных пористых наносфер Cu2O. Были демонстрации сборки пористых наносфер Cu2O, управляемой β-циклодекстрином (β-CD).
Архитектура типа краун-эфира может быть получена при связывании сегментов этиленоксида в сегментах поли(этиленоксида) (ПЭО) триблок-сополимера в водном растворе с ионами металлов, и это является результатом диполь-ионных взаимодействий между этиленоксид связывает электрон неподеленной пары и ион металла. Таким образом, атомы меди объединяются с атомом кислорода в гидрофильную группу ПЭО преимущественно с помощью триблок-сополимеров с образованием ближнеупорядоченных мезопористых сфер Cu2O.
Высокоупорядоченные пористые наноструктуры
Следует отметить, что высокоупорядоченные пористые наноструктуры обладают значительными преимуществами из-за их большой площади поверхности, поскольку они предлагают больше активных участков для трехмерных связанных сетей и каталитическую реакцию для переноса массы (например, ион и молекула) снаружи внутрь для ускорения химической реакции. Хотя управление формой пористых наноматериалов посредством самоорганизации с помощью органических агентов является более сложным по сравнению с управлением формой неупорядоченных пористых материалов. Поэтому разработка упорядоченных несферических пористых наноструктур Cu2O по-прежнему остается сложной задачей.
Хотя управление формой пористых наноматериалов посредством самоорганизации с помощью органических агентов является более сложным по сравнению с управлением формой неупорядоченных пористых материалов. Поэтому разработка упорядоченных несферических пористых наноструктур Cu2O по-прежнему остается сложной задачей.
Тонкие пленки Cu2O
Еще одним важным вопросом для расширения применения в преобразовании энергии является разработка тонких пленок Cu2O с индивидуальной архитектурой. При приготовлении тонких пленок Cu2O обязательно следует учитывать эти два основных момента. Во-первых, это тесный контакт между подложками и тонкими пленками Cu2O, обеспечивающий перенос носителя заряда с гладкой границей раздела. Во-вторых, настройка ориентации строительного блока в фильме для получения максимальных преимуществ. До сих пор существовали различные применения многочисленных методов синтеза, таких как анодное окисление, напыление, электроосаждение, химическое осаждение из паровой фазы и термическое окисление для получения Cu2O.
Электроосаждение
Электроосаждение является одним из широко доступных методов, которые являются дешевым и универсальным методом создания тонких пленок на проводящих подложках, который позволяет эффективно контролировать форму, размеры и ориентацию электроосажденных пленок путем регулировки электрохимические условия раствора (например, добавка, растворитель, вид субстрата, значение pH, приложенное напряжение, температура, концентрация и т. д.).
Можно легко получить тонкие пленки Cu2O с рядом симметричных дендритных морфологий и ориентаций, а также можно получить оптимальное сочетание характеристик переноса заряда и площади поверхности, что приводит к применениям в преобразовании солнечной энергии.
Распределение строительных блоков
Усовершенствованный метод электроосаждения был использован Чжаем и его сотрудниками для специального контроля распределения ориентации строительных блоков в тонких пленках Cu2O для получения ориентированных тонких пленок Cu2O с различными гранями и высокой степенью кристаллизации в ионах лимонной кислоты. присутствие при сравнительно более высоком значении pH и умеренной температуре.
присутствие при сравнительно более высоком значении pH и умеренной температуре.
Чтобы получить дополнительную информацию о порошке Copper Micron,
, вы можете прочитать наш блог здесь 6 9 0.
До сих пор Cu2O в основном применялся в области преобразования энергии и окружающей среды, в частности, в химических темплатах, датчиках и катализаторах. Основное внимание в этом разделе мы уделяем обычно улучшенным и необычным характеристикам, которые создаются путем адаптации гибридных нанокомпозитов Cu2O и кристаллических граней Cu2O. Кроме того, вкратце освещается стратегия использования граненого шаблона Cu2O для создания полых архитектур четкой формы.
КатализаторыФотодеградация
В соответствии с практическими применениями, включая органический синтез, восстановление CO2, расщепление воды и разложение загрязняющих веществ, использование фотокатализа делится на четыре основные области. Во всех этих областях использовались фотокатализаторы на основе Cu2O. Были продемонстрированы фотокатализаторы Cu2O с большой площадью поверхности, которые эффективны для фотокаталитической деградации загрязнителей из-за длительного образования сильных окислителей под воздействием солнечного света.
Во всех этих областях использовались фотокатализаторы на основе Cu2O. Были продемонстрированы фотокатализаторы Cu2O с большой площадью поверхности, которые эффективны для фотокаталитической деградации загрязнителей из-за длительного образования сильных окислителей под воздействием солнечного света.
Хотя, когда дело доходит до реагентов, эти окисляющие частицы менее селективны, что приводит к плохой селективности фотокатализатора. Помимо эффекта интерфейса гибридных наноструктур на основе Cu2O, платформа предлагается за счет адаптации граней кристалла для повышения селективности, при которой адсорбция-десорбция реагентов может зависеть от поверхностных атомных структур, и окислительно-восстановительный потенциал фотогенерируемых дырки и электроны могут быть настроены соответствующими электронными структурами.
Фотоэлектрохимическое расщепление воды
Солнечная энергия может собираться фотоэлектрохимическими (PEC) солнечными элементами для преобразования ее в водородное топливо посредством расщепления воды. Полупроводник Cu2O p-типа представляет особый интерес для расщепления солнечной воды PEC и генерации водорода из-за его уникальных характеристик, таких как прямая запрещенная зона 2,0 ~ 2,2 эВ для благоприятных положений энергетических зон, хорошая подвижность носителей и поглощение видимого света для Расщепление воды ФЭП с полосой проводимости, лежащей на +0,7 В ниже потенциала выделения водорода.
Полупроводник Cu2O p-типа представляет особый интерес для расщепления солнечной воды PEC и генерации водорода из-за его уникальных характеристик, таких как прямая запрещенная зона 2,0 ~ 2,2 эВ для благоприятных положений энергетических зон, хорошая подвижность носителей и поглощение видимого света для Расщепление воды ФЭП с полосой проводимости, лежащей на +0,7 В ниже потенциала выделения водорода.
Были сообщения о теоретически оцененном фототоке -14,7 мАсм-2 с соответствующей эффективностью 18% для преобразования света в водород. Недавно было проведено исследование одного фотокатализатора Cu2O для производства водорода и расщепления воды с помощью солнечной энергии. Стабильность Cu2O в некоторой степени зависит от его морфологии, в которой стабильность улучшается за счет быстрого удаления фотогенерированного носителя с поверхности фотокатода.
Разложение
Однако фотокатализаторы Cu2O могут разлагать воду в дистиллированной воде на кислород и водород под действием видимого света, но это сильно отличается от фотохимической реакции в водном электролите на поляризованных электродах Cu2O.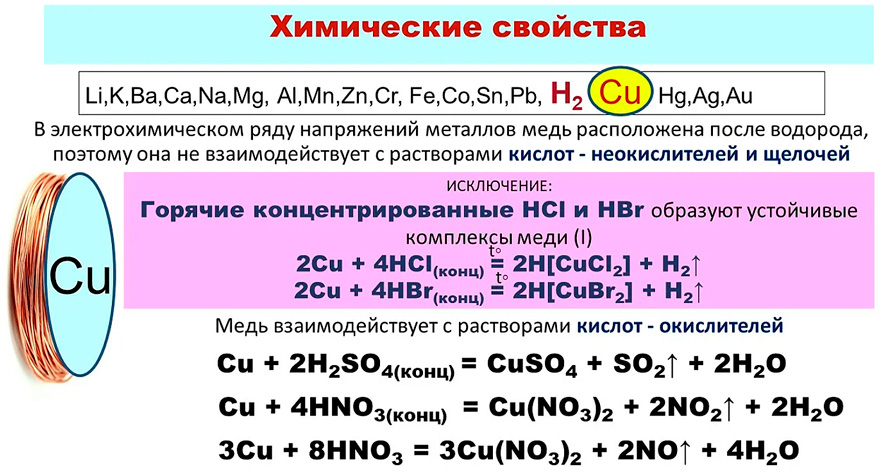
Поскольку окислительно-восстановительные потенциалы для окисления и восстановления одновалентного Cu2O находятся в пределах запрещенной зоны, использование Cu2O для восстановления воды в качестве фотокатода связано с нестабильностью электролита при освещении, что ограничивает их применение в производстве солнечной энергии. Таким образом, Cu2O может быть перспективным материалом в сочетании с соответствующей окислительно-восстановительной системой в качестве фотоэлектрода p-типа в электрохимической фотогальванической ячейке. Поэтому стабилизация поверхности фотоэлектродов Cu2O требует использования конформного покрытия.
Фотовосстановление двуокиси углерода
Мы можем удовлетворить растущие потребности в чистой энергии путем фотохимического восстановления двуокиси углерода (CO2) до химических веществ или топлива с добавленной стоимостью. Согласно недавним открытиям, Cu2O является подходящим фотокатализатором для фотовосстановления диоксида углерода, которое вызывается видимым светом.
Наблюдение за влиянием фасетки Cu2O на фотовосстановление СО2 было чрезвычайно интересным и, согласно результатам, по сравнению с октаэдрическими более высокую активность проявлял кубовидно-агрегированный Cu2O. По сравнению с массивами нанопоясов Cu2O в восстановлении СО2 более высокой активностью обладает камнеподобный Cu2O p-типа как в фотоэлектрохимических, так и в электрохимических системах. Тем не менее, все еще существует потребность в подробных исследованиях для раскрытия подчеркнутых принципов фотовосстановления CO2, зависящих от аномальных аспектов.
Улучшение
Наноструктуры на основе Cu2O могут значительно повысить эффективность преобразования диоксида углерода. Например, при солнечном свете фотоэлектрохимическое восстановление углекислого газа может быть улучшено с помощью Cu2O, закрепленного на поверхности медного электрода. По сравнению с эффективностью преобразования углекислого газа на электроде Cu/Cu2O (n-типа) с той же морфологией, что и у p-типа, эффективность преобразования на электроде Cu/Cu2O (p-типа) намного выше.
Осаждение наночастиц RuOx на Cu2O привело к двукратному увеличению выхода долгоживущих электронов, что приводит к улучшению фотовосстановления диоксида углерода под действием видимого света. Улучшенную фотокаталитическую активность в восстановлении диоксида углерода до метанола могут проявлять массивы нанотрубок с гетероструктурой Cu2O/TiO2, изготовленные методом электроосаждения. Пористый нанопереход Cu2O/TiO2 может обеспечить большее количество активных центров фотореакции, и они также могут способствовать поглощению CO2.
Датчики газа
В последние десятилетия было проведено огромное количество исследований газочувствительных материалов для обнаружения целевого газа, которые затрагивают области здравоохранения, общественной безопасности, защиты окружающей среды и химической промышленности. Подходящее количество деионизированной воды смешивали с испытанным газочувствительным материалом и вышеупомянутую пасту наносили двумя электродами на керамическую трубку. Затем был изготовлен газовый датчик с непрямым нагревом путем помещения проволочного нагревателя в центр керамической трубки.
Затем был изготовлен газовый датчик с непрямым нагревом путем помещения проволочного нагревателя в центр керамической трубки.
Ток нагрева газовой системы обогрева был отрегулирован для получения различных рабочих температур датчика. Наконец, после старения со стабильным напряжением при определенном относительном токе в течение длительного времени было достигнуто обнаружение газа.
Прочие области применения До сих пор кристаллы Cu2O использовались, главным образом, в области химических шаблонов, сенсорных шаблонов и фотокатализаторов. Хотя в таких приложениях, как память с резистивным переключением металл-изолятор-металл, суперконденсаторы, натрий-ионные батареи, литий-ионные батареи, преобразование солнечной энергии и антибактериальная активность, кристаллы Cu2O с индивидуальной архитектурой имеют важное значение. Таким образом, для продвижения вышеуказанных приложений требуется адаптация индекса фасетки кристаллов Cu2O для формирования конкретных реакционных поверхностей.
Например, Ван и его коллеги продемонстрировали антибактериальную активность, зависящую от морфологии. Согласно полученным результатам, по сравнению с кубическими, обусловленными различным расположением атомов на открытой поверхности, более высокой активностью в уничтожении E. coli обладал октаэдрический Cu2O.
Бактериостатические эффекты
Кроме того, Cu2O проявляет очевидные бактериостатические эффекты, которые в основном определяются их морфологией. Например, согласно выводам Гуо и его сотрудников, по сравнению с кубическими, октаэдрические нанокристаллы Cu2O производят больше активных форм кислорода и более высокий коэффициент иммобилизации, что позволяет предположить, что два морфологических нанокристалла оказывают разное токсическое воздействие на кладоцер из-за их различий. в конкретных поверхностных действиях.
Были проведены исследования электрохимических характеристик литирования различных полиэдрических Cu2O в качестве анодов для литий-ионных аккумуляторов. Ожидается, что использование Cu2O с адаптированной архитектурой в этих приложениях приведет к некоторым ожидаемым характеристикам. Хотя применение кристаллов Cu2O во всех вышеперечисленных областях еще продолжается.
Ожидается, что использование Cu2O с адаптированной архитектурой в этих приложениях приведет к некоторым ожидаемым характеристикам. Хотя применение кристаллов Cu2O во всех вышеперечисленных областях еще продолжается.
Окись меди уникальна по своей природе благодаря превосходным свойствам и имеет замечательные применения, которые очень отличаются друг от друга, но очень уникальны по своей природе. Все эти приложения увеличивают производительность оксида меди, поскольку именно они поднимают весь нарост продукта.
Чтобы получить дополнительную информацию, вы можете посетить Blografi .
Ссылки
https://pdf.sciencedirectassets.com/271965/1-s2.0-S0079642518X00048/1-s2.0-S0079642518300367/amz-09: https://pdf.sciencedirectassets.com/271965/1-s2.0-S0079642518300367/amz-09: //www.sciencedirect.com/science/article/abs/pii/00381101867
https://cutt. ly/9H0cp29
ly/9H0cp29
https://www.britannica.com/science/cuprous-oxide
https:/ /www.sciencedirect.com/topics/химия/оксид меди
6 декабря 2021 г. Линси Харт
Оксид меди – свойства, структура, использование и получение
Здесь мы представим и обсудим некоторые явления, связанные с проводимостью в оксиде меди. Медь является хорошим проводником электричества, но естественная окисленная форма Cu2O является не только изолятором, но и светочувствительным (то же самое относится и к большинству других переходных металлов). К счастью, этот оксид можно легко восстановить до металлической меди с помощью тепла или электричества. Оксид меди является хорошим изолятором и светочувствительным веществом, но его можно легко преобразовать в более проводящий металл меди с помощью тепла или электричества. Одним из наиболее важных свойств проводимости в таких материалах является то, что она следует правилу правой руки, которое гласит, что токи будут течь по пути большого пальца вашей правой руки. Здесь мы покажем, что это относится не только к проводимости металлов, но и к фоточувствительности диэлектриков типа Cu2O.
Здесь мы покажем, что это относится не только к проводимости металлов, но и к фоточувствительности диэлектриков типа Cu2O.
Основные принципы электропроводности
Прежде чем мы сможем обсудить явления, связанные с проводимостью в оксиде меди, важно, чтобы вы знали некоторые очень основные принципы электропроводности и того, что происходит с ней при наличии электрического тока. С каждым движущимся зарядом связано магнитное поле (следствие закона Фарадея). Таким образом, постоянный поток электронов в проводе приводит к постоянному и ненулевому магнитному полю, окружающему провод. Если бы вы поместили компас рядом с проводом, вы бы заметили, что стрелка компаса указывает вдоль провода. Это потому, что магнитное поле вокруг провода указывает в том же направлении, что и стрелка компаса.
Размещение металлического предмета рядом с проводом и параллельно ему
Теперь мы посмотрим, что произойдет, если вы поместите металлический предмет рядом с проводом и параллельно ему, а затем включите (или выключите) электричество в этом проводе: во-первых, начнем со случая, когда ток в проводе отсутствует. В этом случае вокруг провода есть магнитное поле, но силовое поле или потенциально связанное с ним поле не указывает на ваш большой палец. Мы говорим, что это магнитное поле направлено ортогонально вашему большому пальцу, и назовем это направление «вверх». Теперь вы заметите, что оно отклоняется или вращается так, что его силовое поле указывает вместе с вашим большим пальцем. Мы говорим, что силовое поле повернулось на 90 градусов.
В этом случае вокруг провода есть магнитное поле, но силовое поле или потенциально связанное с ним поле не указывает на ваш большой палец. Мы говорим, что это магнитное поле направлено ортогонально вашему большому пальцу, и назовем это направление «вверх». Теперь вы заметите, что оно отклоняется или вращается так, что его силовое поле указывает вместе с вашим большим пальцем. Мы говорим, что силовое поле повернулось на 90 градусов.
Размещение металлического предмета рядом с проводом и перпендикулярно ему
Точно так же, если вы поместите металлический предмет перпендикулярно проводу, но со стороны большого пальца, он будет отклонен или повернут так, что его силовое поле будет указывать на из ваших пальцев. По соглашению, направление от вашего тела является положительным. Другими словами, наш большой палец указывает направление, в котором ток будет течь по проводу.
Что такое оксид меди(I)?
Оксид меди, в котором медь находится в жидкой форме, называется оксидом меди. Cu2O представляет собой химическую структуру закиси меди. Ну, здесь в Cu2O медь и кислород имеют ковалентную связь; следовательно, он, естественно, имеет ковалентные связи. Кристаллы закиси меди имеют кубическую форму. При нагревании раствора Cu2O в присутствии водорода раствор быстро восстанавливается. Он диспропорционирует в растворе кислоты с образованием ионов меди и меди (II). Закись меди при нагревании с металлической медью превращается в закись меди. При наличии влаги в воздухе кислород вступает в реакцию с медью на поверхности любого предмета, и закись меди может действовать в таких условиях как антикоррозионная защита. Он будет служить защитным слоем тонкого оксида.
Cu2O представляет собой химическую структуру закиси меди. Ну, здесь в Cu2O медь и кислород имеют ковалентную связь; следовательно, он, естественно, имеет ковалентные связи. Кристаллы закиси меди имеют кубическую форму. При нагревании раствора Cu2O в присутствии водорода раствор быстро восстанавливается. Он диспропорционирует в растворе кислоты с образованием ионов меди и меди (II). Закись меди при нагревании с металлической медью превращается в закись меди. При наличии влаги в воздухе кислород вступает в реакцию с медью на поверхности любого предмета, и закись меди может действовать в таких условиях как антикоррозионная защита. Он будет служить защитным слоем тонкого оксида.
Оксид меди представляет собой чистое соединение всех разновидностей соединений меди. Это заметно из-за удобства использования и универсальности физических свойств. Сверхпроводимость при более высокой температуре, эффекты электронных корреляций и спиновая динамика делают оксид меди полезным во многих отношениях. Кроме того, оба свойства, то есть химическое и физическое, очень стабильны и, следовательно, могут быть легко смешаны с водными растворами или полимерами. Кроме того, оксид меди не дорог.
Кроме того, оба свойства, то есть химическое и физическое, очень стабильны и, следовательно, могут быть легко смешаны с водными растворами или полимерами. Кроме того, оксид меди не дорог.
Другие химические названия, используемые для оксида меди:
Красный Cu2O,
Оксид меди
Оксид меди.
CU2O Химические названия:
Медный (I) Оксид
Медные (II) Оксид
Физические свойства
88. сбивает с толку, так как иногда вы могли видеть красные или черные оксиды меди. Что ж, здесь вы должны иметь четкое представление о том, что существует два типа оксидов меди, такие как оксид меди (I) черного цвета и оксид меди (II) красного цвета.
Прочие характеристики Cu2O (оксида меди(I)
Плотность – 6 г/см3
Молекулярный вес/Молярная масса – 143,09 г/моль
Температура кипения – 1800 °C
6Температура плавления2 – 1, Химическая формула оксида меди – Cu2O
Структура оксида меди(I) – Cu2O
Физические свойства оксида меди(I) – Cu2O
Внешний вид – твердое вещество красного цвета
Запах – без запаха
Ковалентно-связанная единица – 3
Сложность – 2,8
Количество тяжелых атомов – 3
Растворимость – нерастворим в воде
Химические свойства оксида меди(I) – Cu2O
Оксид меди(I) может реагировать с водой, так как кислород присутствует в воды и получить гидроксид меди (II). Ниже приводится химическое уравнение для понимания химической реакции оксида меди (I) и воды.
2Cu2O + 4h3O + O2 → 4Cu(OH)2
В результате химической реакции между хлористым водородом и оксидом меди (I) образуется хлорид меди (I). Что ж, кислород оксида меди (I) восстанавливается атомами хлора и относительно образует хлорид меди. Вы можете понять химическую реакцию между хлористым водородом и Cu2O из приведенного ниже химического уравнения.
Cu2O + 2HCl → 2CuCl + h3O
Использование оксида меди Cu
2 OДно корабля обычно подвергается воздействию морской воды, поэтому дно необходимо покрыть краской, а оксид меди — лучший вариант для необрастающих красок. Оксид меди обладает свойством эффективно контролировать коррозию.
Часть фарфоровых красок.
Фотоэлементы для изготовления выпрямителей и люксметров содержат полупроводники p-типа, которые могут быть оксидом углерода.

Может использоваться как протравитель семян и фунгицид.
Они используются в высокотехнологичных сверхпроводниках, полупроводниках и преобразовании солнечной энергии.
Может применяться в термоэлектрических материалах, катализаторах, сверхпроводящих материалах, стекле, сенсорных материалах, керамике и других областях.
Разница между оксидом меди и оксидом меди
Медь образует два разных оксида в зависимости от валентности: оксид меди и оксид меди. Оксид меди представляет собой порошок коричневого цвета, а оксид меди — красный. Когда атом медной полосы присоединен к молекуле кислорода, то это медная кислота. Когда атом кислорода присоединен к двум атомам меди, говорят, что это оксид меди. Оксид меди в основном находится в активном состоянии, тогда как оксид меди находится в полностью окисленном состоянии.
Насколько оксид меди безвреден для человека?
Высокореактивные молекулы необходимы для уничтожения бактерий, а оксид меди хорошо удерживает электроны. Он также может высвобождать свободные радикалы, а также обладает способностью уничтожать любой патоген, если он обнаружен на поверхности. Закись меди нестабильна и поэтому действует быстрее, чем окись меди. Таким образом, можно сделать вывод, что закись меди безопасна для человека и токсична для бактерий. Что ж, размер также имеет значение, когда речь идет о соотношении между клетками оксида меди и некоторыми бактериями.
Получение оксида меди
Наиболее распространенным способом образования оксида меди (I) является окисление металлической меди.
4Cu + O2 → 2Cu2O
Это происходит, если оставить медь на воздухе. Это чертовски медленно (как железо ржавеет). Вы можете ускорить процесс, добавив воду и определенные кислоты, но он все равно будет медленным.

