Таблица менделеева молибден: Таблица Менделеева online – Mo
alexxlab | 09.02.2023 | 0 | Разное
Таблица Менделеева online – Mo
Mo
42
1
13
18
8
2
95.94±1
4d55s1
Молибден
| Относительная электроотрицательность (по Полингу): | 1,30 |
| Температура плавления: | 2890 K |
| Температура кипения: | 4885 K |
| Теплопроводность: | 0 |
| Плотность: | 10,22 г/см3 |
| Открыт: | в 1817 году получил Й. Берцелиус восстановлением оксида водородом |
| Цвет в твёрдом состоянии: | |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d105f146s26p66d67s2 |
| Электронная формула: |
Mo – 1s Mo – [Kr] 4d5 5s1 |
| Валентность: | (+2), +3, (+4), (+5), +6 |
| Степени окисления: | 0 , +IV, VI |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | |
Электропроводность в тв. фазе: фазе: |
|
| Ковалентный радиус: | |
| Атомный объем: | |
| Атомный радиус: | 139 пм |
| Теплота распада: | |
| Теплота парообразования: | |
| Кристаллическая структура: | кубическая объёмноцентрированая |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 83Mo | 42 | 41 | 82,94874 | 23 мс | 3/2- |
| 84Mo | 42 | 42 | 83,94009 | 3,8 мс | 0+ |
| 85Mo | 42 | 43 | 84,93655 | 3,2 с | 1/2- |
| 86Mo | 42 | 44 | 85,93070 | 19,6 с | 0+ |
| 87Mo | 42 | 45 | 86,92733 | 14,05 с | 7/2+ |
| 88Mo | 42 | 46 | 87,921953 | 8,0 мин | 0+ |
| 89Mo | 42 | 47 | 88,919480 | 2,11 мин | 9/2+ |
| 89mMo | 387,5 кэВ | 190 мс | 1/2- | ||
| 90Mo | 42 | 48 | 89,913937 | 5,56 ч | 0+ |
| 90mMo | 2,87473 МэВ | 1,12 мкс | 8+ | ||
| 91Mo | 42 | 49 | 90,911750 | 15,49 мин | 9/2+ |
| 91mMo | 653,01 кэВ | 64,6 с | 1/2- | ||
| 92Mo | 42 | 50 | 91,906811 | стабилен | 0+ |
| 92mMo | 2,76046 МэВ | 190 нс | 8+ | ||
| 93Mo | 42 | 51 | 92,906813 | 4,0 тыс. лет лет |
5/2+ |
| 93mMo | 2424,89 кэВ | 6,85 ч | 21/2+ | ||
| 94Mo | 42 | 52 | 93,9050883 | стабилен | 0+ |
| 95Mo | 42 | 53 | 94,9058421 | 5/2+ | |
| 96Mo | 42 | 54 | 95,9046795 | стабилен | 0+ |
| 97Mo | 42 | 55 | 96,9060215 | стабилен | 5/2+ |
| 98Mo | 42 | 56 | 97,9054082 | стабилен | 0+ |
| 99Mo | 42 | 57 | 98,9077119 | 2,7489 d | 1/2+ |
| 99m1Mo | 97,785 кэВ | 15,5 мкс | 5/2+ | ||
| 99m2Mo | 684,5 кэВ | 760 нс | 11/2- | ||
| 100Mo | 42 | 58 | 99,907477 | 8,5×1018 лет | 0+ |
| 101Mo | 42 | 59 | 100,910347 | 14,61 мин | 1/2+ |
| 102Mo | 42 | 60 | 101,910297 | 11,3 мин | 0+ |
| 103Mo | 42 | 61 | 102,91321 | 67,5 с | 3/2+ |
| 104Mo | 42 | 62 | 103,91376 | 60 с | 0+ |
| 105Mo | 42 | 63 | 104,91697 | 35,6 с | 5/2- |
| 106Mo | 42 | 64 | 105,918137 | 8,73 с | 0+ |
| 107Mo | 42 | 65 | 106,92169 | 3,5 с | 7/2- |
| 107mMo | 470 нс | 5/2- | |||
| 108Mo | 42 | 66 | 107,92345 | 1,09 с | 0+ |
| 109Mo | 42 | 67 | 108,92781 | 530 мс | 7/2- |
| 110Mo | 42 | 68 | 109,92973 | 270 мс | 0+ |
| 111Mo | 42 | 69 | 110,93441 | 200 мс | |
| 112Mo | 42 | 70 | 111,93684 | 150 мс | 0+ |
| 113Mo | 42 | 71 | 112,94188 | 100 мс | |
| 114Mo | 42 | 72 | 113,94492 | 80 мс | 0+ |
| 115Mo | 42 | 73 | 114,95029 | 60 мс | |
Молибден как химический элемент таблицы Менделеева
Молибден является химическим элементом таблицы Менделеева с атомным номером 42 и условным обозначением Mo.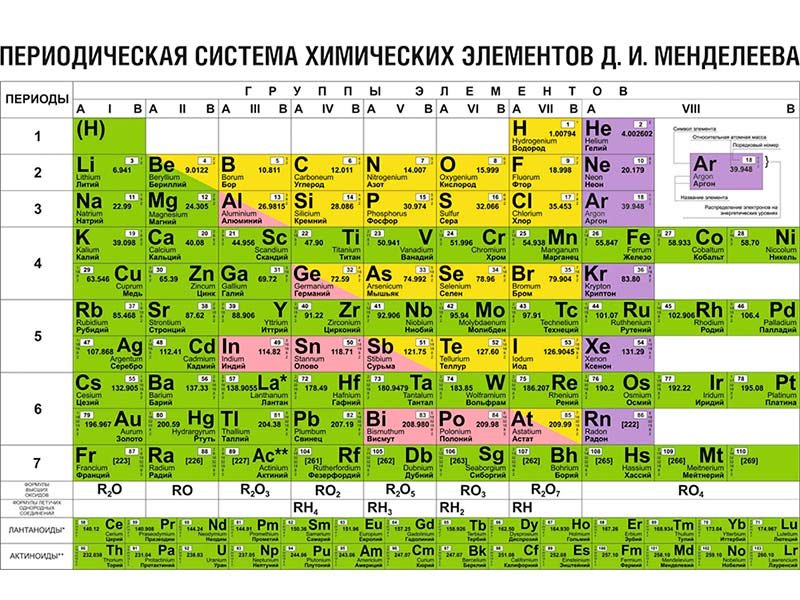 Молибден представляет собой серебристый переходный металл с серым оттенком.
Молибден представляет собой серебристый переходный металл с серым оттенком.
Содержание
- Как был открыт Молибден;
- Где и как добывают Молибден;
- Распространенность Молибдена;
- Применение Молибдена;
- Интересные факты
История открытия такого химического элемента как молибден является достаточно запутанной. Этот химический элемент был известен с давних времен в виде молебденита, но этот минерал достаточно часто путали с галенитом и графитом.
В 1778 году немецкий химик и фармацевт Карл Вильгельм Шееле выделил оксид молибдена из молебденита обработкой минерала азотной кислотой. Само название для нового химического элемента было предложено в честь минерала из которого он добывается. Чистый молибден был получен шведским химиком Питером Якобом Хельмом в 1781 году. Он обработатал оксид молибдена углеродом и льняным маслом.
В следующем столетии молибден не нашел промышленного применения, а получил его только в XX веке. Хотя сплавы с примесью этого металла показали себя с хорошей стороны, но реализовать промышленный план было просто напросто невозможно из слабого развития отрасли.
Хотя сплавы с примесью этого металла показали себя с хорошей стороны, но реализовать промышленный план было просто напросто невозможно из слабого развития отрасли.
Молибден является химическим элементом который добывают в виде минералов, так как в свободном виде он не встречается. Этот элемент встречается в таких минералах как вульфенит, повелит и молебденит. Основным важным минералом коммерческого производства является молебденит, но он так же извлекается как побочный продукт меди и вольфрама.
Процесс выделения молибдена из руды выглядит следующим образом. Молебденитовая руда обжигается на воздухе при температуре 700 ° C. Процесс дает газообразный диоксид серы и оксид молибдена (VI):
2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
Затем окисленную руду обычно экстрагируют водным раствором аммиака с получением молибдата аммония:
MoO3 + 2 NH3+ H2O → (NH4 )2(MoO4)
Медь, примесь в молибдените, менее растворима в аммиаке. Чтобы полностью удалить его из раствора, его осаждают сероводородом. Молибдат аммония превращается в димолибдат аммония, который выделяется в виде твердого вещества. Нагревание этого твердого вещества дает триоксид молибдена:
Чтобы полностью удалить его из раствора, его осаждают сероводородом. Молибдат аммония превращается в димолибдат аммония, который выделяется в виде твердого вещества. Нагревание этого твердого вещества дает триоксид молибдена:
(NH4)2 Mo2O7 → 2 MoO3 + 2NH3 + H2O
Неочищенный триоксид можно дополнительно очистить сублимацией при 1100 ° C (2010 ° F).
Металлический молибден получают восстановлением оксида водородом:
МоО3+ 3 Н2→ Мо + 3 Н2О
Молибден для производства стали восстанавливается в результате алюмотермической реакции с добавлением железа с образованием ферромолибдена. Обычная форма ферромолибдена содержит 60% молибдена.
Распространенность МолибденаКристаллический молибденТакой химический элемент как молибден является достаточно редким и занимает 54 строчку по распространенности в земной коре. Средним значением содержания в земной коре является 1,5 части на миллион. Что касается морской воды и океанов, то его содержание оценивается в 10 частей на миллиард. Такое содержание делает его 25 элементом по распространенности в морской среде. Сравнительная редкость молибдена в земной коре компенсируется его концентрацией в ряде водонерастворимых руд, часто в сочетании с серой и с медью.
Средним значением содержания в земной коре является 1,5 части на миллион. Что касается морской воды и океанов, то его содержание оценивается в 10 частей на миллиард. Такое содержание делает его 25 элементом по распространенности в морской среде. Сравнительная редкость молибдена в земной коре компенсируется его концентрацией в ряде водонерастворимых руд, часто в сочетании с серой и с медью.
Молибден играет важную роль в развитии человечества. Самыми распространенными минералами содержащими молибден являются вульфенит (PbMoO4), повеллит (CaMoO4) и молибденит (MoS2).
В 2011 году мировое производство молибдена составило 250 000 тонн, крупнейшими производителями были Китай (94 000 т), США (64 000 т), Чили (38 000 т), Перу (18 000 т) и Мексика (12 000 т). Общие запасы оцениваются в 10 миллионов тонн и в основном сосредоточены в Китае (4,3 миллиона тонн), США (2,7 миллиона тонн) и Чили (1,2 миллиона тонн). По континентам 93% мирового производства молибдена примерно равномерно распределяется между Северной Америкой, Южной Америкой (в основном в Чили) и Китаем. Остальную часть производят Европа и остальные страны Азии (в основном Армения, Россия, Иран и Монголия).
По континентам 93% мирового производства молибдена примерно равномерно распределяется между Северной Америкой, Южной Америкой (в основном в Чили) и Китаем. Остальную часть производят Европа и остальные страны Азии (в основном Армения, Россия, Иран и Монголия).
По состоянию на август 2009 года стоимость молибдена составляла примерно 30 000 долларов за тонну. В период с 1997 по 2003 год цена на него поддерживалась на уровне или около 10 000 долларов за тонну, и достигла пика в 103 000 долларов за тонну в июне 2005 года.
Применение Молибдена Молибденово-медная пластинаПрименение молибдена является достаточно распространенным. Около 86% добываемого молибдена используется в металлургической промышленности, а остальные приходятся на химическую промышленность.
В процентном соотношении применение молибдена можно приблизительно разделить следующим образом:
- Конструкционная сталь — 35%
- Нержавеющая сталь — 25%
- Химикаты — 14%
- Инструментальная и быстрорежущая сталь — 9%
- Чугун — 6%
- Элементарный металл — 6%
- Суперсплавы — 5%
Молибден может выдерживать экстремальные температуры без значительного расширения или размягчения, что делает его полезным в условиях сильной жары, включая военную броню, детали самолетов, электрические контакты, промышленные двигатели и опоры для нитей накаливания в лампочках.
Большинство высокопрочных стальных сплавов (например, стали 41xx ) содержат от 0,25% до 8% молибдена. Даже в этих небольших количествах более 43 000 тонн молибдена ежегодно используется в нержавеющих сталях , инструментальных сталях , чугунах и жаропрочных жаропрочных сплавах.
Молибден также ценится в стальных сплавах за его высокую коррозионную стойкость и свариваемость. Молибден способствует коррозионной стойкости нержавеющих сталей типа 300 (особенно типа 316) и особенно так называемых супераустенитных нержавеющих сталей (таких как сплав AL-6XN , 254SMO и 1925hMo). Молибден увеличивает деформацию решетки, тем самым увеличивая энергию, необходимую для растворения атомов железа на поверхности. Молибден также используется для повышения коррозионной стойкости ферритных (например, сорт 444) и мартенситных (например, 1.4122 и 1.4418) нержавеющих сталей.
Кроме металлургической промышленности этот химический элемент може использоваться и в химической промышленности. Молибденовый порошок используется в качестве удобрения для некоторых растений, таких как цветная капуста. Радиоактивный изотоп молибдена-99 используется для производства технеция-99m , используемого для медицинской визуализации. Изотоп обрабатывается и хранится в виде молибдата.
Радиоактивный изотоп молибдена-99 используется для производства технеция-99m , используемого для медицинской визуализации. Изотоп обрабатывается и хранится в виде молибдата.
Молибдат свинца (вульфенит), осажденный совместно с хроматом свинца и сульфатом свинца, представляет собой ярко-оранжевый пигмент, используемый в керамике и пластмассах.
Читайте: Автомобильный сайт Беларуси The Auto Belarus
Интересные фактыИнтересных фактов связанных с этим химическим элементом достаточно много. Стоит начать с его роли в человеческом организме. В организме человека содержится около 0,07 мг молибдена на килограмм веса тела, с более высокими концентрациями в печени и почках и более низкими в позвонках. Так же этот химический элемент является основой эмали зубов, который защищает их от разрушения. Смертельной дозой молибдена при опытах на крысах составила всего 180 мг / кг.
Низкая концентрация молибдена в почве в географической полосе от северного Китая до Ирана приводит к общему пищевому дефициту молибдена и связана с повышенным уровнем заболеваемости раком пищевода.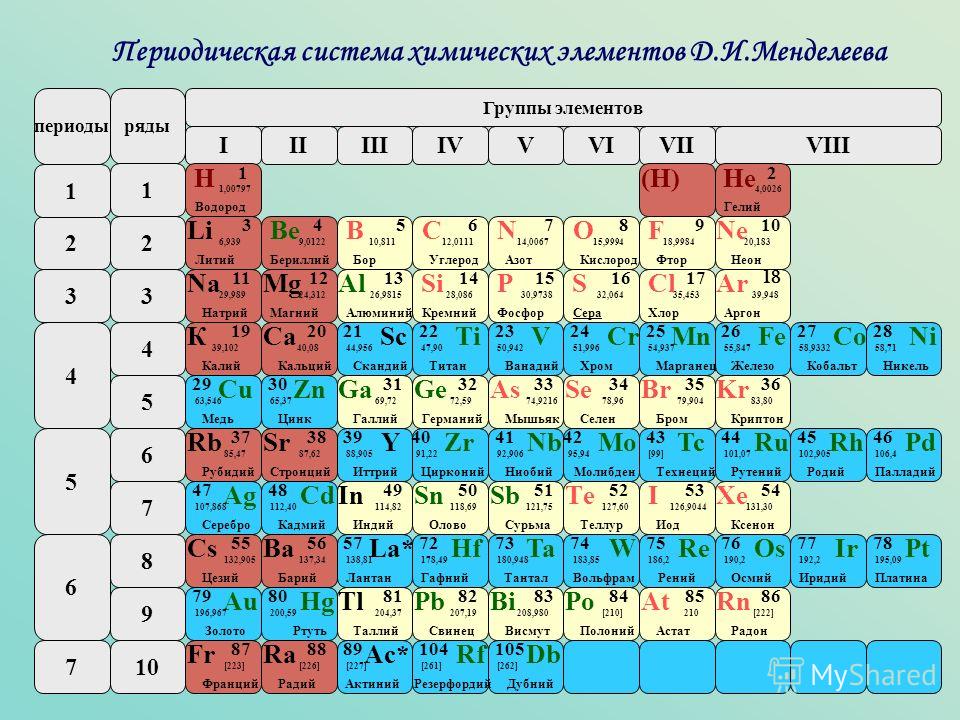 По сравнению с США, где в почве больше молибдена, люди, живущие в этих регионах, имеют примерно в 16 раз больший риск плоскоклеточного рака пищевода.
По сравнению с США, где в почве больше молибдена, люди, живущие в этих регионах, имеют примерно в 16 раз больший риск плоскоклеточного рака пищевода.
Средняя суточная доза молибдена колеблется от 120 до 240 мкг / день, что выше диетических рекомендаций. Свинина, баранина и говяжья печень содержат примерно 1,5 миллионных долей молибдена. Другие важные диетические источники включают стручковые бобы, яйца, семена подсолнечника, пшеничную муку, чечевицу, огурцы и зерно злаков.
Молибден (Mo) — атомный номер 42
Произносится
meh-LIB-deh-nem
Молибден (Mo) — серебристо-белый металл с атомным номером 42 в периодической таблице. Это переходный металл, расположенный в 6-й группе периодической таблицы. Он имеет обозначение Mb.
Молибден не встречается в природе в земной коре, а связан с рудами. Как свободный элемент это серебристый металл и имеет шестую самую высокую температуру плавления среди всех элементов. Он образует твердые и стабильные карбиды при соединении с углеродом в сплавах и используется в производстве стали. Молибденит, руда, из которой он добывается, первоначально был принят за графит из-за его сходного внешнего вида. Молибден получил свое название от древнегреческого «Molybdos», что означает свинец. Ходят слухи, что молибден был впервые сплавлен со сталью в Японии в 14 веке, но никаких доказательств этого обнаружено не было. Впервые он был обнаружен в 1754 году Бенгтом Андерссоном Квистом, но выделен только в 1781 году Питером Джейкобом Хьельмом, который использовал уголь и льняное масло для выделения элемента. Он расположен в группе 6 как переходный металл. Он имеет температуру плавления 2623°С и температуру кипения 4639°С.°с.
Молибденит, руда, из которой он добывается, первоначально был принят за графит из-за его сходного внешнего вида. Молибден получил свое название от древнегреческого «Molybdos», что означает свинец. Ходят слухи, что молибден был впервые сплавлен со сталью в Японии в 14 веке, но никаких доказательств этого обнаружено не было. Впервые он был обнаружен в 1754 году Бенгтом Андерссоном Квистом, но выделен только в 1781 году Питером Джейкобом Хьельмом, который использовал уголь и льняное масло для выделения элемента. Он расположен в группе 6 как переходный металл. Он имеет температуру плавления 2623°С и температуру кипения 4639°С.°с.
Загрузите молибден в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления молибдена?
Молибден имеет температуру плавления 2617°C, что означает, что при 2617°C он превратится в жидкость.
Какова температура кипения молибдена?
Молибден имеет температуру кипения 4612°C, что означает, что при 4612°C он превратится в газ.
Что такое электроотрицательность молибдена?
Электроотрицательность молибдена 2,16. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Карлом Вильгельмом Шееле
Дата открытия
1778
Что такое Теплота испарения молибдена?
Молибден имеет теплоту испарения 598 кДж/моль.
Использование
Его сплавы используются в самолетах, ракетах и защитных покрытиях в плитах котлов.
Источники
Содержится в минералах молибдените (MoS2) и вульфените (MoO4Pb).
Об авторе
Натан М.
Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Цитирование
“Молибден” Опубликовано 30 декабря 2019 г.. https://breakingatom.com/elements/molybdenum
42
Protons
42
Electrons
54
Neutrons
Element Symbol
Mo
Atomic Weight
95.95
Atomic Number
42
Состояние
SOLID
ПЕРЕДЕЛЕНИЕ
Неизвестно
2617
° C
TOPE
4612
Неизвестно
° C
4612
° C
0002 Нагрев испарения
598
Неизвестно
кДж/моль
Кристаллическая структура
Кубические: Центр бодибил. 13,1
Группа
Переходный металл
Период
5
Блок
Блок D
Орбитали
[Kr] Теплового расширения 90 90 0302 90 0302 90 0302 90 03016/см ом
Первый потенциал ионизации
7.0924 V
Второй потенциал ионизации
16,461 В
Третий потенциал ионизации
27,16 В
ионовый радиус
. (6), 5,4,3,2
(6), 5,4,3,2
Параметр решетки
3,1469 Å
Параметр решетки 2
–
Параметр решетки 3
–
Орбитальная конфигурация
2,8,18,13 ,1
Загрузить Периодическую таблицу
Молибден (Mo) – Периодическая таблица
| Согласно Википедии, бесплатная энциклопедия представляет собой химический элемент с символом 4 и молибденом. Неолатинское молибден, от древнегреческого Μόλυβδος молибдос, что означает свинец, поскольку его руды путали со свинцовыми рудами. Минералы молибдена были известны на протяжении всей истории, но этот элемент был открыт (в смысле дифференциации его как нового объекта от минеральных солей других металлов) в 1778 году Карлом Вильгельмом Шееле. Read more on Wikipedia | ||||||||||||||||
Molybdenum in the periodic table | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbol | Mo | |||||||||||||||
| Atomic number | 42 | |||||||||||||||
| Group | 6 | |||||||||||||||
| Период | 5 | |||||||||||||||
| Блок | d | |||||||||||||||
| Категория элемента | Переходный металл | 7Physical properties | ||||||||||||||
| Phase at STP | Solid | |||||||||||||||
| Density | 10. 28 g/cm 3 28 g/cm 3 | |||||||||||||||
| Atomic weight | 95.951 u | |||||||||||||||
| Melting point | 2896 K 2622.85 °C 4753.13 °F | |||||||||||||||
| Boiling point | 4912 K 4638.85 °C 8381.93 °F | |||||||||||||||
Atomic properties | ||||||||||||||||
| Electronegativity (Pauling Scale) | 2.16 | |||||||||||||||
| Electron affinity | 72.1 kJ/mol | |||||||||||||||
| Oxidation states | −4, −2, −1, 0, +1, + 2, +3, +4, +5, +6 (сильно кислый оксид) | |||||||||||||||
| Энергии ионизации |
| |||||||||||||||


