Таблица по химии 8 класс характерные свойства меди и серы: Сравните физические свойства меди и серы
alexxlab | 13.04.2023 | 0 | Разное
Сведения об общеобразовательной организации
Сведения об общеобразовательной организацииЦвет:C C C
Изображения Вкл. Выкл.
Обычная версия сайта
- Телефон доверия: 8 800 200-01-22
Ошибка 404
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Сведения об общеобразовательной организации
Муниципальное бюджетное общеобразовательное учреждение
Cредняя общеобразовательная школа с.

442905, Пензенская область, Тамалинский район, с. Варварино, ул. Цетральная, д. №9
- О школе
- Сведения об образовательной организации
- Основные сведения
- Документы
- Образование
- Образовательные стандарты РФ
- Руководство. Педагогический (научно-педагогический) состав
- Материально-техническое обеспечение и оснащённость образовательного процесса
- Платные образовательные услуги
- Финансово-хозяйственная деятельность
- Вакантные места для приёма (перевода)
- Доступная среда
- Международное сотрудничество
- Сведения об образовательной организации
- О школе
- История школы
- Наши достижения
- Мероприятия
- Руководство.
 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав - Новости
- Сурский край – без наркотиков
- Контакты
- История школы
- Документы на 2022-2023 учебный год
- Здоровьесбережение
- Физическая культура и спорт
- ШСК
- Физическая культура и спорт
- Food
- Профилактика
- ГТО
- Дорожная безопасность
- Информационная безопасность
- Информация
- Доп. курсы / факультативы
- Фотогалерея
- Видеогалерея
- Школьная газета
- Бесплатное питание
- Родителям
- Добро пожаловать в Пензенскую область
- Электронный дневник
- Дополнительная информация
- ЕГЭ и ОГЭ
- Наши проекты
- ВПР
- ОнлайнЛЕТО58
- Дистанционное обучение
- Туристско-информационный центр
- food
- Антикоррупционная политика
- Дополнительное образование
- Функциональная грамотность
- СОУТ
- Приём в 1 класс
- Меню
- Организация питания в образовательной организации
- Документы по организации питания
- Страничка психолога
- Театральная деятельность
- Сценарии
- Видеосюжеты
- Фотографии
- ВСОКО
- Главная страница
- ›
- Сведения об общеобразовательной организации
Личный кабинет
Выйти
Периодическая таблица
Периодическая таблицаКРАТКАЯ ИСТОРИЯ РАЗВИТИЯ ПЕРИОДИЧЕСКОЙ СТОЛИКИ
Хотя Дмитрия Менделеева часто считают «отцом» периодической таблицы, работа многих ученых способствовала ее нынешнему виду.
В начале
Необходимым условием построения периодической таблицы было открытие отдельных элементов. Хотя такие элементы, как золото, серебро, олово, медь, свинец и ртуть известны с древности, первое научное открытие элемента произошло в 1649 годукогда Хенниг Бранд открыл фосфор. В течение следующие 200 лет, огромный объем знаний о свойствах элементов а их соединения были приобретены химиками (см. статья 1790 года об элементах). К 1869 году было открыто 63 элемента. По мере роста числа известных элементов ученые начали распознавать закономерности в свойства и начали разрабатывать схемы классификации.Закон триад
В 1817 году Иоганн Доберейнер заметил, что атомный вес стронция находится посередине между весами кальция и бария, элементов, обладающих сходными химическими свойствами. В 1829 г., после открытия триады галогенов, состоящей из хлора, брома и йода, и триады щелочных металлов из лития, натрия и калия, он предположил, что природа содержит триады элементов, средний элемент имеет свойства, которые являются средними из двух других элементов, когда они упорядочены. атомный вес (закон триад).
атомный вес (закон триад).Эта новая идея триад стала популярной областью изучения. Между 1829 и 1858 годами ряд ученых (Жан Батист Дюма, Леопольд Гмелин, Эрнст Ленссен, Макс фон Петтенкофер и Дж. П. Кук) обнаружили, что эти типы химических отношений выходят за рамки триады. За это время к галогеновой группе присоединился фтор; кислород, сера, селен и теллур были сгруппированы в одно семейство, а азот, фосфор, мышьяк, сурьма и висмут — в другое. К сожалению, исследования в этой области сдерживались тем, что не всегда были доступны точные значения .
Первые попытки создания периодической таблицы
Если рассматривать периодическую таблицу как упорядочение химических элементов, демонстрирующее периодичность химических и физических свойств, то заслуга в создании первой периодической таблицы (опубликованной в 1862 г.), вероятно, должна быть отдана французскому геологу А. Э. Бегуйе де Шанкуртуа. Де Шанкуртуа составил список элементов, расположенных на цилиндре, с точки зрения увеличения атомного веса. Когда цилиндр был сконструирован так, что на цилиндр можно было записать 16 единиц массы за один оборот, тесно связанные элементы были выстроены вертикально. Это привело де Шанкуртуа к предположению, что «свойства элементов — это свойства чисел». Де Шанкуртуа первым обнаружил, что свойства элементов повторяются через каждые семь элементов, и с помощью этой диаграммы он смог предсказать стехиометрию нескольких оксидов металлов. К сожалению, в его диаграмму помимо элементов были включены некоторые ионы и соединения.
Когда цилиндр был сконструирован так, что на цилиндр можно было записать 16 единиц массы за один оборот, тесно связанные элементы были выстроены вертикально. Это привело де Шанкуртуа к предположению, что «свойства элементов — это свойства чисел». Де Шанкуртуа первым обнаружил, что свойства элементов повторяются через каждые семь элементов, и с помощью этой диаграммы он смог предсказать стехиометрию нескольких оксидов металлов. К сожалению, в его диаграмму помимо элементов были включены некоторые ионы и соединения.Закон Октав
Джон Ньюлендс, Английский химик написал в 1863 году статью, в которой классифицировал 56 установленных элементы на 11 групп на основе схожих физических свойств, отметив, что многие существовали пары похожих элементов, которые отличались кратно восьми в атомный вес. В 1864 году Ньюлендс опубликовал свою версию периодической таблицы. предложил Закон Октав (по аналогии с семью интервалами музыкального шкала). Этот закон гласил, что любой данный элемент будет демонстрировать аналогичное поведение. до восьмого элемента, следующего за ним в таблице.
до восьмого элемента, следующего за ним в таблице.Кто является отцом периодической таблицы?
Были некоторые разногласия по поводу того, кто заслуживает признания в качестве «отца». периодической таблицы, немец Лотар Мейер (на фото) или русский Дмитрий Менделеев. Оба химика дали удивительно схожие результаты. при этом работают независимо друг от друга. Учебник Мейера 1864 г. включал довольно сокращенную версию периодической таблицы, используемой для классификации элементы. Он состоял примерно из половины известных элементов, перечисленных в порядке их атомного веса и продемонстрировали периодические изменения валентности как функцию атомного веса. В 1868 году Мейер сконструировал расширенный стол. который он дал коллеге для оценки. К несчастью для Мейера, Менделеев таблица стала доступна научному сообществу благодаря публикации (1869 г.) до Появился Мейер (1870).
Родился Дмитрий Иванович Менделеев (1834-1907), младший из 17 детей
в сибирском городе Тобольске, где его отец был учителем русской словесности. и философия (портрет Ильи Репина). Менделеев не считался
выдающийся ученик в своем раннем образовании отчасти из-за его неприязни к
классические языки, которые в то время были важным образовательным требованием
хотя он показал доблесть в математике и естественных науках. После отца
После смерти он и его мать переехали в Санкт-Петербург, чтобы продолжить университетское образование.
После отказа в поступлении как в Московский университет, так и в Санкт-Петербургский
Университет из-за его провинциального происхождения и ничем не выдающегося академического образования,
он, наконец, заслужил место в Главном педагогическом институте (Санкт-Петербург
института). По окончании учебы Менделеев занял должность преподавателя естественных наук в
гимназия. Поработав учителем, он был принят в аспирантуру в St.
в Петербургском университете, где в 1856 г. получил степень магистра. Менделеев так
произвел впечатление на своих инструкторов тем, что его оставили читать лекции по химии.
и философия (портрет Ильи Репина). Менделеев не считался
выдающийся ученик в своем раннем образовании отчасти из-за его неприязни к
классические языки, которые в то время были важным образовательным требованием
хотя он показал доблесть в математике и естественных науках. После отца
После смерти он и его мать переехали в Санкт-Петербург, чтобы продолжить университетское образование.
После отказа в поступлении как в Московский университет, так и в Санкт-Петербургский
Университет из-за его провинциального происхождения и ничем не выдающегося академического образования,
он, наконец, заслужил место в Главном педагогическом институте (Санкт-Петербург
института). По окончании учебы Менделеев занял должность преподавателя естественных наук в
гимназия. Поработав учителем, он был принят в аспирантуру в St.
в Петербургском университете, где в 1856 г. получил степень магистра. Менделеев так
произвел впечатление на своих инструкторов тем, что его оставили читать лекции по химии. После
расходы 1859и в 1860 году в Германии, продолжая свои химические исследования, он получил
должность профессора химии в Санкт-Петербургском университете, должность
он сохранялся до 1890 года. При написании учебника по систематической неорганической химии, Основы химии , появившиеся в тринадцати последних изданиях.
будучи в 1947 году, Менделеев организовал свой материал по семьям
известные элементы, которые проявляли сходные свойства. Первая часть
текст был посвящен хорошо известной химии галогенов. Далее он выбрал
охватить химию металлических элементов в порядке объединения мощности
— сначала щелочные металлы (объединение силы одного), щелочноземельные (два) и т. д.
Однако было трудно классифицировать такие металлы, как медь и ртуть, которые
имел несколько объединяющих способностей, иногда одну, а иногда две. пока пытаешься
Чтобы разобраться в этой дилемме, Менделеев заметил закономерности в свойствах и атомных
веса галогенов, щелочных металлов и щелочных металлов.
После
расходы 1859и в 1860 году в Германии, продолжая свои химические исследования, он получил
должность профессора химии в Санкт-Петербургском университете, должность
он сохранялся до 1890 года. При написании учебника по систематической неорганической химии, Основы химии , появившиеся в тринадцати последних изданиях.
будучи в 1947 году, Менделеев организовал свой материал по семьям
известные элементы, которые проявляли сходные свойства. Первая часть
текст был посвящен хорошо известной химии галогенов. Далее он выбрал
охватить химию металлических элементов в порядке объединения мощности
— сначала щелочные металлы (объединение силы одного), щелочноземельные (два) и т. д.
Однако было трудно классифицировать такие металлы, как медь и ртуть, которые
имел несколько объединяющих способностей, иногда одну, а иногда две. пока пытаешься
Чтобы разобраться в этой дилемме, Менделеев заметил закономерности в свойствах и атомных
веса галогенов, щелочных металлов и щелочных металлов. Он заметил сходство
между рядами Cl-K-Ca, Br-/Rb-Sr и I-Cs-Ba. Стремясь расширить это
соединив шаблон с другими элементами, он создал карту для каждого из 63 известных элементов.
Каждая карточка содержала символ элемента, атомный вес и его характеристику.
химические и физические свойства. Когда Менделеев разложил карты на столе
в порядке возрастания атомного веса группируют элементы со сходными свойствами
вместе в манере, мало чем отличающейся от расположения карт в его любимом пасьянсе
карточная игра, терпение, таблица Менделеева была сформирована. Из этой таблицы Менделеев
разработал свою формулировку периодического закона и опубликовал свою работу Вкл.
Отношение свойств элементов к их атомному весу в 1869 г. Преимущество таблицы Менделеева перед предыдущими попытками было
что он показал сходство не только в небольших единицах, таких как триады, но
показали сходство во всей сети вертикальных, горизонтальных и диагональных
отношения. В 1906 году Менделеев был в одном голосе от присуждения премии.
Он заметил сходство
между рядами Cl-K-Ca, Br-/Rb-Sr и I-Cs-Ba. Стремясь расширить это
соединив шаблон с другими элементами, он создал карту для каждого из 63 известных элементов.
Каждая карточка содержала символ элемента, атомный вес и его характеристику.
химические и физические свойства. Когда Менделеев разложил карты на столе
в порядке возрастания атомного веса группируют элементы со сходными свойствами
вместе в манере, мало чем отличающейся от расположения карт в его любимом пасьянсе
карточная игра, терпение, таблица Менделеева была сформирована. Из этой таблицы Менделеев
разработал свою формулировку периодического закона и опубликовал свою работу Вкл.
Отношение свойств элементов к их атомному весу в 1869 г. Преимущество таблицы Менделеева перед предыдущими попытками было
что он показал сходство не только в небольших единицах, таких как триады, но
показали сходство во всей сети вертикальных, горизонтальных и диагональных
отношения. В 1906 году Менделеев был в одном голосе от присуждения премии. Нобелевская премия за его работу.
Нобелевская премия за его работу.
В то время, когда Менделеев разработал свою периодическую таблицу, так как экспериментально
определенные атомные массы не всегда были точными, он переупорядочивал элементы, несмотря на
принимаемые ими массы. Например, он изменил вес бериллия с
с 14 до 9. Это поместило бериллий в группу 2 выше магния, свойства которого
он больше напоминал, чем там, где он был расположен над азотом. В
всего Менделеев обнаружил, что 17 элементов пришлось переместить на новые позиции из тех
указаны строго по атомному весу, чтобы их свойства коррелировали с другими
элементы. Эти изменения указывали на наличие ошибок в принятом атомарном
веса некоторых элементов (атомные веса рассчитывались путем объединения весов,
вес элемента, который сочетается с заданным весом эталона.) Однако
даже после внесения поправок путем переопределения атомных весов некоторые элементы
еще нужно было расположить не по порядку их атомных весов. Из пробелов
представленных в его таблице, Менделеев предсказал существование и свойства неизвестных
элементы, которые он назвал эка-алюминием, эка-бором и эка-кремнием. Элементы
Позднее было обнаружено, что галлий, скандий и германий вполне соответствуют его предсказаниям.
хорошо. Помимо того, что таблица Менделеева была опубликована раньше таблицы Мейерса,
его работа была более обширной, предсказывая новые или отсутствующие элементы. Во всем Менделеев
предсказал существование 10 новых элементов, семь из которых в итоге были открыты
— трех других атомных весов 45, 146 и 175 не существует. Он также был
неверно предполагать, что пары элементов аргон-калий, кобальт-никель
и теллур-йод следует поменять местами из-за неточного атомарного
веса. Хотя эти элементы нужно было поменять местами, это произошло потому, что
ошибки в рассуждениях о том, что периодичность является функцией атомного веса.
Элементы
Позднее было обнаружено, что галлий, скандий и германий вполне соответствуют его предсказаниям.
хорошо. Помимо того, что таблица Менделеева была опубликована раньше таблицы Мейерса,
его работа была более обширной, предсказывая новые или отсутствующие элементы. Во всем Менделеев
предсказал существование 10 новых элементов, семь из которых в итоге были открыты
— трех других атомных весов 45, 146 и 175 не существует. Он также был
неверно предполагать, что пары элементов аргон-калий, кобальт-никель
и теллур-йод следует поменять местами из-за неточного атомарного
веса. Хотя эти элементы нужно было поменять местами, это произошло потому, что
ошибки в рассуждениях о том, что периодичность является функцией атомного веса.
Открытие благородных газов
В 1895 году лорд Рэлей сообщил об открытии нового газообразного элемента, названного аргоном, который оказался химически инертным. Этот элемент не подходил ни к одной из известных периодических групп. В 1898 году Уильям Рэмси предложил поставить аргон в периодической таблице между хлором и калием в семействе с гелием, несмотря на то, что атомный вес аргона больше, чем у калия. Эта группа была названа «нулевой» группой из-за нулевой валентности элементов. Рамсей точно предсказал будущее открытие и свойства неона.
В 1898 году Уильям Рэмси предложил поставить аргон в периодической таблице между хлором и калием в семействе с гелием, несмотря на то, что атомный вес аргона больше, чем у калия. Эта группа была названа «нулевой» группой из-за нулевой валентности элементов. Рамсей точно предсказал будущее открытие и свойства неона.Атомная структура и периодическая таблица
Хотя таблица Менделеева продемонстрировала периодичность элементов, открытиям ученых 20 века оставалось объяснить, почему свойства элементов периодически повторяются. В 1911 году Эрнест
Резерфорд опубликовал исследования рассеяния альфа-частиц тяжелыми
ядер атомов, что привело к определению заряда ядра. Он продемонстрировал
что ядерный заряд ядра пропорционален атомному весу
элемент. Также в 1911, А. ван ден Брук в серии из двух статей предложил
что атомный вес элемента примерно равен заряду на
атом. Этот заряд, впоследствии названный атомным номером, можно было использовать для нумерации
элементы периодической таблицы. В 1913 году Генри Мозли (см.
картинку) опубликовал результаты своих измерений длин волн
рентгеновские спектральные линии ряда элементов, которые показали, что упорядочение
длин волн рентгеновского излучения элементов совпало с упорядочением
элементов по атомному номеру. С открытием изотопов элементов,
стало очевидным, что атомный вес не играет существенной роли в периодической
закона, как предлагали Менделеев, Мейерс и другие, а свойства
элементы периодически менялись с атомным номером.
В 1913 году Генри Мозли (см.
картинку) опубликовал результаты своих измерений длин волн
рентгеновские спектральные линии ряда элементов, которые показали, что упорядочение
длин волн рентгеновского излучения элементов совпало с упорядочением
элементов по атомному номеру. С открытием изотопов элементов,
стало очевидным, что атомный вес не играет существенной роли в периодической
закона, как предлагали Менделеев, Мейерс и другие, а свойства
элементы периодически менялись с атомным номером.
На вопрос о том, почему существует периодический закон, ответили ученые, разработавшие понимание электронной структуры элементов, начиная с Нильса Исследования Бора по организации электронов в оболочки через Г.Н. Льюис’ (см. картинку) открытия связывающих электронных пар.
Современная периодическая таблица
Последние серьезные изменения в периодической таблице произошли в результате работы Гленна Сиборга. в середине 20 века. Начиная с открытия им плутония в 1940, он открыл все трансурановые элементы от 94 до 102. Он реконфигурировал
периодической таблицы, поместив ряд актиноидов ниже ряда лантанидов.
В 1951 году Сиборг был удостоен Нобелевской премии.
Премия по химии за свою работу. Элемент 106 был назван сиборгием (Sg).
в его честь.
Он реконфигурировал
периодической таблицы, поместив ряд актиноидов ниже ряда лантанидов.
В 1951 году Сиборг был удостоен Нобелевской премии.
Премия по химии за свою работу. Элемент 106 был назван сиборгием (Sg).
в его честь.Университет Западного Орегона
Авторское право и копия 1997 Университет Западного Орегона
Классификация веществ (элементы, соединения, смеси) – Введение в химию
ЛюменОбучение
Вещества и смеси
Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ.
ЦЕЛИ ОБУЧЕНИЯ
Отличать химические вещества от смесей.
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Материю можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разлагаются на элементы и соединения. Смеси представляют собой физически объединенные структуры, которые можно разделить на исходные компоненты.

- Химическое вещество состоит из атомов или молекул одного типа.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь представляет собой смесь двух или более химических веществ, в которой различные компоненты можно различить визуально.
- Гомогенная смесь – это тип смеси, в которой состав однороден и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, в том числе дистилляция, фильтрация, выпаривание и хроматография. Материя может находиться в одной и той же фазе или в двух разных фазах, чтобы произошло это разделение.
Ключевые термины
- : Что-то, что состоит из различных несвязанных элементов или молекул.
- : химическое вещество, состоящее из атомов определенного вида и не поддающееся расщеплению или преобразованию в ходе химической реакции.
- : Форма вещества с постоянным химическим составом и характерными свойствами.
 Он состоит из одного типа атома или молекулы.
Он состоит из одного типа атома или молекулы.
Химические вещества
В химии химическое вещество – это форма материи, имеющая постоянный химический состав и характерные свойства. Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми, жидкими, газообразными или плазменными. Изменения температуры или давления могут вызвать перемещение веществ между различными фазами материи.
Элемент — это химическое вещество, состоящее из атомов определенного типа и, следовательно, не может быть разрушено или преобразовано в результате химической реакции в другой элемент. Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенные в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями. Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичным примером химического вещества является чистая вода; он всегда имеет одни и те же свойства и одинаковое соотношение водорода и кислорода, независимо от того, выделен ли он из реки или изготовлен в лаборатории. Другими химическими веществами, обычно встречающимися в чистом виде, являются алмаз (углерод), золото, поваренная соль (хлорид натрия) и сахар-рафинад (сахароза). Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшое количество растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, — это смесь.
Например, водопроводная вода может содержать небольшое количество растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, — это смесь.
Химические смеси
Смесь – это система материалов, состоящая из двух или более различных веществ, которые смешиваются, но не соединяются химически. Под смесью понимается физическое сочетание двух или более веществ, в котором сохраняются свойства отдельных веществ. Смеси бывают в виде сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы: Сера встречается в природе в виде элементарной серы, сульфидов и сульфатных минералов, а также в виде сероводорода. Это минеральное месторождение состоит из смеси веществ.Гетерогенные смеси
Гетерогенная смесь представляет собой смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты можно различить визуально и легко разделить физическими средствами. Примеры включают:
Примеры включают:
- смеси песка и воды
- смеси песка и железных опилок
- конгломерат горной породы
- вода и масло
- салат
- трейловая смесь
- смеси золотого порошка и серебряного порошка
https://lab.concord.org/embeddable.html#interactives/sam/interatomic-attractions/3-1-oil-and-water.json
Interactive: Oil and Water : Изучение взаимодействий, образующих воду и масло отделить от смеси.
Гомогенные смеси
Однородная смесь – это смесь двух или более химических веществ (элементов или соединений), в которой различные компоненты невозможно различить визуально. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба выборки. В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу. С практической точки зрения, если интересующее свойство является одним и тем же независимо от того, сколько смеси взято, смесь является гомогенной.
С практической точки зрения, если интересующее свойство является одним и тем же независимо от того, сколько смеси взято, смесь является гомогенной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) средствами.
Классификация вещества (3 части): Введение в классификацию вещества как вещества или смеси веществ.
 Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.
Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.Элементы и соединения
Элемент — это материал, состоящий из атомов одного типа, в то время как соединение состоит из двух или более типов атомов.
ЦЕЛИ ОБУЧЕНИЯ
Различать элементы и соединения и изучать методы разделения.
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые положения
- Элементы — простейшие законченные химические вещества. Каждый элемент соответствует одной записи в периодической таблице. Элемент – это материал, состоящий из атомов одного типа. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, соединенных ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие единицы без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с практическим количеством энергии, такой как тепло от огня.

- Материю можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разлагаются на элементы и соединения. Смеси представляют собой физически объединенные структуры, которые можно снова разделить на исходные компоненты.
Основные термины
- : Любое из простейших химических веществ, которое нельзя изменить в результате химической реакции или каким-либо химическим способом. Состоит из атомов, имеющих одинаковое количество протонов.
- : Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
- : Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов. Обладает уникальными свойствами, отличными от свойств отдельных ее элементов.
Элементы
Химический элемент – это чистое вещество, состоящее из атомов одного типа. Каждый атом имеет атомный номер, который представляет количество протонов, находящихся в ядре одного атома этого элемента. Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, обычно находящиеся в левой части периодической таблицы, имеют номер
.- часто электропроводящие
- ковкий
- блестящий
- иногда магнитный
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
Напротив, неметаллы, находящиеся в правой части периодической таблицы (справа от лестницы), имеют
- обычно непроводящие
- не ковкий
- матовый (не блестящий)
- немагнитный
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды имеют некоторые характеристики металлов и некоторые характеристики неметаллов. Кремний и мышьяк являются металлоидами.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (последним идентифицированным в 2010 г. был унунсептий). Известно, что из этих 118 известных элементов только первые 98 встречаются в природе на Земле. Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами искусственных ядерных реакций. 80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами искусственных ядерных реакций. 80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Водород и гелий — самые распространенные элементы во Вселенной. Однако железо является наиболее распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое, который представляет собой земную кору.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% материи во Вселенной. Остальное — темная материя, таинственная субстанция, не состоящая из химических элементов. В темной материи отсутствуют протоны, нейтроны или электроны.
Соединения
Чистые образцы изолированных элементов в природе встречаются редко. Хотя все 98 встречающихся в природе элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена в виде узнаваемых относительно чистых минералов. Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в виде угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в природе в их чистых несвязанных формах. Тем не менее, большинство этих элементов находится в смесях.
Хотя все 98 встречающихся в природе элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена в виде узнаваемых относительно чистых минералов. Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в виде угля, графита и алмазов. Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в природе в их чистых несвязанных формах. Тем не менее, большинство этих элементов находится в смесях.
Когда два различных элемента химически объединяются, т. е. между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl). Вода — еще один пример химического соединения. Два или более составных элемента соединения могут быть разделены химическими реакциями.
Химические соединения имеют уникальную и определенную структуру, состоящую из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химических соединений может быть
- молекулярные соединения, связанные вместе ковалентными связями
- соли, удерживаемые вместе ионными связями
- интерметаллические соединения, соединенные металлическими связями
- комплексы, скрепленные ковалентными ковалентными связями
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, содержащих только несколько атомов одного элемента, таких как H 2 или S 8 ).
ЛИЦЕНЗИИ И АВТОРСТВО
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, ПРЕДОСТАВЛЯЕМОЕ РАНЕЕ
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, КОНКРЕТНОЕ АВТОРСТВО
- Состояние вопроса.
 Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/State_of_matter. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/State_of_matter. Лицензия : CC BY-SA: Attribution-ShareAlike - газ. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/gas. Лицензия : CC BY-SA: Attribution-ShareAlike
- жидкость. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/liquid. Лицензия : CC BY-SA: Attribution-ShareAlike
- твердый. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/solid. Лицензия : CC BY-SA: Attribution-ShareAlike
- «Фазовые изменения» — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=EZHmUTmJtF8. Лицензия : Общественное достояние: нет данных Авторские права .
 Условия лицензии : Стандартная лицензия YouTube
Условия лицензии : Стандартная лицензия YouTube - Физика перехода состояния материи 1 ru. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:Physics_matter_state_transition_1_en.svg. Лицензия : CC BY-SA: Attribution-ShareAlike
- Химическое вещество. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Chemical_substance. Лицензия : CC BY-SA: Attribution-ShareAlike
- Смесь. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Mixture. Лицензия : CC BY-SA: Attribution-ShareAlike смесь
- . Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/mixture. Лицензия : CC BY-SA: Attribution-ShareAlike
- вещество.
 Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/substance. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/substance. Лицензия : CC BY-SA: Attribution-ShareAlike - «Фазовые изменения» — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=EZHmUTmJtF8. Лицензия : Общественное достояние: авторские права неизвестны . Условия лицензии : Стандартная лицензия YouTube
- Физика перехода состояния материи 1 ru. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:Physics_matter_state_transition_1_en.svg. Лицензия : CC BY-SA: Attribution-ShareAlike
- «Химия 1.2 Классификация веществ (часть 1 из 3)» — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=ZZYjleLadlc. Лицензия : Общественное достояние: авторские права неизвестны .
 Условия лицензии : Стандартная лицензия YouTube
Условия лицензии : Стандартная лицензия YouTube - Schwefel 01. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:Schwefel_01.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
- Химический элемент. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Chemical_element. Лицензия : CC BY-SA: Attribution-ShareAlike
- Химическое соединение. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Chemical_compound. Лицензия : CC BY-SA: Attribution-ShareAlike
- элемент. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/element. Лицензия : CC BY-SA: Attribution-ShareAlike соединение
- .
 Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/compound. Лицензия : CC BY-SA: Attribution-ShareAlike химическая связь
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/compound. Лицензия : CC BY-SA: Attribution-ShareAlike химическая связь - . Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/chemical_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
- «Фазовые изменения» — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=EZHmUTmJtF8. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Физика перехода состояния материи 1 ru. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:Physics_matter_state_transition_1_en.svg. Лицензия : CC BY-SA: Attribution-ShareAlike
- «Химия 1.



 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав
 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав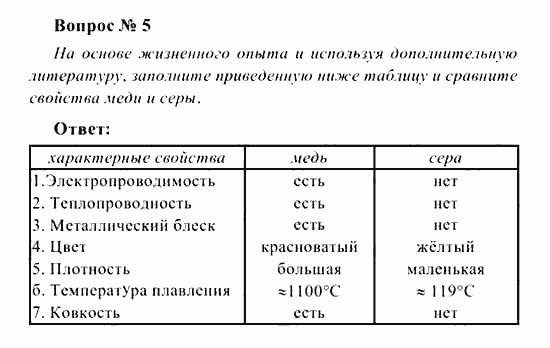
 Он состоит из одного типа атома или молекулы.
Он состоит из одного типа атома или молекулы.
 Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/State_of_matter. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/State_of_matter. Лицензия : CC BY-SA: Attribution-ShareAlike  Условия лицензии : Стандартная лицензия YouTube
Условия лицензии : Стандартная лицензия YouTube Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/substance. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/substance. Лицензия : CC BY-SA: Attribution-ShareAlike  Условия лицензии : Стандартная лицензия YouTube
Условия лицензии : Стандартная лицензия YouTube Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/compound. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/compound. Лицензия : CC BY-SA: Attribution-ShareAlike 