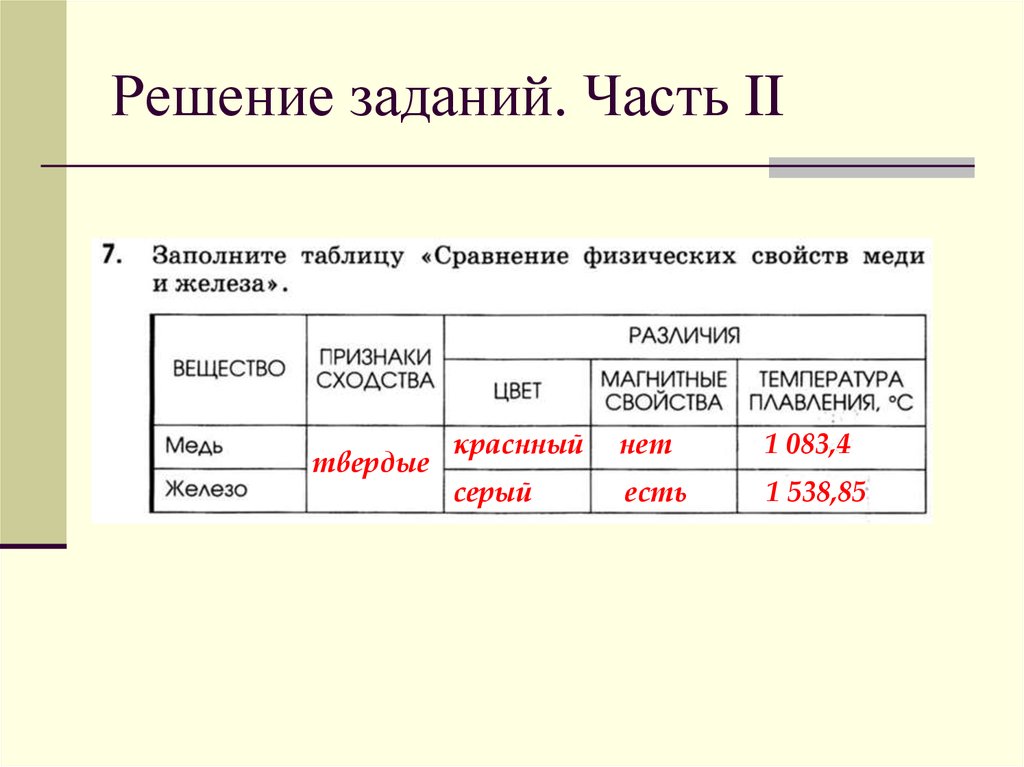
Таблица по химии 8 класс свойство медь сера: Сравните физические свойства меди и серы
alexxlab | 02.07.1989 | 0 | Разное
|
Вход на сайт Наша школа Сведения об ОО Информ.безопасносн Учебный процесс Воспитат. работа Школьная форма |
ГЛАВА I. Первоначальные химические понятия § 1, Предмет химии. Вещества и их свойства § 15. Химические уравнения § 16. Типы химических реакций § 17. Количество вещества. Моль. Молярная масса ГЛАВА II. Кислород. Горение § 18. Кислород, его общая характеристика и нахождение в природе § 19. Получение кислорода ГЛАВА III. Водород ГЛАВА IV. Растворы. Вода ГЛАВА V. Обобщение сведений о важнейших классах неорганических соединений  Основания Основания §32. Кислоты §33. Соли ГЛАВА VI. Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома §34. Классификация химических элементов ГЛАВА VII. Химическая связь. Строение веществ ГЛАВА VIII. Закон Авогадро. Молярный объем газов ГЛАВА IX. Галогены Глава I. Электролитическая диссоциация § 1. Сущность процесса электролитической диссоциации Глава II. Кислород и сера § 10. Химические свойства серы. Применение серы § 11. Сероводород. Сульфиды § 12. Оксид серы(1У). Сернистая кислота § 13. Оксид серы(У1). Серная кислота § 14. Скорость химических реакций и ее зависимость от условий протекания. Химическое равновесие Глава III. § 24. Положение углерода и кремния в периодической таблице химических элементов, строение их атомов § 28. Угольная кислота и ее соли § 29. Круговорот углерода в природе § 30. Кремний и его свойства § 31. Оксид кремния(1У) § 32. Кремниевая кислота и ее соли § 33. Силикатная промышленность Глава V. Общие свойства металлов Глава VI. Металлы IA—IIIA-групп периодической таблицы химических элементов Д. И. Менделеева § 42. Алюминий Глава VII. Железо Глава VIII. Металлургия Глава IX. Краткий обзор важнейших органических веществ Углеводороды Производные углеводородов Глава I. Теория химического строения органических соединений. Электронная природа химических связей § 1. Формирование органической химии как науки Глава II. Предельные углеводороды (алканы, или парафины) § 6. Гомологи и изомеры алканов § 7. Получение, свойства и применение алканов § 8. Циклоалканы (пиклопарафины) Глава III. Непредельные углеводороды (алкены, алкадиены и алкины) Глава IV. Ароматические углеводороды (арены) Глава V. Природные источники углеводородов и их переработка Глава VI. Глава VII. Альдегиды, кетоны и карбоновые кислоты Глава VIII. Сложные эфиры и жиры § 30. Сложные эфиры Глава IX. Углеводы § 34. Крахмал § 35. Целлюлоза Глава X. Азотсодержащие органические соединения Глава XI. Синтетические полимеры Глава I. Важнейшие химические понятия и законы Глава II. Периодический закон и периодическая система химических элементов Д. И. Менделеева с точки зрения учения о строении атомов Глава III. Строение вещества Глава IV. Химические реакции Глава V. Металлы Глава VI. Неметаллы § 30. Обзор неметаллов |
Календарь
Госуслуги Навигатор Элект. Важно! Случайное фото ЭОР авторский Сайт МО нач. кл. Виртуальные музеи Сайт посетили |
||||||||||||||||||||||||||||||||||||||||||||||||||
Халькогены — общая характеристика, свойства и применение » Kupuk.net
Халькогены — это группа химических элементов, которые размещены в главной подгруппе 6 группы периодической таблицы Менделеева.
Интересно узнать, почему они так названы. А все потому, что в природе они очень часто встречаются в виде соединений с медью (на греческом «chalkos» — медь и «genos» — рожденный).
Описание и общая характеристика
Родоначальник этой группы — кислород. Кроме него сюда входят такие элементы как селен, сера, теллур и полоний.
Среди них: неметаллы — сера и кислород, промежуточные элементы между металлами и неметаллами — теллур и селен, и один металл — полоний.
С уменьшением порядочного номера элементов группы радиус атомов уменьшается, поэтому наименьший радиус имеется у кислорода, а наибольший — у полония.
Строение молекул и физические свойства
Электронная конфигурация атомов этих элементов характеризуется шестью электронами на внешнем энергетическом уровне.
Все халькогены могут проявлять разные степени окисления: для кислорода это -2 и +2 (в соединении с фтором), для атома теллура, а также для селена и серы это +2, +4 и +6.
Для кислорода и серы характерно такое свойство как аллотропия. Так как у них есть два неспаренных электрона, то возможны разные варианты строения простых веществ. Например, в зависимости от того, какую связь образует элемент О (кислород) — двойную или тройную, соответственно различают кислород и озон.
Также образовывать аллотропные вещества может сера, создавая многоатомные циклы и цепи.
Аллотропные модификации элементов имеют также различные физические свойства: такие характеристики как растворимость в воде и температура кипения у озона намного выше, чем у кислорода, а виды многоатомных цепей у серы такие как ромбическая и моноклинная, в отличие от пластической — растворяются в органических жидкостях, но при этом все они не растворяются в воде.
Химические свойства халькогенов
Кислород, как наиболее элетроотрицательный элемент этой группы — может выступать окислителем почти всех простых и некоторых сложных веществ.
Только взаимодействуя со фтором он выступает в качестве восстановителя с положительной степенью окисления. С неметаллами он взаимодействует при довольно высоких температурах.
Так как сера имеет высокую реакционную способность (особенно если она находится в твёрдом агрегатном состоянии, а не в расплаве) — она может соединяться почти со всеми простыми веществами, кроме инертных газов.
Её скорость взаимодействия с водородом и хлором увеличивается с увеличением температуры. Также она может гореть во фторе и окисляться при высоких температурах с образованием оксида серы.
Полоний, селен и теллур хотя и не имеют такой большой реакционной способности, как у двоих предыдущих представителей этой группы элементов, тем не менее — так же могут реагировать почти со всеми простыми веществами. Селениды, полониды и теллуриды металлов именуются наиболее устойчивыми.
Селениды, полониды и теллуриды металлов именуются наиболее устойчивыми.
Всем халькогенам характерна реакция диспропорционирования (в виде взаимодействия с водой).
Биологическая роль халькогенов
В этой группе есть как элементы, жизненно необходимые, так и те, биологическую роль которых не обнаружили. К первым относится сера, селен и, как ни странно, кислород; ко вторым — теллур и полоний.
Представители первой группы имеют место в составе биомолекул организма человека. Главное значение здесь по праву принадлежит кислороду.
Он окисляет питательные вещества, в результате чего выделяется энергия, необходимая для жизнедеятельности, принимает участие в защитных свойствах организма, также в медицине огромную роль играет его применение при различных заболеваниях, по причине которых у человека нарушаются дыхательные функции.
Другая форма кислорода — озон — используется для обеззараживания воздуха и дезинфекции помещений. Ещё его применяют для очистки питьевой воды. В природе его можно обнаружить в воздухе из-за характерного чувства приятной свежести и некоего запаха.
Теперь поговорим о сере. Она также, как и предыдущий элемент, относится по содержанию в организме к макроэлементам. Чтобы понять её большое значение, достаточно сказать, что она входит в состав таких биомолекул как белки, аминокислоты, гормоны, витамины.
Также её обнаружили в составе костей, в нервной ткани и в каротине волос. Кроме всего этого она некоторым образом участвует и в защитной системе организма, обезвреживая ядовитые соединения.
И последний представитель «полезных» элементов — селен. Хотя его относят к микроэлементам, но для организма он жизненно необходимым.
Селен может выступать в различных соединениях в роли аналога серы, замещая её. Его также обнаружили в составе некоторых ферментов.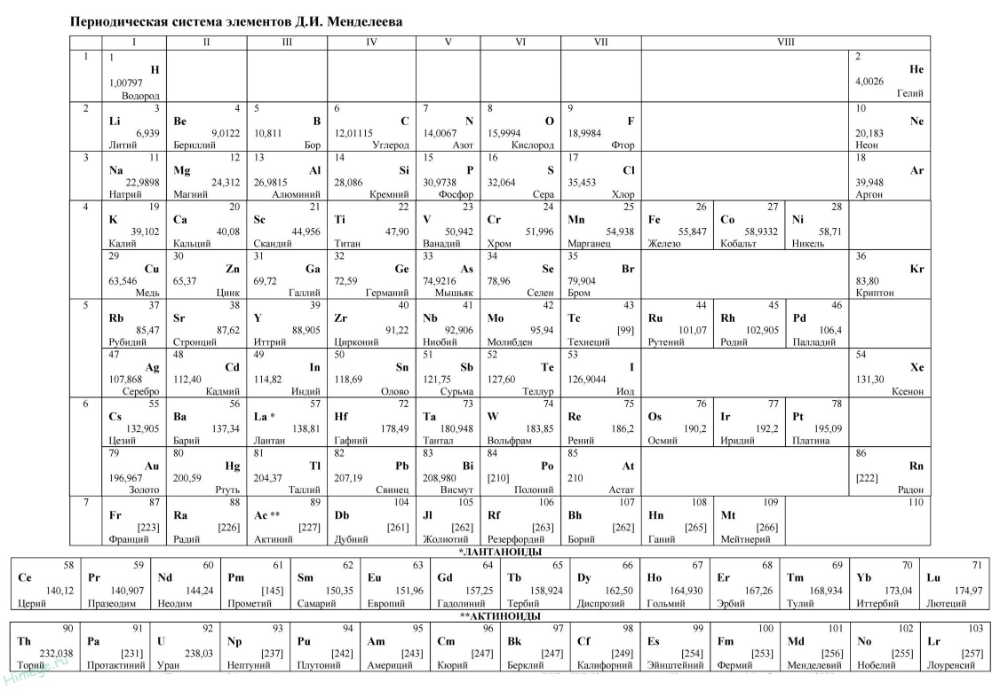
Находясь в активном центре одного из них — он участвует в защите клеток от действия пероксида водорода и органических пероксидов. Физиологическая роль этого элемента в процессе жизнедеятельности доказывается его способностью предохранять ткани от некроза. Ещё одна из функций селена — предохранение от отравления кадмием и ртутью.
Поэтому, если обобщить: сера и кислород — жизненно необходимые, селен — физиологически активен, а роль полония и теллура не обнаружена.
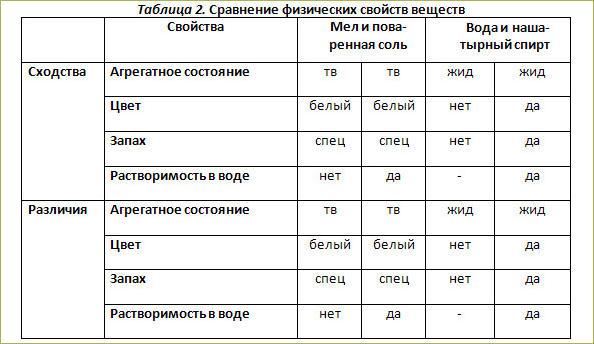
Практическая работа “Вещества и их физические свойства” | План-конспект урока по химии (8 класс):
Практическая работа № 2 Дата _________
«Вещества и их физические свойства» Цель:________________________________________________
_____________________________________________________
Оборудование и реактивы: штатив с пробирками, стеклянная палочка, кусочек стекла, образцы веществ: железо (гвоздь), медь, графит (стержень карандаша), вода, нашатырный спирт, поваренная соль или сахар, мел, медный купорос, алюминий, песок и т. д.
д.
При выполнении опытов соблюдайте правила техники безопасности при работе в химическом кабинете.
Задание. Опишите физические свойства выданных вам веществ.
Свои визуальные наблюдения, экспериментально полученные и справочные данные запишите в виде таблицы.
Физические свойства веществ
Физические свойства | Вещество | |
Агрегатное состояние | ||
Цвет | ||
Блеск | ||
Запах | ||
Твердость | ||
Растворимость в воде | ||
Плотность, г/см8 | ||
Температура плавления0С | ||
Температура кипения, 0С | ||
Задания для контроля
1. Выпишите отдельно название веществ и физических тел из приведенного ряда слов: карандаш, линейка, вода, поваренная соль, графит, проволока, ложка, медь, стекло, пробирка, сахар, труба, сера, стакан..
Выпишите отдельно название веществ и физических тел из приведенного ряда слов: карандаш, линейка, вода, поваренная соль, графит, проволока, ложка, медь, стекло, пробирка, сахар, труба, сера, стакан..
Вещества:_________________________________________________________________________________________________
Физические тела: ______________________________________
_____________________________________________________
2.Из перечисленных свойств веществ выпишите те, которые характерны для уксусной кислоты при обычных условиях: газообразное, твердое, жидкое, без цвета, серое, с запахом, без запаха, растворимо в воде, нерастворимо в воде, пластичный.
Уксусная кислота при обычных условиях — это: _____________________________________________________
3. Даны вещества: медный купорос, сахар, ртуть, аммиак, поваренная соль, спирт, сажа, бензин, нафталин, мел, глицерин, вода, уксусная кислота.. Сгруппируйте их по следующим сходным при обычных условиях свойствам:
а) твердые вещества ___________________________________
_____________________________________________________
б) жидкие вещества___________________________________
_____________________________________________________
в) вещества, обладающие запахом. _______________________
_______________________
_____________________________________________________
Оценка ____________________
Практик эш № 2. _____________
Матдәләр һәм аларның физик үзлекләре
Максат:_____________________________________________
_____________________________________________________
Җиһазлар һәм реактивлар: пробиркалар белән штатив, пыяла таякчык, пыяла кисәге, сулы стаканнар, матдәләр: тимер кадак, бакыр, графит, су, нашатыр спирты, аш тозы, шикәр, акбур, бакыр купоросы, алюминий, ком, цинк.
Тәҗрибәләрне башкарганда химия кабинетында эшләгәндә куркынычсызлык техникасы кагыйдәләрен төгәл үтәгез.
Бирем №1. Сезгә бирелгән матдәләрнең физик үзлекләрен тасвирлагыз.
Үзегезнең визуаль күзәтүләрегезне, тәҗрибә нәтиҗәләрен һәм
таблица күрсәткечләрен түбәндәге таблицага языгыз.
Матдәләрнең физик үзлекләре
Физик үзлекләр | Матдәләр | |
Агрегат халәте | ||
Төсе | ||
Ялтыравыгы | ||
Исе | ||
Катылыгы | ||
Суда эрүчәнлеге | ||
Тыгызлыгы, г/см8 | ||
Эретелү темпер-сы, 0С | ||
Кайнау темпер-сы, 0С | ||
Бирем №2. Түбәндәге биремнәрне башкарыгыз.
Түбәндәге биремнәрне башкарыгыз.
1. Түбәндәге исемлектән матдәләрнең һәм физик җисемнәрнең исемнәрен аерым күчереп языгыз: карандаш, линейка, су, аш тозы, чыбык, графит, калак, бакыр, пробирка, шикәр, стакан, торба, пыяла, күкерт.
Матдәләр: ___________________________________________
______________________________________________________________
Физик җисемнәр: _____________________________________
_____________________________________________________
2. Матдәләрнең күрсәтелгән үзлекләре арасыннан гадәти шартларда серкә кислотасына характерлы булганнарын аерып языгыз: газ, каты, сыеклык, төссез, иссез, соры төстә, исле, суда эрүчән, суда эремәүчән, пластик.
Гадәти шарларда серкә кислотасы ______________________
_______________________________________________ матдә .
3. Матдәләр бирелгән: шикәр, бакыр купоросы, терекөмеш, аммиак, аш тозы, спирт, корым, бензин, акбур, глицерин, су, нафталин, серкә кислотасы.
Түбәндәге үзлекләре буенча аларны группаларга аерыгыз:
а) каты матдәләр; б) сыек матдәләр; в) исле матдәләр.
Каты матдәләр: ______________________________________
____________________________________________________
Сыек матдәләр: ______________________________________
____________________________________________________
Исле матдәләр: _______________________________________
_____________________________________________________
Билге _________________
| Период 1 | 1 Х 1,008 Водород | 2 Он 4.0026 Гелий | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Ли 6,94 Литий | 4 Быть 9.0122 Бериллий | 5 Б 10,81 Бор | 6 С 12.011 Углерод | 7 Н 14.007 Азот | 8 О 15,999 Кислород | 9 Ф 18,998 Фтор | 10 Не 20. Неон | |||||||||||
| 3 | 11 Нет 22.990 Натрий | 12 Мг 24.305 Магний | 13 Ал 26.982 Алюминий | 14 Си 28.085 Кремний | 15 Р 30,974 Фосфор | 16 С 32.06 Сера | 17 Кл 35,45 Хлор | 18 Ар 39,948 Аргон | |||||||||||
| 4 | 19 К 39.098 Калий | 20 Ca 40.078 Кальций | 21 СК 44,956 Скандий | 22 Ти 47.867 Титан | 23 В 50,942 Ванадий | 24 Кр 51,996 Хром | 25 Мн 54,938 Марганец | 26 Фе 55. Железо | 27 Ко 58.933 Кобальт | 28 Ni 58.693 Никель | 29 Медь 63,546 Медь | 30 Цинк 65,38 Цинк | 31 Га 69.723 Галлий | 32 Гэ 72.630 Германий | 33 Как 74,922 Мышьяк | 34 Se 78,971 Селен | 35 руб 79.904 Бром | 36 Кр 83,798 Криптон | |
| 5 | 37 руб. руб.85.468 Рубидий | 38 Старший 87,62 Стронций | 39 Д 88.906 Иттрий | 40 Зр 91.224 Цирконий | 41 № 92,906 Ниобий | 42 Мо 95,95 Молибден | 43 ТК ☢ 96. Технеций | 44 Ру 101.07 Рутений | 45 Рх 102,91 Родий | 46 Пд 106,42 Палладий | 47 Аг 107,87 Серебро | 48 CD 112,41 Кадмий | 49 В 114,82 Индий | 50 Сн 118,71 Олово | 51 Сб 121,76 Сурьма | 52 Те 127,60 Теллур | 53 я 126,90 Йод | 54 Хе 131,29 Ксенон | |
| 6 | 55 Cs 132,91 Цезий | 56 Ба 137,33 Барий | * | 71 Лу 174,97 Лютеций | 72 Хф 178,49 Гафний | 73 Та 180,95 Тантал | 74 Вт 183,84 Вольфрам | 75 Ре 186,21 Рений | 76 ОС 190,23 Осмий | 77 Ир 192,22 Иридий | 78 Пт 195,08 Платина | 79 Золото 196,97 Золото | 80 рт. 200,59 Меркурий | 81 Тл 204,38 Таллий | 82 Пб 207,2 Свинец | 83 Би 208,98 Висмут | 84 ПО ☢ 208,98 Полоний | 85 В ☢ 209,99 Астатин | 86 Р-н ☢ 222.02 Радон |
| 7 | 87 Пт ☢ 223.02 Франций | 88 Ра ☢ 226.03 Радий | ** | 103 Лр ☢ 262,11 Лоуренсиум | 104 Rf ☢ 267,12 Резерфордий | 105 Дб ☢ 270,13 Дубниум | 106 Сг ☢ 269,13 Сиборгиум | 107 Бх ☢ 270,13 Борий | 108 Hs ☢ 269,13 Хассиум | 109 Мт ☢ 278,16 Мейтнерий | 110 Дс ☢ 281,17 Дармштадтиум | 111 Rg ☢ 281,17 Рентгений | 112 Cn ☢ 285,18 Коперниций | 113 Nh ☢ 286,18 Нихоний | 114 Фл ☢ 289. Флеровиум | 115 Мк ☢ 289,20 Московиум | 116 ур. ☢ 293,20 Ливермориум | 117 Ц ☢ 293,21 Теннесси | 118 Ог ☢ 294,21 Оганесон |
| *Лантаноиды | * | 57 Ла 138,91 Лантан | 58 Се 140.12 Церий | 59 Пр 140,91 Празеодим | 60 Нд 144,24 Неодим | 61 ☢ 144,91 Прометий | 62 См 150,36 Самарий | 63 ЕС 151,96 Европий | 64 гд 157,25 Гадолиний | 65 Тб 158,93 Тербий | 66 Дай 162,50 Диспрозий | 67 Хо 164,93 Гольмий | 68 Er 167,26 Эрбий | 69 Тм 168,93 Тулий | 70 Ыб 173,05 Иттербий | ||||
| **Актиноиды | ** | 89 Ac ☢ 227. Актиний | 90 Чт ☢ 232.04 Торий | 91 Па ☢ 231.04 Протактиний | 92 У ☢ 238.03 Уран | 93 Нп ☢ 237,05 Нептуний | 94 Полиуретан ☢ 244,06 Плутоний | 95 Ам ☢ 243,06 Америций | 96 См ☢ 247,07 Кюриум | 97 Бк ☢ 247,07 Берклиум | 98 См. ☢ 251.08 Калифорния | 99 Эс ☢ 252,08 Эйнштейний | 100 FM ☢ 257,10 Фермиум | 101 Мд ☢ 258. Менделевий | 102 № ☢ 259,10 Нобелий | ||||
Периодические тенденции – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 618
Периодические тренды — это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства. Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер. Периодические тренды, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого предсказания свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодического характера элементов.
Электроотрицательность Тенденции
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягивать и связывать электроны. Поскольку электроотрицательность является качественным свойством, стандартного метода расчета электроотрицательности не существует. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Рисунок \(\PageIndex{1}\): Периодическая таблица значений электроотрицательности Электроотрицательность измеряет тенденцию атома притягивать и образовывать связи с электронами. Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов. Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов. Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
- Слева направо по периоду элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его приобретения.
 И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его. - Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром, или увеличивается атомный радиус.
- Важные исключения из приведенных выше правил включают инертные газы, лантаноиды и актиноиды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны. Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.
- Что касается переходных металлов, хотя они имеют значения электроотрицательности, между ними мало различий по периоду и вверх и вниз по группе.
 Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
В соответствии с этими двумя общими тенденциями наиболее электроотрицательным элементом является фтор с 3,98 единицами Полинга.
Рисунок \(\PageIndex{2}\): Периодическая таблица, показывающая тренд электроотрицательностиТенденции энергии ионизации
Энергия ионизации — это энергия, необходимая для отрыва электрона от нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности. Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена. Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Другим фактором, влияющим на энергию ионизации, является экранирование электронов . Электронное экранирование описывает способность внутренних электронов атома экранировать его положительно заряженное ядро от его валентных электронов. При движении вправо от точки увеличивается число электронов и увеличивается сила экранирования. В результате электронам валентной оболочки легче ионизироваться, и, таким образом, энергия ионизации уменьшается вниз по группе. Электронное экранирование также известно как экранирование .
Тенденции
- Энергия ионизации элементов в периоде обычно увеличивается слева направо. Это связано со стабильностью валентной оболочки.
- Энергия ионизации элементов внутри группы обычно уменьшается сверху вниз. Это происходит из-за электронного экранирования.

- Благородные газы обладают очень высокими энергиями ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что у гелия самая высокая энергия ионизации среди всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти различные энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации — это энергия, необходимая для удаления электрона с самой внешней или наивысшей энергией, вторая энергия ионизации — это энергия, необходимая для удалить любой последующий высокоэнергетический электрон из газообразного катиона и т. д. Ниже приведены химические уравнения, описывающие первую и вторую энергии ионизации: 9- \]
Как правило, любые последующие энергии ионизации (2-я, 3-я и т. д.) следуют той же периодической тенденции, что и первая энергия ионизации.
Рисунок \(\PageIndex{4}\): периодическая таблица, показывающая тренд энергии ионизации Энергия ионизации уменьшается по мере увеличения атомного радиуса. На это наблюдение влияют \(n\) (главное квантовое число) и \(Z_{eff}\) (основанное на атомном номере и показывающее, сколько протонов видно в атоме) на энергию ионизации (I). Связь задается следующим уравнением: 92} \]
На это наблюдение влияют \(n\) (главное квантовое число) и \(Z_{eff}\) (основанное на атомном номере и показывающее, сколько протонов видно в атоме) на энергию ионизации (I). Связь задается следующим уравнением: 92} \]
- Через период \(Z_{eff}\) увеличивается на , а n (главное квантовое число) остается тем же самым , поэтому энергия ионизации увеличивается на .
- Вниз по группе \(n\) увеличивает и \(Z_{eff}\) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства к электрону
Как следует из названия, сродство к электрону — это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Рисунок \(\PageIndex{5}\): периодическая таблица, показывающая тренд сродства к электрону Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тренд атомного радиуса, обсуждаемый ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее. Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее. Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
- Сродство к электрону увеличивается слева направо в пределах периода. Это связано с уменьшением атомного радиуса.
- Сродство к электрону уменьшается сверху вниз внутри группы. Это связано с увеличением атомного радиуса.
Atomic Radius Trends
Атомный радиус равен половине расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра окружности). Однако эта идея усложняется тем фактом, что не все атомы обычно связаны друг с другом одинаковым образом. Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью. Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одинарной ковалентной связью. Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Размер атома постепенно уменьшается слева направо по периоду элементов. Это связано с тем, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более положительно заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение. Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру.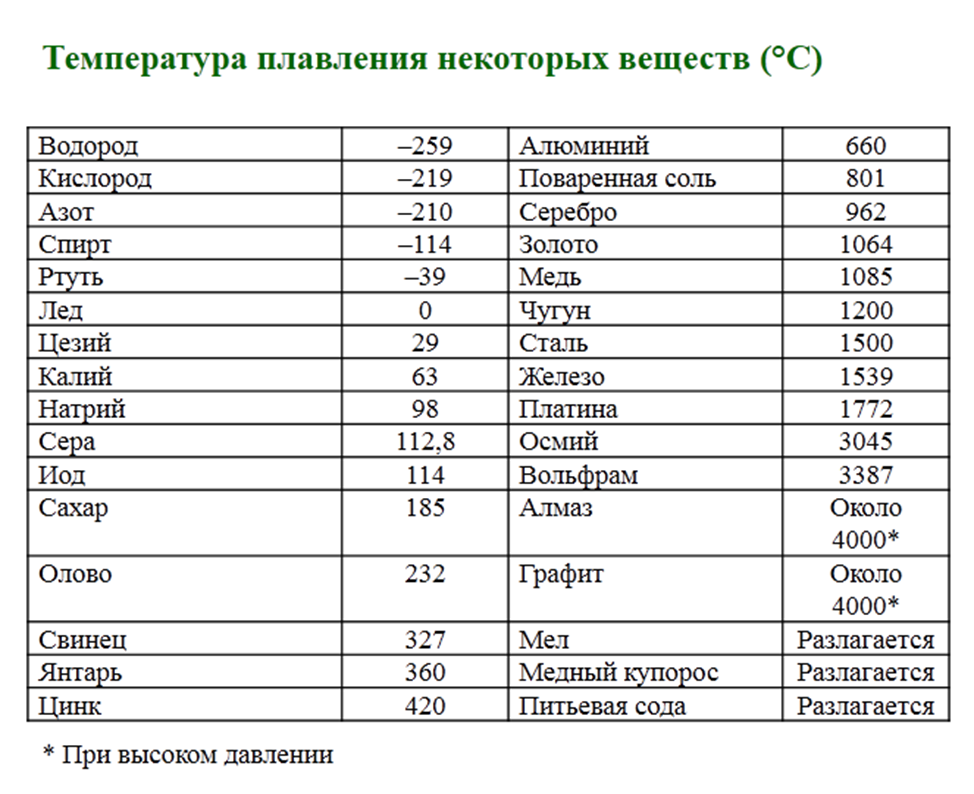 Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
D собственная группа, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n». Экранирование электронов предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.
- Атомный радиус уменьшает слева направо в пределах точки. Это вызвано увеличением числа протонов и электронов за период. Один протон имеет больший эффект, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается сверху вниз внутри группы. Это происходит из-за электронного экранирования.

Тенденции изменения температуры плавления
Температура плавления — это количество энергии, необходимое для разрыва связи (связей) для превращения твердой фазы вещества в жидкость. Как правило, чем прочнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Точки плавления различны и обычно не образуют различимой тенденции в периодической таблице. Однако из рисунка \(\PageIndex{7}\) можно сделать определенные выводы.
- Металлы обычно обладают высокой температурой плавления .
- Большинство неметаллов имеют низкую температуру плавления .
- Неметалл углерод обладает самой высокой температурой плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлического характера
Металлический характер элемента можно определить как легкость, с которой атом может потерять электрон. Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
- Металлические характеристики уменьшаются слева направо по периоду. Это вызвано уменьшением радиуса (вызванным Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики увеличиваются вниз по группе. Электронное экранирование вызывает увеличение атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.

- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Другой более простой способ запомнить тенденцию металлического характера состоит в том, что при движении влево и вниз к нижнему левому углу периодической таблицы металлический характер увеличивается в направлении групп 1 и 2, или групп щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к верхнему правому углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов . К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Переместиться влево по периоду и вниз по группе: увеличить металлический характер (в сторону щелочных и щелочных металлов)
- Перемещение вправо по периоду и вверх по группе: уменьшение металлического характера (в направлении неметаллов, таких как благородные газы)
Задачи
Следующая серия задач дает обзор общего понимания вышеупомянутого материала.
1. Основываясь на периодических трендах энергии ионизации, какой элемент имеет наибольшую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (Не)
2.) Азот имеет больший атомный радиус, чем кислород.
- А.) Правда
- Б.) Ложь
3.) Что имеет более металлический характер, свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицательный, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке убывания эффективного заряда ядра по валентным электронам: Si, Al, Mg, S
8) Перепишите следующий список в порядке убывания сродства к электрону: фтор (F), фосфор (P) , сера (S), бор (B).
9) Атом с атомным радиусом меньшим, чем у серы (S), является __________.
- А.) Кислород (О)
- Б.) Хлор (Cl)
- С.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ничего из вышеперечисленного
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- А.) Верно Б.) Ложно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет наибольшую энергию ионизации, потому что, как и у других благородных газов, валентная оболочка гелия заполнена. Следовательно, гелий стабилен и с трудом теряет или приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Радиус атома увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Объяснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по столбцу. Свинец находится под оловом, поэтому свинец имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: В неметаллах температура плавления увеличивается вниз по столбцу. Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одной колонке. Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полные валентные оболочки.
Пояснение: Из-за полной валентной электронной оболочки благородные газы чрезвычайно стабильны и не теряют и не приобретают электроны.
7. Ответ: S > Si > Al > Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый чувствует притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)>Сера (S)>Фосфор (P)>Бор (B)
Пояснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Объяснение: Периодические тренды показывают, что атомный радиус увеличивается вверх по группе и слева направо по периоду. Поэтому кислород имеет меньший атомный радиус серы.
Поэтому кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, превращаясь в ион, а неметалл приобретает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Ссылки
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения размеров атомов». J. Chem. Образовательный 1998 75 725.{cke_protected}{C}
- Куреши, Пушкин М.; Камунпури, С. Икбал М. «Сольватация ионов: проблема ионных радиусов». J. Chem. Образовательный 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Образовательный 1993 , 70 , 368.

- Руссо, Стив и Майк Сильвер. Введение в химию. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд. Нью-Джерси: Пирсон, 2007. .
- Аткинс, Питер и др. al, Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Альберти, Роберт А. и др. ал, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc, pg. 380.
- Котс, Джон К. и др. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, pg. 305-309.
Periodic Trends распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Света Рамиредди, Бинъяо Чжэн, Эмили Нгуен и Эмили Нгуен.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Оглавление
- нет на странице
- Теги
- Атомный радиус
- автор @ Бинъяо Чжэн
- автор @ Эмили Нгуен
- автор @ Света Рамиредди
- Электронное сродство
- электроотрицательность
- Тенденции электроотрицательности
- Энергия ионизации
- температура плавления
- металлический символ
- периодический закон
- периодическая таблица
- Периодические тренды
- Тренды
1.
 3: Свойства материи — Химия LibreTexts
3: Свойства материи — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21693
↵
Цели обучения
- Отделить физические свойства и изменения от химических
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физические свойства могут быть экстенсивными или интенсивными. Экстенсивные свойства зависят от количества вещества и включают массу, вес и объем. Интенсивные свойства , напротив, не зависят от количества вещества; они включают цвет, температуру плавления, точку кипения, электрическую проводимость и физическое состояние при данной температуре. Например, элементарная сера представляет собой желтое кристаллическое твердое вещество, которое не проводит электричество и имеет температуру плавления 115,2 °C, независимо от того, какое количество исследуется (рис. \(\PageIndex{1}\)). Ученые обычно измеряют интенсивные свойства для определения идентичности вещества, в то время как экстенсивные свойства передают информацию о количестве вещества в образце.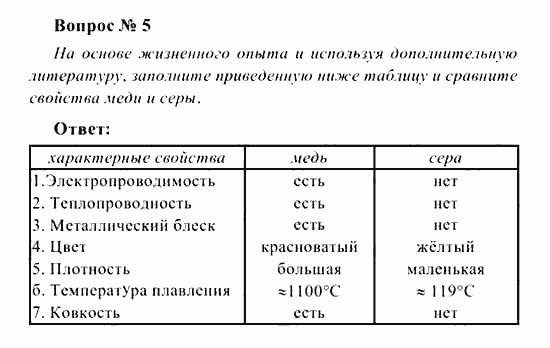
Хотя масса и объем являются экстенсивными свойствами, их соотношение является важным интенсивным свойством, называемым плотностью (\(\rho\)). Плотность определяется как масса на единицу объема и обычно выражается в граммах на кубический сантиметр (г/см 3 ). По мере увеличения массы в данном объеме увеличивается и плотность. Например, свинец с его большей массой имеет гораздо большую плотность, чем тот же объем воздуха, точно так же, как кирпич имеет большую плотность, чем пенополистирол того же объема. При данной температуре и давлении плотность чистого вещества постоянна:
\[\begin{align*} \text{плотность} &={\text{масса} \over \text{объем}} \\[4pt] \rho &={m \over V} \label{Eq1} \end{выравнивание*} \]
Чистая вода, например, имеет плотность 0,998 г/см 3 при 25 °C.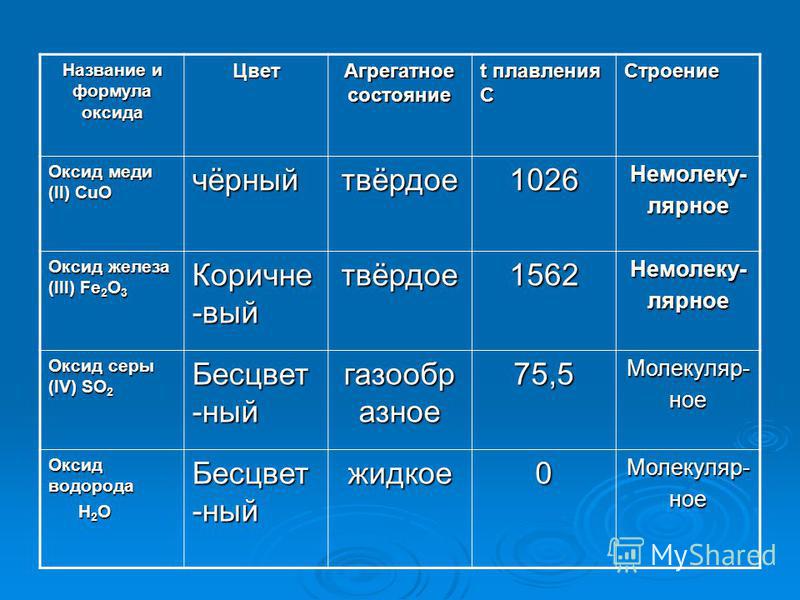 Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (рис. \(\PageIndex{2}\)).
Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (рис. \(\PageIndex{2}\)).
| Вещество | Плотность при 25 °C (г/см 3 ) | Вещество | Плотность при 25 °C (г/см 3 ) |
|---|---|---|---|
| кровь | 1,035 | кукурузное масло | 0,922 |
| жировые отложения | 0,918 | майонез | 0,910 |
| цельное молоко | 1,030 | мед | 1. 420 420 |
Физические свойства и изменение
Физические изменения — это изменения, при которых химические связи не разрываются и не образуются. Это означает, что те же типы соединений или элементов, которые были в начале изменения, остаются и в конце изменения. Поскольку конечные материалы такие же, как и начальные, свойства (такие как цвет, температура кипения и т. д.) также будут одинаковыми. Физические изменения связаны с перемещением молекул, но не с их изменением. Некоторые типы физических изменений включают в себя:
- Изменение состояния (переход из твердого состояния в жидкое или газообразное и наоборот)
- Разделение смеси
- Физическая деформация (порезы, вмятины, растяжения)
- Приготовление растворов (специальных видов смесей).

Когда кубик льда тает, его форма меняется, поскольку он приобретает способность течь. При этом его состав не меняется. Плавление является примером физического изменения (Рисунок \(\PageIndex{3}\)), поскольку некоторые свойства материала меняются, но сущность материи не меняется. Физические изменения можно дополнительно классифицировать как обратимые и необратимые. Растаявший кубик льда можно снова заморозить, поэтому таяние является обратимым физическим изменением. Все физические изменения, связанные с изменением состояния, обратимы. Другие изменения состояния включают испарение (жидкость в газ), замерзание (жидкость в твердое) и конденсация (газ в жидкость). Растворение также является обратимым физическим изменением. Когда соль растворяется в воде, говорят, что соль перешла в водное состояние. Соль можно восстановить, выкипятив воду, оставив соль.
Рисунок \(\PageIndex{3}\): Таяние льда — это физическое изменение. Когда твердая вода (\(\ce{H_2O}\)) в виде льда превращается в жидкость (воду), она кажется измененной. Однако это изменение носит только физический характер, поскольку состав составляющих молекул остается тем же: 11.19.% водорода и 88,81% кислорода по массе.
Когда твердая вода (\(\ce{H_2O}\)) в виде льда превращается в жидкость (воду), она кажется измененной. Однако это изменение носит только физический характер, поскольку состав составляющих молекул остается тем же: 11.19.% водорода и 88,81% кислорода по массе.
Химические свойства и изменение
Химические изменения происходят при разрыве и/или образовании связей между молекулами или атомами. Это означает, что одно вещество с определенным набором свойств (таким как температура плавления, цвет, вкус и т. д.) превращается в другое вещество с другими свойствами. Химические изменения часто труднее обратить вспять, чем физические изменения.
Одним из хороших примеров химического изменения является сжигание бумаги. В отличие от процесса разрывания бумаги, процесс сжигания бумаги фактически приводит к образованию новых химических веществ (точнее, углекислого газа и воды). Другой пример химического изменения происходит при образовании воды. Каждая молекула содержит два атома водорода и один атом кислорода, химически связанные.
Еще одним примером химического изменения является то, что происходит, когда в печи сжигается природный газ. На этот раз перед реакцией у нас есть молекула метана, \(\ce{CH_4}\), и две молекулы кислорода, \(\ce{O_2}\), а после реакции у нас есть две молекулы воды, \(\ce{H_2O}\) и одна молекула углекислого газа, \(\ce{CO_2}\). При этом изменился не только внешний вид, но и структура молекул. Новые вещества не обладают такими же химическими свойствами, как исходные. Следовательно, это химическое изменение.
Сгорание металлического магния также является химическим изменением (Магний + Кислород → Оксид магния):
\[\ce{2 Mg + O_2 \rightarrow 2 MgO } \nonumber \]
как и ржавление железа (Железо + Кислород → Оксид железа/ Ржавчина):
\[\ce{4 Fe + 3O_2 \rightarrow 2 Fe_2O_3} \nonumber \]
Используя компоненты состава и свойства, мы имеем возможность отличить один образец вещества от другие.
Различные определения изменений: Различные определения изменений, YouTube(opens in new window) [youtu.



 Хлор
Хлор  Азот и фосфор
Азот и фосфор Физические свойства металлов
Физические свойства металлов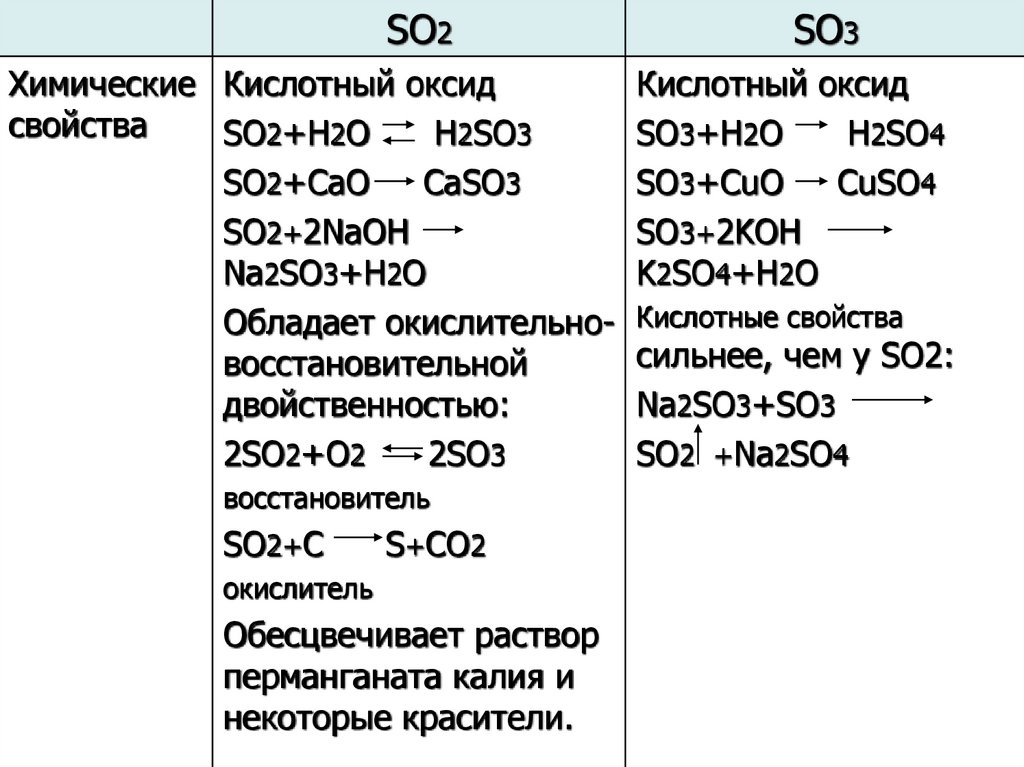 М. Бутлерова
М. Бутлерова
 Спирты и фенолы
Спирты и фенолы Амины
Амины  Валентность и валентные возможности атомов
Валентность и валентные возможности атомов  Обзор металлических элементов А-групп
Обзор металлических элементов А-групп  дневник
дневник 180
180 845
845 906
906 ст.
ст. 03
03 10
10 И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.