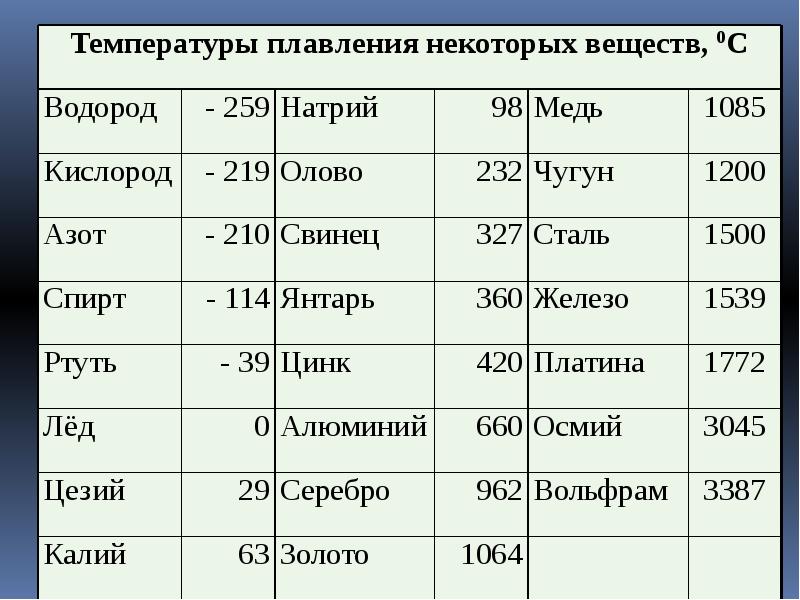
Таблица температур плавления металлов: Таблица температуры плавления металлов и сплавов в градусах
alexxlab | 04.03.2023 | 0 | Разное
Температура плавления | Мир сварки
Содержание
- Температура плавления
- Металлы
- Пластмассы
- Жидкости
- Газы
- Литература
Температура плавления
Температура плавления – температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится.
| Материал | Температура плавления, °С |
|---|---|
| Металлы | |
| Актиний | 990-1090 |
| Алюминий | 658,7 |
| Алюминия оксид | 2050 |
| Америций | 995 |
| Барий | 725 |
| Бериллий | 1285 |
| Бериллия оксид | 2585 |
| Берклий | 986 |
| Ванадий | 1710 |
| Ванадия оксид | 2000 |
| Висмут | 271,3 |
| Висмута оксид | 860 |
| Вольфрам | 3416 |
| Вольфрама оксид | 2636 |
| Гадолиний | 1312 |
| Галлий | 29,8 |
| Гафний | 2150 |
| Гафния бориды | 3000–3200 |
| Германий | 958 |
| Гольмий | 1461 |
| Диспрозий | 1407 |
| Европий | 958 |
| Железо | 1530 |
| Железа оксид | 1560 |
| Золото | 1063 |
| Индий | 156,2 |
| Иридий | 2410 |
| Иттербий | 824 |
| Иттрий | 1500 |
| Кадмий | 320,8 |
| Кадмия оксид | 1420 |
| Калий | 63,7 |
| Кальций | 851,6 |
| Кальция оксид | 2570 |
| Кобальт | 1490 |
| Кобальта оксид | 900 |
| Кюрий | 1340 |
| Лантан | 920 |
| Латунь | 900 |
| Литий | 186 |
| Лития оксид | 1700 |
| Лютеций | 1652 |
| Магний | 651 |
| Магния оксид | 2800 |
| Марганец | 1245 |
| Марганца оксид | 1650 |
| Медь | 1083 |
| Меди оксид | 1235 |
| Молибден | 2625 |
| Молибдена оксид | 795 |
| Натрий | 97,8 |
| Нептуний | 640 |
| Неодим | 1024 |
| Никель | 1452 |
| Никеля оксид | 1655 |
| Ниобий | 2468 |
| Ниобия оксид | 1520 |
| Олово | 231,9 |
| Олова оксид | 1627 |
| Осмий | 3000 |
| Палладий | 1550 |
| Платина | 1773,5 |
| Плутоний | 640 |
| Полоний | 254 |
| Празеодим | 935 |
| Прометий | 1035 |
| Протактиний | 1500 |
| Радий | 700 |
| Рений | 3180 |
| Родий | 1966 |
| Ртуть | -38,9 |
| Рубидий | 38,9 |
| Рутений | 2400 |
| Самарий | 1072 |
| Свинец | 327,3 |
| Свинца оксид | 888 |
| Серебро | 960,8 |
| Скандий | 1539 |
| Сплав Вуда | 65,5 |
| Сталь | 1300-1400 |
| Стронций | 770 |
| Сурьма | 630,5 |
| Сурьмы оксид | 656 |
| Талий | 304 |
| Тантал | 2950 |
| Тантала карбиды | 3500–3900 |
| Тербий | 1356 |
| Технеций | 2200 |
| Титан | 1800 |
| Титана оксид | 1800 |
| Торий | 1696 |
| Тулий | 1545 |
| Уран | 1132 |
| Хром | 1890 |
| Хрома оксид | 1900 |
| Цезий | 28,7 |
| Церий | 795 |
| Цинк | 420 |
| Цинка оксид | 1800 |
| Цирконий | 1852 |
| Циркония бориды | 3000–3200 |
| Циркония карбиды | 3500–3900 |
| Чугун | 1100-1200 |
| Эрбий | 1497 |
| Пластмассы | |
| Винипласт | — |
| Капролон | 220-226 |
| Капрон | 210-218 |
| Лавсан | 264 |
| Полиамид-6 | 220 |
Полиамид-6. 6 6 | 260 |
| Полиамид-6.10 | 213-220 |
| Поливинилиденхлорид | 185-200 |
| Полигексаметиленадипинамид | 225-265 |
| Полигексаметиленсебацинамид | 213-220 |
| Полиизобутилен | 125 |
| Поликапролактам (капролон) | 220-226 |
| Поликапролактам (капрон) | 210-218 |
| Поликарбонат | 180 |
| Полипропилен | 170 |
| Полистирол | — |
| Политетрафторэтилен (фторопласт-4) | 327 |
| Полиуретан (линейный) | 184 |
| Полиформальдегид | 175 |
| Полиэтилен (ВП) | 125 |
| Полиэтилен (НП) | 107 |
| Полиэтилентерефталат (лавсан) | 264 |
| Фторопласт-4 | 327 |
| Жидкости | |
| Ацетон | -94,3 |
| Бензол | 5,5 |
| Бром | -7,2 |
| Лед (вода) | 0 |
| Сероуглерод | -112 |
| Спирт метиловый | -97,8 |
| Спирт этиловый | -114 |
| Толуол | -95,1 |
| Эфир этиловый | -116,3 |
| Газы | |
| Азот | -209,8 |
| Азота оксид | -163,7 |
| Аммиак | -77,7 |
| Аргон | -189,2 |
| Водород | -259,2 |
| Воздух | -213 |
| Гелий | -269,7 |
| Кислород | -218,8 |
| Криптон | -157 |
| Ксенон | -111,9 |
| Неон | -248,6 |
| Озон | -251,5 |
| Радон | -71 |
| Серы диоксид | -72,7 |
| Углерода диоксид | -56,6 |
| Углерода оксид | -207 |
| Фтор | -219,6 |
| Хлор | -100,9 |
| Этан | -183,6 |
| Этилен | -169,4 |
Литература
- Материаловедение / Ю.
 Т. Чумаченко, Г.В. Чумаченко. – Ростов н/Д: Феникс, 2005. – 320 с.
Т. Чумаченко, Г.В. Чумаченко. – Ростов н/Д: Феникс, 2005. – 320 с. - Сварка плавлением титана и его сплавов / Ф.Е. Третьяков. М., Машиностроение, 1968, 142 с.
- Металлургия и технология сварки титана и его сплавов / Под ред. С.М. Гуревича. К., Наукова думка, 1979. 300 с.
- Применение титана в народном хозяйстве / С.Г. Глазунов, С.Ф. Важенин, Г.Д. Зюков-Батырев, Я.Л. Ратнер. Л., Технiка, 1975, 200 с.
- Справочник по элементарной физике / Н.Н. Кошкин, М.Г. Ширкевич. М., Наука. 1976. 256 с.
- Справочник сварщика / И. Н. Бондин. М.: Машгиз. 1959. 268 с.
- Популярная библиотека химических элементов. Серебро – нильсборий / М.: Наука. 1983. – 572 с.
- Высокочастотная сварка пластмасс / Под ред. А.Н. Шамова. – Л.: Машиностроение, 1990. – 80 с.
- Сварка пластмасс / Е.Б. Тростянская, Г.В. Комаров. М.: Машиностроение. 1966. – 251 с.
- Альфа и омега. Краткий справочник / Таллин: Принтэст, 1991 – 448 с.
- Справочник по сварке цветных металлов / С.
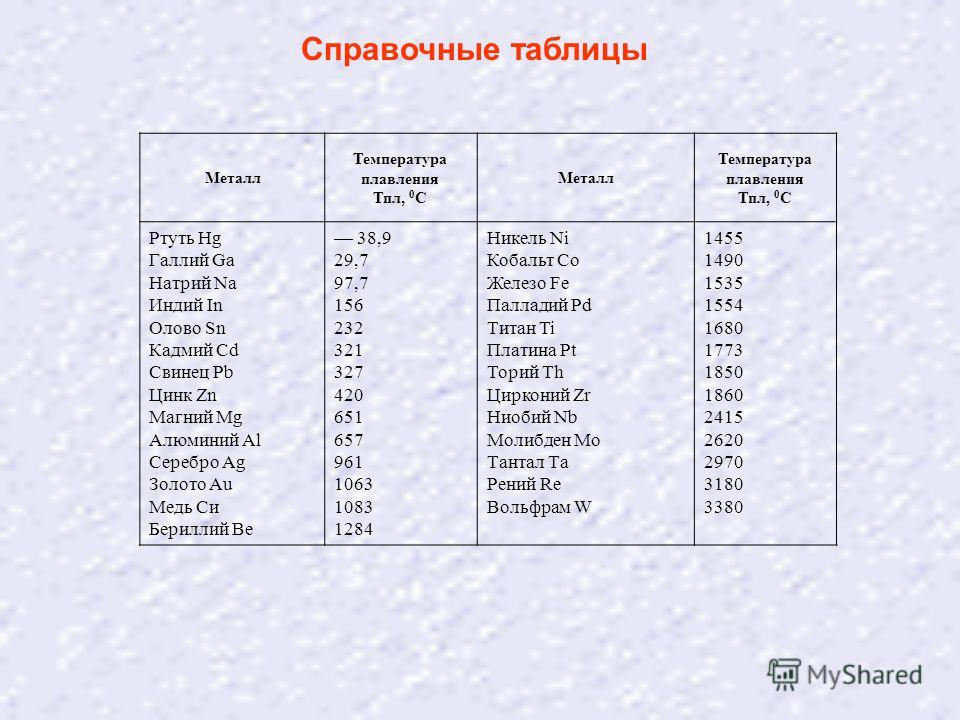 М. Гуревич. Киев.: Наукова думка. 1990. 512 с.
М. Гуревич. Киев.: Наукова думка. 1990. 512 с.
при какой температуре плавится припой ПОС 60
Соединение пайкой — распространенные метод сборки электронных элементов на платах. Применение припоям находится в трубопроводных системах, бытовых и промышленных электрических сетях. За счет прочного соединения гарантируется идеальный контакт или герметичность стыков. В процессе задействован припой — один или несколько металлов с относительно низкой температурой плавления. Рассмотрим виды и технические характеристики данных металлов, в частности олово.
Содержание
- При какой температуре плавится олово
- Виды олова для пайки
- Изготовление припоев
- Марки
- Сплавы на основе олова
- Температура плавления припоев
- Свойства
- Химические
- Металлическое олово
- Олово II
- Олово IV
- Физические
- Серое и белое олово
- Изотопы
- Оптические
- Кристаллографические
- История и происхождение названия
- Нахождение в природе
- Месторождения
- Распространенность в природе
- Формы нахождения
- Твердая фаза минералы
- Собственно минеральные формы
- Коллоидная форма
- Формы нахождения олова в жидкой фазе
- Промышленные типы месторождений олова
- Промышленное получение
- Эффекты от воздействия соединений олова
- На здоровье человека
- На окружающую среду
- Сферы применения олова
При какой температуре плавится олово
Олово входит в группу легких металлов по таблице Менделеева. Имеет хорошую ковкость, при размещении заготовки с подобным покрытием в условиях улицы на поверхности сформируется защитная оксидная пленка.
Имеет хорошую ковкость, при размещении заготовки с подобным покрытием в условиях улицы на поверхности сформируется защитная оксидная пленка.
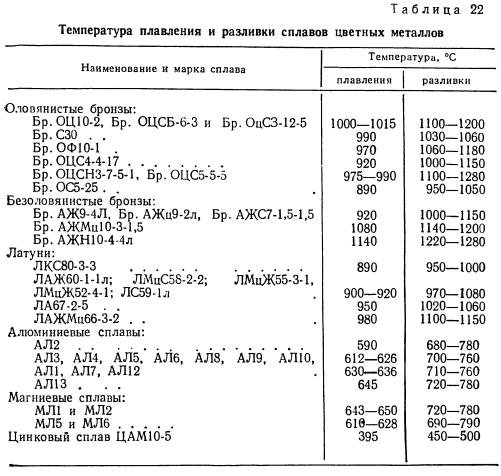
Температура плавления чистого олова для пайки составляет 231 градус Цельсия.
Чаще всего в промышленности и быту применяется не чистый металл, а сплав с другими, подобными ему по температуре плавки и свойствам.
Виды олова для пайки
Для группы припоев существует аббревиатура ПОС — припои оловянно свинцовые. Различие марок — в пропорциональном содержании металлов, наличии дополнительных элементов для повышения качества материала прутков.
По порогу плавления виды олова различают на низкотемпературные припои и высокотемпературные. В зависимости от температуры рабочей среды, применение находят обе группы материалов.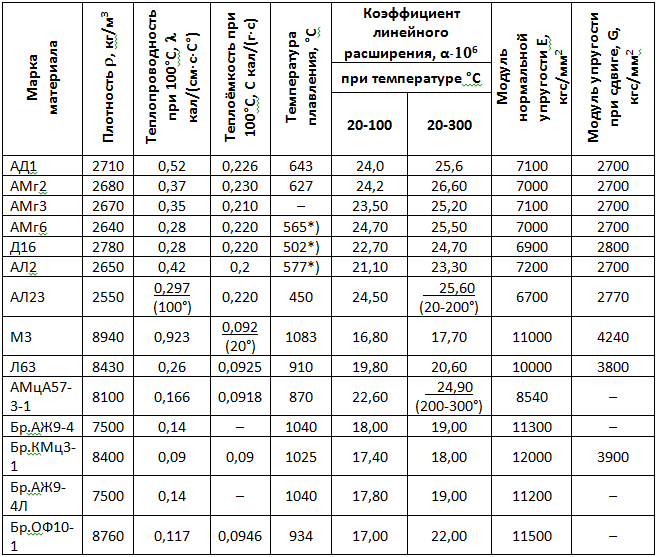
Изготовление припоев
В процессе производства припоев кроме Sn задействованы:
- медь;
- свинец;
- серебро;
- сурьма.
В зависимости от процентного соотношения металлов в готовых марках припоев, варьируется мягкость сплава. Также меняется:
- температура плавления;
- прочность соединения;
- практическая применяемость.
Низкотемпературные припои находят свое применение в радиотехнике и электронике. Это связано с технологической особенностью при сборке и ремонте плат. Некоторые элементы при значительном перегреве могут выйти из строя. Поэтому соединение платы и компонента обязательно производится низкотемпературным сплавом.
Несколько примеров:
- ПОС 60 задействуют для лужения, его температура плавления — 270 градусов.
- Температура плавления в 238 градусов обозначена для ПОС 40. Сплав находит применение в радиотехнике.
Разберем марки чистого металла и получаемых на его основе сплавов.
Марки
Промышленность выпускает следующие разновидности чистого металла:
- О1, О1пч. Готовый продукт представлен проволокой, прутками различного диаметра и чешуей. Содержание примесей — менее 0.01%.
- ОВЧ-000 выходит с конвейера в прутках. Олово высококачественное — до 99.99%.
- О2 — в готовом металле наблюдается до 0.435% примесей.
- В виде чушек сплав О3 после производства содержит 98.49% чистого Sn.
- Наибольшее содержание примесей наблюдается в О4. Полезного металл здесь около 96.5%.
Из чистого продукта промышленность выпускает сплавы, отличие — физические характеристики, в том числе температура плавления, прочность, количество примесей.
На заметку. Температура плавления свинца достаточно низкая и за счет этого олово легко образует сплав с ним. Наиболее популярные и известные обывателю соединения свинца и олова: ПОС 30, ПОС 60 и подобные припои, производимые промышленностью.
Сплавы на основе олова
Включение в сплав того или иного металла напрямую зависит от сферы применения готового продукта.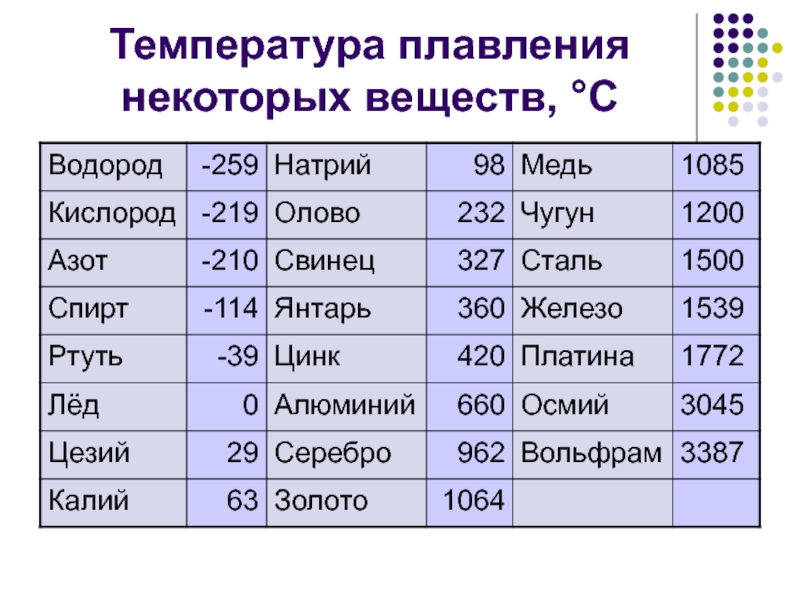 Выделяются две группы:
Выделяются две группы:
- Низкотемпературные. Сюда входят комбинации олова со свинцом, кадмием, цинком, сурьмой. Температура плавления таких сплавов олова — до 300 градусов.
Это мягкий материал, который чаще задействуется в креплениях узлов без динамических нагрузок на отрыв и растяжение.
- Высокотемпературные сплавы олова становятся подвижными после 300, до 600 градусов. Чаще всего это сплавы с долей серебра, меди, цинка. Тугоплавкий материал прочнее и требует более сложной технологии для качественного применения на практике.
На заметку. Для сравнения, чтобы паять мягкими сплавами в бытовых целях достаточно паяльника в 40-80 Вт. Для твердых сплавов потребуется горелка или фен с порогом нагрева 600-700 градусов.
Температура плавления припоев
Важный показатель — температура плавления олова и сплавов для пайки. Таблица поможет производить подбор прутков для проведения работ, требующих определенного порога нагрева.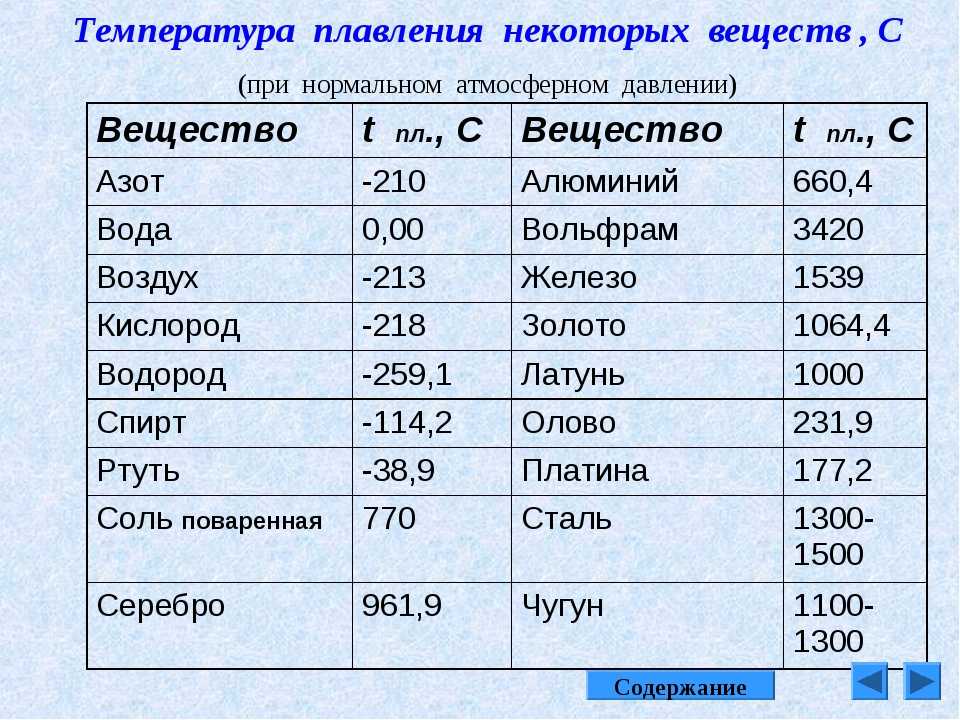 Например, микросхемы и платы майнингового оборудования прослужат значительно дольше, если в производстве применяется подходящий припой.
Например, микросхемы и платы майнингового оборудования прослужат значительно дольше, если в производстве применяется подходящий припой.
Температура плавления припоя указывается в диапазоне:
- Солидус — плавятся легкосплавные составляющие;
- Ликвидус — тугоплавкие добавки.
| Маркировка | t плавления, градусы Цельсия | |
| ПОС90 | 183
| 220 |
| ПОС63 | 238 | |
| ПОС40 | 238 | |
| ПОС30 | 238 | |
| ПОС50 | 222 | |
| ПОС18 | 243 | 277 |
| АВИА-2 | 250 | |
| ПОС25 | 260 | |
| ПОССу-4-6 | 244 | 270 |
| А | 300 | 320 |
| ПОМ3 | 230 | 250 |
| П200А | 220 | 225 |
| ПОСК50-18 | 142 | 145 |
| Сплав Розе | 94 | |
Свойства
Олово — элемент периодической системы с хорошо изученными свойствами.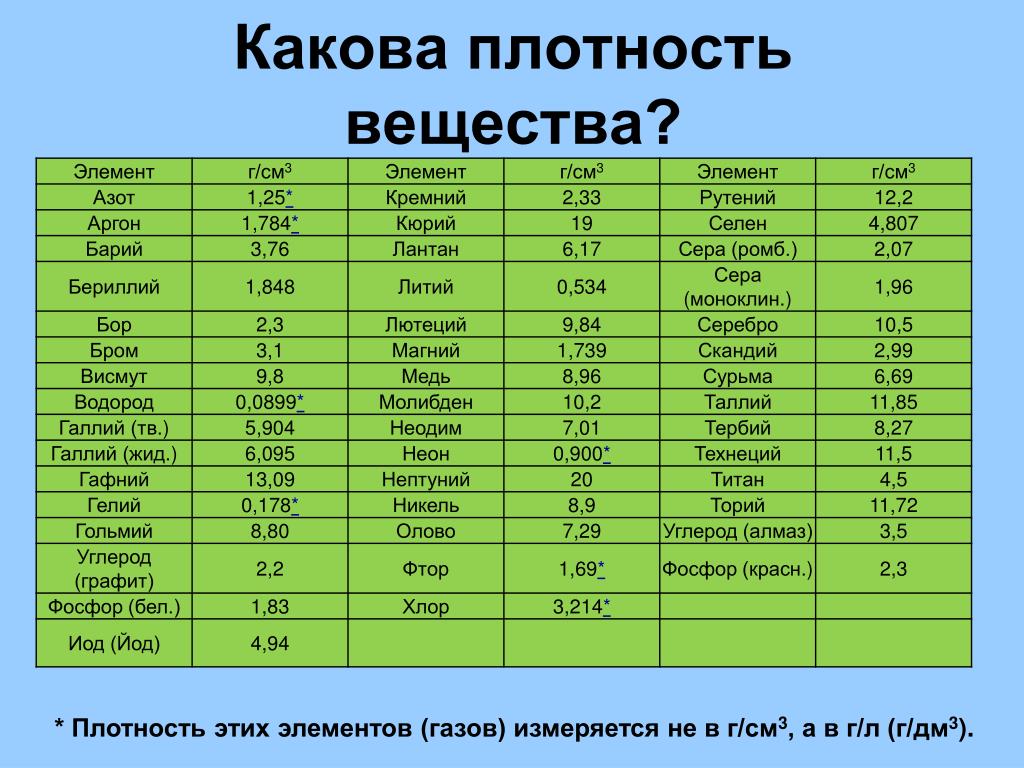 Для правильного применения важно знать все особенности металла.
Для правильного применения важно знать все особенности металла.
Химические
Как представитель группы легких металлов, олово имеет:
- t кипения — 2630 градусов;
- плотность кубометра — 7300 кг.
Материал очень теплоемкий, что позволяет активно передавать тепловую энергию.
Металлическое олово
Нахождение в среде с комнатной температурой делает металл невосприимчивым к воздействию с водой или воздухом. Процессы окисления значительно активизируются при повышении температуры до 150 градусов и выше.
Металл не стойкий к кислотам, реагирует или растворяется, в зависимости от кислоты. Это важно помнить при использовании материала в контакте с агрессивными средами.
Олово II
Полезная статья: Холодная сварка для металла
При нахождении на воздухе активно происходят окислительные процессы. Оксид олова, благодаря хорошей восстановительной способности, задействуется как сырье или исходный продукт для получения иных соединений олова.
Олово IV
Вещество получается за счет процесса окисления в среде кислорода.
Олово с валентностью 4 является основателем большого сегмента оловоорганических производных. Одно из применений — пестициды.
Физические
Отличительные черты олова:
- наличие металлического блеска, непрозрачность;
- серо-белый оттенок;
- характерная ковкость;
- высокая проводимость электричества и теплопроводность.
Серое и белое олово
Две разновидности отличаются физическими свойствами: первое диамагнетик. второе парамагнетик.
Кристаллическая модификация, за счет которой и происходит деление на белое и серое олово, может меняться. При охлаждении белого происходит преобразование кристаллической решетки с изменение в серую форму металла.
Соприкосновение двух видов олова ускоряет изменение кристаллов — белое быстрее преобразуется в серое. Явление получило название «оловяной чумы». Из-за активного изменения кристаллической структуры, происходит разрушение металла. Это является причиной разрушения предметов из данного материала, а так же ряда исторических событий.
Это является причиной разрушения предметов из данного материала, а так же ряда исторических событий.
В трудах историков можно найти упоминания об утраченных оловянных пуговицах на кителях военных в армии Наполеона. Суровая российская зима запустила «оловяную чуму» и оловянный элемент одежды превращался в пыль.
Изотопы
Олово имеет самое большое число стабильных изотопов. Отдельные изотопы применяются в спектроскопии, для гаммо-резонансного анализа.
Оптические
Олово умеренно анизотропично. Не является флуоресцентным веществом и не плеохроирует.
Полезная статья: Разряды сварщиков
Кристаллографические
Олову присущи:
- тетрагональная сингония;
- в пространственной группировке — I 41/amd
- в точечной — 4/mmm.
История и происхождение названия
Первые упоминания о данном металле датируются 4 тысячелетием до нашей эры. В переводе с латиницы станнум — прочный. Название за металлом закрепилось с 4 века н.э. в применении к сплаву металла со свинцом.
Название за металлом закрепилось с 4 века н.э. в применении к сплаву металла со свинцом.
Нахождение в природе
В природе металл представлен в форме руды. В зависимости от месторождения, содержание материала может колебаться в большую и меньшую сторону.
Месторождения
Мировое значение имеют районы добычи олова в Китае и юго-восточной части Азии. Разведанные запасы имеются в Южной Америке, Австралии. Для РФ места залегания оловосодержащих руд — Хабаровский край, Чукотка, Приморье.
Распространенность в природе
Металл распространен в природе за счет своих химических свойств — кислотных и основных. Незначительное содержание наблюдается в незагрязненных водах, концентрация растет в подземных водоемах. Разница и увеличение массовой доли наблюдается в воде, находящейся рядом с месторождениями.
Полезная статья: Сварочная дуга
Формы нахождения
Несмотря на то, что в породе или минеральных соединениях олово имеет рассеянную форму, встречается минеральный формат промышленной концентрации. Данная форма нахождения перспективна для добычи и переработки.
Данная форма нахождения перспективна для добычи и переработки.
Твердая фаза минералы
Один из наглядных примеров — в виде кристаллов касситерита.
Присутствие в минералах-концентраторах сопровождается сопутствием железа, магнетитов, турмалинов. Исследованиями доказана высокая процентная составляющая олова в гранатах — до 5.8% от общего объема минерала.
Собственно минеральные формы
Сюда относятся самородный формат и сплавы, соединения из нескольких металлов со схожими свойствами. При довольно низкой концентрации Sn, подобные образования весьма распространены. С оловом присутствуют: железо, медь, кадмий, титан и другие металлы, в том числе драгоценные.
Коллоидная форма
Данная форма является результатом естественного процесса выпадения в осадок олова при нахождении в гидротермальных растворах. Коллоидные соединения важны в геохимических процессах олова, но находятся в стадии активного изучения ведущими химиками планеты.
Формы нахождения олова в жидкой фазе
Область, которая пока еще в меньшей степени изучена.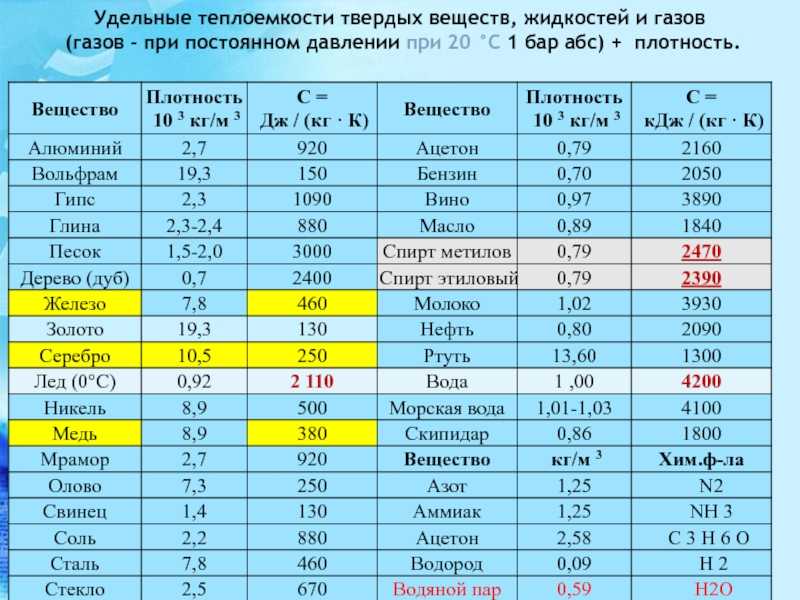 Научное сообщество разделило формы жидкого формата на классы соединений:
Научное сообщество разделило формы жидкого формата на классы соединений:
- Ионных.
- Комплексных.
- Коллоидных.
Так как касситерит является основным «хранилищем» оловянного сырья на месторождениях, все изучения жидкой фазы металла связаны с нахождением форм данного минерала и различии их химических реакций.
Промышленные типы месторождений олова
Ученые поделили месторождения на формации:
- оловоносных и редкометальных гранитов;
- оловоносных пегматитов;
- полевошпат-кварц-касситеритовая;
- кварц-касситеритовая;
- касситерит-силикато-сульфидная;
- касситерит-сульфидная.
Принцип отнесения к формации — геохимические свойства и особенности металла.
Полезная статья: Осциллятор для инвертора
Промышленное получение
Активно применяемые технологии в производстве металла:
- Восстановительная плавка. В технологическом процессе задействуются отражательные печи.
 Температура плавления относительно низкая, олово производится в специальном шахтном оборудовании по методу плавки.
Температура плавления относительно низкая, олово производится в специальном шахтном оборудовании по методу плавки. - Рафинирование. Делится на термический процесс (нагрев) и электролитический — связанный с химическим взаимодействием руды и реагентов.
Металл легко расплавить, что уменьшает энергетические затраты на производство.
Эффекты от воздействия соединений олова
Металл в чистом виде не токсичен и может быть использован в пищевой промышленности. Основную опасность представляют соединения с оловом в виде пара, пыли. Поэтому при работе с припоями и большом количестве паек следует позаботиться о защите органов дыхания.
На здоровье человека
При обычном питании ежесуточно в организм поступает до 3.5 мг металла. Тело также содержит небольшой объем Sn, с наибольшей локализацией материала в кишечнике.
Опасность паров или пыли металла заключается в формировании станноза — болезненное поражение легочной ткани. Соединение олова с водородом — сильное отравляющее вещество.
Доза, при которой человек будет испытывать отравление — 2 г единоразового попадания металла в организм.
На окружающую среду
Сопутствующие металлы и дополнительные вредные элементы при хранении и работе в пределах 600 градусов Цельсия не выделяются в атмосферу. ПДК не превышается и соответствует стандарту ГОСТ 12.1.005-76, для атмосферы величина составляет 0,05 мг на кубометр воздуха.
Полезная статья: Сварочный трансформатор
Сферы применения олова
Температура плавления разных соединений олова с иными металлами позволяет задействовать материал в следующих целях:
- Антикоррозионное покрытие черного металла (лужение).
- Пайка в радиотехнике, электронике, трубопроводах, элементах охлаждения и отопления.
- Спектроскопия.
- Совместно с титаном для производства сплавов.
- Имитация позолоты в форме дисульфида.
- Олово как фольга (станиоль) задействовано в производстве защитных покрытий.
На заметку: Металл является основой изготовления ответственных деталей, например в измерительных приборах.
За счет четкой реакции на температуру изготавливались плавящиеся предохранители, предотвращающие разрушение электрических и электронных систем.
Низкая температура плавления сделала олово востребованным металлом в различных направлениях промышленности. Благодаря различным сплавам с другими металлами были созданы качественные припои, активно применяемые во всех современных отраслях производства.
Да
79.8%
Нет
20.2%
Проголосовало: 203
Задавайте свои вопросы в комментариях, мы поможем Вам найти верный ответ.
Вольфрам имеет самую высокую температуру плавления среди металлов. период…
Вольфрам имеет самую высокую температуру плавления любого металла в период… | Pearson+ ChannelsRecent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 13. Жидкости, твердые тела и межмолекулярные взаимодействия
- Атомные, ионные и молекулярные твердые тела
Задача
Соответствующее решение
1 м
У нас есть вопрос5, который мы здесь рассказываем,
Включи видео:
платина имеет температуру плавления 1000 768 градусов Цельсия при длине связи 277,5 метров PICO в металлической платине? Что произойдет с длиной связи, если платину подвергнуть сильному давлению? Мы ожидаем, что под высоким давлением чистые вещества будут сближаться, поэтому длина связи уменьшится, и это наш окончательный ответ. Спасибо за просмотр. Пока. 9Примеры и задачи Общая химия Chad’s Prep
66views
Types of Solids
DonoChem
172views
Atomic, Ionic and Molecular Solids Concept 9
5 Jules0005
190views
Металлические, ионные, ковалентные и молекулярные твердые тела с примерами!
от Dr. V
387views
Типы твердых тел – молекулярные, ковалентные сети, ионные и металлические
by Mrs. Cash – Chemistry Help and Tutorial Videos
Cash – Chemistry Help and Tutorial Videos
99views
# Курс Crashm3 90:30 от CrashCourse
87просмотров
Ионные твердые тела, молекулярные твердые тела, металлические твердые тела, сетевые ковалентные твердые тела и атомарные твердые тела
от The Organic Chemistry Tutor
113Views
Атомные, ионные и молекулярные твердые тела Пример 1
от Жюля Бруно
147Views
Февраль -точка металла железного и неворнового металла (полная таблица)
07000 февраля. 24, 2023 / Шейн
/ 4 минуты чтения Принцип работы гибки ш…
Пожалуйста, включите JavaScript
Принцип работы гибки листового металла
Какова температура плавления металла?
Какова самая высокая и самая низкая температура плавления металла?
Важной проблемой, о которой следует помнить при обработке металлических материалов, является температура плавления.
Во-первых, давайте посмотрим, что такое температура плавления.
Температура плавления вещества – это температура, при которой твердая и жидкая фазы чистого вещества уравновешиваются при определенном давлении.
То есть при давлении и температуре плавления химический потенциал чистого вещества равен химическому потенциалу жидкости.
Для чисто материальной твердой системы (наносистемы) с большой дисперсией нельзя игнорировать поверхностную часть, и ее химический потенциал является не только функцией температуры и давления, но также связан с размером твердых частиц, который принадлежит термодинамический процесс фазового перехода первого рода.
Проще говоря, только определенная температура плавления может изменить форму металла, таким образом, ковка различных изделий.
Таким образом, мы должны сначала понять температуру плавления различных металлов перед обработкой.
Давайте погрузимся в температуру плавления различных черных и цветных металлов.
No.
Metal Melting Point (℃) Remark Ferrous Metal 1 Iron 1535 Температура плавления стали 1400—1500℃, чугуна 1200℃. 2 Chromium 1890 Pure Metal 3 Manganese 1244 Pure Metal Nonferrous Metal 1 Aluminum 660 Pure Metal 2 Магний 651 Чистый металл 3 Калий 63 Чистый металл 19 289206 Sodium 98 Pure Metal 5 Calcium 815 Pure Metal 6 Strontium 769 Pure Metal 7 Barium 1285 Pure Metal 8 Copper 1083 Pure Metal 9 Lead 328 Pure Metal 10 Zinc 419 Pure Metal 11 Tin 232 Pure Metal 12 Cobalt 1495 Pure Metal 13 Nickel 1453 Pure Metal 14 Antimony 630 Pure Metal 15 Mercury -39 Pure Metal 16 Cadmium 321 Pure Metal 17 Bismuth 271 Pure Metal 18 Gold 1062 Pure Metal 19 Silver 961 Pure Metal 20 Platinum 1774 Pure Metal 21 Ruthenium 231 Pure Metal 22 Palladium 1555 Pure Metal 23 Osmium 3054 Pure Metal 24 Iridium 2454 Pure Metal 25 Bererlilium 1284 Pure MELLAT 26 9067 26 9067 0206 180 Pure Metal 27 Rubidium 39 Pure Metal 28 Cesium 29 Pure Metal 29 Titanium 1675 Pure Metal 30 Цирконий 1852 Pure Metal 31 HAFNIUM 2230 PURE 2230 Pure Metal. 0206
0206 32 Vanadium 1890 Pure Metal 33 Niobium 2468 Pure Metal 34 Tantalum 2996 Pure Metal 35 Tungsten 3410 Pure Metal 36 Molybdenum 2617 Pure Metal 37 PURE 37 Pure 37 37 0206 Gallium 30 Pure Metal 38 Indium 157 Pure Metal 39 Thallium 304 Pure Metal 40 Germanium 937 Pure Metal 41 Rhenium 3180 Pure Metal 42 Lanthanum 921 Pure Metal 43 Cerium 799 Pure Metal 44 Praseodymium 931 Pure Metal 45 Neodymium 1021 Pure Metal 46 SAMARIUM 1072 PURE METAL 47 Europium 822 Pure Metal. 0199
0199 48 Gadolinium 1313 Pure Metal 49 Terbium 1356 Pure Metal 50 Dysprosium 1412 Pure Metal 51 Holmium 1474 Pure Metal 52 Erbium 1529 Pure Metal 53 Thulium 1545 Pure Metal 54 Ytterbium 819 Pure Metal 55 Lutecium 1633 Pure Metal 56 Scandium 1541 Pure Metal 57 Yttrium 1522 Pure Metal 58 Thorium 1750 Чистый металл
В периодической таблице элементов есть два неметаллических материала: кремний и бор, температура плавления которых составляет 1420°C и 2300°C соответственно.
 Cash – Chemistry Help and Tutorial Videos
Cash – Chemistry Help and Tutorial VideosПринцип работы гибки ш…
Пожалуйста, включите JavaScript
Принцип работы гибки листового металла
Какова температура плавления металла?
Какова самая высокая и самая низкая температура плавления металла?
Важной проблемой, о которой следует помнить при обработке металлических материалов, является температура плавления.
Во-первых, давайте посмотрим, что такое температура плавления.
Температура плавления вещества – это температура, при которой твердая и жидкая фазы чистого вещества уравновешиваются при определенном давлении.
То есть при давлении и температуре плавления химический потенциал чистого вещества равен химическому потенциалу жидкости.
Для чисто материальной твердой системы (наносистемы) с большой дисперсией нельзя игнорировать поверхностную часть, и ее химический потенциал является не только функцией температуры и давления, но также связан с размером твердых частиц, который принадлежит термодинамический процесс фазового перехода первого рода.
Проще говоря, только определенная температура плавления может изменить форму металла, таким образом, ковка различных изделий.
Таким образом, мы должны сначала понять температуру плавления различных металлов перед обработкой.
Давайте погрузимся в температуру плавления различных черных и цветных металлов.
No. | Metal | Melting Point (℃) | Remark | ||||
|---|---|---|---|---|---|---|---|
| Ferrous Metal | 1 | Iron | 1535 | Температура плавления стали 1400—1500℃, чугуна 1200℃. | |||
| 2 | Chromium | 1890 | Pure Metal | ||||
| 3 | Manganese | 1244 | Pure Metal | ||||
| Nonferrous Metal | 1 | Aluminum | 660 | Pure Metal | |||
| 2 | Магний | 651 | Чистый металл | ||||
| 3 | Калий | 63 | Чистый металл | 19 289206 | Sodium | 98 | Pure Metal |
| 5 | Calcium | 815 | Pure Metal | ||||
| 6 | Strontium | 769 | Pure Metal | ||||
| 7 | Barium | 1285 | Pure Metal | ||||
| 8 | Copper | 1083 | Pure Metal | ||||
| 9 | Lead | 328 | Pure Metal | ||||
| 10 | Zinc | 419 | Pure Metal | ||||
| 11 | Tin | 232 | Pure Metal | ||||
| 12 | Cobalt | 1495 | Pure Metal | ||||
| 13 | Nickel | 1453 | Pure Metal | ||||
| 14 | Antimony | 630 | Pure Metal | ||||
| 15 | Mercury | -39 | Pure Metal | ||||
| 16 | Cadmium | 321 | Pure Metal | ||||
| 17 | Bismuth | 271 | Pure Metal | ||||
| 18 | Gold | 1062 | Pure Metal | ||||
| 19 | Silver | 961 | Pure Metal | ||||
| 20 | Platinum | 1774 | Pure Metal | ||||
| 21 | Ruthenium | 231 | Pure Metal | ||||
| 22 | Palladium | 1555 | Pure Metal | ||||
| 23 | Osmium | 3054 | Pure Metal | ||||
| 24 | Iridium | 2454 | Pure Metal | ||||
| 25 | Bererlilium | 1284 | Pure MELLAT | ||||
| 26 9067 | |||||||
| 26 9067 | 0206 | 180 | Pure Metal | ||||
| 27 | Rubidium | 39 | Pure Metal | ||||
| 28 | Cesium | 29 | Pure Metal | ||||
| 29 | Titanium | 1675 | Pure Metal | ||||
| 30 | Цирконий | 1852 | Pure Metal | ||||
| 31 | HAFNIUM | 2230 | PURE | 2230 | Pure Metal. 0206 0206 | ||
| 32 | Vanadium | 1890 | Pure Metal | ||||
| 33 | Niobium | 2468 | Pure Metal | ||||
| 34 | Tantalum | 2996 | Pure Metal | ||||
| 35 | Tungsten | 3410 | Pure Metal | ||||
| 36 | Molybdenum | 2617 | Pure Metal | ||||
| 37 | PURE | ||||||
| 37 | Pure | ||||||
| 37 | |||||||
| 37 | |||||||
| 0206 | Gallium | 30 | Pure Metal | ||||
| 38 | Indium | 157 | Pure Metal | ||||
| 39 | Thallium | 304 | Pure Metal | ||||
| 40 | Germanium | 937 | Pure Metal | ||||
| 41 | Rhenium | 3180 | Pure Metal | ||||
| 42 | Lanthanum | 921 | Pure Metal | ||||
| 43 | Cerium | 799 | Pure Metal | ||||
| 44 | Praseodymium | 931 | Pure Metal | ||||
| 45 | Neodymium | 1021 | Pure Metal | ||||
| 46 | SAMARIUM | 1072 | PURE METAL | ||||
| 47 | Europium | 822 | Pure Metal. 0199 0199 | ||||
| 48 | Gadolinium | 1313 | Pure Metal | ||||
| 49 | Terbium | 1356 | Pure Metal | ||||
| 50 | Dysprosium | 1412 | Pure Metal | ||||
| 51 | Holmium | 1474 | Pure Metal | ||||
| 52 | Erbium | 1529 | Pure Metal | ||||
| 53 | Thulium | 1545 | Pure Metal | ||||
| 54 | Ytterbium | 819 | Pure Metal | ||||
| 55 | Lutecium | 1633 | Pure Metal | ||||
| 56 | Scandium | 1541 | Pure Metal | ||||
| 57 | Yttrium | 1522 | Pure Metal | ||||
| 58 | Thorium | 1750 | Чистый металл | ||||
В периодической таблице элементов есть два неметаллических материала: кремний и бор, температура плавления которых составляет 1420°C и 2300°C соответственно.

