Таблица температуры плавления цветных металлов: Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении
alexxlab | 04.02.1970 | 0 | Разное
Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении
| Металл или сплав | tпл. С |
|---|---|
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Германий | 937 |
| Дуралюмин | ~650 |
| Железо | 1539 |
| Золото | 1064?4 |
| Инвар | 1425 |
| Иридий | 2447 |
| Калий | 63,6 |
| Карбиды гафния | 3890 |
| ниобия | 3760 |
| титана | 3150 |
| циркония | 3530 |
| Константин | ~1260 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Нейзильбер | ~1100 |
| Никель | 1455 |
| Нихром | ~1400 |
| Олово | 231,9 |
| Осмий | 3030 |
| Платина | 17772 |
| Ртуть | – 38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Фехраль | ~1460 |
| Цезий | 28,4 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
Вернуться в раздел аналитики
Запись опубликована автором admin в рубрике Полезные материалы. Добавьте в закладки постоянную ссылку.
Добавьте в закладки постоянную ссылку.Температура плавления разных металлов в таблице
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422Со, самая низкая — у ртути: элемент плавится уже при — 39Со. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600Со.
 Это цинк, свинец, виснут, олово.
Это цинк, свинец, виснут, олово. - Среднеплавкие: температура плавления колеблется от 600Со до 1600Со. Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600Со, чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.

- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С
о )| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | — 38,9 Со | 356.73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Таблица среднеплавких металлов и сплавов (от 600С
о до 1600С о )| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со — 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со — 1300 Со | |
Таблица тугоплавких металлов и сплавов (свыше 1600С
о )| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со | ||
| Алюминий (Al) / Aluminum | 660 | 1220 |
| Алюминиевые сплавы / Aluminum Alloy | 463 – 671 | 865 – 1240 |
| Баббит = Babbitt | 249 | 480 |
| Бериллий (Be) = Beryllium | 1285 | 2345 |
| Бронза алюминиевая = Aluminum Bronze | 1027 – 1038 | 1881 – 1900 |
| Бронза бериллиевая, бериллиевая бронза = Beryllium Copper | 865 – 955 | 1587 – 1750 |
| Бронза марганцовистая = Manganese bronze | 865 – 890 | 1590 – 1630 |
| Ванадий (V), Vanadium | 1900 | 3450 |
271. 4 4 |
520.5 | |
| Вольфрам (W), Tungsten | 3400 | 6150 |
| Железо ковкое (Fe) = Carbon Steel | 1482 – 1593 | 2700 – 2900 |
| Золото (Au) чистое 999 пробы 100% золото = Gold 24K Pure | 1063 | 1945 |
| Инконель, жаропрочный никелехромовый сплав = Inconel | 1390 – 1425 | 2540 – 2600 |
| Инколой, жаропрочный никелехромовый сплав = Incoloy | 1390 – 1425 | 2540 – 2600 |
| Иридий (Ir), Iridium | 2450 | 4440 |
| Кадмий (Cd) = Cadmium | 321 | 610 |
| Калий (K) = Potassium | 63.3 | 146 |
| Кобальт (Co) = Cobalt | 1495 | 2723 |
| Кремний (Si) = Silicon | 1411 | 2572 |
| Латунь желтая = Brass, Yellow | 905-932 | 1660-1710 |
| Латунь морская = Морская латунь (29-30% Zn, 70% Cu-1% Sn и 0,02-0,05% As) = Admiralty Brass | 900 – 940 | 1650 – 1720 |
| Латунь красная = Brass, Red | 990 – 1025 | 1810 – 1880 |
| Медь (Cu) = Copper | 1084 | 1983 |
| Мельхиор, купроникель = Cupronickel | 1170 – 1240 | 2140 – 2260 |
| Магний (Mg), Magnesium | 650 | 1200 |
| Магниевые сплавы = Magnesium Alloy | 349 – 649 | 660 – 1200 |
| Марганец (Mn), Manganese | 1244 | 2271 |
| Молибден (Mo), Molybdenum | 2620 | 4750 |
| Монель (до 67 % никеля и до 38 % меди) = Monel | 1300 – 1350 | 2370 – 2460 |
| Натрий (Na) = Sodium | 97. 83 83 |
208 |
| Никель (Ni), Nickel | 1453 | 2647 |
| Ниобий (Nb), Niobium (Columbium) | 2470 | 4473 |
| Олово (Sn), Tin | 232 | 449.4 |
| Осмий (Os), Osmium | 3025 | 5477 |
| Палладий (Pd), Palladium | 1555 | 2831 |
| Платина (Pt),Platinum | 1770 | 3220 |
| Плутоний (Pu), Plutonium | 640 | 1180 |
| Рений (Re), Rhenium | 3186 | 5767 |
| Родий (Rh) = Rhodium | 1965 | 3569 |
| Ртуть (Hg) = Mercury | -38.86 | -37.95 |
| Рутений (Ru) = Ruthenium | 2482 | 4500 |
| Селен (Se) = Selenium | 217 | 423 |
| Cеребро 900 пробы = Coin Silver | 879 | 1615 |
| Серебро (Ar) чистое = Pure Silver | 961 | 1761 |
| Cеребро 925 пробы = Sterling Silver | 893 | 1640 |
| Свинец (Pb), Lead | 327.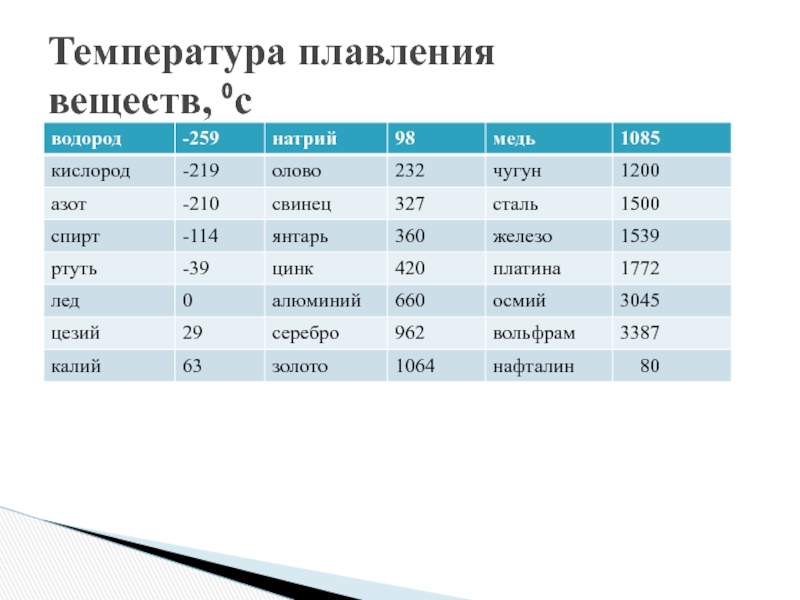 5 5 |
621 |
| Сталь углеродистая = Carbon Steel | 1425 – 1540 | 2600 – 2800 |
| Сталь нержавеющая = Stainless Steel | 1510 | 2750 |
| Сурьма (Sb) = Antimony | 630 | 1170 |
| Тантал (Ta) = Tantalum | 2980 | 5400 |
| Титан (Ti), Titanium | 1670 | 3040 |
| Торий (Th), Thorium | 1750 | 3180 |
| Уран (U), Uranium | 1132 | 2070 |
| Фосфор (P), Phosphorus | 44 | 111 |
| Хастелой С, Hastelloy C (54,5-59,5% Ni; 15-19% Mo; 0,04-0,15% C; 4-7% Fe; 13-16% Cr; 3,5-5,5% W) | 1320 – 1350 | 2410 – 2460 |
| Хром (Cr) = Chromium | 1860 | 3380 |
| Цинк (Zn), Zinc | 419. 5 5 |
787 |
| Цирконий (Zr), Zirconium | 1854 | 3369 |
| Чугун серый = Grey Cast Iron | 1127 – 1204 | 2060 – 2200 |
| Чугун Ковкий, Ductile Iron | 1149 | 2100 |
Температура кипения и плавления металлов, температура плавления стали
Температура кипения и плавления металлов
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы:
гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С.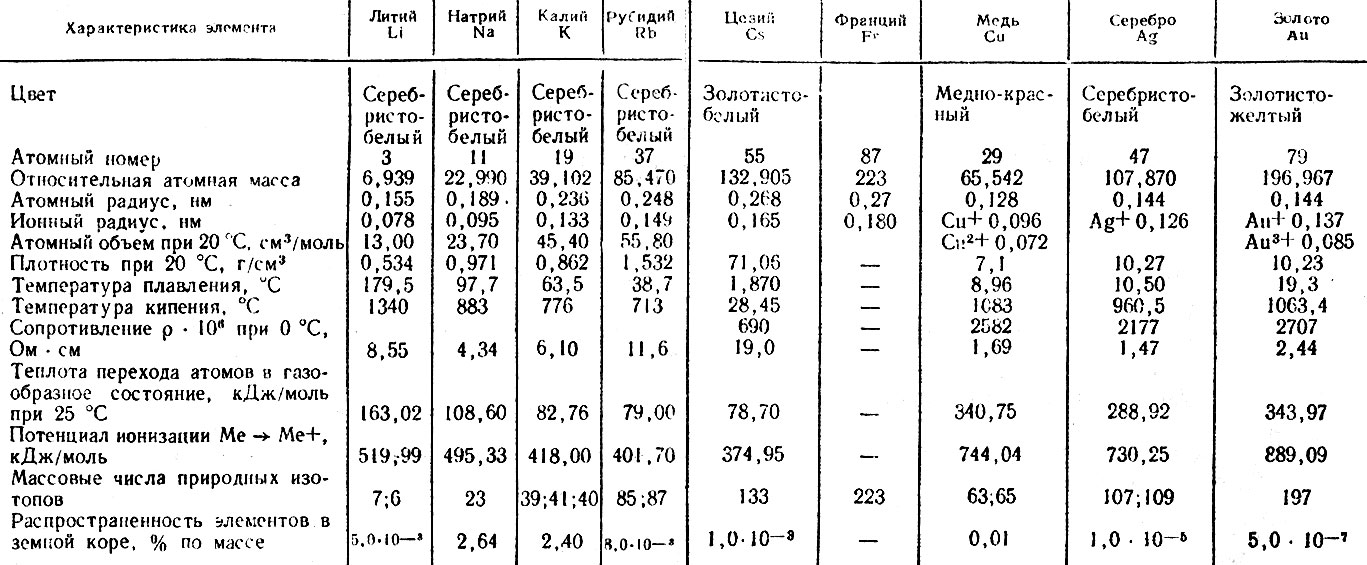 Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
Источники:
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
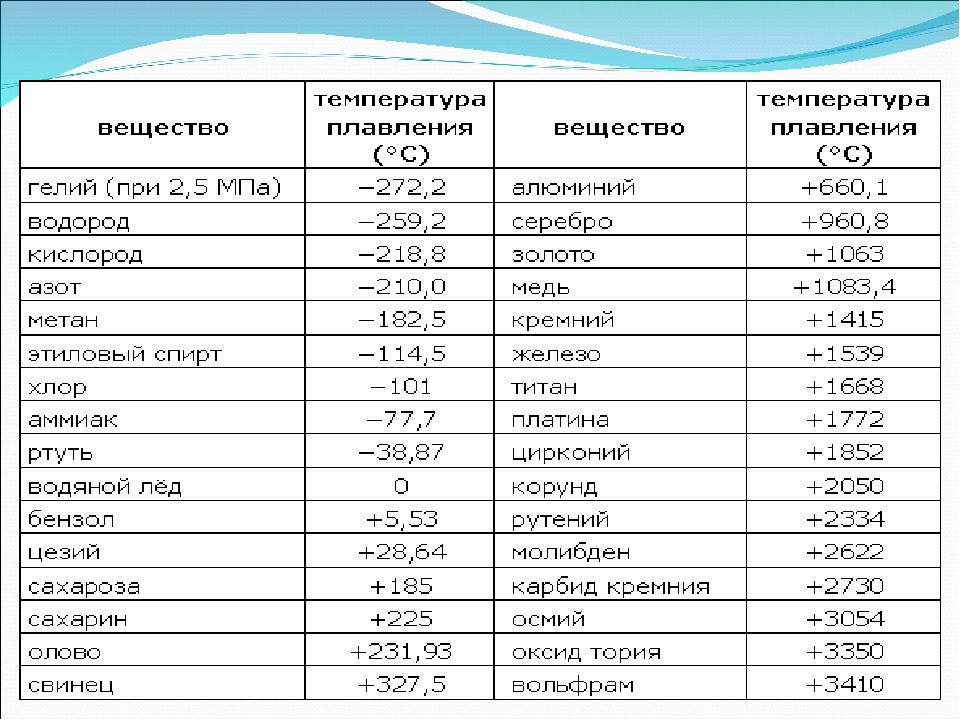
Температура плавления цветных металлов и сплавов таблица
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса.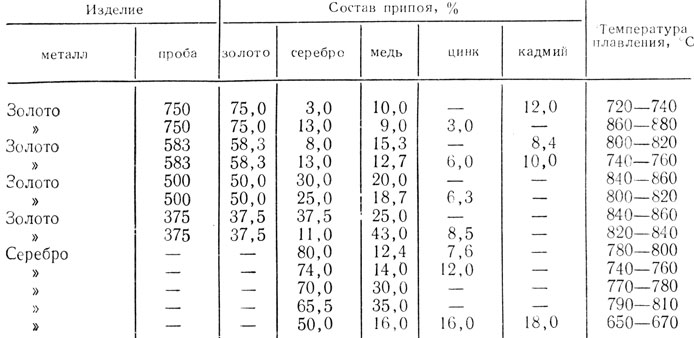 Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.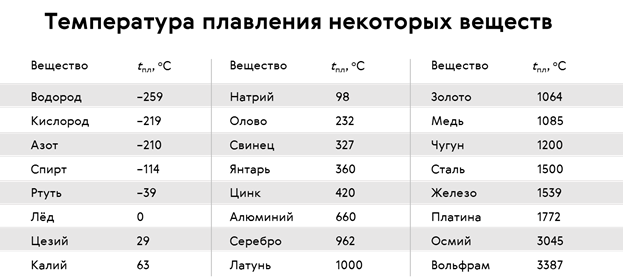
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.

- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
|---|---|
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| Чугун | 1110−1400 |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.

- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
|---|---|
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также плотность металлов в твердом состоянии при 20 °С и плотности жидких металлов при температуре плавления приведены в таблице плавки цветных металлов.
Таблица 1. Плавки цветных металлов
твердого при 20 °С
Сварка и плавка цветных металлов
Сварка меди. Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Наиболее распространенное газовое сварки меди ацетиленокисневим пламенем с помощью горелок, которые в 1,5…2 раза мощнее горелки для сварки сталей. Присадочным металлом есть медные прутки, содержащие фосфор и кремний. Если толщина изделий более 5…6 мм, их сначала подогревают до температуры 250…300°С. Флюсами при сварке является прожаренная бура или смесь, состоящую из 70% буры и 30% борной кислоты. Чтобы повысить механические свойства и улучшить структуру наплавленного металла, медь после сварки проковывают при температуре около 200…300°С. Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Сварка латуни. Латунь – это сплав меди с цинком (до 50%). Основное загрязнение при этом – испарение цинка, в итоге чего шов теряет свои качества, в нем возникают поры. Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, при котором на поверхности ванны создается пленка тугоплавкого оксида цинка, уменьшающая дальнейшее выгорание и испарение цинка. Флюсы используют такие же, как и при сварке меди. Они создают на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь сваривают также в защитных газах и на контактных машинах.
Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, при котором на поверхности ванны создается пленка тугоплавкого оксида цинка, уменьшающая дальнейшее выгорание и испарение цинка. Флюсы используют такие же, как и при сварке меди. Они создают на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь сваривают также в защитных газах и на контактных машинах.
Сварка бронзы. В большинстве случаев бронза – это литейный материал, поэтому
сварку применяют при исправлении дефектов или во время ремонта. Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
Сварка алюминия. Основными факторами, затрудняющими сварку алюминия, является низкая температура его плавления (658°С), большая теплопроводность (примерно в 3 раза выше теплопроводности стали), образование тугоплавких оксидов алюминия, которые имеют температуру плавления 2050°С, поэтому технология плавки цветных металлов, таких как медь или бронза, не подходит для плавки алюминия. Кроме того, эти оксиды слабо реагируют как с кислыми, так и основными флюсами, поэтому плохо удаляются из шва.
Кроме того, эти оксиды слабо реагируют как с кислыми, так и основными флюсами, поэтому плохо удаляются из шва.
Чаще всего используют газовую сварку алюминия ацетиленовым пламенем. В последние годы значительно распространилось также автоматическая дуговая сварка металлическими электродами под флюсом и в среде аргона. При всех способах сварки, кроме аргонодуговой, применяют флюсы или электродные покрытия, в состав которых входят фтористые и хлористые соединения лития, калия, натрия и других элементов. Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Алюминий хорошо сваривается электронным лучом в вакууме, на контактных машинах, электрошлаковым и другими способами.
Сварка сплавов алюминия. Сплавы алюминия с магнием и цинком сваривают без
особых осложнений, так же как и алюминий. Исключением является дюралюминий – сплавы алюминия с медью. Эти сплавы термически упрочняются после закалки и следующего старения.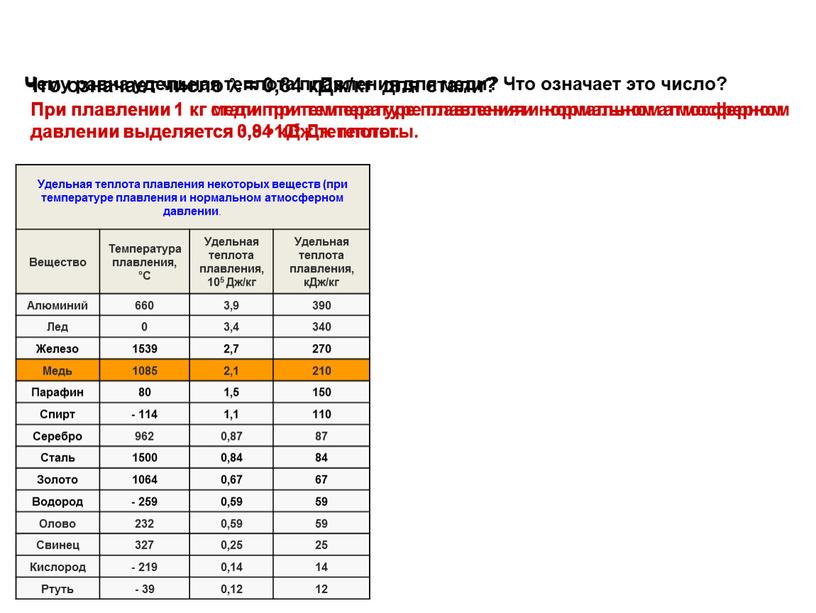 Когда температура плавки цветных металлов свыше 350°С в них происходит снижение прочности, которое не восстанавливается термической обработкой. Поэтому при сварке дюралюминия в зоне термического влияния прочность уменьшается на 40…50%. Если дюралюминий сваривать в защитных газах, то такое снижение может быть восстановлено термической обработкой до 80…90% по отношению к прочности основного металла.
Когда температура плавки цветных металлов свыше 350°С в них происходит снижение прочности, которое не восстанавливается термической обработкой. Поэтому при сварке дюралюминия в зоне термического влияния прочность уменьшается на 40…50%. Если дюралюминий сваривать в защитных газах, то такое снижение может быть восстановлено термической обработкой до 80…90% по отношению к прочности основного металла.
Сварка магниевых сплавов. При газовой сварке обязательно применяют фторидные флюсы, которые в отличие от хлоридных не вызывают коррозии сварных соединений. Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Таблица 2. Физические свойства промышленных цветных металлов
Физические свойства промышленных цветных металлов
Температура плавления железа таблица
Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также плотность металлов в твердом состоянии при 20 °С и плотности жидких металлов при температуре плавления приведены в таблице плавки цветных металлов.
Таблица 1. Плавки цветных металлов
твердого при 20 °С
Сварка меди. Температура плавки металла Cu, почти в шесть раз превышает температуру плавки стали, медь интенсивно поглощает и растворяет различные газы, образуя с кислородом оксиды. Оксид меди II с медью образует эвтектику, температура плавления которой (1064°С) ниже температуры плавления меди (1083°С). При затвердевании жидкой меди эвтектика располагается по границам зерен, делает медь хрупкой и склонной к образованию трещин. Поэтому основной задачей при сварке меди является защита его от окисления и активное раскисление сварочной ванны.
Наиболее распространенное газовое сварки меди ацетиленокисневим пламенем с помощью горелок, которые в 1,5…2 раза мощнее горелки для сварки сталей. Присадочным металлом есть медные прутки, содержащие фосфор и кремний. Если толщина изделий более 5…6 мм, их сначала подогревают до температуры 250…300°С. Флюсами при сварке является прожаренная бура или смесь, состоящую из 70% буры и 30% борной кислоты. Чтобы повысить механические свойства и улучшить структуру наплавленного металла, медь после сварки проковывают при температуре около 200…300°С. Потом ее снова нагревают до 500-550°С и охлаждают в воде. Медь сваривают также электродуговым способом электродами, в струе защитных газов, под слоем флюса, на конденсаторных машинах, способом трения.
Сварка латуни. Латунь – это сплав меди с цинком (до 50%). Основное загрязнение при этом – испарение цинка, в итоге чего шов теряет свои качества, в нем возникают поры. Латунь, как и медь, в основном сваривают ацетиленовым окислительным пламенем, при котором на поверхности ванны создается пленка тугоплавкого оксида цинка, уменьшающая дальнейшее выгорание и испарение цинка. Флюсы используют такие же, как и при сварке меди. Они создают на поверхности ванны шлаки, которые связывают оксиды цинка и затрудняют выход паров из сварочной ванны. Латунь сваривают также в защитных газах и на контактных машинах.
Сварка бронзы. В большинстве случаев бронза – это литейный материал, поэтому
сварку применяют при исправлении дефектов или во время ремонта. Чаще всего применяют сварку металлическим электродом. Присадочным металлом является прутки того самого состава, что и основной металл, а флюсами или электродным покрытием – хлористые и фтористые соединения калия и натрия.
Сварка алюминия. Основными факторами, затрудняющими сварку алюминия, является низкая температура его плавления (658°С), большая теплопроводность (примерно в 3 раза выше теплопроводности стали), образование тугоплавких оксидов алюминия, которые имеют температуру плавления 2050°С, поэтому технология плавки цветных металлов, таких как медь или бронза, не подходит для плавки алюминия. Кроме того, эти оксиды слабо реагируют как с кислыми, так и основными флюсами, поэтому плохо удаляются из шва.
Чаще всего используют газовую сварку алюминия ацетиленовым пламенем. В последние годы значительно распространилось также автоматическая дуговая сварка металлическими электродами под флюсом и в среде аргона. При всех способах сварки, кроме аргонодуговой, применяют флюсы или электродные покрытия, в состав которых входят фтористые и хлористые соединения лития, калия, натрия и других элементов. Как присадочный металл при всех способах сварки используют проволоку или стержни того же состава, что и основной металл.
Алюминий хорошо сваривается электронным лучом в вакууме, на контактных машинах, электрошлаковым и другими способами.
Сварка сплавов алюминия. Сплавы алюминия с магнием и цинком сваривают без
особых осложнений, так же как и алюминий. Исключением является дюралюминий – сплавы алюминия с медью. Эти сплавы термически упрочняются после закалки и следующего старения. Когда температура плавки цветных металлов свыше 350°С в них происходит снижение прочности, которое не восстанавливается термической обработкой. Поэтому при сварке дюралюминия в зоне термического влияния прочность уменьшается на 40…50%. Если дюралюминий сваривать в защитных газах, то такое снижение может быть восстановлено термической обработкой до 80…90% по отношению к прочности основного металла.
Сварка магниевых сплавов. При газовой сварке обязательно применяют фторидные флюсы, которые в отличие от хлоридных не вызывают коррозии сварных соединений. Дуговая сварка магниевых сплавов металлическими электродами через низкое качество сварных швов до настоящего времени не применяется. При сварке магниевых сплавов наблюдается значительный рост зерна в около шовных участках и сильное развитие столбчатых кристаллов в сварном шве. Поэтому предел прочности сварных соединений составляет 55…60% предела прочности основного металла.
Таблица 2. Физические свойства промышленных цветных металлов
| 1.3 Основные физические свойства железа |
Температура плавления химически чистого железа составляет 1539 о С. Технически чистое железо, полученное в результате окислительного рафинирования, содержит некоторое количество растворенного в металле кислорода. По этой причине температура его плавления понижается до 1530 о С.
Температура плавления стали всегда ниже температуры плавления железа в связи с наличием в ней примесей. Растворенные в железе металлы (Mn, Cr, Ni. Co, Mo, V и др.) понижают температуру плавления металла на 1 – 3 о С на 1% введенного элемента, а элементы из группы металлоидов (C, O, S, P и др.) на 30 – 80 о С.
На протяжении большей части общей продолжительности плавки температура плавления металла изменяется главным образом в результате изменения содержания углерода. При концентрации углерода 0,1 – 1,2%, которая характерна для доводки плавки в сталеплавильных агрегатах, температуру плавления металла с достаточной для практических целей точностью можно оценить из уравнения
Теплота плавления железа составляет 15200 Дж/моль или 271,7 кДж/кг.
Температура кипения железа в изданиях последних лет приводится равной 2735 о С. Однако, опубликованы результаты исследований, согласно которым температура кипения железа значительно выше (до 3230 о С).
Теплота испарения железа составляет 352,5 кДж/моль или 6300 кДж/кг.
Давление насыщенного пара железа (PFe, Па) можно оценить при помощи уравнения
где Т – температура металла, К.
Результаты расчета давления насыщенного пара железа при различных температурах, а также содержания пыли в окислительной газовой фазе над металлом (X, г/м 3 ) представлены в таблице 1.1.
Таблица 1.1 – Давление насыщенного пара железа и запыленность газов при разных температурах
Согласно существующим санитарным нормам содержание пыли в газах, которые выбрасываются в атмосферу, не должно превышать 0,1 г/м 3 . Из данных таблицы 1.1 видно, что при 1600 о С запыленность газов над открытой поверхностью металла выше допустимых значений. Поэтому обязательно требуется очистка газов от пыли, состоящей в основном из оксидов железа.
Динамическая вязкость. Коэффициент динамической вязкости жидкости () определяется из соотношения
где F – сила взаимодействия двух движущихся слоев, Н;
S – площадь соприкосновения слоев, м 2 ;
– градиент скорости слоев жидкости по нормали к направлению потока, с -1 .
Динамическая вязкость сплавов железа обычно изменяется в пределах 0,001 – 0,005 Па•с. Ее величина зависит от температуры и содержания примесей, главным образом углерода. При перегреве металла над температурой плавления выше 25 – 30 о С влияние температуры не существенно.
Кинематическая вязкость жидкости представляет собой скорость передачи импульса в потоке единичной массы. Ее величина определяется из уравнения
где – плотность жидкости, кг/м 3 .
Величина динамической вязкости жидкого железа близка к 6•10 -7 м 2 /с.
Плотность железа при 1550 – 1650 о С равна 6700 – 6800 кг/м 3 . При температуре кристаллизации плотность жидкого металла близка к 6850 кг/м 3 . Плотность твердого железа при температуре кристаллизации равна 7450 кг/м 3 , при комнатной температуре – 7800 кг/м 3 .
Из обычных примесей наибольшее влияние на плотность расплавов железа оказывают углерод и кремний, понижая ее. Поэтому обычного состава жидкий чугун имеет плотность 6200 – 6400 кг/м 3 , твердый при комнатной температуре – 7000 – 7200 кг/м 3 .
Плотность жидкой и твердой стали занимает промежуточное положение между плотностями железа и чугуна и составляет соответственно 6500 – 6600 и 7500 – 7600 кг/м 3 .
Удельная теплоемкость жидкого металла практически не зависит от температуры. В оценочных расчетах величину ее можно принимать равной 0,88 кДж/(кг•К) для чугуна и 0,84 кДж/(кг•К) для стали.
Поверхностное натяжение железа имеет максимальное значение при температуре около 1550 о С. В области более высоких и низких температур величина его уменьшается. Это отличает железо от большинства металлов, для которых характерно понижение поверхностного натяжения при повышении температуры.
Поверхностное натяжение жидких сплавов железа существенно меняется в зависимости от химического состава и температуры. Обычно оно изменяется в пределах 1000 – 1800 мДж/м 2 (рисунок 1.1).
Рисунок 1.1 – Влияние примесей на величину поверхностного натяжения сплавов железа
Растворимость. Весьма ограниченную растворимость в жидком и твердом железе имеют щелочные (Li, Na, K, Rb, Cs) и щелочноземельные (Mg, Ca, Ba, Sr) металлы. Кроме того практически нерастворимыми являются Ag, Cd и Bi.
К числу металлов, имеющих неограниченную растворимость в железе, относятся Mn, Ni, Co, Cu, Al, Sb, Ce и все редкоземельные металлы.
Ограниченной растворимостью в железе обладают Cr, V, Mo, W, Ti, Zr, Pb, Sn, Pt и др. Но при высоких температурах все металлы этой группы, кроме Pb и Sn, растворяются в расплавах железа в неограниченных количествах.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути – она плавится даже при -39 °C, самая высокая у вольфрама – 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой – плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие – до 600 °C: свинец, цинк, олово;
- среднеплавкие – от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие – от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина – градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы – непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий – 660 °C;
- температура плавления меди – 1083 °C;
- температура плавления золота – 1063 °C;
- серебро – 960 °C;
- олово – 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец – 327 °C;
- температура плавления железо – 1539 °C;
- температура плавления стали (сплав железа и углерода) – от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) – от 1100 °C до 1300 °C;
- ртуть – -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл – ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия – 2519 °C , у железа – 2900 °C, у меди – 2580 °C, у ртути – 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов – у рения – 5596 °C . Наибольшая температура кипения – у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым – осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа – очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах – это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл – серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла – температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .
- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .
- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия – вольфрам, титан, хром и др.
- – единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.
Таблица температур плавления металлов и сплавов
| Металл | |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др. Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Не стоит путать понятия “температура плавления металла” и “температура кипения металла” – для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях , разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
| Сурьма | Sb | 630 С | 1587 С |
| Плутоний | Pu | 640 С | 3228 С |
| Нептуний | Np | 644 С | 3901,85 С |
| Магний | Mg | 650 С | 1100 С |
| Дуралюмин | Сплав алюминия (основа) с медью (Cu: 2,2-5,2%), магнием (Mg: 0,2-2,7%) марганцем (Mn: 0,2-1%). | 650 С | |
| Алюминий | Al | 660 С | 2519 С |
| Радий | Ra | 700 С | 1736,85 С |
| Барий | Ba | 727 С | 1897 С |
| Стронций | Sr | 777 С | 1382 С |
| Кальций | Ca | 842 С | 1484 С |
| Германий | Ge | 937 С | 2830 С |
| Серебро | Ag | 960 С | 2180 С |
| Латунь | Сплав меди и цинка | 1000 С | |
| Актиний | Ac | 1051 С | 3198 С |
| Золото | Au | 1063 С | 2660 С |
| Медь | Cu | 1083 С | 2580 С |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 С | |
| Чугун | Сплав железа и углерода | 1100 С – 1300 С | |
| Уран | U | 1135 С | 4131 С |
| Марганец | Mn | 1246 С | 2061 С |
| Константин | 1260 С | ||
| Бериллий | Be | 1287 С | 2471 С |
| Сталь | Сплав железа и углерода | 1300 С – 1500 С | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 С | |
| Кремний | Si | 1415 С | 2350 С |
| Инвар | Сплав никеля и железа | 1425 С | |
| Никель | Ni | 1455 С | 2913 С |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 С | |
| Кобальт | Co | 1495 С | 2927 С |
| Железо | Fe | 1539 С | 2900 С |
| Протактиний | Pa | 1572 С | 4027 С |
Точка плавления черных и цветных металлов (Полная таблица)
Какова точка плавления металла? Какая самая высокая и самая низкая температура плавления металла? Важной проблемой, о которой следует помнить при обработке металлических материалов, является температура плавления.
Во-первых, давайте посмотрим, что такое температура плавления.
Точка плавления вещества – это температура, при которой твердая и жидкая фазы чистого вещества уравновешиваются при определенном давлении, то есть при давлении и температуре точки плавления химический потенциал чистого вещества равен химический потенциал жидкости.
Для твердой системы из чистого материала (наносистемы) с большой дисперсией нельзя игнорировать поверхностную часть, и ее химический потенциал зависит не только от температуры и давления, но также зависит от размера твердых частиц, который относится к термодинамический процесс фазового перехода первого рода.
Проще говоря, только определенная температура плавления может изменить форму металла, в результате чего будут выкованы разные изделия.
Следовательно, мы должны сначала понять температуру плавления различных металлов перед обработкой.
Давайте погрузимся в температуру плавления различных черных и цветных металлов.
| № | Металл | Точка плавления (℃) | Примечание | |
|---|---|---|---|---|
| Черный металл | 1 | Утюг | 1535 | Температура плавления стали 1400–1500 ℃ и 1200 ℃ чугуна. |
| 2 | Хром | 1890 | Чистый металл | |
| 3 | Марганец | 1244 | Чистый металл | |
| Цветные металлы | 1 | Алюминий | 660 | Чистый металл |
| 2 | Магний | 651 | Чистый металл | |
| 3 | Калий | 63 | Чистый металл | |
| 4 | Натрий | 98 | Чистый металл | |
| 5 | Кальций | 815 | Чистый металл | |
| 6 | Стронций | 769 | Чистый металл | |
| 7 | Барий | 1285 | Чистый металл | |
| 8 | Медь | 1083 | Чистый металл | |
| 9 | Свинец | 328 | Чистый металл | |
| 10 | Цинк | 419 | Чистый металл | |
| 11 | Олово | 232 | Чистый металл | |
| 12 | Кобальт | 1495 | Чистый металл | |
| 13 | Никель | 1453 | Чистый металл | |
| 14 | Сурьма | 630 | Чистый металл | |
| 15 | Меркурий | -39 | Чистый металл | |
| 16 | Кадмий | 321 | Чистый металл | |
| 17 | висмут | 271 | Чистый металл | |
| 18 | Золото | 1062 | Чистый металл | |
| 19 | Серебро | 961 | Чистый металл | |
| 20 | Платина | 1774 | Чистый металл | |
| 21 | Рутений | 231 | Чистый металл | |
| 22 | Палладий | 1555 | Чистый металл | |
| 23 | Осмий | 3054 | Чистый металл | |
| 24 | Иридий | 2454 | Чистый металл | |
| 25 | Бериллий | 1284 | Чистый металл | |
| 26 | Литий | 180 | Чистый металл | |
| 27 | Рубидий | 39 | Чистый металл | |
| 28 | Цезий | 29 | Чистый металл | |
| 29 | Титан | 1675 | Чистый металл | |
| 30 | Цирконий | 1852 | Чистый металл | |
| 31 | Гафний | 2230 | Чистый металл | |
| 32 | Ванадий | 1890 | Чистый металл | |
| 33 | Ниобий | 2468 | Чистый металл | |
| 34 | Тантал | 2996 | Чистый металл | |
| 35 | Вольфрам | 3410 | Чистый металл | |
| 36 | Молибден | 2617 | Чистый металл | |
| 37 | Галлий | 30 | Чистый металл | |
| 38 | Индий | 157 | Чистый металл | |
| 39 | Таллий | 304 | Чистый металл | |
| 40 | Германий | 937 | Чистый металл | |
| 41 | Рений | 3180 | Чистый металл | |
| 42 | Лантан | 921 | Чистый металл | |
| 43 | Церий | 799 | Чистый металл | |
| 44 | празеодим | 931 | Чистый металл | |
| 45 | Неодим | 1021 | Чистый металл | |
| 46 | Самарий | 1072 | Чистый металл | |
| 47 | Европий | 822 | Чистый металл | |
| 48 | Гадолиний | 1313 | Чистый металл | |
| 49 | Тербий | 1356 | Чистый металл | |
| 50 | Диспрозий | 1412 | Чистый металл | |
| 51 | Гольмий | 1474 | Чистый металл | |
| 52 | Эрбий | 1529 | Чистый металл | |
| 53 | Тулий | 1545 | Чистый металл | |
| 54 | Иттербий | 819 | Чистый металл | |
| 55 | Лютеций | 1633 | Чистый металл | |
| 56 | Скандий | 1541 | Чистый металл | |
| 57 | Иттрий | 1522 | Чистый металл | |
| 58 | торий | 1750 | Чистый металл |
В Периодической таблице элементов есть два неметаллических материала, которые представляют собой кремний и бор, и их температура плавления составляет 1420 ° C и 2300 ° C соответственно.
Какая самая высокая и самая низкая точка плавления? Из таблицы мы смогли ясно понять температуру плавления различных металлов. Что касается металла с самой высокой и самой низкой точкой плавления, я также дам вам краткое введение.
Есть металл серебристо-белого цвета, называемый цезием. Он был найден в 1860 году. За исключением ртути, он имеет самую низкую температуру плавления – 29 ° C.
Среди всех чистых металлов вольфрам имеет самую высокую температуру плавления.
В 1783 году два испанца обнаружили, что температура плавления вольфрама составляет 3417 ± 10 ° C.
Наиболее устойчивы к высоким температурам карбиды ниобия (TG 0,88) и карбиды ниобия (HfG 0,95). Температуры плавления двух материалов составляли 4010 ± 75 ° C и 3960 ± 20 ° C соответственно.
Металлы и сплавы – температуры плавления
Точка плавления – это температура, при которой вещество переходит из твердого состояния в жидкое.
Точки плавления для некоторых металлов и сплавов:
| Металл | Точка плавления ( o C) | ||
|---|---|---|---|
| Адмиралтейство Латунь | 900 – 940 | ||
| Алюминий | 660|||
| Алюминиевый сплав | 463-671 | ||
| Алюминий бронза | 1027-1038 | ||
| Сурьма | 630 | ||
| Баббит | 249 | ||
| Бериллий | 122085 900 | Бериллий Медь | 865-955 |
| Висмут | 271.4 | ||
| Латунь, красный | 1000 | ||
| Латунь, желтый | 930 | ||
| Кадмий | 321 | ||
| Хром | 1860 | ||
| Кобальт | 1495 | ||
| Медь | 1084 | ||
| Купроникель | 1170-1240 | ||
| Золото, 24K чистое | 1063 | ||
| Hastelloy C | 1320-1350 | ||
| Инконель | 1390-1425 | ||
| Инкол | 1390 – 1425 | ||
| Иридий | 2450 | ||
| Кованое железо | 1482 – 1593 | ||
| Железо, серое литье | 1127 – 1204 | ||
| Железо, ковкое | 1149 | ||
| Свинец | 327.5 | ||
| Магний | 650 | ||
| Магниевый сплав | 349-649 | ||
| Марганец | 1244 | ||
| Марганцевая бронза | 865-890 | ||
| Ртуть | -38,86 | ||
| Молибден | 2620 | ||
| Монель | 1300-1350 | ||
| Никель | 1453 | ||
| Ниобий (колумбий) | 2470 | ||
| Осмий | 3025 | ||
| Осмий | 3025 | Палладий | Паллий 900 1555 |
| Фосфор | 44 | ||
| Платина | 1770 | ||
| Плутоний | 640 | ||
| Калий | 63.3 | ||
| Красная латунь | 990-1025 | ||
| Рений | 3186 | ||
| Родий | 1965 | ||
| Рутений | 2482 | ||
| Селен | 217 | 217 | Селен1411 |
| Серебро, монета | 879 | ||
| Серебро, чистое | 961 | ||
| Серебро, стерлинговое | 893 | ||
| Натрий | 97.83 | ||
| Припой 50-50 | 215 | ||
| Сталь углеродистая | 1425-1540 | ||
| Сталь нержавеющая | 1510 | ||
| Тантал | 2980 | ||
| Торий | 1750 | ||
| Олово | 232 | ||
| Титан | 1670 | ||
| Вольфрам | 3400 | ||
| Уран | 1132 | ||
| Ванадий | 1900 | ||
| Желтая латунь | 932|||
| Цинк | 419.5 | ||
| Цирконий | 1854 |
Золото, серебро и медь – давление и температура плавления
Точки плавления металлов | Металл Супермаркеты
Металлы известны своей способностью противостоять экстремальным условиям. Тяжелые нагрузки, непрерывная езда на велосипеде, сильные удары, едкая среда и даже высокие температуры. Печи, двигатели внутреннего сгорания, реактивные двигатели, форсунки зажигания, высокоскоростное оборудование и выхлопные системы постоянно подвергаются воздействию температур, которые могут вызвать плавление некоторых типов металлов.При выборе металла для высокотемпературного применения необходимо оценить несколько различных температурных точек, и одна из наиболее важных температур, которую необходимо знать, – это температура плавления металла.
Что такое температура плавления металлов?
Температура плавления металла, более известная с научной точки зрения как точка плавления, – это температура, при которой металл начинает переходить из твердой фазы в жидкую. При температуре плавления твердая фаза и жидкая фаза металла находятся в равновесии.Как только эта температура будет достигнута, к металлу можно будет непрерывно подводить тепло, однако это не приведет к повышению общей температуры. Как только металл полностью перейдет в жидкую фазу, дополнительное тепло снова продолжит повышать температуру металла.
Почему важна температура плавления металла?
Есть много важных температур, которых достигает металл при нагревании в процессе обработки металла или в результате нанесения, но температура плавления металла является одной из самых важных.
Одна из причин, по которой температура плавления так важна, заключается в отказе компонентов, который может произойти, когда металл достигнет своей температуры плавления. Разрушение металла может произойти до точки плавления, но когда металл достигает температуры плавления и начинает становиться жидкостью, он больше не будет служить своему назначению. Например, если компонент печи начинает плавиться, печь больше не будет работать, если этот компонент достаточно важен. Если топливная форсунка реактивного двигателя расплавится, отверстия засорятся, и двигатель станет бесполезным.Важно отметить, что другие типы разрушения металла, такие как трещины, вызванные ползучестью, могут произойти задолго до достижения температуры плавления, и необходимо заранее изучить влияние различных температур, которым будет подвергаться металл.
Другая причина того, почему температура плавления металла так важна, заключается в том, что металлы наиболее пластичны, когда они находятся в жидком состоянии. Металлы нагреваются до температуры плавления для многих различных производственных процессов. Плавка, сварка плавлением и литье требуют, чтобы металлы были жидкими.При выполнении производственного процесса, в котором металл будет плавиться, важно знать температуру, при которой это произойдет, чтобы можно было выбрать подходящие материалы для используемого оборудования. Например, сварочная горелка должна выдерживать внешнее тепло от электрической дуги и расплавленного металла. Оборудование для литья, такое как штампы, должно иметь более высокую температуру плавления, чем отливаемый металл.
Температуры плавления обычных металлов
Это температуры плавления обычных металлов:
- Алюминий: 660 ° C (1220 ° F)
- Латунь: 930 ° C (1710 ° F)
- Алюминиевая бронза *: 1027-1038 ° C (1881-1900 ° F)
- Хром: 1860 ° C (3380 ° F)
- Медь: 1084 ° C (1983 ° F)
- Золото: 1063 ° C (1945 ° F)
- Инконель *: 1390-1425 ° C (2540-2600 ° F)
- Чугун: 1204 ° C (2200 ° F)
- Свинец: 328 ° C (622 ° F)
- Молибден: 2620 ° C (4748 ° F)
- Никель: 1453 ° C (2647 ° F)
- Платина: 1770 ° C (3218 ° F)
- Серебро: 961 ° C (1762 ° F)
- Углеродистая сталь *: 1425-1540 ° C (2597-2800 ° F)
- Нержавеющая сталь *: 1375-1530 ° C (2500-2785 ° F)
- Титан: 1670 ° C (3038 ° F)
- Вольфрам: 3400 ° C (6152 ° F)
- Цинк: 420 ° C (787 ° F)
* Сплавы содержат более одного элемента, поэтому их температура плавления – это диапазон, который зависит от состава сплава.
Metal Supermarkets – крупнейший в мире поставщик мелкосерийного металла с более чем 90 обычными магазинами в США, Канаде и Великобритании. Мы эксперты по металлу и обеспечиваем качественное обслуживание клиентов и продукцию с 1985 года.
В Metal Supermarkets мы поставляем широкий ассортимент металлов для различных областей применения. В нашем ассортименте: нержавеющая сталь, легированная сталь, оцинкованная сталь, инструментальная сталь, алюминий, латунь, бронза и медь.
Наша горячекатаная и холоднокатаная сталь доступна в широком диапазоне форм, включая пруток, трубы, листы и пластины.Мы можем разрезать металл в точном соответствии с вашими требованиями.
Посетите одно из наших 90+ офисов в Северной Америке сегодня.
Черные и цветные металлы | Примеры и списки металлов
В чем разница между черными и цветными металлами? В случае черных металлов (железо = железо) основным металлом является железо. Они составляют большую часть всех металлов, используемых сегодня. Это стало возможным благодаря их свойствам, которые подходят для многих различных отраслей и сценариев использования.
Цветные металлы, с другой стороны, не включают железо.Это различие сделано потому, что оно приводит к определенному характерному изменению, которого не могут обеспечить цветные металлы.
Свойства черных металлов
Черные металлы могут содержать множество различных легирующих элементов. Некоторые примеры – хром, никель, молибден, ванадий, марганец. Они придают черным сталям свойства материала, которые делают их широко используемыми в машиностроении.
Перечень свойств черных металлов:
- прочный
- Высокая прочность на разрыв
- Обычно магнитный
- Низкая устойчивость к коррозии
- Серебристый цвет
- Вторичная переработка
- Хорошие проводники электричества
Эти качества позволяют использовать их при строительстве долговечных небоскребов.Кроме того, они используются в производстве инструментов, автомобильных двигателей, трубопроводов, контейнеров, автомобилей, столовых приборов и т. Д.
Примеры черных металлов
Все они имеют разные характеристики, что позволяет использовать их в самых разных областях. Для лучшего обзора мы составили список черных металлов:
Нелегированные стали
Нелегированные стали также известны как углеродистые стали, потому что углерод является легирующим элементом. Да, это немного сбивает с толку, поскольку название предполагает одно, но именно так часто бывает в мире металлов.Хотя присутствуют и другие элементы, их содержание достаточно низкое, чтобы не повлиять на свойства материала. Эти элементы – сера, фосфор, кремний и марганец. Сера и фосфор могут действительно отрицательно сказаться на качестве стали, но, опять же, не при таком низком содержании.
Хотя термин «нелегированные стали» не часто упоминается в типичной машиностроительной компании как таковой, наши любимые конструкционные стали, такие как S235, S355 и т. Д., Относятся к этой группе.
Нелегированные стали классифицируются по содержанию углерода на стали с низким, средним и высоким содержанием углерода. У каждого есть свои собственные применения, и характеристики различаются. Также доступны разные методы лечения.
Низкоуглеродистая сталь
Низкоуглеродистая или мягкая сталь содержит 0,05… 0,25% углерода. Они довольно дешевы и очень хорошо подходят для операций гибки. Поверхностную твердость можно повысить за счет науглероживания.
Широко используются недорогие и ковкие низкоуглеродистые стали.Некоторые примеры включают болты и гайки, поковки, детали средней нагрузки и т. Д.
Примеры низкоуглеродистых сталей: C10E / 1.1121, C15E / 1.1141
Среднеуглеродистая сталь
Среднеуглеродистые стали содержат 0,25… 0,6% углерода. Более высокое содержание углерода увеличивает их прочность и твердость по сравнению с низкоуглеродистыми сталями. При этом снижается пластичность. Увеличение содержания углерода и марганца позволяет производить отпуск и закалку.
Шестерни, валы и оси – все черные металлыСреднеуглеродистые стали в основном используются для изготовления различных компонентов автомобильной промышленности, таких как шестерни, оси, валы, а также болты, гайки, винты и т. Д.Стали от 0,4… 0,6% также подходят для всего, что связано с локомотивами и рельсами.
Примеры среднеуглеродистых сталей: C40E / 1.1186, C60E / 1.1221
Высокоуглеродистая сталь
Цифры содержания углерода для высокоуглеродистых сталей варьируются в зависимости от различных источников. Некоторые из них имеют больше подгрупп, в то время как другие останавливаются на высокоуглеродистых сталях, которые начинаются с содержания углерода 0,6% и заканчиваются около 1%. Мы будем придерживаться второй интерпретации.
Это самые прочные из этой группы, что делает их пригодными для применений, где требуется устойчивость к механическому износу материала.Еще одно качество высокоуглеродистых сталей – их способность сохранять форму. Вот почему инструментальная сталь находит множество различных применений в области машиностроения.
С другой стороны, свариваемость, пластичность и ударная вязкость хуже, чем у сталей с меньшим содержанием углерода.
Стали также классифицируются по использованию. Инструментальные стали и высокоуглеродистые стали перекрываются.Сохранение формы делает их полезными в качестве пружин. Другие варианты использования включают лезвия, рельсовые стали, трос, износостойкие пластины, всевозможные инструменты и т. Д.
Примеры высокоуглеродистых сталей: C70U / 1.1520, C105U / 1.1545
Легированные стали и легирующие элементы
Легированные стали составляют еще одну подгруппу черных металлов. Легирующие элементы стали : хром, никель, кремний, медь, титан и т. Д. и т. Д. Каждый из них по-своему влияет на свойства материала. Конечно, их обычно совмещают, поэтому в конечных продуктах есть всего понемногу. Мы обсуждаем, как наиболее распространенные элементы влияют на результат.
Хром
Хром – это элемент, отвечающий за создание нержавеющей стали.Содержание хрома в количестве более 11% делает металл устойчивым к коррозии. Как обсуждалось в статье о материалах износа, защита осуществляется за счет создания слоя окисленного хрома поверх металла. Это означает, что основной металл не контактирует с кислородом, и опасность коррозии значительно снижается.
Таким образом, он готов к использованию без какого-либо защитного покрытия. Вы можете добиться великолепного эстетического результата, выбрав подходящую для вашего применения поверхность из нержавеющей стали.
Кроме того, хром также увеличивает прочность на разрыв, твердость, ударную вязкость, износостойкость и т. Д.
Марганец
Марганец улучшает пластичность, износостойкость и закаливаемость. Последнее осуществляется закалкой, при которой марганец оказывает значительное влияние. Это снижает опасность образования дефектов во время процесса, делая его более стабильным.
Также исключает образование вредных сульфидов железа, повышая прочность при высоких температурах.
Никель
Столовые приборы из нержавеющей стали помогают нам избежать вкуса ржавчины.Его основная цель – повысить пластичность и устойчивость к коррозии в сочетании с другими элементами, а именно с хромом. Когда содержание хрома составляет около 18%, а никеля – 8%, мы получаем чрезвычайно прочные нержавеющие стали.
Кремний
Повышает прочность и эластичность пружин. Еще один значительный эффект – повышение магнитных свойств металла.
Титан
Повышает прочность и коррозионную стойкость, ограничивает размер зерна аустенита.
Ванадий
Образование карбидов ванадия ограничивает размер зерна. Это влияет на повышение пластичности материала.
Он также увеличивает прочность, твердость, износостойкость и ударопрочность. Из-за его эффективности суммы должны быть низкими. В противном случае это может негативно сказаться на свойствах материала.
молибден
Молибден оказывает большое влияние на стальные сплавы при высоких температурах. Он улучшает механические свойства, а также устойчивость к коррозии и действует как усилитель для эффектов других легирующих элементов.
Чугун
Чугун – это сплав железа и углерода с содержанием углерода от 1,5 до 4 процентов. Также присутствуют другие элементы, а именно кремний, марганец, сера и фосфор.
Все мы знаем тяжелые чугунные сковороды 40-летней давности на бабушкиной кухне. Несмотря на то, что они хрупкие, их твердость делает их износостойкими. Окончательная форма изделия из чугуна достигается путем литья. Этот процесс требует лишь незначительной обработки после обработки, чтобы можно было сформировать необходимую форму.
Свойства чугуна:
- Отличная литье
- Сравнительно дешево
- Высокая прочность на сжатие
- Хорошая износостойкость
- Низкая точка плавления
Что такое цветной металл?
Цветные металлы не содержат железа. Они более мягкие и, следовательно, более податливые. Они используются как в промышленности, так и в эстетических целях – драгоценные металлы, такие как золото и серебро, являются цветными. Фактически, все формы чистого металла, кроме чистого железа, являются цветными.
Свойства цветных металлов
Преимущества цветных металлов позволяют использовать их во многих областях вместо железа и стали.
Свойства цветных металлов:
- Высокая коррозионная стойкость
- Простота изготовления – обрабатываемость, литье, сварка и т. Д.
- Высокая теплопроводность
- Отличная электропроводность
- Низкая плотность (меньшая масса)
- Цветной
- Немагнитный
Список цветных металлов
Опять же, мы собираемся предоставить некоторую информацию о каждом металле и его свойствах.Примеры цветных металлов:
Медь
При окислении медь приобретает зеленый цвет.Медь довольно широко распространена в промышленности. Добавьте сплавы латуни (медь и цинк) и бронзу (медь и олово), и вы, возможно, уже увидите множество применений меди. Если нет, мы можем вам помочь. Для инженеров-механиков наиболее известны подшипники скольжения и втулки.
Тем не менее, свойства меди и медных сплавов позволяют использовать больше:
- Высокая теплопроводность – теплообменники, нагревательные сосуды, приборы и т. Д.
- Высокая электрическая проводимость – используется в качестве электрического проводника в электропроводке и двигателях
- Хорошая коррозионная стойкость – красивая, но дорогая кровля
- Высокая пластичность – делает материал очень легко формуемым и подходящим для изготовления статуй
Алюминий
В инженерном отношении очень особенный и важный металл.Может быть не так полезен в повседневном применении из-за цены, но его сочетание небольшого веса и отличной обрабатываемости делает его наиболее популярным металлом на яхтах, самолетах и многих автомобильных запчастях.
Алюминий также является основным металлом во многих сплавах. Наиболее известными марками алюминия, вероятно, являются дюралюминий, Y-сплав и магналий.
Свойства алюминия включают:
- Устойчивость к коррозии
- Хороший проводник тепла и электричества (но меньше, чем у меди) – в сочетании с пластичностью и пластичностью в некоторых случаях заменяет медь
- Высокая пластичность и легкий вес
- После холодной обработки становится твердым, поэтому требуется отжиг
Лазерная резка алюминия – это то, что требует опыта и правильного оборудования.Поэтому внимательно выбирайте субподрядчика для производства.
Свинец
Свойства свинца
Для обычного человека свинец может вызвать тревогу, связанную с пулями (которые теперь не содержат свинца) и газом (имеющим знак «неэтилированный»). Хотя сначала его добавляли в топливо для уменьшения детонации двигателя, оказалось, что он очень вреден для здоровья при испарении в атмосферу.
То же самое и с патронами, и с работниками стрельбища, у которых возникли проблемы со здоровьем.Но зачем вообще это добавлять? Потому что свинец – самый тяжелый из обычных металлов. Поскольку он не вступает в реакцию с другими веществами, они по-прежнему используются в батареях и силовых кабелях, резервуарах для кислоты и водопроводных трубах.
Свойства свинца:
- Очень тяжелый
- Устойчив к коррозии – не вступает в реакцию со многими химическими веществами
- Мягкий и податливый
цинк
Цинк сам по себе не имеет большого значения для обычного человека. С другой стороны, как легирующий элемент он имеет широкий спектр применения.Он в основном используется для цинкования стали во всех областях. Цинкование делает материал более устойчивым к коррозии.
Черные или цветные металлы, Fractory позаботится о ваших работах по изготовлению листового металла.
Характеристики легкоплавких сплавов
Производители по всему миру полагаются на качественные материалы при создании ряда деталей, оборудования и продуктов для предприятий и потребителей. В процессе сборки, возможно, потребуется соединить различные материалы для обеспечения герметичного уплотнения, отлить в пресс-форме до заданной формы или согнуть в новом направлении без разрушения.Легкоплавкие сплавы, также называемые легкоплавкими сплавами, имеют состав, который позволяет металлу переходить в жидкое или полужидкое состояние при низких температурах, а затем повторно затвердевать. Эти легкоплавкие сплавы идеальны, поскольку они позволяют соединять или отливать детали при температурах ниже 300 градусов.
Выбор правильного легкоплавкого сплава важен для обеспечения того, чтобы соединяемая, отливаемая или изгибаемая деталь сохраняла свою прочность и долговечность для применения. Поскольку производимое оборудование и детали подвергаются экстремальным давлениям, нагрузкам и температурам, вам необходимо лучше понимать, какие легкоплавкие сплавы вы выбираете, и их характеристики во время затвердевания.
Распространенные легкоплавкие сплавы и их характеристикиДоступен широкий спектр легкоплавких сплавов. Однако использование некоторых из них ограничено из-за их хрупкости, токсичности и реактивных свойств. Некоторые из этих элементов – висмут, галлий, олово, индий, цинк, кадмий, теллур, сурьма, таллий, ртуть и свинец. Многие из этих минералов также могут быть добавками, вводимыми во время образования легкоплавких сплавов. Сегодня мы обсудим четыре основных сплава: висмут, галлий, олово и индий.
На основе олова: Олово – один из распространенных легкоплавких сплавов на основе олова. Обычно это основа композиции, в которой в сплаве будет около 50% элемента олова. Производители выбирают олово из-за его ковкости, когда им требуется металл, обладающий пластичными характеристиками, так как его можно формовать и формировать, не становясь хрупким.
На основе висмута: Сплавы висмута будут иметь менее пластичный состав, чем олово, поскольку он может стать хрупким.Производители используют висмут из-за его способности к расширению, когда он плавится, а затем затвердевает, поскольку он может расширяться до 3,3%. Чем больше висмута в сплаве, тем больше он расширяется. Он менее дорог, чем другие представленные сплавы, и наименее токсичен, так как может использоваться там, где присутствует питьевая вода.
На основе индия: Сплавы индия можно использовать при приклеивании к золотым, стеклянным и керамическим поверхностям, а также к другим материалам. Он также может свариваться сам с собой и может смачивать как неметаллические, так и металлические поверхности.При поиске пластичного элемента, который обеспечивает фантастическое сопротивление усталости и различные низкие температуры плавления, производители могут выбрать сплавы индия для своих применений.
На основе галлия: Из-за чрезвычайно низкой температуры плавления сплавы на основе галлия обладают способностью плавиться, когда их держат в руке. Он превращается в жидкость при комнатной температуре, так как производители часто используют его для управления температурным режимом. Его также можно использовать для смачивания неметаллических и металлических поверхностей, включая стекло и фарфор.Как и висмут, галлий может стать плотным и хрупким при затвердевании.
Плотностные характеристикиОдна из основных причин использования легкоплавких сплавов заключается в том, как они меняются при плавлении, а затем затвердевании. Некоторые сплавы являются эвтектическими и мгновенно превращаются в чистую жидкость, в то время как другие неэвтектические и переходят в полужидкое состояние, которое имеет тип слякотной текстуры, прежде чем стать жидким. Плотность легкоплавких сплавов также изменится при затвердевании.Сплавы, такие как висмут и галлий, будут сильно расширяться в жидком состоянии, а затем станут плотными, когда снова станут твердыми.
Важно знать плотность сплава, так как производителю необходимо знать, насколько он будет сжиматься или расширяться. Если металл слишком сильно сжимается, он может не создавать надлежащего сцепления с другими материалами или иметь необходимую прочность, чтобы выдерживать нагрузки. Если он слишком сильно расширяется, он может стать хрупким при превращении обратно в твердое тело, поскольку сплав может выйти из строя во время работы продукта или оборудования.
Различная плотность сплавов также может быть важна для производителей в зависимости от того, как они планируют использовать сплав. Для деликатных украшений вы можете не захотеть, чтобы материал слишком сильно расширялся, так как это может повредить окружающий металл, который должен оставаться нетронутым. Также необходимо обращать внимание на удлинение, прочность, модуль упругости и предел текучести сплава в процессе производства.
Компания Belmont Metals предлагает широкий выбор легкоплавких сплавов и металлов для различных применений в производственном процессе.Мы работаем уже 121 год, так как наше современное предприятие может предоставить вам легкоплавкие сплавы, подходящие для ваших нужд.
Идентифицировать металлы: 17 шагов (с изображениями)
Введение: Определить металлы
Если вы любите меня и делаете скульптуры из металлолома, то иногда бывает трудно определить, из какого металла сделан лом. В этом руководстве я покажу вам, как определить некоторые из наиболее распространенных металлов. ПРИМЕЧАНИЕ: это не все металлы, их тысячи, и я не могу рассказать обо всех из них.Также, если вы согнете олово, оно издаст легкий щелчок.
Добавить TipAsk QuestionDownload
Шаг 1: Черные или цветные?
Черный означает, что металл содержит железо, которое в большинстве случаев делает его магнитным, а цветной металл означает, что в нем нет железа. Примером черного металла является низкоуглеродистая сталь, также известная как низкоуглеродистая сталь. Пример цветного металла – медь или алюминий. Всегда полезно принести магнит на свалку.
Добавить TipAsk QuestionDownload
Шаг 2: Алюминий
Алюминий – это блестящий серый металл с прозрачным оксидом, который образуется при контакте с воздухом.Возможно, это не лучший способ его идентифицировать, но температура плавления алюминия составляет 658 ° C (1217 ° F). Также алюминий не искрит. Плотность алюминия составляет 2,70 г / см 3 , это хороший способ идентифицировать это, потому что вы можете найти плотность материала по плотности = масса ÷ объем. Как я уже сказал ранее, алюминий не содержит железа.
Добавить TipAsk QuestionDownload
Шаг 3: Бронза
Большая часть бронзы – это сплав меди и олова, но архитектурная бронза на самом деле содержит небольшое количество свинца.Бронза имеет темный медный цвет и со временем приобретает зеленый окись. Температура плавления бронзы составляет 850-1000 ° C (1562-1832 ° F) в зависимости от того, сколько в ней каждого металла. Бронза цветная. Поскольку бронза – это сплав, плотность может быть разной. При ударе бронза вибрирует, как колокол.
Добавить TipAsk QuestionDownload
Шаг 4: Латунь
Латунь – еще один медный сплав, но он содержит цинк вместо олова. Латунь имеет цвет желтого золота. Температура плавления латуни составляет 900-940 ° C (1652-1724 ° F) в зависимости от того, сколько каждого металла они использовали.Латунь цветная. Поскольку латунь – это сплав, ее плотность варьируется. Если при ударе медь вибрирует, как колокол, это можно использовать, чтобы определить, является ли что-то латунным, а не золотым.
Добавить TipAsk QuestionDownload
Шаг 5: Хром
Хром – это очень блестящий серебристый цвет, который со временем образует прозрачный оксид. Температура плавления хрома составляет 1615 ° C (3034 ° F). Вещи редко делают из чистого хрома, но многие вещи покрывают им, чтобы он блестел и не ржавел. Плотность хрома 7.2 г / см 3 . Хром не содержит железа.
Добавить TipAsk QuestionDownload
Шаг 6: Медь
Медь превращается во многие сплавы, такие как латунь и бронза. Медь имеет светло-красный цвет и со временем превращается в зеленый оксид. Медь цветная. Температура плавления меди составляет 1083 ° C (1981 ° F). Плотность котла 8,94 г / см 3 . Медь, как и латунь, также при ударе вибрирует, как колокол.
Добавить TipAsk QuestionDownload
Шаг 7: Золото
Золото блестящего желтого цвета без оксидов.3. Золото цветное. Золото – «драгоценный» металл, что означает, что оно очень дорогое и используется в монетах и украшениях.
Добавить TipAsk QuestionDownload
Шаг 8: Утюг
Железо является черным (наконец-то!) И магнитным. В неотшлифованном состоянии железо имеет тускло-серый цвет, а ржавчина – красноватый цвет. Железо также используется во многих сплавах, таких как сталь. Температура плавления утюгов составляет 1530 ° C (2786 ° F). Плотность утюга 7,87 г / см 3 .
Добавить TipAsk QuestionDownload
Шаг 9: Свинец
Свинец тускло-серый в неотшлифованном состоянии, но более блестящий при полировке.Свинец имеет относительно низкую температуру плавления, 327 ° C (621 ° F). Свинец цветной. Свинец очень тяжелый, его плотность 10,6 г / см 3 .
Добавить TipAsk QuestionDownload
Шаг 10: Магний
Магний имеет серый цвет и образует оксид, который делает его тусклым. Температура плавления магния составляет 650 ° C (1202 ° F). Магний очень легко воспламеняется в порошке или тонких полосках. Магний горит очень ярко, и его очень трудно потушить, потому что он настолько горячий, что если вы пролить на него воду, он разделит его на водород и кислород, два очень легковоспламеняющихся газа.3. Поскольку магний очень легкий, его используют в блоках двигателей автомобилей, и поскольку он так ярко горит, он используется в зажигательном оружии (для сжигания предметов) и фейерверках.
Добавить TipAsk QuestionDownload
Шаг 11: Низкоуглеродистая сталь
Низкоуглеродистая сталь от черного до темно-серого неполированного и серебристого цвета. Низкоуглеродистая сталь имеет тот же красный оксид ржавчины, что и железо. Низкоуглеродистая сталь также бывает черной и магнитной. Другое название мягкой стали – низкоуглеродистая сталь. При шлифовании из мягкой стали образуются желтые искры.Плотность низкоуглеродистой стали составляет около 7,86 г / см 3 , но она варьируется, поскольку это сплав железа и углерода (низкоуглеродистая сталь). Температура плавления старой стали составляет 1350-1530 ° C (2462-2786 ° F).
Добавить TipAsk QuestionDownload
Шаг 12: Никель
Никель – блестящее серебро при полировке и более темный неполированный. Никель – один из немногих металлов, которые не являются магнитными сплавами железа (никель 5 США не является магнитным, потому что он сделан из медно-никелевого сплава). Температура плавления никеля составляет 1452 ° C (2645 ° F).Плотность никеля 8,902 г / см 3 .
Добавить TipAsk QuestionDownload
Шаг 13: Нержавеющая сталь
Нержавеющая сталь блестящего серебристого цвета не образует и не окисляется. Хром (этап 5) примешивается к стали, когда он затвердевает, хром оставляет покрытие из своего оксида поверх стали, оно слишком тонкое, чтобы его можно было увидеть, поэтому цвет стали просвечивает. Температура плавления нержавеющей стали составляет 1400-1450 ° C (2552-2642 ° F). Плотность нержавеющей стали варьируется, потому что это сплав.В зависимости от сплава некоторые нержавеющие стали являются магнитными, но все они являются черными.
Добавить TipAsk QuestionDownload
Шаг 14: Олово
Олово имеет серебристо-серый цвет (как и большинство металлов) в полированном состоянии и темнее в не полированном состоянии. Олово имеет сравнительно низкую температуру плавления – 231 ° C (449 ° F). Плотность банок 7,365 г / см 3 . Олово цветное
Добавить TipAsk QuestionDownload
Шаг 15: Титан
Титан – металл серебристо-серого цвета в неотправленном состоянии и темнее в неотполированном.При шлифовании титан дает яркие белые искры. Титан цветной. Температура плавления титана составляет 1795 ° C (3263 ° F). Плотность титана 4,506 г / см 3 .
Добавить TipAsk QuestionDownload
Шаг 16: Серебро
Серебро – это блестящий серый цвет даже до полировки, но со временем на нем образуется черная пленка, и его необходимо полировать. Температура плавления серебра составляет 961,78 ° C (1763,2 ° F). Серебро имеет самую высокую электропроводность (через него может проходить больше электричества), чем любой другой металл.3. Серебро цветное. Серебро является «драгоценным» металлом, что означает, что оно дорогое и используется в монетах и ювелирных изделиях.
Добавить TipAsk QuestionDownload
Шаг 17: Цинк
Цинк от природы тускло-серый и его очень трудно полировать. У цинка есть оксид, который отслаивается, неся часть цинка, поэтому им покрываются другие предметы, поэтому цинк «ржавеет» вместо основного металла, это называется гальванизацией. Из-за своей невысокой стоимости цинк является основным металлом у нас в копейках. Температура плавления цинка составляет 419 ° C (786 ° F).Цинк цветной. Плотность цинка 7,14 г / см 3 .
Добавить Подсказка Задать вопросЗагрузить
Будьте первым, кто поделится
Вы сделали этот проект? Поделитесь с нами!
Я сделал это!Рекомендации
Цветные металлы – обзор
23.3.2 Процесс обжига сульфидной руды в псевдоожиженном слое
Большинство цветных металлов, таких как медь, свинец, цинк или кобальт, откладываются в земной коре, в основном в виде сульфидов ( Ullmann, 1996b).Сульфидные руды цинка являются сырьем для производства 90% цинка.
Основной целью процесса обжига является превращение встречающихся в природе сульфидов металлов (MeS) в его оксидную форму (MeO) и удаление серы в виде диоксида серы в соответствии с реакцией [23.7].
[23,7] 2MeS + 3O2 → 2MeO + 2SO2ΔH <0
В процессе обжига сульфиды превращаются в оксид в результате реакции горения, но при этом не происходит удаления материала пустой породы. В следующем разделе в качестве примера процесса описывается применение технологии кипящего слоя для обжига с использованием сульфида цинка.Цинк представляет собой 24-й по частоте элемент в земной коре. Годовая добыча цинка на рудниках в 2011 году составила около 12,4 млн тонн; ведущим производителем цинка является Китай, за ним следуют Австралия и Перу (Геологическая служба США, без даты). Добыча цинка занимает четвертое место в мире по добыче металлов. Как упоминалось ранее, цинк считается халькофильным элементом и в основном встречается в виде сфалерита, известного как цинкосодержащий ZnS. Типичные цинковые руды содержат 10–20% цинка, во многих случаях в сочетании с железом, свинцом, кадмием, марганцем или медью, а также следы мышьяка, ртути, серебра или золота.
На рис. 23.8 показан современный стандартный способ получения первичного цинка из сульфидной руды гидрометаллургическим производством, при котором производство металла происходит в условиях низких температур. В гидрометаллургических процессах используются растворимость и смачиваемость элементов. Этот производственный маршрут обычно состоит из следующих участков: обогащение руды, обжиг, выщелачивание, разделение, электролиз и плавление, а также литье.
23,8. Упрощенная блок-схема расположения стадии обжига в псевдоожиженном слое во всем процессе.
Для увеличения содержания цинка в горнодобывающей руде с 10% до диапазона 40–60% необходимы предварительные процессы обогащения руды. Обычно это включает процессы измельчения в сочетании с установками разделения по плотности и флотации с целью удаления пустых пород, таких как галенит и пирит. Впоследствии цинковый концентрат, который все еще присутствует в виде сульфида, должен быть преобразован в оксидную форму, поскольку следующие стадии требуют оксидов в качестве исходного материала.Поэтому с 1940-х годов обжиг стал важной частью металлургической промышленности. Основы основаны на знаниях о псевдоожижениях, которые были разработаны в нефтяной промышленности несколько лет назад. За последние несколько десятилетий было разработано большое количество процессов обжига, и сегодня обжиг в псевдоожиженном слое и агломерат часто используются в промышленности. Из-за мелкодисперсного материала на выходе ростеры с псевдоожиженным слоем предпочтительны для гидрометаллургического производства. Для выщелачивания требуется мелкозернистое сырье для повышения производительности.Напротив, обжиг агломерата более подходит для последующих пирометаллургических процессов из-за способности процесса получать пористый материал. Обжиговая печь с псевдоожиженным слоем имеет явные преимущества перед агломерационной лентой или многоподовой обжиговой установкой, такие как высокая производительность при низких площадях установки реактора и большая гибкость процесса в зависимости от содержания влаги. Из-за низкого расхода избыточного воздуха из-за тесного контакта газа с твердыми частицами сера обогащается в газе обжига примерно до 10%.По этой причине возможно образование серной кислоты (Enghag, 2004). Кроме того, этот процесс имеет практические преимущества в высокой доступности обжарочного агрегата, поскольку в нем не установлены движущиеся части. Его также легко контролировать и стабилизировать (Ullmann, 1996b). Обжиг в псевдоожиженном слое также имеет большую мощность, чем альтернативные реакторы (Kunii & Levenspiel, 1991). Компания Outotec предлагает ростеры с размером решетки до 123 м 2 с годовой производительностью по цинку 300 000 т. Ростер с псевдоожиженным слоем показан на рис.23.9 в схематических деталях.
23.9. Принципиальная схема обжиговой печи с псевдоожиженным слоем.
Размеры ростера с псевдоожиженным слоем для промышленного использования составляют до 20 м в высоту (Baerns et al ., 2006), около 12,5 м в диаметре, а ростер работает при скоростях газа в диапазоне 1–3 м / с (Йейтс, 1983). В реакторе с псевдоожиженным слоем концентраты цинка превращаются в присутствии воздуха в оксид цинка, который также известен как кальцин, а также диоксид серы, в соответствии с реакцией [23.8]:
[23,8] 2ZnS + 3O2 → 2ZnO + 2SO2ΔH <0
Это происходит в диапазоне температур 800–1000 ° C. Характерный размер частиц загружаемого материала составляет менее 6 × 10 -3 м в диаметре, а в качестве псевдоожижающего агента используется воздух. Для запуска жаровни требуется установка дополнительной системы нагрева (обычно газовой горелки), чтобы поднять температуру жаровни до желаемого диапазона, чтобы достичь автономного режима работы процесса. Температура воспламенения составляет от 550 до 650 ° C в зависимости от размера частиц (Winnacker-Küchler, 2006).Как только реакция начинается, выделяется энергия в виде тепла. Чтобы поддерживать температуру в реакторе на постоянном оптимальном уровне, части этого тепла реакции необходимо охлаждать за счет генерации пара с помощью погружных охлаждающих змеевиков. Летучие соединения сырья, такие как кадмий, свинец и ртуть, в значительной степени обогащены газообразным дымовым газом и должны обрабатываться на другой стадии процесса. Практически все современные процессы обжига, используемые сегодня, представляют собой установку очистки газа с установкой регенерации SO 2 и последующим производством кислой серы.Пыль обжигового газа должна осаждаться при температуре выше 350–400 ° C. Это гарантирует предотвращение конденсации H 2 SO 4 . Осаждение пыли происходит в циклоне или электрофильтре (Baerns et al ., 2006). Оксидный выходной материал обжиговой печи направляется в секцию выщелачивания. В последующей установке сепарации удаляются такие примеси, как медь, кобальт и кадмий. Для дальнейшего электролиза необходимо удалить металлы, менее электроотрицательные, чем цинк.Наконец, продукты электролиза (катодный цинк) плавятся и отливаются для получения слитков цинка. Сегодня около 80% от общего объема производства металлического цинка получают электрохимическим способом.

