Температура кипения и плавления алюминия: Какая температура плавления у алюминия?
alexxlab | 23.03.1985 | 0 | Разное
Какова температура плавления алюминия
Главная » Разное » Какова температура плавления алюминия
Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении
| Металл или сплав | tпл. С |
|---|---|
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Германий | 937 |
| Дуралюмин | ~650 |
| Железо | 1539 |
| Золото | 1064?4 |
| Инвар | 1425 |
| Иридий | 2447 |
| Калий | 63,6 |
| Карбиды гафния | 3890 |
| ниобия | 3760 |
| титана | 3150 |
| циркония | 3530 |
| Константин | ~1260 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Нейзильбер | ~1100 |
| Никель | |
| Нихром | ~1400 |
| Олово | 231,9 |
| Осмий | 3030 |
| Платина | 17772 |
| Ртуть | – 38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Фехраль | ~1460 |
| Цезий | 28,4 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
Вернуться в раздел аналитики
Запись опубликована автором admin в рубрике Полезные материалы. Добавьте в закладки постоянную ссылку.
Добавьте в закладки постоянную ссылку.
Температура плавления меди – при какой температуре плавится медь
Благодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Этап плавления меди
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Как плавили медь наши предки
Благодаря невысокой температуре плавления меди, составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Какие процессы происходят при плавлении меди
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При добавлении в медь олова, имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.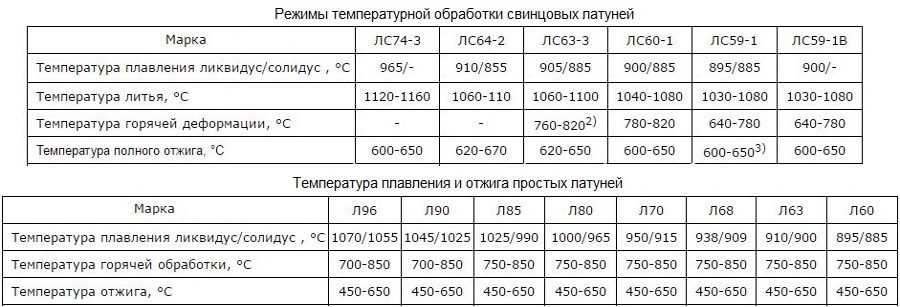
Диаграмма состояния системы хром-медь
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.
Какова температура плавления меди и сплавов?
Сфера применения меди очень широка. Поэтому многие задаются вопросами: как правильно плавить медь и какова температура ее плавления? У меди температура плавки довольно низкая,это же касается и ее сплавов, однако условия варьируются в зависимости от количества примесей.
Медь и ее использование
По предположениям ученых, первобытные предки современного человека находили самородки меди, которые иногда были огромных размеров. На латинице имеет название Cuprum. Древние греки занимались ее добычей на Кипре – отсюда такое имя.
На латинице имеет название Cuprum. Древние греки занимались ее добычей на Кипре – отсюда такое имя.
Стоит отметить, что экологи обеспокоены последствиями добычи металла. При открытом способе добычи карьер превращается в источник токсичных веществ. Самое токсичное озеро в мире — Беркли Пит (штат Монтана, США) — зародилось из кратера медного рудника.
Ввиду того, что температура плавления довольно невысокая (1083 °С), медную руду или же самородки не составляло трудности расплавить прямо на костре. Эта легкость плавления позволяла повсеместно использовать данный металл, чтобы изготовлять предметы быта, орудия труда, оружие, украшения.
Инструменты, изготовленные из этого металла и его сплавов, не создают искр. Этим обуславливается их широкое применение в тех сферах, где существуют повышенные требования к безопасности (на огнеопасных и взрывоопасных производствах).
Еще издавна люди применяли медь регулярно, сфера ее использования была довольно обширна, однако Cuprum занимает всего лишь двадцать третье место среди прочих химических компонентов по количеству нахождения под землей. Наиболее часто можно встретить ее природе в виде различных соединений, компонентов сульфидных руд. Самые популярные – это медный блеск, медный колчедан. Есть несколько методик добывания чистого металла из руды.
Наиболее часто можно встретить ее природе в виде различных соединений, компонентов сульфидных руд. Самые популярные – это медный блеск, медный колчедан. Есть несколько методик добывания чистого металла из руды.
к меню ↑
Как плавили медь раньше
Выше мы уже писали следующую информацию: Cuprum легко плавится, так как температура для плавки низкая. Данный факт давал возможность обработки металла еще на этапах зарождения цивилизации. Стоит сказать: мы в долгу у древнейших металлургов. Они нашли способы добывания, плавления как чистого металла, так и сплавов.
Плавлением называют процесс перехода из твердого состояния в жидкость. Это делали методом простого нагрева, что удавалось благодаря низкой температуре плавления. Далее добавляли олово. Таким образом получалась бронза. Медь уступала бронзе по своей прочности, именно поэтому из сплава делали оружие.
к меню ↑
Медь, её сплавы
к меню ↑
МедьМедь, употребляемая сегодня промышленностью, не представляет собой чистый металл Cuprum. Состав содержит огромное количество других компонентов: железо, никель, сурьма, мышьяк. Качество, соответственно и марка, определяется процентным соотношением примесей (их содержание до 1%). Этот металл является чистым с технической точки зрения. Очень важные качества этого металла — высокие показатели электропроводности, теплопроводности. Этим обуславливается невысокая температура для плавки. Температура плавления меди — 1084°С.
Состав содержит огромное количество других компонентов: железо, никель, сурьма, мышьяк. Качество, соответственно и марка, определяется процентным соотношением примесей (их содержание до 1%). Этот металл является чистым с технической точки зрения. Очень важные качества этого металла — высокие показатели электропроводности, теплопроводности. Этим обуславливается невысокая температура для плавки. Температура плавления меди — 1084°С.
Сам по себе – это достаточно гибкий пластичный металл, поэтому его очень широко используют в различных технических отраслях, промышленности. Как расплавить медь? Идеальный метод плавления красной меди — ацетилено-кислородным пламенем, еще угольной дугой или контактной сваркой.
к меню ↑
ЛатуньЛатунь – смесь меди с цинком, процентное соотношение может доходить до равноценного: 50 на 50. Температурные условие для плавки латуни: плавится при 800-950 градусах Цельсия, температура плавления изменяется от процентного соотношения двух металлов. Закономерность такова: чем меньше цинка, тем ниже температура плавления.
Закономерность такова: чем меньше цинка, тем ниже температура плавления.
Какова сфера использования данного сплава? Его часто используют как литейный материал, а также листовой, сортовой металл.
Помимо цинка в различных марках можно увидеть содержание алюминия, свинца, олова, марганца, железа. Содержание прочих компонентов будет оказывать влияние на процесс плавки.
Латунь хорошо сваривать ацетилено-кислородным пламенем. Остальные виды не так предпочтительны, так как цинк интенсивно будет испаряться.
к меню ↑
БронзаСплав Cuprum и Stannum (олово) называют бронзой. Встречаются также безоловянные — в них нет олова. Например, с некоторым процентом алюминия или железа и марганца.
Сфера применения бронзы не так широка. Чаще всего ее используют как литейный материал в производстве подшипников, работающих на трение, также иногда для изготовления украшений, предметов интерьера.
com/embed/crnmado3zyA” frameborder=”0″ allowfullscreen=”allowfullscreen”>Похожие статьи
Температура кипения и плавления металлов, температура плавления стали
Температура кипения и плавления металлов
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см3, то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
Источники:
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Самостоятельная работа «Плавление и отвердевание кристаллических веществ»
Температура – плавление – цинк
Температура плавления цинка 419 С, Цинк обладает невысокими механическими свойствами, при нормальной температуре хрупкий, от ударов молотка крошится, а при температуре 100 – 150 С становится ковким и тягучим и хорошо прокатывается в листы. Кислоты и щелочи разъедают цинк, а чистая вода не разрушает его. Из-за низких механических свойств цинк в чистом виде для изготовления деталей не применяется. [1]
При температуре плавления цинка 419 практически установлено, что температура цинковой ванны должна быть около 450 и не выше 480, так как в противном случае толщина покрытия падает, растет угар цинка и повышается износ стенок ванны, обычно изготовляемой из железа. Расплавленный цинк должен быть возможно более чистым. Содержание железа в расплавленном цинке не допускается выше 0 05 %, так как в противном случае повышается температура плавления цинка. Вследствие того, что покрытие цинком становится тем более хрупким, чем выше содержание в нем железоцинкового сплава, в практике внимательно следят за систематическим удалением со дна ванны гартцинка и за соблюдением особых мер, предупреждающих его взмучивание. Накопление окиси цинка в расплавленном металле за счет окисления цинка кислородом воздуха приводит к увеличению вязкости расплава, а также к образованию хрупких покрытий. [2]
Расплавленный цинк должен быть возможно более чистым. Содержание железа в расплавленном цинке не допускается выше 0 05 %, так как в противном случае повышается температура плавления цинка. Вследствие того, что покрытие цинком становится тем более хрупким, чем выше содержание в нем железоцинкового сплава, в практике внимательно следят за систематическим удалением со дна ванны гартцинка и за соблюдением особых мер, предупреждающих его взмучивание. Накопление окиси цинка в расплавленном металле за счет окисления цинка кислородом воздуха приводит к увеличению вязкости расплава, а также к образованию хрупких покрытий. [2]
Производить шерардизацию при температурах выше температуры плавления цинка , не рекомендуется, так как в этом случае расплавленные частицы цинка обволакиваются пленкой окиси цинка, создающей препятствие для взаимного слияния расплавленных частиц. После нагревания барабан охлаждается до комнатной температуры. Неостывший барабан открывать нельзя, так как возможно сгорание шерардизирующей смеси.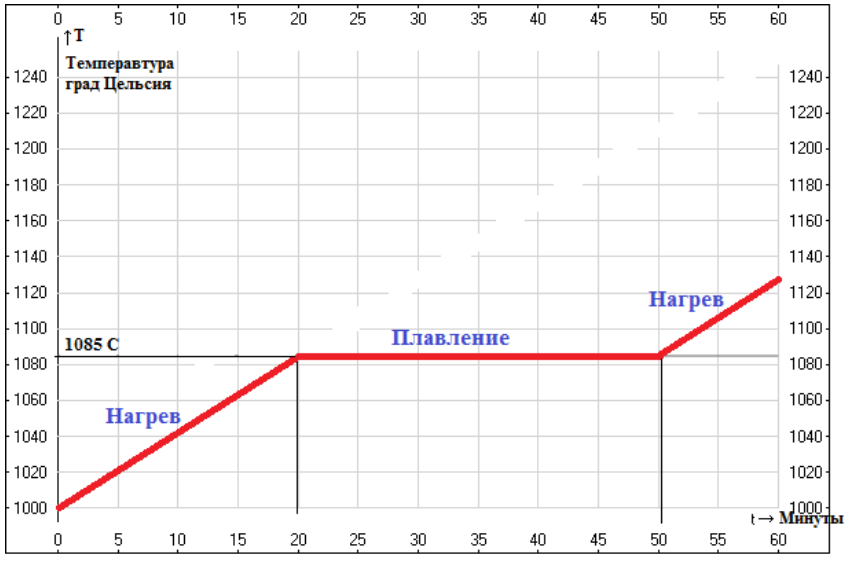 Готовые изделия выбрасываются в сито, через которое отсеивается цинковая пыль. [3]
Готовые изделия выбрасываются в сито, через которое отсеивается цинковая пыль. [3]
Если измерения вести при температурах ниже температуры плавления цинка , то кривые по повышению напряжения хорошо совпадают с кривыми по понижению напряжения. На катоде при этом выделяется цинк в форме дендритов. При измерениях выше температуры плавления цинка некоторое деполяризующее действие оказывает реакция восстановления цинком сульфатов до сульфидов, хотя и в этом случае после охлаждения в католите можно обнаружить цинк в виде королька. [4]
Во время нагревания температура нагревания должна быть немного ниже температуры плавления цинка . [5]
При прохождении тока короткого замыкания суженные места вставки быстро нагреваются до температуры плавления цинка , и плавкая вставка плавится одновременно во всех суженных местах. [6]
Должен знать: кинематические, электрические схемы оцинковального агрегата непрерывного действия в пределах выполняемой работы и правила наладки его; температуру плавления цинка и влияние температуры расплавленного цинка на толщину слоя покрытия; физико-химические свойства цинка и химикатов, применяемых для оцинкования, в пределах выполняемой работы; виды дефектов и причины некачественной подготовки поверхности листов и стальной проволоки. [7]
[7]
Цинк в чистом виде применяют в основном для оцин-кования стали, в электрических батареях и элементах. Температура плавления цинка равна 419 С. [8]
Так, например, при температуре плавления цинка 419 С и олова 232 С латунь и бронза имеют температуру плавления 800 – 950 С. Возникает опасность испарения легкоплавких компонентов. [10]
Повышение температуры вызывает более интенсивное образование диффузионных слоев покрытия, но при толщине выше некоторой предельной покрытие становится рыхлым, легко спадает с поверхности изделия на дно ванны. Температура расплава в ванне ( при температуре плавления цинка 419 С) поддерживается на уровне 450 С и не превышает 480 С. При более высокой температуре недопустимо снижается толщина покрытия, уменьшается срок службы стенок ванны, изготовляемой обычно из стали. Холодные ванны ( при температуре расплава менее 450 С) дают грубые и не-равномерные по толщине покрытия при повышенном расходе цинка на покрытие. Необходимо систематически удалять со дна ванны гартцинк и соблюдать особые меры, предупреждающие взмучивание его. Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [11]
Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [11]
Читать также: Какие величины определяют потенциальную энергию растянутой пружины
Повышение Температуры вызывает более интенсивное образование диффузионных слоев покрытия, но при толщине выше некоторой предельной покрытие становится рыхлым, легко спадает с поверхности изделия на дно ванны. Температура расплава в ванне ( при температуре плавления цинка 419 С) поддерживается1 на уровне 450 С и не превышает 480 С. При более высокой тймпературе недопустимо снижается толщина покрытия, уменьшается срок службы стенок ванны, изготовляемой обычно из стали. Холодные ванны ( при температуре расплава менее 450 С) дают грубые и неравномерные по толщине покрытия при повышенном расходе цинка на покрытие. Необходимо систематически удалять со дна ванны гартцинк и соблюдать особые меры, предупреждающие взмучивание его. Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [13]
Расплавленный металл постепенно загрязняется окисью цинка вследствие окисления цинка кислородом воздуха. Это увеличивает вязкость расплава, а также вызывает образование хрупких покрытий. [13]
Применение цинковых плавких вставок в предохранителях ПР объясняется не только указанными выше преимуществами их по сравнению с вставками из свинца и из его сплавов с оловом. Большое значение имеет и то, что при применении цинковой вставки температура внутри трубки в эксплуатации не может быть выше температуры плавления цинка , равной 420 С. С, что может привести к сильному обугливанию внутренней поверхности фибровой трубки и порче изоляции подводящих проводов. [15]
Цинк — хрупкий металл белого цвета с голубым оттенком. На воздухе покрывается тонкой оксидной плёнкой. Латунь (медно-цинковый сплав) использовали ещё до нашей эры в Древней Греции и Древнем Египте. На сегодняшний день цинк — один из самых важных для многих отраслей человеческой деятельности. Он незаменим в промышленности, медицине. Важен для нормального функционирования человеческого организма
Важен для нормального функционирования человеческого организма
Характеристики свинца
На нашей планете содержится 0,0016% этого металла от совокупной массы земной коры. Этот показатель хоть и небольшой, однако, если его сравнивать с иными химическими элементами — висмутом, золотом, ртутью, то свинец находится на гораздо более высокой позиции.
Преимущественный источник сырьевого материала — сульфидные полиметаллические руды. Металл имеет следующие качества:
- мягкость;
- невысокая температура плавления;
- обрабатывать этот металл можно и самостоятельно.
Этот материал характеризуется грязно-сероватым оттенком. На участке среза металл имеет синеватый отлив, который постепенно становится тусклым. Это связано с окислительным процессом, который происходит благодаря влиянию кислорода. На срезе при этом формируется оксидный слой.
Это тяжёлый металл, его плотность составляет 11,34 г/см³. Этот показатель примерно в полтора раза выше, нежели у обыкновенного железа. Помимо всего прочего, свинец также относится к наиболее мягким металлам.
Этот показатель примерно в полтора раза выше, нежели у обыкновенного железа. Помимо всего прочего, свинец также относится к наиболее мягким металлам.
Его поверхность с лёгкостью царапается даже обыкновенным ножиком или ногтём. Свинец является крайне гибким, расплющить этот металл можно обыкновенной киянкой или молотком. А ещё он нередко используется для литья или плавления своими руками.
Температура плавления
Температурные показатели, при которых свинец начинает закипать — 1751 градус.
Этот металл начинает плавиться при температуре 327,46 градуса по шкале Цельсия. Его литьевые качества полностью сохраняются в пределах от четырёхсот до четырёхсот пятидесяти градусов.
А оксидная плёнка, защищающая материал от воздействия коррозии, начинает плавиться лишь при температуре в 850 градусов Цельсия, что затрудняет сваривание этой разновидности металла с другими. Кроме того, уровень летучести свинца существенно увеличивается при температуре в 700 градусов.
Материал отлично обрабатывается и в охлаждённом виде. Из него можно сделать тонкий слой фольги. Если на этот металл воздействует давление в 2 тонны на квадратный сантиметр, то он приобретает вид монолита.
Проволоку же из него делают посредством продавливания в фильере. Низкая степень прочности на разрыв не позволяет пользоваться обыкновенным волочением для этой цели.
youtube.com/embed/IWFEJ-UK-WY?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Химические и физические свойства и история металла
Несмотря на использование с давних времён в различных целях, чистый цинк получить никак не удавалось. Только в начале восемнадцатого века Уильям Чемпион сумел открыть способ выделения этот элемент из руды с помощью дистилляции. В 1838 году он запатентовал своё открытие, а спустя 5 лет, в 1843 году, Уильямом Чемпионом был запущен первый в истории завод по выплавке этого металла. Спустя некоторое время Андреас Сигизмунд Маргграф открыл ещё один метод. Этот способ был признан более совершенным. Поэтому именно Маргграфа зачастую считают открывателем чистого цинка. Последующие открытия только поспособствовали расширению его популярности.
Последующие открытия только поспособствовали расширению его популярности.
Факторы, ограничивающие применение вольфрама
Есть ряд факторов, которые ограничивают применение этого материала:
- высокая плотность;
- значительная склонность к ломкости в условиях низких температур;
- малое сопротивление окислению.
По своему внешнему виду вольфрам имеет сходство с обычной сталью. Его основное применение связано главным образом с производством сплавов с высокими прочностными характеристиками. Этот металл поддается обработке, но только если его предварительно нагреть. В зависимости от выбранного типа обработки нагрев производится до определенной температуры. Например, если стоит задача выковать прутки из вольфрама, то заготовку необходимо предварительно нагреть до температуры 1450-1500 градусов Цельсия.
Его основное применение связано главным образом с производством сплавов с высокими прочностными характеристиками. Этот металл поддается обработке, но только если его предварительно нагреть. В зависимости от выбранного типа обработки нагрев производится до определенной температуры. Например, если стоит задача выковать прутки из вольфрама, то заготовку необходимо предварительно нагреть до температуры 1450-1500 градусов Цельсия.
На протяжении 100 лет вольфрам не применялся в промышленных целях. Его использование при производстве различной техники сдерживалось его высокой температурой плавления.
Начало его промышленного применения связано с 1856 годом, когда он впервые стал использоваться для легирования инструментальных марок стали. При их производстве в состав стали добавлять вольфрам общей долей до 5%. Присутствие этого металла в составе стали позволило повысить скорость резки на токарных станках с 5 до 8 м в минуту.
Развитие промышленности во второй половине XIX века характеризуется активным развитием отрасли производства станков. Спрос на оборудование с каждым годом постоянно возрастал, что требовало от машиностроителей получения качественных характеристик машин, а помимо этого повышения их рабочей скорости. Первым импульсом в деле повышения скорости резки стало использование вольфрама.
Спрос на оборудование с каждым годом постоянно возрастал, что требовало от машиностроителей получения качественных характеристик машин, а помимо этого повышения их рабочей скорости. Первым импульсом в деле повышения скорости резки стало использование вольфрама.
Уже в начале XX века скорость резки была доведена до 35 метров в минуту. Добиться этого удалось за счет легирования стали не только вольфрамом, но и другими элементами:
- молибденом;
- хромом;
- ванадием.
В дальнейшем скорость резания на станках возросла до 60 метров в минуту. Но, несмотря на такие высокие показатели, специалисты понимали, что есть возможность улучшить эту характеристику. Какой способ выбрать для повышения скорости резания, специалисты долго не думали. Они прибегли к использованию вольфрама, но уже в виде карбидов в союзе с другими металлами и их видами. В настоящее время вполне обычной является скорость резания металла на станках 2000 метров в минуту.
youtube.com/embed/kAVrXgl4p3A?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>Месторождения и получение
Самородного цинка в природе не существует. Сегодня используется около 70 минералов, из которых его выплавляют. Самый известный — сфалерит (цинковая обманка), который содержится в незначительных количествах в организме человека и животных, а также в некоторых растениях. Больше всего — в фиалке.
Цинковые минералы добывают в Казахстане, Боливии, Австралии, Иране, России. Лидеры по производству — Китай, Австралия, Перу, США, Канада, Мексика, Ирландия, Индия.
На сегодняшний день самый популярный метод получения чистого металла — электролитический. Чистота получаемого металла почти стопроцентная (возможны лишь небольшие примеси в объёме не более нескольких сотых процента. В целом они незначительны, поэтому такой цинк считается чистым).
Общее производство цинка во всём мире оценивается примерно в более чем десять миллионов тонн в год.
Читать также: Зачистной диск по дереву на болгарку
Особенности и технологические моменты получения рения
Руды, содержащие рений, сначала обжигают или нагревают на воздухе, чтобы превратить их в оксид рения ReO3. Затем газообразный водород пропускают через оксид рения. Водород превращает оксид рения в чистый металл.
Товарный Re извлекается из топочного дымового газа молибдена, полученного из медно-сульфидных рудах путем высокотемпературного обжига. Часто продается в виде соли аммония, перрената аммония, от которого он может быть дополнительно очищен. Очистка включает восстановление водородом при высоких температурах с получением рениевого порошка, который может быть изготовлен в форме с использованием процессов порошковой металлургии.
Часто продается в виде соли аммония, перрената аммония, от которого он может быть дополнительно очищен. Очистка включает восстановление водородом при высоких температурах с получением рениевого порошка, который может быть изготовлен в форме с использованием процессов порошковой металлургии.
Некоторые руды молибдена содержат от 0,002 до 0,2% рения. Общее мировое производство составляет от 40 до 50 тонн/год. Коммерческие операции по производству рения таким способом можно найти в Майами, Аризоне и Юте в США, а также в Чили, России, Казахстане и Украине. Высокая стоимость этого элемента сильно ограничивают его применение. Тем не менее, благодаря своей исключительной стойкости к высоким температурам Re необходим при выпуске термопар для измерения температур до 2500 C, в неокисляющих атмосферах, а также при производстве тугоплавких сплавов с вольфрамом.
Рений может быть выплавленный с использованием методов сварки инертным газом или электронно-лучевой сваркой, но должен быть защищен от окисления.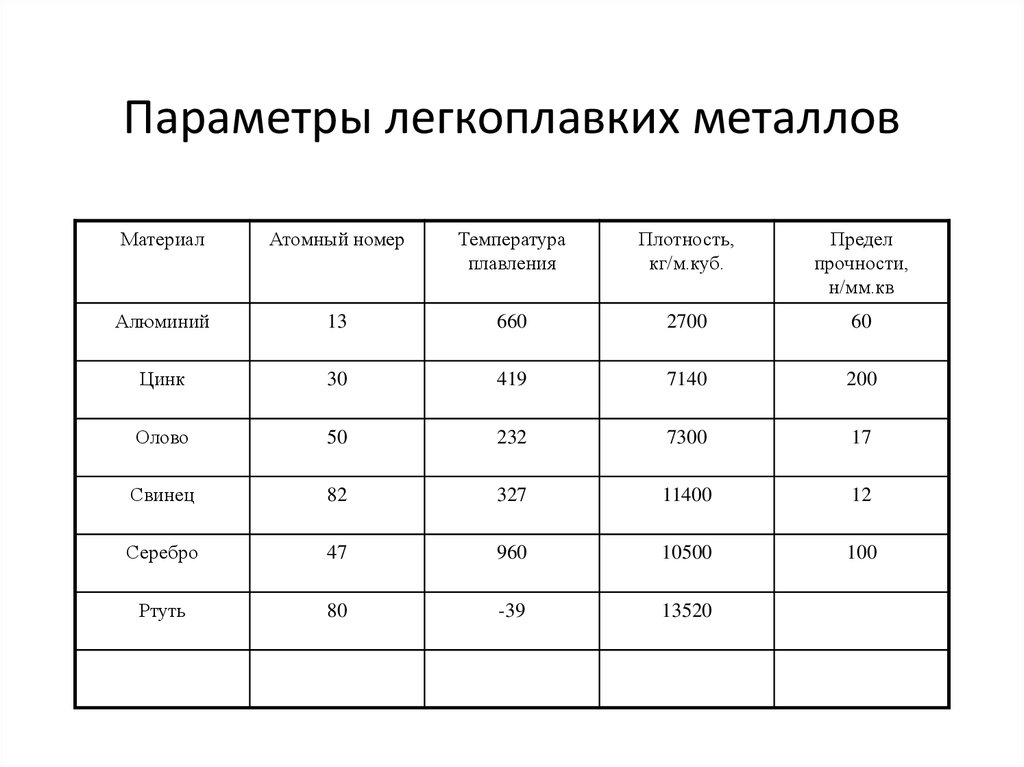 Он может быть обработан с использованием электрохимической, электронно-разрядной обработки, абразивной резки и шлифования.
Он может быть обработан с использованием электрохимической, электронно-разрядной обработки, абразивной резки и шлифования.
Свойства металла и использование в производстве
Цвет чистого металла — серебристо-белый. Довольно хрупок при температуре двадцать-двадцать пять градусов (т.е. комнатной), особенно если содержит примеси. При нагревании до 100 — 150 градусов по Цельсию металл становится пластичным и ковким. При разогревании выше чем сто-сто пятьдесят градусов хрупкость опять возвращается.
При разогревании выше чем сто-сто пятьдесят градусов хрупкость опять возвращается.
- Температура плавления цинка — 907 градусов по Цельсию.
- Относительная атомная масса цинка — 65,38 а. е. м. ± 0,002 а. е. м.
- Плотность цинка — 7,14 г/см 3 .
Металл цинк занимает четвертое место по использованию в различных сферах производства:
- Он применяется при добыче и обработке золотой и серебряной руды.
- Оцинковка защищает сталь от коррозии.

- Важную роль металл играет в батарейках и аккумуляторах.
- С помощью цинковых пластинок печатаются иллюстрации в журналах и книгах.
- В медицине цинковая окись используется как антисептик.
- Применяется в автомопроизводстве.
Содержание в организме человека и продуктах питания
Организм человека обычно содержит около двух граммов цинка. Многие ферменты содержат в себе этот металл. Элемент играет роль в синтезе важных гормонов, таких как тестостерон и инсулин. Элемент крайне необходим для полноценного функционирования мужских половых органов. Кстати, он даже помогает нам справиться с сильным похмельем. С его помощью выводится из нашего организма лишний алкоголь.
Многие ферменты содержат в себе этот металл. Элемент играет роль в синтезе важных гормонов, таких как тестостерон и инсулин. Элемент крайне необходим для полноценного функционирования мужских половых органов. Кстати, он даже помогает нам справиться с сильным похмельем. С его помощью выводится из нашего организма лишний алкоголь.
Недостаток цинка в рационе может привести к множеству нарушений функций организма. Такие люди подвержены депрессии, постоянной усталости, нервозности. Дневная норма для взрослого мужчины — 11 миллиграммов в день, для женщины — 8 миллиграмм.
Содержание в продуктах (в миллиграммах на 100 грамм продукта):
- устрицы — 40 мг;
- отруби — 16 мг;
- семена тыквы — 10 ;
- печень говяжья — 8 мг;
- говядина — 8 мг;
- баранина — 6 мг;
- семена подсолнуха — 5 мг;
- сыр — 4 мг;
- овёс — 4 мг;
- курица — 3 мг;
- орехи грецкие — 3 мг;
- фасоль — 3 мг;
- свинина — 3 мг;
- шоколад — 2 мг;
- кукуруза — 0,5 мг;
- бананы — 0,15 мг.
Избыток элемента в человеческом организме также приводит к серьёзным проблемам, поэтому не стоит хранить продукты в цинковой посуде.
youtube.com/embed/A8xF6StYy9I?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/> Цинк
— хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Эссенциальный (незаменимый) микроэлемент тканей человека. По количественному соотношению в организме занимает второе, после железа, место. Ему принадлежит ключевая роль в регенерации поврежденных тканей, так как без цинка нарушается синтез нуклеиновых кислот и белка.
Смотрите так же:
СВОЙСТВА
При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). Имеет низкую температуру плавления. Объем металла при плавлении увеличивается в соответствии со снижением плотности. С повышением температуры уменьшается кинетическая вязкость и электропроводность цинка и возрастает его удельное электрическое сопротивление. При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
Плавление смесей и твёрдых растворов
У сплавов, как правило, нет определённой температуры плавления; процесс их плавления происходит в конечном диапазоне температур. На диаграммах состояния «температура — относительная концентрация» имеется конечная область сосуществования жидкого и твёрдого состояния, ограниченная кривыми ликвидуса и солидуса. Аналогичная ситуация имеет место и в случае многих твёрдых растворов.
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
ЗАПАСЫ И ДОБЫЧА
Среднее содержание цинка в земной коре — 8,3·10 -3 %, в основных извержённых породах его несколько больше (1,3·10 -2 %), чем в кислых (6·10 -3 %). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»
Читать также: Графитовый тигель своими руками
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
ПРОИСХОЖДЕНИЕ
Цинк в природе как самородный металл не встречается. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
ПРИМЕНЕНИЕ
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.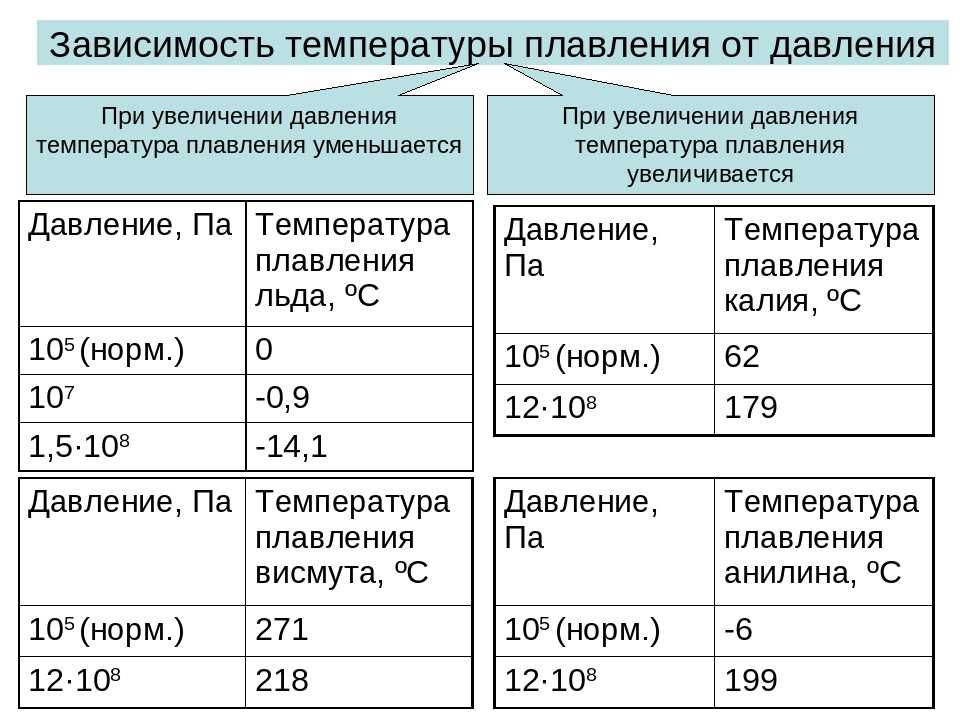
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Жидкий металл: подводные камни. Взгляд глазами химика
Написать эту статью меня сподвиг пост NotSlow Не так страшен жидкий металл. Там все просто: подстраховался от замыкания, нанес тонким слоем, прикрутил и радуйся низким температурам. Но так ли все хорошо на самом деле? Для начала нужно выяснить, что это за жидкий металл такой. Среди чистых металлов единственный, который может быть жидким при комнатной температуре — это ртуть. В здравом уме никто сейчас не станет применять ртуть в качестве термоинтерфейса из-за ее крайней токсичности и испаряемости. Два других становятся жидкими уже при температуре человеческого тела — это цезий и галлий. Цезий — это «фтор наоборот» по своей химической активности, он возгорается и взрывается от малейших следов воздуха и влаги и даже разрушает стекло. Остается галлий (на КПДВ именно он). При комнатной температуре галлий все же твердый, однако с некоторыми другими легкоплавкими металлами он образует эвтектики, плавящиеся при 20,5°С (галлий-олово) и даже 15,3 °С (галлий-индий).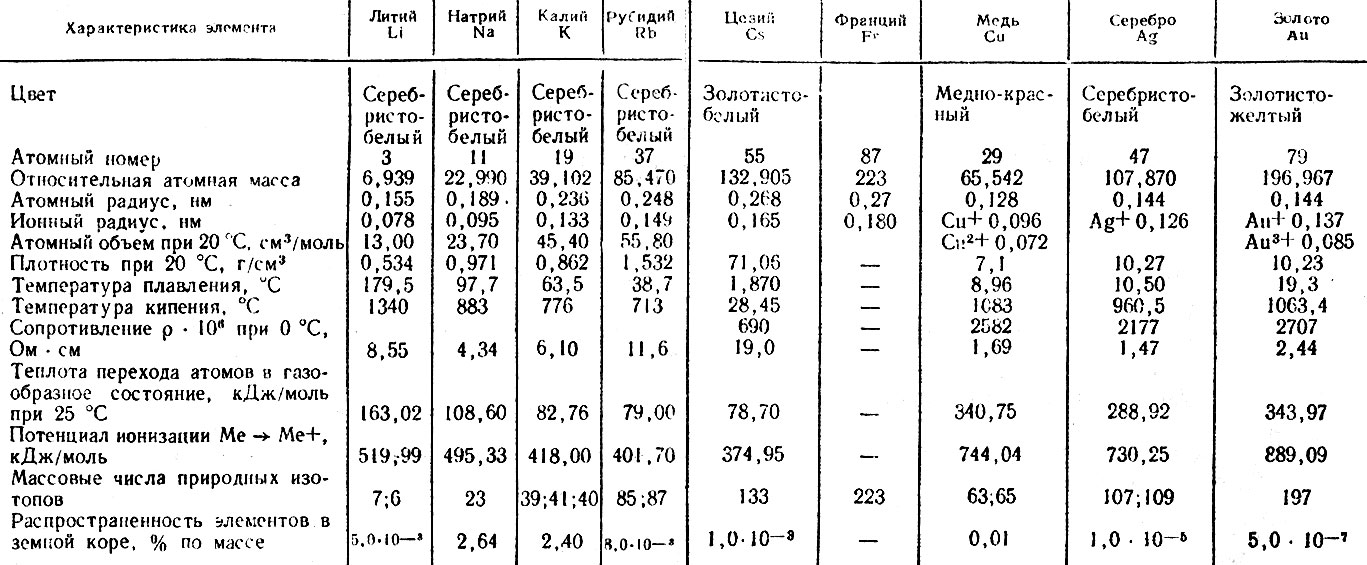 Еще ниже — в районе 5 °С — плавится тройная эвтектика галлий-индий-олово (62, 25 и 13% соответственно). Имеющиеся в продаже термоинтерфейсы типа «жидкий металл» — это как раз и есть сплавы на основе этих трех элементов, возможно с некоторыми дополнительными присадками.
Еще ниже — в районе 5 °С — плавится тройная эвтектика галлий-индий-олово (62, 25 и 13% соответственно). Имеющиеся в продаже термоинтерфейсы типа «жидкий металл» — это как раз и есть сплавы на основе этих трех элементов, возможно с некоторыми дополнительными присадками.
Исходя из этого, ясны и подводные камни. Первый из них — это абсолютная несовместимость галлийсодержащих сплавов с алюминием
!
Во времена, когда уроки химии в школе непременно сопровождались демонстрацией опытов, был среди них и опыт по амальгамированию алюминия. Алюминий покрывали слоем ртути и он тотчас начинал бурно окисляться, рассыпаясь прямо на глазах. Ртуть защищала алюминий от образования оксидного слоя и он образовывался уже на поверхности амальгамы, но не был способен остановить окисление, так как на поверхности жидкости он не удерживался сплошным слоем, растрескивался, и в трещинах открывалась свежая, неокисленная поверхность амальгамы.
Ровно так же действует и галлиевый сплав с той только разницей, что он способен буквально пропитывать алюминий насквозь, проникая в межкристаллитные промежутки. Алюминий, пропитанный жидким галлием, не только окисляется на глазах, но еще и крошится в руках. Так что ЖМ следует держать от алюминия подальше. И это касается не только алюминиевых радиаторов: случайная капелька «жидкого металла» может уничтожить и корпус ноутбука, если тот из алюминиевого сплава, и любую другую алюминиевую деталь. Хотя бы корпус какого-нибудь конденсатора. Причем капелька эта является классическим катализатором — делает свое черное дело, не расходуясь сама.
Алюминий, пропитанный жидким галлием, не только окисляется на глазах, но еще и крошится в руках. Так что ЖМ следует держать от алюминия подальше. И это касается не только алюминиевых радиаторов: случайная капелька «жидкого металла» может уничтожить и корпус ноутбука, если тот из алюминиевого сплава, и любую другую алюминиевую деталь. Хотя бы корпус какого-нибудь конденсатора. Причем капелька эта является классическим катализатором — делает свое черное дело, не расходуясь сама.
Но и медь к галлию небезразлична. На рисунке выше я привел T-x диаграмму системы медь-галлий (из справочника «Диаграммы состояния двойных металлических систем» под ред. Лякишева), на которой видно бесчисленное множество интерметаллических соединений. Как только галлий вступит в контакт с медью, они тут же начинают образовываться. Жидкий галлий (к его сплавам это тоже относится) вообще очень охотно смачивает и металлы, и неметаллы, а явное химическое сродство этому крайне способствует. Так что «жидкий металл» будет просто впитываться в медь, образуя на границе между металлами корку интерметаллидов. Последние не являются металлами с физической точки зрения, они тугоплавки, хрупки и обладают плохой тепло- и электропроводностью, но главное — «жидкий металл» будет расходоваться на их образование и просто уйдет из зазора. Многие из тех, кто пробовал в деле ЖМ, сообщают, что со временем он перестает работать, и сняв радиатор, они обнаружили, что жидкий металл «испарился». Испариться он не мог — заметное давление пара у его компонентов появляется только свыше тысячи градусов — он просто впитался в медь, прореагировал с ней. Устранить это явление помогает никелевое покрытие на меди, хоть оно и является дополнительным препятствием для тепла.
Последние не являются металлами с физической точки зрения, они тугоплавки, хрупки и обладают плохой тепло- и электропроводностью, но главное — «жидкий металл» будет расходоваться на их образование и просто уйдет из зазора. Многие из тех, кто пробовал в деле ЖМ, сообщают, что со временем он перестает работать, и сняв радиатор, они обнаружили, что жидкий металл «испарился». Испариться он не мог — заметное давление пара у его компонентов появляется только свыше тысячи градусов — он просто впитался в медь, прореагировал с ней. Устранить это явление помогает никелевое покрытие на меди, хоть оно и является дополнительным препятствием для тепла.
Кстати, впитываемость галлия и его сплавов в металлы еще касается паяных соединений — помните про ту маленькую капельку, которая может разрушить алюминиевый корпус? Так вот, такая же капелька, попавшая на припой, сделает и его хрупкой, а пайку ненадежной. В какой-то момент это «сработает». Поэтому лично я бы держал «жидкий металл» как можно дальше от любой электроники.
И последнее, о чем следовало бы написать: «жидкий металл», увы, небезвреден. Галлий по некоторым данным сравним по токсичности с мышьяком, второй его компонент, индий — также является токсичным тяжелым металлом. В отличие от ртути сплавы на основе галлия все же абсолютно нелетучи при обычной температуре, так что отравиться их парами не получится, однако из-за своей способности легко прилипать ко всему на свете эти сплавы невероятно мазучие. Испачкать ими, к примеру, руки — легче легкого, а отмыть их до конца очень сложно. Потом это все попадет в рот. Поэтому — работаем с «жидким металлом» и всем, что с ним контактировало только в резиновых перчатках и отдельно от еды, питья и курения
. И да, никогда не делайте так, как на КПДВ!
Температура плавления алюминия. Узнайте точные значения
Алюминий — это техническое название алюминия , который представляет собой химический элемент, принадлежащий к группе металлов. Интересно, что алюминий является третьим по распространенности элементом в земной коре — его весовое содержание составляет 8,13 % (сразу после кислорода — 46,1 % и кремния — 27,72 %). Алюминий — очень популярный строительный материал, но он также используется во многих других отраслях экономики. Сегодня мы проверим, при какой температуре плавится алюминий и каковы его общие физико-химические свойства.
Алюминий — очень популярный строительный материал, но он также используется во многих других отраслях экономики. Сегодня мы проверим, при какой температуре плавится алюминий и каковы его общие физико-химические свойства.
Температура плавления алюминия
Алюминий плавится при 660,32°С . Температура кипения этого элемента составляет целых 2519°С.
Можно ли плавить алюминий в домашних условиях? На самом деле это возможно, но довольно требовательно. Прежде всего следует иметь в виду, что этот элемент легко окисляется (пассивируется и покрывается слоем трехокиси алюминия), поэтому процесс переплавки следует проводить в защитной атмосфере.Таким образом, рассматриваемое покрытие придает алюминию коррозионную стойкость при нормальных условиях эксплуатации.
Интересен тот факт, что из алюминия делают емкости для хранения азотной кислоты. При контакте с этой кислотой она подвергается сильной пассивации и становится устойчивой к ее коррозионному воздействию.
Свойства алюминия
Алюминий
отличается прежде всего малой плотностью и высокой пластичностью. Не вызывает проблем при литье и последующей обработке (не образует искр).Он хорошо проводит электрический ток, но хуже по своим механическим свойствам. Для усиления конструкций из алюминия применяют различные легирующие добавки. Интересен тот факт, что чистый алюминий отлично отражает видимый свет (99%) и инфракрасное излучение (95%).
В связи с тем, что чистый алюминий не обладает удовлетворительными механическими свойствами, обычно используются различные типы сплавов. Сочетание других металлов и алюминия делает все это дело даже в несколько раз прочнее.Интересно, что некоторые алюминиевые сплавы отлично подходят как для литья, так и для формовки. К наиболее популярным алюминиевым потолкам относится фехраль (хромаль), т.е. сочетание железа, хрома и алюминия – особенностью этого сплава является его стойкость к окислению и сере.
К сожалению, несмотря на хорошие механические свойства, алюминиевые сплавы обладают худшей коррозионной стойкостью по сравнению с чистым металлом. Это связано с тем, что чистый алюминий вступает в реакцию с кислородом воздуха и естественным образом покрывается белым налетом – оксидом алюминия.Добавление других ингредиентов ухудшает эти свойства – особенно неблагоприятны медь и кремний.
Это связано с тем, что чистый алюминий вступает в реакцию с кислородом воздуха и естественным образом покрывается белым налетом – оксидом алюминия.Добавление других ингредиентов ухудшает эти свойства – особенно неблагоприятны медь и кремний.
Фото: en.freepik.com
Главный редактор Joblife.pl
Уже 11 лет он занимается созданием специализированного консультативного контента. Его знания получены из многоязычных информационных каналов и научных энциклопедий.Лично я любитель горных путешествий и энтузиаст маркетинга.
.
Температура плавления некоторых металлов, их сплавов и сталей в градусах Цельсия.
Температура плавления некоторых металлов и их сплавов и сталей в градусах Цельсия.
| Металл | Температура плавления |
|---|---|
| Латунь (Cu-69%, Zn 30%, Sn-1%) | 900 – 940 |
| Алюминий | 660 |
| Алюминиевые сплавы | 463 – 671 |
| Алюминиевая бронза | 600 – 655 |
| Сурьма | 630 |
| Берилл | 1285 |
| Медный берилл | 865 – 955 |
| Висмут | 271. 4 4 |
| Латунь | 1000 – 930 |
| Кадмий | 321 |
| Серый чугун | 1175 – 1290 |
| Хром | 1860 |
| Кобальт | 1495 |
| Медь | 1084 |
| Мельхиор | 1170 – 1240 |
| Золото, 24К | 1063 |
| Хастеллой С | 1320 – 1350 |
| Инконель | 1390 – 1425 |
| Инколой | 1390 – 1425 |
| Иридий – Иридий | 2450 |
| Кованое железо | 1482 – 1593 |
| Чугун, серый чугун | 1127 – 1204 |
| Ковкий чугун | 1149 |
| Свинец | 327,5 |
| Магний | 650 |
| Магниевые сплавы | 349 – 649 |
| Марганец | 1244 |
| Марганцево-коричневый | 865 – 890 |
| Меркурий | 90 015-38.|
| Молибден | 2620 |
| Монель | 1300 – 1350 |
| Никель | 1453 |
| Ниобий (колумбий) | 2470 |
| Осм | 3025 |
| Палладий | 1555 |
| Люминофор | 44 |
| Платина | 1770 |
| Плутон | 640 |
| Калий | 63.3 |
| Красная латунь | 990 – 1025 |
| Рен | 3186 |
| Стержень | 1965 |
| Рутений | 2482 |
| Селен | 217 |
| Кремний | 1411 |
| Серебро, Монета | 879 |
| Чистое серебро | 961 |
| Серебро 92,5% + надбавка | 893 |
| Натрий | 97.83 |
| Углеродистая сталь | 1425 – 1540 |
| Нержавеющая сталь | 1510 |
| Тантал | 2980 |
| Трек | 1750 |
| Олово | 232 |
| Титан | 1670 |
| Вольфрам | 3400 |
| Уран | 1132 |
| Ванадий | 1900 |
| Желтая латунь | 905 – 932 |
| Цинк | 419.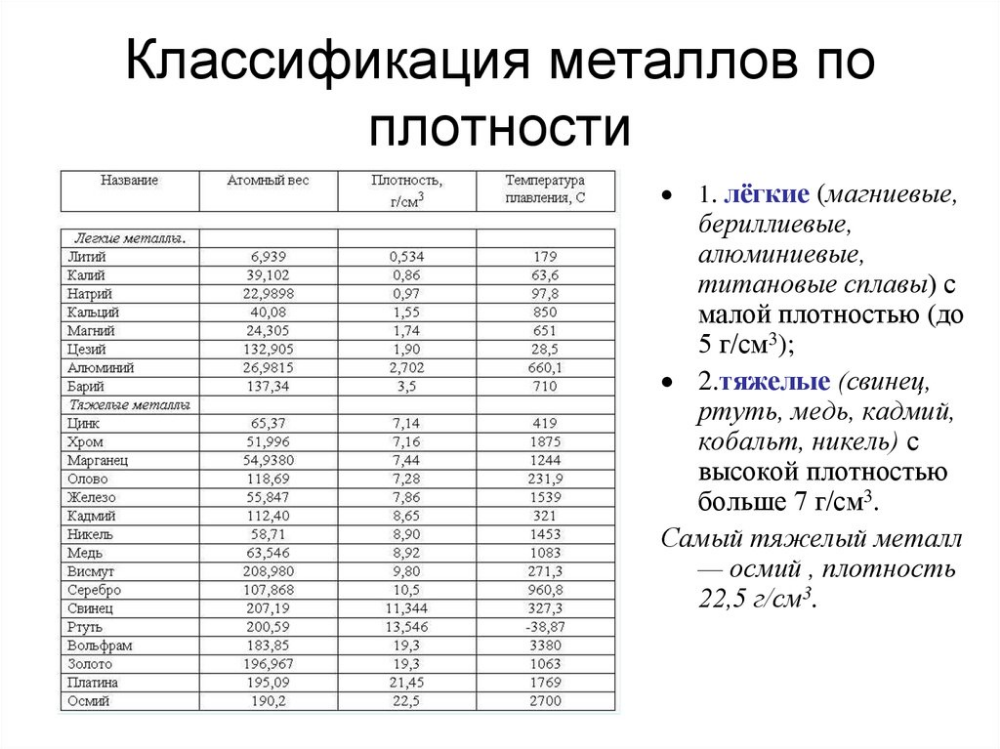 5 5 |
| Циркон | 1854 |
.
Какова температура плавления алюминия?
Алюминий — металл второго ряда и группа 13 в периодической таблице. Это третий по распространенности элемент после кислорода и кремния, который можно найти в земной коре. Алюминий встречается в природе в виде соединений, но никогда не встречается в виде чистого металла. Процесс извлечения алюминия из его соединений сложен и достаточно трудоемок. Алюминий — полезный и широко используемый металл, известный своим легким весом, пластичностью и коррозионной стойкостью.Алюминий легче переработать, чем удалить руду. Он также достаточно безопасен при контакте с кожей и использовании рядом с едой.
Какова температура плавления алюминия?
Температура плавления вещества определяется как температура, при которой вещество переходит из твердого состояния в жидкое, но при заданном атмосферном давлении. Именно при температуре плавления жидкое и твердое состояния вещества находятся в равновесии. Однако температура плавления вещества зависит главным образом от давления; в эталонных материалах он часто специфичен при стандартном давлении. Температура плавления вещества также называется ликвидусом, сжижением или солидусом. Температура плавления алюминия составляет 659 градусов Цельсия или 1218 градусов Цельсия.
Однако температура плавления вещества зависит главным образом от давления; в эталонных материалах он часто специфичен при стандартном давлении. Температура плавления вещества также называется ликвидусом, сжижением или солидусом. Температура плавления алюминия составляет 659 градусов Цельсия или 1218 градусов Цельсия.
Какова цель определения точки плавления вещества?
Температура плавления вещества является важным физическим свойством. Основной целью определения температур кипения и плавления веществ в лабораторном опыте является использование результатов для выявления в этих веществах примесей или неизвестных веществ.Точка плавления неизвестного твердого вещества может использоваться для его идентификации путем сравнения его с различными другими потенциальными твердыми веществами и их температурами плавления, благодаря чему твердое вещество может быть идентифицировано. Кроме того, цель знания температуры плавления вещества состоит в том, чтобы использовать диапазон его температур плавления, чтобы помочь определить его общую чистоту. Соответственно, чем больше интервал плавления вещества, тем менее чистым является вещество, чем больше диапазон плавления уменьшен, тем чище вещество.
Соответственно, чем больше интервал плавления вещества, тем менее чистым является вещество, чем больше диапазон плавления уменьшен, тем чище вещество.
Факторы, влияющие на температуру плавления вещества
Температура плавления вещества варьируется от одного вещества к другому. Например, в то время как кислород плавится при 218 градусах Цельсия, лед плавится при 0 градусах Цельсия, а алюминий — 219 градусов Цельсия. Следовательно, определенные вещи влияют на температуру плавления различных веществ. Факторы, влияющие на температуру плавления вещества, включают межмолекулярные силы, изменение температуры плавления ионных связей, форму молекул и размер молекул.Чистое кристаллическое соединение обычно имеет более точную температуру плавления и поэтому полностью плавится в небольшом интервале температур, не превышающем 0,5-1 градус Цельсия. Когда такое вещество содержит даже минимальное количество примесей, обычно в точках замерзания образуется углубление, свидетельствующее об увеличении ширины диапазона температур плавления. Если диапазон температур плавления превышает пять градусов, вещество загрязнено.
Если диапазон температур плавления превышает пять градусов, вещество загрязнено.
Применение алюминия
Алюминий — один из самых полезных металлов в мире.В чистом виде алюминий в основном используется в электронной промышленности для производства жестких дисков, токопроводящих дорожек на кремниевых чипах и фольги для конденсаторов. Когда металл сплавляется с другими металлами, такими как кремний, цинк, медь и магний, он становится еще прочнее. Еще одним важным применением алюминия является производство банок для напитков и пленок, используемых для консервирования пищевых продуктов, а также различных кухонных принадлежностей.
.90 000 американских ученых разработали супермет – tvp.info
Комбинация гафния, углерода и азота. В правильных пропорциях такой сплав обладает теоретически замечательными свойствами. Ученые американского Университета Брауна подсчитали, что температура плавления такого металла составит 4400 градусов Кельвина, или 4126 градусов Цельсия.
Мостик в стиле оригами.Гениальное изобретение японских инженеров
Обеспечение связью регионов, пострадавших от стихийных бедствий, является сложной задачей для служб: ее необходимо выполнять быстро, а природные условия…
увидеть больше
Если удастся создать такой сплав и он будет обладать нужными свойствами, то это будет самое тугоплавкое вещество, известное человеку.Считающаяся стойкой, сталь плавится при температуре около 1500 градусов Цельсия, золото — около 1000 градусов Цельсия, а алюминий — всего 660 градусов Цельсия.
Ученые из Университета Род-Айленда использовали компьютерное моделирование для разработки новой формулы. Теперь они надеются синтезировать такой металл и подвергнуть его дальнейшим исследованиям.
Более дешевый метод
– Преимущество компьютерного моделирования заключается в том, что различные комбинации можно опробовать с меньшими затратами.Вместо того, чтобы искать в темноте, у нас есть шанс найти решение, о котором стоит позаботиться в лаборатории, — пояснил проф. Аксель ван де Валле из Университета Брауна.
Аксель ван де Валле из Университета Брауна.
В настоящее время наиболее устойчивым к плавлению веществом является сплав гафния, тантала и углерода. Он плавится при 3526 градусах Цельсия. Эти типы металлов в основном используются в теплозащитных экранах космических аппаратов и газовых турбинах.
источник: ежедневная почта.co.uk
#металл #Останавливаться #гафний #коричневый университет #азот #золото #алюминий .
Температура плавления алюминия
Такой металл, как алюминий, очень распространен в мире. Немалое его количество содержится в организме человека, а уж в окружающем мире его еще больше. Среди материалов, из которых построены дома, а также в конструкции любого автомобиля есть некая доля алюминия.
Немалое его количество содержится в организме человека, а уж в окружающем мире его еще больше. Среди материалов, из которых построены дома, а также в конструкции любого автомобиля есть некая доля алюминия.
Нередко из этого вещества изготавливаются детали мебели. И если вдруг что-то из этого сломается, то можно либо приобрести новый товар в соответствующем магазине, либо заняться самостоятельным ремонтом изделия. В последнем случае придется плавить металл в домашних условиях, а для этого уже нужно знать о некоторых свойствах этого металла.
Для изготовления какой-либо алюминиевой конструкции вовсе не обязательно подробно изучать все характеристики вещества, но на основные моменты следует обратить свое внимание, включая знание, при какой температуре плавится алюминий.
Общая информация о процессе
В твёрдом состоянии кристаллическая решётка металла состоит из зёрен, пространственно ориентированных произвольным образом (подобные структуры именуются поликристаллическими).
В процессе плавления объём металла увеличивается. У химически чистых, он происходит быстро и при определённых температурах. Пример. Фактическая температура плавления Al (t):
- сверхчистого, с процентным содержанием Al 99,996%, равняется 660,37°С;
- при снижении доли чистого металла до 99,5, t=657°С;
- при 99,0%, t=643°С.
Резкое увеличение объёма происходит под воздействием определённого тепла, инициирующего плавление. Данная величина именуется скрытой теплотой.
Последнее способствует тому, что исходная кристаллическая структура материала теряет упорядоченность и плотность. Процесс обратим (охлаждение/нагревание).
Оксид алюминия Al2O3
Оксид алюминия Al2O3, называемый также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твердостью. Его прозрачные кристаллы, окрашенные в красный или синий цвет, представляют собой драгоценные камни — рубин и сапфир. В настоящее время рубины получают искусственно, сплавляя с глиноземом в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов — лазеров, создающих направленный пучек монохроматического излучения.
Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов — лазеров, создающих направленный пучек монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей — наждак, применяются как абразивные материалы.
Температура плавления, именуемая равновесной
Любые химически чистые металлы, включая алюминий, имеют температурную характеристику, именуемую «точка плавления». Материалы, достигая её, становятся жидкими. Для незначительных объёмов образцов алюминия переход в иное агрегатное состояние происходит настолько быстро (в плане изменения температурного режима), что измерить его можно с точностью до 0,1°С.
Обратная процедура, предусматривающая переход в твёрдое состояние, происходит при достижении «точки затвердевания». При равновесных условиях, при чисто теоретическом допущении, её значение равно температуре плавления. Фактически между этими значениями существуют незначительные разбросы.
Фактически между этими значениями существуют незначительные разбросы.
Применение металла в промышленном производстве
В естественных условиях алюминий имеет свойство образовывать тонкую оксидную пленку, что предотвращает реакции с водой и азотной кислотой (без нагрева). При разрушении пленки в результате контакта со щелочами химический элемент выступает в качестве восстановителя.
С целью предотвращения образования оксидной пленки в сплав добавляют другие металлы (галлий, олово, индий). Металл практически не подвергается коррозионным процессам. Он является востребованным материалом в различных отраслях промышленности.
Алюминий и его сплавы очень востребованы в различных сферах жизни человека.
- Алюминий считается популярным материалом для изготовления посуды, основным сырьем для авиационной и космической отрасли промышленности. Отличная электропроводность металла позволяет использовать его при напылении проводников в микроэлектронике.
- Свойство алюминия и его сплавов при низких температурах приобретать хрупкость позволяет его использовать в криогенной технике.
 Отражательная способность и дешевизна, легкость вакуумного напыления делают алюминий незаменимым материалом для изготовления зеркал.
Отражательная способность и дешевизна, легкость вакуумного напыления делают алюминий незаменимым материалом для изготовления зеркал. - Нанесение металла на поверхность деталей турбин, нефтяных платформ придают устойчивость к коррозии сплавам из стали. Для производства сероводорода применяется сульфид металла, а чистый алюминий используется в качестве восстановителя редких сплавов из оксидов.
- Химический элемент используют как компонент соединений, например, в алюминиевых бронзах, магниевых сплавах. Наряду с другими материалами его применяют для изготовления спиралей в электронагревательных приборах. Соединения металла широко применяются в стекловарении.
- В данное время чистый алюминий редко используется в качестве материала для ювелирной бижутерии, но набирает популярности его сплав с золотом, обладающий особым блеском и игрой. В Японии металл вместо серебра используется для изготовления украшений.
- В пищевой промышленности алюминий зарегистрирован в качестве добавки.
 Алюминиевые банки для пива стали популярной упаковкой для напитка с 60-х годов прошлого века. Технологическая линия предусматривает производство тары 0,33 и 0,5 л. Упаковка имеет одинаковый диаметр и отличается только высотой.
Алюминиевые банки для пива стали популярной упаковкой для напитка с 60-х годов прошлого века. Технологическая линия предусматривает производство тары 0,33 и 0,5 л. Упаковка имеет одинаковый диаметр и отличается только высотой. - Основным преимуществом упаковки перед стеклом является возможность вторичного использования материала.
- Банки для пива (газированных напитков) выдерживают давление до 6 атмосфер, имеют куполообразное, толстое дно и тонкие стенки. Особенности технологии изготовления путем вытяжки обеспечивают конструкционную прочность и надежные эксплуатационные свойства тары.
Температуры начала и завершения плавления
Эти две величины также необходимо учитывать при рассмотрении вопроса плавления металлов:
- первая, «солидус» (твёрдый) – это значение температуры, по достижению которой начинается процесс плавления;
- вторая, «ликвидус» (жидкий) – обозначает показатель, достижение которого приводит к завершению плавления.
Сплавы на основе алюминия, начинают кристаллизоваться при достижении значения, именуемого «ликвидус». Заканчивается отверждение при достижении «солидус». Между этими значениями металл находится в кашицеобразном состоянии.
Заканчивается отверждение при достижении «солидус». Между этими значениями металл находится в кашицеобразном состоянии.
Характеристика физических и технических параметров алюминия
- Алюминий относится к самым распространенным химическим элементам и характеризуется небольшим весом, мягкостью. Основные физические параметры металла, способность образовывать устойчивые к воздействию среды соединения, позволяют его использовать в различных отраслях промышленного производства.
- Металл является привлекательным материалом для работы в домашних условиях. Удельная теплота плавления алюминия составляет 390 кДж/кг, и для литейных целей расплавить его в бытовых условиях не составляет труда.
- Плавка металла может осуществляться поверхностным и внутренним нагревом. Способ внешнего теплового воздействия не требует особого оборудования и применяется в кустарных условиях.
- Алюминий, температура плавления которого зависит от чистоты соединения, давления, для перехода в жидкое состояние требует нагрева в среднем до 660 °C или 993,5°К.

- Существуют различные мнения относительно показателя температуры плавления металла в домашних условиях, но проверить их можно только на практике.
Особенности плавления силумина
Различные сплавы, имеющие широкий температурный интервал между величинами ликвидус (солидус), именуются эвтектическими. Пример. E cплавов на основе Al, в составе которых 12,5 % Si, этот диапазон сокращён до точки плавления. Именно эта температурное значение будет называться эвтектическим. Данный сплав относится к группе силуминов, обладающих литейными свойствами. Её величина составляет 577°С.
Рост процентного содержания Si приводит к снижению величины «ликвидус» от max (значение для чистого Al составляет 660°C) с величиной «солидуса» (577°С).
Среди иных легирующих материалов следует упомянуть Mg. Эвтектической температуры в 450°С можно достичь при его содержании в 18,9%. Для Gu эта температура равна 548°С. Для Mn, 658°С.
Большинство сплавов содержит три и более легирующих элемента. Поэтому рассмотренные температуры могут быть ещё ниже.
Поэтому рассмотренные температуры могут быть ещё ниже.
Процесс плавления алюминия (его сплавов), весьма сложный технологический процесс. Для получения требуемого результата следует учитывать значительное количество внешних факторов, включая различные температурные характеристики.
Процесс плавления в домашних условиях
Плавление — это довольно опасный процесс. Предварительно необходимо обязательно побеспокоиться о средствах защиты от различных ядовитых веществ, которые будут образовываться, а также подготовить литейную форму.
Средства защиты
- Не обойтись без специальных перчаток даже в том случае, если расплавить алюминий необходимо лишь единожды. Это, пожалуй, основное средство защиты, так как расплавленная масса с большой долей вероятности может попасть на руки, и тогда неминуемо на коже появится ожог, поскольку температура жидкого металла превышает 600 градусов.
- Следующая часть тела, которую также необходимо защитить от попадания горячего алюминия — глаза.
 При частой плавке не обойтись без специальной защитной маски, ну или хотя бы очков. Но лучше всего работать в костюме, который устойчив к воздействию высокой температуры в несколько сотен градусов.
При частой плавке не обойтись без специальной защитной маски, ну или хотя бы очков. Но лучше всего работать в костюме, который устойчив к воздействию высокой температуры в несколько сотен градусов. - Если необходимо получить чистый алюминий, потребуется рафинирующий флюс. И тогда работать нужно в химическом респираторе.
Выбор формы для литья
Для того, чтобы отлить алюминий, необязательно запасаться литейной формой. Достаточно лишь приобрести лист из более тугоплавкого металла — из стали, вылить на него расплавленный алюминий и подождать, пока последний затвердеет. Но для получения какой-либо детали из алюминия обязательно придется приобретать форму для литья.
Ее можно изготовить самостоятельно в домашних условиях. Для этой цели обычно используется скульптурный гипс. Он заливается в форму, затем какое-то время охлаждается. После этого в него вставляют модель и сверху кладут вторую емкость с гипсом. При этом важно не забыть проделать отверстие в гипсе с помощью какого-нибудь предмета цилиндрической формы. Через это отверстие и будет заливаться горячий алюминий.
Через это отверстие и будет заливаться горячий алюминий.
При плавлении алюминия не обойтись без так называемого тигеля: то есть емкости из тугоплавкого металла. Она может быть выполнена из фарфора, кварца, стали, чугуна. Впрочем, изготавливать тигель самостоятельно вовсе не обязательно, ведь его можно просто купить в специальном магазине. Объем тигеля зависит от того, какое количество металла требуется получить.
Использование в качестве упаковки
В каждом доме были или даже есть предметы кухонного обихода из алюминия — это ложки, чашки, поварешки, кастрюли, соковыжималки, мясорубки и многое другое. Очень популярна в кулинарном мире алюминиевая фольга, которую используют при запекании мяса и овощей или просто хранения и транспортировки пищи. Такая фольга отлично подходит для упаковки конфет, шоколада, мороженого, масла, сыра и творога.
Многие кремы и косметические средства, художественная краска (масляная, темпера, гуашь и даже акварель) упаковываются в емкость из пищевого алюминия. В них же, упаковывается и еда для космонавтов. Можно с уверенностью сказать, что алюминий, в том числе пищевой, и сплавы на его основе прочно вошли в нашу повседневную жизнь.
В них же, упаковывается и еда для космонавтов. Можно с уверенностью сказать, что алюминий, в том числе пищевой, и сплавы на его основе прочно вошли в нашу повседневную жизнь.
Алюминий пищевой широко применяется при производстве емкостей под консервы. Из-за такого распространения, ежегодно возрастает и количество алюминиевого мусора, без дела, разлагающегося на свалках.
Как сделать форму для отливки
Перед тем, как расплавить алюминий, готовят болванку для отливки. Существует несколько способов заливки жидкого расплава. Чаще используют открытый и закрытый метод. О каждом стоит рассказать подробнее.
Открытая форма
Когда плавят алюминий по открытой методике, после плавления расплав выливают в подготовленную емкость, например, жестяную банку. Алюминиевую отливку вынимают из банки в горячем виде, когда горячий расплав немного схватится сверху. Достаточно несильно постучать по емкости. Если не нужен слиток заданной геометрии, расплавленный металл выливают на любую ровную огнеупорную поверхность, он хорошо держится, не растекается, внешне напоминает ртуть.
Закрытая форма
Сложные по геометрии отливки получают в специально приготовленных формах. Она должна соответствовать параметрам детали, обычно делается разъемной. Для изготовления формы используют деталь-макет, по которому делают отливку. В качестве формующего материала используют кремнезем, он хорошо трамбуется, его несложно найти. Кремнезем заменяют:
- смесью речного песка и жидкого стекла;
- смесь песка, цемента, вместо воды добавляют тормозную жидкость;
- гипс, он удобен для сложных макетов.
Из гипса делают сплошные бесшовные формы, они одноразовые, их после застывания алюминия разбивают. Деталь-макет изготавливают из воска или пенопласта. Его помещают внутрь емкости, используемой для формы, затем заливают пустоты. Получаются ровные детали, не требующие дополнительной обработки. Когда используется гипс, его сушат в течение пары дней. Гипс боится влаги, разбухает. Он склонен к растрескиванию при высыхании. При контакте с парафином или пенопластом гипс сохраняет свою структуру, не образуется рытвин, раковин.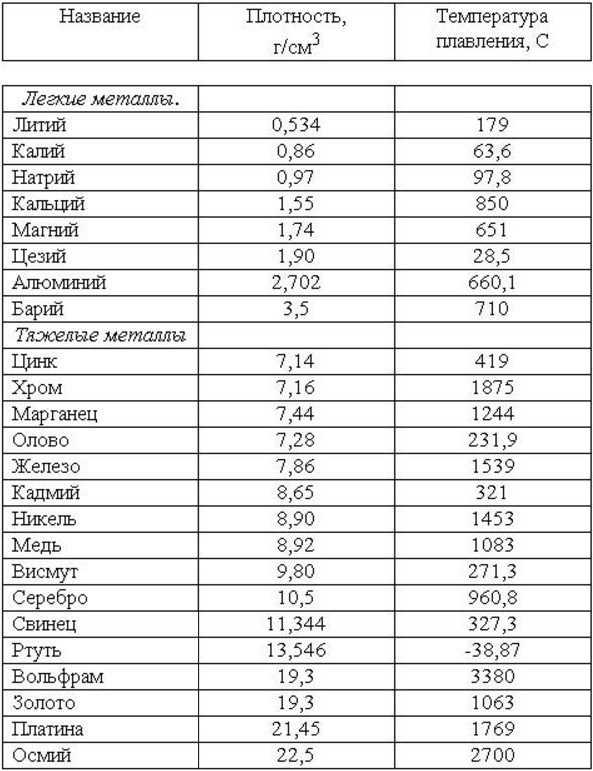
Марки металлических сплавов, включающие в себя алюминий
Также можно применять металлические сплавы, в которых имеется алюминий. К ним относятся марки АВ, АВМ, А0, АД1, АД1М, АЛ22, АЛ23, АМг22. Все эти сплавы активно используются для изготовления ложек.
Достаточно часто, на изделия из пищевого алюминия или его сплавов, должно быть впоследствии нанесено особое покрытие. Но это можно делать с маркой АМц, так как его химический состав полностью соответствует ГОСТу.
Пищевой алюминий давно и прочно вошел в наш ежедневный обиход. Нельзя найти кухню, в которой нет посуды, изготовленной из этого металла. Отзывы о нем лишь положительные, и, судя по всему, его популярность не думает падать.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее. Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов. Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов. Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Свойства сплавов металла
Показатель температурного градиента колеблется для соединений металла с другими химическими элементами, определяющими их свойства. Для литейных сплавов, содержащих магний и кремний, он составляет 500 °C.
Удельная теплота плавления определяет физическое свойство химического элемента. Для сплавов этот показатель характеризует процесс перехода из одного агрегатного состояния в другое в определенном температурном интервале.
Температура начала перехода в жидкое состояние называется точкой солидус (твердый), а окончание — ликвидус (жидкий). Соответственно начало кристаллизации будет определяться точкой ликвидус, а окончание — солидус.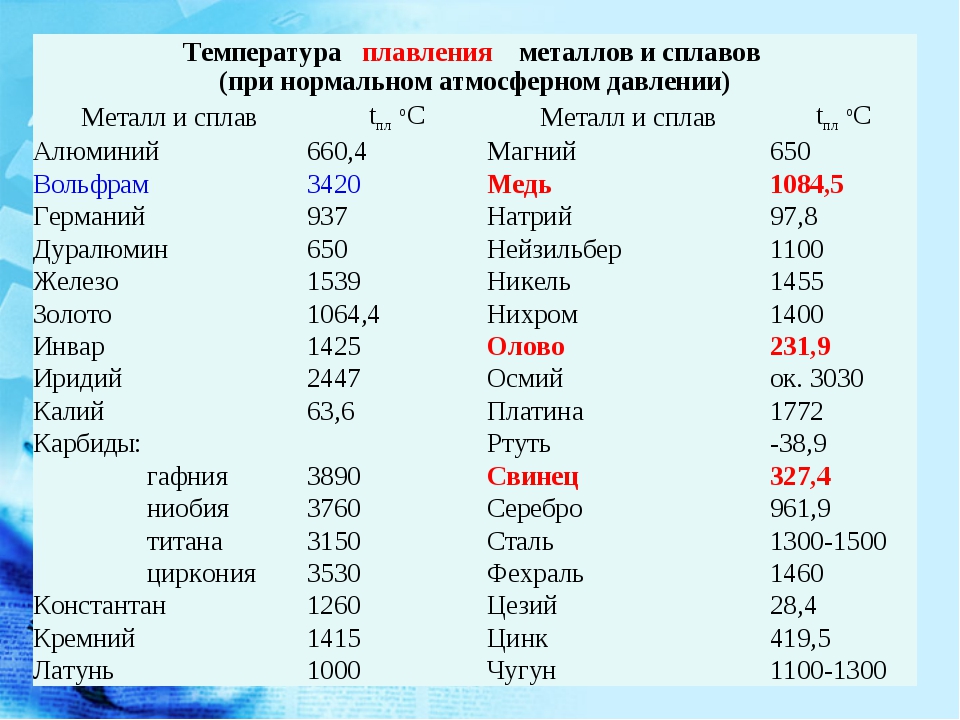 В температурном интервале соединение находится в переходном состоянии от жидкости к твердой фазе.
В температурном интервале соединение находится в переходном состоянии от жидкости к твердой фазе.
В некоторых соединениях алюминия с другими химическими элементами отсутствует интервал между температурными показателями перехода из твердого состояния в расплав. Эти сплавы называются эвтектическими.
Например, соединению алюминия с 12,5% кремния, как и чистому металлу, свойственна точка плавления, а не интервал. Этот сплав относится к литейным и характеризуется постоянной температурой 577 °C.
Оборудование и способы плавки
Прежде, чем плавить алюминий, выбирают место и способ разогрева металла. Два часто используемых варианта:
- В гаражах или домовладениях плавят алюминий, сооружается плавильня, ее составляют из кирпича без использования связующего раствора. В качестве опоры удобен металлический каркас, в нем должно быть отверстие для нагнетания воздуха, для этого используют пылесос или фен. Самодельная печь обкладывается углем.
 Емкость для плавления с ломом помещают внутрь. Для лучшего сохранения тепла кирпичи сверху накрывают листом металла.
Емкость для плавления с ломом помещают внутрь. Для лучшего сохранения тепла кирпичи сверху накрывают листом металла. - В домашних условиях для разогрева небольшого количества лома пользуются:
— газовой плитой, можно плавить небольшое количество лома, но выход расплава будет невысокий.
Литье плавят в стальной посуде. Для повышения скорости нагрева используют конструкцию из двух емкостей, их вставляют одна в другую с зазором 1 см. Дно большой посудины перфорируется, оно выполняет функцию пламярассекателя. Когда есть газовая горелка, совмещают нижний нагрев с верхним. Плавить металл можно быстрее.
Полезные советы
- Расплав должен быть горячим, чтобы форма заполнялась равномерно. Его заливают, когда он приобретает консистенцию ртути.
- Сложные по конфигурации отливки делают быстро, стараются сразу залить формы, чтобы металл не успел схватиться, не образовалось перегородок и пустот.
- В гипс металл можно заливать по воску или пенопласту, от высокой температуры воск и пенопласт выгорают.
 Поверхность отливки будет ровной.
Поверхность отливки будет ровной. - Для охлаждения отливку не опускают в воду, литье потрескается.
- При расплавлении чистого алюминия применяется технология использования защитных флюсов, они предохраняют металл от окисления.
Необходимо соблюдать противопожарную безопасность, процесс литья связан с использованием открытого пламени. Важно использовать индивидуальные средства защиты: перчатки, очки.
Источник
Физические свойства алюминия зависят от его чистоты
Основные свойства
Алюминий – химический элемент третей группы периодической системы Д.И. Менделеева.
| Плотность , (кг/м | 2,7 |
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты:
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99. 97 97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает:
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди [59,5 мкСм×м]. Более чистый алюминий [99,999 %] обладает электропроводностью, равной 65,9% от электропроводности меди.

Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия:
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×[% (Cr+V + Mn + Ti)].
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
Какая температура плавления алюминия. Температура плавления алюминия и его преобразование
ГлавнаяРазноеКакая температура плавления алюминия
Температура плавления алюминия
Алюминий – легкий металл белого цвета с серебристым оттенком, мягкий (можно согнуть руками), хорошо обрабатывается, в то же время достаточно прочный. Является отличным проводником тепла и электричества. В чистом виде алюминий почти не используется, применение его практикуется в виде сплавов с медью, углеродом, оловом, титаном, марганцем и цинком. По электро- и теплопроводности алюминий уступает только серебру и меди. В то же время примеси ванадия, хрома и марганца снижают эти показатели.
По электро- и теплопроводности алюминий уступает только серебру и меди. В то же время примеси ванадия, хрома и марганца снижают эти показатели.
Алюминий активно реагирует с кислотами и щелочами, образуя хлориды, сульфаты, алюминаты и прочие соединения. На воздухе металл моментально покрывается оксидной пленкой, которая защищает его от последующего окисления. Температура плавления алюминия находится в пределах 660,1 градусов, металл в расплавленном виде обладает хорошей жидкотекучестью. Для этого металла характерны высокая пластичность, морозостойкость, коррозионная стойкость при взаимодействии с дистиллированной и пресной водой.
Специалисты отмечают, что коррозионная стойкость зависит от чистоты алюминия – чем выше она, тем больше стойкость. Причиной коррозии могут стать поверхностные нарушения окисной пленки. Доказано, что температура плавления алюминия повышается по мере роста его чистоты. Обладая прекрасными литейными качествами, металл при кристаллизации дает большую усадку, этот показатель важен при изготовлении ответственного литья из этого металла.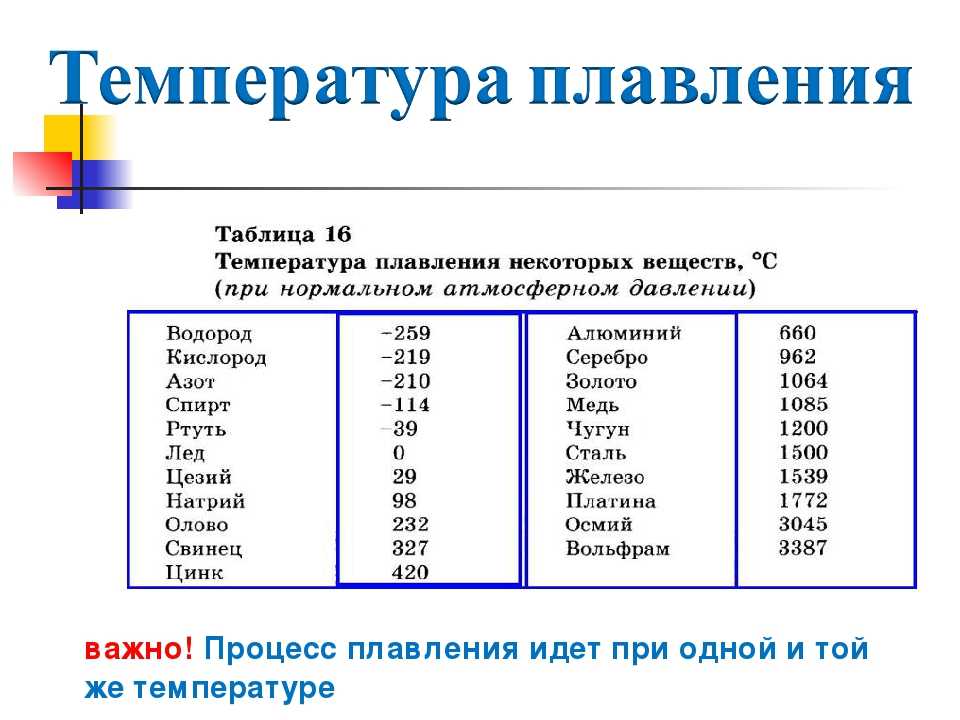
Температура плавления алюминия может колебаться в зависимости от применяемого в качестве примеси материала. Лидерами производства алюминия в настоящее время в мире являются Россия, США, Канада, Австралия. Диапазон использования алюминия достаточно большой, наши предки алюминий в виде соединений (квасцы) применяли как вяжущее средство в медицине, для дубления кож, для продления срока хранения красок.
Достаточно низкая температура плавления алюминия позволяла расплавлять его в примитивных условиях.
В природе встречается оксид алюминия (корунд), он применяется как абразивный материал, а разновидности его – сапфир и рубин – относятся к категории драгоценных камней. Так как в чистом виде алюминий малопригоден для технического применения, чаще всего его применяют как сырье для изготовления различных сплавов. Спектр алюминиевых сплавов довольно обширный, он постоянно пополняется (с применением разных технологий).
В настоящее время из таких сплавов изготавливают пищевые баллоны, бидоны, кухонную посуду и различные предметы домашнего быта.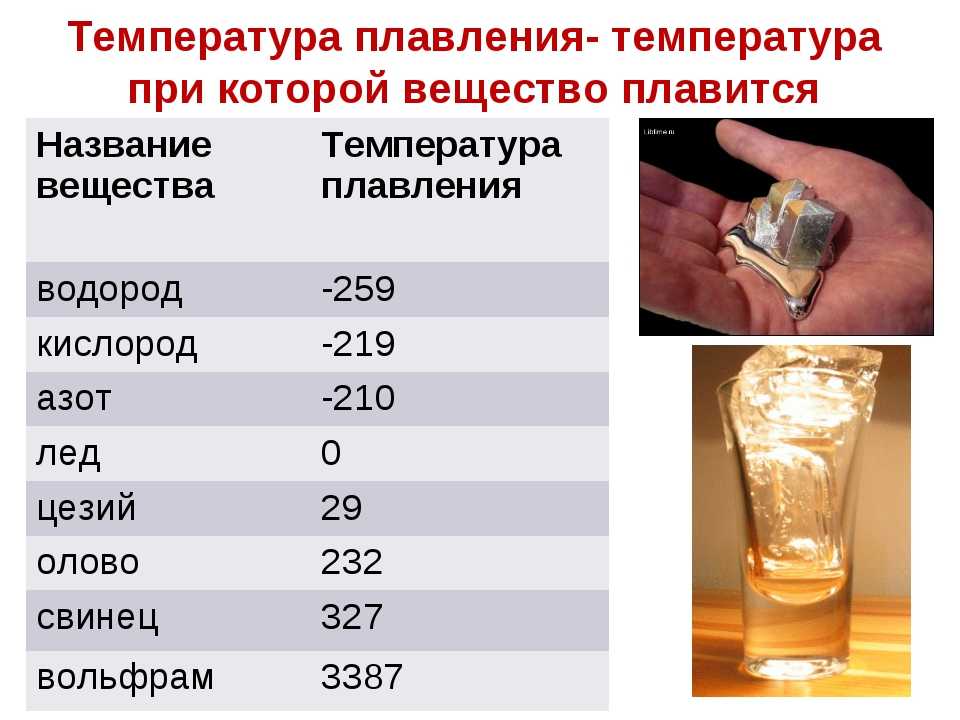 Важными потребителями алюминиевых сплавов являются автомобильная, электротехническая, приборостроительная, химическая, оборонная, металлургическая промышленности. При какой температуре плавится алюминий, учитывается при изготовлении комплектующих частей для оборонной, космической и ядерной промышленностей.
Важными потребителями алюминиевых сплавов являются автомобильная, электротехническая, приборостроительная, химическая, оборонная, металлургическая промышленности. При какой температуре плавится алюминий, учитывается при изготовлении комплектующих частей для оборонной, космической и ядерной промышленностей.
Одним из самых распространенных цветных сплавов является дюралюминий, разработан он в прошлом веке немецким инженером А. Вильмом. Температура плавления дюралюминия составила примерно 650 градусов. Сущность его изобретения заключается в том, что сплав на основе алюминия после термической обработки приобретает большую прочность и твердость. Этим незамедлительно воспользовались специалисты и его пустили на нужды воздухоплавания. Новый сплав стал одним из главных конструкционных материалов в авиастроении.
В настоящее время под понятием дюралюминий подразумевается большой выбор алюминиевых сплавов, отличающихся высокой прочностью. Современные сплавы кроме меди содержат марганец, кремний, магний и т. д., по прочности они приблизились к низкоуглеродистой стали. Сегодня эти сплавы имеют широкое применение в авиационной промышленности, при изготовлении скоростных поездов и в ряде других случаев.
д., по прочности они приблизились к низкоуглеродистой стали. Сегодня эти сплавы имеют широкое применение в авиационной промышленности, при изготовлении скоростных поездов и в ряде других случаев.
fb.ru
Температура плавления алюминия
Образование 27 мая 2012
Алюминий – легкий металл белого цвета с серебристым оттенком, мягкий (можно согнуть руками), хорошо обрабатывается, в то же время достаточно прочный. Является отличным проводником тепла и электричества. В чистом виде алюминий почти не используется, применение его практикуется в виде сплавов с медью, углеродом, оловом, титаном, марганцем и цинком. По электро- и теплопроводности алюминий уступает только серебру и меди. В то же время примеси ванадия, хрома и марганца снижают эти показатели.
Алюминий активно реагирует с кислотами и щелочами, образуя хлориды, сульфаты, алюминаты и прочие соединения. На воздухе металл моментально покрывается оксидной пленкой, которая защищает его от последующего окисления.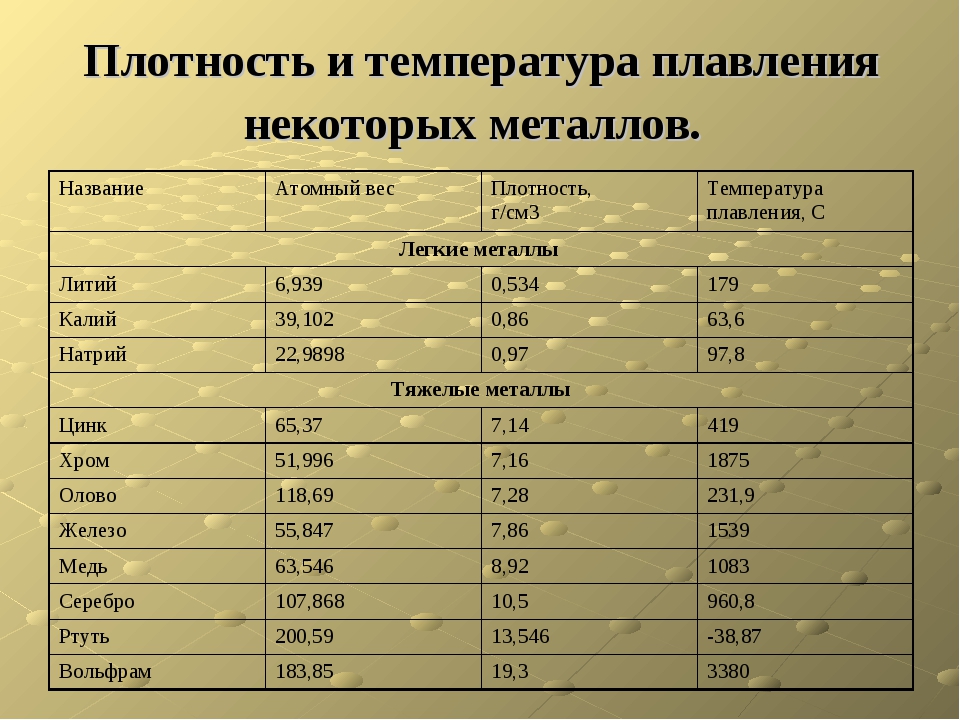 Температура плавления алюминия находится в пределах 660,1 градусов, металл в расплавленном виде обладает хорошей жидкотекучестью. Для этого металла характерны высокая пластичность, морозостойкость, коррозионная стойкость при взаимодействии с дистиллированной и пресной водой.
Температура плавления алюминия находится в пределах 660,1 градусов, металл в расплавленном виде обладает хорошей жидкотекучестью. Для этого металла характерны высокая пластичность, морозостойкость, коррозионная стойкость при взаимодействии с дистиллированной и пресной водой.
Специалисты отмечают, что коррозионная стойкость зависит от чистоты алюминия – чем выше она, тем больше стойкость. Причиной коррозии могут стать поверхностные нарушения окисной пленки. Доказано, что температура плавления алюминия повышается по мере роста его чистоты. Обладая прекрасными литейными качествами, металл при кристаллизации дает большую усадку, этот показатель важен при изготовлении ответственного литья из этого металла.
Температура плавления алюминия может колебаться в зависимости от применяемого в качестве примеси материала. Лидерами производства алюминия в настоящее время в мире являются Россия, США, Канада, Австралия. Диапазон использования алюминия достаточно большой, наши предки алюминий в виде соединений (квасцы) применяли как вяжущее средство в медицине, для дубления кож, для продления срока хранения красок.
Достаточно низкая температура плавления алюминия позволяла расплавлять его в примитивных условиях.
В природе встречается оксид алюминия (корунд), он применяется как абразивный материал, а разновидности его – сапфир и рубин – относятся к категории драгоценных камней. Так как в чистом виде алюминий малопригоден для технического применения, чаще всего его применяют как сырье для изготовления различных сплавов. Спектр алюминиевых сплавов довольно обширный, он постоянно пополняется (с применением разных технологий).
В настоящее время из таких сплавов изготавливают пищевые баллоны, бидоны, кухонную посуду и различные предметы домашнего быта. Важными потребителями алюминиевых сплавов являются автомобильная, электротехническая, приборостроительная, химическая, оборонная, металлургическая промышленности. При какой температуре плавится алюминий, учитывается при изготовлении комплектующих частей для оборонной, космической и ядерной промышленностей.
Одним из самых распространенных цветных сплавов является дюралюминий, разработан он в прошлом веке немецким инженером А. Вильмом. Температура плавления дюралюминия составила примерно 650 градусов. Сущность его изобретения заключается в том, что сплав на основе алюминия после термической обработки приобретает большую прочность и твердость. Этим незамедлительно воспользовались специалисты и его пустили на нужды воздухоплавания. Новый сплав стал одним из главных конструкционных материалов в авиастроении.
Вильмом. Температура плавления дюралюминия составила примерно 650 градусов. Сущность его изобретения заключается в том, что сплав на основе алюминия после термической обработки приобретает большую прочность и твердость. Этим незамедлительно воспользовались специалисты и его пустили на нужды воздухоплавания. Новый сплав стал одним из главных конструкционных материалов в авиастроении.
В настоящее время под понятием дюралюминий подразумевается большой выбор алюминиевых сплавов, отличающихся высокой прочностью. Современные сплавы кроме меди содержат марганец, кремний, магний и т.д., по прочности они приблизились к низкоуглеродистой стали. Сегодня эти сплавы имеют широкое применение в авиационной промышленности, при изготовлении скоростных поездов и в ряде других случаев.
Источник: fb.ru
Комментарии
Идёт загрузка…
Похожие материалы
Бизнес Полипропилен – температура плавления, свойства и характеристики
Полипропилен, температура плавления которого должна быть вам известна, если вы планируете использовать материал для личных целей, представляют собой термопластичный синтетический неполярный полимер, который относится . ..
..
Бизнес Графит: температура плавления, свойства и применение
Графит относится к минералам, которые отличаются многофункциональностью в практическом использовании. Обычно принято ассоциировать его с красящими веществами, но этим его возможности не ограничиваются. В то же время н…
Бизнес Полиэтилен: температура плавления, потребительские свойства и применение
Сегодня человечество не может обойтись без искусственных материалов. Они обладают рядом уникальных качеств, доступны и значительно удешевляют производство. Одним из таких материалов выступает полиэтилен. Температура п…
Бизнес Бронза – температура плавления. Как делаются изделия из бронзы
Бронза представляет собой сплав из меди и другого дополнительного элемента, в качестве которого чаще всего выступает олово, свинец, алюминий или кремний. В зависимости от процентного показателя данных металлов, бронза. .. Еда и напитки Температура плавления пальмового масла, особенности производства, польза и вред
.. Еда и напитки Температура плавления пальмового масла, особенности производства, польза и вред
В различных информационных источниках «пальмовая» тема муссируется неоднозначно. Предмет вопроса – полезно или вредно человеческому организму масло пальмы, ведь в нашу страну оно импортируется в огро…
Образование Полипропилена температура плавления: характеристики и свойства
Полипропилен представляет собой термопластичный полимер пропена. Его получают по технологии полимеризации пропилена при использовании металлокомплексных катализаторов. Параметры для получения этого материала схожи с т…
Образование Температура плавления алмаза, физические свойства и структура минерала
Какова температура плавления и кипения алмаза? Существует ли минерал в расплавленном виде в естественной среде? Поиском ответа на эти и другие вопросы займемся в представленном материале.Как сформировались алм. ..
..
Образование Температура плавления серы. Установки для плавления серы
Сера – один из самых распространённых элементов земной коры. Чаще всего она встречается в составе минералов, содержащих кроме неё металлы. Очень интересны процессы, происходящие при достижении температуры кипения и пл…
Образование Температура плавления золота. Температура плавления и кипения металлов
Именно физические свойства металлов по большей части определяют области их применения людьми в технике и промышленности. Среди основных характеристик немаловажное значение имеет температура их плавления. Знание данног…
Образование Температура плавления ртути. Элемент ртуть
Все химические элементы таблицы Менделеева условно разделяются диагональю B – At на металлы и неметаллы. При этом последние в меньшинстве, располагаются выше и правее границы. Металлы же в явном количественном преимущ. ..
..
monateka.com
Температура плавления алюминия и его преобразование
Температура плавления алюминия и его преобразование. Алюминий- легкий и пластичный металл серебристого цвета. Удельный вес которого 2,7*103 кг/м3, плотность 2,7 г/см3, температура плавления алюминия составляет 660,3 °C . Алюминий обладает высокой электропроводностью, коэффициент теплопроводности составляет 180 ккал/м*час*град, поэтому этот металл считается хорошим проводником электроэнергии. Теплопроводность алюминия больше в пять раз показателей чугуна и в раза три превышает показатель железа.
За счет своего состава этот металл легко раскатать в тонкий лист или же вытянуть в проволоку. На поверхности металла при воздействии с воздухом появляется оксидная пленка, которая создает препятствия окислению и обеспечивает его высокие антикоррозийные свойства. Если нагреть до высоких температур тонкий алюминий, тогда он моментально сгорит и перейдет в состояние оксид алюминия.
Припой для пайки алюминия — основа легкоплавкие материалы
Припои для пайки в основном имеют в своем составе различные химические элементы, они при взаимодействии с алюминием в основном не растворяются. Подходящими припоями для соединения алюминиевых деталей являются тугоплавкие материалы, основу их составляет алюминий и легкоплавкие материалы такие, как кадмий, олово и цинк.
Лучший припой для пайки алюминия, хорошо зарекомендовавший себя на практике, это легкоплавкий материал. При использовании таких компонентов, пайку можно делать при довольно низких температурных показателях и при этом несильно нарушается структура и свойства алюминия. Они являются лучшими припоями для алюминия. При их использовании получается неплохой результат.
Олово и кадмий имеют свои недостатки, они очень подвержены и нестойки к коррозиям и быстрому разрушению материала.
Холодная сварка для алюминия
Если вам нужно произвести мелкие ремонтные работы, то обычную сварку можно заменить, холодной сваркой для алюминия. Специальные устройства деформируют поверхность и скрепляют детали между собой, этот процесс выполняется на обезжиренных, очищенных поверхностях, в результате чего определенные связи атомом расщепляются, и происходит процесс сваривания одно заготовки с другой.
Специальные устройства деформируют поверхность и скрепляют детали между собой, этот процесс выполняется на обезжиренных, очищенных поверхностях, в результате чего определенные связи атомом расщепляются, и происходит процесс сваривания одно заготовки с другой.
Благодаря холодной сварке соединение можно произвести несколькими способами. Стыковым, шовным, а так же точечным либо при помощи клея. При всех этих методах происходит монолитное соединение, которое является очень качественным и прочным. Работать с этим материалом можно и в помещениях, так же он не требует определенной температуры и его не нужно подвергать каким-либо термически обработкам в отличие от обычной дуговой сварки.
dekormyhome.ru
Температура – плавление – алюминий
Температура – плавление – алюминий
Cтраница 1
Температура плавления алюминия составляет 660 4 С, температура кипения около 2500 С. [1]
Температура плавления алюминия колеблется в зависимости от его чистоты в границах между 657 и 660 С, а температура кипения 1800 – 2000 С. [2]
[2]
Температура плавления алюминия – 660 С, однако для достижения оптимальных условий плавления необходима t 700 – 760 С. Но лак удаляется и при более низких ( – 590 С) температурах. Определяющим является процесс плавки. Следует отметить, что можно снимать лак, нанося лом на поверхность солевого расплава с температурой – 590 С. [4]
Температура плавления алюминия равна 658 С, а разливки около 700 – 750 С. Особенностями алюминия являются его легкая окисляемость при высоких температурах и малая плотность 2 5 – 103 кг / м3 в расплавленном состоянии. [5]
Температура плавления алюминия составляет 565 – 578 С, а его оксидной пленки – около 2000 С. [6]
Температура плавления алюминия очень чувствительна к чистоте металла и для высокочистого алюминия ( 99 996 %) составляет 933 4 К ( 660 3 С), а температура начала кристаллизации алюминия по Международной шкале температур ( 1968 г.) считается равной 660 37 С и используется в течение многих десятков лет для калибровки термопар. [7]
[7]
Температура плавления алюминия значительно выше, чем свинца, поэтому заливка расплавленного алюминия в рабочий цилиндр невозможна, так как она может приводить к чрезмерному перегреву прессового инструмента и изоляции кабеля. [8]
Температура плавления алюминия ( 658 С) значительно выше температуры плавления свинца, поэтому заливка расплавленного алюминия в рабочий цилиндр невозможна, так как она может привести к чрезмерному перегреву прессового инструмента и изоляции кабеля. Чтобы избежать перегрева, в рабочий цилиндр загружают не расплавленный алюминий, а предварительно нагретые до 430 – 530 С алюминиевые цилиндрические слитки, диаметр которых меньше внутреннего отверстия цилиндра. [9]
Поскольку температура плавления алюминия равна 659 С, а коэффициент его расширения вдвое больше, чем у железа, эмали для алюминия должны быть легкоплавкими и иметь большой коэффициент термического расширения. [10]
Разность температур плавления алюминия ( 659) и его окиси приводит к тому, что в расплавленной ванне алюминия пленка окислов, находящаяся в твердом состоянии, препятствует качественному сплавлению металла. [11]
[11]
Если достигается температура плавления алюминия, реакция может протекать со взрывом. При добавлении А1С13 в СС14 индукционный период уменьшается до нуля, а скорость коррозии существенно не меняется. [13]
Действительно, температуры плавления алюминия, золота, марганца, железа, хрома, платины равны соответственно 660, 1 063, 1 260, 1 535, 1 615, 1 773 5 С; температура же кипения хрома примерно 2200, меди 2 300, а золота 2 600 С. [14]
Так как температура плавления алюминия равна 660, то получаемый алюминий также находится в расплавленном состоянии. При пропускании электрического тока алюминий выделяется на графитовой обкладке электролизера, а кислород – на угольных электродах. Образующийся расплавленный алюминий время от времени выпускают в формы через специальный канал А. Выделяющийся на анодах кислород окисляет угольные электроды до окиси углерода, поэтому эти электроды по мере сгорания их нижней части опускают вниз. [15]
Страницы: 1 2 3 4
www. ngpedia.ru
ngpedia.ru
При какой температуре плавится алюминий
В обычных условиях алюминий представляет собой белый легкий пластичный металл. Он пассивируется в воде, концентрированной азотной кислоте и растворе дихромата калия из-за образования устойчивой оксидной пленки; амальгамированный металл реагирует с водой. Реакционноспособный, сильный восстановитель. Проявляет амфотерные свойства, реагирует с разбавленными кислотами и щелочами.Температура плавления алюминия равна (это и есть ответ на вопрос «при какой температуре плавится алюминий»), так что, нагревая алюминиевую проволоку над газовой конфоркой расплавить его не удастся. Температура плавления алюминия составляет .Впервые алюминий был получен Ф. Велером в 1827 году действием металлического калия на хлорид алюминия. Однако, несмотря на широкую распространенность в природе, алюминий до конца XIX века принадлежал к числу редких металлов. . В настоящее время алюминий в громадных количествах получают из оксида алюминия электролитическим способом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный получают переработкой природного боксита.
Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный получают переработкой природного боксита.
ru.solverbook.com
Температура – плавление – алюминий
Температура – плавление – алюминий
Cтраница 4
Вследствие высоких значений теплоемкости и теплоты плавления, для нагрева алюминия до температуры плавления и перевода в расплавленное состояние требуется большая затрата тепла, чем для нагрева и расплавления такого же количества меди, хотя температура плавления алюминия ниже, чем меди. [46]
Благодаря высоким значениям теплоемкости и теплоты плавления, для нагрева алюминия до температуры плавления и перевода в расплавленное состояние требуется большая затрата тепла, чем для нагрева и расплавления такого же количества меди, хотя температура плавления алюминия ниже, чем меди. [48]
Алюминиевые сплавы и алюминий по обрабатываемости близки к жаропрочным сплавам на основе никеля: скорость съема при обработке этих сплавов на 30 – 60 % выше скоростей съема при обработке стали, что связано со сравнительно низкой температурой плавления алюминия. [49]
[49]
Вследствие высоких значений удельной теплоемкости и теплоты плавления, для нагрева алюминия до температуры плавления и перевода в расплавленное состояние требуется большая затрата тепла, чем для нагрева и расплавления такого же количества меди, хотя температура плавления алюминия ниже, чем меди. [50]
Поставленная цель достигается тем, что в способе получения алюминиевых сплавов в индукционном агрегате с продольными и поперечными каналами, включающем введение в расплав сплава легирующих добавок, содержащих компоненты с температурой выше температуры плавления алюминия, загрузку и расплавление шихты и перелив сплава в миксер, согласно изобретению, легирующие компоненты с температурой плавления выше температуры плавления алюминия дополнительно вводят в устья продольных каналов печи и миксера и создают электромагнитное поле, вращающее легирующие добавки и удерживающее их в продольных каналах печи и миксера в процессе обработки сплава. Легирующие добавки вводят в устья каналов печи одновременно с введением легирующих добавок в ванну печи, а в устья каналов миксера – перед переливом в него жидкого металла из печи. [51]
[51]
Поверхность алюминия после зачистки в течение нескольких секунд пребывания на воздухе покрывается тонкой оксидной пленкой, твердой и тугоплавкой, с большим удельным электрическим сопротивлением. Температура плавления алюминия составляет 565 – 578 С, а его оксидной пленки – около 2000 С. Зачистку контактных поверхностей алюминиевых сплавов производят наждачной шкуркой или металлической щеткой под тонким слоем кварце-вазелиновой или цинко-вазелиновой пасты. Кварцевый песок и цинк при зачистке разрушают оксидную пленку, а вазелин предохраняет контактные поверхности от повторного окисления. [52]
Поверхность алюминия после зачистки в течение нескольких секунд пребывания на воздухе покрывается тонкой окисной пленкой, твердой и тугоплавкой, с большим удельным электрическим сопротивлением. Температура плавления алюминия составляет 565 – 578 С, а его окисной пленки – около 2000 С. Зачистку контактных поверхностей алюминиевых сплавов производят наждачной шкуркой или металлической щеткой под тонким слоем квар-цево-вазелиновой или цинково-вазелиновой пасты. Кварцевый песок и цинк при зачистке разрушают окисную пленку, а вазелин предохраняет контактные поверхности от повторного окисления. [53]
Кварцевый песок и цинк при зачистке разрушают окисную пленку, а вазелин предохраняет контактные поверхности от повторного окисления. [53]
Сварка и наплавка деталей из алюминиевого сплава осложняются из-за того, что при нагревании эти сплавы интенсивно окисляются, а окислы тугоплавки. Температура плавления алюминия 657 С, а его окислов 2050 С. Пленка окислов затрудняет процесс сплавления присадочного материала с основным и препятствует выходу газов из расплавленного металла. Удаляют окислы флюсами или электродными покрытиями, растворяющими или связывающими окись алюминия. Присадочным материалом могут служить стержни того же состава, что и основной металл. [55]
Алюминий химически активен, на воздухе покрывается тончайшей ( 5 – 10 нм) оксидной пленкой, надежно защищающей металл от дальнейшего окисления. При температуре плавления алюминия 660 С гранулированный А1 не сплавляется в слиток даже при нагреве до 1200 С, так как каждая капля расплава металла оказывается как бы в мешке из оксида. Поэтому почти все реакции с участием алюминия идут с латентным ( скрытым) периодом, необходимым для разрушения оксидной пленки или диффузии реагента через нее. [56]
Поэтому почти все реакции с участием алюминия идут с латентным ( скрытым) периодом, необходимым для разрушения оксидной пленки или диффузии реагента через нее. [56]
Если только нагрев не локализован, то всегда можно ожидать коробления узла. Наконец, температура плавления алюминия гораздо ближе к точке плавления припоев, чем у большинства других основных металлов, так что необходим источник тепла, который не мог бы довести до плавления алюминий в зоне соединения. [58]
Страницы: 1 2 3 4
www.ngpedia.ru
Температура – плавление – алюминий
Температура – плавление – алюминий
Cтраница 3
Нами исследованы электролиты на основе фторидов и хлоридов алюминия в интервале температур выше и ниже температуры плавления алюминия. Рабочая температура электролиза была выбрана с превышением температуры плавления эвтектической смеси на 40 – 50 С. [31]
Наилучшей технологической свариваемостью обладают полуфабрикаты, изготовленные из брикетов, подвергнутых отжигу при температурах выше температуры плавления алюминия. [32]
[32]
С, благодаря чему рабочая температура таких проводов определяется уже не нагревостойкостью изоляции, а температурой плавления алюминия. Пониженная гибкость и значительная гигроскопичность оксидной изоляции алюминиевых проводов сильно ограничивают область их применения. Наименьший диаметр изгиба алюминиевых оксидированных проводов, не вызывающий появления трещин, равен 10 – 20-кратному диаметру провода. Применяемая с целью уменьшения гигроскопичности оксидной изоляции пропитка ее материалами, дающими нагревостойкие пленки ( кремнийорганиче-скиелаки, суспензия политетрафторэтилена), снижая гигроскопичность, снижают и нагревостойкость изоляции. [33]
В связи с этим при сварке САП, изготовленного из брикетов, подвергнутых отжигу при температуре выше температуры плавления алюминия, образование надрывов и рваных пор исключается и возможно лишь образование пор сферической формы ( см. рис. 2, в), не оказывающих существенного влияния на прочность материала. [35]
Алюминий при высоких температурах покрывается очень тонкой, обладающей хорошими защитными свойствами пленкой, устойчивой даже при температуре плавления алюминия. Однако сильное понижение механических свойств алюминия и его сплавов с повышением температуры не позволяют применять эти материалы при высоких температурах. [36]
Однако сильное понижение механических свойств алюминия и его сплавов с повышением температуры не позволяют применять эти материалы при высоких температурах. [36]
В качестве припоя применяют алюминий с присадкой кремния ( например, 7 5 % Si) для снижения температуры плавления алюминия. [37]
При дальнейшем повышении температуры отжига брикетов вплоть до температуры 660 С содержание газов в материале изменяется менее резко и выше температуры плавления алюминия остается постоянны… Это позволяет предположить, что в процессе отжига брикетов при температуре плавления алюминия происходит практически полное разложение кристал – лизационной влаги гидро – § окиси алюминия. САП, из – § готовленном из брикетов, прошедших отжиг при температуре ниже 660 С, присутствует в растворенном состоянии в алюминиевой матрице, в замкнутых не-сплошностях и находится в связанном состоянии в остатках гидроокиси алюминия. [39]
Быстрорежущая сталь дает возможность обрабатывать с практически неограниченной скоростью резания алюминий, так как предел прочности и твердость быстрорежущей стали при температуре плавления алюминия больше, чем твердость алюминия в зоне стружкооб-разования, однако будет ограничена в скорости обработка меди, никеля, стали. [40]
[40]
Ввиду того что основная трудность сварки алюминия и его сплавов заключается в образовании на его поверхности тугоплавкой оксидной пленки А12Оз ( температура ее плавления 2050 С, а температура плавления алюминия 658 С), необходимо удалить эту пленку в процессе сварки. Это удается сделать, применяя хлористые соли и фтористые соединения, в результате расплавления которых в шла ке частично растворяется оксид алюминия и удаляется вместе со шлаком. Кроме того, соединяясь с хлоридами, оксид алюминия образует легкоплавкое хлористое соединение алюминия А1С13, которое кипит при температуре 183 С и легко удаляется с поверхности металла. Сварка покрытыми электродами возможна только в нижнем положении короткой дугой постоянным током обратной полярности. [41]
При сравнении кривых относительной прочности ( см. рис. 1) и суммарного объема пустот ( рис. 3) сварных соединений можно заметить, что ход кривых, особенно в районе температуры плавления алюминия, значительно отличается. В частности, на кривой суммарного объема пустот отсутствует скачок при температуре 660 С. Это обстоятельство свидетельствует о том, что свойства сварных соединений, получаемых при сварке САП, зависят не только от суммарного объема образующихся пустот, но и от ряда других факторов. [42]
Это обстоятельство свидетельствует о том, что свойства сварных соединений, получаемых при сварке САП, зависят не только от суммарного объема образующихся пустот, но и от ряда других факторов. [42]
Министерство внутренних дел США), предназначен для выделения алюминия из отходов производства, например шлаков, а также консервных банок и другой упаковки, без использования флюсов путем нагревания выше температуры плавления алюминия, но ниже 800 С в атмосфере, инертной к расплавленному алюминию. После полного расплавления алюминия нагреваемые материалы аккуратно перемешиваются для агломерации расплавленного алюминия и осаждения его на дне сосуда. После этого алюминий удаляется, в печи остается инертный остаток. В качестве инертного газа обычно используют аргон. [43]
Следует отметить, что внутреннюю поверхность кокилей, отлитых из алюминия, покрывают оксидной анодированной жаропрочной пленкой, обеспечивающей отливку в этих кокилях деталей из металлов с температурой плавления, значительно превышающей температуру плавления алюминия, из которого изготовлен сам кокиль. [44]
[44]
Поставленная цель достигается тем, что в способе получения алюминиевых сплавов в индукционном агрегате с продольными и поперечными каналами, включающем введение в расплав сплава легирующих добавок, содержащих компоненты с температурой выше температуры плавления алюминия, загрузку и расплавление шихты и перелив сплава в миксер, согласно изобретению, легирующие компоненты с температурой плавления выше температуры плавления алюминия дополнительно вводят в устья продольных каналов печи и миксера и создают электромагнитное поле, вращающее легирующие добавки и удерживающее их в продольных каналах печи и миксера в процессе обработки сплава. Легирующие добавки вводят в устья каналов печи одновременно с введением легирующих добавок в ванну печи, а в устья каналов миксера – перед переливом в него жидкого металла из печи. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Физические свойства
Магний — металл
серебристо-белого цвета с гексагональной
решёткой, обладает металлическим
блеском; пространственная группа P
63/mmc,
параметры решётки a
= 0,32029 нм, c
= 0,52000 нм, Z
= 2. При обычных условиях поверхность
магния покрыта прочной защитной плёнкой
оксида магния MgO,
которая разрушается при нагреве на
воздухе до примерно 600 °C,
после чего металл сгорает с ослепительно
белым пламенем с образованием оксида
и нитрида магния Mg3N2.
Плотность магния при 20 °C
— 1,737 г/см³, температура плавления
металла tпл
= 651 °C,
температура кипения tкип
= 1103 °C,
теплопроводность при 20 °C
— 156 Вт/(м·К).
При обычных условиях поверхность
магния покрыта прочной защитной плёнкой
оксида магния MgO,
которая разрушается при нагреве на
воздухе до примерно 600 °C,
после чего металл сгорает с ослепительно
белым пламенем с образованием оксида
и нитрида магния Mg3N2.
Плотность магния при 20 °C
— 1,737 г/см³, температура плавления
металла tпл
= 651 °C,
температура кипения tкип
= 1103 °C,
теплопроводность при 20 °C
— 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество
Раскаленный магний реагирует с водой:
Mg + Н2О = MgO + h3↑;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + h3;
При нагревании
на воздухе магний сгорает с образованием
оксида и небольшого количества нитрида. При этом выделяется большое количество
теплоты и световой энергии.
При этом выделяется большое количество
теплоты и световой энергии.
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
5
Физические свойства
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660°C, температура кипения около 2450°C,плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В.
Легче алюминия
только щелочные и щелочноземельные
металлы (кроме бария), бериллий и магний.
Плавится алюминий тоже легко – при 600°
С (тонкую алюминиевую проволоку можно
расплавить на обычной кухонной конфорке),
зато кипит лишь при 2452° С. По
электропроводности алюминий – на 4-м
месте, уступая лишь серебру (оно на
первом месте), меди и золоту, что при
дешевизне алюминия имеет огромное
практическое значение. В таком же порядке
изменяется и теплопроводность металлов.
В высокой теплопроводности алюминия
легко убедиться, опустив алюминиевую
ложечку в горячий чай. И еще одно
замечательное свойство у этого металла:
его ровная блестящая поверхность
прекрасно отражает свет: от 80 до 93% в
видимой области спектра в зависимости
от длины волны. В ультрафиолетовой
области алюминию в этом отношении вообще
нет равных, и лишь в красной области он
немного уступает серебру (в ультрафиолете
серебро имеет очень низкую отражательную
способность).
В таком же порядке
изменяется и теплопроводность металлов.
В высокой теплопроводности алюминия
легко убедиться, опустив алюминиевую
ложечку в горячий чай. И еще одно
замечательное свойство у этого металла:
его ровная блестящая поверхность
прекрасно отражает свет: от 80 до 93% в
видимой области спектра в зависимости
от длины волны. В ультрафиолетовой
области алюминию в этом отношении вообще
нет равных, и лишь в красной области он
немного уступает серебру (в ультрафиолете
серебро имеет очень низкую отражательную
способность).
Чистый алюминий – довольно мягкий металл – почти втрое мягче меди, поэтому даже сравнительно толстые алюминиевые пластинки и стержни легко согнуть, но когда алюминий образует сплавы (их известно огромное множество), его твердость может возрасти в десятки раз.
Алюминий, химические свойства
Химически алюминий
– довольно активный металл. На воздухе
его поверхность мгновенно покрывается
плотной пленкой оксида Al2О3, которая
препятствует дальнейшему доступу
кислорода к металлу и приводит к
прекращению реакции, что обусловливает
высокие антикоррозионные свойства
алюминия. Защитная поверхностная пленка
на алюминии образуется также, если его
поместить в концентрированную азотную
кислоту.
Защитная поверхностная пленка
на алюминии образуется также, если его
поместить в концентрированную азотную
кислоту.
Характерная степень окисления алюминия +3, но благодаря наличию незаполненных 3р- и 3d-орбиталей атомы алюминия могут образовывать дополнительные донорно-акцепторные связи. Поэтому ион Al3+ с небольшим радиусом весьма склонен к комплексообразованию, образуя разнообразные катионные и анионные комплексы: AlCl4-, AlF63-, [Al(h3O)6]3+, Al(OH)4-, Al(OH)63-, Alh5- и многие другие. Известны комплексы и с органическими соединениями.
Химическая
активность алюминия весьма высока; в
ряду электродных потенциалов он стоит
сразу за магнием. На первый взгляд такое
утверждение может показаться странным:
ведь алюминиевая кастрюля или ложка
вполне устойчивы на воздухе, не разрушаются
и в кипящей воде. Алюминий, в отличие от
железа, не ржавеет. Оказывается, на
воздухе металл покрывается бесцветной
тонкой, но прочной <броней> из оксида,
которая защищает металл от окисления. Так, если внести в пламя горелки толстую
алюминиевую проволоку или пластинку
толщиной 0,5-1 мм, то металл плавится, но
алюминий не течет, так как остается в
мешочке из его оксида. Если лишить
алюминий защитной пленки или сделать
ее рыхлой (например, погружением в
раствор ртутных солей), алюминий тут же
проявит свою истинную сущность: уже при
комнатной температуре начнет энергично
реагировать с водой с выделением
водорода: 2Al + 6h3O -> 2Al(OH)3 + 3h3. На воздухе
лишенный защитной пленки алюминий прямо
на глазах превращается в рыхлый порошок
оксида: 2Al + 3O2 -> 2Al2O3. Особенно активен
алюминий в мелкораздробленном состоянии;
алюминиевая пыль при вдувании в пламя
моментально сгорает. Если смешать на
керамической пластинке алюминиевую
пыль с пероксидом натрия и капнуть на
смесь водой, алюминий также вспыхивает
и сгорает белым пламенем.
Так, если внести в пламя горелки толстую
алюминиевую проволоку или пластинку
толщиной 0,5-1 мм, то металл плавится, но
алюминий не течет, так как остается в
мешочке из его оксида. Если лишить
алюминий защитной пленки или сделать
ее рыхлой (например, погружением в
раствор ртутных солей), алюминий тут же
проявит свою истинную сущность: уже при
комнатной температуре начнет энергично
реагировать с водой с выделением
водорода: 2Al + 6h3O -> 2Al(OH)3 + 3h3. На воздухе
лишенный защитной пленки алюминий прямо
на глазах превращается в рыхлый порошок
оксида: 2Al + 3O2 -> 2Al2O3. Особенно активен
алюминий в мелкораздробленном состоянии;
алюминиевая пыль при вдувании в пламя
моментально сгорает. Если смешать на
керамической пластинке алюминиевую
пыль с пероксидом натрия и капнуть на
смесь водой, алюминий также вспыхивает
и сгорает белым пламенем.
Очень высокое
сродство алюминия к кислороду позволяет
ему <отнимать> кислород от оксидов
ряда других металлов, восстанавливая
их (метод алюминотермии). Самый известный
пример – термитная смесь, при горении
которой выделяется так много тепла, что
полученное железо расплавляется: 8Al +
3Fe3O4 -> 4Al2O3 + 9Fe. Эта реакция была открыта
в 1856 Н.Н.Бекетовым. Таким способом можно
восстановить до металлов Fe2O3, CoO, NiO, MoO3,
V2O5, SnO2, CuO, ряд других оксидов. При
восстановлении же алюминием Cr2O3, Nb2O5,
Ta2O5, SiO2, TiO2, ZrO2, B2O3 теплоты реакции
недостаточно для нагрева продуктов
реакции выше их температуры плавления.
Самый известный
пример – термитная смесь, при горении
которой выделяется так много тепла, что
полученное железо расплавляется: 8Al +
3Fe3O4 -> 4Al2O3 + 9Fe. Эта реакция была открыта
в 1856 Н.Н.Бекетовым. Таким способом можно
восстановить до металлов Fe2O3, CoO, NiO, MoO3,
V2O5, SnO2, CuO, ряд других оксидов. При
восстановлении же алюминием Cr2O3, Nb2O5,
Ta2O5, SiO2, TiO2, ZrO2, B2O3 теплоты реакции
недостаточно для нагрева продуктов
реакции выше их температуры плавления.
Алюминий легко растворяется в разбавленных минеральных кислотах с образованием солей. Концентрированная азотная кислота, окисляя поверхность алюминия, способствует утолщению и упрочнению оксидной пленки (так называемая пассивация металла). Обработанный таким образом алюминий не реагирует даже с соляной кислотой. С помощью электрохимического анодного окисления (анодирования) на поверхности алюминия можно создать толстую пленку, которую нетрудно окрасить в разные цвета.
Вытеснение алюминием
из растворов солей менее активных
металлов часто затруднено защитной
пленкой на поверхности алюминия. Эта
пленка быстро разрушается хлоридом
меди, поэтому легко идет реакция 3CuCl2 +
2Al -> 2AlCl3 + 3Cu, которая сопровождается
сильным разогревом. В крепких растворах
щелочей алюминий легко растворяется с
выделением водорода: 2Al + 6NaOH + 6Н2О ->
2Na3[Al(OH)6] + 3h3 (образуются и другие анионные
гидроксо-комплексы). Амфотерный характер
соединений алюминия проявляется также
в легком растворении в щелочах его
свежеосажденного оксида и гидроксида.
Кристаллический оксид (корунд) весьма
устойчив к действию кислот и щелочей.
При сплавлении со щелочами образуются
безводные алюминаты: Al2O3 + 2NaOH -> 2NaAlO2 +
h3O. Алюминат магния Mg(AlO2)2 – полудрагоценный
камень шпинель, обычно окрашенный
примесями в самые разнообразные цвета.
Эта
пленка быстро разрушается хлоридом
меди, поэтому легко идет реакция 3CuCl2 +
2Al -> 2AlCl3 + 3Cu, которая сопровождается
сильным разогревом. В крепких растворах
щелочей алюминий легко растворяется с
выделением водорода: 2Al + 6NaOH + 6Н2О ->
2Na3[Al(OH)6] + 3h3 (образуются и другие анионные
гидроксо-комплексы). Амфотерный характер
соединений алюминия проявляется также
в легком растворении в щелочах его
свежеосажденного оксида и гидроксида.
Кристаллический оксид (корунд) весьма
устойчив к действию кислот и щелочей.
При сплавлении со щелочами образуются
безводные алюминаты: Al2O3 + 2NaOH -> 2NaAlO2 +
h3O. Алюминат магния Mg(AlO2)2 – полудрагоценный
камень шпинель, обычно окрашенный
примесями в самые разнообразные цвета.
Бурно протекает
реакция алюминия с галогенами. Если в
пробирку с 1 мл брома внести тонкую
алюминиевую проволоку, то через короткое
время алюминий загорается и горит ярким
пламенем. Реакция смеси порошков алюминия
и иода инициируется каплей воды (вода
с иодом образует кислоту, которая
разрушает оксидную пленку), после чего
появляется яркое пламя с клубами
фиолетовых паров иода. Галогениды
алюминия в водных растворах имеют кислую
реакцию из-за гидролиза: AlCl3 + h3O ->Al(OH)Cl2
+ HCl.
Галогениды
алюминия в водных растворах имеют кислую
реакцию из-за гидролиза: AlCl3 + h3O ->Al(OH)Cl2
+ HCl.
Реакция алюминия с азотом идет только выше 800° Сс образованием нитрида AlN, с серой – при 200° С (образуется сульфид Al2S3), с фосфором – при 500° С (образуется фосфид AlP). При внесении в расплавленный алюминий бора образуются бориды состава AlB2 и AlB12 – тугоплавкие соединения, устойчивые к действию кислот. Гидрид (AlH)х (х = 1,2) образуется только в вакууме при низких температурах в реакции атомарного водорода с парами алюминия. Устойчивый в отсутствие влаги при комнатной температуре гидрид Alh4 получают в растворе безводного эфира: AlCl3 + LiH -> Alh4 + 3LiCl. При избытке LiH образуется солеобразныйалюмогидрид лития LiAlh5 – очень сильный восстановитель, применяющийся в органических синтезах. Водой он мгновенно разлагается: LiAlh5 + 4h3O ->LiOH + Al(OH)3 + 4h3.
6
Цветные металлы и сплавы
Подробности
- Подробности
-
Опубликовано 27.
 05.2012 13:22
05.2012 13:22 - Просмотров: 12689
Наибольшее применение в технике имеют следующие цветные металлы: медь, латунь, бронза, алюминий и его сплавы, свинец, олово, цинк.
Медь. Медь представляет собой металл красновато-розового цвета. Температура плавления меди 1083°. Медь обладает высокой электропроводностью, теплопроводностью, пластичностью и стойкостью против атмосферной коррозии. По сравнению со сталью теплопроводность и электропроводность меди выше в шесть раз.
Высокая пластичность позволяет производить прокатку ее в холодном состоянии в тонкие листы. Прочность нагартованной меди достигает 40 кг!мм2, а отожженной и литой — 18—20 кг/мм2.
Обычно применяется медь марок МО, M1, М2, МЗ, (М4) (ГОСТ 859-41), отличающихся друг от друга содержанием примесей. Наиболее чистой от примесей является медь марки МО (количество примесей 0,05%) и марки M1 (примесей 0,1%). Чем меньше примесей, тем лучше медь поддается сварке.
При нагревании свыше 600° С прочность меди резко снижается, она становится хрупкой. В жидком состоянии медь легко поглощает газы и окисляется. Это ограничивает ее применение для литых изделий, а также затрудняет сварку. Высокая теплопроводность и жидко текучесть в расплавленном состоянии также затрудняют сварку меди.
В жидком состоянии медь легко поглощает газы и окисляется. Это ограничивает ее применение для литых изделий, а также затрудняет сварку. Высокая теплопроводность и жидко текучесть в расплавленном состоянии также затрудняют сварку меди.
С понижением температуры механические свойства меди не снижаются, что позволяет применять медь в конструкциях, работающих при низкой температуре. Благодаря высокой электропроводности медь широко применяется в электропромышленности, в химическом машиностроении и других отраслях промышленности для изготовления баков, котлов, теплообменной аппаратуры и т. д.
Латунь. Латунь представляет собой сплав меди с цинком золотисто-желтого цвета. Содержание цинка в латуни 20—45%. Температура плавления латуни в зависимости от состава достигает 880— ‘950° С. С увеличением содержания цинка температура плавления понижается. Латунь достаточно хорошо сваривается и прокатывается. Изготовляется и применяется она обычно в виде листов, прутков, трубок и проволоки. Широкое применение латуни обусловливается ее меньшей стоимостью по сравнению с медью.
Широкое применение латуни обусловливается ее меньшей стоимостью по сравнению с медью.
По ГОСТ 1019-47 латуни разделяются в зависимости от их химического состава на ряд марок: томпак марок Л96 и Л90 (содержание меди 88—97%), полутомпак марок JI80 и Л85 (меди 79— 86%), латунь марок Л62, Л68 и Л70 (цифра обозначает среднее содержание меди). Кроме того, имеются алюминиевые латуни марки ЛА77-2 (меди 76—79%, алюминия в среднем до 2%), марганцовистые, железомарганцовистые и др. Такие латуни обладают повышенной прочностью и вязкостью.
Бронза. Сплавы меди с оловом, марганцем, алюминием, никелем, кремнием, бериллием и другими элементами называют бронзами. Наиболее известны оловянистые бронзы, содержащие олова от 3 до 7%. Оловянистая бронза обладает очень малой усадкой и хорошими литейными свойствами.
Бронзы применяются в промышленности, главным образом в качестве литейного материала для изготовления подшипников и деталей, работающих на трение, а также для различного рода арматуры котлов, аппаратов и т. д.
д.
Температура плавления бронзы зависит от количества в ней примесей и в среднем составляет: для оловянистых бронз 900—950 ° С, для безоловянистых — 950— 1080° С. Бронзы хорошо свариваются.
По ГОСТ 5017-49 различают следующие марки: Бр. ОФ 6,5-0,15 (олова 6—7%, фосфора 0,1—0,25%), Бр. ОФ 4-0,25 (олова 3,5— 4%, фосфора 0,2—0,3%), Бр. ОЦС-4-4-2,5 (олова 3—5%, цинка 3—5%, свинца 1,5—3,5%).
Алюминий и его сплавы. Алюминий — очень легкий металл, светло-серого, почти белого цвета. Он почти в три раза легче стали. Его удельный вес 2,7 г/см3. Алюминий имеет высокую теплопроводность и электропроводность и хорошо сопротивляется окислению благодаря тонкой, но прочной пленке окислов, защищающей его поверхность. Температура плавления алюминия 658° С. Несмотря на низкую температуру плавления, алюминий требует для расплавления большого количества тепла благодаря своей высокой удельной теплоемкости. Механические свойства чистого алюминия невысоки.
Сплавы алюминия с медью (дюралюминий), с магнием (электрон), с кремнием (силумин) и другие обладают прочностью, близкой к прочности малоуглеродистой стали.
В чистом виде алюминий применяется в электротехнике и химическом машиностроении. Алюминиевые сплавы широко применяются в промышленности в качестве литейного материала, а также в виде листового и сортового металла. Алюминий и его сплавы хорошо свариваются.
Из большого количества алюминиевых сплавов в сварных конструкциях чаще всего применяют алюминиево-марганцевый сплав АМц (содержащий до 1,6% марганца), дюралюминий (марки Д1, Д6, Д16) и др.
Все алюминиевые сплавы могут быть разделены на литейные, из которых изготовляются литые детали, и деформируемые, которые используются для изготовления полуфабрикатов прокаткой, прессованием, ковкой, штамповкой (полосы, листы, трубы и другие профили).
Литейные сплавы обозначаются АЛ1-АЛ13 (ГОСТ 2685-44) и отличаются низкими механическими свойствами (предел прочности от 12 до 28 кг/мм2у относительное удлинение от 0,5 до 9%).
Деформируемые алюминиевые оплавы (ГОСТ 4784-49) делятся на две группы: неупрочняющиеся термической обработкой (сплавы марки АМц, АМг) « упрочняющиеся (Д6, Д16, В95).
Упрочняющиеся оплавы (Д6, Д16) после термической обработки имеют предел прочности 42—46 кг/мм2 и относительное удлинение 15—17%. Такие сплавы обозначаются Д6Т, Д16Т.
При сварке указанных упрочняющихся сплавов значительный нагрев металла в зоне, расположенной рядом со швом, приводит к понижению механических свойств (предел прочности понижается до 21—22 кг/мм2).
Магний и его сплавы. Чистый магний в машиностроении не применяется. Широко применяются сплавы магния с алюминием, марганцем, цинком. Магниевые сплавы относятся к легчайшим металлам. Их удельный вес равен 1,75—1,85 г/см3. Температура плавления 648—650° С. Магниевые сплавы удовлетворительно свариваются газовой сваркой. Они могут быть как литейные (марки МЛ1-7-МЛ6, ГОСТ 2855-45), так и деформируемые (марки МА1Ч-МА5).
Цинк — металл синевато-белого цвета. Температура плавления 419° С, температура кипения 906° С. Цинк легко окисляется, пары его весьма вредны для здоровья.
Свинец отличается большим удельным весом (11,3 г/см3), малой теплопроводностью (9% от теплопроводности меди), низкой температурой плавления (325° С), малой прочностью на разрыв (1,35 кг/мм2) и значительным относительным удлинением — 50 %.
При нагревании свинец легко окисляется, покрываясь пленкой окиси с температурой плавления 850° С.
Пары и пыль свинца очень ядовиты.
Свинец и его сплавы свариваются удовлетворительно.
Олово — мягкий и вязкий металл серебристо-белого цвета; температура плавления 232° С. Для него характерна хорошая стойкость против окисления на воздухе и слабая окисляемость в воде. Применяется для лужения посуды, изготовления припоев и различных медных сплавов.
Читайте также
Добавить комментарий
Химические элементы периодической таблицы, отсортированные по температуре плавления
- Главная
- Периодическая таблица
- Химические элементы, перечисленные по температуре плавления
Элементы периодической таблицы, отсортированные по температуре плавления
нажмите на название любого элемента для дальнейших химических свойств, данных об окружающей среде или воздействии на здоровье.
Этот список содержит 118 химических элементов.
| The chemical elements of the periodic chart sorted by: | Melting- point | Name chemical element | Symbol | Atomic number | ||||||||||||
| – Name alphabetically | -272 | Гелий | Не | 2 | ||||||||||||
| – Атомный номер | -25 Hydrogen | H | 1 | |||||||||||||
| – Symbol | -249 | Neon | Ne | 10 | ||||||||||||
| – Atomic Mass | -220 | фтор | F | |||||||||||||
| – Электронигатирование | -218 | Oxygen | -218 | -218 | 0021 O | 8 | ||||||||||
| – Density | -210 | Nitrogen | N | 7 | ||||||||||||
| – Melting point | -189 | Argon | AR | 18 | ||||||||||||
| – Точка кипячения | -157 | Криптон | KR | KR | KR | KR | . 0021 36 0021 36 | |||||||||
| – Vanderwaals radius | -112 | Xenon | Xe | 54 | ||||||||||||
| – Year of discovery | -101 | Chlorine | CL | 17 | ||||||||||||
| – фабрика изобретателя | -71 | Радон | RN | 86 | RN | 86 900 | ||||||||||
| – Elements in earthcrust | -39 | Mercury | Hg | 80 | ||||||||||||
| – Elements in human body | -7 | Bromine | BR | 35 | ||||||||||||
| – Радиус Covalenz | 27 | Francium | FR | FR | FR | FR | 0043 | |||||||||
| – Ионизационная энергия | 29 | Цезий | CS | 55 | ||||||||||||
| 30 | Gallium | Ga | 31 | |||||||||||||
| 39 | Rubidium | Rb | 37 | |||||||||||||
| 44 | Phosphorus | P | 15 | |||||||||||||
| 64 | Potassium | K | 19 | |||||||||||||
| 98 | Sodium | NA | 11 | |||||||||||||
| 113 | СЕЛЛЕР | S | 16 | |||||||||||||
| 114 | 0025 | Iodine | I | 53 | ||||||||||||
| 157 | Indium | In | 49 | |||||||||||||
| 180 | Lithium | Li | 3 | |||||||||||||
| 217 | Selenium | SE | 34 | |||||||||||||
| 232 | GUN | 0021 Sn | 50 | |||||||||||||
| 254 | Polonium | Po | 84 | |||||||||||||
| 271 | Bismuth | Bi | 83 | |||||||||||||
| 302 | Астатин | на | 85 | |||||||||||||
| 303 | Thallium | TL | 8TL | 180025|||||||||||||
| 321 | Cadmium | Cd | 48 | |||||||||||||
| 327 | Lead | Pb | 82 | |||||||||||||
| 420 | Zinc | Zn | 30 | |||||||||||||
| 449 | Tellurium | TE | 52 | |||||||||||||
| 630 | 9 | |||||||||||||||
| 630 | 119 | |||||||||||||||
| 630 | 1119 | |||||||||||||||
| 630 | 119 | |||||||||||||||
| 630 | 119 | |||||||||||||||
| 630 | 19 | |||||||||||||||
. 0013 Antimony 0013 Antimony | Sb | 51 | ||||||||||||||
| 639 | Magnesium | Mg | 12 | |||||||||||||
| 640 | Neptunium | Np | 93 | |||||||||||||
| 640 | Плутоний | Pu | 94 | |||||||||||||
| 660 | 1 9 00021 Al13 | |||||||||||||||
| 700 | Radium | Ra | 88 | |||||||||||||
| 725 | Barium | Ba | 56 | |||||||||||||
| 769 | Strontium | SR | 38 | |||||||||||||
| 795 | CERIUM | CE | 1119 | CE | 11119 | CE | 111190025||||||||||
816. 8 8 | Arsenic | As | 33 | |||||||||||||
| 822 | Europium | Eu | 63 | |||||||||||||
| 824 | Ytterbium | Yb | 70 | |||||||||||||
| 827 | Нобелий | № | 102 902 | Calcium | Ca | 20 | ||||||||||
| 860 | Einsteinium | Es | 99 | |||||||||||||
| 900 | Californium | Cf | 98 | |||||||||||||
| 920 | Лантан | Ла | 57 | |||||||||||||
| 935 | 900m0014Pr | 59 | ||||||||||||||
| 937 | Germanium | Ge | 32 | |||||||||||||
| 962 | Silver | Ag | 47 | |||||||||||||
| 986 | Berkelium | BK | 97 | |||||||||||||
| 994 | Americium | AM 9 0025| 95 | | |||||||||||||
| 1010 | Neodymium | Nd | 60 | |||||||||||||
| 1050 | Actinium | Ac | 89 | |||||||||||||
| 1064 | Gold | Золото | 79 | |||||||||||||
| 1072 | Самарий | См 5 | 600200201083 | Copper | Cu | 29 | ||||||||||
| 1100 | Promethium | Pm | 61 | |||||||||||||
| 1132 | Uranium | U | 92 | |||||||||||||
| 1245 | Манганец | MN | 25 | |||||||||||||
| 1278 | ||||||||||||||||
| 1278 | 0013 Beryllium | Be | 4 | |||||||||||||
| 1311 | Gadolinium | Gd | 64 | |||||||||||||
| 1340 | Curium | Cm | 96 | |||||||||||||
| 1360 | Тербий | TB | 65 | |||||||||||||
| 1410 | Silicon | 910 | . 0021 Si 0021 Si | 14 | ||||||||||||
| 1412 | Dysprosium | Dy | 66 | |||||||||||||
| 1453 | Nickel | Ni | 28 | |||||||||||||
| 1470 | Гольмий | Ho | 67 | |||||||||||||
| 1495 | Кобальт0021 Co | 27 | ||||||||||||||
| 1522 | Erbium | Er | 68 | |||||||||||||
| 1523 | Yttrium | Y | 39 | |||||||||||||
| 1527 | Фермий | Fm | 100 | |||||||||||||
| 1535 | Железо0013 Fe | 26 | ||||||||||||||
| 1539 | Scandium | Sc | 21 | |||||||||||||
| 1545 | Thulium | Tm | 69 | |||||||||||||
| 1552 | Палладий | Pd | 46 | |||||||||||||
| 1568 | 9 0014 9 Протактиний0021 Pa | 91 | ||||||||||||||
| 1627 | Lawrencium | Lr | 103 | |||||||||||||
| 1656 | Lutetium | Lu | 71 | |||||||||||||
| 1660 | Титан | Ti | 22 | |||||||||||||
| 1750 | Торий0021 Th | 90 | ||||||||||||||
| 1772 | Platinum | Pt | 78 | |||||||||||||
| 1852 | Zirconium | Zr | 40 | |||||||||||||
| 1857 | Хром | Cr | 24 | |||||||||||||
| 1890 | 302 Ваний0021 V | 23 | ||||||||||||||
| 1966 | Rhodium | Rh | 45 | |||||||||||||
| 2150 | Hafnium | Hf | 72 | |||||||||||||
| 2200 | Технеций | Tc | 43 | |||||||||||||
| 2250 | 0021 Ru | 44 | ||||||||||||||
| 2300 | Boron | B | 5 | |||||||||||||
| 2410 | Iridium | Ir | 77 | |||||||||||||
| 2468 | Niobium | NB | 41 | |||||||||||||
| 2617 | Молибден | 9 | 0013 Mo | 42 | ||||||||||||
| 2996 | Tantalum | Ta | 73 | |||||||||||||
| 3045 | Osmium | Os | 76 | |||||||||||||
| 3180 | Рений | Re | 75 | |||||||||||||
| 3410 | 12 | 3 Вольфрам3 W | 74 | |||||||||||||
| 3500 | Carbon | C | 6 | |||||||||||||
| Mendelevium | Md | 101 | ||||||||||||||
| Rutherfordium | Рф | 104 | ||||||||||||||
| Дубний | Дб| 40025 | | ||||||||||||||
| Seaborgium | Sg | 106 | ||||||||||||||
| Bohrium | Bh | 107 | ||||||||||||||
| Hassium | Hs | 108 | ||||||||||||||
| Мейтнерий | Mt | 109 | ||||||||||||||
| 0021 Darmstadtium | Ds | 110 | ||||||||||||||
| Roentgenium | Rg | 111 | ||||||||||||||
| Coprnicium | Cn | 112 | ||||||||||||||
| Нихоний | Nh | 113 | ||||||||||||||
| Флеровиум | Fl | 114 | ||||||||||||||
| Moscovium | Mc | 115 | ||||||||||||||
| Livermorium | Lv | 116 | ||||||||||||||
| Tennessine | Ц | 117 | ||||||||||||||
| Оганесон | Ог | 118 |
Щелкните здесь: схематический обзор периодической таблицы элементов в виде диаграммы
Пожалуйста, сообщайте о любых случайных ошибках в приведенной выше статистике химических элементов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3662
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице описываются и объясняются тенденции изменения атомных и физических свойств элементов 3-го периода от натрия до аргона. Он охватывает энергию ионизации, атомный радиус, электроотрицательность, электропроводность, температуру плавления и температуру кипения.
Он охватывает энергию ионизации, атомный радиус, электроотрицательность, электропроводность, температуру плавления и температуру кипения.
Электронные структуры
В периоде 3 Периодической таблицы 3s- и 3p-орбитали заполнены электронами. Ниже приведены сокращенные электронные конфигурации для восьми элементов Периода 3:
| Na | [Не] 3s 1 |
| мг | [Не] 3s 2 |
| Ал | [Ne] 3s 2 3p x 1 |
| Си | [Ne] 3s 2 3p x 1 3p y 1 |
| Р | [Ne] 3s 2 3p x 1 3p y 1 3p z 1 |
| С | [Ne] 3s 2 3p x 2 3p y 1 3p z 1 |
| Класс | [Ne] 3s 2 3p x 2 3p y 2 3p z 1 |
| Ар | [Ne] 3s 2 3p x 2 3p y 2 3p z 2 |
В каждом случае [Ne] представляет полную электронную конфигурацию атома неона. 9-\]
9-\]
Молярная первая энергия ионизации – это энергия, необходимая для осуществления этого изменения на моль \(X\).
Характер первых энергий ионизации за период 3
Существует общая восходящая тенденция в течение всего периода, но эта тенденция нарушается уменьшением между магнием и алюминием, а также между фосфором и серой.
Объяснение закономерности
Энергия первой ионизации зависит от четырех факторов:
- заряда ядра;
- расстояние внешнего электрона от ядра;
- количество экранирования внутренними электронами;
- независимо от того, находится ли электрон на орбитали один или в паре.
Восходящий тренд: В течение всего периода 3 внешние электроны находятся на 3-уровневых орбиталях. Эти электроны находятся примерно на одинаковом расстоянии от ядра и экранируются соответствующими электронами на орбиталях с главными атомными номерами n=1 и n=2. Определяющим фактором увеличения энергии является увеличение числа протонов в ядре от натрия к аргону. Это создает большее притяжение между ядром и электронами и, таким образом, увеличивает энергию ионизации. Увеличение заряда ядра также притягивает внешние электроны к ядру, еще больше увеличивая энергию ионизации по всему периоду.
Это создает большее притяжение между ядром и электронами и, таким образом, увеличивает энергию ионизации. Увеличение заряда ядра также притягивает внешние электроны к ядру, еще больше увеличивая энергию ионизации по всему периоду.
Снижение для алюминия : Можно ожидать, что значение для алюминия будет больше, чем для магния из-за дополнительного протона. Однако этот эффект компенсируется тем фактом, что внешний электрон алюминия занимает 3p-орбиталь, а не 3s-орбиталь. 3p-электрон находится немного дальше от ядра, чем 3s-электрон, и частично экранирован 3s-электронами, а также внутренними электронами. Оба эти фактора компенсируют действие лишнего протона.
Уменьшение серы: В этом случае что-то иное, чем переход с 3s-орбитали на 3p-орбиталь, должно компенсировать эффект дополнительного протона. Экранировка (от внутренних электронов и в некоторой степени от 3s-электронов) одинакова у фосфора и серы, и электрон удаляется с одинаковой орбитали. Разница в том, что в случае серы удаляемый электрон является одним из пары 3p x 2 . Отталкивание между двумя электронами на одной и той же орбитали создает среду с более высокой энергией, из-за чего удалить электрон легче, чем предполагалось.
Разница в том, что в случае серы удаляемый электрон является одним из пары 3p x 2 . Отталкивание между двумя электронами на одной и той же орбитали создает среду с более высокой энергией, из-за чего удалить электрон легче, чем предполагалось.
Атомный радиус
На приведенной ниже диаграмме показано, как изменяется атомный радиус в период 3.
Цифры, используемые для построения этой диаграммы, основаны на:
- металлических радиусах для Na, Mg и Al;
- ковалентных радиуса для Si, P, S и Cl;
- — радиус Ван-дер-Ваальса для Ar (который не образует прочных связей).
Уместно сравнивать металлический и ковалентный радиусы, потому что они оба измеряются в тесно связанных условиях. Однако эти радиусы нельзя сравнивать с радиусом Ван-дер-Ваальса, что делает диаграмму обманчивой. Общая тенденция к уменьшению атомов по периоду не нарушается в аргоне. Для удобства и ясности аргон в данном обсуждении не рассматривается.
Объяснение тенденции
Металлический или ковалентный радиус является мерой расстояния от ядра до связывающей пары электронов. От натрия до хлора все связывающие электроны находятся на уровне 3 и экранируются электронами на первом и втором уровнях. Увеличение числа протонов в ядре по периоду сильнее притягивает связывающие электроны. Величина экранирования постоянна в течение периода 3.
Электроотрицательность
Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Фтору (наиболее электроотрицательному элементу) присваивается значение 4,0, а значения уменьшаются в сторону цезия и франция, которые являются наименее электроотрицательными, на уровне 0,7.
Тенденция
Тенденция по периоду 3 выглядит следующим образом:
Аргон не включен; поскольку он не образует ковалентных связей, его электроотрицательность нельзя определить.
Объяснение тренда
Объяснение такое же, как и для тренда атомных радиусов. Через период валентные электроны для каждого атома находятся на уровне 3. Они экранируются одними и теми же внутренними электронами. Разница только в количестве протонов в ядре. От натрия к хлору число протонов неуклонно увеличивается и, таким образом, сильнее притягивает связывающую пару.
Через период валентные электроны для каждого атома находятся на уровне 3. Они экранируются одними и теми же внутренними электронами. Разница только в количестве протонов в ядре. От натрия к хлору число протонов неуклонно увеличивается и, таким образом, сильнее притягивает связывающую пару.
Физические свойства
В этом разделе обсуждаются электропроводность, а также температуры плавления и кипения элементов 3-го периода. Для этого обсуждения необходимо понимание структуры каждого элемента.
Структуры элементов
Структуры элементов различаются в течение периода. Первые три являются металлическими, кремний представляет собой ковалентную сеть, а остальные представляют собой простые молекулы.
Три металлические конструкции
Натрий, магний и алюминий имеют металлические конструкции. В натрии в металлической связи участвует только один электрон на атом, единственный 3s-электрон. В магнии задействованы оба его внешних электрона, а в алюминии задействованы все три. Одно ключевое различие, о котором следует знать, заключается в том, как атомы упакованы в кристалле металла. Натрий имеет 8-координацию, при этом каждый атом натрия взаимодействует только с 8 другими атомами. Магний и алюминий имеют 12-координацию и поэтому упакованы более эффективно, создавая меньше пустого пространства в металлических структурах и более прочную связь в металле.
Одно ключевое различие, о котором следует знать, заключается в том, как атомы упакованы в кристалле металла. Натрий имеет 8-координацию, при этом каждый атом натрия взаимодействует только с 8 другими атомами. Магний и алюминий имеют 12-координацию и поэтому упакованы более эффективно, создавая меньше пустого пространства в металлических структурах и более прочную связь в металле.
Сетчатая ковалентная структура
Кремний имеет сетчатую ковалентную структуру, как у алмаза. Показана репрезентативная часть этой структуры:
Структура скрепляется сильными ковалентными связями во всех трех измерениях.
Четыре простые молекулярные структуры
Структуры фосфора и серы различаются в зависимости от рассматриваемого типа фосфора или серы. При этом рассматриваются белый фосфор и одна из кристаллических форм серы — ромбическая или моноклинная. Эти структуры показаны ниже:
Помимо аргона, атомы в каждой из этих молекул связаны ковалентными связями. В жидком или твердом состоянии молекулы удерживаются в непосредственной близости дисперсионными силами Ван-дер-Ваальса.
В жидком или твердом состоянии молекулы удерживаются в непосредственной близости дисперсионными силами Ван-дер-Ваальса.
Электропроводность
- Натрий, магний и алюминий являются хорошими проводниками электричества. Проводимость увеличивается от натрия к магнию и алюминию.
- Кремний — это полупроводник.
- Фосфор, сера, хлор и аргон не проводят ток.
Три металла проводят электричество, потому что делокализованные электроны (как в модели «море электронов») могут свободно перемещаться в твердом или жидком металле. Химия полупроводников для таких веществ, как кремний, выходит за рамки большинства курсов химии вводного уровня. Другие элементы не проводят электричество, потому что это простые молекулярные вещества. без свободных, делокализованных электронов..
Точки плавления и кипения
На диаграмме показано, как меняются температуры плавления и кипения элементов в течение периода. Цифры нанесены в градусах Кельвина, а не в градусах Цельсия, чтобы избежать отрицательных температур.
Металлические конструкции
Температуры плавления и кипения трех металлов повышаются из-за повышения прочности их металлических связей. Число электронов, которое каждый атом может внести в делокализованное «море электронов», увеличивается. Атомы также становятся меньше и имеют больше протонов по мере перехода от натрия к магнию и алюминию. Притяжение и, следовательно, температуры плавления и кипения увеличиваются, потому что:
- Ядра атомов заряжены более положительно.
- “Море” заряжено более отрицательно.
- “Море” постепенно приближается к ядрам и, таким образом, сильнее притягивается.
Кремний
Кремний имеет высокие температуры плавления и кипения благодаря своей сетчатой ковалентной структуре. Плавление или кипячение кремния требует разрыва прочных ковалентных связей. Из-за двух разных типов связи в кремнии и алюминии нет смысла напрямую сравнивать две температуры плавления и кипения.
Четыре молекулярных элемента
Фосфор, сера, хлор и аргон являются простыми молекулярными веществами, между молекулами которых существует только ван-дер-ваальсово притяжение. Их температуры плавления или кипения ниже, чем у первых четырех членов периода, имеющих сложное строение. Величины температур плавления и кипения полностью определяются размерами молекул, которые снова показаны для справки:
Их температуры плавления или кипения ниже, чем у первых четырех членов периода, имеющих сложное строение. Величины температур плавления и кипения полностью определяются размерами молекул, которые снова показаны для справки:
- Фосфор: Элементарный фосфор принимает тетраэдр P 4 расположение. При плавлении фосфора ковалентные связи не разрываются; вместо этого он разрушает гораздо более слабые силы Ван-дер-Ваальса между молекулами.
- Сера: Элементарная сера образует S 8 кольца атомов. Молекулы больше, чем молекулы фосфора, и, следовательно, притяжение Ван-дер-Ваальса сильнее, что приводит к более высокой температуре плавления и кипения.
- Хлор: Хлор, Cl 2 , представляет собой гораздо меньшую молекулу со сравнительно слабым ван-дер-ваальсовым притяжением, поэтому хлор будет иметь более низкую температуру плавления и кипения, чем сера или фосфор.
- Аргон: Элементарный аргон является одноатомным.
 Возможности ван-дер-ваальсова притяжения между атомами аргона очень ограничены, поэтому температуры плавления и кипения аргона снова ниже.
Возможности ван-дер-ваальсова притяжения между атомами аргона очень ограничены, поэтому температуры плавления и кипения аргона снова ниже.
Авторы и ссылки
Джим Кларк (Chemguide.co.uk)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Показать страницу Содержание
- № на стр.
- Теги
- Атомный радиус
- Электропроводность
- электроотрицательность
- Электронные конструкции
- Первая энергия ионизации
- Энергия ионизации
- металлоконструкции
- сетчатая ковалентная структура
- Период 3
- Физические свойства
- тренд
Факты о галлии | Живая наука
Кристаллы 99,999% галлия, выращенные в лаборатории (Изображение предоставлено: foobar/Creative Commons) Галлий — мягкий металл серебристого цвета, используемый в основном в электронных схемах, полупроводниках и светоизлучающих диодах (СИД). Он также полезен в высокотемпературных термометрах, барометрах, фармацевтических препаратах и тестах ядерной медицины. Элемент не имеет известной биологической ценности.
Он также полезен в высокотемпературных термометрах, барометрах, фармацевтических препаратах и тестах ядерной медицины. Элемент не имеет известной биологической ценности.
Природный элемент
В природе галлий никогда не встречается в виде свободного элемента и не может быть обнаружен в значительных количествах ни в каких минералах. Скорее, он присутствует в следовых количествах в различных соединениях, включая цинковые руды и бокситы. По весу галлий составляет около 0,0019процентов земной коры, согласно PeriodicTable.com. Однако его легко получить плавлением, и, согласно Chemicool, большая часть коммерческого галлия извлекается как побочный продукт производства алюминия и цинка. Крупнейшими производителями галлия являются Австралия, Россия, Франция и Германия.
Только факты
- Атомный номер (количество протонов в ядре): 31
- Атомный символ (в периодической таблице элементов): Ga
- Атомный вес (средняя масса атома): 69.723
- Плотность: 5,91 грамм на кубический сантиметр
- Фаза при комнатной температуре: твердая
- Температура плавления: 85,57 градусов по Фаренгейту (29,76 градусов по Цельсию)
- Температура кипения: 3,999 F (2,204 C изотопов4) 9000 атомы одного и того же элемента с разным числом нейтронов): 24, периоды полураспада которых известны
- Наиболее распространенные изотопа: Два стабильных изотопа Ga-69 (естественное содержание 60,1 процента) и Ga-71 (естественное содержание 39,9 процента).

Уникальный металл
В периодической таблице элементов галлий относится к семейству боров (группа 13). ), который включает полуметаллический бор (B) и металлы алюминий (Al), галлий, индий (In) и таллий (Tl), согласно Chemistry LibreTexts. Все пять из этих элементов имеют три электрона на внешнем энергетическом уровне.
Галлий — это постпереходный металл. Это металлические элементы, расположенные между переходными металлами и металлоидами (неметаллами) в периодической таблице. Постпереходные металлы обладают некоторыми чертами переходных металлов, но имеют тенденцию быть более мягкими и иметь более плохую проводимость. К постпереходным металлам относятся некоторые элементы семейства бора — алюминий, индий и таллий, а также олово (Sn), свинец (Pb) и висмут (Bi).
Галлий обладает уникальными свойствами. Например, хотя при комнатной температуре (около 77 F/22 C) он твердый, он все же настолько мягкий, что его можно резать ножом. Кроме того, он имеет низкую температуру плавления 85,57 F (290,76 C) — менее чем на 10 градусов выше комнатной температуры — поэтому, если бы вы взяли в руки кусок галлия, он бы буквально растаял от тепла вашей руки. Затем, если вы поставите его обратно, он снова затвердеет.
Даже при такой низкой температуре плавления температура кипения галлия довольно высока и составляет 3999 F (2204 C), что дает ему одно из самых высоких соотношений между температурой плавления и температурой кипения среди всех элементов. При низких температурах галлий представляет собой хрупкое твердое тело, которое довольно легко ломается и, подобно стеклу, разбивается раковисто (не следует естественным плоскостям разделения).
Использование
Галлий в основном используется в электронике. Фактически, около 95 процентов всего произведенного галлия используется для производства арсенида галлия (GaAs), соединения, используемого в микроволновых и инфракрасных цепях, полупроводниках и синих и фиолетовых светодиодах, согласно объяснению химии. Арсенид галлия может производить лазерный свет непосредственно из электричества и используется в солнечных панелях, в том числе в марсоходе Mars Exploration Rover. Соединение нитрида галлия (GaN) используется в качестве полупроводника в технологии Blu-ray, мобильных телефонах и датчиках давления для сенсорных переключателей.
Арсенид галлия может производить лазерный свет непосредственно из электричества и используется в солнечных панелях, в том числе в марсоходе Mars Exploration Rover. Соединение нитрида галлия (GaN) используется в качестве полупроводника в технологии Blu-ray, мобильных телефонах и датчиках давления для сенсорных переключателей.
Галлий легко связывается с большинством металлов и обычно используется для изготовления легкоплавких сплавов. Это один из четырех металлов (включая ртуть, рубидий и цезий), которые находятся в жидком состоянии при комнатной температуре или близкой к ней. Из этих четырех металлов галлий наименее реакционноспособен и наименее токсичен, что делает его наиболее безопасным и экологически чистым выбором для высокотемпературных термометров, барометров, систем теплопередачи, а также охлаждающих и нагревательных устройств.
Однако с жидким галлием довольно сложно работать, так как он прилипает к стеклу, коже и большинству других материалов (кроме графита, кварца и тефлона). Он также расширяется при замерзании, поэтому его нельзя хранить в стеклянных контейнерах.
Он также расширяется при замерзании, поэтому его нельзя хранить в стеклянных контейнерах.
Галлий также используется в некоторых фармацевтических и радиофармацевтических препаратах. Например, радиоактивный изотоп Ga-67 используется в качестве теста ядерной медицины для выявления воспаления, инфекции или рака в организме.
Нитрат галлия используется во многих фармацевтических препаратах и для лечения гиперкальциемии, заболевания, которое может привести к росту опухолей костей. Галлий также был предложен для лечения рака, инфекционных заболеваний и воспалительных заболеваний. Тем не менее, согласно Chemistry LibreTexts, воздействие большого количества галлия может вызвать раздражение горла или грудной клетки, а пары могут привести к некоторым серьезным заболеваниям.
Открытие
До открытия галлия его предсказал русский химик и изобретатель Дмитрий Менделеев, создатель периодической таблицы элементов. Он назвал отсутствующий элемент эка-алюминием, потому что знал, что в таблице Менделеева он будет находиться ниже алюминия в ячейке 31, согласно Chemicool.
Этот элемент был впервые обнаружен французским химиком Полем-Эмилем Лекоком де Буабодраном в 1875 году, который изучал спектры химических элементов в течение 15 лет (спектры — это линии, образующиеся при нагревании химических элементов), согласно объяснению химии. . Поскольку каждый элемент создает свой собственный характерный набор линий или спектров, этот метод был надежным способом идентификации элементов.
Лекок де Буабодран задался вопросом, можно ли найти элемент 31 в цинковых рудах. Цинк, имеющий атомный номер 30, находится рядом с галлием в периодической таблице. В августе 1875 г. с помощью спектроскопа Лекок де Буабодран действительно обнаружил некоторое количество галлия, но только в очень небольших количествах. Он сообщил, что спектр нового элемента состоит из узкого, хорошо видимого фиолетового луча, согласно «Объяснению химии».
Позже в том же году Лекок де Буабодран получил чистый галлий путем электролиза гидроксида галлия в гидроксиде калия, согласно данным лаборатории Джефферсона. Затем горняки передали Лекоку де Буабодрану несколько тонн цинковой руды для его исследований. Из этой руды он смог произвести несколько граммов почти чистого галлия, согласно объяснению химии. Лекок де Буабодран предложил для нового элемента название «галлий», которое происходит от латинского слова «Gallia», означающего «Франция».
Затем горняки передали Лекоку де Буабодрану несколько тонн цинковой руды для его исследований. Из этой руды он смог произвести несколько граммов почти чистого галлия, согласно объяснению химии. Лекок де Буабодран предложил для нового элемента название «галлий», которое происходит от латинского слова «Gallia», означающего «Франция».
Кто знал?
- Жидкий галлий нельзя хранить в стеклянных или металлических контейнерах, поскольку при замерзании он расширяется на 3,1 процента.
- Галлий имеет самый большой запас жидкости среди всех металлов.
- Нейтринная обсерватория в Италии использует большое количество трихлорида галлия для изучения солнечных нейтрино, образующихся на Солнце. По данным Университета Висконсин-Мэдисон, нейтрино — это частицы, созданные в первую секунду Вселенной — даже раньше атомов — и постоянно образующиеся в результате ядерных реакций Солнца и других звезд.
- В чистом виде галлий имеет ярко-серебристый цвет. В твердом состоянии он сине-серый.

- Еще одной необычной особенностью галлия является то, что он довольно легко переохлаждается. Переохлаждение – это охлаждение вещества ниже точки его замерзания без превращения его в твердое состояние.
- По данным LibreTexts, примерно 95 процентов потребления галлия приходится на электронную промышленность. Арсенид галлия и нитрид галлия составляют около 98% потребления галлия в Соединенных Штатах.
- Галлий использовался в ядерных бомбах для стабилизации кристаллической структуры.
- При нанесении на стекло галлий превращается в блестящее зеркало.
- Температура кипения галлия более чем в восемь раз превышает его температуру плавления по абсолютной шкале — наибольшее соотношение между температурой плавления и температурой кипения любого элемента.
Дополнительные ресурсы
- Лос-Аламосская национальная лаборатория: Галлий
- Лаборатория Джефферсона: Элемент Галлий
- Королевское химическое общество: галлий
Трейси Педерсен — независимый автор, который много писал на темы науки, психологии, религии и альтернативного здоровья для различных публикаций. Она также написала 14 книг по естественным наукам и множество справочников для учителей начальной школы. Она постоянно проводит мозговой штурм, как превратить вековые темы в новые и захватывающие истории.
Она также написала 14 книг по естественным наукам и множество справочников для учителей начальной школы. Она постоянно проводит мозговой штурм, как превратить вековые темы в новые и захватывающие истории.
| Старое название этой группы было «земляные металлы», так как они имеют некоторое сходство с щелочные металлы. Техническая важность с алюминием понятно. Кстати, это самый известный металл в мире. земная кора, но нет легко сделать путем «плавления». | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Без бора (B) в качестве легирующего элемента
в кремнии (Si) не было бы микроэлектроники, но основное использование бора
находится в стекольной промышленности. Бор также используется в качестве легирующего элемента в стали.
Нитрид бора (BN) так же тверд, как алмаз, и поэтому находит применение. Бор также используется в качестве легирующего элемента в стали.
Нитрид бора (BN) так же тверд, как алмаз, и поэтому находит применение. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Галлий (Ga) и индий (In) являются
видное место в так называемых полупроводниках III-V, незаменимых для оптоэлектроники
(например, лазеры и светодиоды). Индий, в частности, также необходим в количествах для
что делает «ITO», сокращение от оксида индия-олова, предпочтительным материалом, если
вам нужен светопрозрачный проводник, например. для плоскопанельных дисплеев или некоторых
виды солнечных батарей. Таллий (Tl) и его соединения ядовиты и поэтому мало используются. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица Основные данные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В случае сомнений все номера указаны для комнаты температуры | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| фкк =
лицо
центрированная кубическая; константа решетки = bcc = объемно-центрированная кубическая sc = простой кубический л.с. = простой шестигранник ГПУ = шестиугольный плотно упакованный; постоянные решетки a и c.  оп = просто орторомбический, моноклиника, триклиника тп = просто четырехугольный диаметр = алмазная структура r = тригональный или ромбовидно-треугольный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Галлий и его сюрпризы | Элемент галлия
Знакомство с галлием
Галлий хорошо известен как металл с температурой плавления чуть выше комнатной, что означает, что он может буквально плавиться в вашей руке . В элементарной форме он относительно нетоксичен, что означает, что с ним можно обращаться без тревоги, в отличие от ртути.
Но у металлического галлия много удивительных секретов. Он может образовывать невероятные сплавы с другими металлами. Он может разрушать такие металлы, как алюминий, или наделять их способностями, которые раньше были скрыты от мира — как вы увидите ниже.
Десять удивительных фактов о галлии
- Галлий расширяется при замерзании, это одно из немногих веществ, способных на это.

- Небольшое количество галлия уничтожит все, что сделано из алюминия, включая алюминиевые банки. Он также атакует сталь, делая ее очень хрупкой.
- Хотя он может расплавиться в вашей руке, он не закипит, если вы не нагреете его до 4000F — самый большой диапазон для любого элемента.
- Образует сплав с индием и оловом, который является жидкостью при температуре значительно ниже комнатной.
- Существует книга на основе галлия, которая называется Исчезающая ложка. Здесь можно посмотреть, как сделать исчезающую ложку.
- Дмитрий Менделеев, создатель периодической таблицы, известен тем, что предсказал существование и свойства элемента галлия за несколько лет до его открытия.
- Люди иногда надевают перчатки при работе с металлическим галлием — не потому, что он токсичен, а чтобы не смывать «пятна галлия». Он также окрашивает стекло.
- Как и алюминий, большинство соединений галлия довольно бесцветны.
- Как и ртуть, капля жидкого галлия в воде может имитировать «бьющееся сердце» при колебаниях между окислением и восстановлением в присутствии как окислителя, так и восстановителя.

- Галлий используется в специальных высокотемпературных термометрах из-за его высокой температуры кипения и низкой температуры плавления.
Удивительные и не очень свойства галлия
Температура плавления
Мы знаем, что галлий имеет низкую температуру плавления, 29,76 Цельсия , если быть точным. Если вы держите его в руке и пытаетесь растопить, он в конце концов растает, но это займет некоторое время, и на вашей руке останется липкий осадок. Попытка расплавить галлий в руке не очень впечатляет — но держать в руках не опасно.
Галлий и периодическая таблица
Галлий имеет атомный символ Ga и атомный номер 31. Он расположен справа от цинка и слева от германия. Галлий находится в группе 13 периодической таблицы, группе бора, и находится ниже алюминия и выше индия. Он имеет физические и химические свойства, подобные алюминию и индию, особенно индию.
Gallium’s electron configuration is 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 . Атом галлия имеет 3 валентных электрона, поэтому ион галлия +3 является наиболее распространенным. Он имеет электроотрицательность 1,81.
Атом галлия имеет 3 валентных электрона, поэтому ион галлия +3 является наиболее распространенным. Он имеет электроотрицательность 1,81.
Галлий-алюминиевый сплав
Что впечатляет, так это то, что галлий образует сплав с металлическим алюминием или фольгой. Если вы добавите алюминиевую фольгу в жидкий галлий (вы можете легко расплавить ее в горячей воде), алюминий растворится в галлии. Этот сплав может быстро реагировать с водой, производя большое количество газообразного водорода. Жидкая природа этого сплава препятствует образованию когерентного и прочного слоя оксида алюминия, который обычно предотвращает реакцию алюминия с водой. Галлий фактически диффундирует в металлическую решетку алюминия.
Реакция впечатляет, но она не настолько активна, чтобы вам приходилось беспокоиться о том, что экзотические соединения летят вам в лицо. Полученный серый суп из воды, галлия и гидроксида алюминия не особенно привлекателен — для красивой реакции вы можете проверить, как получить осадок йодида свинца.
Для получения более взрывоопасной реакции с водой попробуйте извлечь калий из банана.
Наше видео об удивительной реакции галлия, алюминиевой фольги и воды. Пожалуйста, подпишитесь на наш канал на Youtube, впереди еще много удивительных видео по химии и элементам!г. Как галлий разрушает алюминий?
Многие задаются вопросом, почему галлий разрушает алюминий? Галлий оказывает несколько эффектов на алюминий и другие металлы. Во-первых, он образует амальгаму, по сути, сплав с алюминием. Галлий проникает в пассивирующий слой оксида алюминия, образующийся на металлическом алюминии, и мешает кристаллической решетке алюминия, делая его хрупким. Это называется структурным разрушением, вызванным галлием. Ртуть оказывает такое же действие на алюминий, но поскольку ртуть токсична, этот эксперимент обычно не проводят.
Это называется структурным разрушением, вызванным галлием. Ртуть оказывает такое же действие на алюминий, но поскольку ртуть токсична, этот эксперимент обычно не проводят.
Из-за этого перевозка галлия на самолетах строго ограничена.
И последнее, но не менее важное, как упоминалось ранее, полученный сплав галлия с алюминием больше не имеет защиты пассивирующего слоя оксида алюминия – образование этого пассивирующего слоя подавляется. Он мгновенно реагирует с водой с образованием газообразного водорода, демонстрируя «истинную» реакционную способность алюминия.
Является ли галлий металлом?
Да, галлий на 100% состоит из металла. Он никогда не классифицируется как неметалл или металлоид. И это не переходный металл. – его называют постпереходным металлом.
Лучший способ увидеть его металлические свойства – это когда он находится в жидком состоянии, но без какой-либо окисленной грязи на нем.
Ядовит ли галлий?
Металлический галлий считается безопасным для игры и обращения, а также считается нетоксичным в своей элементарной форме. Соединения галлия умеренно токсичны, они не считаются опасными, но их нельзя вдыхать или принимать внутрь. Мы не рекомендуем употреблять в пищу элементарный галлий, но если случайно проглотить небольшое количество, он, скорее всего, не будет вредным.
Соединения галлия умеренно токсичны, они не считаются опасными, но их нельзя вдыхать или принимать внутрь. Мы не рекомендуем употреблять в пищу элементарный галлий, но если случайно проглотить небольшое количество, он, скорее всего, не будет вредным.
Применение галлия в современном мире
Наиболее часто галлий используется в электронике в виде арсенида галлия, GaAs, и в синих светодиодах, как нитрид галлия, GaN. Арсенид галлия обычно используется в полупроводниках, поскольку он обладает свойствами, превосходящими свойства кремния, особенно для оборонных и аэрокосмических приложений. Однако он значительно дороже кремния. Арсенид галлия часто начинается как буль, монокристаллический слиток, выращенный из расплавленного галлия и мышьяка.
SWIR-камеры — это коротковолновые инфракрасные камеры (SWIR), в которых используются датчики InGaAs. Камеры SWIR создают тепловые изображения и могут отображать изображение через стекло. Рынок этих камер, используемых для проверки широкого спектра продуктов, таких как солнечные батареи или продукты, а также системы ночного видения, быстро растет.
Группы также рассматривали возможность использования алюминиевых сплавов галлия в качестве источника водорода в качестве устойчивой возобновляемой энергии , но сделать это экономически целесообразным оказалось сложно.
Современные исследования элемента галлия
Исследователи под руководством доктора Родни Руоффа из Центра многомерных углеродных материалов в Ульсане, Южная Корея, проводят интересные исследования. Они комбинируют галлий с неметаллическими материалами, такими как алмаз, графит, графен, карбид кремния и коммерчески доступная силиконовая замазка. Включение этих «наполнителей» в галлий позволяет ему образовывать пасты или замазки. Чем больше наполнителя вы смешиваете, тем более похожим на замазку становится материал.
Эти пасты и замазки обладают несколькими полезными свойствами, включая повышенную теплопроводность (с алмазом), которую можно использовать в качестве термоинтерфейсной пасты, и защиту от электромагнитных помех. Они также смогли объединить эти наполнители со сплавами галлия и индия, которые являются жидкими при комнатной температуре.
Они также смогли объединить эти наполнители со сплавами галлия и индия, которые являются жидкими при комнатной температуре.
Интервью с доктором Бенджамином Каммингом о возможном применении их исследований по пастообразным композитам металлического галлия.
История галлия
Галлий был предсказан Менделеевым в 1871 году, который предсказал многие его свойства. Он был открыт в 1875 году французским химиком Полем Эмилем Лекоком де Буабодраном с помощью спектроскопии на цинковой руде.
Ходят слухи, что старая «салонная» уловка заключалась в том, чтобы сделать ложку из галлия и позволить ничего не подозревающему гостю использовать ее в своем горячем чае, после чего ложка расплавится. Чтобы собрать этот «трюк», потребовалось много времени и ресурсов, поэтому мы не уверены, как часто это происходило на самом деле.
Чтобы собрать этот «трюк», потребовалось много времени и ресурсов, поэтому мы не уверены, как часто это происходило на самом деле.
Химия галлия
Галлий — это металл группы элементов 3А, наряду с бором, алюминием, индием и таллием. Галлий не является переходным металлом и не полуметаллом. Его химия похожа на химию алюминия. Галлий очень медленно реагирует с соляной кислотой, медленно с серной кислотой и быстрее с азотной кислотой с образованием нитрата галлия (III). Галлий не реагирует с водой.
Соединения галлия и степени окисления
В соединениях он обычно находится в степени окисления +3, но может проявлять и степень окисления +1. Соединения галлия (I) являются сильными восстановителями.
Галлий легко реагирует с большинством сильных кислот с образованием соединений галлия (III). Хлорид, нитрат и сульфат галлия (IIII) являются распространенными соединениями галлия (III). Хлорид галлия очень агрессивен.
Реакция галлия с элементом йод с образованием йодида галлия, соединения желтого цвета, существующего в виде димера Ga 2 I 6 . Его можно восстановить с помощью элементарного галлия с образованием GaI. GaI представляет собой реактивный зеленый порошок, содержащий галлий в нулевой, +1 и +3 степени окисления.
Его можно восстановить с помощью элементарного галлия с образованием GaI. GaI представляет собой реактивный зеленый порошок, содержащий галлий в нулевой, +1 и +3 степени окисления.
Галлий растворяется в горячей концентрированной основе, такой как гидроксид натрия, с образованием иона галлата, Ga(OH) 4 – , многоатомного иона.
Галлий – свойства
- Обозначение – Ga
- Температура плавления – 29,7 °C
- Температура кипения – 2400 °C
- Плотность при -20 °C – 5,91 г/см 3
- Атомный вес – 69,723
- Атомный номер – 31
- ЭЛЕКТРОНЕГАТИВНОСТЬ – 1,81
- . конфигурация оболочки – [Ar] 3d 10 4s 2 4p 1
- Изотопы – элемент галлия имеет 31 изотоп, галлий-69 и галлий-71 встречаются в природе
- Встречается в природе в минеральном галлите1871 2 ), а также в цинковых и алюминиевых рудах
- Токсичность: Элементарный галлий считается нетоксичным.
 LD50 хлорида галлия составляет 4700 мг/кг, в пределах хлорида натрия
LD50 хлорида галлия составляет 4700 мг/кг, в пределах хлорида натрия
Где я могу купить элемент галлий?
Продажа галлия не ограничена, вы можете купить небольшое количество на ebay, amazon или на специализированных веб-сайтах. Попробуйте этот поиск.
Следите за дальнейшими статьями, в которых мы из первых рук покажем вам, на что способен галлий – даже опытные химики могут быть удивлены.
АТОМНЫЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ ПЕРИОДА 3 На этой странице описываются и объясняются тенденции изменения атомных и физических свойств элементов 3-го периода от натрия до аргона. Он охватывает энергию ионизации, атомный радиус, электроотрицательность, электропроводность, температуру плавления и температуру кипения. Эти темы освещаются в разных местах сайта, и на этой странице все просто собрано вместе со ссылками на исходные страницы, если вам нужна дополнительная информация по конкретным вопросам. Атомные свойства Электронные конструкции В периоде 3 периодической таблицы 3s и 3p орбитали заполнены электронами. Напоминаем, что сокращенные версии электронных структур для восьми элементов: .
В каждом случае [Ne] представляет полную электронную структуру атома неона. | |||||||||||||||||||||
Примечание: =Если вам не нравятся электронные структуры, обязательно перейдите по этой ссылке, прежде чем идти дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |||||||||||||||||||||
Первая энергия ионизации Первая энергия ионизации — это энергия, необходимая для удаления наиболее слабо удерживаемого электрона из одного моля газообразных атомов с образованием 1 моля газообразных ионов, каждый из которых имеет заряд 1+.
Это энергия, необходимая для осуществления этого изменения на моль X. Характер первых энергий ионизации за период 3 Обратите внимание, что общая тенденция восходящая, но она нарушается падением между магнием и алюминием, а также между фосфором и серой. Объяснение шаблона Первая энергия ионизации регулируется:
| |||||||||||||||||||||
Примечание: Если вы не уверены в причинах какого-либо из этих утверждений, вы должны перейти и прочитать страницу об энергиях ионизации, прежде чем двигаться дальше.  Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||
Восходящий тренд В течение всего периода 3 внешние электроны находятся на 3-уровневых орбиталях. Все они находятся на одинаковом расстоянии от ядра и экранируются одними и теми же электронами на первом и втором уровнях. Основное отличие заключается в увеличении количества протонов в ядре по мере перехода от натрия к аргону. Это вызывает большее притяжение между ядром и электронами и, таким образом, увеличивает энергию ионизации. На самом деле увеличение заряда ядра также притягивает внешние электроны ближе к ядру. Это еще больше увеличивает энергию ионизации по мере прохождения периода. Падение из алюминия Можно ожидать, что значение алюминия будет больше, чем значение магния из-за дополнительного протона. Компенсирует это тот факт, что внешний электрон алюминия находится на 3p-орбитали, а не на 3s. 3p-электрон немного дальше от ядра, чем 3s, и частично экранирован 3s-электронами, а также внутренними электронами. Оба эти фактора компенсируют действие лишнего протона. Падение на серу Когда вы переходите от фосфора к сере, что-то дополнительное должно компенсировать эффект дополнительного протона У фосфора и серы экранирование одинаково (от внутренних электронов и отчасти от 3s-электронов), и электрон удаляется с одинаковой орбитали. Разница в том, что в случае серы удаляемый электрон принадлежит паре 3p x 2 . Отталкивание между двумя электронами на одной и той же орбите означает, что электрон легче удалить, чем в противном случае. Атомный радиус Тренд На диаграмме показано, как изменяется атомный радиус по мере прохождения периода 3. Цифры, используемые для построения этой диаграммы, основаны на:
Справедливо сравнивать металлический и ковалентный радиусы, потому что они оба измеряются в тесно связанных условиях. Однако некорректно сравнивать их с радиусом Ван-дер-Ваальса. Общая тенденция к уменьшению размера атомов по всему периоду НЕ нарушается для аргона. Вы не сравниваете подобное с подобным. Единственная безопасная вещь, которую можно сделать, это игнорировать аргон в последующем обсуждении. | |||||||||||||||||||||
Примечание: Если вы не уверены в том, как измеряются атомные радиусы, обязательно перейдите по этой ссылке, прежде чем идти дальше. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||
Объяснение тенденции Металлический или ковалентный радиус будет мерой расстояния от ядра до связывающей пары электронов. Если вы не уверены в этом, вернитесь и перейдите по последней ссылке. От натрия до хлора все связывающие электроны находятся на уровне 3, экранируясь электронами на первом и втором уровнях. | |||||||||||||||||||||
Примечание: Возможно, вы удивитесь, почему вы не получаете дополнительного экранирования от 3s-электронов в случаях элементов от алюминия до хлора, где в связи участвуют p-электроны. В каждом из этих случаев, прежде чем произойдет связывание, существующие s- и p-орбитали реорганизуются (гибридизуются) в новые орбитали равной энергии. Когда эти атомы связаны, нет 3s-электронов как таковых. Если вы не знаете о гибридизации, просто проигнорируйте этот комментарий – он вам все равно не понадобится для целей уровня UK A. | |||||||||||||||||||||
Электроотрицательность Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Чаще всего используется шкала Полинга. Тренд Тенденция за период 3 выглядит следующим образом: Обратите внимание, что аргон не включен. Электроотрицательность — это склонность атома притягивать 92 351 связывающую 92 352 пару электронов. Поскольку аргон не образует ковалентных связей, вы, очевидно, не можете приписать ему электроотрицательность. Объяснение тенденции Тренд объясняется точно так же, как тренд атомных радиусов. По мере прохождения периода связывающие электроны всегда находятся на одном и том же уровне — уровне 3. Они всегда экранируются одними и теми же внутренними электронами. Отличие только в количестве протонов в ядре. По мере перехода от натрия к хлору количество протонов неуклонно увеличивается и, таким образом, сильнее притягивает связывающую пару. | |||||||||||||||||||||
Примечание: Если вы хотите более подробно обсудить электроотрицательность, перейдите по этой ссылке в раздел сайта, посвященный связи. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||
Физические свойства В этом разделе рассматриваются электропроводность, температуры плавления и кипения элементов. Чтобы понять их, вы должны сначала понять структуру каждого из элементов. Конструкции из элементов Структуры элементов меняются по мере прохождения периода. Первые три являются металлическими, кремний — гигантской ковалентной связью, а остальные — простыми молекулами. Три металлические конструкции Натрий, магний и алюминий имеют металлическую структуру. В натрии в металлической связи участвует только один электрон на атом — единственный 3s-электрон. | |||||||||||||||||||||
Примечание. Если вы не уверены в металлическом соединении, перед тем как продолжить, перейдите по этой ссылке. Посмотрите также на дополнительную ссылку на структуры металлов, которые вы найдете внизу этой страницы. Используйте кнопку НАЗАД (или меню GO, или файл HISTORY) в браузере, чтобы вернуться на эту страницу, когда будете готовы. | |||||||||||||||||||||
Другое отличие, о котором вам нужно знать, это то, как атомы упакованы в кристалле металла. Натрий 8-координирован – каждый атом натрия соприкасается только с 8 другими атомами. И магний, и алюминий имеют 12-координацию (хотя и немного по-разному). Это более эффективный способ упаковки атомов, что приводит к меньшему количеству неиспользуемого пространства в металлических структурах и к более прочным связям в металле. | |||||||||||||||||||||
Примечание: Если этот разговор о согласовании для вас ничего не значит, вам нужно заглянуть на страницу о металлоконструкциях, где это объясняется довольно подробно.  Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||
Гигантская ковалентная структура Кремний имеет гигантскую ковалентную структуру, как и алмаз. Крошечная часть структуры выглядит так: Структура скрепляется прочными ковалентными связями во всех трех измерениях. Четыре простые молекулярные структуры Структуры фосфора и серы различаются в зависимости от типа фосфора или серы, о которых вы говорите. Что касается фосфора, я предполагаю обычный белый фосфор. Для серы я предполагаю одну из кристаллических форм — ромбическую или моноклинную серу. Атомы в каждой из этих молекул удерживаются вместе ковалентными связями (кроме, конечно, аргона). В жидком или твердом состоянии молекулы удерживаются близко друг к другу дисперсионными силами Ван-дер-Ваальса. | |||||||||||||||||||||
Примечание: Вы найдете подробное описание дисперсионных сил Ван-дер-Ваальса, если перейдете по этой ссылке Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||||||||||
Электропроводность
Три металла, конечно, проводят электричество, потому что делокализованные электроны («море электронов») могут свободно перемещаться в твердом или жидком металле. В случае с кремнием объяснение того, как полупроводники проводят электричество, выходит за рамки курсов химии уровня A. Вы не ожидаете, что структура алмаза будет проводить электричество, но это так! Остальные не проводят электричество, потому что это простые молекулярные вещества. Точки плавления и кипения На диаграмме показано, как меняются точки плавления и кипения элементов в течение периода. Цифры нанесены в градусах Кельвина, а не в градусах Цельсия, чтобы избежать отрицательных значений. Лучше всего думать об этих изменениях с точки зрения типов структуры, о которых мы говорили выше на странице. Металлоконструкции Температуры плавления и кипения трех металлов повышаются из-за увеличения прочности металлических связей. Количество электронов, которое каждый атом может внести в делокализованное «море электронов», увеличивается. Атомы также становятся меньше и содержат больше протонов по мере перехода от натрия к магнию и алюминию. Притяжение и, следовательно, температуры плавления и кипения увеличиваются, потому что:
| |||||||||||||||||||||
Примечание: Температура кипения является лучшим показателем прочности металлических связей, чем точка плавления. Металлические связи все еще существуют в жидких металлах и не разрушаются полностью до тех пор, пока металл не закипит. Я не знаю, почему при переходе от магния к алюминию происходит такое незначительное увеличение температуры плавления. Как и следовало ожидать, температура кипения алюминия намного выше, чем у магния. Если вы столкнетесь с объяснением очень небольшого увеличения температуры плавления от магния к алюминию с точки зрения прочности металлической связи, вы должны быть очень осторожны с ним, если оно также не объясняет, почему, несмотря на это, температура кипения алюминия намного выше, чем у магния. | |||||||||||||||||||||
Кремний Кремний имеет высокие температуры плавления и кипения, потому что это гигантская ковалентная структура. Поскольку вы говорите о другом типе связи, нецелесообразно пытаться напрямую сравнивать температуры плавления и кипения кремния с алюминием. Четыре молекулярных элемента Фосфор, сера, хлор и аргон являются простыми молекулярными веществами, между молекулами которых существует только ван-дер-ваальсово притяжение. Их температуры плавления или кипения будут ниже, чем у первых четырех членов периода, имеющих гигантские структуры. Размеры точек плавления и кипения полностью определяются размерами молекул. Запомните строение молекул: Фосфор Фосфор содержит молекулы P 4 . Чтобы расплавить фосфор, вам не нужно разрывать ковалентные связи — достаточно гораздо более слабых ван-дер-ваальсовых сил между молекулами. Сера Сера состоит из S 8 колец атомов. Хлор Хлор, Cl 2 , представляет собой гораздо меньшую молекулу со сравнительно слабым ван-дер-ваальсовым притяжением, поэтому хлор будет иметь более низкую температуру плавления и кипения, чем сера или фосфор. Аргон Молекулы аргона — это всего лишь отдельные атомы аргона, Ar. Возможности ван-дер-ваальсова притяжения между ними очень ограничены, поэтому температуры плавления и кипения аргона снова ниже. | |||||||||||||||||||||
Примечание: На этой странице я описывал один атом аргона как молекулу. Это основано на старом определении слова. В настоящее время IUPAC говорит, что молекула должна иметь более одного атома. Итак, в текущем определении я не должен использовать термин для обозначения аргона. Однако исключение частиц в аргоне из термина «молекула» только усложняет ход этой страницы — например, это усложняет жизнь, если вы говорите о «молекулярных элементах» и межмолекулярных силах. | |||||||||||||||||||||


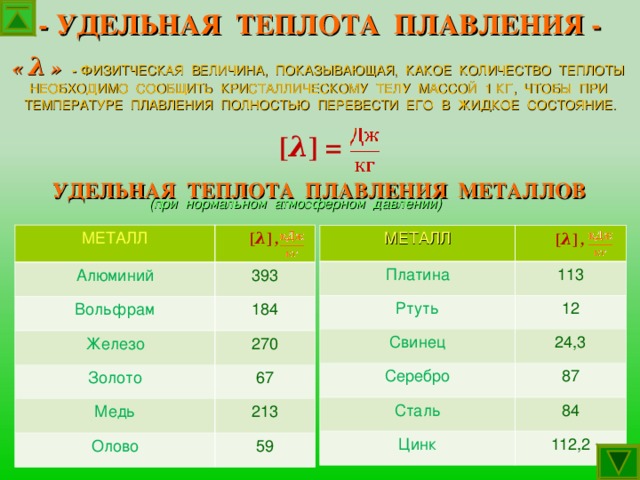 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
 86
86 Отражательная способность и дешевизна, легкость вакуумного напыления делают алюминий незаменимым материалом для изготовления зеркал.
Отражательная способность и дешевизна, легкость вакуумного напыления делают алюминий незаменимым материалом для изготовления зеркал. Алюминиевые банки для пива стали популярной упаковкой для напитка с 60-х годов прошлого века. Технологическая линия предусматривает производство тары 0,33 и 0,5 л. Упаковка имеет одинаковый диаметр и отличается только высотой.
Алюминиевые банки для пива стали популярной упаковкой для напитка с 60-х годов прошлого века. Технологическая линия предусматривает производство тары 0,33 и 0,5 л. Упаковка имеет одинаковый диаметр и отличается только высотой.
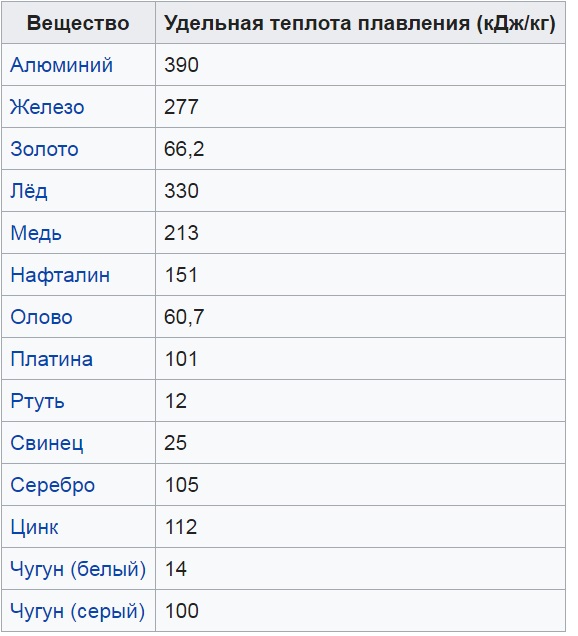 При частой плавке не обойтись без специальной защитной маски, ну или хотя бы очков. Но лучше всего работать в костюме, который устойчив к воздействию высокой температуры в несколько сотен градусов.
При частой плавке не обойтись без специальной защитной маски, ну или хотя бы очков. Но лучше всего работать в костюме, который устойчив к воздействию высокой температуры в несколько сотен градусов. Емкость для плавления с ломом помещают внутрь. Для лучшего сохранения тепла кирпичи сверху накрывают листом металла.
Емкость для плавления с ломом помещают внутрь. Для лучшего сохранения тепла кирпичи сверху накрывают листом металла. Поверхность отливки будет ровной.
Поверхность отливки будет ровной.