Температура кипения и плавления меди и серы: Агрегатное состояние Меди в цвет меди запах меди плотность меди растворимость в воде меди теплопро…
alexxlab | 09.03.2023 | 0 | Разное
Оксид серы (IV) | справочник Пестициды.ru
Химические и физические свойства
Диоксид серы – бесцветный газ с резким запахом. Молекула имеет угловую форму.
- Температура плавления – -75,46 °С,
- Температура кипения – -10,6 °С,
- Плотность газа – 2,92655 г/л.
Легко сжижается в бесцветную легкоподвижную жидкость при температуре 25 °С и давлении около 0,5 МПа.
Для жидкой формы плотность равна 1,4619 г/см3 (при – 10 °С).
Твердый диоксид серы – бесцветные кристаллы, ромбической сингонии.
Диоксид серы заметно диссоциирует только около 2800 °С.
Диссоциация жидкого диоксида серы проходит по схеме:
2SO2 ↔ SO2+ + SO32-
Трехмерная модель молекулы
Трехмерная модель молекулы
Растворимость диоксида серы в воде зависит от температуры:
- при 0 °С в 100 г воды растворяется 22,8 г диоксида серы,
- при 20 °С – 11,5 г,
- при 90 °С – 2,1 г.

Водный раствор диоксида серы – это сернистая кислота H2SO3.
Диоксид серы растворим в этаноле, H2SO4, олеуме, CH3COOH. Жидкий сернистый ангидрид смешивается в любых соотношениях с SO3. CHCl3, CS2, диэтиловым эфиром.
Жидкий сернистый ангидрид растворяет хлориды. Иодиды и роданиды металлов не растворяются.
Соли, растворенные в жидком диоксиде серы, диссоциируют.
Диоксид серы способен восстанавливаться до серы и окисляться до шестивалентных соединений серы.
Диоксид серы токсичен. При концентрации 0,03–0,05 мг/л раздражает слизистые оболочки, органы дыхания, глаза.
Основной промышленный способ получения диоксида серы – из серного колчедана FeS2 путем его сжигания и дальнейшей обработки слабой холодной H2SO4.
Кроме того, серный диоксид можно получить путем сжигания серы, а также как побочный продукт обжига медных и цинковых сульфидных руд.
Содержание диоксида серы в почве и удобрениях
Неорганические соединения серы представлены сульфатами (гипс CaSO4•2H2O, ангидрит CaSO4) и сульфидами (пирит FeS2).
Сульфидная сера доступна растениям только после перехода в сульфатную форму. Большая часть серы присутствует в почве в составе органических соединений, не усваиваемых растениями. Только после минерализации органических веществ и перехода серы в сульфатную форму органическая сера становится доступной для растений.[1]
Химическая промышленность не выпускает удобрений с основным действующим веществом диоксидом серы. Однако в качестве примесей он содержится во многих удобрениях. К ним относятся фосфогипс, простой суперфосфат, сульфат аммония, сульфат калия, калимагнезия, гипс, сланцевая зола, навоз, торф и многие другие.[1]
Поглощение диоксида серы растениями
Сера поступает в растения через корни в виде SO42- и листья в виде диоксида серы. При этом поглощение серы из атмосферы обеспечивает до 80 % потребности растений в данном элементе. В связи с этим вблизи промышленных центров, где атмосфера богата диоксидом серы, растения хорошо обеспечены серой. В удаленных районах количество сернистого ангидрида в осадках и атмосфере сильно снижается и питание растений серой зависит от ее наличия в почве.[2]
При этом поглощение серы из атмосферы обеспечивает до 80 % потребности растений в данном элементе. В связи с этим вблизи промышленных центров, где атмосфера богата диоксидом серы, растения хорошо обеспечены серой. В удаленных районах количество сернистого ангидрида в осадках и атмосфере сильно снижается и питание растений серой зависит от ее наличия в почве.[2]
Температура плавления серы. Установки для плавления серы
Сера – один из самых распространённых элементов земной коры. Чаще всего она встречается в составе минералов, содержащих кроме неё металлы. Очень интересны процессы, происходящие при достижении температуры кипения и плавления серы. Эти процессы, а также связанные с ними сложности мы и разберём в этой статье. Но для начала окунёмся в историю открытия этого элемента.
История
В самородном виде, а также в составе минералов сера была известна ещё с древности. В старых греческих текстах описано ядовитое действие ее соединений на человеческий организм. Сернистый газ, выделяемый при горении соединений этого элемента, действительно может быть смертельно опасен для людей. Примерно в 8 веке серу начали использовать в Китае для приготовления пиротехнических смесей. Неудивительно, ведь именно в этой стране, как считается, изобрели порох.
Сернистый газ, выделяемый при горении соединений этого элемента, действительно может быть смертельно опасен для людей. Примерно в 8 веке серу начали использовать в Китае для приготовления пиротехнических смесей. Неудивительно, ведь именно в этой стране, как считается, изобрели порох.
Ещё в Древнем Египте людям был известен способ обжига серосодержащей руды на основе меди. Таким образом добывали этот металл. Сера уходила в виде ядовитого газа SO2.
Несмотря на известность с древнейших времён, знание о том, что представляет собой сера, пришло благодаря работам французского естествоиспытателя Антуана Лавуазье. Именно он установил, что она является элементом, а продукты её горения – оксидами.
Вот такая вот краткая история знакомства людей с этим химическим элементом. Далее мы подробно расскажем о процессах, происходящих в недрах земли и приводящих к образованию серы в том виде, в котором она есть сейчас.
Как появляется сера?
Существует распространённое заблуждение о том, что чаще всего этот элемент встречается в самородном (то есть чистом) виде. Однако это не совсем так. Самородная сера чаще всего встречается как вкрапление в другую руду.
Однако это не совсем так. Самородная сера чаще всего встречается как вкрапление в другую руду.
На данный момент есть несколько теорий, касающихся происхождения элемента в чистом виде. Они предполагают отличие во времени образования серы и руд, в которые она вкрапляется. Первая, теория сингенеза, предполагает образование серы совместно с рудами. Согласно ей некоторые бактерии, обитающие в толще океана, восстанавливали сульфаты, находящиеся в воде, до сероводорода. Последний, в свою очередь, поднимался вверх, где с помощью других бактерий окислялся до серы. Она падала на дно, смешивалась с илом, и впоследствии они вместе образовывали руду.
Суть теории эпигенеза – то, что сера в руде образовалась позднее её самой. Тут есть несколько ответвлений. Мы расскажем лишь о самом распространённом варианте этой теории. Состоит он вот в чём: подземные воды, протекая через скопления сульфатных руд, обогащаются ими. Затем, проходя через месторождения нефти и газа, ионы сульфатов восстанавливаются до сероводорода благодаря углеводородам. Сернистый водород, поднимаясь к поверхности, окисляется кислородом воздуха до серы, которая и оседает в породах, образуя кристаллы. Эта теория в последнее время находит всё больше подтверждений, но пока остаётся открытым вопрос о химизме этих превращений.
Сернистый водород, поднимаясь к поверхности, окисляется кислородом воздуха до серы, которая и оседает в породах, образуя кристаллы. Эта теория в последнее время находит всё больше подтверждений, но пока остаётся открытым вопрос о химизме этих превращений.
От процесса происхождения серы в природе перейдём к её модификациям.
Аллотропия и полиморфизм
Сера, как и многие другие элементы таблицы Менделеева, существует в природе в нескольких формах. В химии их называют аллотропными модификациями. Существует сера ромбическая. Температура плавления её несколько ниже, чем у второй модификации: моноклинной (112 и 119 градусов по Цельсию). А различаются они строением элементарных ячеек. Ромбическая сера отличается большей плотностью и устойчивостью. Она может при нагревании до 95 градусов переходить во вторую форму – моноклинную. У обсуждаемого нами элемента есть аналоги в таблице Менделеева. Полиморфизм серы, селена и теллура учёные обсуждают до сих пор. Они имеют очень тесную связь между собой, и все модификации, которые они образуют, сильно похожи.
А далее мы разберём процессы, происходящие при плавлении серы. Но перед тем как начать, следует немного окунуться в теорию строения кристаллической решётки и явлений, происходящих при фазовых переходах вещества.
Из чего состоит кристалл?
Как известно, в газообразном состоянии вещество находится в виде молекул (или атомов), беспорядочно движущихся в пространстве. В жидком веществе составляющие его частицы группируются, но всё равно имеют достаточно большую свободу движения. В твёрдом агрегатном состоянии всё немного иначе. Здесь степень упорядоченности возрастает до своего максимального значения, и атомы образуют кристаллическую решётку. В ней, конечно, происходят колебания, но они имеют очень малую амплитуду, и это нельзя назвать свободным движением.
Любой кристалл можно поделить на элементарные ячейки – такие последовательные соединения атомов, которые повторяются во всём объёме образца соединения. Тут стоит уточнить, что такие ячейки – это не кристаллическая решётка, и тут атомы располагаются внутри объёма определённой фигуры, а не в её узлах. Для каждого кристалла они индивидуальны, но их можно разделить на несколько основных типов (сингоний) в зависимости от геометрии: триклинная, моноклинная, ромбическая, ромбоэдрическая, тетрагональная, гексагональная, кубическая.
Для каждого кристалла они индивидуальны, но их можно разделить на несколько основных типов (сингоний) в зависимости от геометрии: триклинная, моноклинная, ромбическая, ромбоэдрическая, тетрагональная, гексагональная, кубическая.
Кратко разберём каждый тип решёток, ведь они делятся ещё на несколько подвидов. И начнём мы с того, чем они могут отличаться между собой. Во-первых, это соотношения длин сторон, а во-вторых, угол между ними.
Таким образом, триклинная сингония, самая низшая из всех, представляет собой элементарную решётку (параллелограмм), в которой все стороны и углы не равны между собой. Ещё один представитель так называемой низшей категории сингоний – моноклинная. Здесь два угла ячейки равны 90 градусам, а все стороны имеют разную длину. Следующий вид, относящейся к низшей категории, – ромбическая сингония. Она имеет три неравные между собой стороны, но все углы фигуры равны 90 градусам.
Перейдём к средней категории. И первый её член – тетрагональная сингония. Тут по аналогии нетрудно догадаться, что все углы фигуры, которую она представляет, равны 90 градусам, а также две из трёх сторон равны между собой. Следующий представитель – ромбоэдрическая (тригональная) сингония. Тут всё немного интереснее. Этот тип определяется тремя одинаковыми сторонами и тремя углами, которые равны между собой, но не являются прямыми.
Тут по аналогии нетрудно догадаться, что все углы фигуры, которую она представляет, равны 90 градусам, а также две из трёх сторон равны между собой. Следующий представитель – ромбоэдрическая (тригональная) сингония. Тут всё немного интереснее. Этот тип определяется тремя одинаковыми сторонами и тремя углами, которые равны между собой, но не являются прямыми.
Последний вариант средней категории – гексагональная сингония. В её определении ещё больше сложности. Этот вариант строится на трёх сторонах, две из которых равны и образуют угол 120 градусов, а третья находится в перпендикулярной им плоскости. Если взять три ячейки гексагональной сингонии и приложить их друг к другу, то мы получим цилиндр с шестигранным основанием (именно поэтому у неё такое название, ведь “гекса” в переводе с латинского означает “шесть”).
Ну а вершина всех сингоний, имеющая симметрию во всех направлениях, – кубическая. Она является единственной принадлежащей к высшей категории. Тут можно сразу догадаться, как её можно характеризовать. Все углы и стороны равны между собой и образуют куб.
Все углы и стороны равны между собой и образуют куб.
Итак, мы закончили разбор теории по основным группам сингоний, а теперь подробнее расскажем о строении различных форм серы и свойствах, которые из этого вытекают.
Строение серы
Как уже было сказано, сера имеет две модификации: ромбическую и моноклинную. После раздела с теорией наверняка стало ясно, чем они отличаются. Но вся суть состоит в том, что в зависимости от температуры структура решётки может меняться. Вся суть в самом процессе превращений, происходящих, когда достигается температура плавления серы. Тогда кристаллическая решётка полностью разрушается, и атомы могут более-менее свободно двигаться в пространстве.
Но вернёмся к строению и особенностям такого вещества, как сера. Свойства химических элементов во многом зависят от их строения. Например, сера в силу особенностей кристаллической структуры обладает свойством флотации. Её частички не смачиваются водой, и прилипающие к ним пузырьки воздуха тянут их на поверхность. Таким образом, комовая сера всплывает при погружении в воду. На этом основаны некоторые способы отделения этого элемента из смеси ему подобных. А далее мы разберём основные методы добычи этого соединения.
Таким образом, комовая сера всплывает при погружении в воду. На этом основаны некоторые способы отделения этого элемента из смеси ему подобных. А далее мы разберём основные методы добычи этого соединения.
Добыча
Сера может залегать с различными минералами, а следовательно, на различной глубине. В зависимости от этого выбирают разные способы добычи. Если глубина небольшая и под землёй нет скоплений газов, мешающих добыче, то материал добывают открытым способом: убирают пласты пород и, находя руду, содержащую серу, отправляют её на переработку. Но если эти условия не соблюдены и есть опасности, то применяют скважинный метод. В нём необходимо, чтобы достигалась температура плавления серы. Для этого применяют специальные установки. Аппарат для плавления комовой серы в этом способе просто необходим. Но об этом процессе -немного позднее.
Вообще при добыче серы любым способом существует большой риск отравления, потому как чаще всего вместе с ней залегают сероводород и сернистый газ, которые очень опасны для человека.
Чтобы лучше понять, какими недостатками и достоинствами обладает тот или иной способ, ознакомимся с методами переработки серосодержащей руды.
Извлечение
Тут тоже есть несколько приёмов, основанных на совершенно разных свойствах серы. Среди них выделяют термические, экстракционные, пароводяные, центрифугальные и фильтрационные.
Самые проверенные из них – термические. Они основаны на том, что температуры кипения и плавления серы ниже, чем у руд, в которые она “вклинивается”. Проблема только в том, что расходуется много энергии. Для поддержания температуры раньше приходилось сжигать часть серы. Несмотря на всю простоту, этот метод малоэффективен, и потери могут доходить до рекордных 45 процентов.
Мы идём по ветке исторического развития, поэтому переходим к пароводяному методу. В отличие от термических эти способы до сих пор используются на многих фабриках. Как ни странно, основаны они на том же свойстве – отличии температуры кипения и плавления серы от аналогичных показателей для сопутствующих металлов. Разница состоит лишь в том, каким образом происходит нагрев. Весь процесс идёт в автоклавах – специальных установках. Туда подаётся обогащённая серная руда, содержащая до 80 % добываемого элемента. Затем под давлением в автоклав закачивается горячий водяной пар. Разогреваясь до 130 градусов по Цельсию, сера плавится и выводится из системы. Конечно, остаются и так называемые хвосты – частички серы, плавающие в воде, образовавшейся благодаря конденсированию водяного пара. Их удаляют и вновь пускают в процесс, так как там тоже содержится немало нужного нам элемента.
Разница состоит лишь в том, каким образом происходит нагрев. Весь процесс идёт в автоклавах – специальных установках. Туда подаётся обогащённая серная руда, содержащая до 80 % добываемого элемента. Затем под давлением в автоклав закачивается горячий водяной пар. Разогреваясь до 130 градусов по Цельсию, сера плавится и выводится из системы. Конечно, остаются и так называемые хвосты – частички серы, плавающие в воде, образовавшейся благодаря конденсированию водяного пара. Их удаляют и вновь пускают в процесс, так как там тоже содержится немало нужного нам элемента.
Один из самых современных методов – центрифужный. К слову, разработан он в России. Если кратко, суть его в том, что расплав смеси серы и минералов, которым она сопутствует, погружается в центрифугу и раскручивается с большой скоростью. Более тяжёлая порода за счёт центробежной силы стремится от центра, а сама сера остаётся выше. Затем полученные слои просто отделяют друг от друга.
Есть ещё один метод, который тоже по сей день используется на производствах. Заключается он в отделении серы от минералов через специальные фильтры.
Заключается он в отделении серы от минералов через специальные фильтры.
В этой статье мы рассмотрим исключительно термические методы извлечения несомненно важного для нас элемента.
Процесс плавления
Исследование теплообмена при плавлении серы – важный вопрос, потому как это один из самых экономичных способов добычи этого элемента. Мы можем комбинировать параметры системы при нагревании, и нам необходимо вычислить их оптимальное сочетание. Именно для этого проводится исследование теплообмена и анализ особенностей процесса плавления серы. Существует несколько видов установок для осуществления этого процесса. Котёл для плавления серы – одна из них. Получение искомого элемента с помощью этого изделия – лишь вспомогательный способ. Однако сегодня есть специальная установка – аппарат для плавления комовой серы. Он может эффективно использоваться на производстве для получения высокочистой серы в большом объёме.
Для вышеизложенной цели в 1890 году была изобретена установка, позволяющая плавить серу на глубине и выкачивать на поверхность с помощью трубы. Её конструкция достаточно проста и эффективна в действии: две трубы находятся друг в друге. По внешней трубе циркулирует перегретый до 120 градусов (температура плавления серы) пар. Конец внутренней трубы достаёт до залежей нужного нам элемента. Нагреваясь водой, сера начинает плавиться и выходить наружу. Всё достаточно просто. В современном варианте установка содержит ещё одну трубу: она находится внутри трубы с серой, и по ней идёт сжатый воздух, который заставляет расплав подниматься быстрее.
Её конструкция достаточно проста и эффективна в действии: две трубы находятся друг в друге. По внешней трубе циркулирует перегретый до 120 градусов (температура плавления серы) пар. Конец внутренней трубы достаёт до залежей нужного нам элемента. Нагреваясь водой, сера начинает плавиться и выходить наружу. Всё достаточно просто. В современном варианте установка содержит ещё одну трубу: она находится внутри трубы с серой, и по ней идёт сжатый воздух, который заставляет расплав подниматься быстрее.
Есть ещё несколько методов, и в одном из них достигается температура плавления серы. Под землю опускают два электрода и пускают по ним ток. Так как сера – типичный диэлектрик, она не проводит ток и начинает сильно нагреваться. Таким образом она плавится и с помощью трубы, как и в первом способе, выкачивается наружу. Если серу хотят направить на производство серной кислоты, то её поджигают под землёй и выводят полученный газ наружу. Его доокисляют до оксида серы (VI), а потом растворяют в воде, получая конечный продукт.
Мы разобрали плавление серы, установки плавления серы и способы её добычи. Теперь пришла пора выяснить, зачем нужны столь сложные методы. На самом деле анализ процесса плавления серы и система контроля температуры нужны для того, чтобы хорошо очистить и эффективно применить конечный продукт добычи. Ведь сера – один из важнейших элементов, играющих ключевую роль во многих сферах нашей жизни.
Применение
Бессмысленно говорить, где применяются соединения серы. Проще сказать, где они не применяются. Сера есть в любой резине и резиновых изделиях, в газе, который подаётся в дома (там он нужен для идентификации утечки в случае таковой). Это самые бытовые и простые примеры. На самом деле сфер применения серы бесчисленное множество. Перечислить их все просто нереально. Но если мы возьмёмся делать это, окажется, что сера – один из самых необходимых для человечества элементов.
Заключение
Из этой статьи вы узнали, какая температура плавления у серы, чем этот элемент так важен для нас. Если вы заинтересованы в этом процессе и его изучении, то наверняка почерпнули для себя что-то новое. Например, это могут быть особенности плавления серы. В любом случае нет предела совершенству, и никому из нас не помешают знания процессов, происходящих в промышленности. Вы можете самостоятельно продолжить освоение технологических тонкостей процессов добычи, извлечения и переработки серы и других элементов, содержащихся в земной коре.
Если вы заинтересованы в этом процессе и его изучении, то наверняка почерпнули для себя что-то новое. Например, это могут быть особенности плавления серы. В любом случае нет предела совершенству, и никому из нас не помешают знания процессов, происходящих в промышленности. Вы можете самостоятельно продолжить освоение технологических тонкостей процессов добычи, извлечения и переработки серы и других элементов, содержащихся в земной коре.
Периодическая таблица элементов
Периодическая таблица элементов| Наименование | Масса | Номер | Температура кипения | Температура плавления |
|---|---|---|---|---|
| Водород | 1,00794 | 1 | 20,28 Кельвина | 13,81 Кельвина |
| Гелий | 4,0026 | 2 | 4,216 Кельвин | 0,95 Кельвин |
| Литий | 6,941 | 3 | 1615 Кельвин | 453,7 Кельвин |
| Бериллий | 9,01218 | 4 | 3243 Кельвин | 1560 Кельвин |
| Бор | 10,811 | 5 | 4275 Кельвин | 2365 Кельвин |
| Углерод | 12,011 | 6 | 5100 Кельвин | 3825 Кельвин |
| Азот | 14,0067 | 7 | 77,344 Кельвин | 63,15 Кельвин |
| Кислород | 15,9994 | 8 | 90,188 Кельвин | 54,8 Кельвин |
| Фтор | 18,9984 | 9 | 85 Кельвин | 53,55 Кельвин |
| Неон | 20.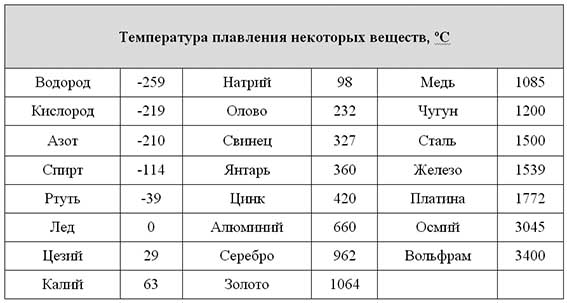 1797 1797 | 10 | 27,1 Кельвина | 24,55 Кельвина |
| Натрий | 22,98977 | 11 | 1156 Кельвин | 371 Кельвин |
| Магний | 24,305 | 12 | 1380 Кельвин | 922 Кельвин |
| Алюминий | 26,98154 | 13 | 2740 Кельвин | 933,5 Кельвин |
| Силикон | 28.0855 | 14 | 2630 Кельвин | 1683 Кельвин |
| Фосфор | 30,97376 | 15 | 553 Кельвин | 317,3 Кельвин |
| Сера | 32,066 | 16 | 717,82 Кельвин | 392,2 Кельвин |
| Хлор | 35,4527 | 17 | 239,18 Кельвин | 172,17 Кельвин |
| Аргон | 39,948 | 18 | 87,45 Кельвин | 83,95 Кельвин |
| Калий | 39,0983 | 19 | 1033 Кельвин | 336,8 Кельвин |
| Кальций | 40,078 | 20 | 1757 Кельвин | 1112 Кельвин |
| Скандий | 44,9559 | 21 | 3109 Кельвин | 1814 Кельвин |
| Титан | 47,88 | 22 | 3560 Кельвин | 1945 Кельвин |
| Ванадий | 50,9415 | 23 | 3650 Кельвин | 2163 Кельвин |
| Хром | 51,996 | 24 | 2945 Кельвин | 2130 Кельвин |
| Марганец | 54,938 | 25 | 2335 Кельвин | 1518 Кельвин |
| Железо | 55,847 | 26 | 3023 Кельвин | 1808 Кельвин |
| Кобальт | 58,9332 | 27 | 3143 Кельвин | 1768 Кельвин |
| Никель | 58,6934 | 28 | 3005 Кельвин | 1726 Кельвин |
| Медь | 63,546 | 29 | 2840 Кельвин | 1356,6 Кельвин |
| Цинк | 65,39 | 30 | 1180 Кельвин | 692,73 Кельвин |
| Галлий | 69,723 | 31 | 2478 Кельвин | 302,92 Кельвин |
| Германий | 72,61 | 32 | 3107 Кельвин | 1211,5 Кельвина |
| Мышьяк | 74,9216 | 33 | 876 Кельвин | 1090 Кельвин |
| Селен | 78,96 | 34 | 958 Кельвин | 494 Кельвин |
| Бром | 79,904 | 35 | 331,85 Кельвин | 265,95 Кельвин |
| Криптон | 83,8 | 36 | 120,85 Кельвина | 116 Кельвина |
| Рубидий | 85,4678 | 37 | 961 Кельвин | 312,63 Кельвин |
| Стронций | 87,62 | 38 | 1655 Кельвин | 1042 Кельвин |
| Иттрий | 88,9059 | 39 | 3611 Кельвин | 1795 Кельвин |
| Цирконий | 91,224 | 40 | 4682 Кельвин | 2128 Кельвин |
| Ниобий | 92,9064 | 41 | 5015 Кельвин | 2742 Кельвин |
| Молибден | 95,94 | 42 | 4912 Кельвин | 2896 Кельвин |
| Технеций | 98 | 43 | 4538 Кельвин | 2477 Кельвин |
| Рутений | 101,07 | 44 | 4425 Кельвин | 2610 Кельвин |
| Родий | 102,9055 | 45 | 3970 Кельвин | 2236 Кельвин |
| Палладий | 106,42 | 46 | 3240 Кельвин | 1825 Кельвин |
| Серебро | 107,868 | 47 | 2436 Кельвин | 1235,08 Кельвин |
| Кадмий | 112,41 | 48 | 1040 Кельвин | 594,26 Кельвин |
| Индий | 114,82 | 49 | 2350 Кельвин | 429,78 Кельвин |
| Олово | 118,71 | 50 | 2876 Кельвин | 505,12 Кельвин |
| Сурьма | 121,757 | 51 | 1860 Кельвин | 903,91 Кельвин |
| Теллур | 127,6 | 52 | 1261 Кельвин | 722,72 Кельвин |
| Йод | 126,9045 | 53 | 457,5 Кельвин | 386,7 Кельвин |
| Ксенон | 131,29 | 54 | 165,1 Кельвин | 161,39 Кельвина |
| Цезий | 132,9054 | 55 | 944 Кельвин | 301,54 Кельвин |
| Барий | 137,33 | 56 | 2078 Кельвин | 1002 Кельвин |
| Лантан | 138,9055 | 57 | 3737 Кельвин | 1191 Кельвин |
| Церий | 140,12 | 58 | 3715 Кельвин | 1071 Кельвин |
| Празеодим | 140,9077 | 59 | 3785 Кельвин | 1204 Кельвин |
| Неодим | 144,24 | 60 | 3347 Кельвин | 1294 Кельвин |
| Прометий | 145 | 61 | 3273 Кельвин | 1315 Кельвин |
| Самарий | 150,36 | 62 | 2067 Кельвин | 1347 Кельвин |
| Европий | 151,965 | 63 | 1800 Кельвин | 1095 Кельвин |
| Гадолиний | 157,25 | 64 | 3545 Кельвин | 1585 Кельвин |
| Тербий | 158,9253 | 65 | 3500 Кельвин | 1629 Кельвин |
| Диспрозий | 162,5 | 66 | 2840 Кельвин | 1685 Кельвин |
| Гольмий | 164,9303 | 67 | 2968 Кельвин | 1747 Кельвин |
| Эрбий | 167,26 | 68 | 3140 Кельвин | 1802 Кельвин |
| Тулий | 168,9342 | 69 | 2223 Кельвина | 1818 Кельвина |
| Иттербий | 173,04 | 70 | 1469 Кельвин | 1092 Кельвин |
| Лютеций | 174,967 | 71 | 3668 Кельвин | 1936 Кельвин |
| Гафний | 178,49 | 72 | 4875 Кельвин | 2504 Кельвин |
| Тантал | 180,9479 | 73 | 5730 Кельвин | 3293 Кельвин |
| Вольфрам | 183,85 | 74 | 5825 Кельвин | 3695 Кельвин |
| Рений | 186,207 | 75 | 5870 Кельвин | 3455 Кельвин |
| Осмий | 190,2 | 76 | 5300 Кельвин | 3300 Кельвин |
| Иридий | 192,22 | 77 | 4700 Кельвин | 2720 Кельвин |
| Платина | 195,08 | 78 | 4100 Кельвин | 2042,1 Кельвин |
| Золото | 196,9665 | 79 | 3130 Кельвин | 1337,58 Кельвин |
| Меркурий | 200,59 | 80 | 629,88 Кельвина | 234,31 Кельвина |
| Таллий | 204,383 | 81 | 1746 Кельвин | 577 Кельвин |
| Свинец | 207,2 | 82 | 2023 Кельвин | 600,65 Кельвин |
| Висмут | 208,9804 | 83 | 1837 Кельвин | 544,59 Кельвин |
| Астатин | 210 | 85 | 610 Кельвин | 575 Кельвин |
| Радон | 222 | 86 | 211,4 Кельвин | 202 Кельвин |
| Франций | 223 | 87 | 950 Кельвин | 300 Кельвин |
| Радий | 226,0254 | 88 | 1413 Кельвин | 973 Кельвин |
| Торий | 232. 0381 0381 | 90 | 5060 Кельвин | 2028 Кельвин |
| Протактиний | 231.0359 | 91 | 4300 Кельвин | 1845 Кельвин |
| Уран | 238,029 | 92 | 4407 Кельвин | 1408 Кельвин |
| Нептуний | 237.0482 | 93 | 4175 Кельвин | 912 Кельвин |
| Плутоний | 244 | 94 | 3505 Кельвин | 913 Кельвин |
| Америций | 243 | 95 | 2880 Кельвин | 1449 Кельвин |
Структуры и физические свойства элементов периода 3
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3632
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице описаны структуры элементов 3-го периода от натрия до аргона и показано, как эти структуры можно использовать для объяснения физических свойств элементов.
Точки плавления и кипения
Через мгновение мы объясним все взлеты и падения на этом графике.
Электропроводность
Натрий, магний и алюминий являются хорошими проводниками электричества. Кремний является полупроводником. Ни один из остальных не проводит электричество. Эти тенденции объясняются ниже.
Три металлические структуры
Натрий, магний и алюминий имеют металлическую структуру, что объясняет их электропроводность и относительно высокие температуры плавления и кипения. Температуры плавления и кипения трех металлов повышаются из-за увеличения числа электронов, которые каждый атом может вносить в делокализованное «море электронов». Атомы также становятся меньше и имеют больше протонов по мере перехода от натрия к магнию и алюминию.
Притяжение и, следовательно, температуры плавления и кипения увеличиваются, потому что:
- Ядра атомов становятся более положительно заряженными.
- Море становится все более отрицательно заряженным.

- Море постепенно приближается к ядрам и тем сильнее притягивается.
Кремний — гигантская ковалентная структура
Кремний — это неметалл и имеет гигантскую ковалентную структуру, точно такую же, как углерод в алмазе — отсюда и высокая температура плавления. Вы должны разорвать прочные ковалентные связи, чтобы расплавить его. В структуре нет явно свободных электронов, и хотя она проводит электричество, но не так, как металлы. Кремний является полупроводником.
Четыре молекулярных элемента
Фосфор, сера, хлор и аргон являются простыми молекулярными веществами, между молекулами которых существует только ван-дер-ваальсово притяжение. Их температуры плавления или кипения будут ниже, чем у первых четырех членов периода, имеющих гигантские структуры. Наличие отдельных молекул предотвращает любую возможность движения электронов, поэтому ни одна из них не проводит электричество. Размеры точек плавления и кипения полностью определяются размерами молекул:
Молекулы аргона состоят из отдельных атомов аргона.
- Фосфор : Существует несколько форм фосфора. Данные на графике в верхней части страницы относятся к белому фосфору, который содержит молекулы P 4 . Чтобы расплавить фосфор, вам не нужно разрывать ковалентные связи — достаточно гораздо более слабых ван-дер-ваальсовых сил между молекулами.
- Сера : сера состоит из S 8 колец атомов. Молекулы больше, чем молекулы фосфора, поэтому притяжение Ван-дер-Ваальса будет сильнее, что приведет к более высокой температуре плавления и кипения.
- Хлор : Хлор, Cl 2 , представляет собой гораздо меньшую молекулу со сравнительно слабым ван-дер-ваальсовым притяжением, поэтому хлор будет иметь более низкую температуру плавления и кипения, чем сера или фосфор.
- Аргон : Молекулы аргона — это всего лишь отдельные атомы аргона, Ar. Возможности ван-дер-ваальсова притяжения между ними очень ограничены, поэтому температуры плавления и кипения аргона снова ниже.