Температура плавления и кипения меди и серы: Агрегатное состояние Меди в цвет меди запах меди плотность меди растворимость в воде меди теплопро…
alexxlab | 16.04.2023 | 0 | Разное
Охлаждающие свойства меди
Александр Филоненко
Охлаждающие свойства меди
В природе медь встречается в виде руд, а в качестве минерала – самородной меди (крайне редко). Большая часть меди добывается в шахтах в форме сульфида меди с использованием флотации.
- химическая формула – Cu
- плотность – 8,93 кг / дм 3
- точка кипения – 2560 градусов по Цельсию
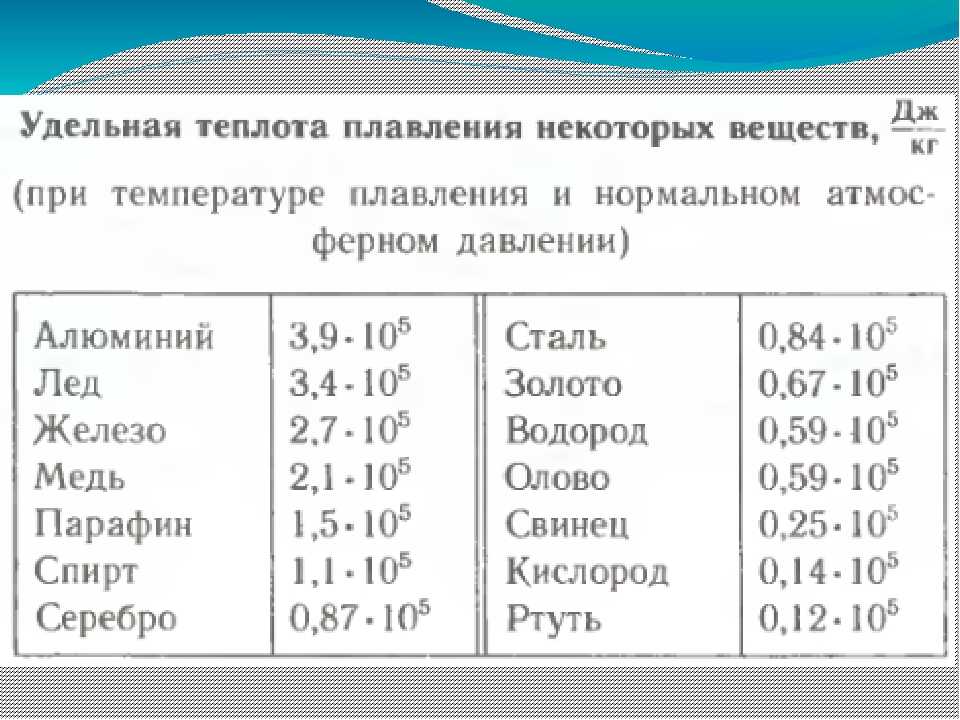
- температура плавления – 1083,4 ° С
- предел прочности на разрыв – 210-240 Н / мм2
- теплопроводность (для 0 ст. С) – 397 Вт / мК
- тепловое расширение (для 20 – 100 град. C) – 0,0168 мм / м / ºC
Техническая медь имеет много примесей, которые в некоторых случаях очень существенно влияют на ее физико-механические свойства:
- элементы, которые образуют твердые растворы в меди (например, Al, Fe, Ni, Sn, Zn, Ag, Pt, Cd и др.
 ), которые оказывают небольшое влияние на пластические свойства меди, повышая ее твердость и прочность, снижая электропроводность и тепловой;
), которые оказывают небольшое влияние на пластические свойства меди, повышая ее твердость и прочность, снижая электропроводность и тепловой; - элементы, которые не образуют твердых растворов с медью даже в небольших количествах. В эту группу входят главным образом свинец и висмут, которые создают эвтектическую смесь на границах зерен, являются наиболее неблагоприятными загрязнителями меди, снижая в наибольшей степени ее пластические и физические свойства;
- элементы, которые даже в небольших количествах образуют химические соединения с медью. Эти элементы включают, прежде всего, кислород и серу. Оксиды и сульфиды меди в виде эвтектических смесей также образуются на границах зерен и, как и в предыдущем случае, они понижают пластические свойства, увеличивают прочностные свойства, но более мягким способом.
Медь обладает относительно высокой коррозионной стойкостью. Во влажном воздухе медь покрыта слоем основного карбоната меди, т.н. патина, в некоторой степени защищающая от дальнейшей коррозии.
Влияние примесей на механические свойства меди очень различно и зависит главным образом от состояния, в котором эти загрязнители встречаются и где они находятся. Структура окисленной меди зависит от содержания кислорода в медном сплаве. В системах холодного, холодного водоснабжения и отопления в основном используются трубы из фосфоресцентной меди. Фосфор является наиболее популярным раскислителем, но его используют в небольших количествах, поскольку его больший остаток в меди после раскисления, как правило, нежелателен, поскольку он влияет на хрупкость материала.
- трасса для кондиционера
- фреоновая трасса
- монтаж кондиционера в два этапа
- Назад
- Вперед
Свойства меди
Медь – химический элемент I группы периодической системы Менделеева; атомный номер 29, атомная масса 63,546. Температура плавления- 1083° C; температура кипения – 2595° C; плотность – 8,98 г/см 3. По геохимической классификации В.М. Гольдшмидта, медь относится к халькофильным элементам с высоким сродством к S, Se, Te, занимающим восходящие части на кривой атомных объемов; они сосредоточены в нижней мантии, образуют сульфиднооксидную оболочку.
Вернадским
в первой половине 1930 г были проведены
исследования изменения изотопного
состава воды, входящего в состав разных
минералов, и опыты по разделению изотопов
под влиянием биогеохимических процессов,
что и было подтверждено последующими
тщательными исследованиями. Как элемент
нечетный состоит из двух нечетных
изотопов 63 и 65 На долю изотопа Cu (63)
приходится 69,09%, процентное содержание
изотопа Cu (65) – 30,91%. В соединениях медь
проявляет валентность +1 и +2, известны
также немногочисленные соединения
трехвалентной меди.
Как элемент
нечетный состоит из двух нечетных
изотопов 63 и 65 На долю изотопа Cu (63)
приходится 69,09%, процентное содержание
изотопа Cu (65) – 30,91%. В соединениях медь
проявляет валентность +1 и +2, известны
также немногочисленные соединения
трехвалентной меди.
К валентности 1 относятся лишь глубинные соединения, первичные сульфиды и минерал куприт – Cu2O. Все остальные минералы, около сотни отвечают валентности два. Радиус одновалентной меди +0.96, этому отвечает и эк – 0,70. Величина атомного радиуса двухвалентной меди – 1,28; ионного радиуса 0,80.
Очень
интересна величена потенциалов ионизации:
для одного электрона – 7,69, для двух –
20,2. Обе цифры очень велики, особенно
вторая, показывающая большую трудность
отрыва наружных электронов. Одновалентная
медь является равноквантовой и потому
ведет к бесцветным солям и слабо
окрашенным комплексам, тогда как
разноквантовя двух валентная медь
характеризуется окрашенностью солей
в соединении с водой.
Медь – металл сравнительно мало активный. В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Она достаточно легко вступает в реакции с галогенами, серой, селеном. А вот с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют.
Электроотрицательность атомов – способность при вступлении в соединения притягивать электроны. Электроотрицательность Cu2+ – 984 кДЖ/моль, Cu+ – 753 кДж/моль. Элементы с резко различной ЭО образуют ионную связь, а элементы с близкой ЭО – ковалентную. Сульфиды тяжелых металлов имеют промежуточную связь, с большей долей ковалентной связи (ЭО у S-1571, Cu-984, Pb-733). Медь является амфотерным элементом – образует в земной коре катионы и анионы.
Медь
входит более чем в 198 минералов, из
которых для промышленности важны только
17, преимущественно сульфидов, фосфатов,
силикатов, карбонатов, сульфатов.
Окислы: тенорит, куприт. Карбонаты: малахит, азурит. Сульфаты: халькантит, брошантит. Сульфиды: ковеллин, халькозин, халькопирит, борнит.
Чистая медь – тягучий, вязкий металл красного, в изломе розового цвета, в очень тонких слоях на просвет медь выглядит зеленовато-голубой. Эти же цвета, характерны и для многих соединений меди, как в твердом состоянии, так и в растворах.
Понижение окраски при повышении валентности видно из следующих двух примеров:
CuCl – белый, Cu2O – красный, CuCl 2+H2O – голубой, CuO – черный
Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем намечается интересный практический признак для поисков.
Практическое
значение имеют: самородная медь, сульфиды,
сульфосоли и карбонаты (силикаты).
Сера – Температура плавления – Температура кипения
Автор
Сера – Температура плавления и кипения
Температура плавления серы 112,82°C.
Температура кипения серы 444,7°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Температура кипения – насыщение
В термодинамике насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при данной температуре и давлении. Температура, при которой начинает происходить испарение (кипение) при данном давлении, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения. Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Точка плавления
В термодинамике точка плавления определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода от жидкого к твердому, ее называют точкой замерзания или точкой кристаллизации.
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебание атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
движение отдельных атомов , ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы вибрируют быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушающие вибрации частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Sulfur – Properties
| Element | Sulfur |
|---|---|
| Atomic Number | 16 |
| Symbol | S |
| Element Category | Non Metal |
| Фаза при STP | Твердое тело |
Атомная масса [а. е.м.] е.м.] | 32,065 |
| Плотность при STP [г/см3] | 1,96 |
| Electron Configuration | [Ne] 3s2 3p4 |
| Possible Oxidation States | +4,6/-2 |
| Electron Affinity [kJ/mol] | 200 |
| Electronegativity [Pauling scale ] | 2.58 |
| 1st Ionization Energy [eV] | 10.36 |
| Year of Discovery | unknown |
| Discoverer | unknown |
| Thermal properties | |
| Melting Point [Celsius scale] | 112.8 |
| Boiling Point [Celsius scale] | 444.7 |
| Thermal Conductivity [W/m K] | 0.269 |
| Specific Heat [J/g K] | 0.71 |
| Heat of Fusion [kJ/mol] | 1.7175 |
| Heat of Vaporization [kJ/mol] | — |
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Алюминий13Al | Кремний14Si | Фосфор15P | Сера16S | Хлор17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Titanium22Ti | Vanadium23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Мышьяк33As | Селен34Se | Бром35Br | Криптон36Kr | ||
| Rubidium37Rb | Strontium38Sr | Yttrium39Y | Zirconium40Zr | Niobium41Nb | Molybdenum42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Теллур52Те | Йод53I | Ксенон54Хе | ||
| Caesium55Cs | Barium56Ba | Lanthanum57La | Hafnium72Hf | Tantalum73Ta | Tungsten74W | Rhenium75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Астатин85At | Радон86Rn | ||
| Франций87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Bohrium107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Оганесон118Ог | ||
| Cerium58Ce | Praseodymium59Pr | Neodymium60Nd | Promethium61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Лютеций71Lu | ||||||
| Thorium90Th | Protactinium91Pa | Uranium92U | Neptunium93Np | Plutonium94Pu | Americium95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
сообщить об этом объявлении
WebAssign
WebAssign| Поиск: | ||||
Химия Справочные данные |
|
WebAssign ® является зарегистрированным знаком обслуживания Университета штата Северная Каролина по лицензии Advanced Instructional Systems, Inc. | |||


 ), которые оказывают небольшое влияние на пластические свойства меди, повышая ее твердость и прочность, снижая электропроводность и тепловой;
), которые оказывают небольшое влияние на пластические свойства меди, повышая ее твердость и прочность, снижая электропроводность и тепловой; 3
3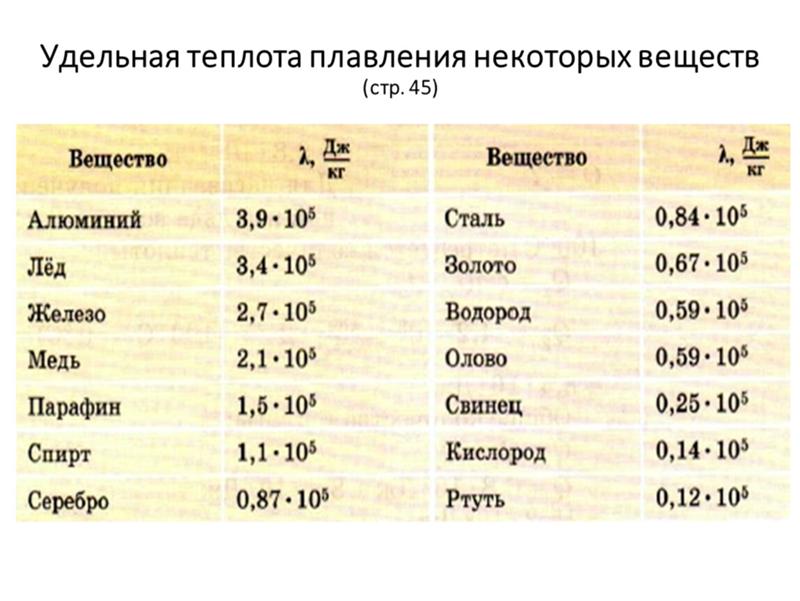 02
02 43
43 502
502