Температура плавления меди и серы: Агрегатное состояние Меди в цвет меди запах меди плотность меди растворимость в воде меди теплопро…
alexxlab | 03.05.2023 | 0 | Разное
Таблица характеристик меди
Медь входит в категорию металлов, встречающихся в природе в чистом самородном виде и в форме соединений. В промышленных масштабах ведется добыча медных руд – халькопирита CuFeS2, борнита Cu5FeS4 и халькозина Cu2S. Элемент медь относится к группе пластичных переходных металлов, отличается податливостью к литью и всем видам обработки. Широко применяется в машиностроении, электротехнике, приборостроении, радиоэлектронике.
Характеристики медиЕстественный цвет меди обладает золотисто-розовым оттенком, при взаимодействии с воздухом поверхность металла становится желто-красной. Характеризуется коррозийной стойкостью в сухих условиях, под воздействием влаги процесс окисления ускоряется.
Физико-химические свойства меди представлены в таблице.
|
Физические характеристики |
||||
|
Параметр для анализа |
Медь |
|||
|
Химическая формула |
Cu |
|||
|
Нахождение в хим. |
4 период, 11 группа, №29 |
|||
|
ГОСТ |
|
|||
|
Пояснение |
Марки меди |
|||
|
Плотность меди, кг/м3 |
8920 |
|||
|
Твердость по Бринеллю |
45 (отожженная), 110 (нагартованная) |
|||
|
Температура литья, °С |
1200 |
|||
|
Температура плавления меди, °С |
1083 |
|||
|
Температура кипения, °С |
2567 |
|||
|
Температура рекристаллизации |
200 |
|||
|
Удельная теплоемкость, кДж/кг·K |
37,5 |
|||
|
Коэффициент теплопроводности при 100°С, кВт/(м·К) |
39 |
|||
|
Показатель температурного электрического сопротивления, T=20-100°С |
4,3 |
|||
|
Удельное сопротивление меди, Ом·мм²/м |
0,026 |
|||
|
Значение линейного теплового расширения, при t=20-200°С (10−6 К−1) |
1,7 |
|||
|
Показатель ударной вязкости, t = 20°С |
630 |
|||
|
Модуль упругости |
120000 |
|||
|
Параметр предела прочности |
200 |
|||
|
Значение предела текучести |
70 (отожженная), 300 (нагартованная) |
|||
|
Величина относительного удлинения |
50 (отожженная), 8 (нагартованная) |
|||
|
Коэффициент Пуассона |
0,34 |
|||
|
Химические свойства меди и соединений |
||||
|
Осуществляемые реакции |
Образуемое соединение |
Особенности проведения |
||
|
С простыми веществами: С кислородом С галогенами С серой С азотом С кремнием С углеродом С водородом |
оксиды меди CuО, Cu2О галогениды CuCl2, CuBr2, 2CuI сульфид меди CuS – – – – |
Реагирует при нагреве Реагирует при нагреве Реагирует при нагреве НЕ РЕАГИРУЕТ НЕ РЕАГИРУЕТ НЕ РЕАГИРУЕТ |
||
|
Со сложными соединениями: С водой С серной кислотой С азотной кислотой Со щелочами С нитратом ртути С оксидом азота С солями железа (хлорид железа) |
карбонат меди сульфат меди, вода, оксид серы нитрат меди, диоксид азота, вода – ртуть, нитрат меди оксид меди, оксид азота (газ) хлорид железа, хлорид меди |
Окисление происходит в условиях влажности и при наличии оксида углерода Взаимодействие происходит исключительно с концентрированным раствором при нагреве В обычных условиях НЕ РЕАГИРУЕТ В обычных условияхВ обычных условиях В обычных условиях |
||
|
Реакции оксида меди: С галогеноводородными кислотами Растворение в азотной кислоте Растворение в серной кислоте С угарным газом С водородом С металлами большей активности (например, алюминием) |
галогенид меди, вода нитрат меди, оксид азота, вода сульфат меди, оксид серы, вода чистый металл, углекислый газ чистое вещество, вода чистое вещество, оксид алюминия |
В обычных условиях Концентрированная кислота Концентрированная кислота Окислительные свойства Окислительные свойства Окислительные свойства |
||
|
Реакции гидроксида меди: С кислотами С раствором аммиака Со щелочами Разложение при нагреве |
бромид меди, хлорид меди гидроксид тетрааммиакат меди комплексные соединения меди оксид меди, вода |
В обычных условиях Легко реагирует, образуемое соединение обладает сине-фиолетовым оттенком Реакция проводится исключительно с концентрированными растворами щелочей |
||
|
Химические свойства солей меди |
||||
|
Реакции |
Образуемое вещество |
Особенности проведения |
||
|
Окисление: азотной кислотой (на примере хлорида I) кислородом (на примере хлорида I) разложение нитрата II разложение карбоната меди |
нитрат меди, соляная кислота, оксид азота, вода хлорид меди II, вода оксид меди, оксид натрия, кислород оксид меди, вода, углекислый газ |
Реакция проходит при концентрированной кислоте Требует соляной кислоты Проходит при нагреве Проходит при нагреве |
||
|
Гидролиз солей элемента на примере сульфата и карбоната натрия |
|
Выполняется по катиону слабого основания, аниону слабой кислоты |
||
В основном состоянии атом меди подразумевает ядро с положительным зарядом, вокруг наблюдается движение 29 электронов, из них один – в наружном слое.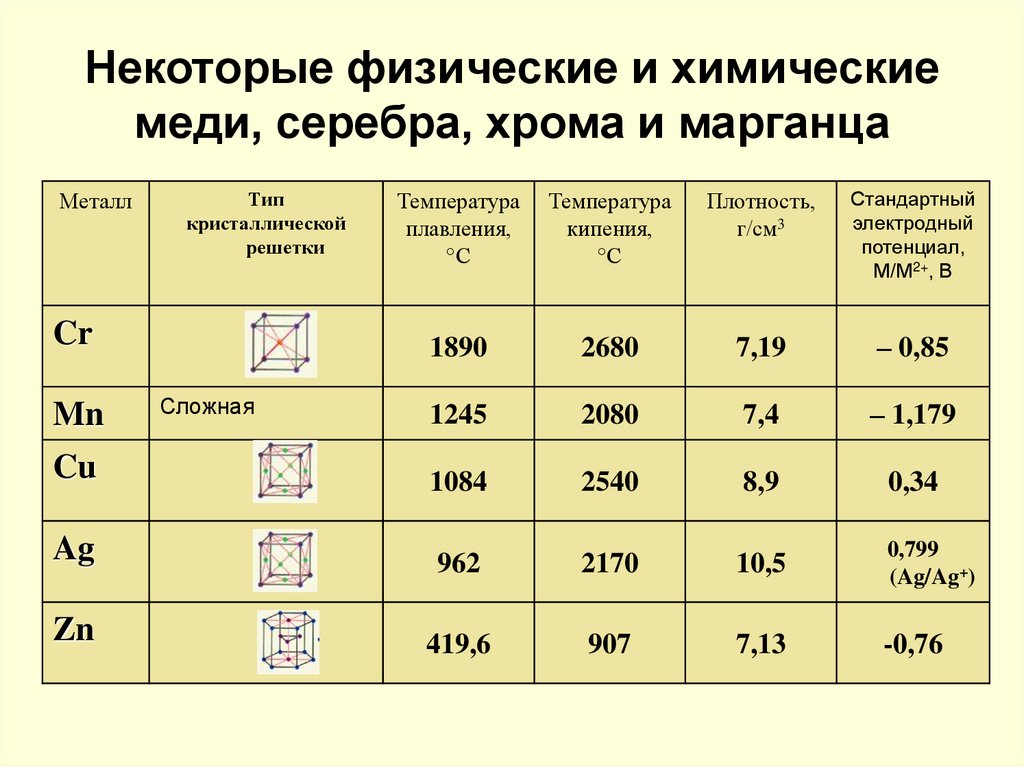 Электронное строение схоже со структурой атомов щелочных металлов, но радиусы атомов и ионов меди существенно меньше. Этим объясняется более высокая плотность, вследствие чего металл характеризуется высокой температурой плавления. Молярная масса элемента совпадает с атомной, составляющей 63,54 г/моль.
Электронное строение схоже со структурой атомов щелочных металлов, но радиусы атомов и ионов меди существенно меньше. Этим объясняется более высокая плотность, вследствие чего металл характеризуется высокой температурой плавления. Молярная масса элемента совпадает с атомной, составляющей 63,54 г/моль.
Наиболее ценные для применения свойства меди:
- мягкость и пластичность, обуславливающие хорошую податливость в обработке и вытяжке;
- высокие показатели теплопроводности и электропроводимости;
- коррозийная устойчивость;
- невосприимчивость к ультрафиолетовому излучению, перепадам температур, химическим воздействиям;
- эстетичность поверхности.
Свариваемость металлопроката характеризуется составом меди. При высоком содержании в сплавах фосфорных, серных свинцовых примесей процесс сварки сопровождается трудностями. Подверженность металла окислению обуславливает образование хрупких швов и трещин. Сварку выполняют с использованием флюсовой либо газовой защиты и применением присадочных материалов с раскислителями.
В промышленных масштабах медь получают из руд – медного блеска и колчедана. Добыча чистого металла осуществляется пирометаллургическим и гидрометаллургическим способами. При пирометаллургической технологии применяются процессы обогащения с обжигом, плавки на штейн, конвертерной продувки. Гидрометаллургическая технология предусматривает выщелачивание металла с помощью слабой серной кислоты и последующим выделением из раствора чистой меди.
Востребованным сырьем в производстве выступает вторичный металл. Сплавы меди с оловом, цинком, алюминием, титаном, никелем присутствуют во многих бытовых и промышленных изделиях.
Источники лома меди:
- обмотка двигателей;
- ламповые телевизоры;
- компрессионные холодильники;
- кабели проводки;
- трансформаторы;
- вышедшие из эксплуатации автомобили, вагоны, суда.
Медные сплавы классифицируют на латунь, подразумевающую соединения меди с цинком, и бронзу, в составе которой присутствуют прочие химические элементы.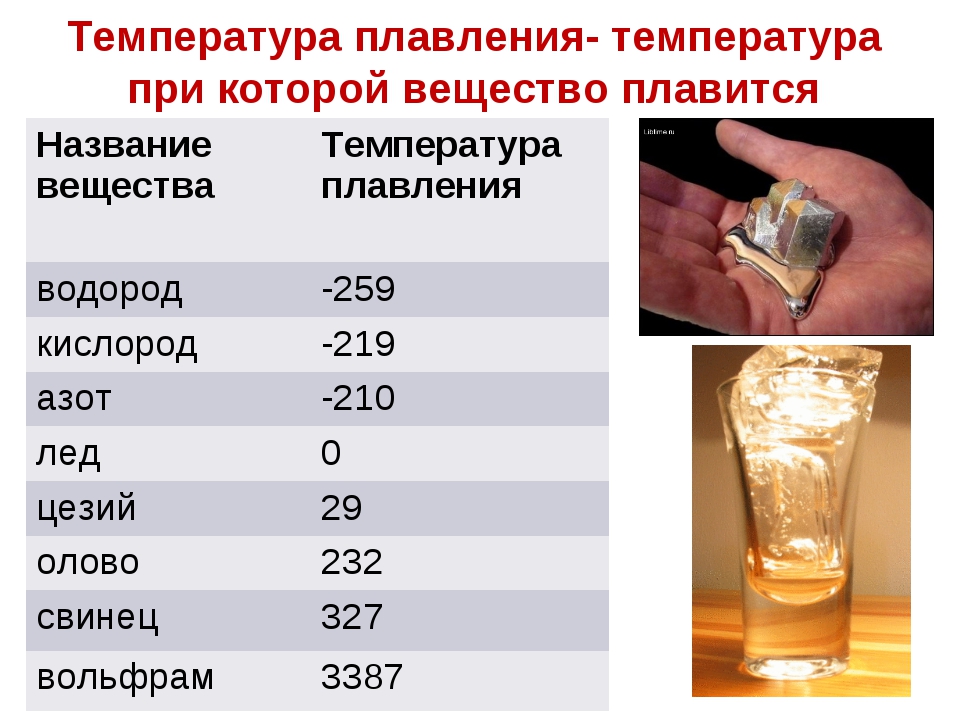 В процессе переработки лома выполняется сортировка и очистка вещества от примесей.
В процессе переработки лома выполняется сортировка и очистка вещества от примесей.
Металл высоко востребован электротехнической отраслью, низкое удельное сопротивление обуславливает популярность медных силовых кабелей и комплектующих для трансформаторов. Показатели теплопроводности элемента позволяют применять его в производстве теплового оборудования – систем отопления, теплообменников, кондиционеров. Сплавы металла с золотом пользуются популярностью в ювелирном деле.
Экологичные свойства меди широко применяются в строительстве. Устойчивый к коррозии металл служит сырьем в производстве кровельных материалов, дверной фурнитуры, перил. Биологическая активность элемента объясняет использование меди в производстве минеральных удобрений. Вещество входит в состав медицинских препаратов, выступая компонентом антисептических глазных и противоожоговых растворов.
Медь сернокислая 5-водная Ч – База химической продукции Югреактив
Главная»В помощь технологу»Химическая продукция»Реактивная продукция»Медь сернокислая 5-водная Ч
Медь сернокислая (II) 5-водная
Синонимы: Медь (II) сульфат пятиводная, Медь сернокислая (II) пентагидрат, медный купорос, сульфат меди
Мы предлагаем Медь сернокислую, медь сульфат 5-водную по выгодным ценам с доставкой по всей России.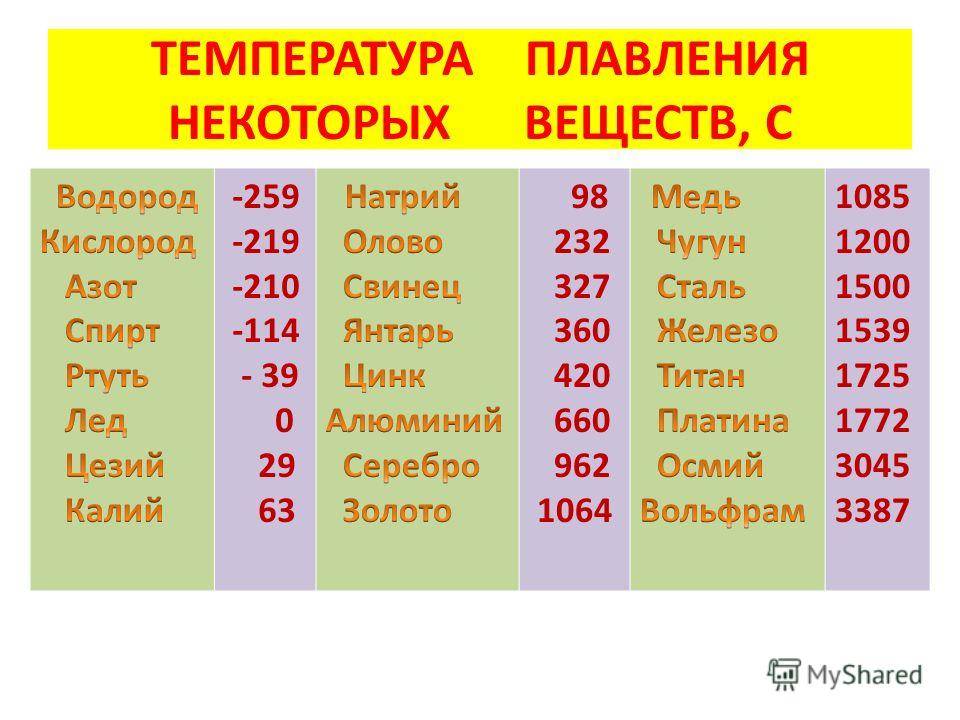
Спецификация | |
|---|---|
Молекулярный вес | 249,68 |
Плотность | 2,29 г/см3 (20°C) |
Температура плавления | 110С |
Медь сернокислая, «ч» | % |
Основное вещ-во, не менее | 98,5 % |
Нерастворимых в воде веществ, не более | 0,008 % |
Содержание CL, не ,более | 0,005 % |
Содержание N общ. | 0,008 % |
Содержание Fe, не более | 0,02 % |
Содержание SO4, не более | 0,2 % |
Медь сернокислая, «чда» | % |
Основное вещ-во, не менее | 99,0 % |
Содержание меди (Cu), не менее | 25,0 % |
Нерастворимых в воде веществ, не более | 0,005 % |
Содержание хлоридов (CL), не более | 0,001 % |
Содержание N общ., не более | 0,001 % |
Содержание Fe, не более | 0,005 % |
Содержание Pb, не более | 0,005 % |
Содержание Sb, не более | 0,006 % |
Содержание Ni, не более | 0,0005 % |
Содержание Zn, не более | 0,002 % |
Медь сернокислая (II) 5-водная или ее также называют медный купорос, сульфат меди — это синий кристаллический порошок, растворимый в воде, разбавленном спирте и концентрированной соляной кислоте, выветривающиеся на воздухе, легко образует основные сульфаты, двойные соли (шёниты), аммиакаты.
Медь сернокислая (II) 5-водная встречается в природе в виде минералов халькокианита CuSO4, халькантита CuSO4.5h3O, бонаттита CuSO4.3Н2О, бутита CuSO4.7Н2О, брошантита CuSO4.3Сu(ОН)2 и др.
Получение
Медь сернокислую, медный купорос получают в промышленности
• растворением меди и медных отходов в разбавленной серной кислоте при продувании воздуха;
• растворением CuO в серной кислоте;
• сульфатизирующим обжигом сульфидов меди;
• как побочный продукт электролитического рафинирования меди и др.
Применение сульфата меди
Медь сернокислая или Медь (II) сульфат пятиводная широко используют
• как протраву при крашении текстильных материалов,
• для усиления и тонирования отпечатков в фотографии;
• для протравливания семян,
• в гальванотехнике,
• Медный купорос марок «Ч» и «ЧДА» успешно используется в сельском хозяйстве как средство защиты плодово-ягодных, фруктовых, овощных растений и городских зеленых насаждений, то есть как фунгицид; для приготовления добавок вносимых в почву и кормовых добавок для домашних и сельскохозяйственных животных, премиксов, для приготовления бордоской жидкости и бургундской смеси. Возможно применение медного купороса при обработке зерновых культур в процессе хранения и протравке семян перед посевом для уничтожения спор плесневых грибов и др.
Возможно применение медного купороса при обработке зерновых культур в процессе хранения и протравке семян перед посевом для уничтожения спор плесневых грибов и др.
Размерная зависимость индуцированного температурой фазового перехода твердое тело-твердое в сульфиде меди(I) (журнальная статья)
Размерная зависимость индуцированного температурой фазового перехода твердое тело-твердое в сульфиде меди(I) (журнальная статья) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
Определение фазовых диаграмм для нанокристаллических форм материалов имеет решающее значение для нашего понимания наноструктур и разработки функциональных материалов с использованием наноразмерных строительных блоков. Возможность изучения таких превращений в наноматериалах с контролируемой формой позволяет лучше понять механизмы перехода и влияние отдельных аспектов. Здесь мы представляем исследование размерно-индуцированного температурно-индуцированного фазового перехода в наностержнях сульфида меди от низкого к высокому халькозину. Мы находим, что температура перехода существенно снижается, а фаза с высоким содержанием халькоцита появляется в мельчайших нанокристаллах при температурах настолько низких, что они типичны для фотоэлектрической работы. Зависимость от размера при фазовых превращениях предполагает возможность доступа к морфологиям, которые не обнаруживаются в объемных твердых телах в условиях окружающей среды. Эти ранее недоступные кристаллические фазы могут позволить использовать материалы с более высокими характеристиками в ряде приложений, включая датчики, переключение, освещение и фотогальванику.
Возможность изучения таких превращений в наноматериалах с контролируемой формой позволяет лучше понять механизмы перехода и влияние отдельных аспектов. Здесь мы представляем исследование размерно-индуцированного температурно-индуцированного фазового перехода в наностержнях сульфида меди от низкого к высокому халькозину. Мы находим, что температура перехода существенно снижается, а фаза с высоким содержанием халькоцита появляется в мельчайших нанокристаллах при температурах настолько низких, что они типичны для фотоэлектрической работы. Зависимость от размера при фазовых превращениях предполагает возможность доступа к морфологиям, которые не обнаруживаются в объемных твердых телах в условиях окружающей среды. Эти ранее недоступные кристаллические фазы могут позволить использовать материалы с более высокими характеристиками в ряде приложений, включая датчики, переключение, освещение и фотогальванику.
- Авторов:
- Ривест, Джесси Б.
 ; Фонг, Лам-Киу; Джайн, Прашант К.; Тони, Майкл Ф; Аливисатос, Пол
; Фонг, Лам-Киу; Джайн, Прашант К.; Тони, Майкл Ф; Аливисатос, Пол
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория Лоуренса Беркли. (LBNL), Беркли, Калифорния (США)
- Организация-спонсор:
- Отделение материаловедения
- Идентификатор ОСТИ:
- 1051268
- Номер(а) отчета:
- LBNL-5080E
Идентификатор журнала: ISSN 1948-7185; РНН: US201218%%1356
- Номер контракта с Министерством энергетики:
- ДЭ-АС02-05Ч21231
- Тип ресурса:
- Журнальная статья
- Название журнала:
- Письма журнала физической химии
- Дополнительная информация журнала:
- Том журнала: 2; Выпуск журнала: 19; Идентификатор журнала: ISSN 1948-7185
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 14 СОЛНЕЧНАЯ ЭНЕРГЕТИКА; 36 МАТЕРИАЛОВЕДЕНИЕ; 75 ФИЗИКА КОНДЕНСИРОВАННЫХ ВЕЩЕСТВ, СВЕРХПРОВОДИМОСТЬ И СВЕРХТЕКУЧЕСТЬ; 37 НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, ФИЗИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ; 77 НАНОНАУКА И НАНОТЕХНОЛОГИИ; СУЛЬФИДЫ МЕДИ; ДИЗАЙН; ФУНКЦИОНАЛЫ; НАНОСТРУКТУРЫ; ФАЗОВЫЕ ДИАГРАММЫ; ФОРМА; СУЛЬФИДЫ; ПРЕОБРАЗОВАНИЯ; ТЕМПЕРАТУРА ПЕРЕХОДА; фазовый переход, низкий высокий халькозин, наночастица, сульфид меди
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Ривест, Джесси Б.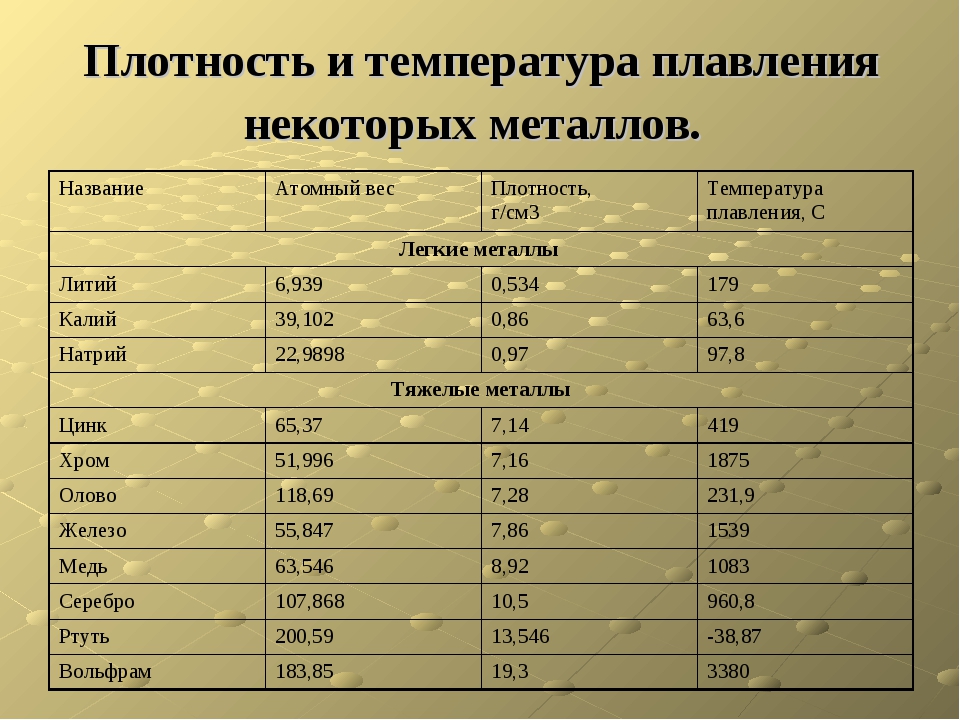 , Фонг, Лам-Киу, Джайн, Прашант К., Тони, Майкл Ф. и Аливисатос, А. Пол. Размерная зависимость индуцированного температурой фазового перехода твердое тело-твердое в сульфиде меди(I) . США: Н. П., 2011.
Веб. дои: 10.1021/jz2010144.
, Фонг, Лам-Киу, Джайн, Прашант К., Тони, Майкл Ф. и Аливисатос, А. Пол. Размерная зависимость индуцированного температурой фазового перехода твердое тело-твердое в сульфиде меди(I) . США: Н. П., 2011.
Веб. дои: 10.1021/jz2010144.
Копировать в буфер обмена
Ривест, Джесси Б., Фонг, Лам-Киу, Джайн, Прашант К., Тони, Майкл Ф. и Аливисатос, А. Пол. Размерная зависимость индуцированного температурой фазового перехода твердое тело-твердое в сульфиде меди(I) . Соединенные Штаты. https://doi.org/10.1021/jz2010144
Копировать в буфер обмена
Ривест, Джесси Б., Фонг, Лам-Киу, Джайн, Прашант К., Тони, Майкл Ф. и Аливисатос, А. Пол. 2011.
«Размерная зависимость индуцированного температурой фазового перехода твердое тело-твердое в сульфиде меди (I)». Соединенные Штаты. https://doi.org/10.1021/jz2010144. https://www.osti.gov/servlets/purl/1051268.
https://doi.org/10.1021/jz2010144. https://www.osti.gov/servlets/purl/1051268.
Копировать в буфер обмена
@статья{osti_1051268,
title = {Зависимость от размера температурно-индуцированного фазового перехода твердое тело-твердое в сульфиде меди (I)},
автор = {Ривест, Джесси Б. и Фонг, Лам-Киу и Джейн, Прашант К. и Тони, Майкл Ф. и Аливисатос, А. Пол},
abstractNote = {Определение фазовых диаграмм для нанокристаллических форм материалов имеет решающее значение для нашего понимания наноструктур и разработки функциональных материалов с использованием наноразмерных строительных блоков. Возможность изучения таких превращений в наноматериалах с контролируемой формой позволяет лучше понять механизмы перехода и влияние отдельных аспектов. Здесь мы представляем исследование размерно-индуцированного температурно-индуцированного фазового перехода в наностержнях сульфида меди от низкого к высокому халькозину. Мы находим, что температура перехода существенно снижается, а фаза с высоким содержанием халькоцита появляется в мельчайших нанокристаллах при температурах настолько низких, что они типичны для фотоэлектрической работы. Зависимость от размера при фазовых превращениях предполагает возможность доступа к морфологиям, которые не обнаруживаются в объемных твердых телах в условиях окружающей среды. Эти недоступные другим способом кристаллические фазы могут позволить использовать материалы с более высокими характеристиками в ряде приложений, включая датчики, переключение, освещение и фотогальванику.},
Мы находим, что температура перехода существенно снижается, а фаза с высоким содержанием халькоцита появляется в мельчайших нанокристаллах при температурах настолько низких, что они типичны для фотоэлектрической работы. Зависимость от размера при фазовых превращениях предполагает возможность доступа к морфологиям, которые не обнаруживаются в объемных твердых телах в условиях окружающей среды. Эти недоступные другим способом кристаллические фазы могут позволить использовать материалы с более высокими характеристиками в ряде приложений, включая датчики, переключение, освещение и фотогальванику.},
дои = {10.1021/jz2010144},
URL-адрес = {https://www.osti.gov/biblio/1051268},
Journal = {Journal of Physical Chemistry Letters},
ISSN = {1948-7185},
число = 19,
объем = 2,
место = {США},
год = {2011},
месяц = {7}
}
Копировать в буфер обмена
Просмотреть журнальную статью (0,85 МБ)
https://doi. org/10.1021/jz2010144
org/10.1021/jz2010144
Найти в Google Scholar
Поиск в WorldCat, чтобы найти библиотеки, в которых может храниться этот журнал Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Похожие записи в сборниках ОСТИ.ГОВ:
- Аналогичные записи
Чистый электрический процесс отделения важных с коммерческой точки зрения металлов от сульфидных минералов за одну стадию
Постдоктор Массачусетского технологического института Сулата Саху (слева) и аспирант Брайан Хмеловец держат образец почти чистой меди, нанесенной на железный электрод. Предоставлено: Denis Paiste/Центр обработки материалов Исследователи Массачусетского технологического института определили правильную температуру и химическую смесь для селективного отделения чистой меди и других металлических микроэлементов от минералов на основе серы с помощью электролиза расплава. Этот одностадийный экологически чистый процесс упрощает производство металлов и устраняет токсичные побочные продукты, такие как диоксид серы.
Этот одностадийный экологически чистый процесс упрощает производство металлов и устраняет токсичные побочные продукты, такие как диоксид серы.
Постдоктор Сулата К. Саху и аспирант Брайан Дж. Чмеловец ’12 разложили богатые серой минералы на чистую серу и извлекли три различных металла очень высокой чистоты: медь, молибден и рений. Они также подсчитали количество энергии, необходимой для запуска процесса экстракции.
Электролизная ячейка представляет собой замкнутую цепь, похожую на батарею, но вместо производства электроэнергии она потребляет электроэнергию для разделения соединений на их элементы, например, для расщепления воды на водород и кислород. Такие электролитические процессы являются основным методом производства алюминия и используются в качестве последней стадии удаления примесей при производстве меди. Однако, в отличие от алюминия, для медьсодержащих сульфидных минералов не существует прямых процессов электролитического разложения с получением жидкой меди.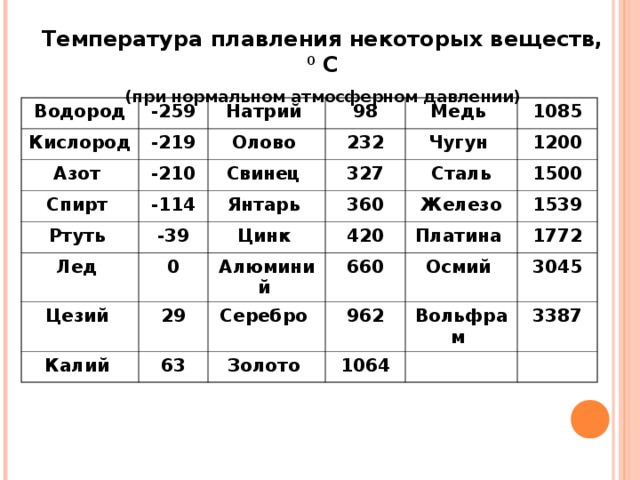
Исследователи Массачусетского технологического института нашли многообещающий метод образования жидкой металлической меди и газообразной серы в своей ячейке из электролита, состоящего из сульфида бария, сульфида лантана и сульфида меди, который дает более 99,9% чистой меди. Эта чистота эквивалентна лучшим современным методам производства меди. Их результаты опубликованы в статье Electrochimica Acta под руководством старшего автора Антуана Алланора, доцента кафедры металлургии.
Одноэтапный процесс
«Это одностадийный процесс, просто разлагающий сульфид на медь и серу. Другие предыдущие методы состоят из нескольких этапов», — объясняет Саху. «Принимая этот процесс, мы стремимся снизить стоимость».
Медь пользуется растущим спросом для использования в электромобилях, солнечной энергии, бытовой электронике и других целях повышения энергоэффективности. Большинство современных процессов извлечения меди сжигают сульфидные минералы в воздухе, что приводит к образованию диоксида серы, вредного загрязнителя воздуха, который необходимо улавливать и перерабатывать, но новый метод производит элементарную серу, которую можно безопасно повторно использовать, например, в удобрениях. Исследователи также использовали электролиз для получения рения и молибдена, которые часто встречаются в сульфидах меди в очень малых количествах.
Исследователи также использовали электролиз для получения рения и молибдена, которые часто встречаются в сульфидах меди в очень малых количествах.
Новая работа основана на статье Журнала Электрохимического общества 2016 года, предлагающей доказательства электролитической экстракции меди, авторами которой являются Самира Соханваран, Санг-Квон Ли, Гийом Ламботт и Алланор. Они показали, что добавление сульфида бария к расплаву сульфида меди подавило электропроводность сульфида меди настолько, чтобы извлечь небольшое количество чистой меди из высокотемпературной электрохимической ячейки, работающей при 1105 градусах Цельсия (2021 по Фаренгейту). Соханваран сейчас работает научным сотрудником в канадской компании Natural Resources-Canmet Mining; Ли — старший научный сотрудник Корейского научно-исследовательского института атомной энергии; а Ламботт сейчас старший инженер-исследователь в Boston Electrometallurgical Corp.
«Эта статья была первой, в которой было показано, что можно использовать смесь, в которой предположительно электронная проводимость преобладает над проводимостью, но на самом деле она не равна 100%. Существует крошечная ионная фракция, которая достаточно хороша для производства меди». Алланор объясняет.
Существует крошечная ионная фракция, которая достаточно хороша для производства меди». Алланор объясняет.
«Новый документ показывает, что мы можем пойти дальше и сделать его почти полностью ионным, то есть уменьшить долю электронной проводимости и, следовательно, повысить эффективность производства металла», — говорит Алланор.
Эти сульфидные минералы представляют собой соединения, в которых металл и элементы серы имеют общие электроны. В расплавленном состоянии у ионов меди отсутствует один электрон, что придает им положительный заряд, в то время как ионы серы несут два дополнительных электрона, что придает им отрицательный заряд. Желаемой реакцией в электролизере является образование атомов элементов путем добавления электронов к металлам, таким как медь, и отнятия электронов у серы. Это происходит, когда дополнительные электроны вводятся в систему приложенным напряжением. Ионы металлов реагируют на катоде, отрицательно заряженном электроде, где они приобретают электроны в процессе, называемом восстановлением; тем временем отрицательно заряженные ионы серы реагируют на аноде, положительно заряженном электроде, где они отдают электроны в процессе, называемом окислением.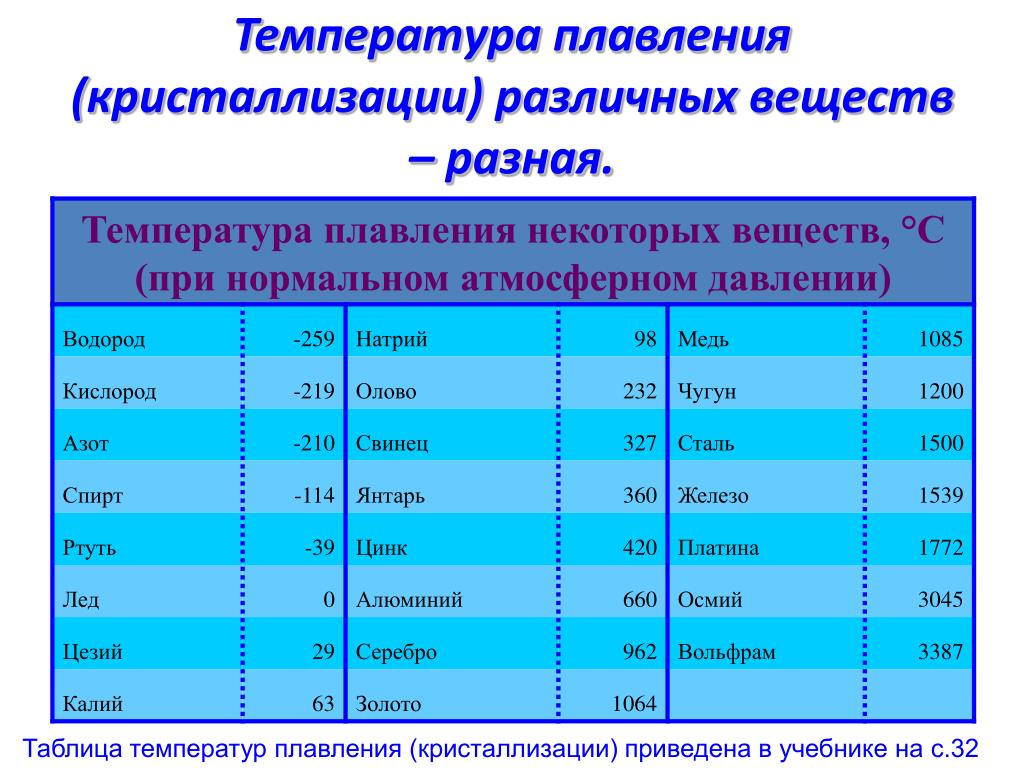
В ячейке, в которой использовался, например, только сульфид меди, из-за его высокой электронной проводимости дополнительные электроны просто протекали бы через электролит, не взаимодействуя с отдельными ионами меди и серы на электродах, и не происходило бы разделения. Исследователи Allanore Group успешно идентифицировали другие сульфидные соединения, которые при добавлении к сульфиду меди изменяют поведение расплава, так что ионы, а не электроны, становятся первичными носителями заряда в системе и, таким образом, обеспечивают желаемые химические реакции. С технической точки зрения, добавки увеличивают ширину запрещенной зоны сульфида меди, поэтому он больше не является электропроводящим, объясняет Хмеловец. Доля электронов, участвующих в реакциях окисления и восстановления, измеряемая в процентах от общего тока, т. е. полного потока электронов в ячейке, называется ее фарадеевской эффективностью.
Удвоение эффективности
Новая работа удваивает эффективность электролитического извлечения меди, указанную в первой статье, которая составляла 28 процентов с электролитом, в котором к сульфиду меди добавлялся только сульфид бария, до 59 процентов во второй статье с обоими лантанами. сульфид и сульфид бария добавляют к сульфиду меди.
сульфид и сульфид бария добавляют к сульфиду меди.
«Демонстрация того, что мы можем проводить фарадеевские реакции в жидком сульфиде металла, является новшеством и может открыть дверь для изучения многих различных систем», — говорит Хмеловец. «Это работает не только с медью. Мы смогли получить рений, и мы смогли сделать молибден». Рений и молибден являются промышленно важными металлами, которые находят применение, например, в двигателях реактивных самолетов. Лаборатория Allanore также использовала электролиз расплава для производства цинка, олова и серебра, но возможны свинец, никель и другие металлы, предполагает он.
Количество энергии, необходимое для запуска процесса разделения в электролизере, пропорционально фарадеевскому КПД и напряжению в ячейке.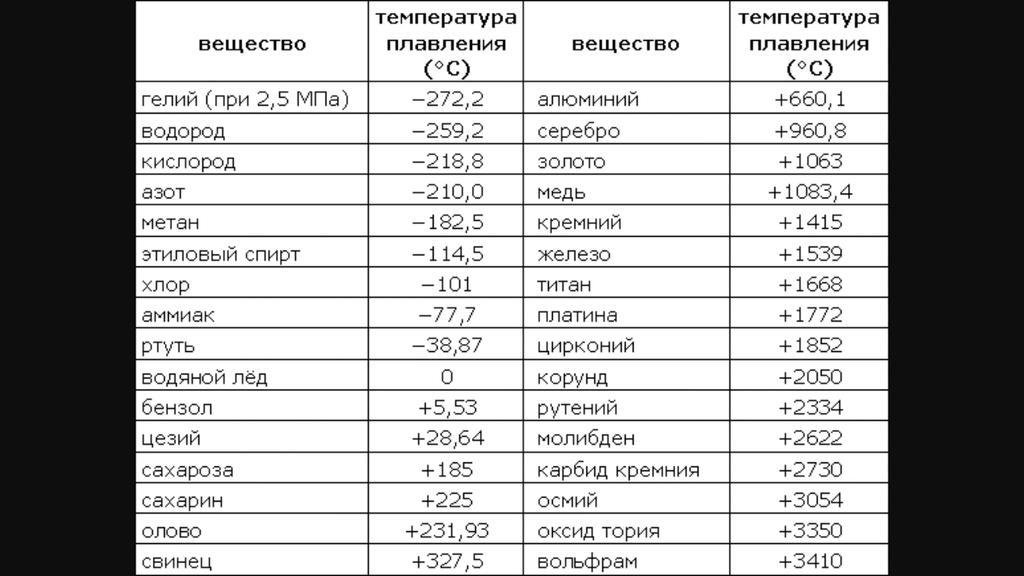 Для воды, которая была одним из первых соединений, выделенных электролизом, минимальное напряжение ячейки или энергия разложения составляет 1,23 вольта. Саху и Хмеловец определили напряжение ячейки в своей ячейке как 0,06 вольта для сульфида рения, 0,33 вольта для сульфида молибдена и 0,45 вольта для сульфида меди. «Для большинства наших реакций мы применяем 0,5 или 0,6 вольта, так что три сульфида вместе восстанавливаются до металла, рения, молибдена и меди», — объясняет Саху. При рабочей температуре ячейки и приложенном потенциале от 0,5 до 0,6 вольта система предпочитает разлагать эти металлы, потому что энергия, необходимая для разложения как сульфида лантана — около 1,7 вольт, так и сульфида бария — около 1,9вольт – сравнительно намного выше. Отдельные эксперименты также доказали способность селективно восстанавливать рений или молибден без восстановления меди на основе их разной энергии разложения.
Для воды, которая была одним из первых соединений, выделенных электролизом, минимальное напряжение ячейки или энергия разложения составляет 1,23 вольта. Саху и Хмеловец определили напряжение ячейки в своей ячейке как 0,06 вольта для сульфида рения, 0,33 вольта для сульфида молибдена и 0,45 вольта для сульфида меди. «Для большинства наших реакций мы применяем 0,5 или 0,6 вольта, так что три сульфида вместе восстанавливаются до металла, рения, молибдена и меди», — объясняет Саху. При рабочей температуре ячейки и приложенном потенциале от 0,5 до 0,6 вольта система предпочитает разлагать эти металлы, потому что энергия, необходимая для разложения как сульфида лантана — около 1,7 вольт, так и сульфида бария — около 1,9вольт – сравнительно намного выше. Отдельные эксперименты также доказали способность селективно восстанавливать рений или молибден без восстановления меди на основе их разной энергии разложения.
Промышленный потенциал
Важные стратегические и товарные металлы, включая медь, цинк, свинец, рений и молибден, обычно встречаются в сульфидных рудах и реже в оксидных рудах, как в случае с алюминием. «Обычно вы сжигаете их в воздухе, чтобы удалить серу, но при этом вы получаете SO2 [диоксид серы], и никому не разрешается выбрасывать его прямо в воздух, поэтому они должны каким-то образом его улавливать. Их много. капитальных затрат, связанных с улавливанием SO2 и преобразованием его в серную кислоту», — объясняет Хмеловец.
«Обычно вы сжигаете их в воздухе, чтобы удалить серу, но при этом вы получаете SO2 [диоксид серы], и никому не разрешается выбрасывать его прямо в воздух, поэтому они должны каким-то образом его улавливать. Их много. капитальных затрат, связанных с улавливанием SO2 и преобразованием его в серную кислоту», — объясняет Хмеловец.
Ближайший промышленный процесс к электролитическому извлечению меди, который они надеются увидеть, — это производство алюминия с помощью электролитического процесса, известного как процесс Холла-Эру, в результате которого образуется расплавленный металлический алюминий, который можно непрерывно выпускать. «В идеале процесс должен быть непрерывным, — говорит Хмеловец. «Итак, в нашем случае вы должны поддерживать постоянный уровень жидкой меди, а затем периодически выпускать ее из электролизера. В алюминиевой промышленности на это ушло много инженерных работ, поэтому мы надеемся использовать это».
Саху и Хмеловец проводили свои эксперименты при температуре 1227°С, что примерно на 150°С выше точки плавления меди. Это температура, обычно используемая в промышленности для извлечения меди.
Это температура, обычно используемая в промышленности для извлечения меди.
Дальнейшие усовершенствования
Системы электролиза алюминия работают с 95-процентным фарадеевским КПД, поэтому есть возможности для улучшения по сравнению с заявленным исследователями 59-процентным КПД. По словам Саху, чтобы повысить эффективность своих ячеек, им может потребоваться модифицировать конструкцию ячеек, чтобы извлекать большее количество жидкой меди. Электролит также можно дополнительно настроить, добавив сульфиды, отличные от сульфида бария и сульфида лантана. «Нет единого решения, которое позволило бы нам это сделать. Это будет оптимизация, позволяющая перейти к более крупному масштабу», — говорит Хмеловец. Эта работа продолжается.
34-летняя Саху получила докторскую степень по химии в Мадрасском университете в Индии. 27-летний Хмеловец, студент второго курса докторантуры и научный сотрудник Salapatas в области материаловедения и инженерии, получил степень бакалавра в области химического машиностроения в Массачусетском технологическом институте в 2012 году и степень магистра в области химического машиностроения в Калифорнийском технологическом институте в 2014 году.
Работа вписывается в работу Allanore Group по высокотемпературным расплавленным материалам, включая недавние прорывы в разработке новых формул для прогнозирования полупроводимости в расплавленных соединениях и демонстрацию расплавленного термоэлектрического элемента для производства электроэнергии из промышленного сбросного тепла. Allanore Group ищет патент на некоторые аспекты процесса экстракции.
Новая и значительная работа
«Используя интеллектуальную схему химического процесса, эти исследователи разработали очень новый способ производства меди», — говорит Рохан Аколкар, доцент кафедры химической и биомолекулярной инженерии им. Ф. Алекса Нейсона в Case Western Reserve. университета, который не участвовал в этой работе. «Исследователи разработали процесс, который включает в себя многие ключевые ингредиенты — это более чистый, масштабируемый и простой одноэтапный процесс производства меди из сульфидной руды».
«С технологической точки зрения авторы осознают необходимость повышения эффективности процесса при сохранении внутренней чистоты производимой меди», — говорит Аколкар, посетивший лабораторию Allanore в конце прошлого года. «Если технология будет развиваться дальше и ее технико-экономические показатели будут выглядеть благоприятными, то она может обеспечить потенциальный путь для более простого и чистого производства металлической меди, что важно для многих приложений». Аколкар отмечает, что «качество этой работы превосходно. Исследовательская группа Allanore в Массачусетском технологическом институте находится в авангарде, когда речь идет о продвижении исследований по электролизу расплавленных солей».
«Если технология будет развиваться дальше и ее технико-экономические показатели будут выглядеть благоприятными, то она может обеспечить потенциальный путь для более простого и чистого производства металлической меди, что важно для многих приложений». Аколкар отмечает, что «качество этой работы превосходно. Исследовательская группа Allanore в Массачусетском технологическом институте находится в авангарде, когда речь идет о продвижении исследований по электролизу расплавленных солей».
Профессор химического машиностроения Рочестерского университета Джейкоб Йорне говорит: «Существующие процессы экстракции включают несколько этапов и требуют больших капиталовложений, поэтому дорогостоящие усовершенствования запрещены. Прямой электролиз сульфидных руд металлов также выгоден, поскольку исключает образование диоксида серы. , загрязнитель кислотных дождей».
“Электрохимия и термодинамика в расплавленных солях сильно отличаются от водных [водных] систем, и исследования Алланора и его группы показывают, что многие хорошие химические процессы игнорировались в прошлом из-за нашей рабской преданности воде. , — предлагает Жорне. «Прямой электролиз металлических руд открывает путь к возрождению металлургии, где могут быть реализованы новые открытия и процессы, которые могут модернизировать стареющую добычную промышленность и повысить ее энергоэффективность. Новый подход может быть применен к другим металлам, имеющим большое стратегическое значение, таким как редкоземельные металлы».
, — предлагает Жорне. «Прямой электролиз металлических руд открывает путь к возрождению металлургии, где могут быть реализованы новые открытия и процессы, которые могут модернизировать стареющую добычную промышленность и повысить ее энергоэффективность. Новый подход может быть применен к другим металлам, имеющим большое стратегическое значение, таким как редкоземельные металлы».
Дополнительная информация: Сулата К. Саху и др. Электролитическая экстракция меди, молибдена и рения из расплавленного сульфидного электролита, Electrochimica Acta (2017). DOI: 10.1016/j.electacta.2017.04.071
Предоставлено Массачусетский Институт Технологий
Эта история переиздана с разрешения MIT News (web.mit.edu/newsoffice/), популярного сайта, освещающего новости об исследованиях, инновациях и преподавании MIT.
Цитата :
Чистый электрический процесс для отделения коммерчески важных металлов от сульфидных минералов за одну стадию (29 июня 2017 г.


 таблице Менделеева
таблице Менделеева , не более
, не более ; Фонг, Лам-Киу; Джайн, Прашант К.; Тони, Майкл Ф; Аливисатос, Пол
; Фонг, Лам-Киу; Джайн, Прашант К.; Тони, Майкл Ф; Аливисатос, Пол