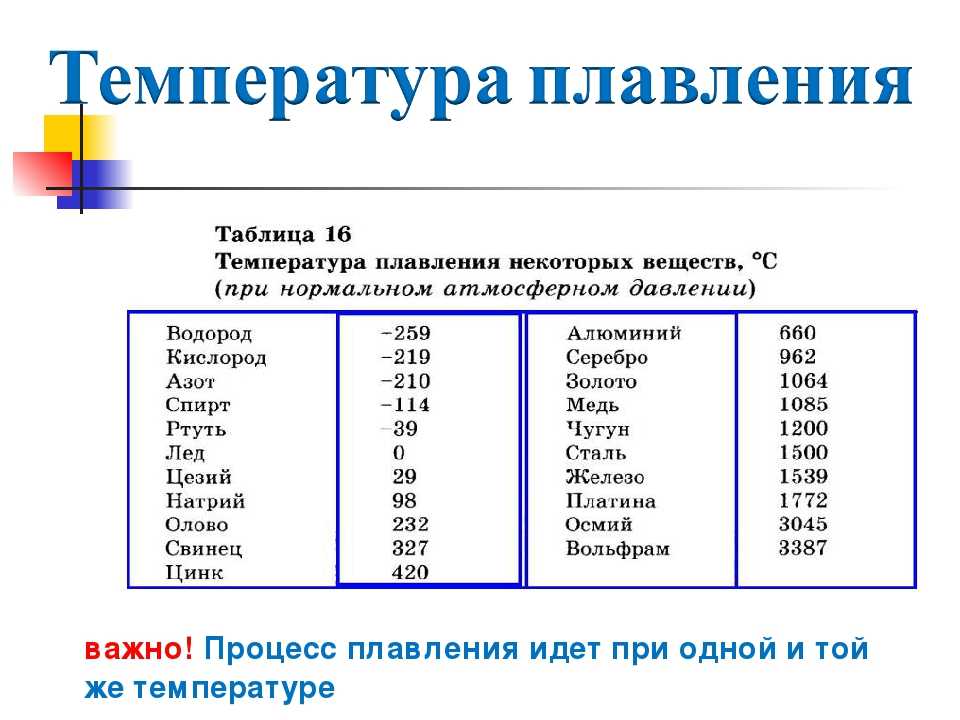
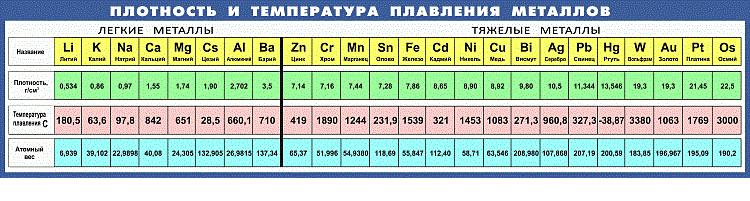
Температура плавления титана и его сплавов: Титан и его сплавы: свойства и сфера применения
alexxlab | 09.08.1985 | 0 | Разное
4. Титановые сплавы. Материаловедение: конспект лекций [litres]
4. Титановые сплавы
Титан – металл серебристо—белого цвета. Это один из наиболее распространенных в природе элементов. Среди других элементов по распространенности в земной коре (0,61 %) он занимает десятое место. Титан легок (плотность его 4,5 г/см 3), тугоплавок (температура плавления 1665 °C), весьма прочен и пластичен. На поверхности его образуется стойкая окисная пленка, за счет которой он хорошо сопротивляется коррозии в пресной и морской воде, а также в некоторых кислотах. При температурах до 882 °C он имеет гексагональную плотно упакованную решетку, при более высоких температурах – объемно—центрированный куб. Механические свойства листового титана зависят от химического состава и способа термической обработки. Предел прочности его – 300—1200 МПа (30—120 КГС/мм 2), относительное удлинение – 4—10 %. Вредными примесями титана являются азот, углерод, кислород и водород. Они снижают его пластичность и свариваемость, повышают твердость и прочность, ухудшают сопротивление коррозии.
Они снижают его пластичность и свариваемость, повышают твердость и прочность, ухудшают сопротивление коррозии.
При температуре свыше 500 °C титан и его сплавы легко окисляются, поглощая водород, который вызывает охрупчи—вание (водородная хрупкость). При нагревании выше 800 °C титан энергично поглощает кислород, азот и водород, эта его способность используется в металлургии для раскисления стали. Он служит легирующим элементом для других цветных металлов и для стали.
Благодаря своим замечательным свойствам титан и его сплавы нашли широкое применение в авиа-, ракето—и судостроении. Из титана и его сплавов изготовляют полуфабрикаты: листы, трубы, прутки и проволоку. Основными промышленными материалами для получения титана являются ильменит, рутил, перовскит и сфен (титанит). Технология получения титана сложна, трудоемка и длительна: сначала вырабатывают титановую губку, а затем путем переплавки в вакуумных печах из нее производят ковкий титан.
Губчатый титан, получаемый магнийтермическим способом, служит исходным материалом для производства титановых сплавов и других целей.

Данный текст является ознакомительным фрагментом.
Медь и сплавы
Медь и сплавы Довольно часто домашние слесари отдают предпочтение меди (удельный вес 9,0 г/см2), поскольку ее мягкость и пластичность позволяют добиваться точности и высокого качества при изготовлении всевозможных деталей и изделий.Чистая (красная) медь – прекрасный
ЛЕКЦИЯ № 5. Сплавы
ЛЕКЦИЯ № 5. Сплавы 1. Строение металлов Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот.2.
 Медные сплавы
Медные сплавы2. Медные сплавы Медь относится к числу металлов, известных с глубокой древности. Раннему знакомству человека с медью способствовало то, что она встречается в природе в свободном состоянии в виде самородков, которые иногда достигают значительных размеров. В настоящее
3. Алюминиевые сплавы
3. Алюминиевые сплавы Название «алюминий» происходит от латинского слова alumen – так за 500 лет до н. э. называли алюминиевые квасцы, которые использовались для протравливания при крашении тканей и дубления кож.По распространенности в природе алюминий занимает третье
5. Цинковые сплавы
5. Цинковые сплавы Сплав цинка с медью – латунь – был известен еще древним грекам и египтянам. Но выплавка цинка в промышленных масштабах началась лишь в XVII в.Цинк – металл светло—серо—голубоватого цвета, хрупкий при комнатной температуре и при 200 °C, при нагревании до
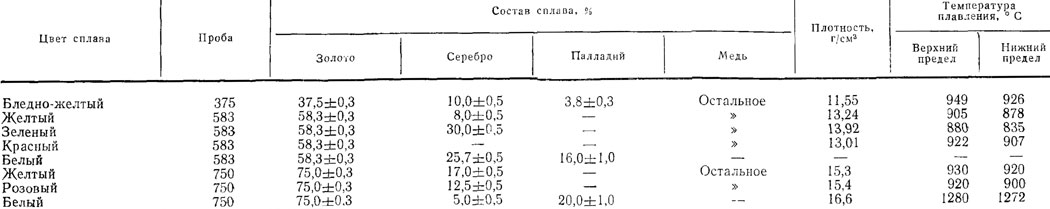
Сплавы золота
Сплавы золота
Для изготовления ювелирных и других изделий далеко не всегда используют чистые металлы. Происходит это из-за высокой стоимости драгоценных металлов, недостаточной твердостью их и износоустойчивости, поэтому на практике чаще всего употребляют сплавы,
Происходит это из-за высокой стоимости драгоценных металлов, недостаточной твердостью их и износоустойчивости, поэтому на практике чаще всего употребляют сплавы,
7.4. Сплавы меди, имитирующие золотые и серебряные сплавы
7.4. Сплавы меди, имитирующие золотые и серебряные сплавы С целью удешевления художественных изделий при производстве недорогих украшений широко используются томпак, латунь, мельхиор, нейзильбер; при изготовлении художественных изделий – бронзы.Сплавы меди с цинком,
8. Сплавы на основе алюминия
8. Сплавы на основе алюминия Алюминиевые сплавы классифицируют по технологии изготовления (деформируемые и литейные), способности к термической обработке (упрочняемые и неупрочнямые) и свойствам (рис. 8.1). Рис. 8.1. Диаграмма состояния алюминий – легирующий элемент
10.
 Серебро и его сплавы
Серебро и его сплавы10. Серебро и его сплавы Серебро – химический элемент, металл. Атомный номер 47, атомный вес 107,8. Плотность 10,5 г/см3. Кристаллическая решетка – гранецентрированная кубическая (ГЦК). Температура плавления 963 °C, кипения 2865 °C. Твердость по Бринеллю 16,7.Серебро – металл белого
10.4. Сплавы серебра для припоев
10.4. Сплавы серебра для припоев Припой – весьма важный вспомогательный материал в ювелирном деле.Для соединения различных элементов ювелирных изделий между собой, при работе в технике скань и зернь применяют серебряные припои – сплавы на основе серебра. Основное
11. Золото и его сплавы
11. Золото и его сплавы
Золото – химический элемент, металл. Атомный номер 79, атомный вес 196,97, плотность 19,32 г/см3. Кристаллическая решетка – кубическая гранецентрировапная (ГЦК). Температура плавления 1063 °C, кипения 2970 °C. Твердость по Бринеллю – 18,5.Золото – металл желтого
Температура плавления 1063 °C, кипения 2970 °C. Твердость по Бринеллю – 18,5.Золото – металл желтого
11.1. Двухкомпонентные сплавы золота
11.1. Двухкомпонентные сплавы золота В ювелирной промышленности иногда применяют двухкомпонентные сплавы: золото – медь и золото – серебро. Рис. 11.1. Диаграмма состояния Сu – Аu.Золото и медь обладают неограниченной растворимостью в жидком, а при высоких температурах и в
11.2. Многокомпонентные сплавы золота
11.2. Многокомпонентные сплавы золота В ювелирной промышленности для изготовления золотых изделий используют в большинстве случаев сплавы системы золото – серебро – медь, которые могут содержать добавки других металлов: никеля, палладия, цинка, платины. Химический
11.6. Золотые сплавы для припоев
11. 6. Золотые сплавы для припоев
При изготовлении ювелирных и художественных изделий из сплавов золота используется пайка. Состав и интервал температур плавки ювелирных припоев для пайки сплавов золота приведен в табл. 11.9. Маркировка золотых припоев осуществляется так
6. Золотые сплавы для припоев
При изготовлении ювелирных и художественных изделий из сплавов золота используется пайка. Состав и интервал температур плавки ювелирных припоев для пайки сплавов золота приведен в табл. 11.9. Маркировка золотых припоев осуществляется так
46. Магний и его сплавы
46. Магний и его сплавы Магний является химически активным металлом: образующаяся на воздухе оксидная пленка МдО в силу более высокой плотности, чем у самого магния, растрескивается и не имеет защитных свойств; порошок и стружка магния легко воспламеняются; горячий и
47. Титан и его сплавы
47. Титан и его сплавы Титан и сплавы на его основе обладают высокой коррозионной стойкостью и удельной прочностью. Недостатки титана: его активное взаимодействие с атмосферными газами, склонность к водородной хрупкости.Азот, углерод, кислород и водород, упрочняя титан,
Свойства титана | Температура плавления и плотность (Ti)
Свойства титана, которые представляют собой сочетание высокой прочности, жесткости, ударной вязкости, низкой плотности и хорошей коррозионной стойкости, обеспечиваемой различными титановыми сплавами при очень низких и повышенных температурах, позволяют снизить вес в аэрокосмических конструкциях и других высокопроизводительных процессах.
При поддержке adguard программа расширения адгуард от duty-free-spb
Содержание:
Титан — Titanium (Ti) определение
Титан химические свойства
Физические свойства титана
Титан механические свойства
Магнитные свойства (Ti)
Сплавы из титана и их свойства
Применение титановых сплавов
Свойства алюминия
Свойства алюминия создают спрос на изделия из этого металла…
Свойства меди
Свойства меди и её сплавов были известны человеку давно…
Титан имеет температуру плавления 1677°C (3051°F) и температуру кипения 3277°C (5931°F). Плотность (Ti) составляет 4,6 грамма на кубический сантиметр.
Определение: Титан — Titanium (Ti)Титан — это металл группы олова периодической таблицы Менделеева, который по многим своим свойствам напоминает железо. Хотя титан является четвертым металлом по распространенности в земной коре, его трудно извлечь из руд из-за его необычайно высокой реакционной способности при повышенных температурах.
Хотя титан является четвертым металлом по распространенности в земной коре, его трудно извлечь из руд из-за его необычайно высокой реакционной способности при повышенных температурах.
Определение титана описывает серебристо-серый металл, который является химическим элементом в периодической таблице элементов. Позиция таблицы Менделеева титана находится в периоде 4 периода.
Группа 4 (IVб), переходные металлы. Символ титана или аббревиатура титана в периодической таблице — Ti.
Является ли титан соединением? Титан не соединение, а элемент таблицы Менделеева. Элементы определяются как вещества, которые нельзя разложить на более простые вещества с помощью химии. Напротив, соединения определяются как вещества, образованные химической связью двух или более химических элементов.
Титан широко распространен в земной коре, и примерно 0,44% земной коры состоит из титана. Титан чаще всего встречается в природе в форме его руд, ильменита и рутила. Однако соединения титана в той или иной степени обнаруживаются во всех горных породах, почве и живых существах.
Однако соединения титана в той или иной степени обнаруживаются во всех горных породах, почве и живых существах.
Титан находится в середине периодической таблицы. Периодическая таблица представляет собой диаграмму, которая показывает, как химические элементы связаны друг с другом. Титан является переходным металлом и входит в группу 4 (IVB).
СИМВОЛ
TiАТОМНЫЙ НОМЕР
22АТОМНАЯ МАССА
47,88СЕМЕЙСТВО
Группа 4 (IVB)
Переходный металл
Титан был одним из первых элементов, открытых современными химиками. Период «современной» химии начинается после середины восемнадцатого века. Этот период выбран потому, что впервые были разработаны основные понятия современной химии.
Титан был открыт английским священником Уильямом Грегором (1761-1817). Грегор изучал минералы в качестве хобби. Он не считал себя химиком, и все же его исследования привели к открытию титана.
Диоксид титана или рутил (Ti02) и титанат железа или ильменит (FeTiO3) являются основными источниками металла. В настоящее время титан получают путем хлорирования руды в присутствии углерода при высокой температуре с образованием TiCl, который затем восстанавливается расплавленным магнием с образованием MgCl2 и титана.
В настоящее время титан получают путем хлорирования руды в присутствии углерода при высокой температуре с образованием TiCl, который затем восстанавливается расплавленным магнием с образованием MgCl2 и титана.
Полученный губчатый титан разделяют на мелкие частицы (на стружку) путем измельчения и отделяют от избытка магния и хлорида магния, связанных с его восстановлением. Затем он плавится в дуговых печах для получения больших слитков титана или титановых сплавов.
Хотя титановые сплавы обладают свойствами, которые делают их очень привлекательными для определенных конструкционных применений, высокая стоимость этих сплавов в прошлом препятствовала их использованию в инженерных конструкциях. До относительно недавнего интереса к разработке конструкционных титановых сплавов соединения титана в основном использовались в качестве металлургических, раскислителей и денитрогенизаторов для повышения ударной вязкости стальных сплавов, в качестве белых пигментов в красках и керамике, а также в красителях и протравах для бумаги и текстиля.
Конструкционные сплавы титана — пластичны, легки по весу, обладают хорошими усталостными свойствами и коррозионной стойкостью. Удельный вес титана составляет всего 2/3 от веса стали и только на 60 % больше, чем у алюминия. С другой стороны, прочность титана намного выше, чем у алюминия, поскольку она на тот же порядок, что и у легированных сталей. Эти весо-прочностные свойства титановых сплавов обеспечивают им самое высокое соотношение прочности и веса среди всех конструкционных материалов. Считается, что титан занимает промежуточное положение между сталью и алюминием по жесткости при растяжении и сдвиге.
Титан химические свойстваТитан, как и другие элементы, представляет собой смесь нескольких изотопов с атомным весом от 46 до 50. Соотношение этих изотопов было рассчитано на основе спектрографического анализа. Математические расчеты с использованием пропорций и массовых чисел определили средний атомный вес титана 47,88.
Титан имеет большое сечение захвата и были идентифицированы пять других изотопов титана. Титан 43 имеет период полураспада 0,58 секунды и является бета-положительным излучателем. Титан 45 имеет две формы: бета-положительная и гамма-излучающая с периодом полураспада 3,08 часа и вторая форма с периодом полураспада 21 день. Титан 51 имеет период полураспада 72 дня и является бета-отрицательным и гамма-излучателем. Существует также метастабильная форма титана 51 с периодом полураспада 6 минут, которая также является гамма- и бета-отрицательным излучателем.
Титан 43 имеет период полураспада 0,58 секунды и является бета-положительным излучателем. Титан 45 имеет две формы: бета-положительная и гамма-излучающая с периодом полураспада 3,08 часа и вторая форма с периодом полураспада 21 день. Титан 51 имеет период полураспада 72 дня и является бета-отрицательным и гамма-излучателем. Существует также метастабильная форма титана 51 с периодом полураспада 6 минут, которая также является гамма- и бета-отрицательным излучателем.
Валентность
Как и для переходных элементов, титан имеет переменную валентность и обычно находится в двух-, трех- и четырехвалентном состояниях. В литературе сообщается о валентностях пять и выше, но их обоснование никогда не приводилось.
Газы
Химическая активность титана зависит от температуры. Взаимодействие металла с другими веществами легче протекает при повышенных температурах. Это свойство особенно ярко проявляется в чрезвычайной реакционной способности металла по отношению к атмосферным газам при высоких температурах.
Это требует использования инертной атмосферы для горячей обработки и защиты поверхности при высоких температурах. Быстрое сочетание титана с реактивными газами атмосферы при температуре выше 950°F приводит к образованию накипи на поверхности. С большими интервалами времени и повышением температуры газы диффундируют в решетку.
Металл соединяется с кислородом, образуя длинную серию оксидов от TiO до Ti 7 O 12 , каждый из которых имеет свой оттенок и при кратковременном воздействии на поверхность образуется радужная пленка. Хотя это поверхностное окисление происходит при 950°F, заметной диффузии в решетку не происходит ниже 1300°F. Воспламенение металла происходит на воздухе при температуре 2200°F, а атмосфера чистого кислорода снижает эту температуру до 1130°F.
Реакционная способность титана с азотом аналогична его действию с кислородом, при котором на поверхности образуется желто-коричневый налет в виде нитрида. Азот будет диффундировать в решетку с ограниченной глубиной проникновения. Это свойство было использовано в нитридной оболочке из металла.
Это свойство было использовано в нитридной оболочке из металла.
Наиболее уникальной из газотитановых реакций является реакция между водородом и металлом. Реакция протекает при температурах немного выше комнатной, и одним граммом титана может быть поглощено до 400 см3 газа. В небольших количествах газ добавляется в качестве междоузлия, но при более высоких концентрациях образуется гидрид TiH. Однако добавление водорода к титану стабильно только при температуре ниже 680°F; выше этой температуры газ выделяется и горит.
Все эти газотитановые реакции ускоряются при снижении давления паров и требуется полная защита от атмосферы.
Водяной пар и углекислый газ разлагаются горячим металлическим титаном. При температуре выше 1500°F водяной пар и металл объединяются, образуя оксид и выделяя водород. При более высоких температурах горячий металл будет поглощать CO 2 и может образовывать оксид и карбид.
Кислоты
Химическая активность титана по отношению к галогенидам также проявляется в его соединении с их кислотами. Самая быстрая реакция снова с фторидом. Эта реакция имеет различные применения; является одним из основных растворителей металлов и их сплавов для химического анализа; он используется как общий травитель как в макро-, так и в микромасштабе, в металлографических работах; и он также используется в качестве средства для удаления накипи.
Самая быстрая реакция снова с фторидом. Эта реакция имеет различные применения; является одним из основных растворителей металлов и их сплавов для химического анализа; он используется как общий травитель как в макро-, так и в микромасштабе, в металлографических работах; и он также используется в качестве средства для удаления накипи.
Действие соляной кислоты и сходным образом серной кислоты протекает медленно при комнатной температуре. Однако небольшой подвод тепла ускоряет атаку, что приводит к образованию низших хлоридов и моносульфата. Эти реакции используются так же, как и фтористоводородная кислота и поскольку они менее токсичны и коррозионно-активны, они постепенно заменяют фторид кислоты.
Органика
Химическая активность титана по отношению к органическим материалам используется металлургической промышленностью лишь в незначительной степени. Реакции органической кислоты и титана образуют цветные пленки на поверхности металла и используются металлографами для окрашивания микрообразцов.
Твердые вещества
В расплавленном состоянии титан соединяется со многими металлами, металлоидами и углеродистыми веществами, образуя очень важные системы. В оксидном состоянии он реагирует с щелочными, щелочноземельными и тяжелыми неблагородными металлами с образованием титанатов, некоторые из которых изучаются в сочетании с более дешевыми методами производства.
Реакция на металлоиды, особенно на оксиды металлов, чрезвычайно беспокоила литейщиков, поскольку расплавленный титан сильно разрушает большинство известных огнеупоров с образованием систем металл-металлоид. Такие огнеупорные материалы, как двуокись кремния и окись алюминия, настолько сильно разрушаются, что их использование опасно. Из всех металлоидов только оксид бериллия и оксид тория показали сколько-нибудь заметное сопротивление жидкому металлу.
Еще одна очень важная реакция — это реакция углерода и титана. Металл в расплавленном состоянии имеет большое сродство к углероду и из-за его пагубного влияния на свойства титана необходимо соблюдать крайнюю осторожность, чтобы свести к минимуму его присутствие в готовых изделиях.
Электрохимия
Электроосаждение металла может осуществляться различными сложными методами, ни один из которых не дает промышленно применимых пленок. Для восстановления металла из его четырехвалентного состояния в двух- и трехвалентную формы использовались электролитические средства с использованием кислых электролитов и электродов из свинца, меди, платины или ртутной струи.
Безопасность
Химическая активность титана в целом неопасна. За исключением мелкодисперсных частиц, подвергшегося воздействию дымящей азотной кислоты в течение длительного времени, не обнаружено ни взрывоопасности, ни воспламенения.
Физические свойства титанаЧистый металлический титан может существовать в виде темно-серого блестящего металла или в виде темно-серого порошка. Он имеет температуру плавления 1677°C (3051°F) и температуру кипения 3277°C (5931°F). Его плотность составляет 4,6 грамма на кубический сантиметр. Металлический титан хрупок в холодном состоянии и может легко разрушиться при комнатной температуре. При более высоких температурах он становится податливым и пластичным. Ковкий означает, что его можно сбивать в тонкие листы. Пластичный означает, что его можно вытягивать в тонкую проволоку.
При более высоких температурах он становится податливым и пластичным. Ковкий означает, что его можно сбивать в тонкие листы. Пластичный означает, что его можно вытягивать в тонкую проволоку.
Элемент обладает интересным физическим свойством. Небольшие количества кислорода или азота делают его намного сильнее.
Титан — единственный элемент, который может гореть в чистом азоте и горит как в кислороде, так и в азоте при высоких температурах.
Атомный номер | 22 |
Атомный вес | 47,88 |
Относительное содержание в земной коре, % | 0,44 |
Плотность при 25°С, г/см 3 | 4,5 |
Атомный радиус для координационного числа шесть в кристалле, нм | 0,145 |
Температура плавления, °С | 1668 |
Температура кипения, °С | 3287 |
Температура фазового превращения, °С | 882 |
Шестиугольный ⇆ объемно-центрированный кубический | |
Постоянные решетки α-Ti при комнатной температуре, нм | с = 0,4679 |
а = 0,2951 | |
Теплота превращения, кДж/моль | 3,685 |
Коэффициент линейного расширения при 25°С, К –1 | 8,5 × 10–6 |
Скрытая теплота плавления, кДж/моль | 20,9 |
Скрытая теплота возгонки, Дж/моль | 464,7 |
Скрытая теплота парообразования, кДж/моль | 397,8 |
Удельная теплоемкость при 25°С, Дж·г –1· К –1 | 0,523 |
Прочностные свойства
Нелегированный титан может иметь предел прочности при растяжении в диапазоне от 250 МПа для металла высокой чистоты, полученного в процессе восстановления йода, до 690 МПа для металла, полученного из губчатого титана высокой твердости. Изделия из нелегированного титана, выплавленные дугой, обладают достаточной пластичностью.
Изделия из нелегированного титана, выплавленные дугой, обладают достаточной пластичностью.
Пластичность
Пластичные изделия из коммерчески чистого титана, полученные дуговым плавлением, имеют диапазон удлинения от 20% до 40% и уменьшения площади от 45% до 65%, в зависимости от содержания междоузлий. Йодный процесс титана дает продукт, обладающий 55% удлинением при 80% уменьшении площади.
Как и в случае со сталью, титан сплавляют с другими металлами для повышения прочности. Такие металлические добавки, как Al , V , Cr , Fe , Mn , Sn используются либо в виде бинарных добавок, либо в виде сложных систем. Результирующее увеличение прочности достигается при снижении пластичности.
Модуль упругости
Нелегированный титан имеет модуль около 15×10 6 фунтов на квадратный дюйм и может быть увеличен до около 18×10 6 фунтов на квадратный дюйм путем легирования. Модуль титана лучше, чем у алюминия (10,4×10 6 ) и магния (6,4×10 6 ), но хуже, чем у стали (29×10 6 ).
Модуль титана лучше, чем у алюминия (10,4×10 6 ) и магния (6,4×10 6 ), но хуже, чем у стали (29×10 6 ).
Как и модуль упругости, модуль сдвига, модуль жесткости титана находится между алюминием и сталью.
Твердость
Титан является гораздо более твердым металлом, чем алюминий и приближается к высокой твердости, которой обладают некоторые термообработанные легированные стали. Титан йодидной чистоты имеет твердость 90 VHN (Виккерс), нелегированный технический титан имеет твердость около 160 VHN, а при легировании и термообработке титан может достигать твердости в диапазоне от 250 до 500 VHN. Можно ожидать, что типичный коммерческий сплав с пределом текучести 130 000 фунтов на квадратный дюйм будет иметь твердость около 320 VHN или 34 градуса по шкале Роквелла.
Ударопрочность
Знание прочности на растяжение и пластичности металла недостаточно для многих инженерных приложений без знания ударной вязкости. Титан относится к тем немногим металлам, которые обладают хорошей ударной вязкостью наряду с высокой прочностью и пластичностью.
Титан относится к тем немногим металлам, которые обладают хорошей ударной вязкостью наряду с высокой прочностью и пластичностью.
Титан может иметь ударную вязкость в диапазоне от более чем 100 футо-фунтов по Шарпи для йодистого продукта более высокой чистоты и 30 футо-фунтов для коммерческого нелегированного продукта до 1 или 2 футо-фунтов для некоторых высокопрочных, но хрупких сплавов.
Магнитные свойства (Ti) титанаТитан слабо притягивается к магнитам, так как является парамагнитным материалом. Основной причиной его парамагнитной природы является его электронная конфигурация с 4 неспаренными электронами, поскольку парамагнетизм зависит от неспаренных электронов. Второй причиной является его магнитный момент, т.е. 1,73 БМ. Титан является парамагнитным в степенях окисления -1, +2 и +3. Но приятно отметить, что магнитная восприимчивость титана очень мала и положительна, что делает его магнитные свойства очень слабыми по сравнению с ферромагнитными материалами.
Магнитны ли титановые сплавы?
Как и следовало ожидать, некоторые титановые сплавы обладают магнитными свойствами. Все зависит от того, какие материалы интегрированы в этот сплав. Если сплав включает кобальт, железо или никель, то можно определенно ожидать, что титановый сплав, созданный с использованием этих соединений, будет обладать магнитными свойствами. Поскольку титан уже изначально обладает некоторыми магнитными свойствами, ему легко усилить эти свойства при смешивании с магнитным металлом.
Однако это не означает, что все титановые сплавы будут магнитными. На самом деле, правда далека от этого. Здесь вам нужно отметить, что если сплав не содержит материалов с магнитными свойствами, то титан не будет навязывать свои слабые магнитные свойства всему результату. Вместо этого вы получите очень хорошее сочетание материалов, сплав, который можно использовать во многих ситуациях, но который не обладает какими-либо важными магнитными свойствами.
В заключение, титановые сплавы могут быть магнитными, но с такой же вероятностью они не могут быть магнитными. Результат зависит от того, что входит в состав сплава и на основании этого вы сможете получить ответ. Одно можно сказать наверняка: титановые сплавы будут магнитными только в том случае, если титан сочетается с такими материалами, как никель, кобальт, железо или чем-либо еще, обладающим сильными магнитными свойствами. Если нет, то титан не привнесет в сплав никаких своих слабых магнитных свойств.
Результат зависит от того, что входит в состав сплава и на основании этого вы сможете получить ответ. Одно можно сказать наверняка: титановые сплавы будут магнитными только в том случае, если титан сочетается с такими материалами, как никель, кобальт, железо или чем-либо еще, обладающим сильными магнитными свойствами. Если нет, то титан не привнесет в сплав никаких своих слабых магнитных свойств.
Титановые сплавы очень популярны в промышленности из-за их очень высокой прочности на растяжение и ударной вязкости, а также их очень легкого веса и исключительной коррозионной стойкости. Титановые сплавы производятся путем объединения чистого титана с другими металлами или химическими компонентами. Присутствие этих различных металлов и химических компонентов изменяет физические свойства титанового сплава. Титан сам по себе относительно силен — примерно так же прочен, как сталь, — но в сочетании с другими металлами и химическими компонентами он становится значительно прочнее. С другой стороны, титановый сплав имеет и другие преимущества, кроме повышенной прочности.
С другой стороны, титановый сплав имеет и другие преимущества, кроме повышенной прочности.
Что такое титановый сплав?
Титановый сплав представляет собой металлический или химический сплав, преимущественно состоящий из чистого титана с рассеянными другими металлами или химическими элементами. Он сделан путем точного комбинирования титана с другими металлами и химическими ингредиентами. Смеси дают остыть, как только будет достигнуто правильное соотношение. Как правило, титановый сплав содержит следы алюминия, ниобия, тантала, молибдена, ванадия, циркония, марганца, железа, никеля, хрома, кобальта и меди.
Типы титанового сплава
В зависимости от металлургической структуры сплавы титана можно разделить на три широкие категории, перечисленные ниже:
Альфа-сплавы:
Они легированы небольшим количеством кислорода для повышения твердости и прочности на растяжение технически чистого титана.
 Можно производить ряд экономически чистых марок титана со значениями прочности в диапазоне от 290 до 740 МПа, регулируя добавляемые количества.
Можно производить ряд экономически чистых марок титана со значениями прочности в диапазоне от 290 до 740 МПа, регулируя добавляемые количества.Хотя небольшие количества бета-фазы возможны, если уровни примесей бета-стабилизаторов, таких как железо, значительны, эти материалы номинально имеют полностью альфа-структуру. Хотя альфа-сплавы не могут подвергаться термообработке для повышения прочности, добавление 2,5% меди к титану позволяет получить материал, который реагирует на обработку раствором и старение так же, как алюминиево-медные сплавы. Алюминий представляет собой альфа-стабилизатор, присутствующий в нескольких коммерчески доступных сплавах в качестве легирующей добавки к титану.
Альфа-бета-сплавы:
Бета-фаза стабилизирована ванадием, молибденом, железом и хромом и были созданы различные альфа-бета-сплавы. Обычно это материалы средней и высокой прочности с пределом прочности при растяжении в диапазоне от 620 до 1250 МПа и сопротивлением ползучести в диапазоне от 350 до 400°C.
 Мало- и многоцикловая усталость и вязкость разрушения становятся все более важными для конструктивных характеристик. Таким образом, процессы термомеханической и термической обработки были разработаны для обеспечения наилучших механических свойств сплавов для различных применений. Сплавы, близкие к альфа, используемые для максимального сопротивления ползучести при температурах выше 450°C. При температурах до 600°С они обладают достаточным сопротивлением ползучести.
Мало- и многоцикловая усталость и вязкость разрушения становятся все более важными для конструктивных характеристик. Таким образом, процессы термомеханической и термической обработки были разработаны для обеспечения наилучших механических свойств сплавов для различных применений. Сплавы, близкие к альфа, используемые для максимального сопротивления ползучести при температурах выше 450°C. При температурах до 600°С они обладают достаточным сопротивлением ползучести.Бета-сплавы:
Бета-сплавы представляют собой другой тип титанового вещества. Полностью бета-сплавы могут быть получены, когда к титану добавлено достаточное количество бета-стабилизирующих элементов. Эти материалы существуют уже давно, но только недавно приобрели популярность. Они легче поддаются тяжелой обработке, чем альфа-бета-сплавы, могут подвергаться термообработке до высокой прочности, а некоторые из них обладают лучшей коррозионной стойкостью, чем коммерчески чистые марки. Существуют международные и национальные спецификации для титановых материалов, используемых в аэрокосмической отрасли, но их не существует для материалов, используемых в других областях.
 Сборник спецификаций ASTM обычно используется в этой отрасли.
Сборник спецификаций ASTM обычно используется в этой отрасли.
Примеры титановых сплавов
В следующей таблице представлен список титановых сплавов вместе с их примерами.
| Типы титанового сплава | Примеры титанового сплава |
| Альфа-титановый сплав | Сплавы Ti/Pd – ASTM классы 7 и 11 |
| Альфа + соединение | Ti-2,5%Cu – IMI 230 |
| Почти альфа-титановые сплавы | Ti-8%Al-1%Mo-1%V Ti-6%Al-5%Zr-0,5%Mo-0,2%Si – IMI 685 Ti-6%Al—2%Sn-4%Zr-2%Mo -0,08%Si Ti-5,5%Al-3,5%Sn-3%Zr-1%Nb-0,3%Mo-0,3%Si – IMI 829 Ti-5,8%Al-4%Sn-3,5%Zr-0,7%Nb- 0,5%Mo-0,3%Si – IMI 834 Ti-6%Al-3%Sn-4%Zr-0,5%Mo-0,5%Si – Ti 1100 |
| Альфа-бета титановые сплавы | Ti-6%Al-4%V Ti-4%Al-4%Mo-2%Sn-0,5%Si Ti-4%Al-4%Mo-4%Sn-0,5%Si – IMI 551 Ti-6% Al-6%V-2%Sn Ti-6%Al-2%Sn-4%Zr-6%Mo |
| Метастабильные бета-титановые сплавы | Ti-3%Al-8%V-6%Cr-4%Zr-4%Mo – Beta C Ti-15%Mo-3%Nb-3%Al-0,2%Si – Timetal 21 S Ti-15%V -3%Cr-3%Sn-3%Al |
Титановые сплавы также можно классифицировать по их механической прочности следующим образом:
- Низкопрочный титановый сплав (прочность <=500 МПа): например, марки ASTM 1, 2, 3, 7 и 11.

- Титановый сплав средней прочности (прочность от 500 до 900 МПа): например, марки ASTM 4, 5 и 9, Ti-2,5% Cu, Ti-8% Al-1% Mo-0,1% V.
- Титановый сплав средней прочности (прочность от 900 до 1000 МПа): например, Ti-6%Al-2%Sn-4%Zr-2%Mo, Ti-5,5%Al-3,5%Sn-3%Zr-1%Nb- 0,3%Mo-0,3%Si
- Высокопрочный титановый сплав (прочность от 1000 до 1200 МПа): например, Ti-3%Al-8%V-6%Cr-4%Zr-4%Mo, Ti-4%Al-4%Mo-2%Sn- 0,5%Si, Ti-6%Al-6%V-2,5%Sn, Ti-15%V-3%Cr-3%Sn-3%Al, Ti-5%Al-2%Sn-4%Mo- 2%Zr-4%Cr, Ti-6%Al-5%Zr-0,5%Mo-0,2%Si, Ti-6%Al-2%Sn-4%Zr-6%Mo, Ti-11%Sn- 5%Zr-2,5%Al-1%Mo, Ti-5,8%Al-4%Sn-3,5%Zr-0,7%Nb-0,5%Mo-0,3%Si
- Очень высокопрочный титановый сплав (прочность >1200 МПа): например, Ti-10%V-2%Fe-3%Al, Ti-4%Al-4%Mo-4%Sn-0,5%Si
Температура перехода
При комнатной температуре и давлении титан кристаллизуется в плотноупакованную гексагональную фазу с отношением ас/а, равным 1,587. Титан претерпевает аллотропное превращение в объемно-центрированную кубическую фазу при температуре около 890 ° C, которая устойчива к температуре плавления.
Титан претерпевает аллотропное превращение в объемно-центрированную кубическую фазу при температуре около 890 ° C, которая устойчива к температуре плавления.
Некоторые легирующие элементы, известные как альфа-стабилизаторы, повышают температуру перехода из альфа-бета в другие, известные как бета-стабилизаторы, понижают ее. Алюминий, галлий, германий, углерод, кислород и азот являются альфа-стабилизаторами. Бета-стабилизаторами являются молибден, ванадий, тантал, ниобий, марганец, железо, хром, кобальт, никель, медь и кремний.
Марки титанового сплава
- Титановый сплав 5 класса, Ti 6Al-4V. Титан класса 5, является наиболее широко используемым из всех титановых сплавов и известен как «рабочая лошадка» среди титановых сплавов. На его долю приходится половина всего использования титана на планете. Термообработку можно использовать для повышения прочности Ti 6Al-4V. Титан класса 5 используется в сварных конструкциях при температурах до 600 градусов по Фаренгейту.
 Превосходная прочность этого сплава при малом весе, полезная формуемость и высокая коррозионная стойкость делают его хорошим выбором. Благодаря своей универсальности сплав Ti 6AI-4V является оптимальным сплавом для использования в различных отраслях промышленности, включая аэрокосмическую, медицинскую, морскую и химическую.
Превосходная прочность этого сплава при малом весе, полезная формуемость и высокая коррозионная стойкость делают его хорошим выбором. Благодаря своей универсальности сплав Ti 6AI-4V является оптимальным сплавом для использования в различных отраслях промышленности, включая аэрокосмическую, медицинскую, морскую и химическую. Титановый сплав 7 класса. Класс 7 механически и физически идентичен классу 2, за исключением того, что он содержит палладий в качестве промежуточного элемента, что делает его сплавом. Титановый сплав Grade 7 является наиболее коррозионностойким титановым сплавом с превосходной свариваемостью и технологичностью. Химические процессы и компоненты промышленного оборудования используют класс 7.
Титановый сплав 11 класса. Марка 11 по существу идентична марке 1, за исключением того, что для улучшения коррозионной стойкости было добавлено небольшое количество палладия, что делает его сплавом. Другими полезными качествами являются оптимальная пластичность, способность к холодной штамповке, функциональная прочность, ударная вязкость и выдающаяся свариваемость.
 Этот сплав можно использовать в тех же областях применения титана, что и сплав класса 1, но он более устойчив к коррозии.
Этот сплав можно использовать в тех же областях применения титана, что и сплав класса 1, но он более устойчив к коррозии. Титановый сплав класса 12, Ti 3Al 2,5. Титан марки 12 получает оценку «отлично» за высококачественную свариваемость. Это прочный сплав с высокой прочностью при высоких температурах. Титан марки 12 имеет свойства, эквивалентные нержавеющей стали класса 300. Этот сплав может быть подвергнут горячей или холодной формовке с использованием листогибочного пресса, гидропрессовки, вытяжки или методом ударного молота. Он может быть сформирован различными способами, полезными в широком диапазоне приложений. Сильная коррозионная стойкость этого сплава делает его идеальным для использования в производственном оборудовании, где щелевая коррозия является проблемой.
Титановый сплав Grade 23, Ti 6AL-4V ELI. Представляет собой чистый Ti 6Al-4V. Катушки, пряди, провода и плоские провода могут быть изготовлены из этого типа сплава.
 Это лучший вариант для любого применения, где требуется сочетание высокой прочности, легкости, исключительной коррозионной стойкости и высокой ударной вязкости. Он более устойчив к повреждениям, чем другие сплавы. Марка 23 является идеальной маркой стоматологического и медицинского титана из-за этих преимуществ. Из-за его биосовместимости, хорошей усталостной прочности и низкого модуля упругости его можно использовать в биомедицинских приложениях, таких как имплантированные компоненты.
Это лучший вариант для любого применения, где требуется сочетание высокой прочности, легкости, исключительной коррозионной стойкости и высокой ударной вязкости. Он более устойчив к повреждениям, чем другие сплавы. Марка 23 является идеальной маркой стоматологического и медицинского титана из-за этих преимуществ. Из-за его биосовместимости, хорошей усталостной прочности и низкого модуля упругости его можно использовать в биомедицинских приложениях, таких как имплантированные компоненты. Титановый сплав 6 класса, Ti 5Al-2.5Sn. Ti 5Al-2.5Sn — нетермообрабатываемый сплав с хорошими сварочными свойствами и стабильностью. Он также имеет высокую степень термостабильности, прочности, коррозионной стойкости и сопротивления ползучести.
Ползучесть — это термин, используемый для описания процесса пластической деформации с течением времени, происходящего при высоких температурах. Титановый сплав Ti 5Al-2,5Sn используется в самолетах, планерах и криогенных устройствах.
Применение титановых сплавов
Изделия из титана могут поразному вписываться в нашу повседневную жизнь .
Металлический титан безопасен для окружающей среды, потому что он обладает такими превосходными свойствами, как малый вес, высокая прочность, коррозионная стойкость и биосовместимость, и его можно легко перерабатывать благодаря его свойству мало меняться с течением времени. Соответственно, он используется для различных применений в нашей повседневной жизни, начиная от самолетов и заканчивая предметами первой необходимости.
Титановые сплавы находят широкое применение в
- Химической обработке
- Производстве хлората
- Опреснение
- Морские применения
- Компоненты производственного оборудования
- Авиационные турбины
- Компоненты двигателя
- Элементы конструкции самолета
- Аэрокосмический крепеж
- Высокопроизводительные автоматические детали
- Спортивное оборудование
- Ортопедические штифты и винты
- Ортопедические тросы
- Лигатурные зажимы
- Хирургические скобы
- Пружины
- Ортодонтические аппараты
- При замене суставов
- Криогенные сосуды
- Устройства для фиксации костей
- Гидрометаллургическое применение
- Химическое производство при повышенной температуре
- Криогенные процессы
Можно сказать, что аэрокосмическая промышленность подходит для максимального использования свойств титана, таких как легкий вес, высокая прочность и отличная коррозионная стойкость. Титан, который может обеспечить легкий вес при сохранении прочности, является материалом, необходимым для эволюции самолетов, целью которых является не только достижение экономических характеристик, но и дальнейшее повышение эффективности использования топлива.
Титан, который может обеспечить легкий вес при сохранении прочности, является материалом, необходимым для эволюции самолетов, целью которых является не только достижение экономических характеристик, но и дальнейшее повышение эффективности использования топлива.
| Функции | Легкий вес, высокая прочность и высокая коррозионная стойкость |
|---|---|
| Примеры целей использования | Детали реактивных двигателей (например, вентиляторы и компрессоры), конструкционные материалы для корпусов самолетов, топливные баки, шасси, болты и пружины. |
Около половины мирового спроса на титан приходится на аэрокосмическую отрасль. Титан начал использоваться в больших количествах в 1960-х годах, в первую очередь в качестве материала для реактивных двигателей из-за его легких и прочных характеристик, а также он используется в частях корпуса самолета, включая шасси, переднюю кромку и болты. .
Кроме того, поскольку легкие пластмассы, армированные углеродным волокном (CFRP), используются во многих частях корпуса самолета, титан, который имеет коэффициент теплового расширения, близкий к коэффициенту CFRP и не имеет проблем с коррозией, используется более широко, поскольку он хорошо совместим с углепластиком.
Титан, который относительно устойчив к коррозии рядом химических веществ и морской воды, широко используется в установках, таких как заводы по производству сжиженного природного газа (СПГ), заводы по опреснению морской воды и химические заводы.
| Функции | Легкий вес, высокая прочность и высокая коррозионная стойкость |
|---|---|
| Примеры целей использования | Лопасти турбин, оборудование для опреснения морской воды и конденсаторы на электростанциях/опреснителях морской воды; электроды, резервуары для хранения, водопровод и лампочки на химических заводах/электролизных предприятиях |
Автоцистерна. Что касается автоцистерн, которые перевозят такие химикаты, как гипохлорит натрия и хромат натрия, то в качестве материала для цистерн используется легкий, высококоррозионностойкий и прочный титан.
Теплообменник. Титан используется как безопасный и экономичный материал для теплообменников, которые эксплуатируются в тяжелых условиях, в том числе при высокой температуре и высоком давлении.
Строительство — архитектура и памятникиБлагодаря легкому весу, долговечности и признанной текстуре материала титан используется для крыш традиционной японской архитектуры, музеев, крыш и экстерьеров куполообразных стадионов и в настоящее время заслужил репутацию нового и лучшего строительного материала.
| Функции | Легкий вес, высокая прочность, высокая коррозионная стойкость и окрашиваемость |
|---|---|
| Примеры целей использования | Кровельные материалы, стеновые и строительные материалы, внутренние и наружные стены, напольные материалы, строительные материалы для окраски, памятники, таблички и перила |
Титан также играет активную роль в производстве автомобилей и мотоциклов. В частности, из деталей мотоциклов именно в глушителях больше всего используется титан. Титан высоко ценится за его термостойкость, прочность и устойчивость к ржавчине в качестве материала для глушителей, используемых в тяжелых условиях.
В частности, из деталей мотоциклов именно в глушителях больше всего используется титан. Титан высоко ценится за его термостойкость, прочность и устойчивость к ржавчине в качестве материала для глушителей, используемых в тяжелых условиях.
| Функции | Легкий вес, высокая прочность, высокая коррозионная стойкость и высокая термостойкость |
|---|---|
| Примеры целей использования | Глушители, шатуны, клапаны двигателя и пружины |
Титан используется в более широком спектре приложений в нашей повседневной жизни, включая не только клюшки для гольфа, но и теннисные ракетки, наручные часы, очки, ножи, ювелирные изделия и скульптуры.
| Функции | Легкий вес, высокая прочность, модность, высокая коррозионная стойкость и биосовместимость |
|---|---|
| Примеры целей использования | Оборудование для гольфа, теннисные ракетки, лыжные товары, велосипеды и снаряжение для альпинизма. |
Наручные часы и очки. Титан, обладающий такими свойствами, как легкость, коррозионная стойкость, биосовместимость (т. е. не вызывает аллергии на металл), умеренная упругость, широко используется в качестве материала для оправ стекол. По той же причине он также используется для изготовления наручных часов, а роскошная текстура титана является одним из его преимуществ.
Ювелирные изделия. Титан широко используется в ювелирных изделиях, включая серьги-клипсы, ожерелья, булавки для галстука и запонки, потому что он легкий, не вызывает аллергии на металл, имеет уникальную текстуру и модный вид.
Кухонные ножи и другие ножи. Титан подходит для кухонных ножей, так как не наносит вреда человеческому организму и гигиеничен. Он обладает превосходными свойствами, такими как легкий вес и удобство использования, а титановые ножи могут оставаться острыми в шесть раз дольше, чем ножи из нержавеющей стали.
ЗдоровьеПоскольку титан обладает высокой биосовместимостью и редко вызывает аллергию на металлы, он широко используется в качестве материала для имплантатов, таких как искусственные корни зубов и искусственные кости, и область его применения расширяется.
| Функции | Нетоксичность, биосовместимость, высокая коррозионная стойкость и высокая прочность |
|---|---|
| Примеры целей использования | Материалы для искусственных костей, сердечных клапанов, кардиостимуляторов, хирургических инструментов, корней зубов и сплавов с памятью формы. |
Стоматологические инструменты из титана. В стоматологии используются многие инструменты из титанового сплава, который легче стали. Такие инструменты из титана превосходят инструменты из нержавеющей стали по коррозионной стойкости и прочности.
Искусственные корни зубов. Поскольку титан обладает высокой биосовместимостью и безвреден для организма человека, его используют в качестве материала для искусственных корней зубов.
© 2022 All Rights Reserved.
2.3. Титан и его сплавы
Титан – металл серебристо-белого цвета, имеющий малую плотность (4,5 г/см3). Температура плавления титана
(1668 ± 4)°С в зависимости
от степени его чистоты.
Титан имеет две полиморфные модификации: α-титан с гексагональной плотноупакованной решеткой с периодами а = 0,296 нм, с = 0,472 нм и высокотемпературную модификацию (-титан с кубической объемно-центрированной решеткой с периодом а = 0,332 нм при 900°С. Температура полиморфного α↔ превращения составляет 882°С.
Механические свойства титана существенно зависят от чистоты металла от примесей.
Чистый титан с малым содержанием водорода (менее 0,002 %) не обладает хладноломкостью при прочности в = 1300 МПа и сохраняет высокую пластичность даже при температуре жидкого гелия.
По удельной прочности в интервале температур
300÷600°С сплавы титана не имеют себе равных; при темпе-ратуре ниже 300°С они уступают алюминиевым сплавам, а выше 600°С – сплавам на основе железа и никеля.
Титан имеет низкий модуль нормальной упругости
(Е
=
112 ГПа), почти в 2 раза меньший, чем у
железа и никеля, что затрудняет
изготовление жестких конструкций. Для
повышения жесткости приходится
увеличивать толщину деталей и их массу.
Для
повышения жесткости приходится
увеличивать толщину деталей и их массу.
Хотя титан относится к числу химически активных металлов, он обладает высокой коррозионной стойкостью, так как на его поверхности образуется стойкая пассивная пленка ТiO2, прочно связанная с основным металлом и исключающая его непосредственный контакт с электролитом. Оксидная пленка на титане возникает при окислении на воздухе, анодном окислении и самопассивации его не только в сильно окисли-тельных, но и в слабокислых и нейтральных растворах. Толщи-на оксидной пленки, образующейся на титане после длительного пребывания на воздухе, обычно достигает 5÷6 нм.
Благодаря оксидной пленке титан и его сплавы не корродируют в атмосфере, пресной и морской воде, устойчивы против кавитационной коррозии и коррозии под напряжением, а также в кислотах органического происхождения.
Производство
изделий из титана и его сплавов имеет
ряд технологических особенностей. Из-за
высокой химической активности
расплавленного титана его выплавку,
разливку и дуговую сварку производят
в вакууме или в атмосфере инертных
газов.
Из-за
высокой химической активности
расплавленного титана его выплавку,
разливку и дуговую сварку производят
в вакууме или в атмосфере инертных
газов.
Сплавы титана имеют несколько меньшую жаро-прочность, чем специальные стали. Рабочая температура их использования не более 500÷550°С. При превышении этой температуры титан и его сплавы легко окисляются и интенсивно поглощают газы.
Основной целью легирования титановых сплавов является повышение прочности, жаропрочности и коррозионной стойкости. Широкое применение нашли сплавы титана с алюминием, хромом, молибденом, ванадием, марганцем, оловом и некоторыми другими элементами.
Титановые сплавы подвергают термической обработке – рекристаллизационному отжигу, закалке и старению, а также химико-термической обработке.
Отжиг
титановых сплавов проводят после
холодной деформации. Температура их
рекристаллизации составляет в среднем
500°С, и отжиг при температуре 700÷800°С
вполне достаточен для устранения
наклепа.
Превращения при закалке и старении в титановых сплавах в принципе похожи на соответствующие превращения в стали. Однако столь существенного упрочнения, как в сталях, в титановых сплавах не происходит. В результате фазовой перекристаллизации происходит измельчение зерна, что положительно сказывается на их пластических свойствах.
Титановые сплавы обладают низкими антифрикци-онными свойствами. Для повышения износостойкости их под-вергают азотированию. Азотирование проводят в среде газообразного азота при температуре около 900°С, длительность процесса до 50 ч.
Азотирование повышает поверхностную твердость, износостойкость и жаропрочность. Для уменьшения хрупкости азотированного слоя проводят вакуумный отжиг заготовок при 800÷900°С.
Для повышения жаростойкости титановые сплавы подвергают силицированию.
Титановые сплавы
по сравнению с техническим титаном
имеют большую прочность, в том числе
при высоких температурах, сохраняя при
этом достаточно высокую пластичность
и коррозионную стойкость.
В табл. 4.9 приведены основные промышленные титановые сплавы. За основу классификации принято соотношение α- и -фаз в структуре сплава и особенности структурных превращений, происходящих при их термической обработке.
Сплавы с α-структурой характеризуются невысокой прочностью при комнатной температуре и не упрочняются при термообработке. Их недостатком является низкая технологи-ческая пластичность, а достоинством – хорошая свариваемость и высокие механические свойства при крио-генных температурах.
Псевдо-α-сплавы, сохраняя достоинства α-сплавов, благодаря присутствию небольших количеств -фазы (до 5 %) имеют более высокую технологическую пластичность и хорошо обрабатываются давлением.
Двухфазные
(α)-сплавы
характеризуются наилучшим сочетанием
механических и технологических свойств.
По структуре после закалки различают
мартенситный и переходный классы
(α)-сплавов.
Сплавы мартенситного класса менее
легированы и в равновесном состоянии
содержат не более 25 % -фазы. Увеличение количества -фазы
в сплавах переходного класса до 50 %
обеспечивает им самую высокую прочность
этой группы сплавов как в отожженном,
так и в закаленном состояниях.
Увеличение количества -фазы
в сплавах переходного класса до 50 %
обеспечивает им самую высокую прочность
этой группы сплавов как в отожженном,
так и в закаленном состояниях.
Таблица 4.9
Классификация титановых сплавов (ГОСТ 19807 – 74)
Группа сплавов | Марка сплава | Средний химический состав, % |
α-Сплавы | ВТ-00 | Нелегированный титан |
ВТ-0 | То же | |
ВТ5 | Ti-5Al | |
ВТ5-1 | Ti-5Al-2,5Sn | |
Псевдо-α-сплавы | ОТ4-0 | Ti-0,8Al-0,8Mn |
ОТ4 | Ti-3,5Al-1,5Mn | |
(α)-Сплавы мартенситного класса | ВТ6С | Ti-5Al-4,0V |
ВТ6 | Ti-6Al-4,5V | |
ВТ16 | Ti-2,5Al-5Mo-5V | |
(α)-Сплавы переходного класса | ВТ22 | Ti-5Al-5Mo-5V-1Fe-1Cr |
ВТ30 | Ti-3Al-7Mo-11Cr | |
Псевдо -сплавы | ВТ35 | Ti-3Al-1,5Mo-15V-3Sn-3Cr |
-сплавы | 4201 | Ti-33Mo |
Псевдо--сплавы
после закалки имеют структуру
метастабильной -фазы. В этом состоянии они имеют хорошую
пластичность и сравнительно низкую
прочность, благодаря чему хорошо
обрабатываются давлением. После старения
их прочность возрастает в 1,5 раза.
В этом состоянии они имеют хорошую
пластичность и сравнительно низкую
прочность, благодаря чему хорошо
обрабатываются давлением. После старения
их прочность возрастает в 1,5 раза.
Однофазные -сплавы отличаются высокой коррозион-ной стойкостью. Однако сплавы со стабильной -структурой сравнительно редко применяют из-за необходимости их легирования большим количеством изоморфных элементов (V, Мо, Nb), имеющих высокую стоимость, и из-за высокой плотности, понижающей удельную прочность изделий.
Титановые сплавы склонны к повышенному налипанию на инструмент, что в сочетании с их низкой теплопроводостью затрудняет процесс механической обработки. При обработке резанием целесообразно применение инструмента с твердосплавными пластинами.
Устойчивость
титана к хлорсодержащим окислительным
средам обусловила его широкое использование
в химической промышленности для
производства хрома, хлоратов, диоксида
хлора. При
этом
оборудование из титановых сплавов
характеризуется высокой долговечностью
и низкими затратами на текущий ремонт.
Титан пригоден для форсунок, работающих на морской воде, сеток фильтров, теплообменников, работающих в азотной кислоте. Так, в 60 %-ной азотной кислоте при 250°С теплообменники из титана работают без повреждений в течение двух лет, а теплообменники из нержавеющей стали – всего 6 месяцев.
Крыльчатки из титана для центробежных насосов показали наиболее высокую коррозионную и эрозионную стойкость.
Паровые реактивные диффузоры, регулирующие высокое давление пара, изготовленные из титана, работают без заметных признаков разрушения 5 лет.
Технический титан марки ВТ1 и сплав 0Т4 применяются при изготовлении теплообменно-конденсационной аппаратуры нефтеперерабатывающих заводов.
Высокая
коррозионная стойкость титана в кислотах
позволяет применять его в нефтяном и
химическом машиностроении. Из титана
изготовляют трубчатые теплообменники
с трубками диаметром 25 мм и
длиной 3 м, работающие
в среде 15 %-ного раствора гипохлорита
натрия. Коррозионная стойкость сварных
соединений ВТ1 и 0Т4 в средах процесса
прямой перегонки нефти (совместное
воздействие хлористого водорода и
сероводорода), а также и в жирных кислотах
не уступает коррозионной стойкости
основного металла. Глубинный показатель
скорости коррозии составляет 0,001÷0,064
мм/год.
Коррозионная стойкость сварных
соединений ВТ1 и 0Т4 в средах процесса
прямой перегонки нефти (совместное
воздействие хлористого водорода и
сероводорода), а также и в жирных кислотах
не уступает коррозионной стойкости
основного металла. Глубинный показатель
скорости коррозии составляет 0,001÷0,064
мм/год.
Титан и его сплавы являются перспективным материалом для изготовления труб конденсационно-холодильного оборудования. В химической промышленности успешно применяют конденсаторы и холодильники с трубными пучками из титана.
Титановые сплавы: классификация, свойства, прочность, маркировка
Титан широко распространен на земле. После Al, Fe и Mg он занимает четвертое место из присутствующих металлов в земной коре и является девятым элементом по распространенности на Земле. Титановые сплавы (ТС) обладают уникальным спектром свойств, благодаря сочетанию высокой прочности и жесткости, ударной вязкости и аникоррозионности, что обеспечивает широкий спектр применения для работы в средах, как с низкими, так и высокими температурами, позволяя снизить вес аэрокосмических конструкций и узлов крупногабаритной техники.
Содержание
- 1 Общая характеристика свойств титана и его сплавов
- 2 Классификация групп
- 3 Высокопрочные конструкционные ТС
- 4 Жаропрочные Ti-сплавы
- 5 Химические сплавы
- 6 Маркировка титановых сплавов
- 7 Производство титана и его сплавов
- 8 Область применения
- 9 Нюансы термообработки титановых сплавов
Общая характеристика свойств титана и его сплавов
Атомный вес Ti составляет 47.88. Он является упруго жестким, около 115 ГПа модуля Юнга, прочным, легким, устойчивым к коррозионным процессам. Ti и титановые сплавы обладают пределом прочности на разрыв в диапазоне 210-1380 МПа, что приближается к пределу прочности, характерному для многих сложных сталей.
Он имеет чрезвычайно низкую плотность примерно 60.0% от плотности Fe. Его можно упрочнить путем легирования растворенным веществом. Ti немагнитен и обладает отличными теплообменными способностями. Одним из его важных свойств титановых сплавов — высокая Т плавления – 1725. 0 C, то есть почти на 200 C больше, чем у стали, и на 1000 C – чем у Al.
0 C, то есть почти на 200 C больше, чем у стали, и на 1000 C – чем у Al.
Ti пассивирован, и, следовательно, его сплавы имеют высокую степень устойчивости к воздействию большинства минеральных кислот. Он нетоксичен и совместим с биологическими тканями и минералами. Превосходная коррозионная устойчивость и биосовместимость совместно с превосходной прочностью сделали их полезными для химической промышленности и биоматериалов. Ti не является хорошим проводником электротока. Если проводимость Cu принять за 100.0%, то у Ti будет только 3.1%, из этого следует, что он довольно хороший резистор.
Слиток титанаКлассификация групп
Сплавы Ti подразделяют на следующие группы:
- Высокопрочные конструкционные — твердые растворы, с оптимальным соотношением прочностных характеристик и пластичности.
- Жаропрочные титановые сплавы — твердые растворы с необходимым количеством присадок, обеспечивающих стойкость в зонах с высокими температурами при незначительном снижении пластичности.

- ТС на базе химического соединения, способных конкурировать со сплавами Ni в определенном интервале температур.
Высокопрочные конструкционные ТС
Высокопрочные сплавы – ВТ-14, ВТ-22, ВТ-23, ВТ-15 (1000.0-1500.0 МПа).
ВТ-22 – свариваемый ТС с высокими прочностными характеристиками и прокаливаемостью. Он нашел широкое применение при изготовлении отечественных самолетов: Ил-76/ 86/ 96, Ан-72/ 74/124/224/148, Як-42, МиГ-29 и других. Из данного ТС изготовляются крупногабаритные детали для внутреннего силового набора, узлов шасси и сварных узлов, например, траверс и балок тележек основных шасси.
ВТ- 22И, полученный высокотехнологичным методом изотермического деформирования в условиях сверхпластичности, может обеспечить выпуск тонкостенных деталей сложной конфигурации и гарантирует надежную сварку титановых сплавов. Высокий и стабильный уровень механических свойств достигается однородной мелкозернистой структурой, что снижает трудоемкость мехобработки деталей на 35–40%.
Жаропрочные Ti-сплавы
Жаропрочные титановые сплавы – ВТ3 1, ВТ8-1,ВТ-9, ВТ8М-1, ВТ-18, ВТ-25 (1000.0-1500.0МПа).
ВТ8-1, ВТ8М-1 — эти марки титановых сплавов отличаются жаропрочностью, стойкостью от трещин и стабильностью при Т 400-550С. Они имеют низкую чувствительность к местным напряжениям и используются для авиационных двигателей, имеющих большой ресурс работы.
Отечественный сплав ВТ-25 с прочностным показателем до 1150.0 МПа, значительно превосходит зарубежные аналоги, обладает самыми высокими свойствами при Т до 550.0С.
ВТ-18 обладает самыми прочными свойствами при Т до 600.0С – лучший среди отечественных сплавов, используемых в промышленности.
Химические сплавы
Интерметаллические (химические) титановые сплавы основаны на так называемой интерметаллической фазе. Технический интерес представляют TiAl, Ti3Al, Al3Ti и Ti2AlNb. Свойства интерметаллидов находятся между керамикой и металлами.
TiAl – жаропрочные титановые сплавы, демонстрируют превосходные свойства, такие как жаропрочность, стойкость к окислению и ползучести, низкую плотность и высокую усталостную прочность. При этом TiAl демонстрирует низкую пластичность. Это необходимо учитывать при проектировании компонентов, и это является основным препятствием для широкого использования во многих приложениях.
При этом TiAl демонстрирует низкую пластичность. Это необходимо учитывать при проектировании компонентов, и это является основным препятствием для широкого использования во многих приложениях.
ТС используется для выпуска поковки, заготовки, пластины и листы из TiAl. Также доступны сложные отливки, потому что он применяется для некоторых высокотемпературных компонентов практически чистой формы. TiAl представляет интерес для таких применений, как лопасти реактивного двигателя, колеса компрессора для турбонагнетателей, автомобильных клапанов и другие жаростойких компонентов. Для высокотемпературного применения, требующего небольшого веса, это хорошая альтернатива суперсплавам до 850 C.
Маркировка титановых сплавов
Существуют две кристаллографические формы титана, учитывающихся при маркировке:
- Альфа-титан, в котором атомы расположены в кристаллической решетке;
- бета-титан, в котором атомы расположены в кристаллической решетке с кубическим телом (BCC).

Чистый титан существует в форме альфа-фазы при температуре выше 883 C и в форме бета-фазы при температуре ниже 883 C.Температура аллотропического превращения альфа-титана в бета-титан называется температурой бета-трансуса.
Легирующие элементы в ТС могут стабилизировать либо альфа-фазу, либо бета-фазу сплава.
Алюминий (Al), галлий (Ga), азот (N), кислород (O) стабилизируют альфа-фазу.
Молибден (Mo), ванадий (V), вольфрам (W), тантал (Ta), кремний (Si) стабилизируют вета-фазу.
Титановые сплавы подразделяются на четыре группы по фазовому составу:
- Коммерчески чистые и низколегированные ТС. Он состоит из зерен-фазы и дисперсных сфероидных частиц бета-фазы. Небольшие количества железа, присутствующие в сплавах, стабилизируют бета-фазу и обладает относительно низкой механической прочностью и хорошей коррозионной стойкостью.
- Титановые альфа сплавы состоят исключительно из альфа-фазы. Они содержат алюминий в качестве основного легирующего элемента, стабилизирующего альфа-фазу.
 Они имеют хорошую вязкость разрушения и сопротивление ползучести в сочетании с умеренной механической прочностью, которая сохраняется при повышенных температурах. Такие ТС легко свариваются, но их работоспособность в горячем состоянии оставляет желать лучшего.
Они имеют хорошую вязкость разрушения и сопротивление ползучести в сочетании с умеренной механической прочностью, которая сохраняется при повышенных температурах. Такие ТС легко свариваются, но их работоспособность в горячем состоянии оставляет желать лучшего. - Титановые альфа-бета сплавы, содержат 4-6% стабилизаторов вета-фазы, поэтому они состоят из смеси обеих фаз. Сплавы альфа-вета подвергаются термообработке. Они имеют высокую механическую прочность и хорошую горячую форму. Сопротивление ползучести таких ТС ниже, чем у альфа-сплавов.
- Титановые бета-сплавы богаты вета-фазой. Они содержат значительное количество вета-фазных стабилизаторов, термически обрабатываемыедо очень высокой прочности и имеют хорошую форму в горячем состоянии. Пластичность и усталостная прочность этих ТС в условиях термообработки низкие.
Титановые сплавы обозначаются согласно их составам:
- Ti-5Al-2.5Sn идентифицирует титановый сплав, содержащий 5% алюминия и 2,5% олова.
- Ti-6Al-4V идентифицирует Ti-сплав, содержащий 6% алюминия и 4% ванадия.

Параллельно этой системе обозначений существуют и другие системы обозначения титановых сплавов (ASTM, IMI, военная система).
Производство титана и его сплавов
Титан производится с использованием процесса Kroll. Основные стадии включают извлечение, очистку, производство губки, создание сплава, а также формование. В начале выплавки производитель получает титановые концентраты с рудников. Хотя рутил можно использовать в его естественной форме, ильменит обрабатывают для удаления железа, чтобы он содержал не менее 85% диоксида титана. Эти материалы помещаются в реактор с псевдоожиженным слоем вместе с газообразным хлором и углеродом. Материал нагревают до 900 C, и последующая химическая реакция приводит к образованию нечистого тетрахлорида титана (TiCl4) и оксида углерода. Далее различные нежелательные хлориды металлов, которые образуются, должны быть удалены.
Прореагировавший металл помещается в большие дистилляционные емкости и нагревается. На этом этапе примеси отделяются с помощью фракционной перегонки и осаждения. На этом этапе удаляются хлориды металлов, в том числе железо, ванадий, цирконий, кремний и магний.
На этом этапе удаляются хлориды металлов, в том числе железо, ванадий, цирконий, кремний и магний.
Очищенный тетрахлорид титана переносится в виде жидкости в реакторную емкость из нержавеющей стали. Затем добавляют магний, и контейнер нагревают до температуры около 1100 C. Аргон закачивается в емкость для удаления воздуха и предотвращает загрязнение сплава кислородом или азотом. Магний реагирует с хлором с образованием жидкого хлорида магния. Это оставляет твердое титановое твердое вещество, так как температура плавления титана выше, чем в реакции.
Твердое титановое вещество удаляют из реактора путем бурения, а затем обрабатывают водой и соляной кислотой для удаления избытка магния. Полученное твердое вещество представляет собой пористый металл, называемый губкой. Чистая титановая губка может быть преобразована в пригодный для использования сплав с помощью дуговой печи с расходуемым электродом. В этот момент губка смешивается с различными добавками сплава. Точное соотношение материала губки к сплаву формулируется в лаборатории до производства. Затем эту массу прессуют в компакты и сваривают вместе, образуя губчатый электрод.
Затем эту массу прессуют в компакты и сваривают вместе, образуя губчатый электрод.
Губчатый электрод помещают в вакуумно-дуговую печь для плавления. В этом охлаждаемом водой медном контейнере электрическая дуга используется для плавления губчатого электрода с образованием слитка. Весь воздух в контейнере либо удаляется (образуя вакуум), либо атмосфера заполняется аргоном для предотвращения загрязнения.
После изготовления слитка его вынимают из печи и проверяют на наличие дефектов. Поверхность может быть кондиционирована по требованию заказчика. Затем слиток отправляется покупателю готовой продукции, где он может быть измельчен и изготовлен в различные продукты.
Производство титанаОбласть применения
Титановый сплав, который имеет высокую коррозионную стойкость, высокую удельную прочность и хорошую термостойкость, используется для различных частей космического корабля, включая наружную оболочку топливного бака и крылья. Сочетая легкий вес с высокой прочностью, титан помогает усилить планеры и повысить производительность реактивных двигателей. В случае космического челнока, титан используется для многих критических частей, включая наружные панели топливного бака и детали крыла.
В случае космического челнока, титан используется для многих критических частей, включая наружные панели топливного бака и детали крыла.
В самолетах используется большое количество титанового сплава, потому что он легкий и чрезвычайно прочный при высоких температурах. ТС применяется для укрепления каркасной конструкции и способствует техническому прогрессу реактивных двигателей.
Титановые сплавы применение:
- Установки для сжиженного природного газа;
- установки опреснения морской воды;
- нефтеперерабатывающие заводы;
- атомные электростанции;
- автоцистерны для химических реагентов, потому что ТС легок, устойчив к коррозии, и чрезвычайно сильный;
- теплообменники, которые используются в экстремальных условиях высокой температуры и высокого давления;
- биомедицинские приложения.
Огромными преимуществами титана являются его высокое отношение прочности к весу и антикоррозионность. В сочетании с нетоксичным состоянием и способностью эффективно противостоять коррозии от биологических жидкостей титан стал базовым металлом для имплантата в области медицины, со сроком службы более 20 лет.
Еще одним преимуществом Ti для применения в медицинской отрасли является его неферромагнитное свойство, позволяющее безопасно обследовать больных с применением МРТ и ЯМР.
Титановый протез суставаНюансы термообработки титановых сплавов
В настоящее время из-за растущего спроса на титан и его сплавы с улучшенными физическими и химическими свойствами многие исследователи проявляют большой интерес к улучшению процессов обработки под воздействием температуры для получения новых видов сплавов.
ТС подвергаются термообработке для достижения следующего:
- Снятие напряжения, чтобы уменьшить остаточные явления, возникающие в процессе изготовления.
- Отжиг для достижения оптимального сочетания пластичности, обрабатываемости, стабильности размеров и структурной устойчивости.
- Обработка раствора и старение, для увеличения прочности.
Комбинации процессов используются для оптимизации свойств и получения других преимуществ, таких как:
- Вязкости разрушения;
- предела выносливости;
- высокой температуры ползучести;
- стойкости к преимущественному химическому воздействию;
- предотвращение искажения;
- подготовки ковки для последующих операций формования и изготовления.

Термическая обработка титановых сплавов ее типы:
- Снятие напряжения. С ТС снимается стресс, без отрицательного влияния на прочность или пластичность. Процесс ковки происходит при температуре от 595 до 705 C в течение до двух часов с последующим воздушным охлаждением. Это уменьшает нежелательные остаточные напряжения, которые могут возникнуть в процессе ковки.
- Отжиг, который обычноприменяется для ковки заготовок, не является полным отжигом и может оставить следы холодной или теплой обработки. Дуплексный и триплексный отжиг используются для улучшения сопротивления ползучести и вязкости разрушения.
- Обработка раствора и старение. Этот процесс состоит из нагрева сплава до определенной температуры, закалки с контролируемой скоростью в масле, воздухе или воде и старении. Выдержка состоит из повторного нагревания до температуры от 425 до 650 C в течение примерно двух часов. Этот процесс развивает более сильные стороны, чем другие.
Таким образом, Ti -сплавы обладают огромным потенциалом для выбора дизайнером «материала будущего» из-за его уникального сочетания металлургических свойств, таких как высокое отношение прочности к весу в диапазоне температур от минус до 540 C. В этом отношении его базовые сплавы превосходят все обычные конструкционные материалы, что позволяет применять их в самых важных процессах.
В этом отношении его базовые сплавы превосходят все обычные конструкционные материалы, что позволяет применять их в самых важных процессах.
Обрабатываемость титана и его сплавов » Ремонт Строительство Интерьер
Титан и его сплавы обычно относятся к материалам, имеющим весьма плохую обрабатываемость. Температура плавления титана составляет 1668° С. При комнатной температуре он является пластичным материалом с гексагональной плотноупакованной структурой, переходящей в объемно-центрированную структуру при температуре 882° С. Поставляется несколько марок технически чистого титана в зависимости от соотношения углерода, азота и кислорода; твердость и прочности титана повышаются, а пластичность уменьшается с увеличением содержания этих элементов.
Характеристики обрабатываемости титана отличаются от характеристик обрабатываемости других чистых металлов, рассмотренных ранее, и по нескольким критериям нельзя сказать, что он имеет плохую обрабатываемость. Стойкость инструмента ограничивается или износом задней поверхности, или деформацией инструмента, или обоими критериями вместе. Скорости съема металла для приемлемой стойкости инструмента ниже, чем при обработке железа. Однако силы резания и потребляемая мощность значительно меньше, чем при обработке железа, никеля или даже меди, особенно в диапазоне низких скоростей резания. Эти малые силы резания связаны с гораздо меньшей площадкой контакта на передней поверхности инструмента, чем при обработке резанием любого из ранее рассмотренных материалов, за исключением магния. Вследствие малой площадки контакта угол сдвига большой и стружка тонкая, часто незначительно толще, чем величина подачи. Образующаяся стружка сплошная, но с явно выраженными сегментами («пилообразная»), и при обработке сплавов это становится особенно заметным (рис. 7.33). При резании технически чистого титана нарост не образуется, и зона пластического течения на передней поверхности в среднем очень тонкая, обычно менее 0,012 мм и часто значительно тоньше.
Стойкость инструмента ограничивается или износом задней поверхности, или деформацией инструмента, или обоими критериями вместе. Скорости съема металла для приемлемой стойкости инструмента ниже, чем при обработке железа. Однако силы резания и потребляемая мощность значительно меньше, чем при обработке железа, никеля или даже меди, особенно в диапазоне низких скоростей резания. Эти малые силы резания связаны с гораздо меньшей площадкой контакта на передней поверхности инструмента, чем при обработке резанием любого из ранее рассмотренных материалов, за исключением магния. Вследствие малой площадки контакта угол сдвига большой и стружка тонкая, часто незначительно толще, чем величина подачи. Образующаяся стружка сплошная, но с явно выраженными сегментами («пилообразная»), и при обработке сплавов это становится особенно заметным (рис. 7.33). При резании технически чистого титана нарост не образуется, и зона пластического течения на передней поверхности в среднем очень тонкая, обычно менее 0,012 мм и часто значительно тоньше.
Основные трудности механической обработки титана связаны с большой продолжительностью работы инструмента и низкими допустимыми скоростями съема металла, несмотря на небольшие силы резания. Причиной этого являются высокие температуры и неблагоприятное распределение температуры в инструментах, используемых для обработки титана. Температуры в зоне пластического течения выше, чем при обработке железа при той же скорости резания, например, максимальная температура на передней поверхности инструмента составляла 900°С после обработки технически чистого титана со скоростью 91 м/мин и 650°С после обработки железа с той же скоростью и при стандартных режимах резания. Градиенты температуры в инструментах, используемых для обработки титана, приведенные на рис. 7.34, должны быть сравнены с градиентами температуры при обработке железа и никеля. Распределение температуры при обработке титана более похоже на распределение температуры при обработке железа, однако холодная зона около режущей кромки очень узкая, и зона высокой температуры расположена гораздо ближе к режущей кромке. Общая длина контакта очень короткая, и нагретые зоны не распространяются вдоль передней поверхности. Таким образом, несмотря на низкие силы резания, напряжения на передней поверхности высокие, и в зоне наибольших напряжений возле режущей кромки генерируется высокая температура. Это приводит к деформации режущей кромки и быстрому выходу инструмента из строя вследствие образования новых источников нагрева на деформированной и изношенной задней поверхности. Зачастую разрушение начинается с вершины инструмента.
Общая длина контакта очень короткая, и нагретые зоны не распространяются вдоль передней поверхности. Таким образом, несмотря на низкие силы резания, напряжения на передней поверхности высокие, и в зоне наибольших напряжений возле режущей кромки генерируется высокая температура. Это приводит к деформации режущей кромки и быстрому выходу инструмента из строя вследствие образования новых источников нагрева на деформированной и изношенной задней поверхности. Зачастую разрушение начинается с вершины инструмента.
Градиенты температуры в инструментах для обработки титановых сплавов аналогичны градиентам температуры, возникающим при обработке технически чистых металлов и отличаются от градиентов температуры при обработке стали или никелевых сплавов. Вообще, влияние легирующих добавок проявляется в увеличении температуры при любых режимах резания и, следовательно, в уменьшении допустимой скорости резания. При обработке резанием технически чистого титана влияние увеличивающегося количества посторонних примесей углерода, азота и кислорода имеет явно выраженный характер. В одной серии экспериментов повышение содержания кислорода от 0,13 до 0,20% снизило скорость срезания, при которой образуется температура 900° С, от 91 до 53 м/мин.
В одной серии экспериментов повышение содержания кислорода от 0,13 до 0,20% снизило скорость срезания, при которой образуется температура 900° С, от 91 до 53 м/мин.
При обработке сплавов, содержащих вторую фазу, повышение температуры при любой скорости резания более заметно. При стандартных режимах во время проведения экспериментов инструменты, используемые для обработки сплавов, содержащих 6% Al и 4% V, нагревались до температуры выше 900° С (на передней поверхности) при скорости резания около 19 м/мин. При обработке коммерческих сплавов, содержащих 11% Sn, 2,25% Al и 4% Mo, выход из строя инструментов из быстрорежущей стали, вызванный напряжениями и температурой, наблюдался после обработки в течение только 30 с при скорости 12 м/мин. При выходе из строя инструментов из быстрорежущей стали не только режущая кромка деформируется под действием нормальных напряжений сжатия, но и срезается нагретая быстрорежущая сталь, образуя лунку износа на передней поверхности, аналогично тому как это происходит при обработке стали.
Помимо деформации, диффузионные процессы, по-видимому, в основном являются причиной износа инструментов как из быстрорежущей стали, так и из твердого сплава при обработке титановых сплавов. При обработке инструментами из твердых сплавов большая стойкость достигается при применении WC—Co сплава, чем твердого сплава для обработки стали, содержащего TiC и TaC. Применение TiC, который успешно препятствует диффузионному износу при обработке стали, оказывает обратный эффект в отношении диффузионного износа при обработке титана и его сплавов. Имеются данные о том, что кубические зерна карбидов, содержащие TiC, диффундируют в обрабатываемый титан быстрее, чем зерна WC. Износостойкость при диффузионном износе и сопротивление деформированию при высоких температурах делают твердый сплав на основе WC—Co пригодным для обработки титановых сплавов. Даже при применении вольфрамовых сплавов скорости резания при механической оработке сплавов с более высоким сопротивлением ползучести низкие, например, 30 м/мин.
Титан — характеристики, свойства сплавов и их применение
Титан — характеристики, свойства сплавов и их применение
Титан (Ti) от латинского Titanium – лёгкий серебристо-белый металл. Температура плавления 1668 °C, кипения 3287 °C. Теплопроводность 21,9 Вт/(м·К) при 20 °C. Температурный коэффициент линейного расширения 9,2·10−6 К−1 в интервале от −120 до +860 °C. Прочность металла мало зависят от температуры, но при этом напрямую зависит от предварительной обработки. Для технического титана твёрдость по Виккерсу составляет 790-800 МПа, модуль нормальной упругости 103 ГПа, модуль сдвига 39,2 ГПа. У высокочистого предварительно отожжённого в вакууме титана предел текучести 140-170 МПа, относительное удлинение 55-70%, твёрдость по Бринеллю 716 МПа. Титан характеризуется с повышенной вязкостью, при механической обработке склонен к налипанию на режущий инструмент, из-за чего требуется нанесение смазочного материала. Покрывается защитной плёнкой оксида TiO2, стояк к коррозии кроме щелочной среды. Повышенная устойчивость титана к испарению в вакууме, плюс легкость делают металл востребованным при конструировании космических кораблей. Температура перехода в сверхпроводящее состояние 0,387 К. При температурах выше 73 кельвин титан парамагнитен.
Повышенная устойчивость титана к испарению в вакууме, плюс легкость делают металл востребованным при конструировании космических кораблей. Температура перехода в сверхпроводящее состояние 0,387 К. При температурах выше 73 кельвин титан парамагнитен.
Основные категории титановых сплавов
- Конструкционные и высокопрочные титановые сплавы. Имеют очень твердый состав, благодаря которому достигается идеальный баланс пластичности и прочности.
- Жаропрочные титановые сплавы. Имеют твердый состав, включающий в себя определенное количество химического соединения, что несколько снижает пластичность, зато придает высокую жаропрочность.
- Титановые сплавы на основе химического соединения. Этот жаропрочный состав имеет малую плотность и может составить конкуренцию никелевым соединениям по жаропрочности при определенной температуре.
Сейчас титан очень широко используют в конструкционной деятельности. Еще 200 лет назад его считали неподходящим для конструирования, но прошло время, и на данный момент это один из самых долговечных и надежных материалов с широким спектром других полезных свойств.
Еще 200 лет назад его считали неподходящим для конструирования, но прошло время, и на данный момент это один из самых долговечных и надежных материалов с широким спектром других полезных свойств.
Марки и химический состав
Процентное соотношение элементов в деформируемых титановых сплавах по ГОСТ 19807–91.
| Марки | Ti | Al | V | Mo | Sn | Zr | Mn | Cr | Si | Fe | O | H | N | C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ВТ1-00 | Основа | – | – | – | – | – | – | – | 0,08 | 0,15 | 0,10 | 0,008 | 0,04 | 0,05 |
| ВТ1-0 | То же | – | – | – | – | – | – | – | 0,10 | 0,25 | 0,20 | 0,010 | 0,04 | 0,07 |
| ВТ1-2 | То же | – | – | – | – | – | – | – | 0,15 | 1,5 | 0,30 | 0,010 | 0,15 | 0,10 |
| ОТ4-0 | То же | 0,4–1,4 | – | – | – | 0,30 | 0,5–1,3 | – | 0,12 | 0,30 | 0,15 | 0,012 | 0,05 | 0,10 |
| ОТ4-1 | То же | 1,5–2,5 | – | – | – | 0,30 | 0,7–2,0 | – | 0,12 | 0,30 | 0,15 | 0,012 | 0,05 | 0,10 |
| ОТ4 | То же | 3,5–5,0 | – | – | – | 0,30 | 0,8–2,0 | – | 0,12 | 0,30 | 0,15 | 0,012 | 0,05 | 0,10 |
| ВТ5 | То же | 4,5–6,2 | 1,2 | 0,8 | – | 0,30 | – | – | 0,12 | 0,30 | 0,20 | 0,015 | 0,05 | 0,10 |
| ВТ5-1 | То же | 4,3–6,0 | 1,0 | – | 2,0 –3,0 | 0,30 | – | – | 0,12 | 0,30 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ6 | То же | 5,3–6,8 | 3,5–5,3 | – | – | 0,30 | – | – | 0,10 | 0,60 | 0,20 | 0,015 | 0,05 | 0,10 |
| ВТ6с | То же | 5,3–6,5 | 3,5–4,5 | – | – | 0,30 | – | – | 0,15 | 0,25 | 0,15 | 0,015 | 0,04 | 0,10 |
| ВТ3-1 | То же | 5,5–7,0 | – | 2,0–3,0 | – | 0,50 | – | 0,8–2,0 | 0,15–0,40 | 0,2–0,7 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ8 | То же | 5,8–7,0 | – | 2,8–3,8 | – | 0,50 | – | – | 0,20–0,40 | 0,30 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ9 | То же | 5,8–7,0 | – | 2,8–3,8 | – | 1,0–2,0 | – | – | 0,20–0,35 | 0,25 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ14 | То же | 3,5–6,3 | 0,9–1,9 | 2,5–3,8 | – | 0,30 | – | – | 0,15 | 0,25 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ20 | То же | 5,5–7,0 | 0,8–2,5 | 0,5–2,0 | – | 1,5–2,5 | – | – | 0,15 | 0,25 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ22 | То же | 4,4–5,7 | 4,0–5,5 | 4,0–5,5 | – | 0,30 | – | 0,5–1,5 | 0,15 | 0,5–1,5 | 0,18 | 0,015 | 0,05 | 0,10 |
| ПТ-7М | То же | 1,8–2,5 | – | – | – | 2,0–3,0 | – | – | 0,12 | 0,25 | 0,15 | 0,006 | 0,04 | 0,10 |
| ПТ-3В | То же | 3,5–5,0 | 1,2–2,5 | – | – | 0,30 | – | – | 0,12 | 0,25 | 0,15 | 0,006 | 0,04 | 0,10 |
| АТ3 | То же | 2,0–3,5 | – | – | – | – | – | 0,2–0,5 | 0,20–0,40 | 0,2–0,5 | 0,15 | 0,008 | 0,05 | 0,10 |
Свойства титана
По плотности и удельной теплоемкости титан занимает промежуточное место между двумя основными конструкционными металлами: алюминием и железом. Стоит также отметить, что его механическая прочность примерно вдвое больше, чем чистого железа, и почти в шесть раз выше, чем алюминия. Но титан может активно поглощать кислород, азот и водород, которые резко снижают пластические свойства металла. С углеродом титан образует тугоплавкие карбиды, обладающие высокой твердостью.
Стоит также отметить, что его механическая прочность примерно вдвое больше, чем чистого железа, и почти в шесть раз выше, чем алюминия. Но титан может активно поглощать кислород, азот и водород, которые резко снижают пластические свойства металла. С углеродом титан образует тугоплавкие карбиды, обладающие высокой твердостью.
Титан обладает низкой теплопроводностью, которая в 13 раз меньше теплопроводности алюминия и в 4 раза – железа. Коэффициент термического расширения при комнатной температуре сравнительно мал, с повышением температуры он возрастает.
Модули упругости титана невелики и обнаруживают существенную анизотропию. Модули упругости характеризуют способность материала упруго деформироваться при приложении к нему силы. Анизотропия заключается в различии свойств упругости в зависимости от направления действия силы. С повышением температуры до 350 °С модули упругости уменьшаются почти по линейному закону. Небольшое значение модулей упругости титана – существенный его недостаток, т. к. в некоторых случаях для получения достаточно жестких конструкций приходится применять большие сечения изделий по сравнению с теми, которые следуют из условий прочности.
к. в некоторых случаях для получения достаточно жестких конструкций приходится применять большие сечения изделий по сравнению с теми, которые следуют из условий прочности.
Титан имеет довольно высокое удельное электросопротивление, которое в зависимости от содержания примесей колеблется в пределах от 42·10-8до 80·10-6 Ом·см. При температурах ниже 0,45 К он становится сверхпроводником.
Титан – парамагнитный металл. Обычно у парамагнитных веществ магнитная восприимчивость при нагревании уменьшается. Магнитная восприимчивость характеризует связь между намагниченностью вещества и магнитным полем в этом веществе. Титан составляет исключение из этого правила – его восприимчивость существенно увеличивается с температурой.
На нашем сайте, в каталоге титанового проката, вы можете ознакомится и приобрести следующие виды продукции из титана:
- Блин титановый
- Карточка титановая
- Квадрат титановый
- Лист титановый
- Плита титановая
- Пруток титановый
- Слиток титановый
- Труба титановая
- Фольга титановая
- Шестигранник титановый
- Проволока титановая
Применение титана
На шельфовых трубопроводах специального назначения применяются для соединения труб титановые блины. Они не ржавеют, не окисляются при контакте с воздухом и агрессивными веществами, жаропрочные и жаростойкие, долго не изнашиваются. Применяются в горной и нефтедобывающей промышленности.
Они не ржавеют, не окисляются при контакте с воздухом и агрессивными веществами, жаропрочные и жаростойкие, долго не изнашиваются. Применяются в горной и нефтедобывающей промышленности.
В медицине титан используют благодаря биологической и физиологической инертности по отношению к живому организму, в сочетании с антикоррозионной стойкостью и повышенным механическим качествам. Титановые карточки применяется в изготовлении протезов, зубных имплантатов, в стоматологических и эндодонтических инструментах.
Широкое использование титана и его сплавов в морском судостроении, из-за малой плотности материала. Исключительная стойкость при воздействии морской водой, делает титан незаменимым материалом, для обшивки судов как правило для этого используется листовой титан. Обшитые листами корпуса судов не требуют окраски, и десятилетиями не ржавеют и не разрушаются в морской воде. Малая плотность позволяет снижать массу корабля, что повышает его маневренность и дальность хода. Также широко используются титановые квадраты. Эрозионная и навигационная стойкость позволят не бояться больших скоростей в морской воде: частицы песка не повредят титановым рулям. Прутки из титановых сплавов применяются для изготовления валов, распорок, опоры, части якоря. На подводных лодках титан используется для изготовления деталей палубной арматуры, антенн, приборов, рукояток, постоянно погруженных в морскую воду. Из титана делают корпуса подводных лодок сверхглубокого погружения до 6 км.
Эрозионная и навигационная стойкость позволят не бояться больших скоростей в морской воде: частицы песка не повредят титановым рулям. Прутки из титановых сплавов применяются для изготовления валов, распорок, опоры, части якоря. На подводных лодках титан используется для изготовления деталей палубной арматуры, антенн, приборов, рукояток, постоянно погруженных в морскую воду. Из титана делают корпуса подводных лодок сверхглубокого погружения до 6 км.
Для изготовления конструктивных деталей вертолетов, самолетов используются титановые плиты. К примеру, у Boeing 787 Dreamliner количество титановых деталей составляет 30%. В авиастроительстве титан используется для надежности конструкции, снижает вес деталей и увеличивает долговечность. Титан материал, используемый при конструировании космического корабля «Восток», на котором Юрий Гагарин совершил первый полет в космос, а также в пилотируемых и беспилотных кораблях «Союз», «Марс», «Луна», «Венера».
Шестигранники из сплавов титана используются как конструктивный элемент двигателей космических кораблей. В изготовлении композитных и многокомпонентных материалов используется фольга из титана. Промышленное фольга толщиной до 13 мкм.
В изготовлении композитных и многокомпонентных материалов используется фольга из титана. Промышленное фольга толщиной до 13 мкм.
В изготовлении шин для авиатранспорта, как армирующий компонент используется титановая проволока. Она значительно снижает вес шин и повышает их долговечность. В новых моделях шин проложена дополнительная силовая сетка, предохраняющая отрыв резинового протектора от корда. Такие модели позволяют эксплуатацию самолета с большим взлетным весом.
В химической и нефтяной промышленности используются титановые трубы. Использование титана в химической промышленности позволило наладить выработку хлора и калия, мочевины и соды, отбеливающих средств, и средств бытовой химии.
Титан в виде слитков используется как сырье для дальнейшей переработки.
Назад в блог статей
Физические свойства титана и его сплавов
Титан легкий, прочный, устойчивый к коррозии и распространен в природе. Титан и его сплавы обладают пределом прочности при растяжении от 30 000 фунтов на квадратный дюйм до 200 000 фунтов на квадратный дюйм (210–1380 МПа), что эквивалентно прочности большинства легированных сталей. Плотность титана составляет всего 56 процентов от плотности стали, а его коррозионная стойкость не уступает платине. Из всех элементов земной коры титан занимает девятое место по распространенности.
Плотность титана составляет всего 56 процентов от плотности стали, а его коррозионная стойкость не уступает платине. Из всех элементов земной коры титан занимает девятое место по распространенности.
Титан имеет высокую температуру плавления 3135°F (1725°C). Эта температура плавления примерно на 400°F (220°C) выше температуры плавления стали и примерно на 2000°F (1100°C) выше температуры плавления алюминия.
Титан легкий, прочный, устойчивый к коррозии и распространен в природе. Титан и его сплавы обладают пределом прочности при растяжении от 30 000 фунтов на квадратный дюйм до 200 000 фунтов на квадратный дюйм. (210-1380 МПа), что эквивалентно прочностным характеристикам большинства легированных сталей. Плотность титана составляет всего 56 процентов от плотности стали, а его коррозионная стойкость хорошо сравним с платиной. Из всех элементов земной коры титан занимает девятое место по распространенности.
Физические свойства
Если все элементы расположить в порядке порядкового номера, то можно заметить, что
существует связь в свойствах, соответствующих атомному номеру.
Титан находится в четвертой колонке вместе с химически подобными цирконием, гафнием, и торий. Поэтому не было неожиданностью, что титан будет обладать некоторыми свойства аналогичны свойствам этих металлов.
Титан имеет два электрона на третьей оболочке и два электрона на четвертой оболочке. При таком расположении электронов, когда внешние оболочки заполняются раньше внутренних оболочки полностью заняты, происходит в металле, известном как переходный металл. Такое расположение электронов отвечает за уникальные физические свойства титан. Чтобы упомянуть некоторые из них, хром, марганец, железо, кобальт и никель обнаружены в переходной серии.
Атомный вес титана 47,88, атомный вес алюминия 26,97. и железо 55,84.
Кристаллическую структуру можно рассматривать как физически однородное твердое тело, в котором
атомы расположены в повторяющемся порядке. Эта аранжировка играет важную роль в
физическое поведение металла. Большинство металлов имеют либо объемно-центрированную кубическую,
гранецентрированная кубическая или гексагонально-плотноупакованная структура.
Титан имеет высокую температуру плавления 3135°F (1725°C). Эта точка плавления примерно на 400°F выше точки плавления стали и примерно на 2000°F выше, чем у алюминия.
Теплопроводность. Способность металла проводить или передавать теплоты называется его теплопроводностью. Таким образом, материал, чтобы быть хорошим изолятором, будет иметь низкую теплопроводность, тогда как радиатор будет иметь высокий показатель проводимости для рассеивания тепла. Физик дал бы определение этому явлению как скорость переноса проводимостью, через единицу толщины, через единицу площадь для единичного температурного градиента.
Коэффициент линейного расширения. Нагрев металла до температуры
ниже точки плавления заставляет его расширяться или увеличиваться в длину. Если брусок или стержень
нагревается равномерно по всей длине, каждая единица длины стержня увеличивается.
Это увеличение на единицу длины на градус повышения температуры называется коэффициентом
линейного расширения. Где металл будет попеременно подвергаться ударам и
циклов охлаждения и должен поддерживать определенный допуск размеров, низкий коэффициент
желательно тепловое расширение. При контакте с металлом другого
коэффициент, это соображение приобретает большее значение.
Где металл будет попеременно подвергаться ударам и
циклов охлаждения и должен поддерживать определенный допуск размеров, низкий коэффициент
желательно тепловое расширение. При контакте с металлом другого
коэффициент, это соображение приобретает большее значение.
Титан имеет низкий коэффициент линейного расширения, равный 5,0×10 -6 дюйм на дюйм/°F, в то время как из нержавеющей стали 7,8х10 -6 , медь 16,5х10 -6 и алюминий 12,9х10 -6 .
Электропроводность и удельное сопротивление. Поток электронов через металл из-за падения потенциала называется электропроводностью. атомная структура металла сильно влияет на его электрические свойства.
Титан не является хорошим проводником электричества. Если проводимость меди
считается 100%, титан будет иметь проводимость 3,1%. Отсюда следует
что титан не будет использоваться там, где хорошая проводимость является основным фактором. За
Для сравнения, нержавеющая сталь имеет проводимость 3,5%, а алюминий имеет проводимость
30%.
Электрическое сопротивление — это сопротивление материала потоку электронов. Поскольку титан является плохим проводником, из этого следует, что он является хорошим резистором.
Магнитные свойства. Если металл поместить в магнитное поле, на него действует сила. Интенсивность намагниченности, называемая М, может быть измерена с точки зрения прилагаемой силы и ее отношения к напряженности магнитного поля, H, в зависимости от восприимчивости K, которая является свойством металла.
Металлы имеют широкий разброс в восприимчивости и могут быть разделены на три группы:
- Диамагнитные вещества, у которых К мала и отрицательна и поэтому слабо отталкивается магнитным полем; примерами являются медь, серебро, золото и висмут.
- Парамагнитные вещества, у которых К мал и положителен и поэтому
слегка притягивается магнитным полем; щелочные, щелочные и неферромагнитные
в эту группу попадают переходные металлы (видно, что титан слегка
парамагнетик).

- Ферромагнитные вещества, имеющие большое значение K и положительные; железо, кобальт, никель и галлий подпадают под эту категорию.
Важной особенностью группы 3, помимо сильного притяжения в магнитном поле, является заключается в том, что эти металлы сохраняют свою намагниченность после удаления из магнитное поле.
К настоящему времени указано большинство наиболее важных физических свойств титана.
Металлургия титана и его сплавов
Металлургия титана и его сплавовHKDH Бхадешия
Чистый титан
Чистый титан плавится при 1670 o С и имеет плотность
4,51 г см -3 . Поэтому он должен идеально подходить для использования в
компоненты, которые работают при повышенных температурах, особенно там, где большие
необходимо соотношение прочности и веса. Титан может загореться и нанести серьезный ущерб
условиях, когда он трется о другие металлы при повышенных температурах. Это
что ограничивает его применение в суровых условиях авиадвигателей, в регионах, где
температура не превышает 400 или С.
Это
что ограничивает его применение в суровых условиях авиадвигателей, в регионах, где
температура не превышает 400 или С.
Последствия титанового пожара в авиадвигатель. Лезвия из никелевого сплава сгорели. Фотография предоставлена доктором М. Хикс, РР. |
Тем не менее мировое производство титана очень невелико, сотни тысяч тонн, что сопоставимо, скажем, со сталью на уровне 750 миллионов тонн в год. 80% всего титана Произведенный используется в аэрокосмической промышленности. Пружины подвески автомобиля можно легко сделать из титан с большим снижением веса, но титан недоступен в больших необходимом количестве и, конечно, не по цене, требуемой для автомобиля Приложения. Целевая цена на титаний должна быть снижена примерно до 30% от его актуальное значение для серьезного применения в автомобилях массового рынка.
Чистый титан обладает отличной коррозионной стойкостью и широко используется
в химической промышленности. Имеется пассивная оксидная пленка, которая делает его
особенно устойчив к коррозии в окислительных растворах. коррозия
стойкость может быть дополнительно улучшена путем добавления палладия (0,15 мас.%), который
облегчает выделение водорода на катодных участках, так что анодный и
баланс катодных реакций в пассивной области
Имеется пассивная оксидная пленка, которая делает его
особенно устойчив к коррозии в окислительных растворах. коррозия
стойкость может быть дополнительно улучшена путем добавления палладия (0,15 мас.%), который
облегчает выделение водорода на катодных участках, так что анодный и
баланс катодных реакций в пассивной области
Чистый титан обладает отличной коррозионной стойкостью и широко используется в химической промышленности. Имеется пассивная оксидная пленка, которая делает его особенно устойчив к коррозии в окислительных растворах. коррозия стойкость может быть дополнительно улучшена путем добавления палладия (0,15 мас.%), который облегчает выделение водорода на катодных участках, так что анодный и катодные реакции уравновешиваются в пассивной области. Диаграмма представляет собой график зависимости потенциала от плотности тока. Катодная реакция представляет собой выделение водорода, представленное прямыми линиями (сплошная ≡Ti, пунктирная ≡Ti-Pd). |
На большинстве химических заводов используются стальные сосуды, плакированные титаном. титан часто связывают взрывом. Титановые конденсаторные трубки используется на электростанции и в опреснительной установке.
Кристаллическая структура титана при температуре окружающей среды и давлении плотноупакованный гексагонал (α) с отношением c/a , равным 1,587. Скольжение возможно на пирамидальной, призматической и базисной плоскостях в плотно упакованные направления. Примерно при 890 o C титан подвергается аллотропному преобразованию в объемно-центрированную кубическую β фаза, которая остается стабильной до температуры плавления.
Кристаллическая структура α-титана. | Кристаллическая структура β-титана. | Плоскости скольжения в α-титан |
Легирование титана
Все элементы в диапазоне 0,85-1,15 атомного радиуса
из титанового сплава замещения и обладают значительной растворимостью в
титан. Элементы с атомным радиусом менее 0,59 радиуса Ti
занимают интерстициальные сайты, а также обладают значительной растворимостью ( напр. Н, Н,
О, С). Легкость, с которой растворенные вещества растворяются в титане, затрудняет
проектирование дисперсионно-твердеющих сплавов. Бор имеет аналогичный, но больший радиус
чем C, O, N и H; поэтому можно индуцировать борид титана
осадки. Осадки меди
также возможно в соответствующих сплавах.
Элементы с атомным радиусом менее 0,59 радиуса Ti
занимают интерстициальные сайты, а также обладают значительной растворимостью ( напр. Н, Н,
О, С). Легкость, с которой растворенные вещества растворяются в титане, затрудняет
проектирование дисперсионно-твердеющих сплавов. Бор имеет аналогичный, но больший радиус
чем C, O, N и H; поэтому можно индуцировать борид титана
осадки. Осадки меди
также возможно в соответствующих сплавах.
График меры атомной радиус против электроотрицательности Полинга для элементов. Заметьте, есть много элементы такого же размера, как титан, а B, H, N, O и C попадают в промежуточный диапазон правил Юма-Розери. |
Легирующие элементы можно разделить на категории в зависимости от их действия на стабильность α- и β-фазы. Таким образом, Al, O, N и Ga все α-стабилизаторы. Mo, V, W и Ta являются β-стабилизаторами.
Cu, Mn, Fe, Ni, Co и H также являются β-стабилизаторами, но образуют
эвтектоид. Эвтектоидная реакция часто бывает вялой (т.к.
замещающих атомов) и подавляется.
Эвтектоидная реакция часто бывает вялой (т.к.
замещающих атомов) и подавляется.
| Фазовые диаграммы для титановых сплавов. |
Молибден и ванадий оказывают наибольшее влияние на β стабильность и являются обычными легирующими элементами. Вольфрам добавляют редко из-за его высокая плотность. Cu образует TiCu 2 , что делает сплавы стареющие и термообрабатываемые; такие сплавы используются как листовые материалы. Обычно его добавляют в концентрациях менее 2,5 мас.% в коммерческих сплавах.
Zr, Sn и Si являются нейтральными элементами.
Межстраничные объявления
Они не подходят должным образом и вызывают изменения в параметрах решетки. Водород является наиболее важным междоузлием. Объемно-центрированный кубический Ti имеет три октаэдрических междоузлия на атом, тогда как c.p.h. Ти имеет один на атом. Поэтому последние больше, так что растворимость O, N, и C намного выше в α-фазе.
Титан способен поглощать до 60 ат. % водорода, который также можно удалить
отжиг в вакууме. Водород входит в тетраэдрические отверстия, которые больше в ОЦК. чем
c.p.h. Таким образом, растворимость водорода больше в
β. Энтальпия растворения водорода в Ti отрицательна (ΔH<0).
% водорода, который также можно удалить
отжиг в вакууме. Водород входит в тетраэдрические отверстия, которые больше в ОЦК. чем
c.p.h. Таким образом, растворимость водорода больше в
β. Энтальпия растворения водорода в Ti отрицательна (ΔH<0).
Как показано на графике справа, растворимость фактически уменьшается с температурой. Это контрастирует с железом, которое показывает противоположную тенденцию.
Из-за этой характеристики титан является материалом-кандидатом на первая стенка магнитоупорных термоядерных реакторов. На основе водорода плазма не вредна, так как при 500 o C и давлении 1 Па Ti не набирает достаточное количество водорода для охрупчивания. Дополнительный особенностью является то, что Ti сопротивляется набуханию из-за нейтронного повреждения.
Достаточно большая концентрация водорода вызывает осаждение
гидриды. TiH 1,5-2,0 имеет решетку Cubic-F и ее
осадки вызывают охрупчивание из-за объемного расширения примерно
18%. В вершинах трещин имеются области гидростатического напряжения, где
формируется преимущественно, что приводит к значительному увеличению роста трещины
скорость, примерно в 50 раз во время утомления.
В вершинах трещин имеются области гидростатического напряжения, где
формируется преимущественно, что приводит к значительному увеличению роста трещины
скорость, примерно в 50 раз во время утомления.
Гидридную реакцию также можно использовать для обратимого хранения водорода:
Отношение энергии к массе такой ячейки примерно в десять раз меньше, чем у бензин.
Одной из проблем этого метода хранения водорода является то, что образование гидрида сопровождается значительное объемное расширение, которое, в свою очередь, может привести к охрупчиванию сплава. Аморфные сплавы титан в этом отношении лучше, так как они образуют гидриды и все же обратимо приспосабливают большие количества водорода за счет расширения расстояние до ближайшего соседа. Титан и цирконий металлургически подобны. Последние также образуют гидриды.
Zr-Ti фаза Лавеса Ti 0,24 Zr 0,76 (Ni 0,55 Mn 0,3 V 0,065 Fe 0,085 9016 8 найдено) 106168 0,085 для реверсивного размещения почти 1,5% водорода по массе с номиналом батареи
каких-то 440 мАч г -1 .
Специальные сплавы
α-сплавы
Сплавыα легко свариваются и относительно прочны даже при криогенных температурах. Помимо Zr и Sn основным легирующим элементом является алюминий. комбинированный эффект выражается как:
Если это превышает примерно 9 мас.%, то могут быть вредные реакции осаждения (обычно Ti 3 X, которые имеет упорядоченную в.п.п. структура).
Наличие небольшого количества более пластичной β-фазы в почти α-сплавы выгодны для термической обработки и способность ковать. Таким образом, сплавы могут содержать около 1 мас.% Mo , т.е.
, где Zr и Sn дают твердые укрепление раствора.
Ti-5Al-2,5Sn вес.% представляет собой α-сплав, который коммерчески доступен во многих формах. Поскольку он стабилен в условиях α, его нельзя упрочнить термической обработкой. Поэтому он не особенно прочен, но легко поддается сварке. Ударная вязкость при криогенных температурах увеличивается, когда концентрации кислорода, углерода и азота уменьшаются для получения варианта, обозначенного 9. 0108 ELI , расшифровывается как очень низкие межстраничные объявления . Тот факт, что прочность увеличивается при низких температурах без какого-либо ухудшения ударной вязкости, делает сплав особенно подходящим для изготовления криогенных емкостей для хранения, например, содержащих жидкий водород.
0108 ELI , расшифровывается как очень низкие межстраничные объявления . Тот факт, что прочность увеличивается при низких температурах без какого-либо ухудшения ударной вязкости, делает сплав особенно подходящим для изготовления криогенных емкостей для хранения, например, содержащих жидкий водород.
Представленные выше результаты относятся к слитку Ti-5Al-2,5Sn ELI , который был прокован при 1473 К (максимум), выдержан при 1073 К в течение 2 часов, а затем охлажден на воздухе. Изменчивость данных по прочности является отражением положения, из которого образец для испытаний был извлечен из кованой заготовки. Данные предоставлены Национальным институтом материаловедения Японии. | |
Микроструктура сплава Ti-5Al-2.5Sn ELI в заготовке диаметром 160 мм (Национальный институт материаловедения, Япония). Он состоит в основном из α с небольшим количеством β. |
Сплавы, близкие к α
Разработан сплав, близкий к α, с хорошими свойствами при повышенных температурах. (Т<590 или С):
Добавлен ниобий для устойчивости к окислению, а углерод для обеспечения более высокой температуры. диапазон, в котором сплав представляет собой смесь α+β, чтобы облегчить термомеханическая обработка. Именно этот сплав используется в производстве авиадвигателей. диски и заменили диски, сделанные из гораздо более тяжелых суперсплавов на основе никеля. Финал микроструктура сплава состоит из равноосных первичных α-зерен, Widmanstätten α-пластины, разделенные β-фазой.
α+β сплавы
Большинство сплавов α+β обладают высокой прочностью и формуемостью, и
содержат 4-6 мас.% β-стабилизаторов, что позволяет существенно
количество β, которое должно быть сохранено при гашении из
β→α+β фазовые поля, напр. Ти-6Ал-4В. Al уменьшает плотность, стабилизирует и укрепляет
α, в то время как ванадий обеспечивает большее количество более пластичных
β-фаза для горячей обработки. Этот сплав, на долю которого приходится около половины всех
производимого титана, популярен благодаря своей прочности (1100 МПа), сопротивлению ползучести при
300 o C, сопротивление усталости и способность к литью.
Этот сплав, на долю которого приходится около половины всех
производимого титана, популярен благодаря своей прочности (1100 МПа), сопротивлению ползучести при
300 o C, сопротивление усталости и способность к литью.
Типичная микроструктура сплава Ti-6V-4Al, масс. %, охлажденного из поля α-фазы для получения видманштеттовой β. Микрофотографии взяты из проекта DoITPoMS, любезно предоставлены Биллом Клайном. |
Одной из трудностей с β-фазой, которая имеет объемно-центрированную кубическую кристаллическую структуру, является что, как и ферритный чугун, он имеет температуру вязко-хрупкого перехода. Переход температура, как правило, выше комнатной температуры, с преобладанием раскола при температуре окружающей среды. температуры.
Разработан вариант порошковой металлургии Ti-6Al-4V, содержащий небольшие концентрации бора и углерода, с примерно на 25% более высокими прочностью и модулем, но значительно меньшей пластичностью. Сплав содержит стабильные выделения TiB, которые предотвращают рост зерен во время операций горячей обработки (Adv. Mater. Proc., Oct 2005, p.9).
Сплав содержит стабильные выделения TiB, которые предотвращают рост зерен во время операций горячей обработки (Adv. Mater. Proc., Oct 2005, p.9).
Жаропрочные β-сплавы
Пожары титана могут иногда возникать в авиационных двигателях или в теплообменниках на основе титана. используется в химической промышленности.
Добавление хрома в концентрациях, превышающих 10 мас.%, помогает улучшить жаростойкость титановых сплавов. Сплав Ti-35V-15Cr мас.%, имеет достаточное количество хрома сопротивляться горению в среде авиационных двигателей до температур примерно до 510 o С . хром не эффективен в бинарных сплавах Ti-Cr, где он не способствуют образованию сплошной пленки защитного оксида.
Закалка от β
Закалка β-фазы приводит к образованию г.к.п. α’ мартенсит. Это не особенно сложно, и количество количество оставшегося β в микроструктуре в виде растворенного вещества концентрация увеличивается, а М S температура снижается.
, а габитусная плоскость мартенсита близка к {3 3 4} β .
| Мартенситный преобразование из β. Обратите внимание, что для всех составов превращение подавляется ниже равновесной фазовой границы α+β/β. Это связано с неравновесной природой мартенсита. |
β→ω Преобразование
ω – метастабильная фаза, образующаяся из β в сплавах на основе титана, цирконий и гафний. Это важно, потому что его формирование обычно приводит к ухудшение механических свойств. В сплавах Ti-Nb на его образование влияет сверхпроводимость. Превращение в ω бездиффузионное, происходит ниже T 0 температуры и часто не может быть подавлена даже закалкой при 11000 К с -1 . Его присутствие вызывает диффузные полосы на электронограммах β-фаза. Полосы становятся более интенсивными и искривленными в зависимости от температуры или температуры. концентрация растворенного вещества увеличивается. Кроме того, увеличивается электрическое сопротивление формы ω.
Превращение β→ω обратимо и бездиффузионно, но
не мартенситный в классическом смысле, так как нет формы инвариантной плоской деформации
деформация. Однако это связано с скоординированным движением атомов.
Однако это связано с скоординированным движением атомов.
Объемно-центрированную кубическую (ОЦК) кристаллическую структуру β можно представить как стопку
{111} плоскостей β в последовательности укладки ….ABCABC…. . Обратите внимание, что эти самолеты
не плотно упакованы в ОЦК структуру. Преобразование β → ω
происходит при прохождении волны продольного смещения вдоль <111>, что вызывает B и C , чтобы врезаться друг в друга, не затрагивая A . Укладка
таким образом, последовательность меняется на …AB’AB’AB’…. , в котором плоскости B’ имеют удвоенную плотность
атомов как плоскостей A . …AB’AB’AB’…. укладка соответствует ω гексагональной кристаллической структуре с c/a около
0,6. Атомы в плоскости B’ имеют тригональную координацию, подобную таковой в
графит, и связь становится частично ковалентной. Это приводит к увеличению
электрическое сопротивление. Продольные волны смещения ответственны за
появление полос на электронограммах.
| (a) Волна смещения, связанная с преобразование β в ω. Плоскости A не затрагиваются, так как они лежат в узлы. (б) Полосы на электронограмме при ω-превращении. |
Алюминиды титана
Самый удачный из алюминидов имеет пластинчатую структуру, состоящую из чередующиеся слои шестиугольной Ti 3 Al α 2 соединение и тетрагональный TiAl или γ.
Тетрагональный TiAl, γ. Кино. | Проекция кристаллической структуры вдоль оси z . Шестигранник Ti 3 Al α 2 . Числа представляют дробные координаты вдоль оси z . | Шестигранник Ti 3 Al α 2 .Movie. |
Пластичность при растяжении составляет около 4-6% при температуре окружающей среды. γ-алюминид, как правило,
более пластичный. Плотность около 4,5 г см 2 , а алюминий делает алюминид более устойчивым к горению. сплавы
были тщательно изучены для аэрокосмических и автомобильных турбокомпрессоров, потому что
их высокой прочности, низкой плотности и сопротивления ползучести. γ-фаза
формы с наиболее плотно упакованной плоскостью, параллельной базисной плоскости
α 2 :
сплавы
были тщательно изучены для аэрокосмических и автомобильных турбокомпрессоров, потому что
их высокой прочности, низкой плотности и сопротивления ползучести. γ-фаза
формы с наиболее плотно упакованной плоскостью, параллельной базисной плоскости
α 2 :
Пластинчатый микроструктура является прямым следствием этого отношения ориентации.
| Ti-48Al ат.%: пластинчатый микроструктура чередующихся слоев α 2 и γ (Ким и Маруяма, 2001) |
Применение титана и его сплавов
- Компьютеры, автомобили, авиадвигатели и т. д.
- Фильмы, демонстрирующие различные приложения.
- Оксигенирование и электродеоксигенирование Ti-6Al-4V
Каталожные номера
- Улучшенная емкость хранения водорода Аморфные сплавы TiZrNiCu, Materials Transactions JIM 42 (2001) 2133-2135, X. Го, Л. Ма и А. Иноуэ.
- Водород в титане, International Journal of Hydrogen Energy, 24 (1999) 565-576,
О.
 Н. Сенков и Ф. Х. Фрус.
Н. Сенков и Ф. Х. Фрус. - Фазовые превращения в системе Ti-6Al-4V-H, Журнал металлов, 54 (2002) 68-71, Дж. И. Кази, Дж. Рахим, О. Н. Сенков и Ф. Х. Фроуз.
- Двойник во время ползучести в TiAl, Acta Materialia, 49 (2001) 2635-2643, Х. Ю. Кима и К. Маруяма.
| Домашняя страница группы ПТ | Алгоритмы материалов |
Понимание термических свойств титана — IMS
Титан и его сплавы широко используются для конструкционных применений в аэрокосмической, автомобильной, оборонной, спортивной технике и здравоохранении из-за их высокой прочности, малого веса, отличной коррозионной стойкости и в целом стабильных свойств. при высоких и низких температурах. Однако уникальные термические свойства титана делают его непригодным для одних применений, в то время как для других он превосходен.
Титан ведет себя несколько иначе, чем большинство металлов при экстремальных температурах, поэтому важно понимать тепловые свойства титана, прежде чем использовать его в такой среде. Например, хотя титан остается прочным при высоких температурах, он плохо рассеивает тепло, что может привести к его накоплению в металле. Однако некоторые титановые сплавы также могут очень хорошо работать при криогенных температурах.
В этом посте мы рассмотрим термические свойства титана при высоких температурах и криогенных температурах и то, как они влияют на его способность работать в обычных приложениях.
Термические свойства титана при высоких температурах
Титан хорошо работает в условиях экстремальных температур благодаря своей высокой температуре плавления и многоцикловой усталостной прочности. Он предпочтителен в таких приложениях, как авиационные двигатели, военно-морские корабли, космические корабли, ракеты и трубы для электростанций из-за его превосходной коррозионной стойкости, вызванной защитным процессом окисления, который происходит при воздействии высоких температур. Эта температура окисления снижается в атмосфере чистого кислорода.
Эта температура окисления снижается в атмосфере чистого кислорода.
Ниже мы более подробно рассмотрим термические свойства технически чистого титана и титановых сплавов.
Коммерчески чистый титан
Коммерчески чистый титан имеет высокое отношение прочности к весу и является отличным выбором для использования в компонентах, работающих при высоких температурах, поскольку имеет температуру плавления около 3034°F и плотность приблизительно 4,5 г/см3. Однако его применение иногда может быть ограничено, так как титан может загореться и нанести серьезный ущерб, если он подвергается воздействию ситуаций, когда он трется о другие металлы при повышенных температурах.
Технически чистый титан устойчив к коррозии, образуя защитное оксидное покрытие при воздействии высоких температур. Это может быть положительным моментом, когда он вступает в реакцию с водой или при температуре окружающей среды в любой точке Земли. Однако титан также реагирует с кислородом и углеродом при высоких температурах, что создает проблемы при получении металлического титана, кристаллов или порошка. Если титановый порошок нагревается в присутствии кислорода, он может стать взрывоопасным в таких процессах, как 3D-печать и металлургия порошкового спекания. Эти свойства превосходны для труб, но непригодны для реактивных двигателей и ракетных двигателей.
Если титановый порошок нагревается в присутствии кислорода, он может стать взрывоопасным в таких процессах, как 3D-печать и металлургия порошкового спекания. Эти свойства превосходны для труб, но непригодны для реактивных двигателей и ракетных двигателей.
Благодаря своей высокой прочности и сопротивлению ползучести технически чистый титан может оставаться стабильным при температуре приблизительно до 572°F. По сравнению с другими металлами, такими как алюминий, титан имеет низкую тепло- и электропроводность, что может привести к чрезмерному накоплению тепла.
Титан не растворяется в воде, а его растворимость в водороде еще больше снижается при повышенных температурах, что делает его хорошим кандидатом для магнитных термоядерных реакторов. Титан также часто используется в ортопедических и зубных имплантатах, однако в большинстве случаев к титану часто добавляют другие металлы для создания более прочных и жестких сплавов.
Титановые сплавы
Чистый титан часто смешивают с другими металлами для создания сплавов, обеспечивающих повышенную прочность на растяжение и ударную вязкость даже при высоких температурах. Эти сплавы делятся на три категории: альфа, бета и альфа+бета. Краткое описание каждой категории титановых сплавов приведено ниже.
Эти сплавы делятся на три категории: альфа, бета и альфа+бета. Краткое описание каждой категории титановых сплавов приведено ниже.
- Альфа-сплавы содержат такие металлы, как алюминий и олово, и обладают исключительным сопротивлением ползучести при температурах до 1100°F. Из-за этого альфа-сплавы часто предпочтительны для высокотемпературных применений. Однако они имеют прочность от низкой до средней, которую нельзя повысить термической обработкой.
- Бета-сплавы , которые содержат такие элементы, как молибден, ванадий и ниобий, обладают отличной прокаливаемостью и могут легко подвергаться термообработке для повышения прочности. Эти сплавы имеют высокую вязкость разрушения и хорошо поддаются ковке. Однако бета-сплавы не могут выдерживать такие высокие температуры, как альфа-сплавы.
- Сплавы Alpha+beta также поддаются термообработке и обладают прочностью от средней до высокой. Эти сплавы также могут работать при более высоких температурах, чем марки технически чистого титана, и имеют сопротивление ползучести до 500-800°F.

Некоторые титановые сплавы более высокой сложности демонстрируют высокую прочность при температурах до 932°F. Титановые сплавы также обычно имеют более низкую теплопроводность, чем технически чистый титан.
Термические свойства титана при криогенных температурах
Титан и его сплавы также отличаются от других металлов тем, что некоторые из них могут невероятно хорошо сохранять свою прочность и пластичность при криогенных температурах. В частности, альфа-сплавы подходят для криогенных применений из-за отсутствия перехода от пластичности к хрупкости, характерного для бета-сплавов. Бета-сплавы обычно не рассматриваются для использования в средах с криогенными температурами из-за этого перехода от пластичности к хрупкости. Однако альфа-бета-сплавы, которые содержат кристаллические структуры как альфа-, так и бета-фазы, также обладают высокими прочностными характеристиками в криогенных средах. В частности, сплав Ti-6Al-4V альфа+бета может использоваться при криогенных температурах примерно до 800°F и используется для изготовления многих деталей планера и двигателя.
Ваш местный поставщик титана
Industrial Metal Service уже более двух десятилетий поставляет специальные металлы производителям, машинистам и производителям в районе залива Сан-Франциско и по всей стране, и мы заработали репутацию благодаря профессионализму, надежности и клиентоориентированный сервис. Мы предлагаем как новые, так и переработанные остатки металлов, таких как титан, алюминий, сталь и медь, проверенные с помощью рентгенофлуоресцентных анализаторов, чтобы гарантировать качество приобретаемых вами металлов.
Нужен ли вам разовый специальный заказ или постоянный поставщик металла, мы упростим вам работу с нами. У нас нет требований к минимальному заказу и мы можем отправить по всей стране. Свяжитесь с нами сегодня, чтобы обсудить ваши требования к металлу.
Свяжитесь с нами
Титан или сталь: что лучше для вашего проекта
Подумайте о самых прочных и универсальных металлах, используемых сегодня в промышленности. Конечно, ваш выбор включает титан и сталь. Оба эти металла являются отличным выбором для различных применений из-за их превосходных химических и физических свойств.
Оба эти металла являются отличным выбором для различных применений из-за их превосходных химических и физических свойств.
Титан против стали, безусловно, важный спор. Хотя оба металла предлагают широкий спектр сплавов и областей применения, они различаются многими ключевыми характеристиками, а также ценой, ударной вязкостью и прочностью.
Иногда даже самые опытные профессионалы не могут сделать правильный выбор. Для достижения наилучших результатов важно понимать основные различия между двумя металлами.
Титан и сталь: обзор
И титан, и сталь обладают различными преимуществами. Прежде чем углубляться в технические детали, давайте взглянем на краткий обзор обоих металлов, обсудив их основные свойства, доступность, цены и общие области применения.
Титан
Титан — это элемент земли. В основном вы найдете его в высокопроизводительных отраслях из-за его высокой стоимости. Из-за ценника многие люди считают титан редким металлом. На самом деле, его высокая цена на самом деле связана со сложными требованиями к обработке.
Естественно, титан имеет очень высокую температуру плавления. Это делает его очень трудным для механической обработки или обработки титана по сравнению со сталью. Этот металл имеет несколько сплавов с железом, алюминием и другими металлами.
Сегодня титан является важным выбором для ряда высокопроизводительных приложений, таких как аэрокосмическая промышленность, автомобильные двигатели, морское оборудование премиум-класса и промышленные машины. Кроме того, вы даже найдете титан в некоторых потребительских товарах. Однако такое использование встречается довольно редко и предназначено только для продуктов премиум-класса.
Превосходная коррозионная стойкость титана, способность поглощать удары, отношение прочности к весу и многие другие свойства делают его лучшим выбором, обеспечивающим превосходные характеристики практически в любых условиях.
Сталь
В отличие от титана, сталь не встречается в природе и требует определенных процессов, прежде чем она будет готова. Сталь – это прежде всего сплав железа и углерода. Он доступен в различных комбинациях с различными количествами других металлов, таких как титан, хром, цинк или другие металлы, для улучшения какого-либо конкретного свойства.
Сталь – это прежде всего сплав железа и углерода. Он доступен в различных комбинациях с различными количествами других металлов, таких как титан, хром, цинк или другие металлы, для улучшения какого-либо конкретного свойства.
Как правило, сталь известна своей прочностью, термостойкостью, пределом прочности при растяжении, высокой обрабатываемостью и другими превосходными физическими свойствами. Более низкая стоимость и рабочие характеристики делают сталь популярным выбором во многих отраслях промышленности, включая строительство, автомобилестроение, инфраструктуру, промышленное оборудование и многое другое.
Сталь против титана: 8 основных различий между двумя популярными металлами
И сталь, и титан — прочные материалы, широко используемые в различных областях. Вопрос в том, что в матче между сталью и титаном что окажется лучше, сталь или титан?
Правильный ответ зависит от области применения и ограничений вашего проекта. Иногда сталь была бы лучшим выбором из-за функциональных требований или доступного бюджета. Тем не менее, превосходные физические свойства титана также могут быть тем, что вам нужно в различных приложениях.
Тем не менее, превосходные физические свойства титана также могут быть тем, что вам нужно в различных приложениях.
Вот 8 наиболее важных различий, которые вы можете учитывать при сравнении титана и стали для вашего применения.
1 – Элементный состав
Элементный состав является первым важным отличием в сопоставлении титана со сталью. Как указывалось ранее, титан является природным элементом и доступен как в чистом виде, так и в виде сплава. В большинстве случаев Ti 6-4 — сплав, содержащий алюминий и ванадий — является наиболее распространенным титановым сплавом, который вы найдете.
Сталь, с другой стороны, не встречается в природе. В первую очередь это комбинация железа и углерода с различными количествами других элементов, добавленных для настройки свойств в зависимости от применения. Вот почему вы нигде не найдете технических свойств стали. Для получения подробной информации вам нужно будет указать сплав, такой как нержавеющая сталь (даже у которой есть много типов), высокоуглеродистая сталь или определенные сплавы, такие как 4130, 4140 или A36.
2 – Вес
Определяющими характеристиками титана являются его низкая плотность и высокое отношение прочности к весу. Вот почему этот металл является предпочтительным материалом для станков с ЧПУ в аэрокосмической промышленности и других подобных областях, где вам необходимо уменьшить вес без ущерба для прочности.
Напротив, стальные сплавы, как правило, долговечны и обладают большой прочностью, но проигрывают в весе. Они являются идеальным выбором для приложений, где вес не является одним из основных конструктивных ограничений.
3 – Твердость
Твердость входит в число областей, в которых сталь превосходит титан. Низкое число Бринелля — одна из причин, почему титан так трудно поддается механической обработке. Титановые сплавы часто используются в промышленности, поскольку следовые количества других металлов компенсируют низкую твердость титана.
4 – Эластичность
Это еще одна область, в которой сталь превосходит титан, поскольку большинство его сплавов более эластичны. Опять же, большая эластичность облегчает обработку стали и создание нестандартных деталей, что является чрезвычайно важной характеристикой, поскольку напрямую влияет на стоимость обработки.
Опять же, большая эластичность облегчает обработку стали и создание нестандартных деталей, что является чрезвычайно важной характеристикой, поскольку напрямую влияет на стоимость обработки.
Споры о стали и титане никогда не дадут однозначного ответа. Во всех случаях ваш проект, условия и доступный бюджет определят, какой из них является лучшим выбором.
5 – Долговечность
Долговечность – это многогранный параметр с несколькими аспектами, зависящими от области применения. С точки зрения прочности и долговечности многие стальные сплавы имеют такие же (иногда даже лучшие) характеристики, как и титан. Однако титан выделяется своей предельной коррозионной стойкостью и способностью выдерживать экстремальные температуры.
Несмотря на то, что стальные сплавы, как правило, хорошо работают во многих условиях, присутствие железа означает, что они со временем подвергаются коррозии. Титан, с другой стороны, работает значительно лучше и, следовательно, используется во многих суровых условиях, где ожидается постоянное воздействие влаги, химикатов и других элементов.
6 – Предел текучести при растяжении
При любом сравнении титана со сталью вы увидите, что титан обладает большей прочностью на единицу массы. Тем не менее, сталь по-прежнему является лучшим выбором, когда речь идет об общей прочности, и этот факт становится очевидным, когда вы сравниваете их предел текучести при растяжении.
Если прочность выбранного вами металла является единственной задачей, тогда сталь является естественным выбором. Титан идеально подходит для ситуаций, когда вас беспокоит прочность наряду с весом. Вот почему строительство и промышленность полагаются на сталь, а в автомобильной и аэрокосмической промышленности — на титан.
7 – Общие области применения
Титан обычно используется для высокопроизводительных применений, где необходимы отличные тепловые свойства, коррозионная стойкость и высокое отношение прочности к весу. Некоторые из наиболее распространенных применений титана:
- Хирургические инструменты и приложения
- Протезы
- Аэрокосмическая промышленность
- Теннисные ракетки
- Автоспорт .
 От производства металлических деталей до простого строительства и разработки машин. Вы найдете его повсюду. Вот некоторые из его наиболее распространенных применений:
От производства металлических деталей до простого строительства и разработки машин. Вы найдете его повсюду. Вот некоторые из его наиболее распространенных применений:- Строительство
- Электроприборы
- Производство труб
- Поезда и автомобили
- Различные типы обычных инструментов
отделение. Как указывалось ранее, титан довольно распространен, но его высокая температура плавления и требования к обработке делают его очистку и обработку значительно дороже. Во многих случаях использование чего-то столь дорогого, как титан, просто не имеет смысла для бизнеса.
В отличие от титана, сталь является чрезвычайно экономичным вариантом. Его легче производить, так как в мире нет недостатка в железе и углероде. Кроме того, сталь не имеет каких-либо сложных требований к обработке. Однако цены на сталь сильно различаются из-за огромного количества ее вариантов. Сплав, содержащий только углерод и железо, будет самым дешевым, в то время как сплав, обогащенный хромом, цинком или даже титаном, потребует больше капитала.

Теперь вы можете лучше понять разницу между титаном и сталью, чтобы знать, как выбрать лучший материал для вашего проекта. Если вы проектируете металлическую деталь и ищете услуги по быстрому прототипированию, RapidDirect — ваш выбор. RapidDirect славится производством деталей и прототипов по конкурентоспособным ценам и в кратчайшие сроки. Начать сейчас!
Хотите получить быстрый ответ? Вот краткая таблица, чтобы дать вам краткий обзор сравнения стали и титана.Characteristic Titanium Steel Elemental composition It’s a naturally occurring element that you can find in its pure form and as an alloy as well. Сталь в основном представляет собой сплав железа и углерода и должна подвергаться многочисленным процессам. Его свойства можно настроить с помощью других элементов, в зависимости от ваших требований. 
Вес Титан намного легче по сравнению с некоторыми его альтернативами и предлагает лучшее соотношение веса и прочности. Это потери в отделе веса. Сталь идеально подходит для приложений, где вес не имеет значения. Твердость Титан плохо поддается механической обработке, так как имеет низкую твердость Сталь намного лучше титана в этом отношении и обычно имеет высокое число Бринелля. Эластичность Эластичность титана низкая, что затрудняет его обработку, так как он легко деформируется. Имея гораздо более высокую эластичность, сталь легче поддается обработке. Долговечность Как правило, титан обладает лучшей устойчивостью к коррозии и температуре. Сталь в идеальных условиях может работать лучше, чем титан, но она подвержена коррозии. Предел текучести при растяжении Несмотря на более высокую прочность на единицу прочности, титан имеет более низкий предел текучести при растяжении по сравнению со сталью. 
Сталь обладает высоким пределом текучести, что делает ее предпочтительным выбором для проектировщиков, которые уделяют основное внимание только прочности. Применение Высокопроизводительные изделия, такие как аэрокосмическая промышленность, автоспорт, судовые двигатели и т. д. Цена Как правило, дороже из-за высоких требований к экстракции и обработке. Более экономичный выбор из-за простых требований к производству и обработке. Титан по сравнению со сталью – плюсы и минусы каждого металла
Оба эти материала обладают уникальным набором свойств, которые делают тот или иной материал более подходящим для ваших конкретных требований. Итак, титан для вас лучше нержавеющей стали? Следующий углубленный анализ их преимуществ и недостатков может помочь прояснить часть этой путаницы.
Преимущества титана
Коррозионная стойкостьСамое лучшее в использовании титана — его невероятная коррозионная стойкость.
Необычно высокая температура плавления Титан образует тонкий непроницаемый слой оксида на своей поверхности при контакте с воздухом. Кроме того, оксидный слой обладает естественной прочностью и устойчив почти ко всем распространенным источникам коррозии, что делает титан идеальным выбором для любого наружного применения.
Титан образует тонкий непроницаемый слой оксида на своей поверхности при контакте с воздухом. Кроме того, оксидный слой обладает естественной прочностью и устойчив почти ко всем распространенным источникам коррозии, что делает титан идеальным выбором для любого наружного применения.Титан также демонстрирует высокую температуру плавления. Благодаря температуре плавления около 1668 °C титан идеально подходит для высокотемпературных применений, таких как газотурбинные реактивные двигатели и т. д.
Нетоксичный элементВ отличие от большинства материалов титан не токсичен для людей и животных. Вот почему вы увидите широкое использование титана в медицинской промышленности. От укрепления костей до зубных брекетов титан является основным выбором для медицинских работников.
Способность выдерживать экстремальные температурыМногие свойства титана позволяют ему демонстрировать высокую устойчивость к экстремальным температурам.
Высокая прочность Титан не сжимается и не расширяется, что делает его важным компонентом для поддержания структурной целостности.
Титан не сжимается и не расширяется, что делает его важным компонентом для поддержания структурной целостности.Наконец, титан — один из самых прочных материалов, которые только можно найти. Несмотря на легкий вес, титан предлагает отличное соотношение прочности и веса.
Преимущества стали
Низкая стоимостьСталь является одним из наиболее часто используемых и широко доступных материалов в мире. Это также относительно недорого и дешево приобрести.
Высокая прочностьНикогда еще сталь не славилась своей прочностью и долговечностью. Сталь также может выжить и сохранить структурную целостность в суровых условиях, таких как торнадо, ураганы и т. д.
ЭкологичностьСамое лучшее в стали то, что ее всегда можно использовать повторно с минимальной обработкой, не теряя своей первоначальной прочности или универсальности.
Поддающийся модификации
Сталь как компонент обеспечивает разработчикам большую гибкость и возможности настройки по сравнению с другими альтернативами. Используя различные другие элементы, свойства стали можно изменить в соответствии с вашими потребностями.
Предсказуемые реакцииВы никогда не узнаете, как тот или иной материал поведет себя в неконтролируемых условиях, но обычно это не относится к стали, поскольку ее реакцию легко предсказать.
Недостатки титана
Высокая стоимостьМногие преимущества титана могут быть компенсированы его высокой стоимостью. Без надлежащего рассмотрения вы можете легко исчерпать свой бюджет.
ДеформацияТитан имеет низкий модуль упругости и легко деформируется. Низкое отношение напряжения к деформации титана затрудняет его обработку.
Проблемы с литьемЕсли вы планируете использовать титан для литья, вам следует остановиться и поискать другие альтернативы.
Сложная обработка Неотъемлемые свойства титана, такие как его высокая температура плавления и прочность, усложняют процесс литья.
Неотъемлемые свойства титана, такие как его высокая температура плавления и прочность, усложняют процесс литья.Говоря простым языком, это свойство титана должно управляться по-разному на всех этапах производства, что делает его дорогим и сложным в обработке.
Трудно извлечьИзвлечь титан также сложно. Компоненты, необходимые для экстракции, не только дороги, но и опасны в обращении. Кроме того, процесс добычи также приводит к эрозии почвы и другим экологическим проблемам.
Недостатки стали
Высокий уровень обслуживанияЕсли за сталью не ухаживать должным образом, она может ежегодно терять до 1,5 мм своей толщины и, следовательно, своей прочности.
Низкая прочность при высоких температурахСталь также требует надежной защиты от высоких температур. Хотя вам никогда не будет угрожать возгорание, сталь может деформироваться при высоких температурах и даже привести к обрушению всей конструкции.
Изгиб
Обычно стальные профили изготавливаются из тонких стальных листов. Если на эти пластины оказывается дополнительная нагрузка, это может привести к деформации стали.
ЭстетикаДля большинства предметов сталь не считается приятной на вид. Вот почему стальные изделия обычно нуждаются в отделке поверхности или облицовке, чтобы сделать их более привлекательными с эстетической точки зрения.
КоррозияСталь очень восприимчива к коррозии и требует регулярного обслуживания и защиты от коррозии. Одним из наиболее распространенных способов защиты стальных конструкций является их покрытие краской и ограничение их контакта с воздухом.
Выберите лучшего партнера
Все еще не знаете, что использовать: титан или сталь? Или вам нужен партнер, который поможет вам извлечь максимальную пользу из обоих этих материалов и поставлять продукцию высочайшего качества по самой низкой цене? Если это так, RapidDirect — это именно то, что вам нужно.

Компания RapidDirect имеет опыт работы с титаном и сталью и может предоставить услуги по изготовлению и изготовлению на заказ. Мы также обеспечиваем конкурентоспособное прототипирование и производство для мелкосерийного производства. Вы можете связаться с нами как для руководства, так и для профессионального совета относительно изготовления вашего дизайна и использования материалов. Просто загрузите файл САПР и получите мгновенное предложение.
Не стесняйтесь загружать файл дизайна здесь
Титан против стали: Заключение
Есть причина, по которой выбор между использованием стали и титана не так прост, как кажется. В зависимости от уникальных требований вашего дизайна вы предпочтете тот или иной вариант. Прежде чем сделать окончательный выбор, лучше всего понять основные свойства обоих материалов.
Титан: полное руководство
Титан — химический элемент 4-й группы периодической таблицы с символом «Ti». Серебристо-серый металл с атомным номером 22 и атомным весом 47,867.
 Титан легкий, прочный и устойчивый к коррозии.
Титан легкий, прочный и устойчивый к коррозии.Титан имеет прочность, аналогичную стали, но менее плотную, и часто используется в качестве сплава в авиационной и аэрокосмической промышленности для самолетов и ракет, поскольку он может выдерживать экстремальные температуры.
Обычно титан используется в форме диоксида титана (TiO2), который используется в качестве ярко-белого пигмента в красках, эмалях, бумаге и художественных материалах. Диоксид титана увеличивает белизну, отражательную способность и непрозрачность красок и эмалей.
Производители сочетают определенное соотношение титана, смешанного с другими металлами, такими как алюминий, железо и молибден, для получения титановых сплавов с улучшенными свойствами. Международная классификация ASTM для титановых сплавов варьируется от класса 1, самого мягкого и наиболее пластичного, до класса 38, являющегося чрезвычайно твердым с очень высокой прочностью на растяжение.
Титан является 9-м наиболее распространенным элементом в земной коре, составляя 0,44% от общей массы земной коры.
 Двумя распространенными минералами, из которых извлекается титан, являются ильменит и рутил.
Двумя распространенными минералами, из которых извлекается титан, являются ильменит и рутил.Наряду с прочностью и высокой коррозионной стойкостью титан обладает рядом других качеств.
• Титан имеет температуру плавления 1668°C.
• По шкале твердости Мооса это 6,5.
• Температура кипения 3287°C.
• Титан имеет плотность 4,54 г/см³.
• Температура фазового превращения составляет 882°C.
• Атомный вес титана 47,88.
• Процентное содержание металлического титана в земной коре составляет 0,44%.
• Прочность титана в два раза выше, чем у стали, и в три раза выше, чем у алюминия.
• Существует 26 признанных изотопов титана. Ti-48 встречается чаще всего.
• Легкий титан
• Титан обладает выдающейся устойчивостью к коррозии, особенно к морской и соленой воде.
• Он имеет низкое тепловое расширение и лишь незначительное изменение размеров при воздействии тепла.
• По своей природе он гибкий, а его модуль упругости составляет 116 ГПа.
• Его предел прочности при растяжении составляет 220 МПа.
• Значение модуля сдвига составляет 43,0 ГПа.
• Уровень твердости титана по шкале Виккерса равен 60.
• Коэффициент Пуассона равен 0,34 • Значение теплопроводности титана составляет 17 Вт/мК.Титан используется в различных областях, где требуется высокая прочность на растяжение, долговечность, топливная экономичность и коррозионная стойкость. Некоторые свойства аналогичны стали и алюминию. Он легкий по сравнению со сталью, но имеет такую же прочность. По сравнению с алюминием титан тяжелее и прочнее.
Титановые сплавы широко используются в аэрокосмической промышленности в роторах , компрессионных лопастях, деталях гидравлических систем, шасси, ракетах, выхлопных отверстиях самолетов и военно-морских кораблях.
Платиновый сплав марки 5 (Ti-6Al-4V) составляет 50% титана, используемого в самолетах, от двигателей до оконных рам.
 Он состоит из 6% алюминия и 4% ванадия.
Он состоит из 6% алюминия и 4% ванадия.Основные характеристики: коррозионная стойкость, теплостойкость, легкость и прочность. Его называют «рабочим домом» титановых сплавов. Его основные приложения:
• Вращающиеся детали реактивного двигателя. Лопасти вентилятора из титана повышают эффективность и снижают уровень шума.
• Производство планера для снижения веса и повышения производительности.Титановый сплав Grade 23 (Ti-6Al-4V ELI) также называют хирургическим титаном из-за его биосовместимости. Он широко используется в медицинских науках в качестве имплантатов тела, потому что он не вреден для человеческого организма и обладает большой инертностью. Из-за своей гибкости из него можно формовать катушки, проволоку, пряди и трубы. Его основными свойствами являются высокая коррозионная стойкость, высокая прочность, низкий модуль упругости, гибкость, легкость и отличная прочность.
Некоторые из применений титановых сплавов в биомедицинской промышленности:
- Хирурги-ортопеды используют титановые сплавы для искусственных тазобедренных и коленных суставов, костных пластин, винтов для фиксации переломов, сердечных протезов и кардиостимуляторов.

- В стоматологии марки чистого титана и сплава титана (марка 5) используются для изготовления зубных имплантатов, коронок, мостовидных протезов, зубных протезов и винтов для имплантации протезов.
- Титановые покрытия используются для повышения эффективности медицинских устройств, снижения износа и повреждений.
- Медицинские компоненты, такие как хирургические пинцеты, щипцы, ножницы, иглы, штифты, стержни и имплантационные пластины, в настоящее время изготавливаются из титана.
Благодаря своему легкому весу и меньшей плотности титан считается удобным металлом с точки зрения износостойкости.
Титан гипоаллергенен и устойчив к коррозии, поэтому кольца из титана могут носить люди с аллергией на другие металлы, отсюда его популярность для пирсинга и украшений для тела.
Титан стал очень модным для изготовления мужских обручальных колец, в частности обручальных колец из черного титана.
Титановые наручные часы таких брендов, как Seiko, Farer, Tissot, Breitling, Longines и Titanium Apple Watch 6, пользуются большим спросом благодаря полезным свойствам металла.

Черный титан создается с использованием особого сорта титана, который при нагревании образует черное покрытие. Однако со временем это черное покрытие сотрется.
Вопреки распространенному мнению, титановые кольца можно легко отрезать с помощью канцелярского ножа в больнице.
Какой титан используется в ювелирных изделиях?
Сплавы, используемые в ювелирных изделиях из титана, наряду с титаном состоят из 6% алюминия, 4% ванадия, 0,25% железа и 0,2% кислорода. Эти сплавы прочнее чистого титана.
Преимущества украшений из титана
- Дешевле, чем золото и платина, так как оба являются редкими элементами, тогда как титан встречается в изобилии.
- Не тускнеет
- Очень легкий
- Может окрашиваться электролитическим способом. Этот процесс известен как анодирование. Это часто можно увидеть с украшениями для пирсинга.
Недостатки украшений из титана
- Кольца настолько прочные, что их размер или регулировку трудно изменить.

- Из-за этого ювелиры считают, что с этим металлом трудно работать, и поэтому стоимость рабочей силы может быть высокой.
- Со временем может потускнеть или оставить атласную патину.
- Черные кольца из титана не останутся черными навсегда, покрытие сотрется.
Работа с титаном для изготовления ювелирных изделий
Работа с титаном для изготовления ювелирных изделий является трудоемкой и довольно сложной задачей, поэтому большинство ювелиров будут работать с листами, стержнями или трубками в их исходном состоянии, поскольку их нельзя отлить или припаять.
- Титан можно резать пильными дисками, но всегда используйте пчелиный воск или какую-либо смазку.
- Титан можно подпиливать обычными стальными напильниками Vallorbe, но регулярно чистите их, чтобы избежать засорения зубцов.
- Титан можно просверливать с помощью сверл из карбида вольфрама на высоких скоростях.
- Титан можно вырезать с помощью борфрез из карбида вольфрама.
 Это популярный выбор для оставления радужных следов после анодирования.
Это популярный выбор для оставления радужных следов после анодирования.
Полировка украшений из титана
По шкале твердости Мооса это 6,5, поэтому украшения из титана будут царапаться и в конечном итоге оставят атласную поверхность, но их очень легко полировать.
Полиры, используемые для аналогичных твердых белых металлов, таких как платина, также используются для полировки титана. Они часто пропитаны алмазным абразивом или керамической связкой.
- Алмазные полиры Diapol: алмазная пропитка. В разобранном виде различных форм и размеров
- Diatwist Single: круги для радиальной полировки с алмазным зерном
- Алмазная полировальная паста: паста в готовых к использованию шприцах с различными микронными размерами
- Резиновые силиконовые полиры: абразивы на керамической связке, различных форм и размеров
- Полировальные пасты Dialux: блоки Green/Vert и Grey/Gris
- Алмазные абразивные полировальные салфетки: можно резать и склеивать или использовать как есть.

- Airflex Ненагревающиеся полировальные круги: охлаждающие абразивы с открытыми порами
- EVE Chrom Plus: абразивы на основе карбида кремния.
- Зеленые мягкие колеса: используйте зеленые мягкие колеса в качестве окончательной полировки после EVE Chrom plus.
- Гибридные печатные платы из титана более эффективны, чем традиционные печатные платы.
- Титановые контуры используются в различных приложениях для измерения расхода, давления жидкости и измерения температуры.
- Широко используется в жестких дисках.
Раньше в электронике использовался алюминий, но теперь его заменил титан из-за его огромных преимуществ. Он сводит к минимуму помехи при обработке данных, обладает способностью выдерживать нагрев в процессе нанесения покрытия, а чистота титана увеличивает емкость диска.
Использование титана в автомобильной промышленности с момента обилия рынков гоночных автомобилей и франшиз. Благодаря своим свойствам, таким как коррозионная стойкость, долговечность, прочность, гибкость и термостойкость, титан стал идеальным материалом, главным образом, для использования в деталях двигателей транспортных средств.

• Подключаемые стержни
• Клапаны и фиксаторы клапана
• Планисты на запястье
• Рокер Руки
• Спрингс
• Распределительные валы
• Турбокомпрессоры
• Выхлопные системы
• Рамы кузоваДругие применения титана
• Титановые тонкостенные трубы На электростанциях
• В химической промышленности титан используется для увеличения срока службы оборудования.
• Титановые трубы используются в нефтяной промышленности.
• Из-за своей прочности и высокого баллистического коэффициента титан используется для изготовления брони.
• Оправы для очков
• Рыболовные удочки
• Спортивный инвентарь: клюшки для гольфа, теннисные ракетки, лыжи, кии для снукера и бильярда, бейсбольные биты.
• Снаряжение для активного отдыха: палки для ходьбы и ледорубы
• Автоспорт и велосипеды.
• Часы
• Диоксид титана содержит ярко-белый пигмент и обладает отражающими свойствами – часто используется в красках, бумаге, пластике, резине, текстильной промышленности и керамике.
Как и все другие металлы и химические элементы, титан имеет некоторые преимущества и недостатки.
Преимущества
- Наиболее распространенным преимуществом титана является его прочность. Это один из самых прочных и долговечных металлов на Земле. Он имеет самое высокое отношение прочности к плотности в периодической таблице.
- Титан обладает естественной устойчивостью к коррозии и ржавчине даже в жесткой воде и суровых погодных условиях. В отличие от других металлов, титан не окисляется и сохраняет свои позиции годами.
Недостатки
- Металлический титан очень трудно отливать из-за его ударной вязкости и прочности.
- Титан обычно дороже по сравнению с другими типами металлов, такими как сталь, алюминий и железо, так как титан встречается реже, чем эти металлы.
- Для обработки требуется дорогостоящее оборудование.
Добыча титана
Титан получают из нескольких руд, находящихся в земной коре, таких как рутил, ильменит и лейкоксен, открытым способом.

Рабочие месторождения титана разбросаны по всему миру, в основном в Австралии, США, Канаде, Южной Африке, Сьерра-Леоне, Украине, Малайзии, России, Норвегии и многих других регионах земного шара.Обыкновенный минерал рутил содержит 95 % диоксида титана, ильменит содержит от 50 до 60 % TiO2, а лейкоксен содержит некоторые залежи железа.
Минералы титана образуются в аллювиальных и вулканических образованиях. Месторождения рутиловых минералов истощаются и их трудно найти, поэтому часто добываются месторождения ильменита.
Металлический титан из необработанных минералов производится с помощью процесса Кролла. Эта технология используется во всем мире для извлечения титана из руд. Этот процесс включает в себя множество этапов, таких как экстракция, очистка, производство губки, формирование сплава и придание формы.
Добыча
На производственной площадке обрабатываются минеральные руды, такие как рутил и ильменит. Рутил можно использовать естественным образом, тогда как ильменит перерабатывается для удаления железа и получения 85% диоксида титана.
 В результате химической реакции получают нечистый тетрахлорид титана (TiCl4) и монооксид углерода (СО).
В результате химической реакции получают нечистый тетрахлорид титана (TiCl4) и монооксид углерода (СО).Очистка
Полученный металл помещают в перегонные чаны и нагревают от примесей, применяя фракционную перегонку и осаждение. Из концентрата выделяют хлориды металлов железа, кремния, ванадия и магния.
Производство губки
Очищенный тетрахлорид титана перемещают в реактор из нержавеющей стали. После добавления магния сосуд нагревают примерно до 1100°С. Для удаления воздуха и предотвращения загрязнения кислородом и хлором внутрь закачивается аргон. В результате получают жидкий хлорид магния и чистый твердый титан.
Через отверстие твердый титан вынимают из реактора, а затем подвергают реакции с водой и соляной кислотой для удаления остатков избыточного хлорида магния. Оставшийся элемент имеет форму пористого металла, называемого губкой.
Производство сплавов
Для изготовления сплава чистый металлический титан смешивают с различными элементами и металлическим ломом.
 Используемое соотношение губки и сплавов определяется в лаборатории до проведения процедуры. После смешивания все спрессовывается в дискообразную форму и сваривается вместе для создания титанового электрода.
Используемое соотношение губки и сплавов определяется в лаборатории до проведения процедуры. После смешивания все спрессовывается в дискообразную форму и сваривается вместе для создания титанового электрода.Затем электрод помещают в вакуумную дуговую печь, где он плавится. В этом медном контейнере дуга используется для плавления губки и превращения ее в слиток. Весь лишний воздух удаляется из контейнера с помощью аргона. Затем слиток повторно нагревают и плавят пару раз, чтобы получить коммерчески приемлемый слиток, который отправляется производителям товаров, где он измельчается и формуется.
Переработка побочных продуктов
При производстве чистого титана получается хлорид магния, который перерабатывается в ячейке переработки сразу после его производства. В этой ячейке сначала отделяют металлический магний, а затем производят газообразный хлор. Оба они повторно используются в производстве титана.
Глобальные запасы титанаИльменит и рутил являются двумя наиболее важными источниками титана.
 По данным Геологической службы США (USGS), ильменит составляет 92% мирового титана. Общие запасы титана во всем мире составляют 750 миллионов тонн.
По данным Геологической службы США (USGS), ильменит составляет 92% мирового титана. Общие запасы титана во всем мире составляют 750 миллионов тонн.Китай обладает 20 млн т запасов, что составляет почти 29% мировых, является ведущей страной по добыче ильменита. На Австралию приходится 24 млн тонн запасов рутила, что составляет 50% от общемировых запасов. Это ведущая страна, имеющая в изобилии рутиловый минерал.
Ведущими странами по добыче титановых полезных ископаемых были Южная Африка, Австралия, США, Китай, Канада и Индия.
В 1791 году геолог по имени Уильям Грегор обнаружил неизвестный минерал, изучая черный песок в Корнуолле, затем в 1795 году химик по имени Мартин Генрих Клапрот из Германии заново открыл его в составе элемента рутила в Венгрии. Он понял, что минерал содержит оксид ранее открытого минерала в 1791 году и назвал его «Титан» в честь «Титанов» из греческой мифологии.
Чистый металлический титан был впервые изобретен Мэтью А. Хантером в 1910 году путем нагревания тетрахлорида титана (TiCl4) с натрием при высокой температуре.
 Тогда это было известно как процесс Хантера.
Тогда это было известно как процесс Хантера.В 1932 году Уильям Джастин Кролл восстановил тетрахлорид титана кальцием, магнием и натрием и назвал этот метод процессом Кролла.
Затем, в 1960 году, металлический титан использовался Советским Союзом во время холодной войны для изготовления компонентов военного назначения и подводных лодок. После этого титан и титановые сплавы стали широко использоваться для многих целей во всем мире.
Типы титановых сплавов
Титан присутствует в двух типах кристаллографических форм. Чистый титан или нелегированный титан при комнатной температуре имеет гексагональную кристаллическую форму с закрытой упаковкой, известную как альфа (α) фаза. Когда тот же кристалл нагревается до 883°C, он превращается в объемно-центрированную кубическую структуру, называемую бета-(β)-фазой. Эксперименты с этими кристаллографическими структурами путем добавления различных сплавов в термохимический процесс привели к получению различных сплавов с разными свойствами.
 Основная классификация титановых сплавов на основе их фаз: α-сплавы, β-сплавы и α + β-сплавы.
Основная классификация титановых сплавов на основе их фаз: α-сплавы, β-сплавы и α + β-сплавы.Альфа-сплавы
Альфа-сплавы содержат такие металлы, как алюминий и олово. Эти металлы имеют α-стабилизаторы, которые выполняют свою функцию, ингибируя изменения при температуре фазового перехода. Альфа-сплавы
обладают более высоким сопротивлением ползучести, чем бета-сплавы, и поэтому их предпочтительно использовать в высокотемпературных приборах и машинах. В отличие от бета-сплавов, в альфа-сплавах отсутствует пластично-хрупкая фаза, что делает их идеальными для криогенных применений.
Свойства альфа-сплавов включают промежуточную прочность, ударную вязкость и свариваемость. Альфа-сплавы нельзя упрочнить нагревом.Альфа-бета-сплавы
Альфа- и бета-сплавы состоят из смеси альфа- и бета-фаз, имеющих 10-50% бета-фазы, достигаемой при комнатной температуре. Наиболее распространенным альфа-бета-сплавом является Ti-6Al-4V, который трудно формовать даже в кованом состоянии.
 Другие альфа-бета-сплавы обычно обладают хорошей формуемостью. Общие характеристики этих сплавов можно контролировать с помощью термической обработки, которая используется для определения и регулирования количества присутствующей в них бета-фазы. Процесс включает в себя использование обработки раствора и нагревание его до 480-650°C, закаливание таким образом альфа-кристалла, альфа- и бета-соединений должным образом смешиваются друг с другом.
Другие альфа-бета-сплавы обычно обладают хорошей формуемостью. Общие характеристики этих сплавов можно контролировать с помощью термической обработки, которая используется для определения и регулирования количества присутствующей в них бета-фазы. Процесс включает в себя использование обработки раствора и нагревание его до 480-650°C, закаливание таким образом альфа-кристалла, альфа- и бета-соединений должным образом смешиваются друг с другом.Бета-сплавы
Третий класс — бета-сплавы. Когда к титану добавляются переходные или β-стабилизирующие элементы, можно изготавливать все типы бета-сплавов. Эти элементы содержат ванадий, ниобий и молибден. Эти элементы снижают температуру перехода α-фазы в β-фазу, образуя объемно-центрированную кубическую (ОЦК) β-фазу. Они, как правило, демонстрируют выдающуюся способность к штамповке в более широком диапазоне температур ковки по сравнению с α-сплавами.
Некоторыми полезными свойствами бета-сплавов являются их прокаливаемость и готовность к высоким температурам.
 Бета-сплавы более поддаются холодной обработке, чем альфа-бета-сплавы, и могут быть упрочнены за счет нагревания.
Бета-сплавы более поддаются холодной обработке, чем альфа-бета-сплавы, и могут быть упрочнены за счет нагревания.Некоторые β-сплавы обладают мощной коррозионной стойкостью до технически чистых марок. Обычная термическая обработка включает обработку на твердый раствор вместе с нагревом при температурах от 450°С до 650°С. В результате этой обработки в оставшихся β-частицах получают мелкодисперсные α-частицы.
Эта основная классификация подразделяется на международные классы ASTM. Чистый титан имеет классы 1, 2, 3 и 4. Титановые сплавы имеют классы 5, 7, 11, 12 и 23. Титан класса 5 или Ti-6AL-4V является наиболее часто используемым сплавом во всем мире благодаря своим многочисленным преимуществам. . Он широко используется в аэрокосмической и автомобильной промышленности, медицинских науках и на предприятиях химической промышленности.
ЗаключениеТитан – это металл, обладающий выдающимися свойствами и имеющий множество применений. Использование титана в качестве заменителя алюминия, стали или железа маловероятно из-за высокой стоимости, высокого энергопотребления и дорогостоящего оборудования для его обработки.
 Из-за этих недостатков титан нельзя рассматривать в качестве металла-заменителя в будущем, но там, где требуется высокопрочный, устойчивый к коррозии и гибкий металл, титан будет по-прежнему востребован.
Из-за этих недостатков титан нельзя рассматривать в качестве металла-заменителя в будущем, но там, где требуется высокопрочный, устойчивый к коррозии и гибкий металл, титан будет по-прежнему востребован.Взгляд на точечные дефекты и примеси в титане из первых принципов
Abstract
Титановые сплавы находят широкое применение в аэрокосмической и биомедицинской промышленности благодаря уникальному сочетанию прочности, плотности и коррозионной стойкости. Десятилетия в основном экспериментальных исследований привели к большому объему знаний о связях между обработкой, микроструктурой и свойствами. Но большая часть существующего понимания точечных дефектов, играющих значительную роль в механических свойствах титана, основана на полуэмпирических правилах. В этой работе мы представляем результаты подробного самосогласованного исследования первых принципов, которое было разработано для определения энергий образования собственных точечных дефектов, включая вакансии, собственные междоузлия и внешние точечные дефекты, такие как примеси внедрения и замещения / легирующие примеси.
 . Мы обнаружили, что большинство элементов, независимо от размера, предпочитают замещающие позиции, но сильно электроотрицательные элементы, такие как C, N, O, F, S и Cl, некоторые из которых являются обычными примесями в Ti, занимают междоузельные позиции.
. Мы обнаружили, что большинство элементов, независимо от размера, предпочитают замещающие позиции, но сильно электроотрицательные элементы, такие как C, N, O, F, S и Cl, некоторые из которых являются обычными примесями в Ti, занимают междоузельные позиции.Введение
Точечные дефекты играют ключевую роль в механических свойствах металлических материалов и в диффузионных фазовых превращениях. 1 Точечными дефектами обычно считаются междоузлия, в том числе собственные междоузлия, атомы замещения и вакансии. 2 Наиболее важными примесными элементами для точечных дефектов в титане и его сплавах являются азот, водород, кислород и углерод. Кислород играет особую роль из-за большого химического сродства с титаном и значительной растворимости как в гексагональном плотноупакованном (ГПУ), так и в объемно-центрированном кубическом (ОЦК) титане. На большую растворимость кислорода, азота и водорода в титане указывал Фаст еще в 1938.
 3 Эрлих был первым, кто количественно исследовал растворимость кислорода в титане и определил предел растворимости кислорода в титане на уровне 42 % по массе. Эрлих также наблюдал изменение отношения c / a ГПУ-решетки титана с увеличением содержания кислорода. Для чистого титана соотношение c / a меньше идеального значения 1,633; но оно приближается к 1,633 при более высоком содержании кислорода. Тем временем термодинамическая оценка системы Ti-O подтвердила предел около 33 ат. % в широком диапазоне температур для Ti-O. 4 Элементы внедрения в ГПУ кристаллической структуре создают несимметричные поля деформации и, следовательно, эффективно взаимодействуют с дислокациями. 5 Полученный эффект упрочнения используется в технически чистых титановых сплавах классов 1–4 в качестве основного механизма упрочнения, при этом предел текучести увеличивается с содержанием кислорода, как и усталостная прочность. Например, предел текучести высокочистого титана (99,99 %) увеличивается примерно с 322 МПа для технически чистого титана с низким содержанием железа до примерно 420 МПа при увеличении содержания кислорода с 2100 млн до 29.
3 Эрлих был первым, кто количественно исследовал растворимость кислорода в титане и определил предел растворимости кислорода в титане на уровне 42 % по массе. Эрлих также наблюдал изменение отношения c / a ГПУ-решетки титана с увеличением содержания кислорода. Для чистого титана соотношение c / a меньше идеального значения 1,633; но оно приближается к 1,633 при более высоком содержании кислорода. Тем временем термодинамическая оценка системы Ti-O подтвердила предел около 33 ат. % в широком диапазоне температур для Ti-O. 4 Элементы внедрения в ГПУ кристаллической структуре создают несимметричные поля деформации и, следовательно, эффективно взаимодействуют с дислокациями. 5 Полученный эффект упрочнения используется в технически чистых титановых сплавах классов 1–4 в качестве основного механизма упрочнения, при этом предел текучести увеличивается с содержанием кислорода, как и усталостная прочность. Например, предел текучести высокочистого титана (99,99 %) увеличивается примерно с 322 МПа для технически чистого титана с низким содержанием железа до примерно 420 МПа при увеличении содержания кислорода с 2100 млн до 29. 00 ч/млн. 6 В конце концов, при содержании кислорода около 0,25% пластичность и ударная вязкость быстро снижаются до такой степени, что титано-кислородный сплав теряет свои свойства конструкционного материала. Водород, хотя его растворимость ограничена примерно 1% при комнатной температуре, диффундирует на порядки быстрее, чем другие элементы внедрения, и легко образует гидриды, которые отрицательно влияют на механические свойства. 7 Было показано, что азот обладает самым сильным упрочняющим эффектом на единицу добавления. 8 Междоузлия в титане образуют твердые растворы, но при составах, превышающих пределы растворимости твердых растворов, могут образовывать сложные фазы. Эти составные фазы представляют собой проблему, в частности, для водорода в титане из-за их хрупкой природы и сильно отличающихся упругих свойств от титановой матрицы. Считается, что растворимость водорода в титане при комнатной температуре составляет от 20 до 200 частей на миллион и увеличивается с повышением температуры до более чем 6000 частей на миллион, но снижается в присутствии кислорода.
00 ч/млн. 6 В конце концов, при содержании кислорода около 0,25% пластичность и ударная вязкость быстро снижаются до такой степени, что титано-кислородный сплав теряет свои свойства конструкционного материала. Водород, хотя его растворимость ограничена примерно 1% при комнатной температуре, диффундирует на порядки быстрее, чем другие элементы внедрения, и легко образует гидриды, которые отрицательно влияют на механические свойства. 7 Было показано, что азот обладает самым сильным упрочняющим эффектом на единицу добавления. 8 Междоузлия в титане образуют твердые растворы, но при составах, превышающих пределы растворимости твердых растворов, могут образовывать сложные фазы. Эти составные фазы представляют собой проблему, в частности, для водорода в титане из-за их хрупкой природы и сильно отличающихся упругих свойств от титановой матрицы. Считается, что растворимость водорода в титане при комнатной температуре составляет от 20 до 200 частей на миллион и увеличивается с повышением температуры до более чем 6000 частей на миллион, но снижается в присутствии кислорода. Гранецентрированный кубический (ГЦК) гидрид ( 9Фаза 0519 δ ) образуется при концентрации водорода более 200 ppm в альфа-титане. 9 Но водород также взаимодействует с дислокациями и трещинами, и было показано, что он влияет на механические свойства даже при концентрациях менее 125 ppm. 10
Гранецентрированный кубический (ГЦК) гидрид ( 9Фаза 0519 δ ) образуется при концентрации водорода более 200 ppm в альфа-титане. 9 Но водород также взаимодействует с дислокациями и трещинами, и было показано, что он влияет на механические свойства даже при концентрациях менее 125 ppm. 10 Примеси внедрения уже давно признаны в практике плавки и производства слитков титана как источники дефектов расплава. Включения низкой плотности (LDI) представляют собой области интерстициально-упрочненной альфа-фазы с повышенной твердостью, пониженной пластичностью и повышенной температурой бета-перехода. 11 На протяжении многих лет для отливок и поковок применялся строгий контроль обработки, что значительно снизило возникновение промежуточных дефектов. В случае LDI, например, в настоящее время допускается менее одного дефекта на 500 000 кг произведенного титанового сплава. 12 Внедрение новых технологий, таких как плавка в холодном поде, способствовало снижению бракосочетания.
 Но возможности контроля дефектов, связанных с примесями, в титановых сплавах резко изменились с появлением аддитивного производства. Переработка больше не ограничивается высококвалифицированными производителями титана с уникальными производственными технологиями и средами, такими как вакуумно-дуговая переплавка или плавильные печи с холодным подом. Вместо этого титановые компоненты изготавливаются из порошка на машинах для аддитивного производства, где обращение с порошком и его хранение, а также контроль окружающей среды в машинах в значительной степени возложены на пользователей, что открывает широкий спектр методов обработки и, следовательно, самые разные уровни примесей. Хуже того, многократное увеличение удельной поверхности порошков по сравнению с сыпучими материалами подвергает титан и его сплавы воздействию элементов внедрения в атмосфере аддитивных машин, в частности кислорода, азота и водорода. Во время электронно-лучевой плавки титана слой порошка поддерживается при повышенных температурах в процессе сборки, и эти повышенные температуры улучшают растворимость и диффузионность примесей.
Но возможности контроля дефектов, связанных с примесями, в титановых сплавах резко изменились с появлением аддитивного производства. Переработка больше не ограничивается высококвалифицированными производителями титана с уникальными производственными технологиями и средами, такими как вакуумно-дуговая переплавка или плавильные печи с холодным подом. Вместо этого титановые компоненты изготавливаются из порошка на машинах для аддитивного производства, где обращение с порошком и его хранение, а также контроль окружающей среды в машинах в значительной степени возложены на пользователей, что открывает широкий спектр методов обработки и, следовательно, самые разные уровни примесей. Хуже того, многократное увеличение удельной поверхности порошков по сравнению с сыпучими материалами подвергает титан и его сплавы воздействию элементов внедрения в атмосфере аддитивных машин, в частности кислорода, азота и водорода. Во время электронно-лучевой плавки титана слой порошка поддерживается при повышенных температурах в процессе сборки, и эти повышенные температуры улучшают растворимость и диффузионность примесей. Специалисты по аддитивному производству выиграют от более глубокого понимания взаимодействий в металлическом порошке, особенно влияния окружающей среды (парциальное давление кислорода) и роли примесей в изменении свойств порошка. Чтобы принять решение об условиях обработки, специалисты по аддитивному производству могут использовать эти научно обоснованные рекомендации по хранению порошков, обращению с ними, переработке, а также выбору и контролю атмосферы в камере сборки.
Специалисты по аддитивному производству выиграют от более глубокого понимания взаимодействий в металлическом порошке, особенно влияния окружающей среды (парциальное давление кислорода) и роли примесей в изменении свойств порошка. Чтобы принять решение об условиях обработки, специалисты по аддитивному производству могут использовать эти научно обоснованные рекомендации по хранению порошков, обращению с ними, переработке, а также выбору и контролю атмосферы в камере сборки.Эти научно обоснованные рекомендации должны начинаться с изучения энергетики междоузельных атомов и вакансий в определенных узлах решетки и их распределения в основной решетке титана и продолжаться с тех же соображений для замещающих элементов. Расчеты теории функционала плотности (DFT) хорошо подходят для определения энергий межузельных атомов, вакансий и атомов замещения. Были проведены обширные исследования DFT титана, в частности, роль точечных дефектов в .α ↔ ω структурное превращение 13,14,15 и диффузия кислорода в решетке, 16,17 обобщенные дефекты крепления, такие как, \(\left( {10\bar 12} \right)\) границы двойников и \((10\bar 10)\) дефект упаковки плоскости призмы, миграция вакансий 18 , термодинамика из первых принципов, основанная на формализме кластерного расширения и моделировании Монте-Карло, а также при определении ближнего порядка.
 19,20 Хотя были предприняты некоторые попытки систематически охарактеризовать примеси в Ti, проблема в основном сводилась к дефектным комплексам, образованным из-за растворенных веществ замещения и межузельного кислорода. 17 С этой целью крайне желательно систематическое изучение роли различных примесей в ГПУ-титане.
19,20 Хотя были предприняты некоторые попытки систематически охарактеризовать примеси в Ti, проблема в основном сводилась к дефектным комплексам, образованным из-за растворенных веществ замещения и межузельного кислорода. 17 С этой целью крайне желательно систематическое изучение роли различных примесей в ГПУ-титане.Тема точечных дефектов изучается с использованием методов электронной структуры с начала 1960-х годов для объяснения механизма самодиффузии в Cu и образования и миграции вакансий в Cu. 21,22 Величина и степень анизотропии диэлектрической поляризуемости, рассчитанные для Al, Cu и Mo, дают представление о том, что расщепленная конфигурация <100> преобладает в ГЦК металлах, а расщепленная конфигурация <110> преобладает в ОЦК металлах . 23 Недавно появились модели DFT для изучения взаимодействий растворенных веществ и вакансий в Al, в которых рассматривались 3d-ряды растворенных веществ. 24 Основное состояние и термодинамика систем M-H (M = Al, Ba, Ca, K, Mg, La, Li, Na, Ni, Pd, Sc, Sr, Ti, V и Y) 25 также учился.
 H в Al и интерметаллические выделения Al-Cu-Mg-(Si) и Al-Zn-Mg обычно встречаются в литературе по сплавам Al. 26 Также было успешно проведено моделирование бинарных фазовых диаграмм сплавов Ti-переходных металлов с использованием методологий первых принципов. 27,28 Используя методы молекулярной статики и динамики при изучении влияния напряжения на междоузельную диффузию в Ti, показано, что одноосное напряжение в направлении \([11\bar 20]\) может увеличивать скорость роста радиационно-индуцированных пустот почти на 20%. 29 Применяя модель теории континуума, Šob et al. утверждают, что упрочнение hcp Ti растворенными веществами внедрения (O, N и C) объясняется механизмом трансформации сидячих и скользящих дислокаций. 30 Обычно ожидается, что металлы с одинаковой валентностью демонстрируют одинаковое пластическое поведение. Однако исследование деформации с помощью просвечивающей электронной микроскопии in situ и расчеты из первых принципов показали, что Ti и Zr имеют одинаковую валентность, но имеют разное поведение пластичности из-за инверсии стабильности между скользящими и сидячими ядрами дислокаций.
H в Al и интерметаллические выделения Al-Cu-Mg-(Si) и Al-Zn-Mg обычно встречаются в литературе по сплавам Al. 26 Также было успешно проведено моделирование бинарных фазовых диаграмм сплавов Ti-переходных металлов с использованием методологий первых принципов. 27,28 Используя методы молекулярной статики и динамики при изучении влияния напряжения на междоузельную диффузию в Ti, показано, что одноосное напряжение в направлении \([11\bar 20]\) может увеличивать скорость роста радиационно-индуцированных пустот почти на 20%. 29 Применяя модель теории континуума, Šob et al. утверждают, что упрочнение hcp Ti растворенными веществами внедрения (O, N и C) объясняется механизмом трансформации сидячих и скользящих дислокаций. 30 Обычно ожидается, что металлы с одинаковой валентностью демонстрируют одинаковое пластическое поведение. Однако исследование деформации с помощью просвечивающей электронной микроскопии in situ и расчеты из первых принципов показали, что Ti и Zr имеют одинаковую валентность, но имеют разное поведение пластичности из-за инверсии стабильности между скользящими и сидячими ядрами дислокаций. 31 Ю и др. сообщили о своем исследовании, основанном на теории первых принципов, о том, что глубокое упрочнение hcp Ti примесями O связано с сильным химическим взаимодействием O с ядром дислокации. 16
31 Ю и др. сообщили о своем исследовании, основанном на теории первых принципов, о том, что глубокое упрочнение hcp Ti примесями O связано с сильным химическим взаимодействием O с ядром дислокации. 16 Эти результаты подчеркивают важную роль химической гибридизации компонентов сплава. В настоящем отчете проводится систематическое исследование точечных дефектов в ГПУ Ti с использованием теории функционала плотности из первых принципов. В данной работе исследуются энергетически предпочтительные места для точечных дефектов, такие как вакансия Ti ( V Ti ), собственные междоузлия, замещение и междоузельные положения примесных элементов с атомным номером от 1 (H) до 20 (Ca), а также несколько переходных металлов с атомным номером больше, чем у титана. Знания, полученные в результате текущей работы, в конечном итоге помогут лучше понять пути диффузии в титане и проложат путь к анализу точечных дефектов для коммерческих сплавов, таких как Ti-6Al-4V.

Результаты
Титан в чистом виде при комнатной температуре и атмосферном давлении кристаллизуется в ГПУ-структуре с пространственной групповой симметрией P6 3 /mmc (международная космическая группа № 194). Кристаллическая структура содержит два атома на примитивную ячейку. 32 Параметры решетки, определенные из экспериментов и теоретических исследований, показаны в таблице 1, где значения, рассчитанные с использованием обменно-корреляционных функционалов, таких как аппроксимация локальной плотности (LDA 33 ) и две различные параметризации приближения обобщенного градиента (GGA ), PW’91 34 и PBE сравниваются.
Таблица 1 Равновесные параметры решетки ГПУ Ti, определенные с помощью различных обменно-корреляционных обработок в DFT, и их сравнение с экспериментальными значениямиПолный размер таблицы
Чтобы сравнить относительную стабильность различных дефектов, мы рассчитываем энергию образования, которая получается из полных энергий, рассчитанных с помощью DFT.
 Энергия образования определяется как 35,36,37
Энергия образования определяется как 35,36,37 D}} \right) – E_{{\mathrm{Ti}} – {\mathrm{host}}} – pn_X\mu _X$$
(1)
Здесь, E f (D) — энергия образования дефекта D, измеряемая в эВ/суперячейка, E Supercell (D) и E Ti−хозяин — полная энергия дефекта и чистой суперячейки соответственно. мк Х — химический потенциал для видов X и n X — количество таких примесей в дефектной суперъячейке. стр = ±1 в зависимости от того, удаляется ли атом из суперячейки-хозяина или добавляется к ней для создания дефектной суперячейки. Концентрация точечных дефектов пропорциональна экспоненте энергии образования. Энергия образования также помогает определить коэффициент диффузии для кинематики дефектов. 38 Однако первые принципы определения энергии пласта, рассчитанной по формуле.
 (1) зависит от выбора μ X ; следовательно, правильный выбор химических потенциалов улучшает интерпретацию энергий образования. В нашем исследовании мк X Значения выбирают из чистого состояния примесей, называемых химическими потенциалами «элементов», а оксиды соответствующих элементов-примесей называют химическими потенциалами «оксидов». Подробно об источниках μ X и их роль в термодинамике представлена во вспомогательной информации.
(1) зависит от выбора μ X ; следовательно, правильный выбор химических потенциалов улучшает интерпретацию энергий образования. В нашем исследовании мк X Значения выбирают из чистого состояния примесей, называемых химическими потенциалами «элементов», а оксиды соответствующих элементов-примесей называют химическими потенциалами «оксидов». Подробно об источниках μ X и их роль в термодинамике представлена во вспомогательной информации.Мы отмечаем, что LDA и GGA не могут предсказать свойства основного состояния сильно коррелированных систем, особенно оксидов переходных металлов, проявляющих сегнетоэлектричество, сверхпроводимость, переходы металл-изолятор и магнетизм. Проблема более остра для полупроводниковых свойств и магнитных свойств и не так серьезна для простых металлических элементов. Ситуацию в идеале можно преодолеть, включив на месте специфический для элемента и орбитально селективный член кулоновского отталкивания, называемый Хаббардом 9.
 0519 U (метод DFT + U ). Однако нет единого мнения об использовании конкретного значения U для всех расчетов, поскольку эти значения не подлежат передаче. Фактическое значение U меняется в зависимости от элементов переходных металлов и их соответствующих соединений. Это еще более осложняется тем фактом, что значение U не должно быть одинаковым для разных кристаллических структур одного и того же элемента или соединения. Таким образом, полная энергия зависит от значения U в методе DFT + U . Поскольку полная энергия является основой нашего анализа, мы пытаемся здесь избежать двусмысленности, которая может возникнуть из-за включения двух разных уровней теории, DFT и DFT + U и варьирования значения U индивидуально для каждого элемента.
0519 U (метод DFT + U ). Однако нет единого мнения об использовании конкретного значения U для всех расчетов, поскольку эти значения не подлежат передаче. Фактическое значение U меняется в зависимости от элементов переходных металлов и их соответствующих соединений. Это еще более осложняется тем фактом, что значение U не должно быть одинаковым для разных кристаллических структур одного и того же элемента или соединения. Таким образом, полная энергия зависит от значения U в методе DFT + U . Поскольку полная энергия является основой нашего анализа, мы пытаемся здесь избежать двусмысленности, которая может возникнуть из-за включения двух разных уровней теории, DFT и DFT + U и варьирования значения U индивидуально для каждого элемента.Собственные междоузлия
Атомы титана, занимающие междоузельные узлы решетки, являются собственными междоузлиями. В ГПУ-кристаллической решетке дефект собственного внедрения может располагаться в шести узлах элементарной ячейки, как показано на рис.
Рис. 1 1.9.0030 39 Они называются ортогональными (О) и тетраэдрическими (Т) позициями. Примеси в базально-тетраэдрических (BT) и базально-октаэдрических (BO) позициях лежат в базисной плоскости, на полпути между двумя соседними позициями T и позициями O вдоль направления c соответственно. Краудионы представляют собой промежуточные положения между центром связи Ti-Ti, и были идентифицированы две разные конфигурации: базальный (CB) и небазальный (CN) краудионы. В отличие от этих примесных узлов, которые могут содержать только один примесный атом на узел, димероподобные межузельные точечные дефекты состоят из двух атомов. Два атома димероподобной примеси смещены симметрично относительно вакантного узла решетки. Из-за гексагональной симметрии существуют две ориентации димероподобных точечных дефектов. Конфигурация гантелей, ориентированная вдоль c -направление (DC) и конфигурация гантели, лежащая в базовой плоскости (DB), являются уникальным выбором. Конфигурации DC и DB представляют собой разделенные межстраничные объявления, которые являются своего рода собственными межстраничными объявлениями.
1.9.0030 39 Они называются ортогональными (О) и тетраэдрическими (Т) позициями. Примеси в базально-тетраэдрических (BT) и базально-октаэдрических (BO) позициях лежат в базисной плоскости, на полпути между двумя соседними позициями T и позициями O вдоль направления c соответственно. Краудионы представляют собой промежуточные положения между центром связи Ti-Ti, и были идентифицированы две разные конфигурации: базальный (CB) и небазальный (CN) краудионы. В отличие от этих примесных узлов, которые могут содержать только один примесный атом на узел, димероподобные межузельные точечные дефекты состоят из двух атомов. Два атома димероподобной примеси смещены симметрично относительно вакантного узла решетки. Из-за гексагональной симметрии существуют две ориентации димероподобных точечных дефектов. Конфигурация гантелей, ориентированная вдоль c -направление (DC) и конфигурация гантели, лежащая в базовой плоскости (DB), являются уникальным выбором. Конфигурации DC и DB представляют собой разделенные межстраничные объявления, которые являются своего рода собственными межстраничными объявлениями. Положения всех восьми междоузельных конфигураций показаны на схематическом изображении на рис. 1. Энергии образования суммированы для восьми собственных междоузельных конфигураций в Ti, перечисленных в таблице 2. Суперячейка состоит из периодического повторения ГПУ примитивной решетки. единиц, в которых размещаются примесные атомы. Эта суперячейка геометрически оптимизирована схемой сопряженных градиентов, чтобы минимизировать внутреннюю деформацию. Характерные положения примеси в оптимизированной суперячейке устанавливаются путем изучения ее ближайшего соседа. Разность энергий образования и полная разность энергий для изолированных дефектов собственного внедрения одинаковы. Однако энергия образования имеет преимущество, так как позволяет сравнивать расщепленную энергетику внедрения со случаями конфигураций дефектов замещения и внедрения.
Положения всех восьми междоузельных конфигураций показаны на схематическом изображении на рис. 1. Энергии образования суммированы для восьми собственных междоузельных конфигураций в Ti, перечисленных в таблице 2. Суперячейка состоит из периодического повторения ГПУ примитивной решетки. единиц, в которых размещаются примесные атомы. Эта суперячейка геометрически оптимизирована схемой сопряженных градиентов, чтобы минимизировать внутреннюю деформацию. Характерные положения примеси в оптимизированной суперячейке устанавливаются путем изучения ее ближайшего соседа. Разность энергий образования и полная разность энергий для изолированных дефектов собственного внедрения одинаковы. Однако энергия образования имеет преимущество, так как позволяет сравнивать расщепленную энергетику внедрения со случаями конфигураций дефектов замещения и внедрения.Схематическая кристаллическая структура, показывающая положения различных типов собственных междоузлий в решетке ГПУ Ti.
 Положения тетраэдрического (Т), ортогонального (О), базового тетраэдрического (ВТ), базового ортогонального (ВО), краудиона в базисной (CB) и небазальной (CN) плоскостях, а также расщепленного междоузлия вдоль c -направление (DC) и в базисной плоскости (DB). В таблице 2 приведена относительная стабильность этих дефектов в Ti-хозяине
Положения тетраэдрического (Т), ортогонального (О), базового тетраэдрического (ВТ), базового ортогонального (ВО), краудиона в базисной (CB) и небазальной (CN) плоскостях, а также расщепленного междоузлия вдоль c -направление (DC) и в базисной плоскости (DB). В таблице 2 приведена относительная стабильность этих дефектов в Ti-хозяинеПолноразмерное изображение
Таблица 2 Сравнение E f (в эВ на суперячейку) для восьми конфигураций собственных междоузлий (показаны на рис. 1)Полный размер таблицы
Длина связи слитого междоузлия была рассчитана как 1,663 и 1,930 Å для DC и DB соответственно. Исходные геометрии были выбраны путем выбора конфигурации с наименьшей полной энергией после проверки зависимости полной энергии от длины связи примесной пары в чистой решетке. Энергии образования приведены в табл. 2 для начального ( Е ф U ) и расслабленный ( E f R ) суперячейки для различных конфигураций.
 Другими словами, E f U указывает энергию примесных межузельных димеров, когда атомы-хозяева не релаксированы. Разница в энергии (Δ E f UR = Е ф U − E f R ) объясняет выигрыш в химической энергии за счет локальных искажений решетки. Длины связей Ti–Ti составляют 1,430 и 1,463 Å для конфигураций CN и CB соответственно, что составляет примерно половину равновесной постоянной решетки. Δ Е f UR выглядит большим для собственных межстраничных объявлений Crowdion; 90,4 и 9,8 эВ для CB и CN соответственно из-за величины E f U , которая уже велика за счет дополнительного атома Ti между равновесными связями Ti–Ti. По сравнению с этим разность энергий Δ E f UR минимален для разделенных междоузельных конфигураций, DC и DB, поскольку два примесных атома расположены в междоузельной области близко к их равновесному разделению из-за способа подготовки моделей DC и DB.
Другими словами, E f U указывает энергию примесных межузельных димеров, когда атомы-хозяева не релаксированы. Разница в энергии (Δ E f UR = Е ф U − E f R ) объясняет выигрыш в химической энергии за счет локальных искажений решетки. Длины связей Ti–Ti составляют 1,430 и 1,463 Å для конфигураций CN и CB соответственно, что составляет примерно половину равновесной постоянной решетки. Δ Е f UR выглядит большим для собственных межстраничных объявлений Crowdion; 90,4 и 9,8 эВ для CB и CN соответственно из-за величины E f U , которая уже велика за счет дополнительного атома Ti между равновесными связями Ti–Ti. По сравнению с этим разность энергий Δ E f UR минимален для разделенных междоузельных конфигураций, DC и DB, поскольку два примесных атома расположены в междоузельной области близко к их равновесному разделению из-за способа подготовки моделей DC и DB.
Мы обнаружили, что конфигурация BO является наиболее благоприятной конфигурацией собственного междоузлия. Энергия конфигурации CB аналогична энергии конфигурации BO. Релаксированные суперячейки конфигурации CB идентичны конфигурации BO. Результаты, ранее сообщавшиеся в исх. 29 тот факт, что конфигурация DB является наиболее благоприятной самоинтерстициальной конфигурацией, противоречит нашим результатам. Фактически, наши нерелаксированные результаты суперячейки совпадают с выводами исх. 9{\mathrm{U}}\) в таблице 2).
Пары вакансия-междоузлия
Энергия образования атома, отсутствующего в узле решетки, т. е. вакансии ( V Ti , не путать с ванадием, замещенным на узле Ti, V Ti ), равна рассчитывается как
$$E_f\left( {V_{{\mathrm{Ti}}}} \right) = E\left( {{\mathrm{Ti}} + V_{{\mathrm{Ti}}}} \right) – \mu _{{\mathrm{Ti}}}$$
(2)
где E – полная энергия и значение μ Ti , полученное из объема Ti, составляет 1,94 эВ, что аналогично значению, полученному из расчетов сверхмягких псевдопотенциалов.
 40 Энергии вакансий Ti получены в аналогичном диапазоне с разными обменно-корреляционными функционалами, 41 которые завышены по сравнению с полученными в эксперименте (1,55 эВ в ссылке 42 и 1,27 эВ из спектроскопии позитронной аннигиляции в ссылке 43 ). Расхождение связано с отсутствием обменной корреляции на основе плотности для учета точной обработки электронной корреляции. 44 Существует способ обойти ограничения GGA, добавив поправочный член Хаббарда U . Однако в нашем исследовании он не использовался из-за неоднозначности, которую он вносит в трактовку химических потенциалов, что влияет на расчет энергий образования. Энергетика показывает, что величина энергии образования вакансий сравнима с собственными междоузлиями, см. табл. 2. Таким образом, можно предположить, что и вакансии, и собственные междоузлия, вероятно, одновременно реагируют на термодинамические возмущения, которые можно объединить для получения механизм миграции атома Ti для прыжка из положения в решетке в ближайшее междоузельное положение.
40 Энергии вакансий Ti получены в аналогичном диапазоне с разными обменно-корреляционными функционалами, 41 которые завышены по сравнению с полученными в эксперименте (1,55 эВ в ссылке 42 и 1,27 эВ из спектроскопии позитронной аннигиляции в ссылке 43 ). Расхождение связано с отсутствием обменной корреляции на основе плотности для учета точной обработки электронной корреляции. 44 Существует способ обойти ограничения GGA, добавив поправочный член Хаббарда U . Однако в нашем исследовании он не использовался из-за неоднозначности, которую он вносит в трактовку химических потенциалов, что влияет на расчет энергий образования. Энергетика показывает, что величина энергии образования вакансий сравнима с собственными междоузлиями, см. табл. 2. Таким образом, можно предположить, что и вакансии, и собственные междоузлия, вероятно, одновременно реагируют на термодинамические возмущения, которые можно объединить для получения механизм миграции атома Ti для прыжка из положения в решетке в ближайшее междоузельное положение. Рассмотрение μ Ti , полученные из объемных моделей Ti, включают ситуацию, когда решетка вакансий находится в термодинамическом равновесии с идеальным объемным Ti. Однако это может быть нереалистичным в технологических процессах, особенно если интересующий смещенный атом Ti остается глубоко в объемном образце, образуя вторичные фазы с другими дефектами/примесями в решетке. Наиболее тривиальным случаем для нашего обсуждения были бы дефектные комплексы, состоящие из вакансии и примеси собственного внедрения.
Рассмотрение μ Ti , полученные из объемных моделей Ti, включают ситуацию, когда решетка вакансий находится в термодинамическом равновесии с идеальным объемным Ti. Однако это может быть нереалистичным в технологических процессах, особенно если интересующий смещенный атом Ti остается глубоко в объемном образце, образуя вторичные фазы с другими дефектами/примесями в решетке. Наиболее тривиальным случаем для нашего обсуждения были бы дефектные комплексы, состоящие из вакансии и примеси собственного внедрения.Чтобы получить представление о дефектных комплексах, мы рассчитали энергию образования V Ti – межузельная пара Ti в зависимости от разделения отдельных компонентов, т.е. вакансии титана, V Ti и межузельного атома титана. Модели Supercell были приготовлены с междоузлиями Ti в конфигурации BO и V Ti , созданными в разных положениях, так что расстояние V Ti от междоузельного Ti составляет 2,15, 4,20, 4,58, 6,44 и 9,23 Å.
 После минимизации внутренних сил в суперячейках (геометрическая оптимизация) обнаружено, что для первых трех более коротких расстояний между парами межузельный Ti будет притягиваться к пустому узлу решетки, что может привести к устранению дефекта. Однако при больших расстояниях 6,44 и 9.23 Å взаимодействие между V Ti и межузельным атомом титана экранируется атомами-хозяевами между ними. В результате V Ti и межузельный атом Ti попадают в локальные минимумы энергии без заметного изменения их разделительного расстояния. Энергии образования для трех кратчайших расстояний одинаковы и почти на 3,9 эВ меньше, чем энергии образования двух больших расстояний. В идеале с точки зрения энергетики можно было бы ожидать, что вакансии и междоузлия должны аннигилировать друг с другом и, таким образом, восстановить окружение идеальной ГПУ-решетки, если эти дефекты находятся в непосредственной близости.
После минимизации внутренних сил в суперячейках (геометрическая оптимизация) обнаружено, что для первых трех более коротких расстояний между парами межузельный Ti будет притягиваться к пустому узлу решетки, что может привести к устранению дефекта. Однако при больших расстояниях 6,44 и 9.23 Å взаимодействие между V Ti и межузельным атомом титана экранируется атомами-хозяевами между ними. В результате V Ti и межузельный атом Ti попадают в локальные минимумы энергии без заметного изменения их разделительного расстояния. Энергии образования для трех кратчайших расстояний одинаковы и почти на 3,9 эВ меньше, чем энергии образования двух больших расстояний. В идеале с точки зрения энергетики можно было бы ожидать, что вакансии и междоузлия должны аннигилировать друг с другом и, таким образом, восстановить окружение идеальной ГПУ-решетки, если эти дефекты находятся в непосредственной близости.Примеси внедрения и замещения
Энергии образования примесей в положениях внедрения и замещения в ГПУ-решетке Ti рассчитаны из «элементных» химических потенциалов ( μ элемент ) и «оксидных» химических потенциалов ( μ оксид ), см.
Таблица 3 Энергии образования (в эВ на суперячейку) примесей в различных положениях в ГПУ Ti (см. рис. 1) вспомогательную информацию, которая указана в таблицах 3 и 4 соответственно. Например, на рис. 2а показаны рассчитанные энергии образования примеси О в Ti. Энергии образования в нижнем диапазоне получаются из полной энергии O 2 , что можно интерпретировать как термодинамическое состояние с богатой кислородом средой, в то время как энергии образования в верхнем диапазоне получены из TiO 2 в структуре рутила, что можно интерпретировать как термодинамическое состояние с дефицитом кислорода Окружающая среда. Горизонтальные пунктирные линии на этом рисунке обозначают конфигурацию с наименьшей энергией образования в каждом случае. Замечено, что атом O предпочитает октаэдрическое междоузлие, когда в окружающей среде дефицит кислорода. С другой стороны, в среде с высоким содержанием кислорода термодинамически стабильной фазой являются пары примесей кислорода, приводящие к конфигурациям DB и DC (см. рис. 1). Относительные различия энергий образования позиций внедрения и замещения для двух типов химического окружения можно оценить по данным рис.
вспомогательную информацию, которая указана в таблицах 3 и 4 соответственно. Например, на рис. 2а показаны рассчитанные энергии образования примеси О в Ti. Энергии образования в нижнем диапазоне получаются из полной энергии O 2 , что можно интерпретировать как термодинамическое состояние с богатой кислородом средой, в то время как энергии образования в верхнем диапазоне получены из TiO 2 в структуре рутила, что можно интерпретировать как термодинамическое состояние с дефицитом кислорода Окружающая среда. Горизонтальные пунктирные линии на этом рисунке обозначают конфигурацию с наименьшей энергией образования в каждом случае. Замечено, что атом O предпочитает октаэдрическое междоузлие, когда в окружающей среде дефицит кислорода. С другой стороны, в среде с высоким содержанием кислорода термодинамически стабильной фазой являются пары примесей кислорода, приводящие к конфигурациям DB и DC (см. рис. 1). Относительные различия энергий образования позиций внедрения и замещения для двух типов химического окружения можно оценить по данным рис. 2а.
2а.Полная таблица
Таблица 4 Энергии образования (в эВ на суперячейку) примесей в различных положениях в ГПУ Ti (см. рис. 1)Полная таблица
Рис. 2Сравнение энергий образования примесных элементов в различных позициях внедрения и на позиции замещения. Примесь O выбрана в качестве примера в ( a ). Нижний и верхний диапазоны энергий образования получены с использованием μ оксида и μ элемента , полученного из молекулы O 2 и твердого вещества TiO 2 , соответственно, значения которых показаны пунктирными горизонтальными линиями. б Минимальное значение энергий образования исследуемых примесей от двух источников химических потенциалов. Символы соответствуют конфигурациям примесей, как в ( и ).
 Энергии формирования данных для выбранных элементов 3d, 4d и 5d показаны на заштрихованном (желтом) фоне
Энергии формирования данных для выбранных элементов 3d, 4d и 5d показаны на заштрихованном (желтом) фонеУвеличить
Чем ниже энергия образования дефектной конфигурации, тем выше вероятность обнаружения такого дефекта в образце. На рис. 2b показаны самые низкие энергии образования, полученные для различных элементов, от H (атомный номер = 1) до Ca (атомный номер = 20), за исключением элементов благородных газов He и Ne. Дополнительные выбранные элементы из переходных металлов серий 3d, 4d и 5d, V, Ni, Cu, Zr, Mo, Ag, Ta, W, Au и Pb, рассматриваются для того, чтобы сравнить тенденции энергий образования элементов для относительно больший размер атома. Энергии образования этих случаев показаны в заштрихованной области рис. 2б. Тренд наименьших энергий образования (среди различных конфигураций примесей) на рис. 2б, полученный из μ Элемент отмечен красной линией. Энергии образования, полученные из μ оксида , отмечены синей линией на том же рисунке.
 Обнаружено, что эти химические потенциальные обработки приводят к двум различным тенденциям в отношении самых низких энергий пласта.
Обнаружено, что эти химические потенциальные обработки приводят к двум различным тенденциям в отношении самых низких энергий пласта.Как правило, металлические примеси, независимо от размера их атомов и воздействия типа химической среды (учитывая два различных химических потенциала), благоприятствуют местам замещения. С другой стороны, обычные высокоэлектроотрицательные элементы, такие как C, N, O, F, S и Cl, не благоприятствуют сайту замены. Вместо этого элементы C, N и Cl предпочитают октаэдрические междоузлия для двух химических сред. H, O и S стабилизируют различные конфигурации примесей при различной обработке химическим потенциалом: октаэдрические конфигурации примесей для μ оксид и конфигурация примесь-димер (DB и DC) для μ элемент . Фтор является единственным элементом, который образует примесь-димер в Ti для обоих типов химических потенциалов. Следует подчеркнуть, что H, который легко мог потерять свой электрон, образуя катион H + , фактически ведет себя аналогично электроотрицательным элементам, будучи введенным в качестве примеси в Ti.
 Этот результат подтверждает анализ переноса заряда, в котором наблюдается, что H приобретает электроны от соседних атомов Ti, что обсуждается в следующем разделе. 9{{\ mathrm {hybridized}}} \) – это вычисленный заряд Бейдера после достижения самосогласованных полевых решений. Согласно этому определению отрицательные значения для Δ q B ( X ) будет означать накопление заряда от окрестности атомной позиции X (определение согласуется с определением заряда электрона, рассматриваемого как отрицательное), в то время как положительное значение будет означать потерю заряда с атомной позиции X 905:20 по окрестностям. Тенденция Δ q B Ожидается, что ( X ) для примеси и атомов-хозяев будут обратно пропорциональны, поскольку потеря или приобретение заряда в месте примеси должно коррелировать с изменениями заряда в соседних атомах-хозяевах. Отрицательные значения Δ q B являются общими для электроотрицательных примесей, таких как C, N, O и F.
Этот результат подтверждает анализ переноса заряда, в котором наблюдается, что H приобретает электроны от соседних атомов Ti, что обсуждается в следующем разделе. 9{{\ mathrm {hybridized}}} \) – это вычисленный заряд Бейдера после достижения самосогласованных полевых решений. Согласно этому определению отрицательные значения для Δ q B ( X ) будет означать накопление заряда от окрестности атомной позиции X (определение согласуется с определением заряда электрона, рассматриваемого как отрицательное), в то время как положительное значение будет означать потерю заряда с атомной позиции X 905:20 по окрестностям. Тенденция Δ q B Ожидается, что ( X ) для примеси и атомов-хозяев будут обратно пропорциональны, поскольку потеря или приобретение заряда в месте примеси должно коррелировать с изменениями заряда в соседних атомах-хозяевах. Отрицательные значения Δ q B являются общими для электроотрицательных примесей, таких как C, N, O и F. Перенос заряда на соседний носитель Ti (<Δ Б (Ti)>) усредняется по ближайшим соседним координациям 4, 6 и 12 для примесного атома, расположенного в тетраэдрической, октаэдрической и замещенной примесных позициях соответственно.
Перенос заряда на соседний носитель Ti (<Δ Б (Ti)>) усредняется по ближайшим соседним координациям 4, 6 и 12 для примесного атома, расположенного в тетраэдрической, октаэдрической и замещенной примесных позициях соответственно.Перенос заряда между атомами примеси и ближайшими соседними атомами-хозяевами Ti в зависимости от атомного номера (кроме инертных газов) показан на рис. 3а для октаэдрических и примесных позиций замещения. Перенос заряда следует той же тенденции периодов в периодической таблице для обоих примесных узлов. Средний перенос заряда на Ti ниже по величине, потому что несколько атомов Ti из соседней области связываются с атомом примеси. Перенос заряда на примесные атомы в октаэдрических междоузлиях и позициях замещения различается в зависимости от среднего переноса заряда Ti, как показано на рис. 3б. Синие и черные сплошные линии представляют собой линии тренда для данных о примесях в октаэдрических положениях внедрения и замещения соответственно.
Рис. 3 Из рис. 3б видно, что перенос заряда на примеси в случаях замещения (наклон черной линии) в целом больше, чем для октаэдрических положений примеси (наклон синей линии). Та же информация также изображена на рис. 3а, где мы отмечаем разницу в значениях переноса заряда между случаями замещения (закрашенные квадраты) и интерстициального (незаштрихованные кружки). Как уже указывалось в предыдущем разделе, H в металлическом Ti имеет отрицательные значения Δ Б как для случаев замещения, так и для случаев внедрения (см. рис. 3a,b), предполагая, что он действует как примесь, притягивающая электроны, подобно C, O и F.
Из рис. 3б видно, что перенос заряда на примеси в случаях замещения (наклон черной линии) в целом больше, чем для октаэдрических положений примеси (наклон синей линии). Та же информация также изображена на рис. 3а, где мы отмечаем разницу в значениях переноса заряда между случаями замещения (закрашенные квадраты) и интерстициального (незаштрихованные кружки). Как уже указывалось в предыдущем разделе, H в металлическом Ti имеет отрицательные значения Δ Б как для случаев замещения, так и для случаев внедрения (см. рис. 3a,b), предполагая, что он действует как примесь, притягивающая электроны, подобно C, O и F.a соседние атомы Ti. б Сравнение тренда переноса заряда для примесей в октаэдрических позициях внедрения и замещения
Увеличенное изображение
Предпочтительная конфигурация для рассматриваемых элементов представлена на рис. 4, где энергии образования примесей замещения сравниваются с минимальная энергия образования из междоузельных конфигураций.
Рис. 4 Обнаружено, что сильно электроотрицательные элементы, H, C, N, O, F, S и Cl, благоприятствуют междоузлиям (см. рис. 2b). Химическая гибридизация играет более решающую роль, чем другие конкурирующие термины. Линия y = х — случай, когда равновероятны как замещающие, так и внедренные примеси. Чем дальше от этой линии, тем выше вероятность примесей внедрения или замещения. Случаи примесей P и Ni отклоняются от ожидаемого поведения. Другими словами, энергии их образования лежат относительно близко к линии y = x . Интуитивно ожидается, что P будет благоприятствовать интерстициальному положению, в то время как Ni, как ожидается, будет благоприятствовать замещающему сайту. Пересмотр исходных соединений, из которых получен химический потенциал, потенциально может помочь исправить это несоответствие. Кроме того, для Ni трудность может заключаться в значении химических потенциалов, которое определяется оксидным соединением NiO. NiO является примером соединения, в котором приближение GGA не учитывает сильные эффекты электронной корреляции.
Обнаружено, что сильно электроотрицательные элементы, H, C, N, O, F, S и Cl, благоприятствуют междоузлиям (см. рис. 2b). Химическая гибридизация играет более решающую роль, чем другие конкурирующие термины. Линия y = х — случай, когда равновероятны как замещающие, так и внедренные примеси. Чем дальше от этой линии, тем выше вероятность примесей внедрения или замещения. Случаи примесей P и Ni отклоняются от ожидаемого поведения. Другими словами, энергии их образования лежат относительно близко к линии y = x . Интуитивно ожидается, что P будет благоприятствовать интерстициальному положению, в то время как Ni, как ожидается, будет благоприятствовать замещающему сайту. Пересмотр исходных соединений, из которых получен химический потенциал, потенциально может помочь исправить это несоответствие. Кроме того, для Ni трудность может заключаться в значении химических потенциалов, которое определяется оксидным соединением NiO. NiO является примером соединения, в котором приближение GGA не учитывает сильные эффекты электронной корреляции. 47
47 Сравнение энергий образования места замещения (по оси абсцисс) и наиболее благоприятной конфигурации внедрения (по оси ординат). Линия y = x показывает четкое разделение и предполагает благоприятную конфигурацию точечных дефектов 50 , которые учитывают: (а) разницу в электроотрицательности среди вовлеченных частиц, (б) разницу в размере составляющих атомов, (в) правила заполнения электронами (приобретение октатной электронной конфигурации посредством гибридизации) и ( г) конкурирующие кристаллические структуры для объяснения тенденций растворимости твердых веществ. Аналогичные эмпирические правила можно было бы сформулировать для точечных дефектов и примесей в металлах. Пренебрегая тепловыми эффектами, такие ориентиры можно вывести из энергий образования, поскольку они напрямую связаны со стабильностью примесей. Хотя это и не указано в первоначальной форме правил, энергия ионизации примесных элементов может быть включена в качестве дескриптора в настоящий контекст точечных дефектов, поскольку для уравновешивания зарядов в однофазной системе электроотрицательность примесных атомов должна быть связано с потенциалом ионизации атомов-хозяев и наоборот.
Рис. 5 Динамика энергии ионизации, электроотрицательности и ковалентного радиуса элементов показана на рис. 5а–е. Легко сравнить данные в зависимости от числа валентных электронов для элементов во второй (от Li до F) и третьей строках (от Na до Cl) таблицы Менделеева, а также в зависимости от номера столбца таблицы Менделеева. для элементов четвертой, пятой и шестой строк. Переходные металлы имеют несколько потенциальных состояний валентности, которые обрабатываются путем выбора номера столбца периодической таблицы. Значение соответствующих физических величин для Ti показано горизонтальной пунктирной линией. Более легкие элементы демонстрируют четкие тенденции по сравнению с более тяжелыми переходными элементами. С увеличением атомного номера электроны занимают d и появляются f-орбитали. Они сильно коррелированы, и их химия более сложна.
Динамика энергии ионизации, электроотрицательности и ковалентного радиуса элементов показана на рис. 5а–е. Легко сравнить данные в зависимости от числа валентных электронов для элементов во второй (от Li до F) и третьей строках (от Na до Cl) таблицы Менделеева, а также в зависимости от номера столбца таблицы Менделеева. для элементов четвертой, пятой и шестой строк. Переходные металлы имеют несколько потенциальных состояний валентности, которые обрабатываются путем выбора номера столбца периодической таблицы. Значение соответствующих физических величин для Ti показано горизонтальной пунктирной линией. Более легкие элементы демонстрируют четкие тенденции по сравнению с более тяжелыми переходными элементами. С увеличением атомного номера электроны занимают d и появляются f-орбитали. Они сильно коррелированы, и их химия более сложна.Тенденция изменения энергии ионизации, электроотрицательности и ковалентного радиуса элементов в зависимости от расположения элементов в периодической таблице показана на ( a – f ).
 Обратите внимание, что данные сравниваются с числом валентных электронов для элементов во второй (от Li до F) и третьей строках (от Na до Cl) таблицы Менделеева и в зависимости от номера столбца таблицы Менделеева для элементов в четвертой, пятой, и шестой ряд соответственно. Значение соответствующей физической величины для Ti показано горизонтальной пунктирной линией. Наименьшие значения энергии образования, полученные для нескольких конфигураций, отложены по оси абсцисс величин в ( g ) и ( h ), соответственно, как графики слева и справа
Обратите внимание, что данные сравниваются с числом валентных электронов для элементов во второй (от Li до F) и третьей строках (от Na до Cl) таблицы Менделеева и в зависимости от номера столбца таблицы Менделеева для элементов в четвертой, пятой, и шестой ряд соответственно. Значение соответствующей физической величины для Ti показано горизонтальной пунктирной линией. Наименьшие значения энергии образования, полученные для нескольких конфигураций, отложены по оси абсцисс величин в ( g ) и ( h ), соответственно, как графики слева и справаПолноразмерное изображение
ТПФ — это количественная теория, которая может дать способ объяснить тенденции в свойствах материалов, такие как описанные по правилам Юма-Розери. Поскольку энергии образования зависят от выбора химического потенциала, найти уникальную функциональную зависимость энергий образования от физических параметров может быть непросто. Существуют дополнительные сложности для примесей переходных металлов из-за их многовалентного состояния.
Рис. Энергии образования соответствующих примесей для μ элемент и μ оксид для показаны на рис. 5г, ч. Расчеты были выполнены с учетом объемной релаксации суперячейки, что подразумевает, что объединенная роль электроотрицательности, потенциала ионизации, ковалентных радиусов и т. д. может быть собрана в один физический дескриптор, которым является изменение объема суперячейки. Изменение объема можно зафиксировать экспериментально, определив параметры решетки с помощью общедоступных методов определения характеристик, таких как дифракция рентгеновских лучей, электронов или нейтронов. На рис. 6 показано сравнение изменения объема для всех конфигураций примеси. Конфигурации с наименьшей энергией пласта обведены прямоугольниками для каждой обработки химическим потенциалом (синий цвет для μ элемент и зеленый для μ оксид ). Обратите внимание, что в большинстве случаев конфигурация с наименьшей энергией одинакова для обеих химических потенциалов, поэтому показан только синий прямоугольник.
Энергии образования соответствующих примесей для μ элемент и μ оксид для показаны на рис. 5г, ч. Расчеты были выполнены с учетом объемной релаксации суперячейки, что подразумевает, что объединенная роль электроотрицательности, потенциала ионизации, ковалентных радиусов и т. д. может быть собрана в один физический дескриптор, которым является изменение объема суперячейки. Изменение объема можно зафиксировать экспериментально, определив параметры решетки с помощью общедоступных методов определения характеристик, таких как дифракция рентгеновских лучей, электронов или нейтронов. На рис. 6 показано сравнение изменения объема для всех конфигураций примеси. Конфигурации с наименьшей энергией пласта обведены прямоугольниками для каждой обработки химическим потенциалом (синий цвет для μ элемент и зеленый для μ оксид ). Обратите внимание, что в большинстве случаев конфигурация с наименьшей энергией одинакова для обеих химических потенциалов, поэтому показан только синий прямоугольник. Наблюдается, что, за исключением сильно электроотрицательных элементов C, N, O, F, S и Cl, общая тенденция к меньшему изменению объема соответствует более низким энергиям образования, что достигается замещением в решетке Ti. Это ожидается, потому что большие объемные изменения в кристаллической решетке увеличат упругую энергию системы. Для сравнения, объем ГПУ Ti, рассчитанный по DFT, составляет 34,263 Å 3 /ячейка, тогда как ОЦК Ti составляет 34,012 Å 3 /ячейка (элементарная ячейка содержит 2 атома Ti). 51 Разница в объеме составляет 0,251 Å 3 /элементарную ячейку, что сравнимо с изменением объема, возникающим для точечных дефектов, особенно для примесей переходных металлов. Это существенное возмущение решетки Ti. С другой стороны, для сильно электроотрицательных элементов решающую роль играет химическая гибридизация точечного дефекта с окружающей его матрицей, и эти примеси находятся в междоузлиях.
Наблюдается, что, за исключением сильно электроотрицательных элементов C, N, O, F, S и Cl, общая тенденция к меньшему изменению объема соответствует более низким энергиям образования, что достигается замещением в решетке Ti. Это ожидается, потому что большие объемные изменения в кристаллической решетке увеличат упругую энергию системы. Для сравнения, объем ГПУ Ti, рассчитанный по DFT, составляет 34,263 Å 3 /ячейка, тогда как ОЦК Ti составляет 34,012 Å 3 /ячейка (элементарная ячейка содержит 2 атома Ti). 51 Разница в объеме составляет 0,251 Å 3 /элементарную ячейку, что сравнимо с изменением объема, возникающим для точечных дефектов, особенно для примесей переходных металлов. Это существенное возмущение решетки Ti. С другой стороны, для сильно электроотрицательных элементов решающую роль играет химическая гибридизация точечного дефекта с окружающей его матрицей, и эти примеси находятся в междоузлиях. 6
6 Изменение объема на примитивную ГПУ-ячейку (на два атома), полученное в результате геометрической оптимизации суперячейки с примесями в различных конфигурациях. Положительное значение изменения объема подразумевает гидростатическую деформацию растяжения, а отрицательное значение — гидростатическую деформацию сжатия. Цветовой код примесных конфигураций такой же, как на рис. 2(а). Конфигурации с самой низкой энергией образования обведены синими и зелеными прямоугольниками для μ элемент и μ оксиды соответственно. Случаи, когда конфигурации с наименьшей энергией перекрываются, показаны только синим прямоугольником. Тенденция, согласно которой низкое изменение объема связано с низкими энергиями образования, отражается для большинства примесей, за исключением сильно электроотрицательных элементов, таких как C, N, O, F, S и Cl. точечные дефекты в Ti и в любом основном металле имеют жизненно важное значение. Например, было замечено, что микроструктура нержавеющей стали чувствительна к газовой среде, в которой выполняется лазерная плавка.
 52 Металлы часто загрязняются газами при высокотемпературной обработке. Газообразные элементы, такие как азот в стали, иногда преднамеренно добавляют в качестве легирующего элемента. 53 Другой пример; Объединяя тот факт, что c / a соотношение ГПУ-решетки Ti увеличивается с 1,59 до 1,633 с увеличением содержания кислорода 3,4 и сопоставляя результаты на рис. 6, можно интерпретировать, что O не способствует замещению или межстраничное положение DB, чтобы учесть положительное изменение объема. Обратите внимание, что положение DB (также DC) предпочтительнее при очень высоком химическом потенциале кислорода или при воздействии очень высокого парциального давления O 2 газ.
52 Металлы часто загрязняются газами при высокотемпературной обработке. Газообразные элементы, такие как азот в стали, иногда преднамеренно добавляют в качестве легирующего элемента. 53 Другой пример; Объединяя тот факт, что c / a соотношение ГПУ-решетки Ti увеличивается с 1,59 до 1,633 с увеличением содержания кислорода 3,4 и сопоставляя результаты на рис. 6, можно интерпретировать, что O не способствует замещению или межстраничное положение DB, чтобы учесть положительное изменение объема. Обратите внимание, что положение DB (также DC) предпочтительнее при очень высоком химическом потенциале кислорода или при воздействии очень высокого парциального давления O 2 газ.Достижения в методах обработки материалов, таких как лазерное аддитивное производство, привели к возрождению интереса к точечным дефектам и их стабильности из-за фундаментальной необходимости контролировать обработку и хранение исходных порошков.
 Светопоглощающая способность и нагрев порошков лазерным излучением зависят от химического состава вместе с другими факторами, такими как распределение среднего размера частиц и состояние поверхности порошка. Для повышения степени абсорбции исходный материал может быть подвергнут соответствующей предварительной обработке. Легирование является одним из методов, с помощью которых можно настроить электронную структуру исходного материала, например, для максимального увеличения поглощающей способности лазера. Еще одним преимуществом лазерных технологий аддитивного производства является возможность контролируемой обработки в различных газовых средах в одной сборке, что позволяет осуществлять локальный контроль микроструктуры. Следовательно, эти химические тенденции точечных дефектов могут привести к необходимому пониманию, чтобы потенциально преодолеть проблемы лазерной поглощающей способности и фазовой стабильности. Таким образом, несмотря на то, что тепловыми эффектами пренебрегали, результаты DFT дают полезную информацию о физике точечных дефектов и о свойствах материалов в основном состоянии.
Светопоглощающая способность и нагрев порошков лазерным излучением зависят от химического состава вместе с другими факторами, такими как распределение среднего размера частиц и состояние поверхности порошка. Для повышения степени абсорбции исходный материал может быть подвергнут соответствующей предварительной обработке. Легирование является одним из методов, с помощью которых можно настроить электронную структуру исходного материала, например, для максимального увеличения поглощающей способности лазера. Еще одним преимуществом лазерных технологий аддитивного производства является возможность контролируемой обработки в различных газовых средах в одной сборке, что позволяет осуществлять локальный контроль микроструктуры. Следовательно, эти химические тенденции точечных дефектов могут привести к необходимому пониманию, чтобы потенциально преодолеть проблемы лазерной поглощающей способности и фазовой стабильности. Таким образом, несмотря на то, что тепловыми эффектами пренебрегали, результаты DFT дают полезную информацию о физике точечных дефектов и о свойствах материалов в основном состоянии.
В заключение мы изучили внутренние и внешние точечные дефекты в ГПУ Ti с использованием теории функционала плотности. Примеси систематически выбираются из периодической таблицы с атомными номерами от 1 до 20 (кроме благородных газов) и выбранными элементами с атомным номером выше 20, такими как V, Ni, Cu, Zr, Mo, Ag, Ta, W, Au, и Pb, чтобы понять тенденции образования межузельных и замещающих дефектов. Исследованы два химических состояния, представленных химическим потенциалом элемента и химическим потенциалом оксида. По результатам этого исследования сделаны следующие выводы:
- (я)
Базовая ортогональная (БО) конфигурация является энергетически наиболее выгодным местом для собственных межузельных атомов Ti в ГПУ-решетке Ti. CB (базальная краудионная конфигурация) после геометрической оптимизации с целью минимизации локальных сил приводит к конфигурации BO и, следовательно, имеет такое же значение энергии образования, как и конфигурация BO.

- (ii)
Металлические примеси благоприятствуют местам замещения в ГПУ Ti независимо от размера их атомов и химического окружения.
- (iii)
Сильно электроотрицательные элементы, такие как C, N, O, F, S и Cl, имеют стабильные конфигурации в октаэдрических междоузлиях или в виде примесных димеров в зависимости от химического окружения. Хотя атомы водорода не являются сильно электроотрицательными, они также энергетически благоприятствуют октаэдрическим междоузлиям. Фтор является единственным элементом, который способствует димерной конфигурации в ГПУ Ti для двух исследованных химических условий.
- (4)
Комплексы дефектов между вакансиями в ГПУ-решетке Ti и междоузлиями Ti имеют тенденцию к слиянию и аннигиляции.
 Они сохраняют свое существование только на расстоянии более двух единиц параметра решетки.
Они сохраняют свое существование только на расстоянии более двух единиц параметра решетки. - (в)
Мы показываем, что изменение объема суперячейки может быть хорошим дескриптором поступления примесей в решетку Ti. Наши результаты показывают, что более низкие изменения удельного объема способствуют более вероятной конфигурации примесей из-за более низкой стоимости упругой энергии. Этой тенденции удовлетворяют все примеси переходных металлов, предпочитающие места замещения. Однако элементы с высокой электроотрицательностью, такие как C, N, O, F, S и Cl, отклоняются от этой тенденции из-за сильной химической гибридизации.
Методы
Мы использовали ТПФ для нашего теоретического анализа. Расчеты спин-поляризованной полной энергии были выполнены для размера суперячейки 6 × 6 × 3 примитивных ячеек.
 Суперячейка имеет 216 атомов титана для корпуса из чистого титана. A single point defect in the supercell thus corresponds to a concentration of x ~0.46 at% (Ti 99.54 X 0.46 ; X = V Ti , elements with atomic number 1 (H ) до 20 (Ca) и более крупных элементов, таких как V, Ni, Cu, Zr, Mo, Ag, Ta, W, Au и Pb, грубо сканируя элемент из 3 d , 4 d и 5 d периодов таблицы Менделеева. Случаи примесных димеров имеют x ~0,92 ат% из-за двух примесных атомов в суперячейке. GGA используется для функционала обменно-корреляционной энергии, параметризованного Perdew-Burke-Erzernhof 54 вместе с методом дополненной волны проектора. 55 Отсечка кинетической энергии для плоских волн установлена на 500 эВ. Интегрирование в обратном пространстве проводится с Γ-центрированными 3 × 3 × 3 k -точечная сетка гексагональной зоны Бриллюэна. Геометрическая оптимизация суперячейки была разрешена с критерием допуска для полной энергии, установленным на 10 -7 эВ, чтобы минимизировать локальные силы.
Суперячейка имеет 216 атомов титана для корпуса из чистого титана. A single point defect in the supercell thus corresponds to a concentration of x ~0.46 at% (Ti 99.54 X 0.46 ; X = V Ti , elements with atomic number 1 (H ) до 20 (Ca) и более крупных элементов, таких как V, Ni, Cu, Zr, Mo, Ag, Ta, W, Au и Pb, грубо сканируя элемент из 3 d , 4 d и 5 d периодов таблицы Менделеева. Случаи примесных димеров имеют x ~0,92 ат% из-за двух примесных атомов в суперячейке. GGA используется для функционала обменно-корреляционной энергии, параметризованного Perdew-Burke-Erzernhof 54 вместе с методом дополненной волны проектора. 55 Отсечка кинетической энергии для плоских волн установлена на 500 эВ. Интегрирование в обратном пространстве проводится с Γ-центрированными 3 × 3 × 3 k -точечная сетка гексагональной зоны Бриллюэна. Геометрическая оптимизация суперячейки была разрешена с критерием допуска для полной энергии, установленным на 10 -7 эВ, чтобы минимизировать локальные силы. Расчеты DFT были выполнены с использованием пакета моделирования Vienna ab initio. 56,57
Расчеты DFT были выполнены с использованием пакета моделирования Vienna ab initio. 56,57 Заявление о доступности данных
Авторы заявляют, что данные, подтверждающие результаты этого исследования, доступны в документе и в файле с дополнительной информацией.
Ссылки
Smallman, R. E., Harris, J. E. & Society, M. Вакансии ’76: Материалы конференции по « Поведение точечных дефектов и диффузионные процессы», Metals Society, организованной и проводимой в Королевском форте Бристольского университета, 13–16 сентября 1976 г. (Общество металлов, 1977 г.).
Damask, A.C. & Dienes, G.J. Точечные дефекты в металлах (Gordon and Breach, 1963).
Fast, N.D. Spanlose Formung von Zirkon und Titan. Metallwirtsch 17 , 459–466 (1938).
Google ученый
“>
Фишер, Э. Термодинамический расчет системы O-Ti. J. Фазовое равновесие. 18 , 338–343 (1997).
Артикул Google ученый
Конрад Х. Влияние растворов внедрения на прочность и пластичность титана. Прог. Матер. науч. 26 , 123–403 (1981).
Артикул Google ученый
Симби, Д. Дж. и Скалли, Дж. К. Влияние остаточных элементов внедрения и железа на механические свойства технически чистого титана. Матер. лат. 26 , 35–39 (1996).
Артикул Google ученый
Tal-Gutelmacher, E. & Eliezer, D. Водородное охрупчивание сплавов на основе титана. JOM 57 , 46–49 (2005).
Артикул Google ученый
Джаффи, Р.
 И. и Кэмпбелл, И. Э. Влияние кислорода, азота и водорода на очищенный йодом титан. JOM . 1 , 646–654 (1949).
И. и Кэмпбелл, И. Э. Влияние кислорода, азота и водорода на очищенный йодом титан. JOM . 1 , 646–654 (1949).Donachie, M. J. Титан и титановые сплавы . (Американское общество металлов, 1982 г.).
Wasz, M.L., Brotzen, F.R., McLellan, R.B. & Griffin, A.J. Влияние кислорода и водорода на механические свойства титана коммерческой чистоты. Междунар. Матер. 41 , 1–12 (1996).
Артикул Google ученый
Donachie, M.J. Jr. Тиатан — Техническое руководство 2nd edn, Vol. 55, 1023–1026 (ASM International, 2000).
Лютьеринг, Г. и Уильямс, Дж. К. Титан . (Springer-Verlag Berlin Heidelberg, 2007).
Hennig, R.G. et al. Примеси блокируют мартенситное превращение из альфа в омега в титане. Нац. Матер. 4 , 129–133 (2005).

Артикул Google ученый
Нишитани С.Р., Кавабе Х. и Аоки М. Расчеты из первых принципов перехода ОЦК-ГПУ титана. Матер. науч. англ. А 312 , 77–83 (2001).
Артикул Google ученый
Ахуджа Р., Уиллс Дж. М., Йоханссон Б. и Эрикссон О. Кристаллические структуры Ti, Zr и Hf при сжатии: теория. Физ. Ред. B 48 , 16269–16279 (1993).
Артикул Google ученый
Ю. К. и др. Происхождение сильного упрочняющего эффекта растворенного кислорода в титане. Наука 347 , 635–639 (2015).
Артикул Google ученый
Ву, Х. Х. и Тринкль, Д. Р. Влияние растворенного вещества на диффузию кислорода в α-титане. Дж. Заявл.
 Физ . 113 (2013).
Физ . 113 (2013).Ву, X., Ван, Р. и Ван, С. Энергия обобщенного дефекта упаковки и свойства поверхности для металлов HCP: исследование первых принципов. Заяв. Серф. науч. 256 , 3409–3412 (2010).
Артикул Google ученый
ван де Валле, А. и Аста, М. Исследование из первых принципов идеальных и диффузных антифазных границ в сплавах Ti-Al на основе ГПУ. Металл. Матер. Транс. A 33 , 735–741 (2002).
Артикул Google ученый
Аста, М., Де Фонтен, Д., Ван Шильфгаард, М., Слютер, М. и Метфессель, М. Исследование фазовой стабильности на основе первых принципов ГЦК-сплавов в системе Ti-Al. Физ. Ред. B 46 , 5055–5072 (1992).
Артикул Google ученый
“>Хантингтон, Х. Б. Самосогласованное рассмотрение вакансионного механизма металлической диффузии. Физ. 61 , 325–338 (1942).
Артикул Google ученый
Роброк, К.-Х. в Механическая релаксация междоузлий в облученных металлах (изд. Роброк, К.-Х.) 47–75 (Springer Berlin Heidelberg, 1990).
Волвертон, К. Связывание растворенного вещества с вакансией в алюминии. Acta Mater. 55 , 5867–5872 (2007).
Артикул Google ученый
Волвертон, К., Озолиньш, В. и Аста, М. Водород в алюминии: основные расчеты структуры и термодинамики.
 Физ. Ред. B 69 , 144109 (2004).
Физ. Ред. B 69 , 144109 (2004).Артикул Google ученый
Волвертон, К. Кристаллическая структура и стабильность сложных выделенных фаз в сплавах Al-Cu-Mg-(Si) и Al-Zn-Mg. Acta Mater. 49 , 3129–3142 (2001).
Артикул Google ученый
Хуанг Л.-Ф. и другие. От электронной структуры к фазовым диаграммам: восходящий подход к пониманию стабильности сплавов титана с переходными металлами. Acta Mater. 113 , 311–319 (2016).
Артикул Google ученый
Sluiter, M. & Turchi, P.E.A. Фазовая стабильность в сплавах Ti-V и Ti-Cr: теоретическое исследование. Физ. Ред. B 43 , 12251–12266 (1991).
Артикул Google ученый
“>Шоб М., Кратохвил Дж. и Крупа Ф. Теория упрочнения альфа-титана растворенными веществами внедрения. Чехословакия. Дж. Физ. B 25 , 872–890 (1975).
Артикул Google ученый
Clouet, E., Caillard, D., Chaari, N., Onimus, F. & Rodney, D. Блокировка дислокаций по сравнению с легким скольжением в титане и цирконии. Нац. Матер. 14 , 931–936 (2015).
Артикул Google ученый
Партридж, П. Г. Кристаллография и режимы деформации гексагональных плотноупакованных металлов. Междунар. Матер. 12 , 169–194 (1967).

Артикул Google ученый
Пердью, Дж. П. и Зунгер, А. Поправка на самодействие для приближений функционала плотности для многоэлектронных систем. Физ. Rev. B 23 , 5048–5079 (1981).
Артикул Google ученый
Perdew, J. P. et al. Атомы, молекулы, твердые тела и поверхности — применение приближения обобщенного градиента для обмена и корреляции. Физ. Ред. B 46 , 6671–6687 (1992).
Артикул Google ученый
Барафф Г.А. и Шлюльтер М. Электронная структура, полная энергия и распространенность элементарных точечных дефектов в GaAs. Физ. Преподобный Летт. 55 , 1327–1330 (1985).
Артикул Google ученый
Чжан, С.
 Б. и Нортрап, Дж. Э. Зависимость энергии образования дефектов в GaAs от химического потенциала: приложение к самодиффузии Ga. Физ. Преподобный Летт. 67 , 2339–2342 (1991).
Б. и Нортрап, Дж. Э. Зависимость энергии образования дефектов в GaAs от химического потенциала: приложение к самодиффузии Ga. Физ. Преподобный Летт. 67 , 2339–2342 (1991).Артикул Google ученый
Neugebauer, J. & Van De Walle, C.G. Атомная геометрия и электронная структура собственных дефектов в GaN. Физ. Ред. B 50 , 8067–8070 (1994).
Артикул Google ученый
Франк В., Брейер У., Эльзассер К. и Фэнле М. Расчеты из первых принципов абсолютных концентраций и констант самодиффузии вакансий в литии. Физ. Преподобный Летт. 77 , 518–521 (1996).
Артикул Google ученый
Франк В. Собственные точечные дефекты в гексагональных плотноупакованных металлах. J. Nucl. Матер. 159 , 122–148 (1988).

Артикул Google ученый
Raji, A. T. et al. Ab initio исследование Kr в ГПУ Ti: диффузия, образование и стабильность малых кластеров Kr-вакансий. Нукл. Инструм. Методы физ. Рез. Б. 267 , 2991–2994 (2009).
Артикул Google ученый
Медасани, Б., Харанчик, М., Каннинг, А. и Аста, М. Энергии образования вакансий в металлах: сравнение MetaGGA с обменно-корреляционными функционалами LDA и GGA. Вычисл. Матер. науч. 101 , 96–107 (2015).
Артикул Google ученый
Шестопал В. О. Теплоемкость и образование вакансий в титане при высоких температурах. Сов. физ. Твердотельный 7 , 2798–2799 (1966).
Google ученый
Хашимото Э.
 , Смирнов Э. А. и Кино Т. Температурная зависимость формы линии аннигиляции позитронов в α-Ti, уширенной доплеровским методом. J. Phys. Ф. Мет. физ. 14 , L215–L217 (1984).
, Смирнов Э. А. и Кино Т. Температурная зависимость формы линии аннигиляции позитронов в α-Ti, уширенной доплеровским методом. J. Phys. Ф. Мет. физ. 14 , L215–L217 (1984).Артикул Google ученый
Карлинг, К. и др. Вакансии в металлах: от первопринципных расчетов к экспериментальным данным. Физ. Преподобный Летт. 85 , 3862–3865 (2000).
Артикул Google ученый
Танг В., Санвилл Э. и Хенкельман Г. Алгоритм анализа Бейдера на основе сетки без смещения решетки. J. Phys. Конденс. Материя 21 , 84204 (2009).
Артикул Google ученый
Bader, RFW Атомы в молекулах: квантовая теория. (Кларендон Пресс, 1990).
Дударев С.Л., Саврасов С.Ю., Хамфрис С.
 Дж. и Саттон А.П. Спектры потерь энергии электронов и структурная стабильность оксида никеля: исследование LSDA+U. Физ. Ред. B 57 , 1505–1509(1998).
Дж. и Саттон А.П. Спектры потерь энергии электронов и структурная стабильность оксида никеля: исследование LSDA+U. Физ. Ред. B 57 , 1505–1509(1998).Артикул Google ученый
Mizutani, U. Правила Хьюма-Розери для структурно сложных фаз сплава. Миссис Булл. 37 , 169 (2012).
Артикул Google ученый
Даркен, Л. С. и Гарри, Р. В. Физическая химия металлов . (Макгроу-Хилл, 1953).
Массальский Т.Б. в Физическая металлургия 4-е изд. (ред. Кан, Р. В. и Хаасен, П.) 135–204 (Северная Голландия, 1996).
Аргаман У., Эйдельштейн Э., Леви О. и Маков Г. Термодинамические свойства титана на основе расчетов ab initio. Матер. Рез. Экспресс 2 , 16505 (2015).
Артикул Google ученый
“>Коттрелл, А. Введение в металлургию (Институт материалов, 1995).
Perdew, J., Burke, K. & Ernzerhof, M. Аппроксимация обобщенного градиента стала проще. Физ. Преподобный Летт. 77 , 3865–3868 (1996).
Артикул Google ученый
Крессе Г. От ультрамягких псевдопотенциалов к проекторному методу дополненной волны. Физ. Ред. B 59 , 1758–1775 (1999).
Артикул Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективность расчетов полной энергии ab-initio для металлов и полупроводников с использованием базисного набора плоских волн.
 Вычисл. Матер. науч. 6 , 15–50 (1996).
Вычисл. Матер. науч. 6 , 15–50 (1996).Артикул Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективные итерационные схемы для неэмпирических расчетов полной энергии с использованием базисного набора плоских волн. Физ. Ред. B 54 , 11169–11186 (1996).
Артикул Google ученый
Вуд, Р. М. Постоянные решетки высокочистого альфа-титана. Проц. физ. соц. 80 , 783–786 (2002).
Артикул Google ученый
Вохра Ю.К. и Спенсер П.Т. Новая γ-фаза металлического титана при мегабарном давлении. Физ. Преподобный Летт. 86 , 3068–3071 (2001).
Артикул Google ученый
Эрлих, П. Лёсунген фон Зауэрстофф в металлиском Титане.
 Z. für Anorg. и Allg. хим. 247 , 53–64 (1941).
Z. für Anorg. и Allg. хим. 247 , 53–64 (1941).Артикул Google ученый
Дешан, М., Куиви, А., Баур, Г. и Лер, П. Влияние распределения межузельных атомов кислорода на параметры решетки в разбавленных H.C.P. твердые растворы титан-кислород (90–4000 млн ат.). Штрих. Металл. 11 , 941–945 (1977).
Артикул Google ученый
Chemikerausschuß der GDMB Gesellschaft Deutscher Metallhütten- und Bergleute e. V. Titan (Springer-Verlag, 1951).
Винит Шарма
Текущий адрес: Отдел материаловедения и технологии, Окриджская национальная лаборатория, Ок-Ридж, Теннесси, 37831, США
Департамент материаловедения и инженерии и Институт материаловедения, Университет Коннектикута , Сторрс, Коннектикут, 06269, США
Санджив К. Наяк, Кейн Дж. Хунг, Винит Шарма, С. Памир Алпай, Авинаш М. Донгаре и Райнер Дж. Хеберт
Факультет физики, Коннектикутский университет, Сторрс , Коннектикут, 06269, USA
S. Pamir Alpay
Pratt & Whitney, East Hartford, CT, 06108, USA
William J. Brindley
Инновационный центр аддитивного производства, University of Connecticut, USA9, Storrs6
Райнер Дж. Хеберт
- Санджив К. Наяк
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Cain J.
 Hung
HungПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Винит Шарма
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- С. Памир Алпай
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Авинаш М. Донгаре
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- William J. Brindley
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Rainer J. Hebert
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Микроструктура и механические свойства титана марки 23, полученного методом селективного лазерного плавления
- Петр Никель
- Мирослав Врубель
- Анджей Бачманский
Архив строительства и машиностроения (2021)
Влияние растворенного азота на усталостное поведение Ti-6Al-4V
- Ч.
 Р. Коллинз
Р. Коллинз - Ф. Ф. Дорогой
- D. Краситель
Металлургические операции и материалы A (2021)
- Ч.
Теория функциональных возмущений плотности с высокой пропускной способностью и прогнозирование инфракрасных, пьезоэлектрических и диэлектрических характеристик с помощью машинного обучения
- Камаль Чоудхари
- Кевин Ф.

Хантингтон, Х. Б. и Зейтц, Ф. Механизм самодиффузии в металлической меди. Физ. Ред. 61 , 315–325 (1942).
Артикул Google ученый
Вен, М., Ву, С. Х. и Хуанг, Х. Атомистические исследования воздействия напряжения на междоузельную диффузию в α-титане. Дж. Вычисл. Матер. Дес. 7 , 97–110 (2000).
Артикул Google ученый
Murr, L. E. et al. Микроструктура и свойства нержавеющей стали 17-4 РН, полученной методом селективного лазерного плавления. Дж. Матер. Рез. Технол. 1 , 167–177 (2012).
Артикул Google ученый
Загрузить ссылки
Благодарности
Компания Pratt and Whitney выражает благодарность за финансовую поддержку через UConn—Pratt & Whitney Center of Excellence. Эта публикация одобрена для публичного выпуска. Вычислительные ресурсы для работы были предоставлены Службой информационных технологий Университета Коннектикута.
Информация об авторе
Примечания автора
Авторы и филиалы
Авторы
Вклады
Исследование было задумано S.K.N., C.J.H., S.P.A. и Р. Дж.Х. С.К.Н. выполнил расчеты. Результаты были проанализированы с помощью всех авторов. S.K.N., C.J.H., V.S., S.P.A., A.M.D., W.J.B. и R.J.H. способствовал написанию рукописи.
Дж.Х. С.К.Н. выполнил расчеты. Результаты были проанализированы с помощью всех авторов. S.K.N., C.J.H., V.S., S.P.A., A.M.D., W.J.B. и R.J.H. способствовал написанию рукописи.
Авторы переписки
Переписка с Санджив К. Наяк или Райнер Дж. Хеберт.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и принадлежности к организациям.
Дополнительные электронные материалы
Дополнительные методы
Права и разрешения
Открытый доступ формате, если вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения

