Температура плавления вольфрам: Температура плавления вольфрама
alexxlab | 03.05.2023 | 0 | Разное
Как правильно выбрать вольфрамовые электроды для TIG сварки
В настоящее время в качестве электрода для аргонодуговой сварки неплавящимся электродом (TIG) широко применяются шлифованные прутки длиной 175мм диаметром 1.0, 1.6, 2.4, 3.2, 4.0, 5.0 и 6.0мм, изготовленные из различных вольфрамовых сплавов.
Чистый вольфрам (W) применяется при сварке на переменном токе (АС) и маркируется зеленым цветом. Этого типа электроды производятся из чистого вольфрама, температура плавления чистого вольфрама 3400°С. Он используется для сварки алюминиевых сплавов, а рабочая поверхность электрода должна иметь сферическую форму.
Торированный вольфрам (ThW) применяется для сварки на постоянном токе (DС) и маркируется красным цветом. Этого типа электроды на протяжении десятков лет традиционно используют для сварки на постоянном токе коррозионно-стойких сталей, углеродистых сталей, меди, титана и подобных металлов. В последнее время эти электроды вызывают опасения у сварщиков из-за радиоактивности тория.
Цирконированный вольфрам (ZrW) применяется для сварки на переменном токе (AC), но может использоваться и для сварки на постоянном токе (DC) и маркируется белым цветом. Эти типы электродов применяют для сварки легких металлов таких как алюминий, магний и т д. Эти электроды дают несколько лучшие результаты, чем электроды из чистого вольфрама. Температура плавления цирконированного вольфрама около 3800°С.
Лантанированный вольфрам (LaW) применяется для сварки как на переменном, так и на постоянном токе (AC/DC), маркируется черным цветом. Эти электроды легированы 1% лантана. Их используют для сварки, как на переменном токе, так и на постоянном токе.Температура плавления лантанированного вольфрама около 4200°С.
Церированный вольфрам (CeW) применяется преимущественно для сварки на постоянном токе (DC), но может использоваться и для сварки на переменном токе (AC) маркируется серым цветом.
Не так давно фирма ESAB представила новую марку вольфрамовых электродов под названием Gold Plus. Этот электрод легирован 1,5 % лантана и обладает прекрасными сварочно-технологическими характеристиками. Это универсальный вольфрамовый электрод, который используется для сварки большинства материалов на постоянном токе, а также для сварки алюминия и магния на переменном токе. В этих электродах отсутствует торий, тем самым нет радиационной опасности, которая может причинить вред здоровью.
Отличительные особенности:
• Прекрасное возбуждение и повторное возбуждение дуги
• Большой срок службы
• Высокая несущая способность по току
• Непревзойденные характеристики в диапазоне малых токов
• Упакованы в пеналы с маркировкой ESAB
• Привлекательная цена
Приобрести электроды GOLD PLUS и познакомиться с подробной информацией о технике аргонно-дуговой сварки, об оборудовании и о сварочных материалах можно в ООО “Сварочная техника”.
Связаться
Werkstoff – Wolfram – Ankuro
Ihr Browser kann dieses Video nicht wiedergeben.
Dieser Film zeigt eine Demonstration des video-Elements.
Sie können ihn unter Link-Addresse abrufen.
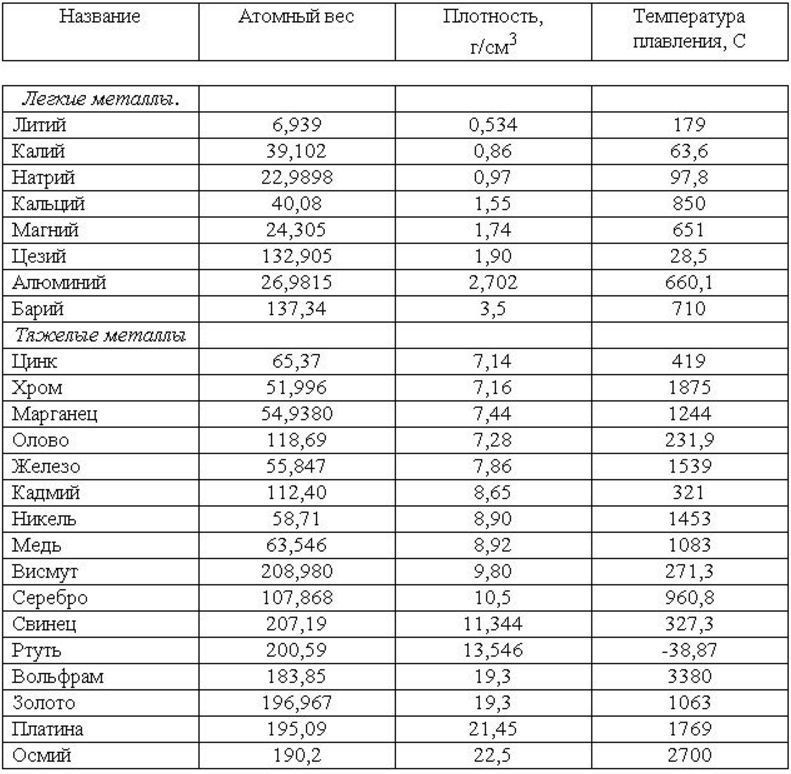
- Вольфрам имеет самую высокую температуру плавления среди металлов. Модуль упругости также очень высок. Механические свойства даже выше, чем у молибдена.
- Вольфрам имеет самый низкий коэффициент теплового расширения 4,5 мкм/(м-К)при 25°C из всех металлов.
- Вольфрам обладает хорошей коррозионной стойкостью к кислотам и жидким металлам
- Благодаря высокой плотности вольфрам обладает очень хорошими защитными свойствами против рентгеновских и гамма-лучей.
| Символ | W |
| Температура плавления | 3.422 °C |
| Плотность | 19,25g/cm³ (25°C) |
| Температура плавления | 3422°C |
| Модуль упругости | 405GPa |
| Коэффициент Пуассона | 0,28 |
- Как нить накала в осветительной технике, но сегодня уже не используется
- Для компонентов для высокотемпературных печей и жаропрочных сплавов
- В качестве мишеней для рентгеновского излучения
- Радиационная защита для различных типов излучения
- Для снарядов для пробивания брони
- Карбид Вольфрама WC или TC является очень твердым материалом и может использоваться для резки пластин для инструментов обработки металла и дерева
- Электроды для сварки TIG
| Название | Марка | Прочность g/cm³ | Предел прочности MPa | Предел текучести MPa | |
|---|---|---|---|---|---|
| 1 | Чистый вольфрам | 99,95/CP | 19,3 | 980 | 750 |
| 2 | WNiCu (W906Ni4Cu) сплав | Класс 1 | 17,0 | 650 | 520 |
| 3 | WNiFe (W92. 5Ni5.25Fe2.25) 5Ni5.25Fe2.25) | Класс 2 | 17,5 | 760 | 520 |
| 4 | WNiCu (W95Ni3.5Cu1.5) | Класс 3 | 18,0 | 650 | 520 |
| 5 | MAX AD 600MM MAX WD 125MM | Класс 4 | 18,5 | 690 | 520 |
| Продукция | Размеры | Стандарт | Примечания |
|---|---|---|---|
| Пруток | диаметр 2,0-320mm x 600mm | ASTM B777 | |
| Проволка для электр.. аппаратов и нитей | диаметр 0,025-3,5mm | ASTM F288 ASTM B288 | |
| Фольга | 0,05mm-0,10mm | ASTM B760 | |
| ист | 0,15mm-50mm | ASTM B760 | |
| Трубы | Внешний диаметр 0,5-150mm x Внутренний диаметр 0,07-13mm | ||
| Крепёж | M3-M20 | ASTM B777 | |
CuW электр. контакты контакты | ASTM B702 ASTM B631 |
- Тигель
- Пружины
- Винты
- Электроды, легированные: WT (Th02), WL (La2O3), WC (CeO2), WZ (ZrO2), WY (Y2O3), WX
Вольфрамовый элемент | Прочный элемент Вольфрам
Знакомство с вольфрамомЭлемент вольфрам представляет собой серебристо-серый переходный металл. Вольфрам известен своей удивительно высокой температурой плавления и невероятной прочностью на растяжение по сравнению с другими чистыми металлами. Из-за этих качеств мы часто используем вольфрам для производства промышленного оборудования и инструментов.
10 забавных фактов о вольфраме- Вольфрам обладает удивительно высокой радиационной стойкостью.
- По сравнению со всеми другими металлами вольфрам является вторым по твердости после хрома.
- Вольфрам имеет самую высокую температуру плавления (3422°C) среди всех элементов периодической таблицы.

- Вольфрам удивительно плотный. Он имеет плотность чуть выше, чем у золота, и занимает пятое место по плотности среди всех переходных металлов.
- При воздействии кислорода на поверхности кристаллов вольфрама образуется оксидный слой, который может иметь радужный цвет, похожий на висмут.
- Вольфрам — один из двух элементов, теоретически способных образовывать шестикратные связи. В частности, эти связи существуют в W 2 , двухатомной газообразной форме вольфрама, которая образуется только при температуре выше точки кипения 5930°C. Эта связь включает две сигма-, две пи- и две дельта-связи и возможна только благодаря уникальной конфигурации электронов вольфрама.
- Название «вольфрам» означает «тяжелый камень» на шведском языке, и это название первоначально служило шведским термином для минерала шеелита, руды, в состав которой входит вольфрам.
- Его символ в периодической таблице W относится не к названию «вольфрам», а скорее к названию «вольфрам».
 В немецком, испанском и многих славянских языках «вольфрам» — это название элемента, в то время как «вольфрам» вместо этого используется носителями английского и французского языков.
В немецком, испанском и многих славянских языках «вольфрам» — это название элемента, в то время как «вольфрам» вместо этого используется носителями английского и французского языков. - В большинстве организмов вольфрам может оказывать токсическое воздействие. В частности, вольфрам может заменить кофакторы молибдена или меди в некоторых реакциях, катализируемых ферментами.
- Интересно, что некоторые виды бактерий научились использовать вольфрам для катализа некоторых окислительно-восстановительных реакций.
Вольфрам имеет атомный символ W с атомным номером 74. Он расположен в d-блоке периодической таблицы, с танталом слева и рением справа. Вольфрам занимает третье место в группе 6 периодической таблицы вместе с хромом, молибденом и сиборгием. Вольфрам имеет электронную конфигурацию [Xe]4f 14 5d 4 6s 2 . Кроме того, элемент имеет электроотрицательность 2,36 по шкале Полинга.
Благодаря своей исключительной прочности на растяжение (1510 МПа), высокой температуре плавления (3422 °C) и коррозионной стойкости вольфрам служил важным компонентом тяжелого вооружения в начале 20 века. С сплавом, обогащенным вольфрамом, заводы могли бы производить оружие, которое могло бы выдерживать более сильные внутренние взрывы, чтобы стрелять более крупными полезными нагрузками на большие расстояния.
В частности, во время Первой мировой войны спрос европейских великих держав на производство артиллерии сделал вольфрам невероятно дорогим. Вольфрам продавался по более высокой цене за единицу массы, чем золото или серебро. Поскольку он оставался нейтральным на протяжении большей части войны, обе стороны конфликта обращались к США за покупкой вольфрама. На американском Западе существовало много вольфрамовых рудников США, и соседние с ними сельские города стали невероятно оживленными и богатыми. Однако после войны цена на вольфрам упала, оставив после себя города-призраки, такие как Вольфрам, штат Колорадо.
Во время Второй мировой войны спрос на вольфрам снова резко возрос. Британская империя заблокировала торговлю военными материалами с нацистской Германией, включая вольфрамовую руду. Это торговое эмбарго распространялось на остальные союзные державы, а также на нейтральных подписантов, включая Португалию. В то время в Португалии была репрессивная военная диктатура под руководством Антониу де Оливейра Салазара. Однако Салазар симпатизировал нацистской Германии, хотя и хотел поддерживать отношения с Великобританией. Получив щедрые суммы из Германии, Салазар тайно торговал вольфрамовой рудой из Северной Португалии с Германией. Португальская руда неизбежно помогала создавать оружие, которое нацистская Германия использовала для ведения войны, что стало непреходящим наследием Португалии во время Второй мировой войны9.0007
Применение вольфрама в современном мире Для чего используется вольфрам? Как упоминалось ранее, полезность вольфрама в современном мире обусловлена его замечательной прочностью на растяжение и температурой плавления.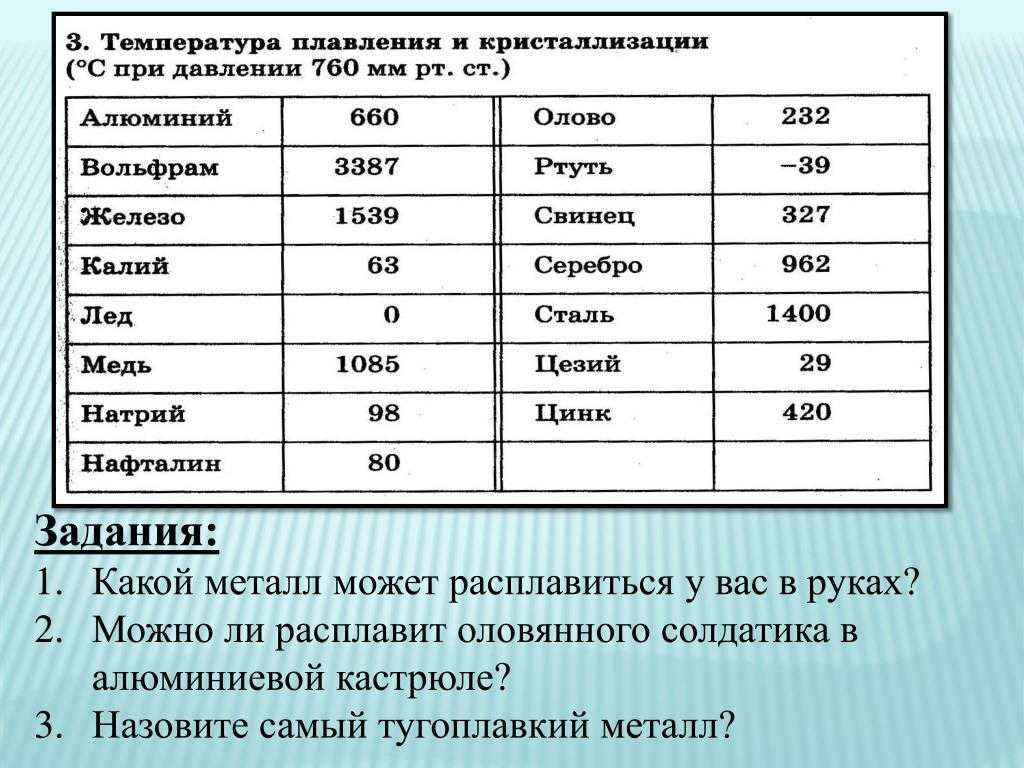 Вольфрам часто можно найти в проволоке, стержнях и инструментах с высокими нагрузками, используемых в промышленности. Обычные инструменты с высоким содержанием вольфрама включают пилы, сверла и горнодобывающее оборудование. Кроме того, вольфрамовые нити и электроды широко используются в электронике, например, в лампочках и телевизионных дисплеях. Ионы вольфрама также можно использовать в новых методах химического катализа и синтеза.
Вольфрам часто можно найти в проволоке, стержнях и инструментах с высокими нагрузками, используемых в промышленности. Обычные инструменты с высоким содержанием вольфрама включают пилы, сверла и горнодобывающее оборудование. Кроме того, вольфрамовые нити и электроды широко используются в электронике, например, в лампочках и телевизионных дисплеях. Ионы вольфрама также можно использовать в новых методах химического катализа и синтеза.
Вольфрамовые сплавы обладают множеством уникальных качеств, которые делают их идеальными для целого ряда применений. (См. ниже).
Где добывают вольфрам? Вольфрам — довольно редкий металл, если его можно найти в природе на Земле. Как правило, металл входит в состав минералов шеелита и вольфрамита. В обеих этих рудах вольфрам встречается в составе ионного вольфрамата (WO 4 2-). В вольфрамите вольфрамат ионно связывается с катионами железа и магния, а в шеелите вольфрамат связывается с катионами кальция. Другие минералы с вольфрамом, как правило, очень редки.
Другие минералы с вольфрамом, как правило, очень редки.
Большинство мировых запасов вольфрама находится в Китае, хотя в Канаде, России, Вьетнаме, Боливии и Португалии также имеются значительные месторождения вольфрама.
Когда и как был открыт вольфрам?Теперь историки признают, что Карл Вильгельм Шеель, шведский химик, открыл «вольфрамовую кислоту» из руды, называемой «вольфрам», в 1781 году. Позже эта руда получила название «шеелит» в честь химика. Название «вольфрам» было применено именно к новому элементу после того, как он был выделен из кислотного вещества Шееле.
Однако в 1783 году два испанских химика (которые также были братьями) по имени Фаусто и Хосе Эльхуяр обнаружили такое же кислотное вещество из вольфрамита. После того, как элемент был выделен из кислоты, этот элемент получил название «вольфрам». Испанские власти приписали братьям открытие нового элемента, а Шееле получил признание за свое открытие намного позже. Из-за проблемного открытия вольфрам до сих пор сохраняет букву «W» в качестве атомного символа.
Из-за проблемного открытия вольфрам до сих пор сохраняет букву «W» в качестве атомного символа.
Ученые-материаловеды создали множество полезных сплавов с вольфрамом, в том числе:
- Вольфрам-никель-железо: этот сплав сохраняет прочность и температуру плавления вольфрама, а также имеет низкий коэффициент теплового расширения. Низкое расширение делает его идеальным для герметизации стекла к металлу. Кроме того, он имеет более высокую радиационную защиту, чем свинец, но при этом не токсичен для биологических систем, что делает его идеальным для защиты от радиации.
- Вольфрам-железо-углерод: Преимущество этого сплава в том, что он выдерживает невероятно высокие температуры без потери твердости. В результате металлурги используют его в основном в пилах и сверлах, изделиях, которые испытывают сильное трение на высоких скоростях. Из-за его преимущественных качеств при высокоскоростном трении металлурги называют его «быстрорежущей сталью».

- Вольфрам-никель-медь: этот сплав обладает многими качествами вольфрама-никеля-железа, помимо высокой электропроводности и немагнитности. Это делает сплав идеальным для высокотехнологичного электрооборудования, в том числе военной и медицинской техники.
- Вольфрам-тантал: Этот сплав также имеет высокую температуру плавления, в дополнение к высокой стойкости к растяжению и коррозии. В результате он имеет тенденцию хорошо работать в средах с высокой степенью коррозии, например, в космических кораблях, атомных электростанциях и печах.
Известные соединения вольфрама включают:
- Карбиды вольфрама (WC, W 2 C): это соединение обладает высокой твердостью и жесткостью и часто используется в промышленных инструментах, а также в ювелирных изделиях. .
- Галогениды вольфрама (WF 6 , WCl 6 , W 6 Cl 18 и т.
 д.): эти соединения относительно легко образуются из элементарного вольфрама. Химики склонны использовать их для получения более ценных соединений вольфрама.
д.): эти соединения относительно легко образуются из элементарного вольфрама. Химики склонны использовать их для получения более ценных соединений вольфрама.
Анион вольфрамата (WO 4 2-): это наиболее распространенная свободная ионная форма вольфрама. Это также преобладающая форма, встречающаяся в природе в сочетании с катионом другого металла.
Анион вольфрамаГексакарбонил вольфрама (W(CO) 6 ): Этот вольфрамовый комплекс включает шесть лигандов монооксида углерода, взаимодействующих с вольфрамом. Это соединение имеет важное значение как предшественник первого синтезированного диводородного комплекса, который включает интактный h3 в качестве лиганда.
Вольфрамовый гексакарбониловый комплексХимики обнаружили, что вольфрам имеет тенденцию проявлять небольшую реакционную способность в большинстве условий. Однако была обнаружена пара полезных реакций с участием элементарного вольфрама:
- Галогенирование: включает реакцию элементарного вольфрама с двухатомным галогеном.
 Это может происходить при комнатной температуре с F 2 , но для реакции с Cl 2 требуется значительное количество тепла (250°C). В результате получается галогенид вольфрама. Эта реакция имеет важное значение, поскольку галогениды вольфрама могут реагировать с образованием карбида вольфрама или комплексных солей вольфрама.
Это может происходить при комнатной температуре с F 2 , но для реакции с Cl 2 требуется значительное количество тепла (250°C). В результате получается галогенид вольфрама. Эта реакция имеет важное значение, поскольку галогениды вольфрама могут реагировать с образованием карбида вольфрама или комплексных солей вольфрама.
W + 3F 2 → WF 6
W + 3Cl 2 → WCl 6
6W + 6Cl 2 → W 6 Cl 12
- Reaction with Oxygen: Это включает реакцию элементарного вольфрама с двухатомным кислородом с образованием триоксида вольфрама (WO 3 ). Как и в случае с хлором, для этого требуются высокие температуры. В основных условиях триоксид вольфрама образует вольфрамат (WO 4 2-).
2W + 3O 2 → WO 3
Выделение вольфрамового элемента Как упоминалось ранее, вольфра CaWO 4 ). Для извлечения элементарного вольфрама из руды соединение вольфрамата превращается в оксид вольфрама (IV) (WO 3 ). Затем этот продукт нагревают для получения порошкообразного элементарного вольфрама.
Для извлечения элементарного вольфрама из руды соединение вольфрамата превращается в оксид вольфрама (IV) (WO 3 ). Затем этот продукт нагревают для получения порошкообразного элементарного вольфрама.
Степени окисления вольфрама включают:
- Вольфрам(II): W 2+ , W 2 C
- Вольфрам(III): W 3+ , W 6 Cl 18
- Вольфрам(IV): W 4+ , WC
- Вольфрам(V): W 5+ , WCl 5
- Вольфрам(VI): W 6+ , WO 4 2- , WO 3
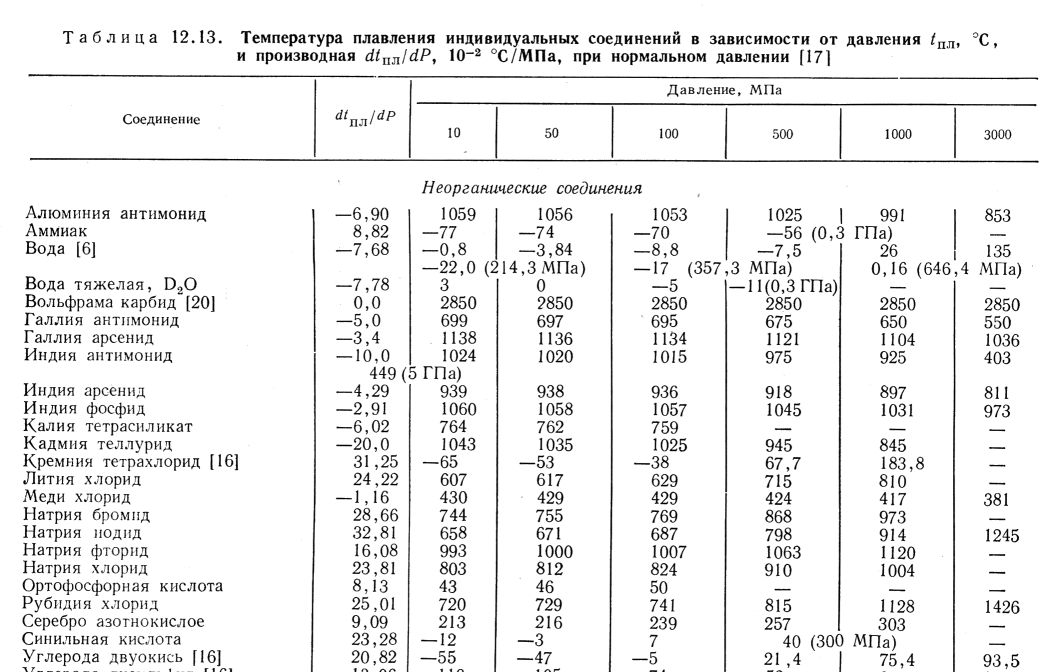
- Атомный символ: W
- Температура плавления: 3695К; 3422°С; 6192°F
- Температура кипения: 6203К; 5930°С; 10706°F
- Плотность: 19,26 г/мл
- Атомный вес: 183,84
- Атомный номер: 74
- Электроотрицательность: 2,36
- Молярная теплоемкость: 24,27 Дж/(моль*К)
- Классификация: переходный металл
- Естественное содержание в земной коре: 1,5 ppm
- Конфигурация электронной оболочки: [Xe]4f 14 5d 4 6с 2
- Стабильные изотопы: 180, 181, 182, 183, 184, 186
- Встречается в природе в минералах: вольфрамите, шеелите, ферберите, хюбнерите
- Токсичность: Умеренно токсичен
Продавцы большинства других металлов также продают вольфрам, часто в виде карбида вольфрама или какого-либо сплава.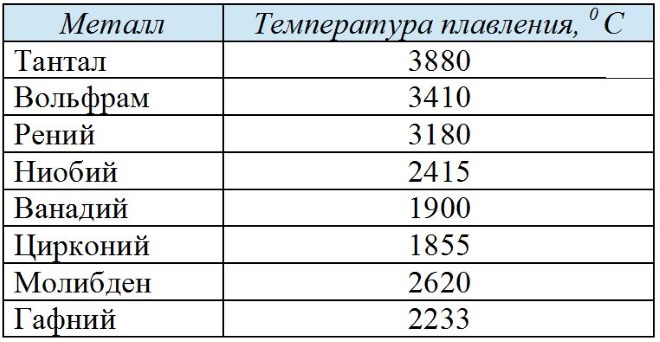 Интернет-магазины также продают элементарный вольфрам по цене от 2 долларов за грамм.
Интернет-магазины также продают элементарный вольфрам по цене от 2 долларов за грамм.
Какова температура плавления вольфрама?
5 декабря 2022 г. 5 декабря 2022 г. | 17:51
Вы когда-нибудь задумывались, какова температура плавления вольфрама? Вольфрам, также известный как вольфрам, представляет собой металл с чрезвычайно высокой температурой плавления — настолько высокой, что это один из немногих материалов, пригодных для использования в качестве нити накала в лампочках. Давайте поближе познакомимся с этим уникальным материалом и его впечатляющей температурой плавления.
Атомная структура вольфрама
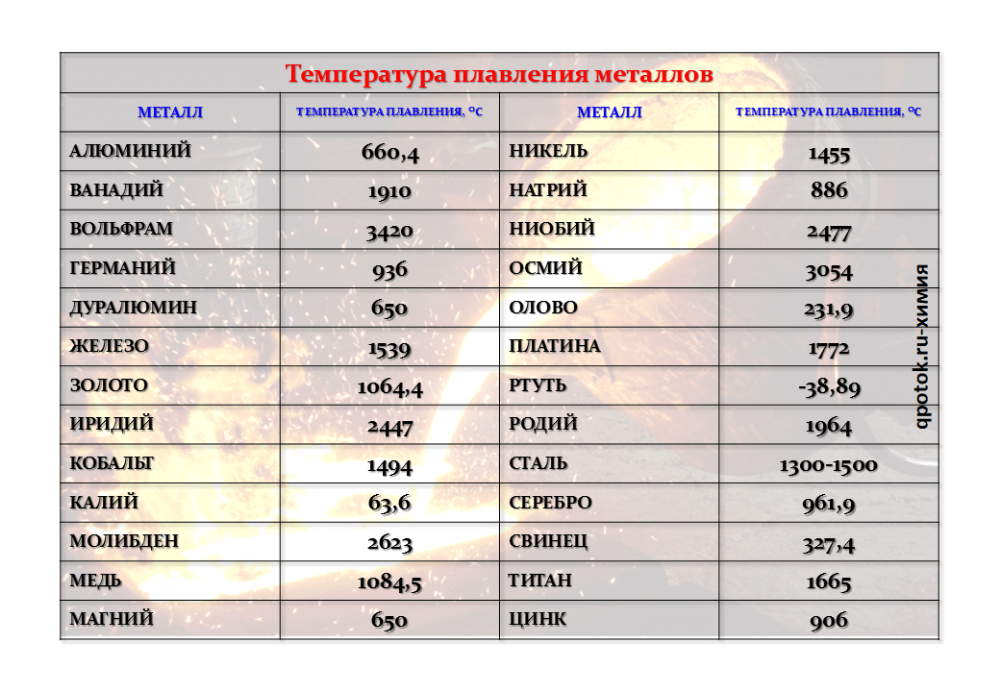
Металлический вольфрам состоит из атомов, соединенных прочными ковалентными связями, обладающими высокой устойчивостью к разрушению. Это придает вольфраму его невероятную прочность, но это также означает, что требуется огромное количество энергии, чтобы разорвать эти связи и расплавить металл.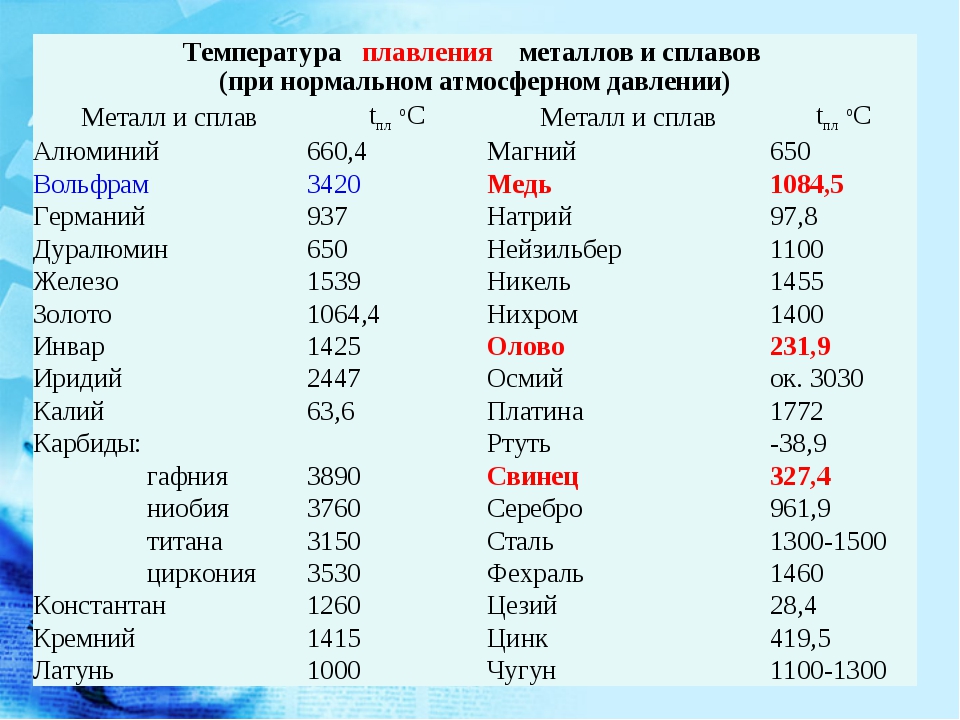 В результате вольфрам имеет невероятно высокую температуру плавления — впечатляющие 3422°C (6192°F). Это более чем в два раза превышает температуру плавления железа (1538°C или 2800°F), и даже выше температуры кипения некоторых металлов.
В результате вольфрам имеет невероятно высокую температуру плавления — впечатляющие 3422°C (6192°F). Это более чем в два раза превышает температуру плавления железа (1538°C или 2800°F), и даже выше температуры кипения некоторых металлов.
Почему вольфрам такой особенный?
Причина, по которой вольфрам имеет такую высокую температуру плавления, заключается в том, что его атомная структура делает его очень устойчивым к теплу и другим формам энергии. Это сопротивление делает вольфрам идеальным для использования в приложениях, где распространены экстремальные температуры, таких как компоненты печей, сварочные электроды и даже нити накаливания ламп! Он также невероятно плотный, что делает его полезным для приложений, где вес не имеет значения, но имеет значение прочность.
Вольфрам — удивительный металл, хорошо известный благодаря неизменно высокой температуре плавления его сплавов. Температура плавления вольфрама по Цельсию составляет 3422 ° C или 6 192 ° F.


 В немецком, испанском и многих славянских языках «вольфрам» — это название элемента, в то время как «вольфрам» вместо этого используется носителями английского и французского языков.
В немецком, испанском и многих славянских языках «вольфрам» — это название элемента, в то время как «вольфрам» вместо этого используется носителями английского и французского языков.
 д.): эти соединения относительно легко образуются из элементарного вольфрама. Химики склонны использовать их для получения более ценных соединений вольфрама.
д.): эти соединения относительно легко образуются из элементарного вольфрама. Химики склонны использовать их для получения более ценных соединений вольфрама. Это может происходить при комнатной температуре с F 2 , но для реакции с Cl 2 требуется значительное количество тепла (250°C). В результате получается галогенид вольфрама. Эта реакция имеет важное значение, поскольку галогениды вольфрама могут реагировать с образованием карбида вольфрама или комплексных солей вольфрама.
Это может происходить при комнатной температуре с F 2 , но для реакции с Cl 2 требуется значительное количество тепла (250°C). В результате получается галогенид вольфрама. Эта реакция имеет важное значение, поскольку галогениды вольфрама могут реагировать с образованием карбида вольфрама или комплексных солей вольфрама.