Термообработка образцов: термообработка образцов
alexxlab | 31.05.2023 | 0 | Разное
термообработка образцов
№ п/п | Размер образца, мм | Режим термообработки | Температура нагрева, С | Выдержка в печи, час | Условия охлаждения | Примечание |
1 | 300500 | Исходное состояние | – | – | – | – |
2 | 300500 | Низкий отпуск | 250-300 | 0,5 | на воздухе | Перераспределение
собственных напряжений, незначительное
повышение пластических свойств без значительных потерь уровня
прочностных характеристик. |
3 | 300500 | Средний отпуск | 350-400 | 0,5 | на воздухе | Способствует формированию мелкодисперсной структуры. Незначительное снижение прочности и повышение пластических свойств |
4 | 300500 | Высокий отпуск | 600-650 | 1,0 | с печью | Для сварных соединений полное снятие ОСН, закалки металла шва и ЗТВ. Прочность незначительно снижается, пластичность и ударная вязкость существенно повышаются. |
5 | 300500 | В межкритическом интервале температур (Ас1-Ас3) | 750-780 | 5,0 | с печью | Вызывает
процесс неполной перекристаллизации,
частичное измельчение крупнозернистой
структуры. |
6 | 300500 | Нормализация | 900-930 | 0,5 | на воздухе | Для получения однородной структуры с измельченным зерном. Незначительное повышение прочности и существенное повышение пластичности и ударной вязкости |
Режимы термообработки темплетов из трубы Æ1420х15,7 мм
Макс.размер образцов для печи 300600 мм, макс.температура нагрева печи 1070С
Соседние файлы в папке От Муравьева
- #
12.03.2015236.03 Кб7Механические ипытания.doc
- #
12.
 03.2015121.74 Кб7Сварка образцов KCV_2.docx
03.2015121.74 Кб7Сварка образцов KCV_2.docx - #
12.03.201523.78 Кб7термообработка образцов.docx
- #
12.03.2015715.35 Кб9Технический акт проведение работ по микроструктурному анализу.pdf
- #
12.03.201520.75 Кб9ударная ИжГТУ стр шум.xlsx
Термообработка различных металлов. Термообработка стали. Режимы термообработки
Термообработка металла и всевозможных его сплавов представляет собой совокупность процессов, воздействующих на материал и меняющих его характеристики. К данной обработке относятся операции по нагреву, выдержке и охлаждению. Повышенные температуры или ее резкие перепады влияют на структуру образцов. Для проведения испытаний и исследований применяют специальный сушильный шкаф или печь.
Термообработка металла требуется для увеличения его свойств, таких как прочность, твердость и т. д.
д.
История термообработки стали и других металлов
Развитие термообработки стали и прочих материалов началось в древние времена. Для закалки применялись примитивные, но при этом эффективные методы. Раскаленные поверхности погружали в разные жидкости:
- Воду.
- Масло.
- Вино.
Постоянно досконально изучались свойства материалов, изменялись способы воздействия на них. Вначале XIX чугун стали помещать в емкости, наполненные льдом, которые засыпали сахаром. После того как поверхности в течение 20 часов прогревались можно было начинать ковку. Такая долгая процедура была необходима для того, чтобы не повредить хрупкую структуру.
Сегодня применяют специализированные трубчатые, шахтные печи для термообработки валов и прочих деталей, другие типы оборудования.
Основной принцип термообработки металловВ середине XIX в. Д. К. Чернов подтвердил посредством испытаний, что при смене температур металл способен изменять свои первоначальные свойства
Термообработка металла выполняется строго определенный период. Общее время воздействия приравнивается к сумме:
Общее время воздействия приравнивается к сумме:
- Собственного нагрева до определенной отметки.
- Времени, которое материал проводит максимально нагретым.
Показатели термообработки (ГОСТ) индивидуальны и варьируются в зависимости от:
- Разновидности печи.
- Размера детали.
- Типа материалов.
- Скорости фазных превращений свойств сплавов.
При слишком длительном термовоздействии на образец происходит обезуглероживание, как следствие – хрупкость и снижение прочности детали
Режимы термообработки, их особенности
Режимы термообработки можно разделить на три основные группы. Каждую определяет способ воздействия на материал:
- Термический (только температурой).
- Термомеханический (температурой и пластическими деформациями).
- Термохимический (температурой и химическими веществами).

Также выделяют низко- и высокотемпературную обработку. В зависимости от необходимого эффекта используют камерные, шахтные, муфельные печи электрические и т.д.
Виды термообработки различных металлических деталей и образцовЕсли рассматривать виды термообработки, можно выделить:
1.ОтжигДеталь нагревается до определенной температуры и выдерживается в печи. После этого ее медленно охлаждают. Такой метод дает возможность улучшить структурные свойства сплава, снижает его твердость. Также он способствует образованию зернистости.
2. ЗакалкуОтжиг обеспечивает гладкость фактуры, устраняет неровности
Закаливание – процесс термообработки, при котором образец нагревают до оптимальной температуры, выдерживают нужное время и быстро охлаждают. Эта методика придает стали прочность и жесткость. С ее помощью снижают пластичность металла.
Во время закалки нужно внимательно следить за мощностью нагрева и скоростью остывания сплава
3.
 Отпуск
ОтпускПрименяется на завершающем этапе обработки. Поверхность нагревается и охлаждается с разной скоростью. Он помогает формировать структуру, закрепляет определенные свойства.
Управлять процессами можно при помощи терморегулятора, для выставления циклов используются программируемые модули
Печи для термообработки металлов и сплавов
Печи для термообработки (горизонтальные, вертикальные и т.д.) применяются в лабораториях, цехах и мастерских, заводах. Подобрать оборудование можно учитывая производственные мощности, технологию и прочие особенности работы.
Оборудование для термической обработки может быть выполнено с естественной или принудительной конвекцией
Печи для термообработки металла можно разделить на:
- Индукционные. Нагрев и выделение жара происходит при движении тока через металлические детали в тигле.

- Дуговые. Источником тепла служит переменный или постоянный ток, напряжение образуется при возникновении заряда между графитовыми электродами и металлом.
- Газовые. Выполняются из материалов с высокими изоляционными свойствами.
- Электрические. Наиболее распространены модели с нихромовыми пластинами, обеспечивающими быстрый и равномерный прогрев образцов.
- Муфельные. Обрабатываемые детали защищены от повреждений нагревательными элементами при помощи муфеля.
Лабораторные и промышленные печи для термообработки легко разделить на категории, по характеристикам приборов. Учитывается объем камеры, максимальная мощность, тип конвекции, способ загрузки и прочее.
Современные печи для термообработки металлов характеризуются экономным потреблением электроэнергии
Вы можете приобрести электропечи для плавки алюминия и других сплавов, для выполнения задач в различных сферах деятельности. Звоните, подробнее о специфике работы с образцами расскажут специалисты ООО ТД «Лабор»!
Звоните, подробнее о специфике работы с образцами расскажут специалисты ООО ТД «Лабор»!
ТЕРМООБРАБОТКА СТАЛИ И КОНЕЧНЫЕ СВОЙСТВА
ТЕРМООБРАБОТКА СТАЛИ И КОНЕЧНЫЕ СВОЙСТВАТЕРМООБРАБОТКА СТАЛИ И ПОЛУЧАЕМЫЕ СВОЙСТВА
1. Введение
Должно стать ясно, что свойства материалов зависят от предварительной обработки. В частности, различные термообработки для данного стального сплава позволяют получить ряд альтернативных микроструктур, которые, в свою очередь, влияют на механические свойства стали. В этой лабораторной работе мы исследуем несколько (из бесконечного набора возможностей) температур и времен отпуска, чтобы определить их влияние на механические свойства среднеуглеродистой стали. Механические свойства исследуются с использованием как испытаний на твердость, так и испытаний на вязкость разрушения. Взаимосвязь между этими свойствами также будет рассмотрена.
2. Термическая обработка
Общее представление о процессах термической обработки стали должно быть получено из информации, содержащейся в примечаниях к классу и справочных чтений [1-3]. Для стали существует ряд различных термообработок, в зависимости от микроструктуры и свойств, которые должна получить сталь. Образцы аустенизируют в аустенитной области фазовой диаграммы железо-углерод, а затем охлаждают (или закаливают) с различной скоростью. Различные скорости охлаждения приводят к различным микроструктурам. Медленное охлаждение из аустенитной области способствует образованию перлита, продукта равновесного превращения. Очень высокие скорости охлаждения подавляют зависящее от времени превращение в перлит и приводят к развитию мартенситных структур, которые обычно являются твердыми и хрупкими. Затем эти структуры подвергаются дальнейшей обработке путем «закалки» стали. Отпуск заключается в повторном нагреве образцов до умеренных температур в течение определенного интервала времени для достижения желаемых механических свойств. Температуры печи и время отпуска должны быть определены экспериментально, чтобы оптимизировать интересующие механические свойства.
Для стали существует ряд различных термообработок, в зависимости от микроструктуры и свойств, которые должна получить сталь. Образцы аустенизируют в аустенитной области фазовой диаграммы железо-углерод, а затем охлаждают (или закаливают) с различной скоростью. Различные скорости охлаждения приводят к различным микроструктурам. Медленное охлаждение из аустенитной области способствует образованию перлита, продукта равновесного превращения. Очень высокие скорости охлаждения подавляют зависящее от времени превращение в перлит и приводят к развитию мартенситных структур, которые обычно являются твердыми и хрупкими. Затем эти структуры подвергаются дальнейшей обработке путем «закалки» стали. Отпуск заключается в повторном нагреве образцов до умеренных температур в течение определенного интервала времени для достижения желаемых механических свойств. Температуры печи и время отпуска должны быть определены экспериментально, чтобы оптимизировать интересующие механические свойства.
3. Испытание на твердость по Роквеллу C
Испытание на твердость по Роквеллу C
Термин «твердость» представляет собой сопротивление материала необратимому повреждению из-за внешнего механического воздействия. Существует ряд альтернативных методов измерения твердости, но одним из наиболее удобных методов является испытание на твердость по Роквеллу. В этой процедуре твердость различных материалов измеряется относительно произвольной шкалы. Существует несколько доступных шкал, и из них шкала Роквелла С будет использоваться для стальных образцов в этой лаборатории. Твердость может быть связана с пределом прочности материалов на растяжение (с некоторыми сложными расчетами), и, поскольку твердость гораздо проще измерить, этот тест часто используется вместо более сложной процедуры испытания на растяжение.
После калибровки и выбора подходящей шкалы для измерения образец помещается на опорную пластину твердомера под алмазным индентором, и автоматически прикладывается нагрузка, вдавливающая индентор в образец. Твердость образца появляется на цифровом дисплее; опять же, это измерение относится к шкале С Роквелла. Твердые материалы имеют более высокую твердость по Роквеллу, чем более мягкие материалы.
Твердость образца появляется на цифровом дисплее; опять же, это измерение относится к шкале С Роквелла. Твердые материалы имеют более высокую твердость по Роквеллу, чем более мягкие материалы.
Рекомендации для воспроизводимых результатов испытаний на твердость [2]:
1. Индентор и наковальня должны быть чистыми и хорошо сидеть.
2. Испытываемая поверхность должна быть чистой и сухой, гладкой и свободной от оксидов. Шероховатая поверхность земли обычно подходит для теста Роквелла.
3. Поверхность должна быть плоской и перпендикулярной индентору. (Это означает, что вы НЕ должны тестировать сторону на 180 градусов, противоположную ранее протестированной стороне!)
4. Испытания на цилиндрических поверхностях дадут низкие показания, погрешность зависит от кривизны, нагрузки, индентора и твердости материала. Поправки приведены в ASTM E140-78
5. Толщина образца должна быть такой, чтобы на обратной стороне образца НЕ образовывались отметины или выпуклости. Рекомендуется, чтобы толщина не менее чем в десять раз превышала глубину вмятины. Испытания следует проводить только на одной толщине материала.
Рекомендуется, чтобы толщина не менее чем в десять раз превышала глубину вмятины. Испытания следует проводить только на одной толщине материала.
6. Расстояние между углублениями должно в три-пять раз превышать диаметр углубления. (Можно сделать несколько показаний, чтобы найти среднее значение.)
7. Скорость приложения нагрузки должна быть стандартизирована. (Это для нашего оборудования.)
4. Испытание на ударную вязкость по Шарпи
Два типа стандартизированных испытаний на ударный стержень с надрезом обычно используются для определения склонности материала к хрупкому поведению. Испытания на удар по Шарпи предпочтительнее испытаний по Изоду, где различия заключаются в геометрии образцов и испытаний. Испытания на удар выявляют различия в пластично-хрупком поведении материалов таким образом, который трудно обнаружить при стандартных испытаниях на растяжение. Однако результаты испытаний на стержнях с надрезом нелегко выразить с точки зрения требований к конструкции, и нет общего согласия в отношении интерпретации или значимости результатов, полученных в результате этого типа испытаний. Тем не менее испытание на удар по Шарпи остается важным методом для характеристики механического поведения материалов.
Тем не менее испытание на удар по Шарпи остается важным методом для характеристики механического поведения материалов.
Размеры образца показаны на рис. 8.16 в вашем тексте. Надрез расположен в центре испытательного стержня. Образец поддерживается горизонтально в двух точках, а затем на него воздействует маятник с удельным весом со стороны, противоположной надрезу. Образец разрушается (ломается) при изгибе под действием этого удара. Основным показателем испытания на удар является энергия, поглощаемая при разрушении образца. Эта энергия измеряется разницей в потенциальной энергии, опять же с использованием относительной шкалы в футо-фунтах. Материалы, которые показывают 0 фут-фунтов поглощенной энергии, указывают на то, что материал очень легко сломать: он демонстрирует хрупкое разрушение. В качестве альтернативы материалы, которые поглощают энергию (энергия > 0 ft-lbs) во время разрушения, будут демонстрировать пластичное поведение.
5. Эксперименты
Эксперименты
Образцы для термообработки: сталь 1095. Образцы для испытаний по Шарпи с соответствующей маркировкой
А – При получении
B – Аустенизация (870°C, 15 мин.) + закалка водой
C – Аустенитизированный (870C, 15 мин.) + Воздушное охлаждение
D – Аустенизация (870°C, 15 мин.) + закалка в воде + отпуск @ ________ для _______
E – Аустенизация (870°C, 15 мин) + закалка в воде + отпуск @ ________ для _______
Испытание на твердость по Роквеллу C (Rc)
Измерьте среднюю твердость по 5 точкам на каждой из двух соседних сторон каждого образца.
Испытание на ударную вязкость по Шарпи
Определите энергию разрушения в фут-фунтах, необходимую для разрушения каждого образца.
6. Назначение
Используя информацию из обо всех образцах, подвергнутых термообработке и механическим испытаниям, составьте серию графиков, которые показывают тенденции и отношения между временем отпуска, температурами отпуска, твердостью и ударной вязкостью. Используя стандартный формат лабораторного отчета, обсудите обоснование этих результатов, основанных на теории фазовых превращений. Мартенсит и чугун — твердые и хрупкие материалы. Объясните разницу в вашем рассуждении. Во введении дайте краткое описание системы классификации простых углеродистых сталей.
Используя стандартный формат лабораторного отчета, обсудите обоснование этих результатов, основанных на теории фазовых превращений. Мартенсит и чугун — твердые и хрупкие материалы. Объясните разницу в вашем рассуждении. Во введении дайте краткое описание системы классификации простых углеродистых сталей.
Ссылки:
1. G. E. Dieter, Mechanical Metallurgy , McGraw-Hill, Inc., США 1976.
2. М. А. Мейерс и К. К. Чавла, Механическая металлургия: принципы и приложения , Prentice-Hall, Inc., Englewood Cliffs, NJ, 1984.
3. В. Д. Каллистер, Материаловедение и инженерия: введение , John Wiley & Sons, Inc., NY, NY, 1994, стр. 292-304, 312-316, 352-364.
Диаграмма сбора данных
Тип стали: 1095
| Данные образца | Закалка | Температура отпуска | Время отпуска | Твердость | Прочность |
А | |||||
Б | |||||
С | |||||
Д | |||||
Е | |||||
Тепловая обработка перед исследованием позволяет выявить антиген Dirofilaria immitis в сыворотке крови кошек | Паразиты и переносчики
- Исследования
- Открытый доступ
- Опубликовано:
- Susan E Little 1 ,
- Melissa R Raymond 1 ,
- Jennifer E Thomas 1 ,
- Jeff Gruntmeir 1 ,
- Joe A Hostetler 2 ,
- James H Meinkoth 1 и
- …
- Байрон Л. Блэгберн 3
Паразиты и переносчики том 7 , номер статьи: 1 (2014) Процитировать эту статью
6757 Доступ
133 Цитаты
1 Альтметрика
Сведения о показателях
Abstract
История вопроса
Диагностика инфекции Dirofilaria immitis у кошек осложняется трудностями, связанными с надежным определением антигена в образцах кошачьей крови и сыворотки.
Методы
Чтобы определить, может ли образование комплекса антиген-антитело мешать обнаружению антигена в образцах кошачьих, мы оценили эффективность четырех различных коммерчески доступных тестов на сердечного червя с использованием образцов сыворотки от шести кошек, экспериментально инфицированных D. immitis и подтверждено наличие небольшого количества взрослых червей (среднее = 2,0). Сыворотки, собранные через 168 (n = 6), 196 (n = 6) и 224 (n = 6) дней после инфицирования, тестировали как непосредственно, так и после тепловой обработки.
Результаты
Антиген был обнаружен в образцах сыворотки от 0 или 1 из 6 инфицированных кошек с использованием анализов в соответствии с указаниями производителя, но после термической обработки образцов сыворотки у 5 из 6 кошек обнаруживался антиген через 6–8 месяцев после инфекционное заболевание. Антитела к D. immitis были обнаружены у всех шести инфицированных кошек с помощью коммерческого анализа в клинике и в референс-лаборатории.
Выводы
Эти результаты показывают, что термическая обработка образцов перед тестированием может улучшить чувствительность тестов на антигены у кошачьих пациентов, поддерживая более точную диагностику этой инфекции у кошек. Обследования, проведенные с помощью тестирования на антигены без предварительной термической обработки образцов, вероятно, недооценивают истинную распространенность инфекции у кошек.
Исходная информация
Обнаружение антигена Dirofilaria immitis является чувствительным и специфическим методом диагностики сердечного червя у собак, но эти тесты считаются гораздо менее надежными у кошек [1–3]. Отсутствие обнаружения антигена у кошек было связано с низкой циркулирующей антигенемией из-за небольшого количества гельминтов, часто наблюдаемых при кошачьих инфекциях, более высокой вероятности заражения только самцами и задержкой развития взрослых особей D. immitis у аберрантного хозяина [4]. –6]. Считается, что у собак эти тесты способны выявлять инфекции всего у 1–3 взрослых самок 9.0102 D. immitis [1, 7].
–6]. Считается, что у собак эти тесты способны выявлять инфекции всего у 1–3 взрослых самок 9.0102 D. immitis [1, 7].
Когда впервые были разработаны анализы на основе антигенов для обнаружения D. immitis у собак, перед тестированием сыворотку предварительно обрабатывали нагреванием и/или ЭДТА для разрушения иммунных комплексов, поскольку было установлено, что комплексы антиген-антитело препятствуют обнаружению антиген в некоторых образцах собак [8-10]. Однако этот этап больше не включен в протоколы коммерческих тестов на антиген D. immitis , включая тесты, предназначенные для использования на кошках. Недавно мы описали, что термическая обработка образцов собачьей сыворотки перед тестированием может выявить антиген D. immitis , феномен, который может мешать обнаружению инфекции у 7% собак на юге США [S. Немногочисленные, неопубликованные данные]. В образцах собачьей сыворотки, которые дают ложноотрицательные результаты коммерческих анализов, антиген, по-видимому, захвачен иммунными комплексами, что препятствует обнаружению. Как только эти комплексы разрушены, анализы могут точно обнаруживать антиген [8–10].
Как только эти комплексы разрушены, анализы могут точно обнаруживать антиген [8–10].
Для определения роли, которую блокирование антигена может играть в обнаружении D. immitis в образцах кошачьих, мы протестировали образцы сыворотки от кошек, экспериментально инфицированных небольшим числом сердечных червей, с помощью четырех различных коммерчески доступных анализов до и после тепловой обработки сыворотки.
Методы
Образцы
Образцы сыворотки большого объема были получены от шести (3 самцов и 3 самок) домашних короткошерстных кошек, экспериментально инфицированных в возрасте 10 месяцев вирусом Dirofilaria immitis путем подкожной инокуляции личинок третьей стадии (L 3 ) и инфицирование подтверждено обнаружением взрослых червей при вскрытии или подтверждением гистологических поражений. Вкратце, капельное заражение в общей сложности 100 л 3 из D. immitis было проведено путем подкожной паховой инокуляции каждой кошки в общей сложности четыре раза, в дни исследования 7, 14, 21 и 28, с 25 л . 3 (штамм Миссури), собранный незадолго до инокуляции от инфицированных комаров Aedes aegypti (ливерпульский штамм). Образцы цельной крови собирали из яремной или, реже, головной вены каждой кошки на 84, 112, 140, 168, 19 дни.6 и 224 непосредственно в вакуумные пробирки, содержащие ЭДТА или не содержащие добавки. На протяжении всего исследования о кошках заботились в рамках программы животных ресурсов, аккредитованной Ассоциацией государственного университета Оклахомы по оценке и аккредитации по уходу за лабораторными животными; все исследовательские процедуры следовали подробному протоколу ухода за животными и использованию, одобренному Комитетом по институциональному уходу и использованию животных Университета штата Оклахома. Антикоагулированную цельную кровь анализировали на наличие микрофилярий с помощью модифицированного теста Нотта и методом ПЦР в реальном времени в течение 9 дней.0102 Wolbachia spp. как описано ранее [11, 12]. Для пробирок без добавок кровь давали свернуться, сыворотку отделяли центрифугированием, помещали на аликвоты и хранили при -80°C до дальнейшего использования.
3 (штамм Миссури), собранный незадолго до инокуляции от инфицированных комаров Aedes aegypti (ливерпульский штамм). Образцы цельной крови собирали из яремной или, реже, головной вены каждой кошки на 84, 112, 140, 168, 19 дни.6 и 224 непосредственно в вакуумные пробирки, содержащие ЭДТА или не содержащие добавки. На протяжении всего исследования о кошках заботились в рамках программы животных ресурсов, аккредитованной Ассоциацией государственного университета Оклахомы по оценке и аккредитации по уходу за лабораторными животными; все исследовательские процедуры следовали подробному протоколу ухода за животными и использованию, одобренному Комитетом по институциональному уходу и использованию животных Университета штата Оклахома. Антикоагулированную цельную кровь анализировали на наличие микрофилярий с помощью модифицированного теста Нотта и методом ПЦР в реальном времени в течение 9 дней.0102 Wolbachia spp. как описано ранее [11, 12]. Для пробирок без добавок кровь давали свернуться, сыворотку отделяли центрифугированием, помещали на аликвоты и хранили при -80°C до дальнейшего использования.
Тестирование на антитела
Тестирование на антитела проводилось с использованием коммерческого анализа (Solo Step® FH, HESKA) в соответствии с инструкциями производителя, а также в платной справочной лаборатории (ANTECH Diagnostics) с использованием имеющегося в продаже микротитрационного планшета для анализа (Synbiotics Корпорация, Зоэтис). Референс-лаборатория проверила каждый образец в трех повторностях и предоставила результаты оптической плотности (ОП) для каждой лунки, определенные с помощью спектрофотометрии, а также соответствующие лунки с положительным и отрицательным контрольными образцами.
Тестирование на антиген
Все тесты на антиген проводились с использованием коммерческих анализов в соответствии с инструкциями производителей, за исключением того, что образцы тестировались до и после термической обработки в каждом анализе. Для термической обработки образцы сыворотки помещали в термоблок при 103°C на 10 минут, полученный сгусток центрифугировали, а надосадочную жидкость использовали в каждом коммерческом анализе. Тестовые наборы, оцениваемые до и после тепловой обработки, включали твердофазный иммуноферментный анализ (ELISA) в форматах титрационных микропланшетов (DiroCHEK®, Synbiotics Corporation, Zoetis; PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.), мембранно-связанные тесты ELISA (SNAP® Feline). Heartworm® Test, IDEXX Laboratories, Inc.) и иммунохроматографические тесты с латеральным потоком (WITNESS® HW, Synbiotics Corporation, Zoetis). Кроме того, О.Д. показания были получены с помощью спектрофотометрии до и после тепловой обработки для одного из анализов на титрационных микропланшетах (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.) в соответствии с указаниями производителя.
Тестовые наборы, оцениваемые до и после тепловой обработки, включали твердофазный иммуноферментный анализ (ELISA) в форматах титрационных микропланшетов (DiroCHEK®, Synbiotics Corporation, Zoetis; PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.), мембранно-связанные тесты ELISA (SNAP® Feline). Heartworm® Test, IDEXX Laboratories, Inc.) и иммунохроматографические тесты с латеральным потоком (WITNESS® HW, Synbiotics Corporation, Zoetis). Кроме того, О.Д. показания были получены с помощью спектрофотометрии до и после тепловой обработки для одного из анализов на титрационных микропланшетах (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.) в соответствии с указаниями производителя.
Сравнение результатов испытаний
Оптическая плотность по результатам анализа на титрационных микропланшетах (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.) и средняя оптическая плотность. трехкратные тесты на антитела (диагностика ANTECH) для каждой кошки за все дни, когда антиген был обнаружен у любой кошки, и для кошек в каждый из трех отдельных дней исследования (168, 196 и 224 дни исследования) сравнивались с использованием однофакторного дисперсионного анализа. в Excel 2007 (Microsoft Office) со значением альфа = 0,05 [13]. Соотношение антиген/антитело также определяли для каждой кошки на 168, 19 дни.6 и 224 с использованием ОП и среднего ОП соответственно.
в Excel 2007 (Microsoft Office) со значением альфа = 0,05 [13]. Соотношение антиген/антитело также определяли для каждой кошки на 168, 19 дни.6 и 224 с использованием ОП и среднего ОП соответственно.
Результаты
У всех шести кошек развилась инфекция D. immitis , о чем свидетельствует обнаружение классических поражений при гистопатологическом исследовании или обнаружение взрослых червей при вскрытии. Всего от 5 кошек было собрано от 1 до 6 взрослых особей D. immitis ; взрослые гельминты не были обнаружены у оставшейся кошки при вскрытии, но при гистопатологическом исследовании были обнаружены тяжелые легочные поражения, соответствующие инфекции D. immitis (таблица 1). Микрофилярии D. immitis не были обнаружены ни в один день с помощью теста Нотта в цельной крови и ПЦР в реальном времени для Wolbachia spp. на цельную кровь был стабильно отрицательным. Антитела к D. immitis были обнаружены обоими тестами у пяти кошек на 84 день и у всех шести кошек на 112, 140, 168, 196 и 224 дни исследования. Антиген D. immitis был обнаружен у 0, 1 и 1 кошка на 168, 196 и 224 дни соответственно, когда тестирование проводили по инструкции производителя, без предварительного нагревания, с использованием лунок микротитрационного анализа. При тестировании с помощью мембраносвязанного ИФА и иммунохроматографического теста с латеральным потоком антиген был обнаружен у 0 или 1 кошки соответственно. 9Таблица 1 обработки образцов, лунки микротитров идентифицировали антиген у 1, 5 и 5 из 6 кошек на 168, 196 и 224 дни соответственно. Антиген также был обнаружен у 4 из 6 кошек после нагревания образцов, собранных на 224-й день с использованием как мембранного ИФА, так и иммунохроматографического теста с латеральным потоком. Результаты (ОП) одного из анализов на титрационных микропланшетах (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.) до и после нагревания, а также анализа антител из тех же образцов в течение 19 дней.6 и 224 показаны в таблице 1. Результаты (OD) теста на антиген (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.
Антиген D. immitis был обнаружен у 0, 1 и 1 кошка на 168, 196 и 224 дни соответственно, когда тестирование проводили по инструкции производителя, без предварительного нагревания, с использованием лунок микротитрационного анализа. При тестировании с помощью мембраносвязанного ИФА и иммунохроматографического теста с латеральным потоком антиген был обнаружен у 0 или 1 кошки соответственно. 9Таблица 1 обработки образцов, лунки микротитров идентифицировали антиген у 1, 5 и 5 из 6 кошек на 168, 196 и 224 дни соответственно. Антиген также был обнаружен у 4 из 6 кошек после нагревания образцов, собранных на 224-й день с использованием как мембранного ИФА, так и иммунохроматографического теста с латеральным потоком. Результаты (ОП) одного из анализов на титрационных микропланшетах (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.) до и после нагревания, а также анализа антител из тех же образцов в течение 19 дней.6 и 224 показаны в таблице 1. Результаты (OD) теста на антиген (PetChek® Heartworm PF Antigen Test, IDEXX Laboratories, Inc.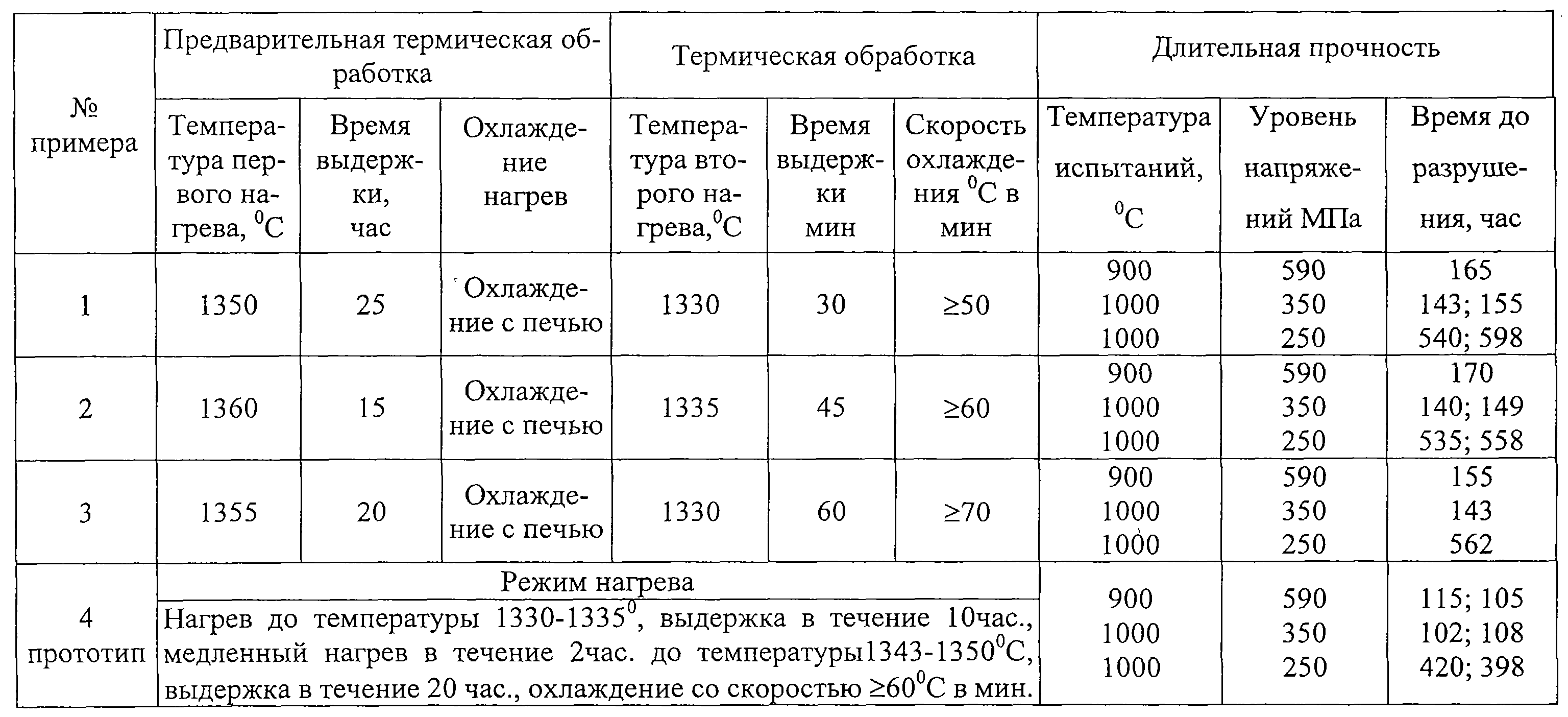 ) после нагревания и тестов на антитела были в значительной степени связаны, если все дни учитывались вместе ( R 2 = 0,40, F = 16,6, P <0,001) и на образцах с днем 224 ( R 2 = 0,70, F = 16.1, P.00103 = 0,70, F = 16.1, P.00103). для дней 168 ( F = 2,6, P =0,15) или 196 ( F = 0,36, P =0,56) отдельно. Соотношение антиген/антитело было самым высоким у одной кошки, у которой антиген был обнаружен до нагревания на 196-й день (таблица 1), хотя ограниченное количество образцов препятствовало значимому статистическому анализу.
) после нагревания и тестов на антитела были в значительной степени связаны, если все дни учитывались вместе ( R 2 = 0,40, F = 16,6, P <0,001) и на образцах с днем 224 ( R 2 = 0,70, F = 16.1, P.00103 = 0,70, F = 16.1, P.00103). для дней 168 ( F = 2,6, P =0,15) или 196 ( F = 0,36, P =0,56) отдельно. Соотношение антиген/антитело было самым высоким у одной кошки, у которой антиген был обнаружен до нагревания на 196-й день (таблица 1), хотя ограниченное количество образцов препятствовало значимому статистическому анализу.
Обсуждение
В настоящем исследовании мы показали, что термическая обработка кошачьей сыворотки перед тестированием на антиген привела к резкому увеличению обнаружения антигена D. immitis . Хотя только 1/6 (16,7%) образцов от кошек, инфицированных небольшим числом взрослых сердечных червей, были антиген-позитивными до термической обработки, до 5/6 (83,3 %) стали положительными после термической обработки, когда наиболее чувствительный луночный микротитрационный планшет анализы использовались, предположительно, из-за разрушения антител и высвобождения антигена из комплексов антитело-антиген [8]. Соответственно, блокирование антигена приводило к ложноотрицательному результату у большинства (80%) кошек, несущих оба взрослых D. immitis и циркулирующий антиген. Учитывая результаты настоящего исследования, представляется разумным подвергать образцы сыворотки кошек с высоким индексом подозрения на инфекцию сердечным червем перед тестированием на антиген D. immitis .
Соответственно, блокирование антигена приводило к ложноотрицательному результату у большинства (80%) кошек, несущих оба взрослых D. immitis и циркулирующий антиген. Учитывая результаты настоящего исследования, представляется разумным подвергать образцы сыворотки кошек с высоким индексом подозрения на инфекцию сердечным червем перед тестированием на антиген D. immitis .
Несмотря на то, что в кошачьих рекомендациях Американского общества сердечных червей конкретно указано, что «тесты на антигены более надежны [у кошек], чем обычно считается», у многих все же сложилось впечатление, что, поскольку у кошек обычно очень мало гельминтов или глистные инфекции встречаются только у самцов, тесты на антигены бесполезны для кошек [4, 6]. Данные настоящего исследования интересны тем, что они предполагают, что как только комплексы антиген-антитело разрушены, тесты на антигены могут иметь большое значение для подтверждения кошачьей инфекции D. immitis , в частности анализы на основе лунок микротитрования. Термическая обработка образцов перед тестированием может иметь клиническое значение, особенно учитывая низкий уровень циркулирующих микрофилярий, обычно присутствующих у кошек, и трудности в интерпретации результатов теста на антитела [2, 5]. Этот вывод может быть полезен не только для подтверждения первоначального клинического подозрения на инфекцию дирофиляриозом кошек, но и для оценки феномена самоизлечения у кошек, для которого ранее требовалась оценка уровней антител через 12 месяцев после антигена D. immitis больше не идентифицировали [14]. Распространенность антигена D. immitis в образцах кошачьих в Соединенных Штатах оценивается в 0,9% [15], но данные настоящего исследования показывают, что фактическая распространенность, вероятно, выше, особенно в районах, таким образом распространение на кошек, является эндемичным или гиперэндемичным.
Термическая обработка образцов перед тестированием может иметь клиническое значение, особенно учитывая низкий уровень циркулирующих микрофилярий, обычно присутствующих у кошек, и трудности в интерпретации результатов теста на антитела [2, 5]. Этот вывод может быть полезен не только для подтверждения первоначального клинического подозрения на инфекцию дирофиляриозом кошек, но и для оценки феномена самоизлечения у кошек, для которого ранее требовалась оценка уровней антител через 12 месяцев после антигена D. immitis больше не идентифицировали [14]. Распространенность антигена D. immitis в образцах кошачьих в Соединенных Штатах оценивается в 0,9% [15], но данные настоящего исследования показывают, что фактическая распространенность, вероятно, выше, особенно в районах, таким образом распространение на кошек, является эндемичным или гиперэндемичным.
Интересно, что термическая обработка сыворотки позволила нам обнаружить антиген почти у каждой инфицированной кошки, включенной в настоящее исследование.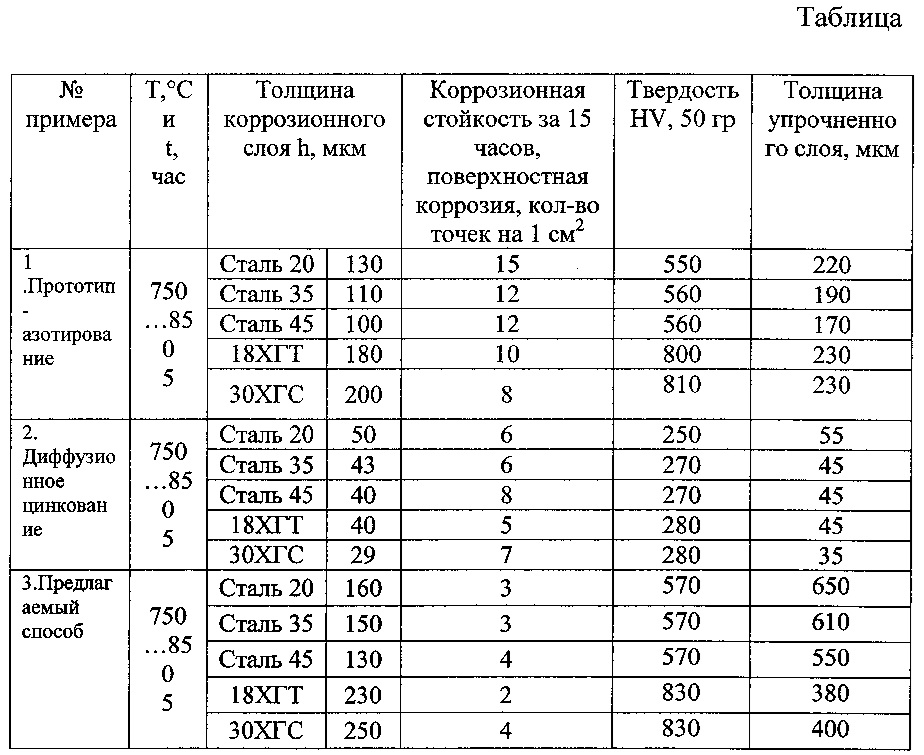 Основа вмешательства в определение антигена до конца не изучена, но в других системах считается, что этот процесс связан с образованием комплекса антиген-антитело [16, 17]. Кошки заражены D. immitis развивается значительная степень воспаления, которая проявляется тяжелой патологией легких, характеризующейся ворсинчатым артериитом, медиальной гипертрофией легочных артериол и повреждением легочной паренхимы, что в совокупности называется респираторным заболеванием, ассоциированным с сердечными червями (HARD) [2, 3 , 5]. Этот хронический воспалительный процесс, вероятно, приводит к гипергаммаглобулинемии, которая может препятствовать обнаружению антигена D. immitis за счет специфического или неспецифического образования комплексов антиген-антитело , in vivo [8, 18]. Выяснение механизмов, ответственных за ингибирование обнаружения антигена в образцах кошачьих, а также наилучший подход к разрушению этих комплексов потребуют дополнительных исследований.
Основа вмешательства в определение антигена до конца не изучена, но в других системах считается, что этот процесс связан с образованием комплекса антиген-антитело [16, 17]. Кошки заражены D. immitis развивается значительная степень воспаления, которая проявляется тяжелой патологией легких, характеризующейся ворсинчатым артериитом, медиальной гипертрофией легочных артериол и повреждением легочной паренхимы, что в совокупности называется респираторным заболеванием, ассоциированным с сердечными червями (HARD) [2, 3 , 5]. Этот хронический воспалительный процесс, вероятно, приводит к гипергаммаглобулинемии, которая может препятствовать обнаружению антигена D. immitis за счет специфического или неспецифического образования комплексов антиген-антитело , in vivo [8, 18]. Выяснение механизмов, ответственных за ингибирование обнаружения антигена в образцах кошачьих, а также наилучший подход к разрушению этих комплексов потребуют дополнительных исследований.
Выводы
Тесты на антигены D.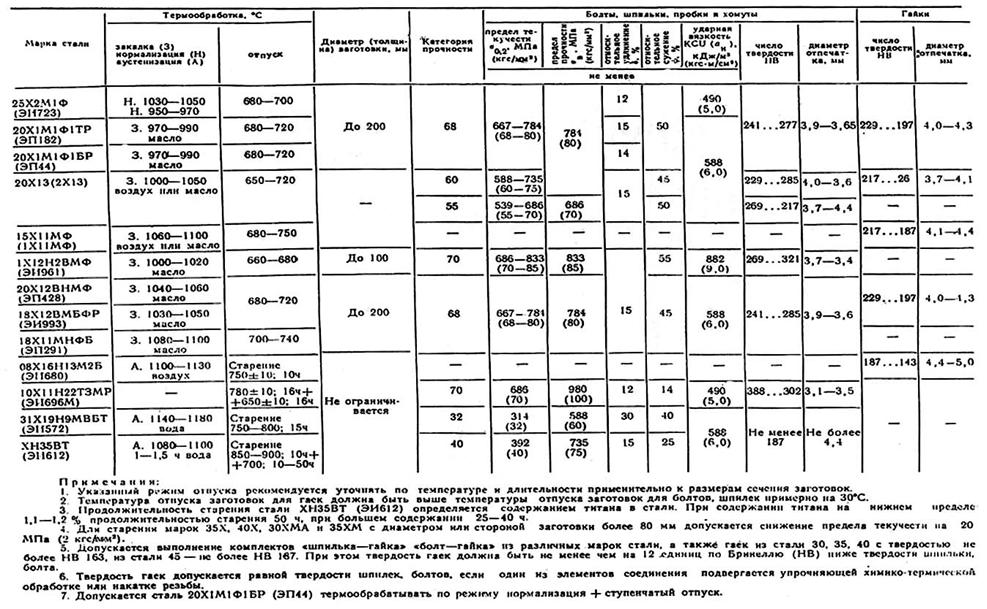 immitis долгое время считались малопригодными для кошек. Данные настоящего исследования предполагают необходимость пересмотра этой концепции. Нагрев образцов кошачьей сыворотки перед тестированием значительно облегчил обнаружение D. immitis антиген, предположительно из-за разрушения комплексов антиген-антитело.
immitis долгое время считались малопригодными для кошек. Данные настоящего исследования предполагают необходимость пересмотра этой концепции. Нагрев образцов кошачьей сыворотки перед тестированием значительно облегчил обнаружение D. immitis антиген, предположительно из-за разрушения комплексов антиген-антитело.
Ссылки
Atkins CE: Сравнение результатов трех коммерческих тестовых наборов на антигены сердечного червя у собак с низким уровнем заражения дирофиляриозом. J Am Vet Med Assoc. 2003, 222: 1221-1223. 10.2460/явма.2003.222.1221.
Артикул КАС пабмед Google Scholar
McCall JW, Genchi C, Kramer LH, Guerrero J, Venco L: Дирофиляриоз у животных и людей. Ад Паразитол. 2008, 66:193-285.
Артикул пабмед Google Scholar
“>Hoch H, Strickland K: Дирофиляриоз собак и кошек: жизненный цикл, патофизиология и диагностика. Compend Contin Educ Pract Vet. 2008, 30: 133-141.
Google Scholar
Нельсон КТ: Заражение сердечным червем кошек: диагностика и лечение. Compend Contin Educ Pract Vet. 2008, 30: 393-400.
Google Scholar
Грэм В., Рубин С.Б., Бёк А., Бурхардт Л.Ф., Джонс С., Миллер М., Пейн П., Рем С., Смит-Блэкмор М., Стэннард Р., Нельсон К.Т., Аткинс С., Каритерс Д., Макколл Дж., Фон Симсон C: Текущие рекомендации для собак по диагностике, профилактике и лечению сердечного червя (9).
 0102 Dirofilaria immitis ) инфекция у кошек (пересмотрено в январе 2012 г.). http://www.heartwormsociety.org, по состоянию на 1 октября 2013 г.
0102 Dirofilaria immitis ) инфекция у кошек (пересмотрено в январе 2012 г.). http://www.heartwormsociety.org, по состоянию на 1 октября 2013 г.Courtney CH, Zheng Q-Y: Сравнение эффективности набора для тестирования на антиген сердечного червя у собак с низким бременем сердечного червя. Вет Паразитол. 2001, 96: 317-322. 10.1016/С0304-4017(01)00374-0.
Артикул КАС пабмед Google Scholar
Weil GJ, Malane MS, Powers KG, Blair LS: Моноклональные антитела к антигенам паразитов обнаружены в сыворотке Dirofilaria immitis -зараженные собаки. Дж Иммунол. 1985, 134: 1185-1191.
КАС пабмед Google Scholar
Brunner CJ, Hendrix CM, Blagburn BL, Hanrahan LA: Сравнение серологических тестов для обнаружения антигена при инфекциях сердечного червя собак. J Am Vet Med Assoc.
 1988, 192: 1423-1427.
1988, 192: 1423-1427.КАС пабмед Google Scholar
Tonelli QJ, Quentin AB: Факторы, влияющие на точность иммуноферментного анализа для Dirofilaria immitis взрослый антиген. Слушания Am Heartworm Symp. 1989, Вашингтон, округ Колумбия: Американское общество сердечного червя, 161–165.
Google Scholar
Zajac AM, Conboy GA: Обнаружение паразитов в крови. Ветеринарная клиническая паразитология. 2012, Западный Суссекс: John Wiley and Sons, Inc., 185–211. 8
Google Scholar
Турба М.Е., Замбон Э., Заннони А., Руссо С., Джентилини Ф.: Обнаружение Wolbachia ДНК в крови для диагностики филяриатозных синдромов у кошек. Дж. Клин Микробиол. 2012, 50: 2624-30. 10.1128/JCM.00528-12.
Артикул ПабМед Центральный пабмед Google Scholar
“>Venco L, Genchi C, Genchi M, Grandi G, Kramer LH: Клиническая эволюция и рентгенологические данные о кошачьей дирофиляриозе у бессимптомных кошек. Вет Паразитол. 2008, 158: 232-7. 10.1016/ж.ветпар.2008.09.011.
Артикул КАС пабмед Google Scholar
Lorentzen L, Caola AE: Частота положительных результатов тестов на антитела и антигены сердечного червя в лабораториях IDEXX: тенденции и потенциальное влияние на осведомленность и профилактику сердечного червя кошек. Вет Паразитол. 2008, 158: 183-90. 10.1016/ж.ветпар.2008.09.006.
Артикул пабмед Google Scholar
Wheat LJ, Walsh TJ: Диагностика инвазивного аспергиллеза путем обнаружения галактоманнановой антигенемии с использованием иммуноферментного анализа.
 Eur J Clin Microbiol Infect Dis. 2008, 27: 245-251. 10.1007/s10096-007-0437-7.
Eur J Clin Microbiol Infect Dis. 2008, 27: 245-251. 10.1007/s10096-007-0437-7.Артикул КАС пабмед Google Scholar
Swartzentruber S, LeMonte A, Witt J, Fuller D, Davis T, Hage C, Connolly P, Durkin M, Wheat LJ: улучшенное обнаружение Histoplasma антигенемия после диссоциации иммунных комплексов. Клин Вак Иммунол. 2009, 16: 320-322. 10.1128/CVI.00409-08.
Артикул КАС Google Scholar
Weil GJ, Malane MS, Powers KG: Обнаружение антигенов циркулирующих паразитов при дирофиляриозе собак с помощью контриммуноэлектрофореза. Am J Trop Med Hyg. 1984, 33: 425-430.
КАС пабмед Google Scholar
Lee AC, Atkins CE: Понимание кошачьей сердечной инфекции: заболевание, диагностика и лечение. Топ-компаньон Аним Мед. 2010, 25: 224-230. 10.1053/j.tcam.2010.09.003.
Артикул пабмед Google Scholar
Кросс С.Л., Дэниел В.В.: Биостатистика: основа для анализа в науках о здоровье. 2013, John Wiley and Sons, Inc.: Западный Суссекс, 10
Google Scholar
Загрузить ссылки
Благодарности
Финансирование для поддержки экспериментальных инфекций кошек, которые предоставили образцы, используемые в этом исследовании, было предоставлено Bayer HealthCare, Animal Health.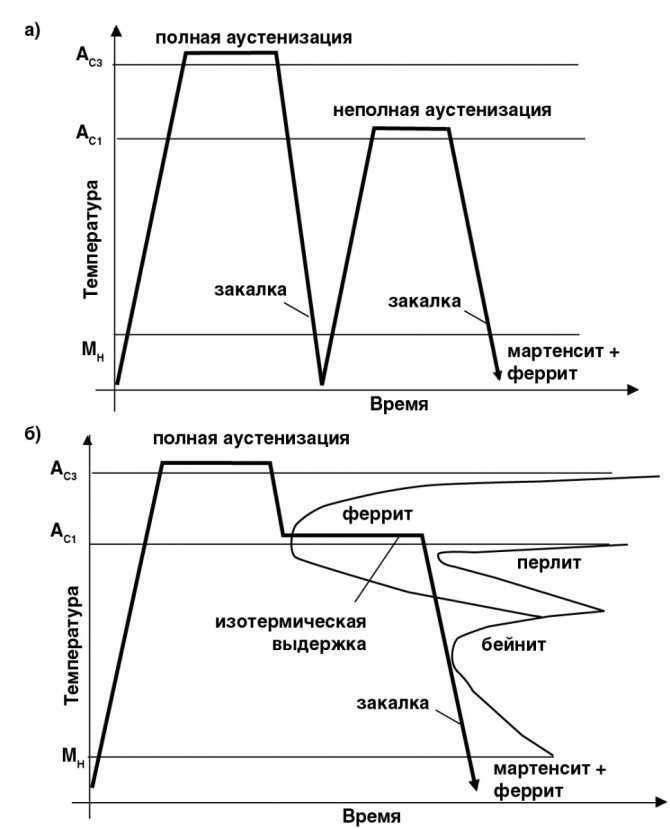 Дополнительное финансирование было предоставлено Фондом Крулла-Юинга в Университете штата Оклахома и Национальным центром ветеринарной паразитологии, который получает ежегодную поддержку от Bayer HealthCare, Animal Health, Novartis Animal Health и Merial, Limited, компании Sanofi. Д-р Линдсей Старки, Энн Барретт, Кейлин Грунтмеир и сотрудники отдела лабораторных ресурсов животных Центра ветеринарных медицинских наук оказали выдающуюся техническую помощь.
Дополнительное финансирование было предоставлено Фондом Крулла-Юинга в Университете штата Оклахома и Национальным центром ветеринарной паразитологии, который получает ежегодную поддержку от Bayer HealthCare, Animal Health, Novartis Animal Health и Merial, Limited, компании Sanofi. Д-р Линдсей Старки, Энн Барретт, Кейлин Грунтмеир и сотрудники отдела лабораторных ресурсов животных Центра ветеринарных медицинских наук оказали выдающуюся техническую помощь.
Информация об авторе
Авторы и организации
Кафедра ветеринарной патобиологии, Центр ветеринарных медицинских наук, Государственный университет Оклахомы, Стиллуотер, Оклахома, 74078, США
Susan E Little, Melissa R Raymond, Thomas, Jeffnifer E Gruntmeir & James H Meinkoth
Bayer HealthCare, Animal Health, Shawnee Mission, Shawnee, KS, USA
Joe A Hostetler
Кафедра ветеринарной патобиологии, Колледж ветеринарной медицины, Обернский университет, США
Byron L Blagburn
Авторы
- Susan E Little
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Мелисса Р.
 Рэймонд
РэймондПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jennifer E Thomas
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Jeff Gruntmeir
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Joe A Hostetler
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- James H Meinkoth
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Byron L Blagburn
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Сьюзан Э Литтл.
Дополнительная информация
Конкурирующие интересы
За последние пять лет SL, JT и BB получали компенсацию, гонорары за выступления или поддержку исследований от IDEXX Laboratories и Pfizer Animal Health (теперь Zoetis), производителей D. immitis , или от Bayer Animal Health, компании, которая производит средства для профилактики сердечных гельминтов, в том числе для кошек. Кроме того, JH является сотрудником Bayer Animal Health. Другие авторы (MR, JG, JM) не имеют конкурирующих финансовых интересов, о которых следует раскрывать.
Вклад авторов
SL, BB и JM задумали исследование, SL и JH участвовали в его разработке и проведении и составили рукопись, а MR и JG провели тестирование на антигены и антитела. JT руководил завершением исследования, особенно экспериментальных инфекций. Все авторы прочитали и одобрили окончательный вариант рукописи.
Права и разрешения
Эта статья опубликована по лицензии BioMed Central Ltd.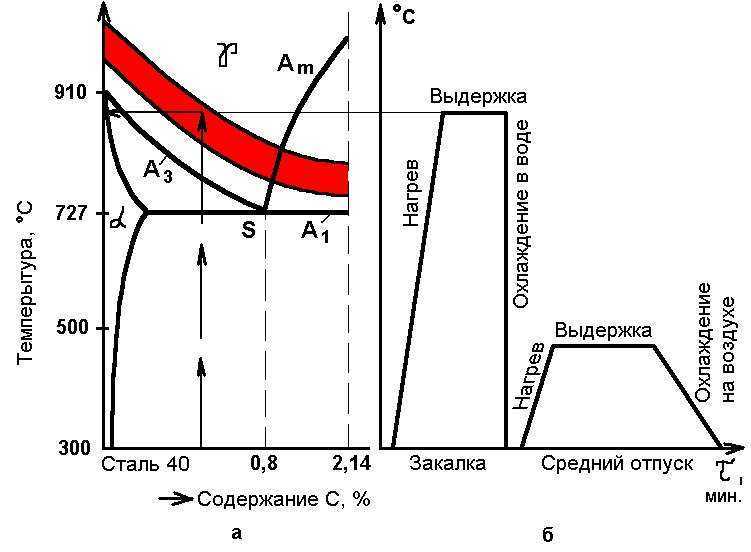




 03.2015121.74 Кб7Сварка образцов KCV_2.docx
03.2015121.74 Кб7Сварка образцов KCV_2.docx

 0102 Dirofilaria immitis ) инфекция у кошек (пересмотрено в январе 2012 г.). http://www.heartwormsociety.org, по состоянию на 1 октября 2013 г.
0102 Dirofilaria immitis ) инфекция у кошек (пересмотрено в январе 2012 г.). http://www.heartwormsociety.org, по состоянию на 1 октября 2013 г.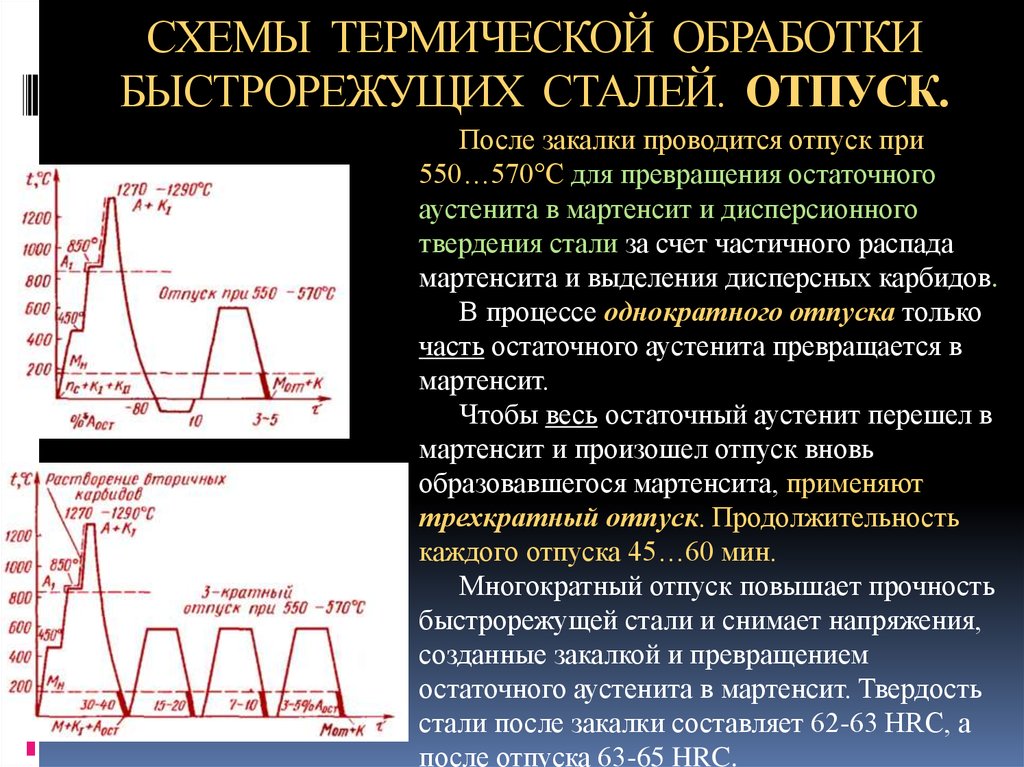 1988, 192: 1423-1427.
1988, 192: 1423-1427. Eur J Clin Microbiol Infect Dis. 2008, 27: 245-251. 10.1007/s10096-007-0437-7.
Eur J Clin Microbiol Infect Dis. 2008, 27: 245-251. 10.1007/s10096-007-0437-7. Рэймонд
Рэймонд