Типы металлических кристаллических решеток: Глава 2.2. Атомно-кристаллическое строение металлов — Купити в Харкові, Києві, Україні. Безкоштовне тестування
alexxlab | 17.05.2023 | 0 | Разное
«Как различаются типы кристаллической решетки? Какие способы определения?» — Яндекс Кью
Популярное
Сообщества
ФизикаХимияУчеба
Анонимный вопрос
·
132,4 K
ОтветитьУточнитьКристина Михалкова
2,7 K
Человек науки, полиглот, энтузиаст. Химия, компьютерные технологии, нейропсихология и все… · 31 окт 2018
Существует 4 типа кристаллических решеток: ионные, молекулярные, атомные и металлические.
В узлах ионных кристаллических решеток находятся ионы, как можно понять из названия. Такой тип решетки характерен для солей, оксидов и некоторых гидроксидов. Например, самый яркий представитель – NaCl. Вещества подобного строения характеризуются высокой твердостью, тугоплавкостью и нелетучестью.
В молекулярных кристаллических решетках в узлах находятся молекулы. Такие решетки могут быть полярные и неполярные. Например, I2 или N2 – неполярные, а HCl или h3O – полярные. Характерны для жидких и газообразных веществ (при н.у.). Так как молекулярные взаимодействия слабые, то и кристаллические решетки эти будут нетвердые, летучие и с низкой температурой плавления. К таким решеткам относят твердую органику (сахар, глюкоза, нафталин).
В атомных кристаллических решетках в узлах находятся атомы, связанные друг с другом прочными ковалентными связями. Такая решетка характерна простым веществам неметаллам, которые при нормальных условиях находятся в твердом состоянии, например алмаз. Температура плавления у подобных веществ очень высокая, они прочные, твердые и нерастворимы в воде.
Металлические решетки характеризуются тем, что в узлах находятся атомы или ионы одного или нескольких металлов (у сплавов). Для металлических решеток характерно наличие так называемого общего электронного облака.
Вообще в материаловедении для изучения кристаллических структур существует множество методов, основанных на свойствах рентгеновского излучения (дифракция, интерференция), электронографический анализ и другие. Но если вы хотите просто определить тип решетки вещества известного состава, нужно понять к какому классу веществ оно относится и какие физико-химические свойства имеет.
80,5 K
Аза К.
8 октября 2019
Спасибо )))
Комментировать ответ…Комментировать…
Майя Эленве
3,0 K
Занимаюсь козами, люблю животных, книги, штангу, учу языки. Круг интересов практически… · 30 окт 2018
Круг интересов практически… · 30 окт 2018
Вещества с ионной связью (основанной на взаимодействии ионов, обладающих противоположным электрическим зарядом) твердые, но хрупкие, не проводят ни тепло, ни электричество. Ионная кристаллическая решетка бывает у солей, оксидов и щелочей. В металлической решетке могут находится и атомы, и ионы, причем ионы способны становиться атомами. Как можно понять из названия… Читать далее
16,3 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Типы кристаллических решёток – презентация онлайн
Похожие презентации:
Сложные эфиры. ЖирыФизические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Типы кристаллических решёток
ВыполнилаКузнецова Л.В
Ученица
«Б»
класса
Учитель
химии11
ГБОУ
лицей
№144
Санкт-Петербург
Гладинова
Анастасия
2013
ЗАДАЧИ УРОКА:
Сформировать понятие о кристаллическом
и аморфном состоянии твердых тел
Дать характеристику основных типов
кристаллических решёток
Установить зависимость физических свойств
вещества от характера химической связи и
типа кристаллической решётки
Состояние
вещества
Твердое
Жидкое
Газообразное
Твердое вещество
Аморфное
смола
стекло
пластилин
воск
пластмассы
Кристаллическое
хлорид натрия
графит
металлы
5. Особенности кристаллических веществ
1) Строгое расположение частиц, образующихкристаллическую решётку
2) Строго определенные Тпл и Ткип
Узлы кристаллической
решётки
Кристаллические решётки веществ-это
упорядоченное расположение частиц
(атомов, молекул, ионов) в строго
определённых точках пространства.
 Точки
Точкиразмещения частиц называют узлами
кристаллической решётки.
Узлы кристаллической
решетки
7. Особенности аморфных веществ
1) Нет строгого расположения частиц, неткристаллической решётки.
2) Нет строго определенных Тпл и Ткип
8. Типы кристаллических решёток
Кристаллическиерешётки
Ионная
Металлическая
Молекулярная
Атомная
Тип
Виды
Вид связи Примеры Физические
решётки частиц между
веществ свойства
в узлах частицами
веществ
решётки
10. Ионная кристаллическая решётка
В узлах решётки ионы (+ и –заряженные), между которыми
существует ионная сязь
Свойства веществ:
1) относительно высокая
твердость, прочность
2) хрупкость
3) термостойкость
4) тугоплавкость
5) нелетучесть
Примеры: соли (NaCl), основания
( NaOH), некоторые оксиды
типичных металлов
11. Атомная кристаллическая решётка
алмазграфит
В узлах решётки отдельные
атомы.
Химическая связь ковалентная
Свойства веществ:
1) высокая твердость,
прочность
2) высокая Тпл.
3) тугоплавкость
4) практически нерастворимы
5) нелетучесть
Примеры: углерод в форме
алмаза, графита; бор и др.
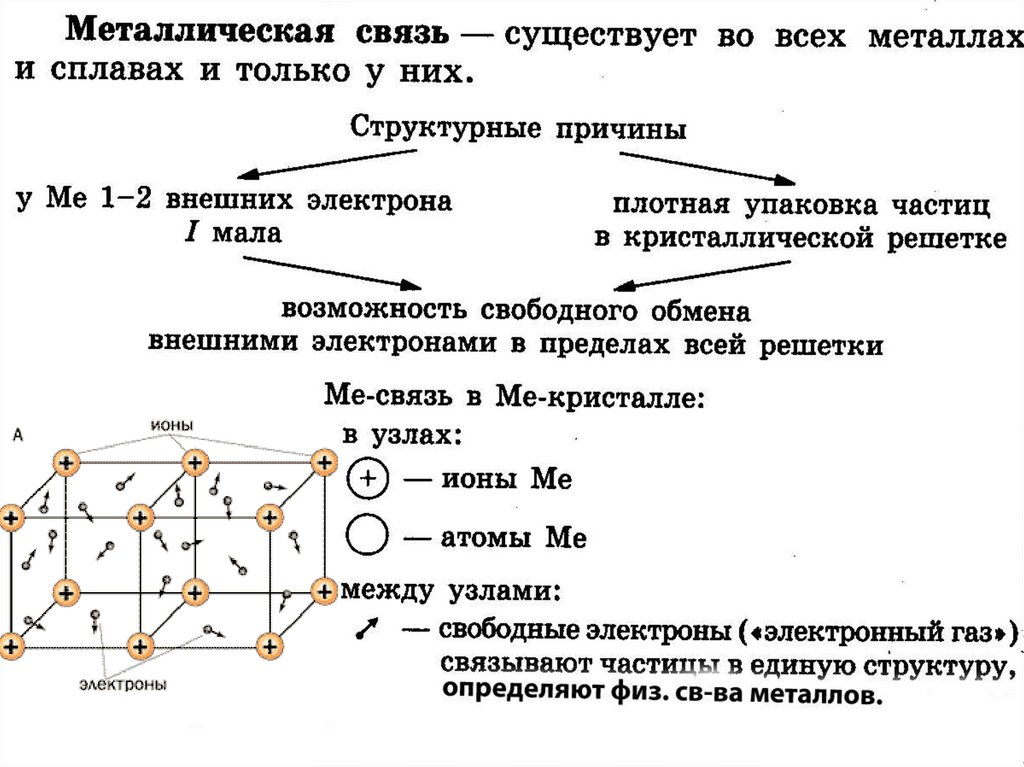
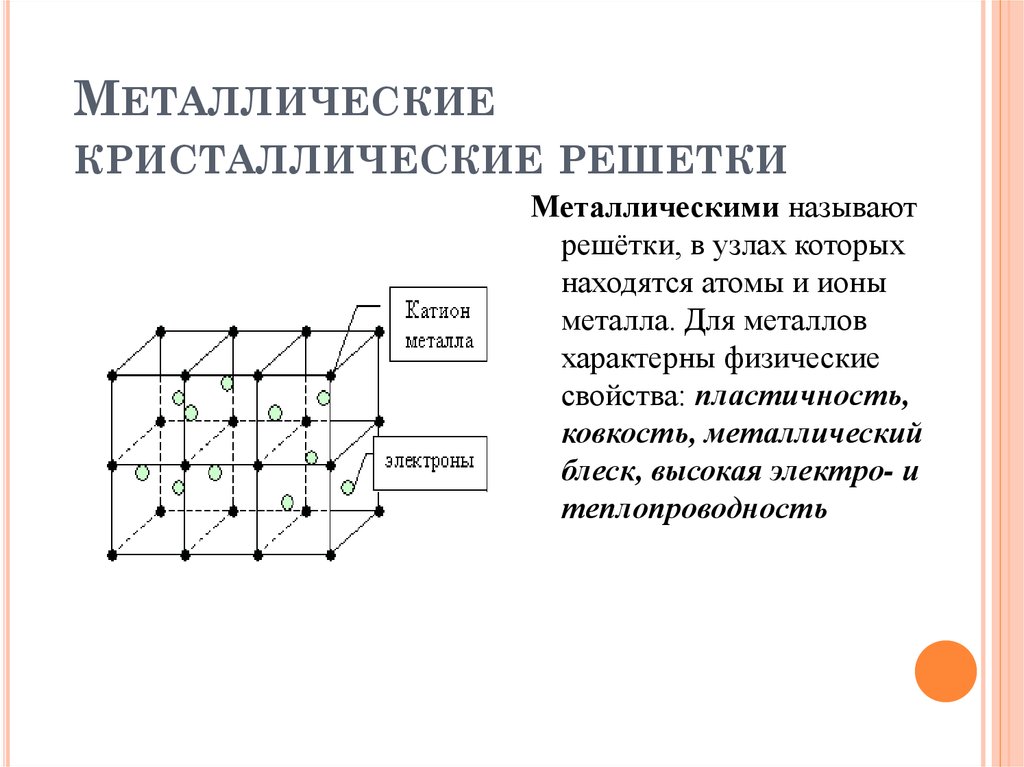
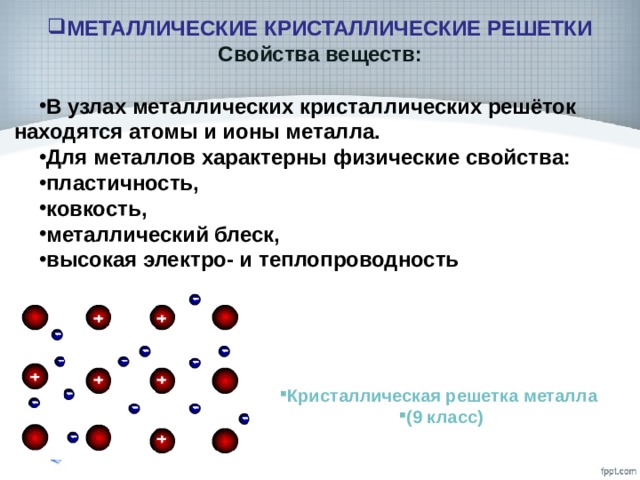
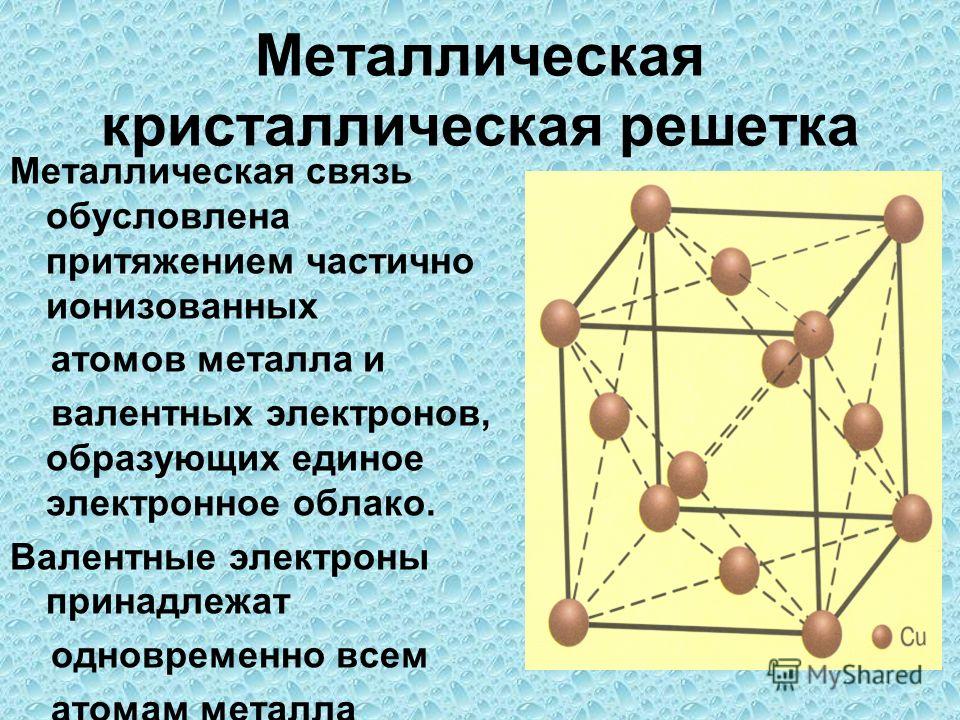
12. Металлическая кристаллическая решётка
В узлах решётки атомы иионы (+)
Химическая связь
металлическая
Свойства веществ:
1) металлический блеск
2) тепло- и
электропроводность
3) ковкость и пластичность
4) непрозрачность
Примеры: Все металлы (Na,
Ca, Fe…, кроме Hg), сплавы и
т.д.
13. Разновидности металлических решёток
а)кубическаяб)кубическая
объемно-центрированная
гранецентрированная
в)гексагональная
плотноупакованная
Вещества
Молекулярного
строения:
состоят из молекул
Немолекулярного
строения:
состоят из атомов
и ионов
15. Молекулярная кристаллическая решетка
В узлах решетки – молекулыХимическая связь
Ковалентная
неполярная
(между частицами в
узлах решётки
действуют только
слабые
межмолекулярные
силы)
Ковалентная
полярная
(между молекулами
в узлах действуют
слабые силы
межмолекулярного
притяжения)
16.
 Молекулярная кристаллическая решёткайод I2
Молекулярная кристаллическая решёткайод I2Свойства веществ:
1) малая твердость, прочность
2) низкие Тпл, Ткип,
3) при комнатной Т обычно жидкость
или газ
4) высокая летучесть
Примеры:
углекислый газ СО2
Ковалентная
неполярная:
Ковалентная
полярная:
Большинство
неметаллов (h3,N ,O ,
Cl , P4, S 8 и т.д., кроме
Si и C)
Большинство
неорганических и
органических веществ
(H O, HCl, H S)
17. Молекулярная кристаллическая решётка
Белый фосфор Р4Сера S8
Взаимосвязь
Между положением элемента в периодической системе и
кристаллической решёткой его соответствующего простого вещества
существует тесная взаимосвязь.
г р у п п а
I
II
III
IV
V
VI
VII
h3
VIII
He
II
Li
Be
B
C
N2
O2
F2
Ne
III
Na
Mg
Al
Si
P4
S8
Cl2
Ar
IV
Ca
Ga
Ge
As
Se
Br2
Kr
V
Rb
Sr
In
Sn
Sb
Te
I2
Xe
I
п
е
р
и
о
д
Тип
кристалличес
кой решётки
металлическая
атомная
молекулярная
Состав
вещества
Вид
химической
связи
Тип
кристаллической
решётки
Свойства
Применение
ВЫВОД
Свойства веществ зависят не только от
вида химической связи,
существующей между частицами, но и
от пространственного расположения
этих частиц относительно друг друга.

English Русский Правила
Кристаллические структуры — ключ к гибкости конструкции стали
для проектирования транспортных средств
Мартенситная нержавеющая сталь проникает в автомобильный сектор
Понимание основ двигателей из аморфного железа
Монокристаллические лопатки турбин получили статус промежуточного этапа ASME
Металлурги и металлурги уже давно оценили способность стали (сплав железа и углерода) изменять рабочие характеристики стали (сплав железа и углерода), включая ее прочность, твердость, пластичность и обрабатываемость. Одним из способов модификации стали и создания новых ее типов является добавление различных сплавов, таких как бор, никель, хром, марганец, кремний и ванадий. Другой способ — изменить его кристаллическую структуру и состав, нагревая, охлаждая и обрабатывая его. Оба позволяют разрабатывать ферросплавы для удовлетворения самых разных потребностей в дизайне.
Посмотрите, как инженеры-материаловеды настраивают свойства стальных сплавов.
В железоуглеродистых сплавах важное фазовое превращение (превращение А3) происходит при температурах примерно от 1300 до 1600°F. Точная температура определяется тем, сколько углерода и других легирующих элементов содержится в металле сплава.
Железо переходит из гранецентрированной кубической (ГЦК) структуры — гамма-фазы, или аустенита, — при высоких температурах в объемноцентрированную кубическую (ОЦК) структуру — альфа-фазы, или феррита, — при более низких температурах. В чистом железе это превращение (превращение А3) характеризуется отчетливым увеличением длины при охлаждении металла ниже критической температуры, поскольку объемно-центрированная решетка менее компактна, чем гранецентрированная решетка.
Высокотемпературный аустенит, структура FCC, имеет достаточно места для того, чтобы атомы углерода могли втиснуться между атомами железа. Атомы железа сохраняют свое место в решетке, а атомы углерода становятся «междоузлиями». Однако в низкотемпературном феррите или структуре ОЦК нет места для атомов углерода.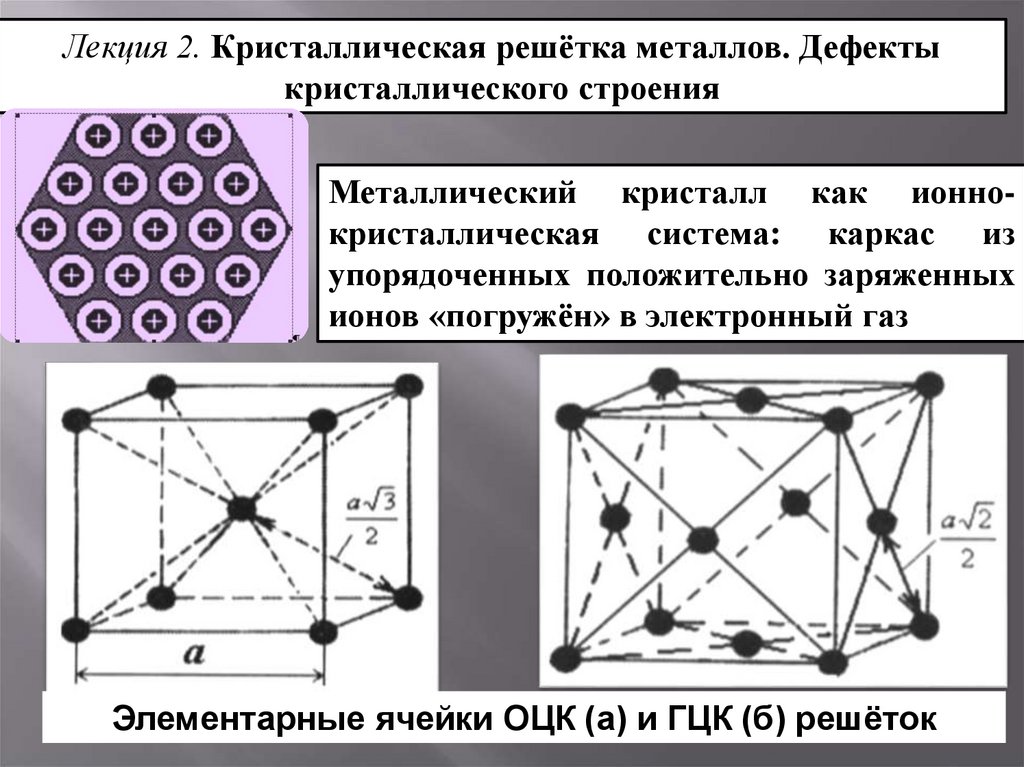 То, что происходит с этими атомами углерода, определяет многие свойства железа и стали.
То, что происходит с этими атомами углерода, определяет многие свойства железа и стали.
Например, при медленном охлаждении низкоуглеродистой (0,20% углерода) стали, такой как AISI 1020, превращение начинается, когда металл достигает 1555°F. Первый металл, достигший этой температуры, превращается в феррит, который вытесняет внедренный углерод в то, что осталось от аустенита. По мере того как металл продолжает охлаждаться, больше железа превращается в феррит, оставляя меньше аустенита и больше областей, богатых вытесненным внедренным углеродом.
Наконец, при температуре около 1350°F, нижней границе диапазона температур превращения для стали 1020, последний оставшийся аустенит пытается трансформироваться, несмотря на высокую концентрацию углерода. В этот момент углерод связывается с доступными атомами железа с образованием Fe3C, интерметаллического соединения, называемого цементитом (или карбидом железа). Он выделяется в виде дискретной структуры, а оставшийся аустенит превращается в феррит.
Результатом этого окончательного преобразования является ламинат, называемый перлитом. Он состоит из чередующихся слоев феррита и карбида железа. Конечно, ранее трансформировавшиеся участки металла остаются в виде крупных островков чистого феррита. Комбинированная структура феррита и перлита мягкая и пластичная, но это одна из самых слабых (низкопрочных) форм стали.
Напротив, когда сплавы черных металлов быстро охлаждаются (закаливаются), выброшенные атомы углерода не успевают покинуть железо, поскольку оно превращается в феррит. Сталь становится настолько жесткой, что, прежде чем атомы углерода смогут двигаться, они оказываются запертыми в решетке, поскольку атомы железа пытаются преобразоваться в структуру ОЦК. В результате получается объемно-центрированная тетрагональная структура с углеродом в качестве промежуточного члена. Сталь, подвергающаяся этому типу превращения, является мартенситной. Естественно, мартенсит находится в неравновесном состоянии, но его высокая прочность и твердость (и меньшая пластичность) обусловлены искаженной, напряженной структурой решетки.
Для изменения структуры стали был разработан ряд циклов термической обработки. Например, при отпуске мартенсита (нагреве ниже температуры A3) некоторые внутренние напряжения снимаются, и полученная структура обладает большей пластичностью, чем мартенсит после закалки.
Прочая термообработка изменяет пропорции перлита и мартенсита; некоторые даже захватывают аустенит при комнатной температуре. Другие изменяют или уменьшают размер зерна или его рисунок, придавая сплаву большую прочность или ударную вязкость.
| |||||
| | |||||
Все
металлы, используемые в реакторе, имеют кристаллическую структуру. ЭО 1.2 ОПРЕДЕЛИТЕ следующие термины: а. Кристаллическая структура б. Объемно-центрированная кубическая структура в. Гранецентрированная кубическая структура д. Шестиугольная плотно упакованная конструкция ЭО 1.3УКАЖИТЕ три типа решетки конструкции из металлов. ЭО 1.4 Учитывая описание или рисунок, Различают три наиболее распространенных типа кристаллических структур. Общие кристаллические структуры В
В металлах и во многих других твердых телах атомы располагаются правильными рядами.
называются кристаллами. А кристаллическая структура состоит из атомов
расположены по схеме, которая периодически повторяется в трехмерном пространстве. В в целом, три наиболее распространенных основных кристаллических узора, связанных с металлами являются: (а) объемно-центрированная кубическая, (б) гранецентрированная кубическая и (в) шестиугольная плотно упакованная. На рис. 2 показаны эти три шаблона. Объемно-центрированный кубический В по центру тела кубическое (ОЦК) расположение атомов, элементарная ячейка состоит из восьми атомы в углах куба и один атом в центре тела куба. Гранецентрированный куб В гранецентрированном
кубическое (ГЦК) расположение атомов, элементарная ячейка состоит из
восемь атомов в углах куба и по одному атому в центре каждого из
грани куба. Шестигранник В закрытой упаковке В шестиграннике плотноупакованное (ГПУ) расположение атомов, элементарная ячейка состоит из три слоя атомов. Верхний и нижний слои содержат по шесть атомов. углы шестиугольника и один атом в центре каждого шестиугольника. Середина слой содержит три атома, расположенные между атомами верхнего и нижнего слои, отсюда и название плотноупакованные. Большинство схем структурных ячеек для ВСС и ФКК формы железа нарисованы так, как если бы они были одного размера, как показано на рис. 2, но их нет. В компоновке BCC структурная ячейка, которая использует всего девять атомов, намного меньше. Рис. 2. Распространенные типы решеток Металлы, такие как (х-железо (Fe) (феррит), хром (Cr),
ванадий (V), молибден (Mo) и вольфрам (W) обладают ОЦК-структурами. Эти
Металлы ОЦК имеют два общих свойства: высокую прочность и низкую пластичность. Резюме Важная информация в этой главе кратко ниже. Общие сведения о типах решеток Кристаллическая структура состоит из атомов, расположенных в узор, который периодически повторяется в трехмерной геометрической решетке. Объемно-центрированная кубическая структура представляет собой расположение атомов в котором элементарная ячейка состоит из восьми атомов в углах куба и одного атом в центре тела куба. Гранецентрированная кубическая структура представляет собой расположение атомов
в котором элементарная ячейка состоит из восьми атомов в углах куба и одного
атом в центре каждой из шести граней куба. Гексагональная плотно упакованная структура представляет собой компоновку атомов, в которых элементарная ячейка состоит из трех слоев атомов. Верх и нижние слои содержат шесть атомов в углах шестиугольника и один атом в центр каждого шестиугольника. Средний слой состоит из трех атомов, расположенных между атомы верхнего и нижнего слоев. Металлы, содержащие структуры ОЦК, включают феррит, хром, ванадий, молибден и вольфрам. Эти металлы обладают высокой прочность и низкая пластичность. Металлы, содержащие структуры FCC, включают аустенит, алюминий, медь, свинец, серебро, золото, никель, платина и торий. Эти металлы обладают низкой прочностью и высокой пластичностью. Металлы, содержащие ГПУ структуры, включают бериллий, магний, цинк, кадмий, кобальт, таллий и цирконий. HCP-металлы не такой же пластичный, как металлы FCC. ЗЕРНОВАЯ СТРУКТУРА И ГРАНИЦА Металлы
содержат зерна и кристаллические структуры. | |||||


 Кристаллический
микроструктуры организованы в виде трехмерных массивов, называемых решетками. Этот
В этой главе мы обсудим три наиболее распространенные решетчатые структуры и их
характеристики.
Кристаллический
микроструктуры организованы в виде трехмерных массивов, называемых решетками. Этот
В этой главе мы обсудим три наиболее распространенные решетчатые структуры и их
характеристики.  геометрическая решетка. Силы химической связи вызывают это повторение. Это
этот повторяющийся шаблон, который контролирует такие свойства, как прочность, пластичность,
плотность (описано в Модуле 2, Свойства металлов), электропроводность (свойство
проведения или передачи тепла, электричества и т. д.) и формы.
геометрическая решетка. Силы химической связи вызывают это повторение. Это
этот повторяющийся шаблон, который контролирует такие свойства, как прочность, пластичность,
плотность (описано в Модуле 2, Свойства металлов), электропроводность (свойство
проведения или передачи тепла, электричества и т. д.) и формы.
 (что допускает постоянную деформацию). Металлы FCC, такие как y-железо (Fe)
(аустенит), алюминий (Al), медь (Cu), свинец (Pb), серебро (Ag), золото (Au),
никель (Ni), платина (Pt) и торий (Th), как правило, имеют более низкую прочность.
и более высокая пластичность, чем у металлов BCC. ГПУ-структуры обнаружены в бериллии.
(Be), магний (Mg), цинк (Zn), кадмий (Cd), кобальт (Co), таллий (TI) и
цирконий (Zr).
(что допускает постоянную деформацию). Металлы FCC, такие как y-железо (Fe)
(аустенит), алюминий (Al), медь (Cu), свинец (Pb), серебро (Ag), золото (Au),
никель (Ni), платина (Pt) и торий (Th), как правило, имеют более низкую прочность.
и более высокая пластичность, чем у металлов BCC. ГПУ-структуры обнаружены в бериллии.
(Be), магний (Mg), цинк (Zn), кадмий (Cd), кобальт (Co), таллий (TI) и
цирконий (Zr).
