Цинк в химии: Ошибка 403 — доступ запрещён
alexxlab | 14.07.2023 | 0 | Разное
Цинк. Большая российская энциклопедия
Химические элементы
- Области знаний:
- Общие вопросы химии
- Символ:
- Zn
- Атомный номер:
- 30
- Группа элементов:
- Переходные металлы
- Относительная атомная масса:
- 65,38 а. е. м.
- Радиус атома:
- 133,2 пм
- Электроотрицательность (шкала Полинга):
- 1,65 ед.
- Агрегатное состояние:
- Твёрдое
- Плотность при н. у.:
- 7,133 г/см³
- Температура плавления:
- 419,58 °C
- Температура кипения:
- 906,2 °C
Цинк (лат. Zincum), Zn, химический элемент II группы короткой формы (12-й группы длинной формы) периодической системы; атомный номер 30; атомная масса 65,38. В природе 5 стабильных изотопов: 64Zn (48,6 %), 66Zn (27,9 %), 67Zn (4,1 %), 68Zn (18,8 %) и 70Zn (0,6 %). Важнейший радиоизотоп 65Zn (период полураспада Т1/2 243,8 суток, электронный захват).
Историческая справка
Сплавы цинка (латунь) были известны с глубокой древности (2400–2000 до н. э.). Получение латуни описал древнегреческий географ Страбон. Выделение металлического цинка при восстановительном процессе впервые осуществлено, по-видимому, в Индии в 13 в. н. э., затем в Китае, где в эпоху династии Мин использовались цинковые монеты. Промышленное производство цинка в Европе началось в 18 в. (Англия, Силезия, Бельгия). Происхождение названия элемента связывают с немецким Zinke – острие, зуб, благодаря внешнему виду металла.
Распространённость в природе
Содержание цинка в земной коре 7,6·10–3 % по массе. Элемент относится к халькофилам, важнейшие руды – сульфиды. По мере разрушения горных пород цинк выщелачивался и осаждался в виде карбонатов, силикатов или фосфатов. Известно свыше 70 минералов цинка, из них важнейшие: сфалерит (цинковая обманка) – кубическая модификация ZnS, его светлая разновидность – клейофан и чёрная – марматит; вюртцит – гексагональная модификация ZnS; смитсонит ZnCO3; каламин (гемиморфит) Zn4[Si2O7](OH)2·H2O; цинкит (Zn,Mn)O, виллемит Zn2SiO4; франклинит (Zn,Fe,Mn)(Fe,Mn)2O4. Минералы цинка обычно ассоциируются с минералами Рb и Сu в полиметаллических рудах. Постоянные спутники цинка в рудах – рассеянные элементы Cd, In, Ge, Ga, Tl.Минерал сфалерит, источник цинка в природе.
Фото: Vvoennyy / legion-media.ru
Минералы цинка обычно ассоциируются с минералами Рb и Сu в полиметаллических рудах. Постоянные спутники цинка в рудах – рассеянные элементы Cd, In, Ge, Ga, Tl.Минерал сфалерит, источник цинка в природе.
Фото: Vvoennyy / legion-media.ru
Свойства
Конфигурация внешней электронной оболочки атома цинка 3d104s2; в соединениях проявляет степень окисления +2; энергия ионизации Zn0→Zn+→Zn2+→Zn3+ 906,4; 1733,3; 3832,6 кДж/моль; сродство к электрону 9 кДж/моль, электроотрицательность по Полингу 1,65; атомный радиус 133,2 пм, ионный радиус (пм, в скобках указано координационное число) Zn2+ 60 (4), 74 (6).
В свободном состоянии цинк – голубовато-белый металл. Кристаллическая решётка гексагональная плотноупакованная; tпл 419,58 °C, tкип 906,2 °C; плотность 7133 кг/м3. Диамагнитен. Ниже 0,825 К – сверхпроводник. При комнатной температуре хрупок, при 100–150 °C становится пластичным и прокатывается в тонкие листы и проволоку, при 200–250 °C – очень хрупок, может быть истолчён в порошок. Цинковая пыль пирофорна.
Цинковая пыль пирофорна.
Стандартный электродный потенциал для пары Zn2+/Zn0 –0,76 В. Компактный цинк тускнеет на воздухе, покрываясь тонким слоем оксида ZnO. На воздухе сгорает с образованием ZnO. Реагирует с парáми воды при нагревании с выделением Н2, с кислотами и щелочами в водном растворе с образованием солей гидроксоцинкатов, например Na2[Zn(OH)4]. Взаимодействует с галогенами и халькогенами, образуя галогениды и халькогениды. При действии Р образуются фосфиды Zn3P2 и ZnP2. Получены арсениды аналогичного состава и стибиды Zn3Sb2, Zn4Sb3 и ZnSb. Все соединения цинка с Р, As и Sb – полупроводники. Гидроксид и соли цинка растворимы в растворах NH3 с образованием комплексных катионов, содержащих 1–6 молекул NH3. Комплексные аммиакаты хорошо растворимы в воде. Фосфид Zn3P2 разлагается горячей водой и кислотами с выделением РН3, применяется как зооцид (родентицид). Ортофосфат Zn3(PO4)2 – антисептик для древесины, инсектицид, компонент необрастающих красок. Стеарат (C17H35COO)2Zn – вспомогательный сиккатив, загуститель смазок, компонент косметических кремов, пудры и др. ZnO – пигмент (цинковые белила).
Ортофосфат Zn3(PO4)2 – антисептик для древесины, инсектицид, компонент необрастающих красок. Стеарат (C17H35COO)2Zn – вспомогательный сиккатив, загуститель смазок, компонент косметических кремов, пудры и др. ZnO – пигмент (цинковые белила).
Цинк относится к микроэлементам; необходим для жизнедеятельности растений, животных и человека, т. к. входит в состав некоторых ферментов и гормонов.
Получение
Исходное сырьё – сульфидные цинковые и полиметаллические руды. Гидрометаллургический способ: огарок после обжига рудного концентрата обрабатывают отработанным электролитом, содержащим H2SO4. Полученный раствор ZnSO4 очищают от примесей Fe, As, Sb, Al, In, Ga, Сu, Cd, Ni и Со. Из очищенного раствора цинк осаждают электролитически на алюминиевых катодах. Отработанный электролит возвращают на выщелачивание. Из отходов, получаемых при удалении примесей, попутно извлекают редкие элементы. Пирометаллургическое производство также начинают окислительным обжигом, а затем агломерат восстанавливают углём или коксом, при этом цинк отгоняется, его пары конденсируют и подвергают многоступенчатой очистке от примесей. Для получения цинка высокой чистоты используют дистилляцию в инертной атмосфере или в вакууме, ректификацию и зонную перекристаллизацию в атмосфере Аr.
Пирометаллургическое производство также начинают окислительным обжигом, а затем агломерат восстанавливают углём или коксом, при этом цинк отгоняется, его пары конденсируют и подвергают многоступенчатой очистке от примесей. Для получения цинка высокой чистоты используют дистилляцию в инертной атмосфере или в вакууме, ректификацию и зонную перекристаллизацию в атмосфере Аr.
Объём мирового производства 12,609 млн. т/год (2012).
Применение
Основная область использования цинка – антикоррозионные покрытия железа и стали и получение сплавов. Цинк применяют в аккумуляторах и сухих элементах, в типографском деле, в металлургии при рафинировании Рb от Ag и Аu, для выделения Cd, In, Au из растворов цементацией, в качестве восстановителя в органическом синтезе.
Цинк малотоксичен. Оксид и фосфид цинка токсичны. Растворимые соли вызывают расстройство пищеварения, раздражение слизистых оболочек.
Аликберова Людмила Юрьевна. Первая публикация: Большая российская энциклопедия, 2017.
Дата публикации: 24 августа 2022 г. в 12:29 (GMT+3)
Цинк и его соединения | ChemToday — химический портал
Цинк (Zn) — 30-й элемент таблицы Менделеева, по внешнему виду представляющий из себя металл серебристого цвета со слегка синеватым отливом. Он довольно пластичен, на воздухе покрывается оксидной плёнкой, предохраняющей его от дальнейшего окисления. Довольно невысокая температура плавления (420°С) позволяет использовать его в качестве материала для металлических изделий.
Металлический цинкРаспространённость в природе и получение
Цинк — очень распространённый элемент. Природные соединения цинка включают в себя сульфид ZnS (две полиморфные модификации: вюрцит и сфалерит), он же цинковая обманка; карбонат ZnCO3 — цинковый шпат.
Сфалерит, цинковая обманкаДля получения чистого цинка руды сначала обжигают, а затем восстанавливают полученный оксид углём:
$$\ce{2ZnS + 3O_2 -> 2ZnO + 2SO_2}$$ $$\ce{ZnCO_3 -> ZnO + CO_2}$$ $$\ce{ZnO + C -> Zn + CO}$$
Химические свойства
Цинк относится к довольно реакционноспособным металлам, поэтому и химических реакций с ним довольно много.
При повышении температуры цинк реагирует с неметаллами: кислородом, галогенами, серой, фосфором:
$$\ce{2Zn + O_2 -> 2ZnO}$$ $$\ce{Zn + Cl_2 -> ZnCl_2}$$ $$\ce{3Zn + 2P ->Zn_3P_2}$$ $$\ce{Zn + S ->ZnS}$$
Реакция цинка с серой — одна из очень красивых, но относительно безопасных пиротехнических реакций, которую можно посмотреть в видео ниже:
Видео с YouTube-канала ChemTodayС кислотами-неокислителями цинк реагирует довольно быстро, выделяя водород:
$$\ce{Zn + 2HCl ->ZnCl_2 + H_2\uparrow}$$
А при повышенной температуре (в раскалённом состоянии) цинк окисляется водой до оксида:
$$\ce{Zn_{раскал. } + H_2O ->[\ce{temp}]ZnO + H_2\uparrow}$$
} + H_2O ->[\ce{temp}]ZnO + H_2\uparrow}$$
С кислотами-окислителями, то есть концентрированной серной, разбавленной и концентрированной азотной, цинк реагирует очень быстро, и в зависимости от концентрации кислоты получаются разные продукты восстановления элемента-окислителя в кислоте:
$$ \ce{3Zn + 8HNO_{3 (конц.)} ->3Zn(NO_3)_2 + 2NO\uparrow + 4H_2O}$$ $$\ce{4Zn + 10HNO_{3 (разб.)} -> 4Zn(NO_3)_2 + N_2O\uparrow + 5H_2O}$$ $$\ce{5Zn + 12HNO_{3 (оч. разб.)} -> 5Zn(NO_3)_2 + N_2\uparrow + 6H_2O}$$ $$\ce{4Zn + 10HNO_{3 (оч. разб.)} -> 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O}$$ $$\ce{Zn + 2H_2SO_{4 (конц.)} -> ZnSO_4 + SO_2 + 2H_2O}$$ $$\ce{3Zn + 4H_2SO_{4 (мен. конц.)} -> 3ZnSO_4 + S + 4H_2O}$$ $$\ce{4Zn + 5H_2SO_{4 (сред. конц.)} -> 4ZnSO_4 + H_2S + 4H_2O}$$ $$\ce{Zn + H_2SO_{4 (разб.)} -> ZnSO_4 + H_2}$$
Металл имеет амфотерные свойства, поэтому помимо кислот растворяется также в растворах щелочей с образованием комплексных соединений — тетрагидроксоцинкатов, а при сплавлении — метацинкатов:
$$\ce{Zn + 2NaOH + 2H_2O ->[\ce{h3O}] Na_2[Zn(OH)_4] + H_2}$$
$$\ce{Zn + 2NaOH ->[\ce{temp. }] Na_2ZnO_2 + H_2}$$
}] Na_2ZnO_2 + H_2}$$
Вторая реакция идёт в присутствии следов воды или оксида цинка, который может попутно образовываться при высокой температуре сплавления.
За счёт комплексообразования цинк медленно растворяется даже в растворе аммиака, восстанавливая воду. При этом выделяется водород:
$$\ce{Zn + 4NH_3 * H_2O -> [Zn(NH_3)_4](OH)_2 + H_2\uparrow + 2H_2O}$$
Соединения цинка
Оксид цинка ZnO — белое кристаллическое вещество, образующееся при окислении металла кислородом (обжиге) или при разложении его соединений:
Оксид цинка ZnOОксид цинка проявляет амфотерные свойства, и легко реагирует как с кислотами, так и с основными оксидами и щелочами:
$$\ce{ZnO + 2HCl -> ZnCl_2 + H_2O}$$
$$\ce{ZnO + Na_2O -> Na_2ZnO_2}$$
$$\ce{ZnO + 2NaOH + H_2O ->[\ce{h3O}] Na_2[Zn(OH)_4]}$$
$$\ce{ZnO + 2NaOH ->[\ce{temp. }] Na_2ZnO_2 + H_2O\uparrow}$$
}] Na_2ZnO_2 + H_2O\uparrow}$$
Оксид цинка легко превратить в металлический цинк реакцией с разными восстановителями, например, водородом и углём при повышенной температуре:
$$\ce{ZnO + C -> Zn + CO\uparrow}$$ $$\ce{ZnO + H_2 ->Zn + H_2O\uparrow}$$
Гидроксид цинка Zn(OH)2 — твёрдое белое вещество, которое получают действием щёлочи на растворимые соли цинка. При реакции он образуется в виде белого аморфного осадка:
$$\ce{ZnCl_2 + 2NaOH -> Zn(OH)_2\downarrow + 2NaCl}$$
Аналогично оксиду он проявляет амфотерные свойства. То есть очень легко растворяется в кислотах и щелочах, разлагается до оксида при нагревании:
$$\ce{Zn(OH)_2 + 2HNO_3 -> Zn(NO_3)_2 + 2H_2O}$$ $$\ce{Zn(OH)_2 + 2NaOH ->[\ce{h3O}] Na_2[Zn(OH)_4]}$$ $$\ce{Zn(OH)_2 + 2NaOH ->[\ce{temp.}] Na_2ZnO_2 + 2H_2O\uparrow}$$ $$\ce{Zn(OH)_2 ->ZnO + H_2O\uparrow}$$
В отличие от алюминия цинк образует комплекс с аммиаком, и при помощи этой реакции их можно разделить или различить:
$$\ce{Zn(OH)_2 + 4NH_3 -> [Zn(NH_3)_4](OH)_2}$$ $$\ce{Al(OH)_3 + NH_3 ≠}$$
А также в реакции с растворимыми карбонатами осаждается в виде карбоната, а не гидроксида:
$$\ce{ZnCl_2 + Na_2CO_3 -> ZnCO_3\downarrow + 2NaCl}$$ $$\ce{2AlCl_3 + 3Na_2CO_3 + 3H_2O -> 2Al(OH)_3\downarrow + 3CO_2\uparrow + 6NaCl}$$
Любите химию!
Чтобы оставить отзыв, обратитесь к разделу «Комментарии» на правой колонке страницы или внизу страницы при просмотре с мобильного телефона.
Спасибо за просмотр!
Химия цинка – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31652
Название цинка немецкого происхождения, цинк. Это было известно с доисторических времен, и соединения, а также металл использовались за много лет до того, как кто-либо вообще подумал об элементах! Цинк (Zn) представляет собой сине-белый металл умеренной прочности, твердости и пластичности. Цинк является одним из наименее распространенных элементов и в основном производится путем электролиза водного сульфата цинка. Около трети всего металлического цинка используется для изготовления оцинкованных гвоздей. Благодаря низкой температуре плавления и способности образовывать связи с железом или сталью он служит для покрытия металла и защиты его от коррозии. Металлический цинк также используется для изготовления сухих батарей.
Металлический цинк также используется для изготовления сухих батарей.
Физические свойства
Чистый цинк представляет собой голубовато-серебристый и пластичный металл с низкой температурой плавления и кипения. Сегодня большую часть цинка получают из ZnS, извлеченного из руды цинковой обманки и обожженного для удаления серы. Цинк также можно получить электролизом водного сульфата цинка, что является обычным лабораторным упражнением.
Рисунок 1: Латунный штамп вместе с образцами цинка и меди. из Википедии
Цинк играет огромную роль в производстве сплавов. Одним из самых известных сплавов цинка является латунь, которая содержит от 55 до 95% меди. Цинк также принимает участие в производстве припоя, который имеет относительно низкую температуру плавления. Припой используется для соединения электрических компонентов, а также труб и других металлов.
Химические свойства
Цинк достаточно устойчив к коррозии и используется в качестве покрытия для неблагородных металлов, таких как железо (“гальванизация”). Цинк можно легко отливать или формовать. Цинк обладает многими уникальными характеристиками. Например, его пары горят на воздухе зеленым пламенем, образуя оксид цинка. Оксид цинка — это распространенное соединение цинка, которое используется в красках, косметике, пластмассах и многом другом. Металлический цинк очень медленно реагирует со слабыми кислотами. Сера имеет сильное сродство к цинку. При нагревании два порошка реагируют со взрывом с образованием сульфида цинка. Сульфид цинка используется для изготовления экранов телевизоров и люминесцентных ламп.
Цинк можно легко отливать или формовать. Цинк обладает многими уникальными характеристиками. Например, его пары горят на воздухе зеленым пламенем, образуя оксид цинка. Оксид цинка — это распространенное соединение цинка, которое используется в красках, косметике, пластмассах и многом другом. Металлический цинк очень медленно реагирует со слабыми кислотами. Сера имеет сильное сродство к цинку. При нагревании два порошка реагируют со взрывом с образованием сульфида цинка. Сульфид цинка используется для изготовления экранов телевизоров и люминесцентных ламп.
Цинк также реагирует с галогенами. Однако по мере уменьшения электроотрицательности среди группы галогенов снижается реакционная способность с цинком. Таким образом, наиболее электроотрицательный из галогенов (фтор) бурно реагирует с цинком, в то время как менее электроотрицательный галоген (йод) выделяет лишь небольшое количество тепла. Интересно, что на свойства цинка сильно влияют такие примеси, как свинец, кадмий и железо. Также цинк чаще всего используется в качестве восстановителя в химических реакциях и образует комплексные ионы с ионами аммиака и цианида.
Также цинк чаще всего используется в качестве восстановителя в химических реакциях и образует комплексные ионы с ионами аммиака и цианида.
Справки
- Городецкий, Малка; Зингерман, Аммон. «Гальванопластика: импровизированный эксперимент по гальванике». J. Chem. Образовательный 1980 , 57 , 514.
Авторы и авторство
- Табата Шнелкер
Стивен Р. Марсден
Chemistry of Zinc распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Химические свойства
- цинкование
- физические свойства
- Цинк
- цинк
Цинк — Энциклопедия Нового Света
Цинк (химический символ Zn , атомный номер 30) — голубовато-белый металл, который встречается в рудах во многих частях мира. Это важнейший элемент для живых организмов. Различные клетки в организме человека выделяют ионы цинка, и правильное функционирование многих белков зависит от ионов цинка. Цинк считается антиоксидантом, обеспечивающим защиту от преждевременного старения кожи и мышц. Соли цинка используются в лекарствах, которые лечат кожную сыпь, облегчают кашель и борются с болезнетворными микробами.
Содержание
- 1 История
- 2 Изобилие и производство
- 3 Примечательные характеристики
- 3.1 Изотопы
- 4 Здоровье и питание
- 4.1 Источники пищи
- 4.2 Дефицит цинка
- 4.3 Токсичность цинка
- 5 Применение цинка и его сплавов
- 5.1 Популярные заблуждения
- 6 соединений
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Кроме того, цинк является четвертым по распространенности используемым металлом, уступая по годовому объему производства только железу, алюминию и меди. Он используется в таких сплавах, как латунь и нейзильбер, и является основным компонентом американского пенни. Это гальваническое средство, которое защищает сталь от коррозии. Оксид цинка является основой для белых красок, а также используется для защиты от солнечных ожогов и опрелостей. Хлорид цинка является дезодорантом, а сульфид используется в люминесцентных красках.
История
Производство металлического цинка было широко распространено в древней Индии. Многие рудники Завармалы (в Раджастане) были активны еще в 1300–1000 годах 90 188 года до н. э. В рукописи, известной как Чарака Самхита, 300 года до н. э. Раса Ратна Самуккая (800 н.э. ) объясняет существование двух типов руд для металла, один из которых идеален для извлечения металла, другой — для медицинских целей [1].
Цинковые сплавы использовались веками. Например, изделия из латуни (сплав меди и цинка), датируемые 1000–1400 гг. 90–188 гг. до н. э. были найдены в Израиле, а цинковые предметы с 87-процентным содержанием цинка были найдены в доисторической Трансильвании. Учитывая низкую температуру кипения и высокую химическую активность этого металла, изолированный цинк скорее уходит в дымоход, чем захватывается. Следовательно, истинная природа цинка не была понята в древние времена.
Производство латуни было известно римлянам около 30 9 г. до н.э.0188 г. до н. э. , используя метод, при котором каламин (цинковая руда) и медь нагревались вместе в тигле. Оксиды цинка в каламине были восстановлены, и свободный металлический цинк был захвачен медью, образуя сплав. Полученную каламиновую латунь либо отливали, либо придавали ей форму.
до н.э.0188 г. до н. э. , используя метод, при котором каламин (цинковая руда) и медь нагревались вместе в тигле. Оксиды цинка в каламине были восстановлены, и свободный металлический цинк был захвачен медью, образуя сплав. Полученную каламиновую латунь либо отливали, либо придавали ей форму.
Выплавка и извлечение нечистых форм цинка осуществлялись уже в 1000 г. г. н.э. г. в Индии и Китае. На Западе нечистый цинк в виде остатка в плавильных печах был известен с древности, но его обычно выбрасывали как негодный. Страбон упоминает об этом как псевдоаргурос , или «ложное серебро». Бернская цинковая табличка – это вотивная табличка, датируемая Римской Галлией, вероятно, сделанная из таких остатков цинка.
Открытие чистого металлического цинка чаще всего приписывают немцу Андреасу Маргграфу в 1746 году, но вся эта история является предметом споров. В 1597 году английский металлург Либавиус получил некоторое количество металлического цинка в чистом виде, до того неизвестного на Западе. Либавий назвал его «индийским / малабарским свинцом», а Парацельсу (1616 г.) приписывают название «цинк». О незнании ценности этого металла можно судить по тому факту, что до 1751 года Универсальный словарь Постлевейта (наиболее достоверный источник всей технической информации в Европе) ничего не упоминал о цинке.
Либавий назвал его «индийским / малабарским свинцом», а Парацельсу (1616 г.) приписывают название «цинк». О незнании ценности этого металла можно судить по тому факту, что до 1751 года Универсальный словарь Постлевейта (наиболее достоверный источник всей технической информации в Европе) ничего не упоминал о цинке.
В 1738 году Уильяму Чемпиону приписывают патентование в Великобритании процесса извлечения цинка из каламина в плавильном заводе, технологию, которую он приобрел после посещения цинковых рудников Завара в Завармале и его окрестностях, Раджастхан. Его первый патент был отклонен патентным судом на основании плагиата технологии, распространенной в Индии. Однако он получил патент по своей второй заявке. Каламин был минеральным источником металлического цинка до разработки метода флотации сульфида цинка, указанного ниже.
Изобилие и производство
Цинк является двадцать третьим наиболее распространенным элементом в земной коре. Цинковые рудники есть по всему миру, крупнейшими производителями являются Австралия, Канада, Китай, Перу и США.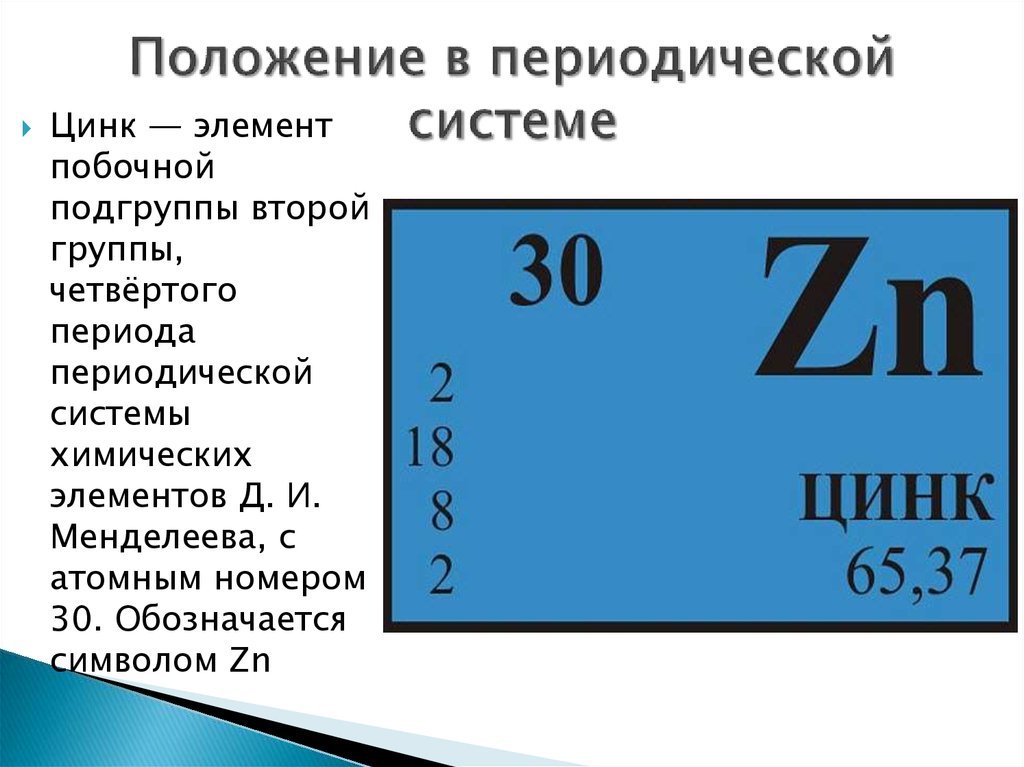 Шахты в Европе включают Vieille Montagne в Бельгии; холм Тара, Галмой и Лишин в Ирландии; и Цинкгруван в Швеции.
Шахты в Европе включают Vieille Montagne в Бельгии; холм Тара, Галмой и Лишин в Ирландии; и Цинкгруван в Швеции.
Минералы, из которых извлекают цинк, включают сфалерит (сульфид цинка), смитсонит (карбонат цинка), гемиморфит (силикат цинка) и франклинит (цинковая шпинель). Наиболее интенсивно добываемые руды (особенно сфалерит), как правило, содержат примерно 10 процентов железа, а также 40-50 процентов цинка.
Металлический цинк производится с использованием экстрактивной металлургии. Минералы сульфида цинка (сфалерита) концентрируют методом «пенной флотации», а затем обычно обжигают с использованием «пирометаллургии» для окисления сульфида цинка до оксида цинка. Оксид цинка выщелачивается в несколько стадий все более сильной серной кислотой. Железо обычно отбраковывают в виде ярозита или гетита, одновременно удаляя другие примеси. Окончательная очистка использует цинковую пыль для удаления меди, кадмия и кобальта. Затем металл извлекают из раствора электролизом (крупномасштабное гальванопокрытие) в виде катодных отложений. Цинковые катоды могут быть непосредственно отлиты или сплавлены с алюминием.
Цинковые катоды могут быть непосредственно отлиты или сплавлены с алюминием.
Примечательные характеристики
Цинк (от немецкого zink ) представляет собой металлический элемент, который находится в периоде 4 и группе 12 (бывшая группа 2B) периодической таблицы. В периоде 4 он следует сразу за медью, а в группе 12 лежит выше кадмия и ртути. Это умеренно реактивный элемент, который тускнеет во влажном воздухе, образуя слой карбоната. Реагирует с кислотами и щелочами. Когда он не совсем чистый, он реагирует с разбавленными кислотами с выделением водорода. Одна распространенная степень окисления цинка +2.
Как элемент группы 12, цинк традиционно классифицируется как «переходный металл». Однако эта точка зрения была изменена на основе текущего определения переходных элементов, установленного Международным союзом теоретической и прикладной химии (IUPAC). Согласно этому определению, переходный элемент — это «элемент, атом которого имеет неполную d-подоболочку или который может давать катионы с неполной d-подоболочкой» [2]. Цинк не подходит под это определение, потому что его атомы и ионы содержат электроны, которые полностью заполняют d орбитали.
Цинк не подходит под это определение, потому что его атомы и ионы содержат электроны, которые полностью заполняют d орбитали.
Изотопы
Встречающийся в природе цинк состоит из пяти стабильных изотопов: 64 Zn, 66 Zn, 67 Zn, 68 Zn и 70 Зн. Из них 64 Zn является наиболее распространенным (48,6%) в природе. Кроме того, был охарактеризован 21 радиоизотоп цинка, из которых наиболее распространенным является 65 Zn с периодом полураспада 244,26 дня, а 72 Zn имеет период полураспада 46,5 часов. Все другие радиоактивные изотопы имеют период полураспада менее 14 часов, а период полураспада большинства из них составляет менее 1 секунды.
Здоровье и питание
В ионной форме цинк необходим для поддержания жизнедеятельности живых организмов. Подсчитано, что три тысячи из сотен тысяч белков в организме человека используют цинк, присоединенный к связывающим белок молекулам, называемым «протезными группами».
Более дюжины типов клеток в организме человека секретируют ионы цинка, и в настоящее время активно изучается роль этих секретируемых сигналов цинка в здоровье и медицине. Интересно, что клетки головного мозга в переднем мозге млекопитающих являются одним из типов клеток, которые секретируют цинк вместе с другими веществами, передающими нейроны. Другие клетки, которые выделяют цинк, включают клетки слюнных желез, предстательной железы, иммунной системы и кишечника.
Соли цинка эффективны против патогенов при непосредственном применении. Инфекции желудочно-кишечного тракта (ЖКТ) также сильно ослабляются при приеме внутрь цинка, и этот эффект может быть связан с прямым антимикробным действием ионов цинка в желудочно-кишечном тракте или абсорбцией цинка и его повторным высвобождением из иммунных клеток, или и тем, и другим.
Прямое воздействие цинка (как в леденцах) на бактерии и вирусы также хорошо известно, и он используется в качестве паллиативной мази в солях цинка, по крайней мере, с 2000 г. г. до н. э. Однако вопрос о том, как именно доставлять соли цинка против патогенов, не повреждая собственные ткани, все еще исследуется.
г. до н. э. Однако вопрос о том, как именно доставлять соли цинка против патогенов, не повреждая собственные ткани, все еще исследуется.
Недавно было показано, что значительное потребление цинка с пищей препятствует развитию гриппа. Кроме того, клинические исследования показали, что цинк в сочетании с антиоксидантами может задерживать прогрессирование возрастной дегенерации желтого пятна, но его эффективность, по-видимому, ограничена.
Пищевые источники
Пищевые продукты и специи, содержащие необходимый минерал цинк.
Цинк содержится в устрицах и, в гораздо меньшей степени, в большинстве белков животного происхождения, бобах, орехах, цельных зернах, семенах тыквы и подсолнечника. Известно, что фитаты (соли фитиновой кислоты), содержащиеся в цельнозерновом хлебе, крупах, бобовых и других продуктах, снижают усвоение цинка. Методы сохранения почвы анализируют растительное поглощение встречающегося в природе цинка во многих типах почв.
Дефицит цинка
Дефицит цинка возникает в результате недостаточного поступления или усвоения цинка организмом. Признаки дефицита цинка включают выпадение волос, поражения кожи, диарею, истощение тканей тела и, в конечном итоге, смерть. Зрение, вкус, обоняние и память также связаны с цинком, а дефицит цинка может вызвать сбои в работе этих органов и функций. Врожденные аномалии, вызывающие дефицит цинка, могут привести к заболеванию, называемому энтеропатическим акродерматитом.
Получение достаточного количества цинка во время беременности и у детей раннего возраста является реальной проблемой, особенно для тех, кто не может позволить себе хорошее и разнообразное питание. Развитие мозга останавливается из-за недостатка цинка в утробе матери и в молодости. Мальчикам-подросткам требуется 11 миллиграммов цинка.
Токсичность цинка
Несмотря на то, что цинк необходим для здорового организма, слишком много цинка может быть вредным. Например, чрезмерное поглощение цинка может также подавлять поглощение меди и железа. Проглотив монету в один цент США (98 процентов цинка) могут повредить слизистую оболочку желудка из-за высокой растворимости ионов цинка в кислой среде желудка (Bothwell and Mair, 2003). Британский пенни, напротив, сделан из стали с медным покрытием. Существует также состояние, называемое цинковыми встрясками или цинковыми ознобами , которое может быть вызвано вдыханием свежеобразованного оксида цинка во время сварки оцинкованных материалов.
Проглотив монету в один цент США (98 процентов цинка) могут повредить слизистую оболочку желудка из-за высокой растворимости ионов цинка в кислой среде желудка (Bothwell and Mair, 2003). Британский пенни, напротив, сделан из стали с медным покрытием. Существует также состояние, называемое цинковыми встрясками или цинковыми ознобами , которое может быть вызвано вдыханием свежеобразованного оксида цинка во время сварки оцинкованных материалов.
Токсичность цинка, в основном в виде проглатывания пенни США, отчеканенных после 1982 г., обычно приводит к летальному исходу у собак, вызывая тяжелую гемолитическую анемию (Stowe, et al. 19).78, 270).
Кроме того, свободный ион цинка в растворе очень токсичен для растений, беспозвоночных и даже позвоночных рыб. Модель активности свободных ионов (FIAM) хорошо известна в научной литературе и показывает, что даже микромолярные количества свободных ионов убивают некоторые организмы.
Применение цинка и его сплавов
Цинк и его сплавы имеют ряд применений, некоторые из которых приведены ниже.
- Цинк используется для защиты стали от ржавчины и коррозии путем (а) гальванизации, при которой металл покрывается цинком посредством электрохимического процесса; или (b) Паркеризация, при которой металл погружают в раствор цинка в фосфорной кислоте.
- Цинк используется в таких сплавах, как латунь, никелированное серебро, металл для пишущих машинок, различные паяльные составы и нейзильбер.
- Цинк является основным металлом, используемым для изготовления американских пенни с 1982 года.
- Цинк используется в литье под давлением, особенно в автомобильной промышленности.
- Цинк используется в составе контейнеров электрических аккумуляторов.
- Цинк используется в современном органостроении в качестве заменителя классического сплава свинца и олова в трубах, звучащих самыми низкими (педальными) тонами, потому что он тонально почти неотличим от свинца / олова на этих высотах и имеет дополнительные преимущества: гораздо экономичнее и легче по весу.
 Даже лучшие строители органов используют цинк в этом качестве.
Даже лучшие строители органов используют цинк в этом качестве. - Цинк является четвертым распространенным материалом, используемым в металлической настенной плитке, и используется на кухнях из-за его бактерицидных свойств [3].
- Цинк входит в состав большинства безрецептурных витаминных и минеральных добавок в виде одной таблетки. Считается, что он обладает антиоксидантными свойствами, которые защищают от преждевременного старения кожи и мышц тела. Некоторые считают, что в больших количествах, принимаемых в виде одного цинка в других патентованных рецептах, он ускоряет процесс заживления после травмы. Препараты включают ацетат цинка и глюконат цинка.
- Цинк используется в качестве анода или топлива воздушно-цинковой батареи/топливного элемента.
Популярные заблуждения
Весьма характерные металлические счетчики традиционных французских слитков часто называют цинковыми слитками (или цинковыми ), но цинк никогда не использовался для этой цели, и счетчики действительно сделаны из сплав свинца и олова.
Соединения
Примерно четверть всего производимого цинка потребляется в виде соединений цинка. Некоторые из их применений перечислены ниже.
- Оксид цинка, возможно, является самым известным и наиболее широко используемым соединением цинка, так как он является хорошей основой для белых пигментов в красках и акварелях. Он также используется в качестве активатора в резиновой промышленности. В качестве безрецептурной мази ее наносят тонким слоем на открытые участки кожи лица или носа, чтобы предотвратить обезвоживание этого участка кожи. Он может защитить от солнечных ожогов летом и обветривания зимой. Нанесенный тонким слоем на область подгузника ребенка (промежность) при каждой смене подгузника, он может защитить от сыпи.
- Хлорид цинка используется в качестве дезодоранта, а также может использоваться в качестве консерванта для древесины.
- Сульфид цинка используется в люминесцентных пигментах, например, для стрелок часов и других предметов, светящихся в темноте.

- Метил цинка (Zn(CH 3 ) 2 ) используется в ряде химических реакций для синтеза органических соединений.
- Цинк стеарат представляет собой смазочную добавку для пластмасс.
- Лосьоны из каламина, смеси Zn-(гидрокси-)карбонатов и силикатов, используются для лечения кожной сыпи.
- Глюконат цинка, глицин и ацетат цинка также используются в леденцах от горла для облегчения кашля и симптомов простуды [4].
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Лос-Аламосская национальная лаборатория — цинк
- Stowe, C.M., R. Nelson, R. Werdin, et al. 1978. «Отравление фосфидом цинка у собак». ЯВМА 173 (1978).
Внешние ссылки
Все ссылки получены 16 октября 2020 г.
- WebElements.com — Цинк
- Статистика и информация Геологической службы США
- Восстанавливающие агенты > Цинк
Авторы
Энциклопедия Нового Света и редакторы переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia .

