Цинка общая характеристика: Ошибка 403 — доступ запрещён
alexxlab | 23.05.2023 | 0 | Разное
16. Общая характеристика и химические свойства элементов подгруппы цинка.
Соли цинка, кадмия и ртути, их гидролиз. Амидные соединения ртути. Соединeния Hg22+: получение и свойства.
Общая характеристика подгруппы цинка, их химические свойства (Zn,Cd,Hg).
В соединениях в основном проявляют степень окисления +2,электроны характеризуются d10-конфигурацией. Исключение проявляют производные иона Hg22+, который формально проявляет степень окисления +1. Для комплексных соединений более характерно КЧ4, однако для кадмия характерно образование соединений с КЧ6. Для ртути характерно образование связей Hg-Hg, образование связей с другими металлами (Hg6[Rh(PM3)3]4, [Os3(CO)11Hg]3).
Получение: Цинк добывают из сульфидных руд:
2ZnS + 3O2 = 2ZnO + 3SO2
2ZnO + C = 2Zn + CO2
Кадмий
получают из побочных продуктов переработки
цинковых, свинцово-цинковых и медно-цинковых
руд.
Ртуть добывают относительно прямым способом:
HgS + O2 = Hg + SO2.
Химические свойства: Цинк и кадмий довольно похожи, а ртуть несколько отличается. Цинк и кадмий при нагревании взаимодействуют с кислородом, серой, фосфором и галогенами; ртуть не взаимодействует с фосфором. Ни один из металлов не реагирует с водородом, углеродом и азотом.
Сплавы ртути с другими металлами – амальгамы, являются мягкими восстановителями:
2NaHg + 2H2O = 2Hg + 2NaOH + H2
Цинк – более сильный восстановитель, чем кадмий:
Zn 0 + Cd2+ = Zn2++ Cd0
С разбавленными кислотами:
Zn + H2SO4(разб) = ZnSO4 + H2
С кислотами-окислителями:
Zn + 4HNO3(конц,гор)=Zn(NO3)2 + 2NO2+2H2O
4Zn + 10HNO3(разб,гор)=4Zn(NO3)2 + N2O + 5H2O
Ртуть не взаимодействует с разбавленными кислотами, но с концентрированными:
Hg+4HNO3(конц)=Hg(NO3)2 +2NO2 + 2H2O
Hg+2H2SO4(конц,гор)=HgSO4 + SO2 + 2 H2O
Разбавленная азотная образует динитрат ртути:
6Hg+8HNO3 = 3Hg2(NO
Цинк
– единственный представитель группы,
который растворяется в водн. р-рах
щелочей с образованием комплексов:
р-рах
щелочей с образованием комплексов:
Zn+2OH– + 2H2O = [Zn(OH)4]2- + H2
Zn + 4NH3*H2O=[Zn(NH3)4](OH)2 + 2H2O + H2.
Соли цинка, кадмия и ртути, их гидролиз
Сульфиды цинка, кадмия и ртути малорастворимы. Сфалерит ZnS – главный источник цинка. Легко растворяется в кислотах с выделением сероводорода
ZnS + 2H3O+ = Zn2+ + H2S + 2H2O
Сульфид кадмия более устойчив, выпадает в осадок даже в кислой среде, устойчив к действию растворов щелочей и большинства кислот. Сульфид кадмия получают:
CdSO4 + BaS = CdS + BaSO 4 (камподон – смесь сульфата бария и сульфида кадмия)
Сульфид ртути подвергается действию только концетрированных HBr и HCl или царской водки или царской водки:
3HgS + 8HNO3 + 6 HCl = 3HgCl2 + 3H2SO4 + 8NO + 4H2O
Галогениды – известны все галогениды элементов
этой подгруппы, а так же 4 галогенида
диртути.
2HgCl2+[SnCl3]– + Cl– = Hg2Cl2 + [SnCl6]2-
Для цинка и кадмия наиболее характерны тетраэдрические комплексы.
Zn(OH)2 + 4NH3*H2O = [Zn(NH3)4](OH)2 + 4H2O, для кадмия и октаэдрические:
Cd(OH)2+6NH3*H2O = [Cd(NH3)6](OH)2
Соли ртути в водной среде осаждаются в виде основных солей:
Hg(NO3) + H2O = Hg(OH)(NO3) + HNO3
При поджигании Hg(SCN)2 –«фараоновы змеи»
2Hg(SCN)2 = 2Hgs + C3N2 + CS2+N2
Реактив Несслера – крайне чувствительный реагент на аммиак:
2K2[HgI4]
+ 3KOH
+ NH3 = Hg2NI*H2O
+ 7KI
+ 2H2O
– иодидная соль основания Миллона
([Hg2N(OH)*(H2O)2).
Ртуть образовывает прямые связи с азотом:
HgCl2 + 2NH3 =(HgNH2)Cl + NH4Cl
При избытке NH4+:
HgCl2 + 2NH3 =[Hg(NH3)2)Cl 2].
Соединения Hg 22+:
Получение: взаимодействием хлорида ртути(II) и металлической ртути при высокой температуре
HgCl2 + Hg = Hg2Cl2
взаимодействием хлорида ртути(II) с цианидом ртути(II):
HgCl2+Hg(CN)2 = Hg2Cl2 + C2N2
Свойства: катион диртути в водном растворе диспропорционирует
Hg22+ = Hg + Hg2+
Hg22++2OH– = HgO + Hg + H2O
Hg22+ + S2- = HgS + Hg
Большинство солей нерастворимы. ОВР с сильными окислителями и восстановителями
Hg2(NO3)2 + 4 HNO3 = 2Hg(NO3)2 + 2NO + 2H2O
Hg2Cl2 + [SnCl3]– + Cl– = 2Hg + [SnCl6]2-
Гидролиз солей:
ZnSO4 + 2h3O = Zn(OH)2 + h3SO4
Cd(CN)2 + 2H2O = Cd(OH)2 + HCN
От
солей цинка к солям ртути гидролиз
ослабевает, соли ртути очень слабо
диссоциированы.
Т.к. Hg(OH)2 не существует, то при гидролизе:
2Hg(NO3)2 + H2O = Hg2O(NO3)2 + 2HNO3
Аммонийные соединения ртути Только для ртути известны амидные соединения, содержащие связь Hg—N устойчивые в водной среде (другие металлы образуют подобные соединения лишь в неводных растворах).
Для Hg (II):
HgCl2 + 2Nh5OH→[HgNh3]Cl2↓ + Nh5Cl + 2h3
Для Hg (I)
Hg 2Cl2 + 2Nh4→[HgNh3]Cl↓ + Nh5Cl + Hg↓
ХиМиК.ru – §4. Подгруппа цинка
По распространенности в природе цинк и его аналоги стоят далеко позади соответствующих элементов подгруппы кальция. Содержание цинка в земной коре оценивается в 0,001%, кадмия 8·10 –6 % и ртути – 6·10–7 %.
Все три элемента встречаются
преимущественно в виде сернистых соединений типа ЭS. Важнейшими рудами цинка и ртути являются минералы цинковая обманка
(ZnS) и киноварь (HgS). Аналогичный им природный сульфид кадмия – минерал гринокит (CdS)–самостоятельно встречается крайне редко. Напротив, небольшие количества CdS почти всегда
содержатся в цинковой обманке. Важной рудой цинка является также минерал галмей
(ZnСО3 ). Минералы цинка очень
часто встречаются совместно со свинцовыми и серебряными. В состав большинства
подобных полиметаллических (содержащих несколько металлов) руд входит также и
кадмий.
Напротив, небольшие количества CdS почти всегда
содержатся в цинковой обманке. Важной рудой цинка является также минерал галмей
(ZnСО3 ). Минералы цинка очень
часто встречаются совместно со свинцовыми и серебряными. В состав большинства
подобных полиметаллических (содержащих несколько металлов) руд входит также и
кадмий.
Процесс получения элементарного цинка из руд проводится в две стадии. Сначала обжигом на воздухе переводят сульфид в окись, а затем восстанавливают ее углем:
2ZnS + ЗО2 = 2SO2 + 2ZnO
и
ZnO + С = СО + Zn
Образующиеся по второй реакции пары цинка увлекаются током СО и сгущаются в конденсаторах. Однако часть их уносится далее и оседает затем в виде тонкого порошка. Основная масса последнего подвергается повторной переработке, частично же он поступает в продажу под названием цинковой пыли.
Для выделения цинка часто пользуются
также электролизом. В этом случае полученную путем окислительного обжига руды ZnO обрабатывают серной кислотой. Образующийся
раствор ZnSO4 и служит электролитом,
из которого затем осаждают цинк.
В этом случае полученную путем окислительного обжига руды ZnO обрабатывают серной кислотой. Образующийся
раствор ZnSO4 и служит электролитом,
из которого затем осаждают цинк.
Вследствие большей летучести кадмия по сравнению с цинком он накапливается в цинковой пыли. Последнюю растворяют в H2 SO4 и на раствор действуют металлическим цинком. При этом по схеме
Cd2+ + Zn = Zn2+ Cd
происходит выделение кадмия.
Ввиду нестойкости HgO при высоких температурах получение металлическей ртути сводится к одной реакции:
HgS + O2 = SO2 + Hg
Выделяющиеся пары ртути улавливают в специальных приемниках, где они и сжижаются.
Элементы подгруппы цинка представляют
собой белые металлы с синеватым (Zn) или серебристым
(Cg, Hd) оттенком. На влажном воздухе они
покрываются пленками окислов и теряют свой блеск. Все три металла (особенно
ртуть) легкоплавки. Их важнейшие константы сопоставлены в приводимой таблице.
Их важнейшие константы сопоставлены в приводимой таблице.
В противоположность ковкому и тягучему кадмию цинк при обычных условиях довольно хрупок. Все три элемента легко образуют сплавы друг с другом и– многими другими металлами. Не сколько особое место среди них занимают сплавы ртути (т. н. амальгамы), многие из которых жидки или тестообразны.
1) Ежегодное мировое производство цинка составляет около 2,5 млн. т. Большая часть добываемого металла используется для оцинковывания железа (т. е. покрытия его тонким слоем цинка) с целью предохранения от ржавления.
Основное потребление кадмия связано с производством так называемых щелочных аккумуляторов. Его ежегодная мировая выработка составляет около 7 тыс. т.
Ртуть находит применение в очень многих самых разнообразных областях, Ее ежегодная мировая добыча составляет около 6 тыс. г.
2) Важное использование ртути связано с
получением высокого вакуума. Для этого обычно служит изготовляемый из стекла
или металла ртутный вакуумный насос, схематически показанный на рис. 182.
Нагреванием до кипения заполняющей нижнюю часть сосуда ртути соз дается
непрерывная струя ее пара, котораясквозь узкую
трубку с большой скоростью поступает в охлаждаемое снаружи водой пространство,
присоединенное к откачиваемому сосуду через А. Быстро летящие атомы ртути
своими ударами гонят молекулы откачиваемого газа к отводу Б, где эти молекулы
попадают под действие более грубого насоса («фор–вакуумного»), дающего всей
системе предварительное разрежение порядка О,1 –0,01 мм рт. ст. Сами ртутные пары
конденсируются в охлаждаемом пространстве, и жидкая ртуть вновь поступает в
нагреваемый сосуд. Установка работает непрерывно и способна создать вакуум с
давлением до стомиллионных Долей миллиметра ртутного столба.
182.
Нагреванием до кипения заполняющей нижнюю часть сосуда ртути соз дается
непрерывная струя ее пара, котораясквозь узкую
трубку с большой скоростью поступает в охлаждаемое снаружи водой пространство,
присоединенное к откачиваемому сосуду через А. Быстро летящие атомы ртути
своими ударами гонят молекулы откачиваемого газа к отводу Б, где эти молекулы
попадают под действие более грубого насоса («фор–вакуумного»), дающего всей
системе предварительное разрежение порядка О,1 –0,01 мм рт. ст. Сами ртутные пары
конденсируются в охлаждаемом пространстве, и жидкая ртуть вновь поступает в
нагреваемый сосуд. Установка работает непрерывно и способна создать вакуум с
давлением до стомиллионных Долей миллиметра ртутного столба.
В соприкосновении с сухим воздухом Zn, Cd и Hg при обычной
температуре не изменяются. Будучи достаточно нагреты, Zn и Cd сгорают до
окислов ЭО, тогда как ртуть окисляется лишь медленно. Взаимодействие Zn и Cd с серой
протекает также весьма энергично, но для начала реакции требуется нагревание. Напротив, ртуть соединяется с мелко раздробленной серой (при растирании обоих
элементов в ступке) уже на холоду. Аналогичные различия наблюдаются и в
отношении этих металлов к галоидам, с которыми при обычных условиях ртуть
реагирует легче, чем Zn и Cd. Эта повышенная химическая активность ртути
обусловлена ее жидким агрегатным состоянием, сильно облегчающим протекание реакций. По существу же
металлические свойства элементов в ряду Zn–Cd–Hg заметно ослабляются. Это видно, частности, из приведенного на рис. 183
сопоставления теплот образования аналогичных соединений рассматриваемых
элементов: при переходе от Zn к Hg они во всех случаях уменьшаются.
Напротив, ртуть соединяется с мелко раздробленной серой (при растирании обоих
элементов в ступке) уже на холоду. Аналогичные различия наблюдаются и в
отношении этих металлов к галоидам, с которыми при обычных условиях ртуть
реагирует легче, чем Zn и Cd. Эта повышенная химическая активность ртути
обусловлена ее жидким агрегатным состоянием, сильно облегчающим протекание реакций. По существу же
металлические свойства элементов в ряду Zn–Cd–Hg заметно ослабляются. Это видно, частности, из приведенного на рис. 183
сопоставления теплот образования аналогичных соединений рассматриваемых
элементов: при переходе от Zn к Hg они во всех случаях уменьшаются.
В ряду напряжений цинк расположен левее
железа, кадмий – несколько правее его, а ртуть – значительно–правее водорода.
Несмотря на то, что Zn и Cd более металличны, чем водород, они практически
не вытесняют его из воды, так как поверхность металлов быстро покрывается
защитной окисной пленкой. В разбавленных НСl и H2 SO4цинк растворяется легко, кадмий медленно, а
ртуть нерастворима. В азотной кислоте все три элемента легко растворяются.
Например, реакция с ртутью идет па уравнению:
В разбавленных НСl и H2 SO4цинк растворяется легко, кадмий медленно, а
ртуть нерастворима. В азотной кислоте все три элемента легко растворяются.
Например, реакция с ртутью идет па уравнению:
3Hg.+ 8HNO3 = 3Hg(NO3 )3 + 2NO + 4Н2 О
От своих аналогов цинк отличается растворимостью также в крепких растворах щелочей:
Zn + 2NaOH = Na2 ZnO2 + Н2
Цинк и кадмий образуют только один ряд соединений, отвечающий двухвалентным элементам. Для ртути, кроме того, характерны производные, в которых она электрохимически одновалентна. Соединения этого типа будут отдельно рассмотрены в конце параграфа. В противоположность не очень ядовитым производным Zn и Cd и сама ртуть и ее соединения чрезвычайно ядовиты.
Окиси цинка и его аналогов (ЭО) могут
быть получены путем непосредственного соединения элементов с кислородом при
нагревании. В противоположность белой ZnO аналогичные
окислы Cd и Hg имеют коричневый (CdO) или
ярко–красный (HgO) цвет. При очень
тонком измельчении окиси ртути цвет ее становится желтым. В воде окиси Zn, Cd и Hg почти
нерастворимы, но в кислотах легко растворяются, образуя соответствующие соли.
В противоположность белой ZnO аналогичные
окислы Cd и Hg имеют коричневый (CdO) или
ярко–красный (HgO) цвет. При очень
тонком измельчении окиси ртути цвет ее становится желтым. В воде окиси Zn, Cd и Hg почти
нерастворимы, но в кислотах легко растворяются, образуя соответствующие соли.
Отвечающие окислам ЭО гидроокиси [Э(ОН)2 ] цинка и кадмия выделяются в виде белых студенистых осадков при действии сильных щелочей на растворы солей Zn и Cd. Гидроокись цинка является амфотерным соединением (с преобладанием основных свойств над кислотными) и поэтому растворяется в избытке сильной щелочи с образованием цинкатов (например, Na2 ZnO2 ). У гидроокиси кадмия отчетливо выражены лишь основные свойства. В кислотах обе гидроокиси легко растворяются.
Аналогичная им гидроокись ртути [Hg(OH)2] отщепляет воду уже в момент образования. Поэтому при действии сильных щелочей на соли ртути, например, по реакции
2NaOH + Hg(NO3 )2 = 2NaNO3 + HgO + H2 O
выделяется желтая окись ртути. В избытке
щелочи она нерастворима, а с кислотами легко образует соли.
В избытке
щелочи она нерастворима, а с кислотами легко образует соли.
Подобно самим катионам Zn2+, Cd2+и Hg2+, бесцветно и большинство их солей. Нитраты и сульфаты цинка и его аналогов хорошо растворимы в воде. По ряду Zn–Cd–Hg растворимость фторидов увеличивается, а других галоидных (и большинства остальных) солей уменьшается. Производные слабых неорганических кислот (Н2 СО3 , H2 S и т. п.), как правило, малорастворимы в воде. Очень разбавленный раствор HgCl2 (хлорной ртути, или «сулемы») является одним из употребительных дезинфицирующих веществ.
Некоторые соли Cd2+и Hg2+(а отчасти и Zn2+) в растворах значительно менее
диссоциированы, чем то обычно для типа МХ2 . В частности, это
относится к галоидным солям Cd и Hg (за исключением фтористых), причем по ряду Cl– – Br– – J–степень
диссоциации уменьшается. Особенно мало диссоциирован цианид ртути [Hg(CN)2 ], раствор которого почти не проводит
электрического тока. Напротив, нитраты и сульфаты Cd2+и Hg2+диссоциированы нормально.
Особенно мало диссоциирован цианид ртути [Hg(CN)2 ], раствор которого почти не проводит
электрического тока. Напротив, нитраты и сульфаты Cd2+и Hg2+диссоциированы нормально.
Нормально диссоциированные соли Zn и его аналогов подвержены в растворе значительному гидролизу, который по ряду Zn–Cd–Hg усиливается. Некоторые соли Zn, Cd и Hg легко образуют комплексные соединения. Среди них преобладают типы М[ЭХ3 ] и М2 [ЭХ4 ]. Примером может служить хорошо растворимый в воде бесцветный ртутноиодистый калий – K2 [HgJ4 ].
3) Взаимодействие ионов Zn2+и Cd2+с аммиаком сопровождается ком–плексообразованием по схеме Э2+
+ 4NН3 = [Э(NН3 )4 ]2+. Для Hg2+гораздо типичнее замещение водорода в NH3 . Так, в растворе HgCl2 по реакции HgCl2 + 2NH3 = NH2 HgCl + NH4 Cl
выпадает
белый осадок амидного соединения NH2 HgCl. Весьма
характерны для ртути также различные соли амидного основания, отвечающего
формуле HN(HgOH)2 . Наиболее
известна из них коричневая йодистая соль, выпадающая в осадок при
взаимодействии аммиака (или солей аммония) с щелочным раствором K2 [HgJ4 ]. Образование ее
идет по уравнению: NH3 + 2K2 [HgJ4 ] + 3КОН = HOHgNHHgJ + 7KJ + 2H2 O. Реакция эта используется для открытия
аммиака.
Весьма
характерны для ртути также различные соли амидного основания, отвечающего
формуле HN(HgOH)2 . Наиболее
известна из них коричневая йодистая соль, выпадающая в осадок при
взаимодействии аммиака (или солей аммония) с щелочным раствором K2 [HgJ4 ]. Образование ее
идет по уравнению: NH3 + 2K2 [HgJ4 ] + 3КОН = HOHgNHHgJ + 7KJ + 2H2 O. Реакция эта используется для открытия
аммиака.
В отличие от обоих других элементов
рассматриваемой подгруппы, для ртути известны производные, в которых она
электрохимически одновалентна. На самом деле во всех таких произволных
содержится группировка атомов –Hg2 –, причем оба
атома ртути в ней двухвалентны, но одна валентность каждого из ник утрачивается
на образование неполярной связи с другим по схеме: –Hg–Hg–. Так как при
электролитической диссоциации группировка эта не разрушается, в
растворах содержится сложный ион Hg2+.
Вещества, содержащие в своем составе группировку –Hg2 – носят название соединений закиси ртути. Ион Hg22+бесцветен. Большинство производящихся от него солей малорастворимо в воде. Немногие хорошо растворимые сильно диссоциированы и заметно тидролизованы. Примером производных этого типа может служить легкорастворимая в воде азотнокислая закись ртути [Нg2 (NО3 )2 ], образующаяся при взаимодействии HNO3 с избытком ртути:
6Hg + 8HNO3 = 3Hg2 (NO3 )2 + 2NO + 4H2 O
Практически важна почти нерастворимая в воде хлористая ртуть (Hg2 Cl2 ), используемая в медицине под названием «каломели».
Под действием окислителей соединения закиси ртути довольно легко переходят в производные окиси, например:
Hg2 Cl2 + Cl2 = 2HgCl2
Наоборот, восстановители легко переводят соединения окиси ртути в производные закиси, например, по реакции:
2HgCl2 + SO2 + 2H2 O = H2 SO4 + Hg2 Cl2 + 2HCl
При избытке восстановителя процесс часто идет до выделения металлической ртути:
Hg2 Cl2 + SO2 + 2H2 O = H2 SO4 + Hg + 2HCl
4) Для многих солей Hg22+характерен
распад на соответствующую соль Hg2+и металлическую
ртуть по схеме: Hg2 X2
= HgX2 + Hg. В некоторых случаях (например, Hg2 Cl2 , Hg2 SO4 )
он
идет под действием света или нагревания и крайне медленно, в других случаях
[например, Hg2 (CN)2 , Hg2 S]
настолько
быстро протекает уже в момент образования соли Hg22+, что последняя вовсе не может быть
выделена. Например, при взаимодействии Hg2 (NO3 )2 с KCN реакция/идет по уравнению:
В некоторых случаях (например, Hg2 Cl2 , Hg2 SO4 )
он
идет под действием света или нагревания и крайне медленно, в других случаях
[например, Hg2 (CN)2 , Hg2 S]
настолько
быстро протекает уже в момент образования соли Hg22+, что последняя вовсе не может быть
выделена. Например, при взаимодействии Hg2 (NO3 )2 с KCN реакция/идет по уравнению:
Hg2 (NO3 )2 + 4KCN = 2KNO3 + K2 [Hg(CN)4 ] + Hg
Сопоставляя Zn, Cd и Hg с основными элементами вторсуи группы– бериллием и магнием, –можно отметить, что некоторые свойства в ряду Be–Hg изменяются весьма закономерно. Примером могут служить температуры плавления и кипения элементов, последовательно уменьшающиеся при переходе от Be к Hg.
Однако подобная закономерность в изменении многих других свойств
для ряда Be– Ra характерна еще более. В этом ряду мы имеем, например, строго
последовательное возрастание атомных и ионных радиусов, отчетливое усиление
основного характера гидроокисей и увеличение их растворимости в воде, повышение
термической устойчивости солей и т. д.
В этом ряду мы имеем, например, строго
последовательное возрастание атомных и ионных радиусов, отчетливое усиление
основного характера гидроокисей и увеличение их растворимости в воде, повышение
термической устойчивости солей и т. д.
Суммарно оба сопоставления показывают, что с точки зрения закономерности характера изменения свойств самих элементов Be и Mg могут быть включены как первые члены в обе подгруппы, а с точки зрения свойств соединений – только в подгруппу кальция.
Цинк – свойства, применение и биологическое значение
Цинк – один из переходных земных металлов, имеющий блестящий голубовато-белый цвет. Символ цинка представлен как Zn. Атомный номер Zn равен 30. Содержание элемента цинка оценивается почти в 65 граммов на каждую тонну земной коры. Слово «цинк» имеет немецкое происхождение, тогда как его точное происхождение выходит за рамки персидского слова «петь», что означает «камень».
Zn в химии является очень важным элементом и имеет несколько химических свойств.
Zn + 2HCl → ZnCl2 + h3
2Zn + O2 → 2ZnO
Цинк состоит из пяти различных природных стабильных изотопов
Эти изотопы включают; 64Zn, 66Zn, 67Zn, 68Zn и 70Zn
Цинк имеет самую низкую температуру плавления после кадмия и ртути среди всех переходных металлов
Цинк не реагирует с водой напрямую. Однако металлический цинк может реагировать с кислородом, присутствующим в воздухе, в присутствии паров воды и, таким образом, образовывать гидроксид цинка.
Zn + 2h3O → Zn(OH)2 + h3
Группа | 9 0002 12 |
Период | 4 |
Блок | d |
Цинк Атомный номер | 30 |
Твердый | |
Электронная конфигурация | [Ar]3d104s2 |
Температура плавления цинка 9 0040 | 419,527°C, 787,149°F, 692,677 K |
Температура кипения | 907°C, 1665°F, 1180 K |
Плотность | 7,134 г/см3 | Относительная атомная масса цинка | 65. |
Основные изотопы | 64Zn |
Использование цинка c
Цинк является одним из наиболее часто используемых металлов в промышленности. Вот список некоторых применений цинка:
Большая часть цинка используется в производстве оксидов цинка, а также при создании кровельных материалов
Оксиды цинка в основном используются в качестве добавки к резинам для производство шин. Это помогает выдерживать более высокие температуры, а также предотвращает ненужный износ
Цинк также используется при цинковании других металлов, таких как железо и сталь. Он предотвращает ржавление железа. С другой стороны, оцинкованная сталь в основном используется в производстве транспортных средств
Сплавы металлов также формируются с использованием цинка.
 Некоторые из примеров включают нейзильбер, латунь и даже алюминиевый припой
Некоторые из примеров включают нейзильбер, латунь и даже алюминиевый припойЦинк также используется в производстве литья под давлением. Он играет неотъемлемую часть электронного оборудования.
Оксид цинка также используется в косметике, чернилах, фармацевтических препаратах и даже пластмассах
Сульфид цинка используется для изготовления флуоресцентных ламп, рентгеновских экранов, а также светящихся красок
Биологическое значение цинка 900 03
Атомная структура цинка играет неотъемлемую роль в любом другом живом организме. Фактически почти 20 металлоферментов имеют активный центр, образованный цинком. В среднем человеческом организме содержится около 2,5 г цинка, тогда как мы потребляем почти 15 мг в день. Некоторые из наиболее распространенных источников цинка в продуктах питания включают говядину, баранину, семена подсолнечника, сельдь и сыр.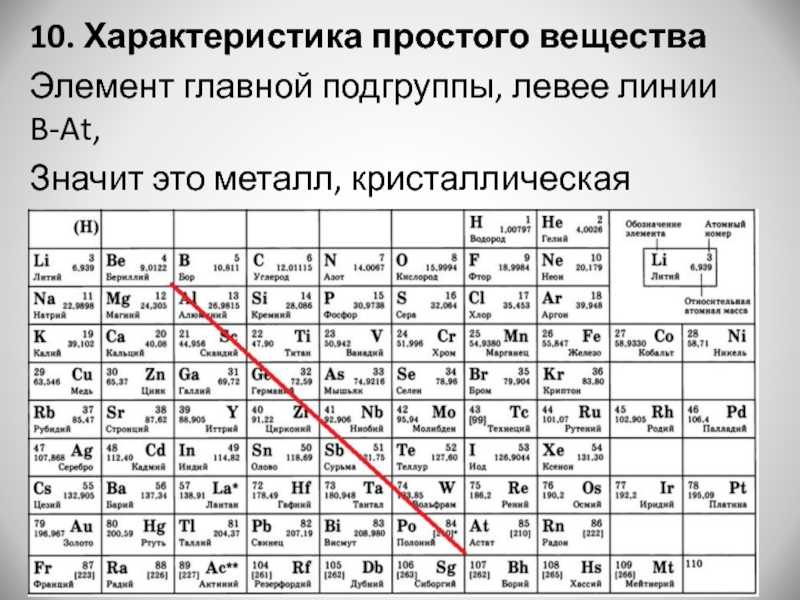
Цинк, наоборот, тоже обладает канцерогенными свойствами. Вдыхание оксида цинка (II) может вызвать «цинковый озноб» или широко известный как «оксидный озноб». остается хрупким с кристаллическим состоянием
Одним из свойств цинка является то, что при нагревании от 110°C до 150°C он становится пластичным и пластичным
Цинк очень активно реагирует с разбавленными кислотами, вызывая выделение водорода
Цинк также проявляет свои реакционные свойства при взаимодействии с кислородом или любым другим неметаллом
Наиболее распространенные соединения цинка
Обязательно Понятно, что большинство соединений цинка широко используются в органическом синтезе. Ниже приведен список некоторых наиболее широко используемых соединений цинка:
Галогениды цинка (фторид, бромид, хлорид, йодид)
Карбиды цинка
Фосфиды
Сульфиты, селениды, арсениды цинка
Тиоциан аты, цианиды и тиосульфаты
Аммиачные комплексы
Гидроксоцинкаты: амфотерные соединения, образованные из гидроксида и оксид цинка
Интересные факты о цинковом элементе
Вот список некоторых наиболее интересных фактов о цинке, которые стоит упомянуть:
Цинк занимает 24-е место среди наиболее распространенных элементов земной коры
Цинк составляет почти 0,0075% всей земной коры хотя это около 30 частей на миллиард
Первое известное использование цинковых дат назад к 1000 до н.
 э.
э.Большая часть цинка (95%) добывается в пределах руды сульфида
Цинк является четвертым наиболее часто используемым металлом в рамках металла
. промышленность
Текущее производство цинка включает 70:30; горнодобывающий и перерабатывающий рацион
В 1746 году Маргграф определил атомную структуру цинка, заявив, что он имеет отдельный элемент
Характеристики цинка | ВМЦИНК Великобритания
Цинк и жизнь
Цинк и живые организмы
Цинк является важным элементом для всех живых организмов. Цинк необходим и незаменим для жизни человека, животных и растений.
Для каждого живого организма существует оптимальный диапазон концентрации цинка. В этом диапазоне концентраций живые организмы могут регулировать свою внутреннюю концентрацию, чтобы удовлетворить потребности своего метаболизма.
В этом диапазоне концентраций живые организмы могут регулировать свою внутреннюю концентрацию, чтобы удовлетворить потребности своего метаболизма.
Если эти оптимальные условия не соблюдены и возникает дефицит, может возникнуть дефицит цинка, а в случае его избытка возникают экотоксикологические проблемы.
Люди обычно не подвергаются избытку цинка, но могут испытывать дефицит цинка.
Цинк и человек
Цинк является важным элементом. Это важный металлический элемент для человечества, так как он занимает 3-е место после магния и железа.
Цинк играет важную роль для здоровья. Он необходим для роста, развития мозга, защиты кожи, правильного функционирования иммунной системы, пищеварения, воспроизводства, вкуса, обоняния и многих других естественных процессов.
Организм человека не может синтезировать необходимый ему цинк. Поэтому он получает цинк из пищи. Всемирная организация здравоохранения (ВОЗ) рекомендует ежедневное потребление цинка 10 мг/день для детей, 12 мг/день для женщин и 15 мг/день для мужчин. Определенные группы населения имеют более высокую потребность в цинке и поэтому более подвержены риску дефицита цинка: дети и подростки, беременные женщины, пожилые люди и т. д.
Определенные группы населения имеют более высокую потребность в цинке и поэтому более подвержены риску дефицита цинка: дети и подростки, беременные женщины, пожилые люди и т. д.
Основные симптомы, связанные с риском дефицита: снижение вкусовых ощущений и запах, проблемы с кожей, умственная вялость и снижение фертильности.
Разнообразие рациона человека зависит в первую очередь от его культуры и уровня жизни. Поскольку количество цинка варьируется в зависимости от типа пищи, в глобальном масштабе многие взрослые и дети придерживаются диеты с низким содержанием цинка. В развивающихся странах дефицит цинка занимает 5-е место среди 10 ведущих факторов риска для здоровья человека; Всемирная организация здравоохранения (ВОЗ) ежегодно связывает 800 000 смертей во всем мире с дефицитом цинка и потерей более 28 миллионов лет здоровой жизни (¹).
Цинк и экотоксикология
Цинк естественным образом присутствует в окружающей среде: горные породы, почва, вода и воздух всегда естественным образом содержали его в различных концентрациях. В ходе своей эволюции все живые организмы использовали цинк, доступный в окружающей среде, для определенных функций своего метаболизма. Итак, цинк является эссенциальным элементом, который необходим и незаменим для всех живых организмов во всех экосистемах.
В ходе своей эволюции все живые организмы использовали цинк, доступный в окружающей среде, для определенных функций своего метаболизма. Итак, цинк является эссенциальным элементом, который необходим и незаменим для всех живых организмов во всех экосистемах.
Живые организмы приспособлены к естественной концентрации цинка в их экосистеме. Кроме того, они разработали механизмы для поддержания оптимальных условий жизни, когда этот уровень концентрации отличается от естественной нормы. Но если концентрация цинка радикально изменится, условия жизни перестанут быть оптимальными, и это может повлиять на функционирование экосистемы.
К счастью, концентрации цинка в европейских экосистемах возникают либо в результате деятельности человека (например, атмосферная коррозия цинкового проката и оцинкованной стали, износ автомобильных шин, удобрений и кормов для животных и т. д.), либо в результате естественных выбросов (в основном из-за вулканических активности), остаются в пределах оптимальных условий существования. Хорошим примером этого являются текущие уровни цинка в Рейне (экстремальные значения от 3 до 25 мкг/л), которые находятся в пределах оптимального диапазона для цинка (²,³).
Хорошим примером этого являются текущие уровни цинка в Рейне (экстремальные значения от 3 до 25 мкг/л), которые находятся в пределах оптимального диапазона для цинка (²,³).
(¹) Международная ассоциация цинка (IZA) – Справочник по цинку 2003
(²) «Воздействие цинка и его компонентов на человека и окружающую среду», P.Ciarletta et F.Van Assche, Colloque CEFRACOR – Центр цинка – Сент-Уан – март 1993 г.
(³) “Цинк в окружающей среде”, Международная ассоциация цинка, 1997 г., издание
Состав цинка
Сплав с лучшими характеристиками
Состав сплаваНаш цинковый прокат легирован медью и титаном для получения материала с оптимальными механическими и физическими характеристиками для применения в строительстве, особенно в отношении механической прочности и сопротивления ползучести. .
Состоит из цинка очень высокого качества Z1 (чистота цинка 99,995 %), согласно стандарту EN 1179, с добавлением титана и меди. Медь повышает механическую стойкость сплава, делая его более твердым и прочным.
Титан увеличивает сопротивление ползучести, обеспечивая большее тепловое расширение и сжатие материала, не вызывая усталости металла.
Норма EN988Европейский стандарт EN 988 применяется с 1997 года в 18 европейских странах. Этот стандарт устанавливает очень строгие требования к составу цинкового проката и его физическим, механическим и размерным характеристикам, что делает его международным эталоном.
| Физические свойства цинка титана по VMZINC | |
|---|---|
| Плотность | 7,2 кг/дм³ | Коэффициент теплового расширения (параллельно направлению прокатки) | 0,022 мм/м/°C |
| Температура плавления | 420°C |
| Температура рекристаллизации | 300°C |
| Теплопроводность | 90 037 110 Вт/(м.К)|
| Электропроводность | 17 МС/м |
| Опасность искрения | Безыскровость |
| Магнитные свойства | Диамагнитные | 9004 5
ЭПД
Экологическая декларация продукта — это международно признанный документ, содержащий экологическую информацию о строительном продукте.


 38
38 Некоторые из примеров включают нейзильбер, латунь и даже алюминиевый припой
Некоторые из примеров включают нейзильбер, латунь и даже алюминиевый припой э.
э.