Тугоплавкие и легкоплавкие металлы: ЛЕГКОПЛАВКИЕ МЕТАЛЛЫ | это… Что такое ЛЕГКОПЛАВКИЕ МЕТАЛЛЫ?
alexxlab | 14.04.1989 | 0 | Разное
Тугоплавкие металлы – список и область применения
Еще с конца 19 века были известны тугоплавкие металлы. Тогда им не нашлось применения. Единственная отрасль, где их использовали, была электротехника и то в очень ограниченных количествах. Но все резко поменялось с развитием сверхзвуковой авиации и ракетной техники в 50-е года прошлого столетия. Производству потребовались новые материалы, способные выдерживать значительные нагрузки в условиях температур свыше 1000 ºC.
Список и характеристики тугоплавких металлов
Тугоплавкость характеризуется повышенным значением температуры перехода из твердого состояния в жидкую фазу. Металлы, плавление которых осуществляется при 1875 ºC и выше, относят к группе тугоплавких металлов. По порядку возрастания температуры плавки сюда входят следующие их виды:
- Ванадий
- Хром
- Родий
- Гафний
- Рутений
- Вольфрам
- Иридий
- Тантал
- Молибден
- Осмий
- Рений
- Ниобий.

Современное производство по количеству месторождений и уровню добычи удовлетворяют только вольфрам, молибден, ванадий и хром. Рутений, иридий, родий и осмий встречаются в естественных условиях довольно редко. Их годовое производство не превышает 1,6 тонны.
Жаропрочные металлы обладают следующими основными недостатками:
- Повышенная хладноломкость. Особенно она выражена у вольфрама, молибдена и хрома. Температура перехода у металла от вязкого состояния к хрупкому чуть выше 100 ºC, что создает неудобства при их обработке давлением.
- Неустойчивость к окислению. Из-за этого при температуре свыше 1000 ºC тугоплавкие металлы применяются только с предварительным нанесением на их поверхность гальванических покрытий. Хром наиболее устойчив к процессам окисления, но как тугоплавкий металл он имеет самую низкую температуру плавления.
К наиболее перспективным тугоплавким металлам относят ниобий и молибден. Это связано с их распространённостью в природе, а, следовательно, и низкой стоимостью в сравнении с другими элементами данной группы.
Помимо этого, ниобий зарекомендовал себя как металл с относительно низкой плотностью, повышенной технологичностью и довольно высокой тугоплавкостью. Молибден ценен, в первую очередь, своей удельной прочностью и жаростойкостью.
Самый тугоплавкий металл встречаемый в природе – вольфрам. Его механические характеристики не падают при температуре окружающей среды свыше 1800 ºC. Но перечисленные выше недостатки плюс повышенная плотность ограничивают его область использования в производстве. Как чистый металл он применяется все реже и реже. Зато увеличивается ценность вольфрама как легирующего компонента.
Физико-механические свойства
Металлы с высокой температурой плавления (тугоплавкие) являются переходными элементами. Согласно таблице Менделеева выделяют 2 их разновидности:
- Подгруппа 5A – тантал, ванадий и ниобий.
- Подгруппа 6A – вольфрам, хром и молибден.
Наименьшей плотностью обладает ванадий – 6100 кг\м3, наибольшей вольфрам – 19300 кг\м3.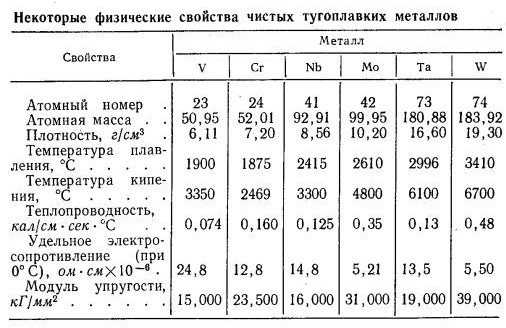 Удельный вес остальных металлов находится в рамках этих значений. Эти металлы отличаются малым коэффициентом линейного расширения, пониженной упругостью и теплопроводностью.
Удельный вес остальных металлов находится в рамках этих значений. Эти металлы отличаются малым коэффициентом линейного расширения, пониженной упругостью и теплопроводностью.
Данные металлы плохо проводят электрический ток, но обладает таким качеством как сверхпроводимость. Температура сверхпроводящего режима составляет 0,05-9 К исходя из вида металла.
Абсолютно все тугоплавкие металлы отличаются повышенной пластичностью в комнатных условиях. Вольфрам и молибден помимо этого выделяются на фоне остальных металлов более высокой жаропрочностью.
Коррозионная стойкость
Жаропрочным металлам свойственна высокая стойкость к большинству видов агрессивных сред. Сопротивление коррозии элементов 5A подгрупп увеличивается от ванадия к танталу. Как пример, при 25 ºC ванадий растворяется в царской водке, между тем как ниобий полностью инертен по отношению к данной кислоте.
Тантал, ванадий и ниобий отличаются устойчивостью к воздействию расплавленных щелочных металлов. При условии отсутствия в их составе кислорода, которые значительно усиливает интенсивность протекания химической реакции.
При условии отсутствия в их составе кислорода, которые значительно усиливает интенсивность протекания химической реакции.
Молибден, хром и вольфрам имеют большую сопротивляемость к коррозии. Так азотная кислота, которая активно растворяет ванадий, значительно менее воздействует на молибден. При температуре 20 ºC данная реакция вообще полностью останавливается.
Все тугоплавкие металлы охотно вступают в химическую связь с газами. Поглощение водорода из окружающей среды ниобием осуществляется при 250 ºC. Тантал при 500 ºC. Единственный способ остановить эти процессы – проведение вакуумного отжига при 1000 ºC. Стоит заметить, что вольфрам, хром и молибден куда менее склонны к взаимодействию с газами.
Как уже было сказано ранее, лишь хром отличается сопротивляемостью к окислению. Данное свойство обусловлено его способностью образовывать твердую пленку оксида хрома на своей поверхности. Растворение кислорода хромом происходит только при 700 С. У остальных тугоплавких металлов процессы окисления начинаются ориентировочно при 550 ºC.
Хладноломкость
Распространению использования жаропрочных металлов в производстве мешает обладание ими повышенной склонности к хладноломкости. Это означает, что при падении температуры ниже определенного уровня происходит резкое возрастание хрупкости металла. Для ванадия такой температурой служит отметка в -195 ºC, для ниобия -120 ºC, а вольфрама +330 ºC.
Наличие хладноломкости жаропрочными металлами обусловлено содержанием примесями в их составе. Молибден особой чистоты (99,995%) сохраняет повышенные пластические свойства вплоть до температуры жидкого азота. Но внедрение всего 0,1% кислорода сдвигает точку хладноломкости к -20 С.
Области применения
До середины 40-х годов тугоплавкие металлы использовались только как легирующие элементы для улучшения механических характеристик стальных цветных сплавов на основе меди и никеля в электропромышленности. Соединения молибдена и вольфрама применялись также в производстве твердых сплавов.
Техническая революция, связанная с активным развитием авиации, ядерной промышленности и ракетостроения, нашла новые способы использования тугоплавких металлов.
- Производство тепловых экранов головного узла и каркасов ракет.
- Конструкционный материал для сверхзвуковых самолётов.
- Ниобий служит материалом сотовой панели космических кораблей. А в ракетостроении его используют в качестве теплообменников.
- Узлы термореактивного и ракетного двигателя: сопла, хвостовые юбки, лопатки турбин, заслонки форсунок.
- Ванадий является основой для изготовления тонкостенных трубок тепловыделяющих элементов термоядерного реактора в ядерной промышленности.
- Вольфрам применяется как нить накаливания электроламп.
- Молибден все шире и шире используется в производстве электродов, применяемых для плавки стекла. Помимо этого, молибден – металл, используемый для производства форм литья под давлением.
- Производство инструмента для горячей обработки деталей.
Оцените статью:
Рейтинг: 0/5 – 0 голосов
Самые прочные металлы в мире: топ-10
С древних времен человек научился обрабатывать и использовать в своей жизни металлы. Какие-то из них подходят для изготовления посуды и других товаров народного потребления, из других, например нержавеющая сталь, делают оружие и медицинские инструменты. А некоторые металлы и сплавы используются для строительства сложных технических механизмов, например космический корабль или самолет. Одной из характеристик, на которую обращают внимание при выборе того или иного материала, является его тугоплавкость.
Какие-то из них подходят для изготовления посуды и других товаров народного потребления, из других, например нержавеющая сталь, делают оружие и медицинские инструменты. А некоторые металлы и сплавы используются для строительства сложных технических механизмов, например космический корабль или самолет. Одной из характеристик, на которую обращают внимание при выборе того или иного материала, является его тугоплавкость.
Самый тугоплавкий металл вольфрам
Тантал
У этого металла сразу три достоинства: он прочный, плотный и очень устойчив к коррозии. Кроме того, этот элемент относится к группе тугоплавких металлов, таких как вольфрам. Чтобы расплавить тантал вам придется развести огонь температурой 3 017 °C.
Тантал в основном используется в секторе электроники для производства долговечных, сверхмощных конденсаторов для телефонов, домашних компьютеров, камер и даже для электронных устройств в автомобилях.
Ванадий
Серый металл с серебристым блеском. Обладает достаточно высоким показателем плавкости (1920 оС). Используется в основном как катализатор во многих процессах, благодаря своей инертности. Применяется в энергетике как химический источник тока, в производствах неорганических кислот. Основное значение имеет не чистый металл, а именно некоторые его соединения.
Обладает достаточно высоким показателем плавкости (1920 оС). Используется в основном как катализатор во многих процессах, благодаря своей инертности. Применяется в энергетике как химический источник тока, в производствах неорганических кислот. Основное значение имеет не чистый металл, а именно некоторые его соединения.
Бериллий
А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
Однако бериллий несет не только вред, но и благо. Например, добавьте всего 0,5 % бериллия в сталь и получите пружины, которые будут упругими даже если довести их до температуры красного каления. Они выдерживают миллиарды циклов нагрузки.
Бериллий применяют в аэрокосмической промышленности для создания тепловых экранов и систем наведения, для создания огнеупорных материалов. И даже вакуумная труба Большого Адронного Коллайдера сделана из бериллия.
И даже вакуумная труба Большого Адронного Коллайдера сделана из бериллия.
Уран
Это естественное радиоактивное вещество очень широко распространено в земной коре, но сконцентрировано в определенных твердых скальных образованиях.
Один из самых твердых металлов в мире имеет два коммерчески значимых применения — ядерное оружие и ядерные реакторы. Таким образом, конечной продукцией урановой промышленности являются бомбы и радиоактивные отходы.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Железо и сталь
Как чистое вещество железо не такое твердое по сравнению с другими участниками рейтинга. Но из-за минимальных затрат на добычу оно часто комбинируется с другими элементами для производства стали.
Сталь — это очень прочный сплав из железа и других элементов, таких как углерод. Это наиболее часто используемый материал в строительстве, машиностроении и других отраслях промышленности. И даже если вы не имеете к ним никакого отношения, то все равно используете сталь каждый раз, когда режете продукты ножом (если он, конечно, не керамический).
Титан
Титан — это практически синоним прочности. Он обладает впечатляющей удельной прочностью (30-35 км), что почти вдвое выше, чем аналогичная характеристика легированных сталей.

Будучи тугоплавким металлом, титан обладает высокой устойчивостью к нагреву и истиранию, поэтому является одним из самых популярным сплавов. Например, он может быть легирован железом и углеродом.
Если вам нужна очень твердая и при этом очень легкая конструкция, то лучше чем титан металла не найти. Это делает его выбором номер один для создания различных деталей в авиа- и ракетостроении и судостроении.
Цирконий
Один из самых дорогих металлов, поэтому применение его в технических целях затруднено. Однако физические характеристики делают его просто незаменимым во многих других отраслях.
При обычных условиях это красивый серебристо-белый металл. Обладает достаточно высокой температурой плавления — 1855 оС. Имеет хорошую твердость, устойчивость к коррозии, так как химически не активен. Также отличается великолепной биологической совместимостью с кожей человека и всего организма в целом. Это делает его ценным металлом для использования в медицине (инструменты, протезы и так далее).
Основные области применения циркония и его соединений, в том числе сплавов, следующие:
- ядерная энергетика;
- пиротехника;
- легирование металлов;
- медицина;
- изготовление биопосуды;
- конструкционный материал;
- как сверхпроводник.
Из циркония и сплавов на его основе изготавливаются даже украшения, способные влиять на улучшение состояния здоровья человека.
Рений
Это очень редкий и дорогой металл, который хотя и встречается в природе в чистом виде, обычно идет «довеском»-примесью к молибдениту.
Если бы костюм Железного человека был сделан из рения, он мог бы выдержать температуру в 2000 ° C без потери прочности. О том, что стало бы с самим Железным человеком внутри костюма после такого «фаер-шоу» мы умолчим.
Россия — третья страна в мире по природным запасам рения. Этот металл используется в нефтехимической промышленности, электронике и электротехнике, а также для создания двигателей самолетов и ракет.
Примечания
- H. Ortner.
International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Проверено 26 сентября 2010. Архивировано 20 июня 2012 года. - Michael Bauccio.
Refractory metals // ASM metals reference book / American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 9780871704788. - Wilson, J. W.
General Behaviour of Refractory Metals // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624. - Joseph R. Davis.
Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444. - ↑ 12Borisenko, V. A.
Investigation of the temperature dependence of the hardness of molybdenum in the range of 20-2500 °C // Журнал Soviet Powder Metallurgy and Metal Ceramics. — 1963. — С. 182. — DOI:10.1007/BF00775076. - Fathi, Habashi.

Historical Introduction to Refractory Metals // Журнал Mineral Processing and Extractive Metallurgy Review. — 2001. — С. 25—53. — DOI:10.1080/08827509808962488. - Schmid, Kalpakjian.
Creep // Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358. - Weroński, Andrzej; Hejwowski, Tadeusz.
Creep-Resisting Materials // Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265. - ↑ 12Erik Lassner, Wolf-Dieter Schubert.
Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532. - National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material.
Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
— С. 1—3. — 90 с. - Michael K. Harris.
Welding Health and Safety // Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287. - William L. Galvery, Frank M. Marlow.
Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517. - W. Lanz, W. Odermatt, G. Weihrauch
(7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in
19th International Symposium of Ballistics
.. - P. Ramakrishnan.
Powder metallurgyfor Aerospace Applications // Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303. - Arora, Arran.
Tungsten Heavy Alloy For Defence Applications // Журнал Materials Technology. — 2004. — Вып. 19. — № 4. — С. 210—216. - V. S.
 Moxson, F. H. Froes.
Moxson, F. H. Froes.
Fabricating sports equipment components via powder metallurgy // Журнал JOM. — 2001. — Вып. 53. — С. 39. — DOI:10.1007/s11837-001-0147-z. - Robert E. Smallwood.
TZM Moly Alloy // ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 9780803102033. - Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A.
Corrosion Resistance of Molybdenum in Mercury // Журнал Protection of Metals. — 2003. — Вып. 39. — С. 374—376. — DOI:10.1023/A:1024903616630. - Gupta, C. K.
Electric and Electronic Industry // Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580. - Michael J. Magyar.
Commodity Summary 2009:Molybdenum. United States Geological Survey. Проверено 26 сентября 2010. Архивировано 20 июня 2012 года. - D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg.

Structure and properties of high energy, high rate consolidated molybdenum alloy TZM // Журнал Materials Science and Engineering: A. — 1988. — Вып. 102. — С. 25. - Neikov Oleg D.
Properties of Molybdenum and Molybdenum Alloys powder // Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220. - Joseph R. Davis.
Refractory Metalls and Alloys // ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969. - ↑ 12John Hebda.
Niobium alloys and high Temperature Applications // Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). — Companhia Brasileira de Metalurgia e Mineração, 2001. Архивировано 17 декабря 2008 года. - J. W. Wilson.
Rhenium // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624.
— Stanford University Press, 1965. — ISBN 9780804701624.
Хром
По шкале Мооса, которая измеряет устойчивость химических элементов к царапинам, хром находится в пятерке лучших, уступая лишь бору, алмазу и вольфраму.
Хром ценится за высокую коррозионную стойкость и твердость. С ним легче обращаться, чем с металлами платиновой группы, к тому же он более распространен, поэтому хром является популярным элементом, используемым в сплавах, таких, как нержавеющая сталь.
А еще один из прочнейших металлов на Земле используется при создании диетических добавок. Конечно, вы будете принимать внутрь не чистый хром, а его пищевое соединение с другими веществами (например, пиколинат хрома).
Свойства ртути
Итак, самый легкоплавкий металл – это ртуть. Для её плавления нужна температура от 234,32 К или -38,83 ° С. Кроме неё, при низких температурах плавятся свинец, таллий, галлий, висмут, олово, кадмий. Закипает ртуть при 629,88 К или 356,73 градусов Цельсия, а при 4,155 К ведёт себя как сверхпроводник.
Она обладает серебристо-белым цветом с ярко выраженным блеском. В периодической таблице ей присвоен номер 80. Это единственный металл, который при комнатной температуре находится в жидком состоянии. В твёрдом состоянии она обладает ромбоэдрической решеткой.
Иридий
Как и его «собрат» осмий, иридий относится к металлам платиновой группы, и по внешнему виду напоминает платину. Он очень твердый и тугоплавкий. Чтобы расплавить иридий, вам придется развести костер температурой выше 2000 °C.
Иридий считается одним из самых тяжелых металлов на Земле, а также одним из самых устойчивых к коррозии элементов.
Осмий
Этот «крепкий орешек» в мире металлов относится к платиновой группе и обладает высокой плотностью. Фактически это самый плотный природный элемент на Земле (22,61 г/см3). По этой же причине осмий не плавится до 3033 ° C.
Когда он легирован другими металлами платиновой группы (такими как иридий, платина и палладий), он может использоваться во многих различных областях, где необходимы твердость и долговечность. Например, для создания емкостей для хранения ядерных отходов.
Например, для создания емкостей для хранения ядерных отходов.
Разногласия в критическом параметре
Одни источники устанавливают пороговую величину как 4000 F. В переводе на привычную шкалу это дает 2204 0С. Согласно этому критерию, к жаропрочным относятся только пять элементов: вольфрам, ниобий, рений, тантал и молибден. Например, температура плавления вольфрама составляет 3422 0С.
Видео — плавка вольфрама водородной горелкой
Другое утверждение позволяет расширить класс температуростойких материалов, поскольку принимает за точку отсчета температуру плавления железа – 1539 0С. Это позволяет увеличить список еще на девять элементов, включив в него титан, ванадий, хром, иридий, цирконий, гафний, родий, рутений и осмий.
Существует еще несколько пороговых величин температуры, однако они не получили широкого распространения.
Вольфрам
Самый прочный металл, который только есть в природе. Этот редкий химический элемент также самый тугоплавкий из металлов (3422 ° C).

Впервые он был обнаружен в форме кислоты (триоксида вольфрама) в 1781 году шведским химиком Карлом Шееле. Дальнейшие исследования привели двух испанских ученых — Хуана Хосе и Фаусто д’Эльхуяра — к открытию кислоты из минерала вольфрамита, из которого они впоследствии изолировали вольфрам с помощью древесного угля.
Помимо широкого применения в лампах накаливания, способность вольфрама работать в условиях сильной жары делает его одним из наиболее привлекательных элементов для оружейной промышленности. Во время Второй мировой войны этот металл сыграл важную роль в инициировании экономических и политических отношений между европейскими странами.
Вольфрам также используется для изготовления твердых сплавов, а в аэрокосмической промышленности — для изготовления ракетных сопел.
Воздействие на организм
Самый легкоплавкий металл обладает первой степенью токсичности. Он испаряется уже при комнатной температуре, и чем воздух горячее, тем выше скорость испарения. На организм человека ртуть действует отравляюще, поражая нервную, пищеварительную, дыхательную и другие системы. Это может привести к летальному исходу. Симптомы проявляются спустя 8-24 часа.
Это может привести к летальному исходу. Симптомы проявляются спустя 8-24 часа.
Длительное воздействие небольших доз ртути проявляется в виде хронических недугов. Человек становится раздражительным и вспыльчивым, страдает от нехватки сна и головных болей, теряет работоспособность, быстро устает.
Острые отравления могут иметь похожие симптомы вначале. Они также сопровождаются повышенной температурой, слабостью, рвотой и тошнотой, болью в желудке, дрожью во всем теле или в отдельных его частях. Вещество поражает почки, что проявляется частыми позывами к мочеиспусканию.
Широкое применение ртути нередко было причиной профессиональных отравлений. Так, в средние века её использовали для изготовления фетра для шляп. Симптомы, которые появлялись у мастеров, называли «болезнью старого шляпника».
Пищевые отравления ртутью возможны у тех, кто любит морепродукты. Металл отлично усваивается организмом морских обитателей, постепенно накапливаясь в нём. В регионах, где люди постоянно употребляют рыбу и другие продукты моря, могут возникать симптомы хронического отравления. Особенно часто они встречаются у жителей прибрежных областей Канады, Колумбии, Бразилии и Китая.
Особенно часто они встречаются у жителей прибрежных областей Канады, Колумбии, Бразилии и Китая.
Таблица предела прочности металлов
| Металл | Обозначение | Предел прочности, МПа |
| Свинец | Pb | 18 |
| Олово | Sn | 20 |
| Кадмий | Cd | 62 |
| Алюминий | Al | 80 |
| Бериллий | Be | 140 |
| Магний | Mg | 170 |
| Медь | Cu | 220 |
| Кобальт | Co | 240 |
| Железо | Fe | 250 |
| Ниобий | Nb | 340 |
| Никель | Ni | 400 |
| Титан | Ti | 600 |
| Молибден | Mo | 700 |
| Цирконий | Zr | 950 |
| Вольфрам | W | 1200 |
Сплавы против металлов
Сплавы представляют собой комбинации металлов, и основной причиной их создания является получение более прочного материала.
 Наиболее важным сплавом является сталь, которая представляет собой комбинацию железа и углерода.
Наиболее важным сплавом является сталь, которая представляет собой комбинацию железа и углерода.Чем выше прочность сплава — тем лучше. И обычная сталь тут не является «чемпионом». Особенно перспективными представляются металлургам сплавы на основе ванадиевой стали: несколько компаний выпускают варианты с пределом прочности до 5205 МПа.
А самым прочным и твердым из биосовместимых материалов на данный момент является сплав титана с золотом β-Ti3Au.
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
Поделиться:
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
11.10.2019
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость. Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов. Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов. К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость. Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов. Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов. К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Вольфрам
Самая высокая температура плавления – у металла вольфрама. Выше него по этому показателю стоит только неметалл углерод. Вольфрам представляет собой светло-серое блестящее вещество, очень плотное и тяжелое. Он кипит при 5555 °C, что почти приравнивается к температуре фотосферы Солнца. При комнатных условиях он слабо реагирует с кислородом и не подвергается коррозии. Несмотря на свою тугоплавкость, он довольно пластичен и поддается ковке уже при нагревании до 1600 °C. Эти свойства вольфрама используют для нитей накаливания в лампах и кинескопах электродов для сварки. Большую часть добытого металла сплавляют со сталью, чтобы повысить ее прочность и твердость. Широкое применение вольфрам имеет в военной сфере и технике. Он незаменим для изготовления боеприпасов, брони, двигателей и наиболее важных частей военного транспорта и самолетов.
Ртуть
Ртуть – единственный металл, температура плавления которого имеет минусовое значение. К тому же это один из двух химических элементов, простые вещества которых при нормальных условиях, существуют в виде жидкостей. Интересно, что кипит металл при нагревании до 356,73 °C, а это намного выше температуры его плавления. Имеет серебристо-белый цвет и ярко выраженный блеск. Она испаряется уже при комнатных условиях, конденсируясь в небольшие шарики. Металл очень токсичен. Он способен накапливается во внутренних органах человека, вызывая болезни головного мозга, селезенки, почек и печени. Ртуть – один из семи первых металлов, о которых узнал человек. В Средние века она считалась главным алхимическим элементом. Несмотря на ядовитость, когда-то ее применяли в медицине в составе зубных пломб, а также как лекарство от сифилиса. Сейчас ртуть почти полностью исключили из медицинских препаратов, но широко используют ее в измерительных приборах (барометрах, манометрах), для изготовления ламп, переключателей, дверных звонков.
Сплавы
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления. Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.
Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий. Те, в составе которых находится ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия – при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Источник: syl.ru
Советуем подписаться на наши страницы в социальных сетях: Facebook | Вконтакте | Twitter | Google+ | Одноклассники
Рейтинг статьи:
Просмотров: 1285
Поделиться:
Теги
История (1) Ковка (1039) Самоделки (1) Сварка (1008)
Еще
Тугоплавкие металлы (определение, примеры и применение) — Материаловедение и инженерия
«Тугоплавкие металлы» — это один из тех разговорных терминов, которые используются для группировки материалов с чрезвычайно высокими температурами плавления. Тугоплавкие металлы имеют несколько общих характеристик друг с другом, в зависимости от определения пользователя.
Тугоплавкие металлы — это металлические элементы с самой высокой температурой плавления, высокой твердостью и высокой плотностью. Консервативные определения «тугоплавких» относятся к 5 промышленно используемым металлам с температурой плавления >2000°C: вольфрам (W), рений (Re), тантал (Ta), молибден (Mo) и ниобий (Nb).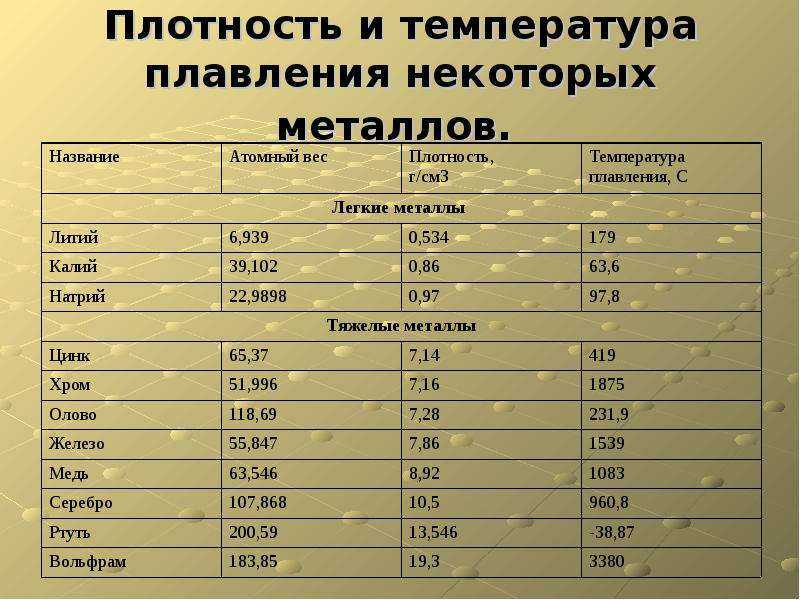 Более широкие определения включают до 15 металлов.
Более широкие определения включают до 15 металлов.
В этой статье я объясню общие области применения всех 15 тугоплавких металлов.
Outline
- Неоспоримые тугоплавкие металлы
- Расширенный список тугоплавких металлов
- Общие свойства тугоплавких металлов
- Приложения
- Заключительные мысли
- Ссылки и дополнительная литература
Неоспоримые тугоплавкие металлы
5 неоспоримых тугоплавких металлов: вольфрам, рений, тантал, молибден и ниобий.
- Tungsten (W) 3380°C, BCC
- Rhenium (Re) 3180°C, HCP
- Tantalum (Ta) 3014°C, BCC
- Molybdenum (Mo) 2617° C, BCC
- Ниобий (Nb) 2468°C, BCC
Эти металлы, как правило, плотные, твердые и имеют очень высокую температуру плавления. Они также достаточно многочисленны, чтобы быть полезными в общих инженерных приложениях. Осмий является примером металла с высокой температурой плавления, который не всегда считается тугоплавким металлом, хотя он имеет 3-ю самую высокую температуру плавления среди всех металлов, поскольку он редко используется при высоких температурах (его оксид токсичен).
Осмий является примером металла с высокой температурой плавления, который не всегда считается тугоплавким металлом, хотя он имеет 3-ю самую высокую температуру плавления среди всех металлов, поскольку он редко используется при высоких температурах (его оксид токсичен).
Расширенный список тугоплавких металлов
В дополнение к металлам, перечисленным выше, мы могли бы также считать тугоплавкими металлы все металлы с температурой плавления >1650°C :
- Осмий (Os) 3027°C , HCP
- Iridium (IR) 2447 ° C, FCC
- Ruthenium (RU) 2250 ° C, HCP
- HAFNIUM (HF) 2227 ° C, HCP
- 666666666666666666666666666666666666666666666666666666666 (HF) 2227 ° C, HCP
- (HF) 2227 ° C, HCP
- (HF) 2227 ° C, HCP
- (HF). °C, HCP (радиоактивный)
- Rhodium (RH) 1963 ° C, FCC
- Vanadium (V) 1902 ° C, BCC
- Хром (CR) 1857 ° C, BCC
- Zirconium (ZR) 1852 ° C, HCC, HCC, HCC, HCC,
- (ZR) 1852 ° C.
 CCC
CCC - Титан (Ti) 1670°C, HCP
Некоторые из этих металлов, такие как цирконий, титан, ванадий и хром, не включены в более строгое определение, поскольку они имеют низкую плотность и низкую температуру плавления. ниже 2000°С. Другие обычно не используются для промышленных высокотемпературных применений из-за стоимости (Ru, Ir, Os), токсичности (Os) или даже радиоактивности (Tc).
Общие свойства тугоплавких металлов
Все тугоплавкие металлы имеют плотноупакованную или почти плотноупакованную кристаллическую структуру: FCC, BCC или HCP. Большинство из них имеют кристаллическую структуру ОЦК. Из 5 бесспорных тугоплавких металлов 4 имеют ОЦК-структуру, а 1 — ГПУ-структуру.
Мое лучшее объяснение высоких температур плавления, связанных с кристаллической структурой ОЦК, заключается в том, что она почти плотно упакована, поэтому в целом стабильна, но в ней больше пустого пространства, чем в действительно плотноупакованной решетке, что дает атомам больше места для взаимодействия. вибрировать, прежде чем вырваться из решетки. Для (очень сложного) математического доказательства того, почему ОЦК имеет тенденцию быть наиболее стабильной высокотемпературной фазой, ознакомьтесь с этой статьей Александра и МакТэга.
вибрировать, прежде чем вырваться из решетки. Для (очень сложного) математического доказательства того, почему ОЦК имеет тенденцию быть наиболее стабильной высокотемпературной фазой, ознакомьтесь с этой статьей Александра и МакТэга.
Все тугоплавкие металлы имеют очень высокую температуру плавления. В зависимости от того, кого вы спросите, могут быть разные ограничения температуры. Ниобий имеет самую низкую температуру плавления среди традиционных тугоплавких металлов, но все же выше 2400°C. В расширенном списке, который я представляю, цирконий имеет самую низкую температуру плавления при 1850°C.
Тугоплавкие металлы, как правило, имеют высокую плотность (вольфрам и осмий являются самыми тяжелыми элементами) и высокую твердость (вольфрам и рений известны своей твердостью). Эта комбинация делает тугоплавкие металлы пригодными для применений, требующих высокой износостойкости; однако многие тугоплавкие металлы также хрупкие.
Тугоплавкие металлы обычно плохо поддаются коррозии. Фактически, иридий, осмий, родий и рутений являются тугоплавкими и благородными металлами.
Фактически, иридий, осмий, родий и рутений являются тугоплавкими и благородными металлами.
Однако тугоплавкие металлы и легко окисляются.
Благодаря сочетанию высокой прочности и термостойкости тугоплавкие металлы относительно устойчивы к ползучести. Поскольку они часто имеют низкую скорость диффузии, они особенно полезны для легирования другими элементами для улучшения сопротивления ползучести основного сплава.
Области применения
Вольфрам (W)Металл, способный выдерживать самые высокие температуры, также не особенно дорог, поэтому вольфрам является предпочтительным металлом для высокотемпературных применений, таких как лампочка нити накала , сварка электроды , и нагревательные элементы печи .
Рений (Re) Используется в суперсплавах для реактивных двигателей для замедления диффузии (в основном 70% извлеченного рения используется для этой цели). Это редкий/дорогой элемент, поэтому он редко используется в качестве основного основного металла в сплаве.
Это редкий/дорогой элемент, поэтому он редко используется в качестве основного основного металла в сплаве.
На самом деле его применение почти не связано с его высокой температурой плавления, потому что оксид осмия сверхтоксичен. Однако он может быть чрезвычайно твердым/износостойким при обычных температурах — например, вы могли использовать сплав осмия и иридия для наконечников перьевых ручек.
Тантал (Ta)Тантал используется для изготовления высокотемпературных коррозионно-стойких сплавов, таких как те, которые используются в деталях вакуумной печи .
Молибден (Mo) Как и многие другие материалы в его списке, молибден в основном используется для сплавов с другими металлами. Он находит широкое применение в суперсплавах для реактивных двигателей. Это полезный легирующий элемент, потому что он относительно легкий. Mo и Nb имеют наилучшее сочетание низкой плотности и высокой температуры плавления.
Mo и Nb имеют наилучшее сочетание низкой плотности и высокой температуры плавления.
Ниобий — элемент, используемый в суперсплавах. Сплавы на основе ниобия также используются в аэрокосмической технике в качестве материалов для сопел двигателей жидкостных ракет.
Иридий (Ir)Существуют свечи зажигания на основе иридия , которые используются в авиации. Он в основном используется в приложениях, связанных с электроникой.
Рутений (Ru)Когда речь идет о высокотемпературных применениях, рутений используется в качестве легирующей добавки к суперсплавам. Рутений также может быть сплавлен с платиной для повышения износостойкости платины без потери других свойств платины.
Гафний (Hf) Как и многие другие материалы в этом списке, гафний в основном используется для сплавов с другими металлами, такими как Fe, Ti, Nb, Ta и другими. Сплав C103, состоящий из Nb (89%), Hf (10%) и Ti (1%), использовался в соплах жидкостных ракетных двигателей основного двигателя лунных модулей Apollo. Иногда его добавляют в суперсплавы на основе никеля для улучшения сцепления защитных оксидных слоев.
Сплав C103, состоящий из Nb (89%), Hf (10%) и Ti (1%), использовался в соплах жидкостных ракетных двигателей основного двигателя лунных модулей Apollo. Иногда его добавляют в суперсплавы на основе никеля для улучшения сцепления защитных оксидных слоев.
Технеций является радиоактивным, что несколько ограничивает его применение. Однако его можно использовать для медицинской радиационной визуализации, а также его можно легировать сталью для повышения коррозионной стойкости. Вам просто нужно убедиться, что эта сталь находится в месте, куда люди не могут добраться!
Родий (Rh) Родий — это благородный металл, который редко вступает в реакцию с другими химическими веществами, что делает его хорошим катализатором. Как и Pt, Rh используется для проводов, которые могут подвергаться воздействию горячей/коррозионной среды. Pt может выдерживать высокие температуры и коррозию без легирования , что позволяет ей сохранять свою электропроводность. Родий встречается даже реже, чем платина.
Родий встречается даже реже, чем платина.
Ванадий используется в реактивных двигателях в качестве легирующей добавки к техническому титановому сплаву (Ti-6Al-4V). Один сплав на основе ванадия (V-4Cr-4Ti) является многообещающим кандидатом для использования в будущих термоядерных реакторах
Хром (Cr)Хотя хром имеет высокую температуру плавления, он более известен своей низкой плотностью и устойчивостью к окислению. Cr является основным легирующим элементом (помимо железа) в нержавеющей стали, и его добавляют в турбины из жаропрочных сплавов. Даже если жаропрочные сплавы не содержат непосредственно Cr, они могут иметь тонкое покрытие из сплава Cr для защиты от окисления.
Цирконий (Zr) Когда речь идет о высокотемпературных применениях, цирконий широко используется в виде оксида циркония. YSZ – ZrO 2 -8 мас. % Y 2 O 3 (так называемый оксид циркония, стабилизированный оксидом иттрия) – обычно используемое защитное покрытие, предназначенное для повышения максимальной рабочей температуры жаропрочных сплавов, используемых в реактивных двигателях.
% Y 2 O 3 (так называемый оксид циркония, стабилизированный оксидом иттрия) – обычно используемое защитное покрытие, предназначенное для повышения максимальной рабочей температуры жаропрочных сплавов, используемых в реактивных двигателях.
Титан используется в компрессорах реактивных двигателей (Ti-6Al-4V).
Последние мысли
Вот оно! Все тугоплавкие металлы, включая строгое определение W, Re, Ta, Mo и Nb; а также более широкие определения, включающие Ir, Os, Hf, Rh, Ru, Zr, Tc, Cr, V и Ti.
Эти металлы обладают высокой твердостью, высокими температурами плавления, высокой плотностью, высокой износостойкостью, хорошей коррозионной стойкостью и плохой стойкостью к окислению. (Не все эти обобщения верны для всех металлов в списке, особенно для тех, которые не входят в состав основных 5 тугоплавких металлов).
Тугоплавкие сплавы обычно используются в высокотемпературных приложениях, таких как сварочные электроды, нагревательные катушки, детали ракет и лопатки газовых турбин. Вольфрам является наиболее распространенным тугоплавким элементом, потому что он имеет самую высокую температуру плавления, твердые механические свойства, а также является одним из наиболее распространенных тугоплавких элементов (поэтому он дешев).
Вольфрам является наиболее распространенным тугоплавким элементом, потому что он имеет самую высокую температуру плавления, твердые механические свойства, а также является одним из наиболее распространенных тугоплавких элементов (поэтому он дешев).
| Refractory Metal | Vickers Hardness (HV) |
| Tungsten (W) | 350 |
| Rhenium (Re) | 250 |
| Tantalum (Ta) | 89 |
| Molybdenum (Mo) | 156 |
| Niobium (Nb) | 135 |
| Titanium (Ti) | 99 |
| Vanadium (V) | 64 |
| Chromium (Cr) | 108 |
| Zirconium (Zr) | 92 |
| Ruthenium (Ru) | 234 |
| Rhodium (Rh) | 127 |
| Hafnium (HF) | 180 |
| OSMIUM (OS) | 422 |
| IRIDIUM (IR) | 180 |
| Список рефрактерных металлов («Консервативное определение») | W, RE, TA, MO, NB |
| СПИСОК ЛИ СПИСОК 9 | |
| . | W, Re, Ta, Mo, Nb, Ir, Os, Hf, Rh, Ru, Zr, Tc, Cr, V, Ti |
| Типичные свойства | Высокая температура плавления, плотность, износостойкость; хорошая коррозионная стойкость; плохая стойкость к окислению; slow diffusion rates |
| Melting Point Range (°C) | 1670 (Ti) – 3380 (W) |
| Density Range (g/cm3) | 4. 5 (Ti) – 22.6 ( OS) 5 (Ti) – 22.6 ( OS) |
| . Правая* |
Тугоплавкие металлы также имеют низкую скорость диффузии, поэтому их часто добавляют в сплавы для повышения сопротивления ползучести. Скорость диффузии зависит от химического состава, поэтому не существует простого правила, для которого элемент является самым медленным диффузором, но известно, что рений медленно действует в жаропрочных сплавах на основе никеля и вызывает «эффект рения» превосходного сопротивления ползучести в жаропрочных сплавах на основе никеля.
Ссылки и дополнительная литература
Если вам понравилась эта статья, вы также можете найти ее интересной для металлов с высокой температурой плавления.
Если вы хотите узнать больше о сплавах в целом, здесь вы найдете нашу статью на эту тему.
Температура плавления огнеупорных материалов
Содержание
- Значение температуры плавления
- Факторы и условия, влияющие на наблюдаемую температуру плавления
- Химический состав
- Химический состав
- Характер окружающей среды
- Условия эксплуатации, влияющие на кажущуюся температуру плавления
- Практическое определение температуры плавления
- , шлифование и литье
- Время и скорость нагрева
- Тип печи и условия.
 факторы и условия, влияющие на наблюдаемые значения температур плавления тугоплавких материалов, и описать практические методы определения этих точек. Хотя представляется необходимым обсудить некоторые общие свойства силикатов и огнеупоров, эти вопросы были затронуты только в той мере, в какой они относятся к температуре плавления и ее определению.
факторы и условия, влияющие на наблюдаемые значения температур плавления тугоплавких материалов, и описать практические методы определения этих точек. Хотя представляется необходимым обсудить некоторые общие свойства силикатов и огнеупоров, эти вопросы были затронуты только в той мере, в какой они относятся к температуре плавления и ее определению.Огнеупорные материалы, такие как шамоты, огнеупорные кирпичи и минералы в целом, могут считаться состоящими из соединений оксидов металлов, твердых растворов оксидов, чистых оксидов или смесей трех классов вместе с небольшими количествами различных химические соединения. Оксиды кремнезема и глинозема чаще всего встречаются в огнеупорных материалах; в сочетании с ними часто встречаются окислы щелочноземельных, щелочных, группы железа и редкоземельных металлов.
Значение точки плавленияВ самом строгом смысле термин точка плавления применяется к температуре, при которой твердая и жидкая фазы чистого кристаллического вещества могут оставаться в равновесии; при температуре плавления обычно происходит прерывистое изменение ряда его физических свойств.
https://www.911metallurgist.com/equipment/smelting/gas/ В случае тех огнеупорных материалов, которые представляют собой аморфные или гетерогенные смеси или соединения оксидов или других веществ, термин «температура плавления» не является определенной температурой; переход от твердого состояния к состоянию, в котором материал будет течь, происходит постепенно в зависимости от температуры и интервала времени. Кроме того, при плавлении часто протекают физические и химические реакции, не являющиеся равновесными.
В случае тех огнеупорных материалов, которые представляют собой аморфные или гетерогенные смеси или соединения оксидов или других веществ, термин «температура плавления» не является определенной температурой; переход от твердого состояния к состоянию, в котором материал будет течь, происходит постепенно в зависимости от температуры и интервала времени. Кроме того, при плавлении часто протекают физические и химические реакции, не являющиеся равновесными.При повышении температуры огнеупорного материала первым важным явлением, обычно наблюдаемым, является спекание или стеклование частиц; то есть края частиц сначала становятся мягкими и жидкими, и частицы слипаются, даже если все части материала имеют одинаковую температуру. В результате поверхностного натяжения мягкие края частиц закругляются. Спекание также может быть произведено сплавлением компонентов с более низкой температурой плавления, образованием эвтектик и растворов и химической реакцией компонентов.
 Если в результате этих явлений образуется вещество с достаточной текучестью, чтобы диффундировать через массу, то все тело может течь, в то время как твердые частицы удерживаются во взвешенном состоянии. С того момента, когда вещество начинает спекаться, оно может постепенно становиться более вязким в течение длительного диапазона температур, пока не станет течь, или может размягчаться и отчетливо течь в коротком диапазоне температур. Хотя эти материалы имеют более или менее определенный температурный интервал плавления или область плавления, их размягчение также является функцией времени.
Если в результате этих явлений образуется вещество с достаточной текучестью, чтобы диффундировать через массу, то все тело может течь, в то время как твердые частицы удерживаются во взвешенном состоянии. С того момента, когда вещество начинает спекаться, оно может постепенно становиться более вязким в течение длительного диапазона температур, пока не станет течь, или может размягчаться и отчетливо течь в коротком диапазоне температур. Хотя эти материалы имеют более или менее определенный температурный интервал плавления или область плавления, их размягчение также является функцией времени.Если огнеупорный материал представляет собой чистое кристаллическое соединение, он будет иметь определенную температуру плавления, строго говоря. Тем не менее существуют такие чистые тугоплавкие соединения, как кварц и альбит, размягчающиеся очень медленно и интервал плавления которых есть интервал времени; т. е. для достижения равновесия между кристаллическим твердым телом и жидкостью необходимо длительное время.
 Для этих веществ температурно-временной метод не подходит для определения точки плавления. В практических и технических целях для таких веществ используется критерий заметного течения. Из-за перегрева во время плавления температура плавления, определенная этим методом, может быть намного выше истинной точки плавления, как в случае кварца, где она примерно на 50°С выше.
Для этих веществ температурно-временной метод не подходит для определения точки плавления. В практических и технических целях для таких веществ используется критерий заметного течения. Из-за перегрева во время плавления температура плавления, определенная этим методом, может быть намного выше истинной точки плавления, как в случае кварца, где она примерно на 50°С выше.Под огнеупорностью огнеупорного материала обычно понимают его устойчивость к действию тепла или, точнее, его способность сохранять форму при высоких температурах в точно заданных условиях. Термин «огнеупорность» шире и имеет более общее значение, чем «плавкость», которую обычно измеряют по температуре размягчения или температуре плавления. Последнее относится к температуре, при которой материал начинает терять форму и течет. Последние упомянутые явления обычно происходят в несколько стадий в диапазоне температур. Спекание материала вызывает усадку и изгиб; но это явление не следует рассматривать как имеющее место в области плавления.
Если предположить, что образец имеет форму конуса или цилиндра, то начало деформации, изгиба или приседания образца знаменует первую стадию плавления; вторая стадия начинается, когда материал слился в комок или шар или, в случае конуса, когда вершина коснулась основания; третья стадия начинается, когда шишка сплющивается и становится жидкой. Эти стадии линьки происходят в интервалах температур разной величины, в зависимости от вещества; во многих случаях более или менее чистых соединений вещество плавится при определенной температуре или в очень небольшом температурном интервале, и, таким образом, разграничение стадий плавления бесполезно. Та конкретная стадия в диапазоне плавления, которую следует рассматривать как точку плавления или точку размягчения, зависит от материала и степени размягчения, при которой будет получено наибольшее количество информации относительно некоторых ограничений использования материала или выводов, которые будут сделаны на основе анализа. испытание на температуру плавления.
 С общей и практической точки зрения и там, где условия использования материала конкретно не известны, знание температуры, при которой начинается заметное и отчетливое течение пробы, является наиболее важным и полезным в качестве фиксированной температуры, а также для сравнения. температура.
С общей и практической точки зрения и там, где условия использования материала конкретно не известны, знание температуры, при которой начинается заметное и отчетливое течение пробы, является наиболее важным и полезным в качестве фиксированной температуры, а также для сравнения. температура.Температура, при которой начинается заметное течение, обычно возникает после начала упомянутой выше первой стадии плавления. В частности, для образцов в форме конуса и цилиндра и при высоких скоростях нагрева видно, что начало заметного и отчетливого течения происходит, когда образец примерно наполовину согнут или находится на полпути между первыми двумя стадиями.
В общем, практическое определение точки плавления огнеупорного материала идентично определению его температуры размягчения или плавления и произвольно определяется как температура, при которой начинается заметное течение материала. При деформации конуса или цилиндра температура плавления находится посередине между температурой, при которой начинается деформация, и температурой, при которой материал сплавляется в комок или шар или полностью сгибается.
Факторы и условия, влияющие на наблюдаемую температуру плавления Химический состав Для большинства тугоплавких материалов температура плавления при определенных условиях является воспроизводимой и достаточно определенной, чтобы ее можно было определить.
Для большинства тугоплавких материалов температура плавления при определенных условиях является воспроизводимой и достаточно определенной, чтобы ее можно было определить.Очевидно, что химический состав огнеупорного материала в значительной степени влияет на наблюдаемую температуру плавления. Хотя и предпринимались попытки установить связь между температурой плавления и составом шамотов, определенной и полной связи не обнаружено. В самом деле, для такой сложной и неоднородной смеси, как шамоты и шамотные кирпичи, нельзя установить никакой диаграммы равновесия; во-первых, из-за большого количества компонентов, во-вторых, из-за неоднородности химических составляющих. По тем же причинам трудно установить эмпирические зависимости между наблюдаемой температурой плавления (которая не является равновесной температурой) и составом. Тем не менее, химические анализы часто указывают на относительную огнеупорность различных материалов.
 Конечно, там, где мы имеем сочетания химически чистых оксидов, в которых образуются определенные химические соединения, твердые растворы или эвтектики, для ряда групп оксидов установлены зависимости температуры от состава или диаграммы равновесия, как, например, для соединений извести, оксид алюминия, магнезия и кремнезем.
Конечно, там, где мы имеем сочетания химически чистых оксидов, в которых образуются определенные химические соединения, твердые растворы или эвтектики, для ряда групп оксидов установлены зависимости температуры от состава или диаграммы равновесия, как, например, для соединений извести, оксид алюминия, магнезия и кремнезем.Добавление примеси к огнеупорному материалу обычно снижает его температуру плавления. Например, в шамотных веществах добавление соединений натрия, калия, железа, титана, кальция или магния вызывает очень заметное понижение температуры плавления; добавление кремнезема к шамотным материалам снижает огнеупорность, а добавление глинозема повышает ее.
Размер частиц, форма и положение телаХорошо известно, что в определенных пределах чем мельче частицы тугоплавкого материала, тем ниже может быть его температура плавления. Размягчение поверхности частиц происходит при более низкой температуре, чем размягчение всего тела в массе; другими словами, частицы спекаются вместе до того, как тело потечет.
 Очевидно, что чем мельче частицы или чем тоньше текстура, тем большая площадь поверхности подвергается размягчению. Мелкое разделение частиц также позволяет более широко и тщательно распределять флюсы; следовательно, стеклование будет происходить быстрее, растворение и реакция компонентов будут облегчены, а материал будет течь при более низкой температуре. Наоборот, более тонкое разделение частиц может привести к более широкому и более тщательному распределению компонентов с более высокой температурой плавления вплоть до повышения температуры плавления.
Очевидно, что чем мельче частицы или чем тоньше текстура, тем большая площадь поверхности подвергается размягчению. Мелкое разделение частиц также позволяет более широко и тщательно распределять флюсы; следовательно, стеклование будет происходить быстрее, растворение и реакция компонентов будут облегчены, а материал будет течь при более низкой температуре. Наоборот, более тонкое разделение частиц может привести к более широкому и более тщательному распределению компонентов с более высокой температурой плавления вплоть до повышения температуры плавления.Общее влияние изменения размера частиц на температуру плавления обычно невелико. Например, в случае большого количества образцов угольной золы эти образцы, измельченные «до неощутимого порошка, имеют тенденцию к размягчению при несколько более низкой температуре, чем зола, которая проходит через сито 100 меш. Разница в среднем составляла 6°С и ни в одном испытании не превышала 40°С». Эксперименты, проведенные в лаборатории пирометрии Бюро стандартов по температурам плавления кварцевых формовочных песков частиц, только что прошедших через сито 10 меш, не показали различий в температуре плавления, превышающих ошибку эксперимента, когда частицы были измельчены для прохождения через сито 80 меш.
 экран. Другие эксперименты с шамотным кирпичом показали температуру плавления 1655°С при измельчении для прохождения через сито с размером ячеек 80 и 1640°С при измельчении для прохождения через сито с размером ячеек 200 меш. Было установлено, что температура плавления неизмельченного кирпича составляет 1630°С. В данном случае представляется, что измельчение служит для изменения распределения различных компонентов в дополнение к уменьшению их размера. Все эти опыты проводились в одинаковых условиях.
экран. Другие эксперименты с шамотным кирпичом показали температуру плавления 1655°С при измельчении для прохождения через сито с размером ячеек 80 и 1640°С при измельчении для прохождения через сито с размером ячеек 200 меш. Было установлено, что температура плавления неизмельченного кирпича составляет 1630°С. В данном случае представляется, что измельчение служит для изменения распределения различных компонентов в дополнение к уменьшению их размера. Все эти опыты проводились в одинаковых условиях.Поскольку плавление тугоплавкого материала сопровождается более или менее постепенным уменьшением вязкости, температура заметного течения будет зависеть от исходной геометрической формы и положения вещества. Например, пирометрические конусы в форме тетраэдра с осями, расположенными под разными углами к вертикали, будут испытывать различные изгибающие моменты при размягчении и падении; таким образом, когда он наклонен, степень достигнутой текучести не будет той же самой. Если бы то же самое вещество имело форму короткого цилиндра, вероятно, по приседанию цилиндра нельзя было бы судить о температуре, при которой возникает та же степень вязкости, что и в случае конуса; следовательно, температура плавления, наблюдаемая с цилиндром, может отличаться от наблюдаемой с конусом.
Время и скорость нагрева Однако опыты, проведенные в этом бюро, не показали разницы между температурами плавления конуса и цилиндра одинаковой высоты, поставленных вертикально и нагретых в одинаковых условиях. Размер цилиндра 2,5 см. в высоту и 1,2 см. в диаметре; конус был в форме тетраэдра, будучи 2,5 см. высокий и имеющий 8-мм. стороны для основания.
Однако опыты, проведенные в этом бюро, не показали разницы между температурами плавления конуса и цилиндра одинаковой высоты, поставленных вертикально и нагретых в одинаковых условиях. Размер цилиндра 2,5 см. в высоту и 1,2 см. в диаметре; конус был в форме тетраэдра, будучи 2,5 см. высокий и имеющий 8-мм. стороны для основания.Процесс стеклования и плавления огнеупоров зависит как от времени, так и от температуры. Очевидно, что чем дольше вещество находится в интервале стеклования, тем больше степень спекания; то есть размягчение, плавление, растворение или реакция компонентов. Таким образом, если огнеупор выдерживается в течение длительного времени в диапазоне его стеклования, его плавкость будет повышаться; если огнеупор находится в течение длительного времени ниже интервала стеклования, спекание будет незаметным. Температура плавления может быть повышена за счет химической реакции, которая приводит к образованию соединения с более высокой температурой плавления, чем любой из компонентов; в этом случае быстрое нагревание остановило бы образование такого соединения.
 В случае некоторых материалов длительное нагревание приводит к улетучиванию более летучих компонентов, таких как щелочные соединения, с последующим повышением огнеупорности.
В случае некоторых материалов длительное нагревание приводит к улетучиванию более летучих компонентов, таких как щелочные соединения, с последующим повышением огнеупорности.Наблюдаемая температура плавления также заметно зависит от скорости нагревания. В соответствии с известным принципом увеличения скорости реакции с повышением температуры скорость стеклования ускоряется при повышении температуры; следовательно, чем быстрее повышается температура, тем меньше общее количество спекания или стеклования. В то же время при быстром нагревании можно значительно задержать растворение компонентов и образование эвтектики; таким образом, эффективность некоторых факторов, которые могут вызвать текучесть материала, значительно снижается.
Для плавления некоторых чистых тугоплавких соединений требуется много времени; таким образом, температура плавления будет изменяться в зависимости от скорости нагрева, так как степень перегрева при плавлении будет разной для каждой скорости нагрева.
 Практически во всех случаях нечистых огнеупорных смесей или соединений диапазон плавления будет зависеть от скорости нагрева, а также из-за влияния времени на плавление. Считается, что эффект изменения скорости нагрева тем заметнее, чем ближе к температуре плавления.
Практически во всех случаях нечистых огнеупорных смесей или соединений диапазон плавления будет зависеть от скорости нагрева, а также из-за влияния времени на плавление. Считается, что эффект изменения скорости нагрева тем заметнее, чем ближе к температуре плавления.Как правило, и в определенных пределах, чем быстрее повышается температура, тем выше кажущаяся температура плавления. Лучшей иллюстрации этого нельзя найти, чем конусы Сегера, где температуру размягчения можно легко изменить на 50°C. или более путем изменения скорости нагрева. В Бюро стандартов не было обнаружено разницы в температуре плавления огнеупорного кирпича, нагретого до температуры плавления за 1 час. и один нагревается в течение 5 часов. В случае очень высоких скоростей нагрева большой градиент температуры в образце может играть роль в повышении температуры плавления.
Природа окружающей средыНа температуру плавления влияют несколько возможных внешних условий. Давление атмосферы само по себе практически не будет иметь никакого значения; то есть потребовалось бы давление во много атмосфер, чтобы хотя бы немного изменить точку плавления.
 Однако косвенным образом точка плавления может значительно измениться в вакууме; а именно, более летучие и легкоплавкие компоненты, такие как соединения щелочных и щелочноземельных металлов, могут перегоняться или возгоняться, что вызывает повышение температуры плавления, и наоборот, те вещества, которые испаряются при атмосферном давлении, могут не выделяться при более высоких давлениях.
Однако косвенным образом точка плавления может значительно измениться в вакууме; а именно, более летучие и легкоплавкие компоненты, такие как соединения щелочных и щелочноземельных металлов, могут перегоняться или возгоняться, что вызывает повышение температуры плавления, и наоборот, те вещества, которые испаряются при атмосферном давлении, могут не выделяться при более высоких давлениях.Из-за химической реакции с газами в атмосфере, окружающей огнеупор, его температура плавления может значительно измениться. В случае некоторых материалов, например угольной золы, природа атмосферы является фактором, оказывающим наибольшее влияние на температуру плавления. Термины восстановительная, окислительная и нейтральная атмосферы недостаточно точны, и при рассмотрении природы атмосферы следует указывать присутствующие газы. Например, в восстановительной атмосфере могут преобладать либо пары углерода и окись углерода, либо водород и пары воды; и действие одной атмосферы может быть совершенно иным, чем действие другой.

В восстановительной атмосфере углерода и монооксида углерода многие огнеупоры подвергаются очень сильному агрессивному воздействию, степень которого зависит от химического состава, давления и температуры. При некоторых восстановительных условиях оксиды железа в шамотных веществах или других огнеупорах восстанавливаются до двухвалентного состояния и соединяются с образованием легкоплавких силикатов, которые весьма существенно повышают плавкость. В очень сильно восстановительной углеродной атмосфере все оксиды железа могут быть восстановлены до металлического железа, что предотвращает реакции с силикатами. При высоких температурах кремнезем и силикаты восстанавливаются углеродом, образуя при определенных условиях различные соединения кремния, углерода и кислорода. С другой стороны, в окислительных атмосферах некоторые вещества могут окисляться, позволяя или предотвращая их реакцию с огнеупором и вызывая изменение температуры плавления.
Условия эксплуатации, влияющие на кажущуюся температуру плавленияВещества, вступающие в контакт с огнеупором, такие как расплавленные металлы, шлаки, флюсы и колошниковая пыль, часто воздействуют на огнеупор и могут значительно снизить его температуру плавления.
 Поскольку температура, при которой огнеупор начинает течь, связана со степенью вязкости материала, приложение нагрузки заставит материал деформироваться быстрее и при более низкой температуре. Из-за более тесного контакта частиц приложение нагрузки позволит огнеупору спекаться при более низкой температуре, а продолжительное приложение силы приведет к размягчению или плавлению материала при более низкой температуре. Также кажется верным, что чем больше приложенная нагрузка, тем ниже температура, при которой материал будет размягчаться и разрушаться. Например, температура размягчения шамотного кирпича без нагрузки составила 1730°С, а с нагрузкой 50 фунтов на квадратный дюйм – 1200°С. Шамот с температурой размягчения 1650°С дал температура размягчения 1435°С при нагрузке 54 фунта на квадратный дюйм; и один при 1380°С с нагрузкой 72 фунта на квадратный дюйм
Поскольку температура, при которой огнеупор начинает течь, связана со степенью вязкости материала, приложение нагрузки заставит материал деформироваться быстрее и при более низкой температуре. Из-за более тесного контакта частиц приложение нагрузки позволит огнеупору спекаться при более низкой температуре, а продолжительное приложение силы приведет к размягчению или плавлению материала при более низкой температуре. Также кажется верным, что чем больше приложенная нагрузка, тем ниже температура, при которой материал будет размягчаться и разрушаться. Например, температура размягчения шамотного кирпича без нагрузки составила 1730°С, а с нагрузкой 50 фунтов на квадратный дюйм – 1200°С. Шамот с температурой размягчения 1650°С дал температура размягчения 1435°С при нагрузке 54 фунта на квадратный дюйм; и один при 1380°С с нагрузкой 72 фунта на квадратный дюймВообще в плавление тугоплавкого материала вступает столь большое количество сложных физико-химических явлений, что становится невозможным в большинстве случаев предсказать, в каком направлении изменится температура плавления при изменении факторов и условий, при которых происходит плавление материала.
Практическое определение точки плавления нагревается.
нагревается.Идеальным методом определения точки плавления огнеупорного материала было бы наблюдение за ней в реальных условиях использования; однако в большинстве случаев это практически невозможно. Что действительно необходимо сделать, так это найти компромисс между дублированием условий использования, с одной стороны, и заменой реальных методов, предоставляемых лабораторным оборудованием, с другой; к сожалению, обычно приходится почти всецело принимать решение в пользу последнего. Для определения точки плавления в условиях, приближенных к условиям эксплуатации, или таким образом, чтобы образовалась определенная и специфическая корреляция между температурой плавления и другими используемыми свойствами, очень часто в случае каждого материала требуется расширенное и тщательное исследование (например, , например, отношение температуры плавления угольной золы и степени клинкерообразования). Из-за большого разнообразия свойств и характеристик огнеупорных материалов эти условия испытаний нельзя сделать оптимальными для всех материалов; соответственно, их нельзя сделать такими же подробными и особенными, как если бы мы имели дело с одним типом огнеупоров.
 Насколько это возможно, они должны быть логичными, простыми и легко воспроизводимыми, чтобы можно было установить стандартный и практичный метод определения температуры плавления огнеупоров.
Насколько это возможно, они должны быть логичными, простыми и легко воспроизводимыми, чтобы можно было установить стандартный и практичный метод определения температуры плавления огнеупоров.Тот факт, что условия эксплуатации, такие как нагрузка и химическая реакция, могут давать кажущуюся температуру плавления, сильно отличающуюся от наблюдаемой в лаборатории, не является веским основанием для очень грубого определения точки плавления, например, путем проведения пирометрических измерений с помощью конуса Зегера, варьируя и не уточняя размеры частиц, время и скорость нагревания, химическую природу атмосферы. Каждый из этих факторов вносит переменную в значение наблюдаемой температуры плавления; и если эти факторы не указаны и время от времени меняются, наблюдаемая температура плавления не будет иметь определенного и воспроизводимого значения. Поскольку испытание на температуру плавления используется как одно из ряда испытаний для определения того, соответствуют ли огнеупоры техническим условиям, очень важно, чтобы оно имело определенное значение в той мере, в какой испытание на температуру плавления того же материала, изготовленного в различные лаборатории должны давать практически одно и то же значение, и это значение должно быть воспроизведено в одной и той же лаборатории.
Отбор проб, измельчение и формовка Для того чтобы это совпадение было возможным, факторы и условия испытания температуры плавления должны быть практически одинаковыми или, по крайней мере, существующие факторы и условия не должны быть достаточно разными, чтобы вызвать большие разногласия.
Для того чтобы это совпадение было возможным, факторы и условия испытания температуры плавления должны быть практически одинаковыми или, по крайней мере, существующие факторы и условия не должны быть достаточно разными, чтобы вызвать большие разногласия.Если материалом, для которого необходимо определить температуру плавления, является шамотный кирпич со сравнительно большими кусками шамота, скрепленными шамотом, невозможно получить репрезентативный образец, просто отломив шамот. кусок наугад. В случае огнеупорного кирпича или любого другого материала, текстура и состав которого неоднородны или размер частиц превышает 30 меш, необходимо тщательно отобрать пробы материала. Таким образом, возникает необходимость его измельчения, что делает обязательным формование материала в виде цилиндра или конуса. Однако с кирпичами тонкой и однородной текстуры можно отколоть кусок и придать ему форму конуса или цилиндра. Материалы в виде мелкодисперсного порошка после смешивания можно сразу брикетировать.

Поскольку размер частиц может влиять на температуру плавления, необходимо указать степень измельчения материала, по крайней мере приблизительно. Существует возможность измельчения материала настолько тонко, что любое дальнейшее измельчение не повлияет на температуру плавления; также измельчение материала в достаточной степени, чтобы обеспечить однородность распределения компонентов и надлежащую консистенцию, чтобы форма могла сохранять свою форму после брикетирования. С точки зрения сравнения температур плавления различных огнеупоров первый лучше, но требует труда и времени тонкого измельчения; второй вариант более осуществим, и для большого разнообразия материалов, когда используется цилиндрический образец, шлифование для прохождения через сито 80 меш представляется подходящим. При изготовлении конусов материал должен быть измельчен до размера 100-200 меш и сформован со связующим. Связующее не нужно для цилиндрической формы, потому что с помощью небольшого количества влаги материал можно очень удобно брикетировать под давлением.
 Связующее не следует использовать, если оно будет воздействовать на огнеупор. 10-процентный раствор декстрина в воде является удовлетворительным связующим. После того, как образец сформован, безопаснее всего выжечь декстрин в окислительной атмосфере при температуре около 600°С, а затем определить температуру плавления.
Связующее не следует использовать, если оно будет воздействовать на огнеупор. 10-процентный раствор декстрина в воде является удовлетворительным связующим. После того, как образец сформован, безопаснее всего выжечь декстрин в окислительной атмосфере при температуре около 600°С, а затем определить температуру плавления.Поскольку оказывается, что нет существенной разницы между температурой плавления конуса 2,5 см. высокий и имеющий 8 мм. стороны для основания и цилиндра 1,2 см. в диаметре и 2,5 см. высокий, можно использовать любой из них. Как было показано выше, цилиндр наиболее удобен в использовании.
Следует принять меры предосторожности, чтобы температура плавления образца ни в коем случае не была слишком высокой для используемой скорости нагревания, поскольку в образце могут возникнуть большие температурные градиенты. Чем меньше образец, тем легче поддерживать достаточную однородность температуры образца в лабораторной печи.
Время и скорость нагреваЧтобы приблизиться к обычным условиям использования, скорость нагрева должна быть низкой, а время увеличено; такой курс нежелателен или удобен в лаборатории.
 Время нагревания не должно быть слишком продолжительным, чтобы не терять время и не утомлять наблюдение за образцом; и скорость не должна быть настолько высокой, чтобы скрыть эффект плавления или сделать интервал плавления слишком коротким, чтобы было достаточно времени для измерения температуры в точке плавления.
Время нагревания не должно быть слишком продолжительным, чтобы не терять время и не утомлять наблюдение за образцом; и скорость не должна быть настолько высокой, чтобы скрыть эффект плавления или сделать интервал плавления слишком коротким, чтобы было достаточно времени для измерения температуры в точке плавления.Время нагревания от комнатной температуры до примерно 1000°С обычно может быть очень коротким, поскольку считается, что скорость в течение этого интервала не имеет большого значения. Для материалов с температурой плавления около 1700°С общее время нагрева не менее 30 мин. и до 2ч. и скорость нагревания (начиная примерно с 50° ниже точки плавления и во время плавления) от 5° до 10°С в минуту являются удовлетворительными. В следующей таблице представлена зависимость температуры от времени нагрева огнеупорного кирпича, температура плавления которого была определена в Бюро, с достаточным приближением:
Следует подчеркнуть, что при установлении температуры плавления огнеупорного материала кривая зависимости температуры от времени должна быть представлена настолько определенно, насколько это необходимо, чтобы можно было воспроизвести практически одно и то же значение наблюдаемой температуры плавления.
Тип печи и условия, существующие в печи
Тугоплавкие металлы, металлы платиновой группы и керамика Ultramet
Перейти к содержаниюМатериалы 101стефано гросси
Тугоплавкие металлы — это те металлы в периодической таблице, которые обладают высокой температурой плавления. При повышенных температурах тугоплавкие металлы обладают отличными механическими свойствами. За исключением вольфрама, все они обладают отличной пластичностью.
Области применения, поддерживаемые Ultramet
Вольфрам, 6165°F (3407°C)
Без водородного охрупчивания0003Рений, 5756°F (3180°C)
Пластичность, прочность при температуре, отсутствие водородного охрупчивания
Высокопроизводительные ракетные двигатели жаропрочные сплавы лопаток турбинТантал, 5457°F (3014°C)
Биосовместимость, отличная коррозионная стойкость
Биомедицинские имплантаты
Химическая промышленность — даже тонкие пленки тантала защищают стали и сплавы на основе никеля от кислотного воздействия
Высокотемпературные печи для изготовления конденсаторовМолибден, 4743°F (2617°C)
Без водородного охрупчивания
Стеклоформовочная промышленность для расплава электродов
Сопла для изготовления стекловолокна и других изделий, контактирующих с с расплавленным стекломНиобий, 4473°F (2467°C)
Меньшая коррозионная стойкость, более низкая стоимость, чем у тантала
Химическая промышленность
Высокотемпературные тигли для выращивания кристалловРутений Осмий Родий Иридий Палладий Платина Металлы платиновой группы уникальны среди переходных металлов, потому что (за исключением осмия) они сочетают превосходную каталитическую активность с низкой химической активностью.
 В результате металлы платиновой группы в Ультрамете используются в основном для двух целей: защитных и каталитических покрытий.
В результате металлы платиновой группы в Ультрамете используются в основном для двух целей: защитных и каталитических покрытий.Иридий и платина чаще всего используются в качестве защитных покрытий. Платина обычно обладает лучшей стойкостью к окислению, чем иридий, но иридий имеет более высокую температуру плавления и поэтому лучше подходит для применения при более высоких температурах, таких как ракетные двигатели. Защитные покрытия должны быть непрерывными и не иметь пор и других дефектов, которые позволили бы химически активным веществам проникнуть в подлежащий защите материал.
Морфология каталитического покрытия отличается от морфологии защитного покрытия. В каталитическом покрытии металл диспергируется на подложке в виде небольших (10 нм) кластеров, а непокрытые участки подложки существуют между кластерами. Этот тип морфологии максимизирует площадь поверхности металла и позволяет сторонам кластеров, а не только вершинам, действовать как каталитические поверхности.

Металлы платиновой группы
Рутений Осмий Родий Иридий Палладий Платина Металлы платиновой группы уникальны среди переходных металлов, потому что (за исключением осмия) они сочетают превосходную каталитическую активность с низкой химической активностью. В результате металлы платиновой группы в Ультрамете используются в основном для двух целей: защитных и каталитических покрытий.
Иридий и платина чаще всего используются в качестве защитных покрытий. Платина обычно обладает лучшей стойкостью к окислению, чем иридий, но иридий имеет более высокую температуру плавления и поэтому лучше подходит для применения при более высоких температурах, таких как ракетные двигатели. Защитные покрытия должны быть непрерывными и не иметь пор и других дефектов, которые позволили бы химически активным веществам проникнуть в подлежащий защите материал.

Морфология каталитического покрытия отличается от морфологии защитного покрытия. В каталитическом покрытии металл диспергируется на подложке в виде небольших (10 нм) кластеров, а непокрытые участки подложки существуют между кластерами. Этот тип морфологии максимизирует площадь поверхности металла и позволяет сторонам кластеров, а не только вершинам, действовать как каталитические поверхности.
Керамика
Керамика представляет собой ковалентные соединения, обычно содержащие атомы металлов и неметаллов. Карбид титана и оксид алюминия являются примерами керамики. Керамика обычно имеет высокие температуры плавления, высокую твердость, отличную химическую коррозионную стойкость, отличную эрозионную стойкость и хорошие механические свойства при повышенных температурах. Некоторые керамики являются хорошими тепловыми или электрическими проводниками, тогда как другие являются хорошими изоляторами или диэлектриками.
Хрупкость керамики обусловливает их обычное использование в качестве покрытий или армирования волокнами.
 При использовании в качестве покрытия керамика обеспечивает износостойкость и/или защиту от окисления/коррозии. Например, режущие инструменты могут быть покрыты карбидом титана, который благодаря своей твердости обеспечивает превосходную износостойкость и продлевает срок службы инструмента. Графитовые компоненты могут быть покрыты карбидом кремния для обеспечения стойкости к окислению. Другие покрытия, такие как карбид гафния/карбид кремния Ultramet, специально разработаны для обеспечения максимальной защиты от химического и окислительного воздействия при повышенных температурах.
При использовании в качестве покрытия керамика обеспечивает износостойкость и/или защиту от окисления/коррозии. Например, режущие инструменты могут быть покрыты карбидом титана, который благодаря своей твердости обеспечивает превосходную износостойкость и продлевает срок службы инструмента. Графитовые компоненты могут быть покрыты карбидом кремния для обеспечения стойкости к окислению. Другие покрытия, такие как карбид гафния/карбид кремния Ultramet, специально разработаны для обеспечения максимальной защиты от химического и окислительного воздействия при повышенных температурах.Поскольку керамика обычно имеет более низкую плотность, чем тугоплавкие металлы, интерес к замене тяжелых металлических компонентов керамикой велик. Чтобы уменьшить хрупкость, керамику армируют высокопрочными волокнами, чтобы обеспечить стойкость к разрушению и свести к минимуму хрупкость. Керамика, армированная волокном, чаще всего изготавливается из карбида кремния из-за его низкой плотности, высокой прочности и превосходной стойкости к окислению/коррозии.

- Тип печи и условия.



 могут предложить менее плотные альтернативы.
могут предложить менее плотные альтернативы.