Твердость в химии это: ХиМиК.ru – ТВЕРДОСТЬ – Химическая энциклопедия
alexxlab | 26.09.1990 | 0 | Разное
Что это – твердость? Определение твердости
Что тверже – гранит или мрамор, никель или алюминий? И что такое твердость вообще? На эти вопросы мы попробуем ответить в нашей статье. Проблемой определения твердости минералов и веществ занимался целый ряд зарубежных ученых. Среди них – Альберт Шор, Фридрих Моос, Юхан Август Бринелль, Уильям Виккерс и другие. Однако единственного и общепринятого метода расчета твердости в науке до сих пор не существует.
Что такое твердость?
Каждое из известных науке веществ обладает целым рядом определенных физических свойств и качеств. В этой статье речь пойдет о том, что такое твердость. Это способность того или иного материала сопротивляться внедрению в него другого, более прочного тела (например, режущего или колющего инструмента).
Твердость веществ чаще всего измеряется в специальных единицах – кгс/мм2 (килограмм-сила на квадратный миллиметр площади). Обозначается она латинскими буквами HB, HRC или HRB, в зависимости от выбранной шкалы.
Самым твердым минералом на Земле считается алмаз. Если же говорить о материалах искусственного происхождения, то самым прочным является фуллерит. Это молекулярный кристалл, который образуется при высоких температурах (около 300 градусов по Цельсию) и чрезвычайно высоком давлении (свыше 90 000 атмосфер). Согласно исследованиям ученых, фуллерит примерно в полтора раза тверже алмаза.
Какой бывает твердость?
Различают три основных варианта твердости:
- Поверхностная (определяется соотношением величины нагрузки к площади поверхности отпечатка).
- Проекционная (отношение нагрузки к площади проекции отпечатка).
- Объемная (отношение нагрузки к объему отпечатка).
Помимо этого, твердость физических тел измеряется в четырех диапазонах:
- Нанотвердость (величина нагрузки составляет менее 1 гс).
- Микротвердость (1 – 200 гс).
- Твердость при малых нагрузках (200 гс – 5 кгс).
- Макротвердость (более 5 кгс).
Твердость металлов
Из 104 элементов периодической системы Менделеева 82 являются металлами. А общее количество известных человеку сплавов достигает пяти тысяч! Область применения металлов в современном мире невероятно широка. Это военная и химическая промышленность, металлургия, электротехника, космическая отрасль, ювелирное дело, кораблестроение, медицина и т. д.
А общее количество известных человеку сплавов достигает пяти тысяч! Область применения металлов в современном мире невероятно широка. Это военная и химическая промышленность, металлургия, электротехника, космическая отрасль, ювелирное дело, кораблестроение, медицина и т. д.
Среди всех физико-химических характеристик металлов твердость играет далеко не последнюю роль. Ведь она наглядно демонстрирует:
- степень износоустойчивости металла;
- сопротивляемость давлению;
- его способность разрезать другие материалы.
Помимо всего прочего, твердость металла показывает, можно ли подвергать его обработке на тех или иных станках, поддается ли он шлифовке и тому подобное. Кстати, учеными уже давно доказано, что твердость металла во многом определяет и другие механические его свойства.
Какова твердость железа, меди и алюминия? И какой из металлов является самым твердым и прочным?
К наиболее мягким металлам причисляют магний и алюминий. Значения их твердости колеблются в пределах 5 кгс/мм2. Примерно вдвое тверже – никель и медь (около 10 кгс/мм2). Твердость железа оценивается в 30 кгс/мм2. Ну а к самым твердым металлам естественного происхождения относят титан, осмий и иридий.
Примерно вдвое тверже – никель и медь (около 10 кгс/мм2). Твердость железа оценивается в 30 кгс/мм2. Ну а к самым твердым металлам естественного происхождения относят титан, осмий и иридий.
Определение твердости: методы, способы и подходы
Как измеряют твердость физического тела? Для этого в образец внедряется так называемый индентор. Его роль может выполнять сверхпрочный металлический шарик, пирамида либо алмазный конус. После прямого контактного воздействия индентора на испытуемом образце остается отпечаток, по размеру которого и определяется твердость материала.
На практике применяют две группы методов измерения твердости:
- Динамические.
- Кинетические.
При этом прилагаемая нагрузка во время внедрения индентора в тело может быть осуществлена посредством царапания, вдавливания (чаще всего), разрезания или же отскока.
В наши дни существует несколько различных подходов по определению твердости:
- по Роквеллу;
- по Бринеллю;
- по Виккерсу;
- по Шору;
- по Моосу.

Соответственно, есть ряд разных шкал твердости материалов, прямой взаимосвязи между которыми нет. Тот или иной метод измерения выбирают исходя из целого ряда факторов (например, свойств конкретного материала, условий проведения эксперимента, используемой аппаратуры и пр.). Приборы, определяющие твердость металлов или минералов, принято называть твердомерами.
Метод Роквелла
Величина твердости по Роквеллу определяется по глубине отпечатка алмазного конуса или металлического шарика, оставленного на поверхности тестируемого образца. Причем она является безразмерной и обозначается буквами HR. Слишком мягкие материалы могут иметь отрицательные значения твердости.
Так называемый твердомер Роквелла был изобретен в начале прошлого века американцами Хью Роквеллом и Стэнли Роквеллом. В следующем видеоролике вы можете увидеть, как он работает. Крайне важным фактором для этого метода является толщина тестируемого образца. Она не должна быть менее значения десятикратной глубины проникновения индентора в испытуемое тело.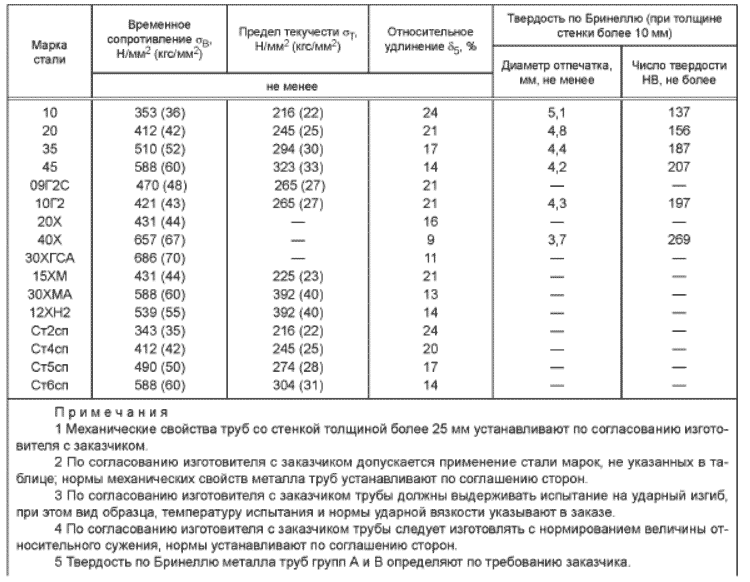
В зависимости от типа индентора и прилагаемой нагрузки существуют три измерительные шкалы. Их обозначают тремя латинскими буквами: A, B и C. Значение твердости по Роквеллу имеет числовой вид. Например: 25,5 HRC (последняя буква обозначает шкалу, которая была использована в тесте).
Метод Бринелля
Величину твердости по Бринеллю определяют по диаметру отпечатка, оставленному стальным закаленным шариком на поверхности тестируемого металла. Единицей измерения служит кгс/мм2.
Метод предложил в 1900 году шведский инженер Юхан Август Бринелль. Испытание проводится следующим образом: вначале задается предварительная нагрузка индентора на образец, а уж затем – основная. Причем материал под этой нагрузкой выдерживают до 30 секунд, после чего измеряется глубина вдавливания. Твердость по Бринеллю (обозначается как HB) рассчитывается как отношение приложенной нагрузки к площади поверхности полученного отпечатка.
Некоторые значения твердости для различных материалов (по Бринеллю):
- Древесина – 2,6-7,0 HB.

- Алюминий – 15 HB.
- Медь – 35 HB.
- Мягкая сталь – 120 HB.
- Стекло – 500 HB.
- Инструментальная сталь – 650-700 HB.
Метод Виккерса
Твердость по методу Виккерса определяется посредством вдавливания в образец алмазного наконечника, имеющего форму правильной четырехугольной пирамиды. После снятия нагрузки измеряют две диагонали, образовавшиеся на поверхности материала, и рассчитывают среднее арифметическое значение d (в миллиметрах).
Твердомер Виккерса достаточно компактен (см. фото ниже). Испытание проводится при комнатной температуре (+20 градусов). Значение твердости тела обозначается буквами HV.
Метод Шора
Этот метод измерения твердости был предложен американским изобретателем Альбертом Шором. Его еще нередко называют «методом отскока». При измерении твердости по Шору боек стандартного размера и массы падает с определенной высоты на поверхность тестируемого материала. Ключевое значение данного опыта – высота отскока бойка, измеряемая в условных единицах.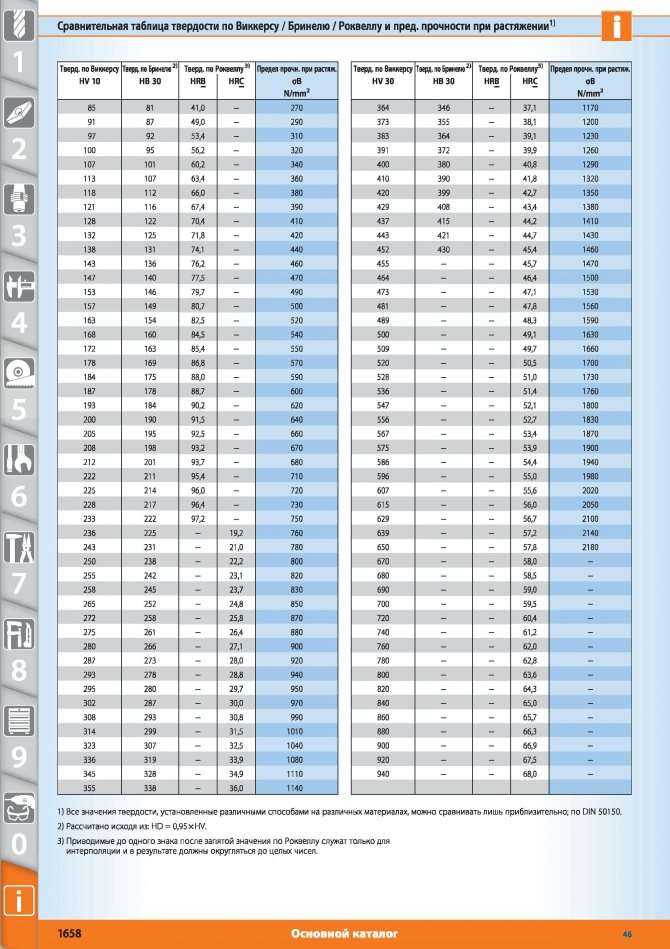
Твердость по Шору измеряется в диапазоне от 20 до 140 единиц. Ста единицам соответствует высота отскока в 13,6 мм (± 0,5 мм). По стандарту эта величина является твердость закаленной углеродистой стали. Современный прибор для измерения твердости материалов по Шору называют склероскопом или дюрометром (его можно увидеть на фото ниже).
Шкала Мооса
Шкала твердости по Моосу является относительной и применяется она исключительно для минералов. В качестве эталонных выбрано десять минералов, которые были расположены в порядке возрастания их твердости (на фотосхеме ниже). Соответственно, шкала имеет 10 баллов (от 1 до 10).
Минералогическая шкала твердости была предложена немецким ученым Фридрихом Моосом еще в 1811 году. Тем не менее в геологии она используется до сих пор.
Как определить твердость конкретного минерала по шкале Мооса? Это можно сделать при помощи внимательного рассмотрения царапины, оставленной образцом. При этом удобно пользоваться ногтем, медной монетой, куском стекла или стальным ножом.
Итак, если тестируемый минерал пишет по бумаге, не царапая ее, то его твердость равна единице. Если камень легко царапается ногтем, его твердость – 2. Три балла имеют минералы, которые легко царапаются ножом. Если же нужно приложить некоторые усилия, чтобы оставить на камне отметку, то его твердость равна 4 или 5. Минералы с твердостью 6 или выше сами оставляют царапины на лезвии ножа.
В заключение…
Итак, что такое твердость? Это способность физического тела противостоять разрушению и деформированию при воздействии местных контактных усилий. Самым твердым минералом на Земле считается алмаз, а самым прочным металлом – иридий. В современной науке и технике используется несколько методик измерения твердости (по Бринеллю, Роквеллу, Виккерсу, Шору и Моосу).
Список химических элементов по твёрдости
Толкование
- Список химических элементов по твёрдости
Основная статья: Списки химических элементов
№ Символ Название Твёрдость по Моосу Твёрдость по Виккерсу
(ГПа)Твёрдость по Бриннелю
(ГПа)3 Li Литий 0.  6
64 Be Бериллий 5.5 1,67 0,6 5 B Бор 9.5 49 6 C Углерод 1.5 (графит) 6 C Углерод 10.0 (алмаз) 11 Na Натрий 0.5 0,00069 12 Mg Магний 2.5 0,26 13 Al Алюминий 3 0,167 0,245 14 Si Кремний 6.5 16 S Сера 2.0 19 K Калий 0.4 0,000363 20 Ca Кальций 1.5 0,167 21 Sc Скандий 0,75 22 Ti Титан 6.  0
00,97 0,716 23 V Ванадий 7.0 0,628 0,628 24 Cr Хром 8.5 1,06 1,120 25 Mn Марганец 6.0 0,196 26 Fe Железо 4.0 0,608 0,49 27 Co Кобальт 5.0 1,043 0,7 28 Ni Никель 4.0 0,638 0,7 29 Cu Медь 3.0 0,369 0,874 30 Zn Цинк 2.5 0,412 31 Ga Галлий 1.5 0,06 32 Ge Германий 6.0 33 As Мышьяк 3.5 34 Se Селен 2.  0
00,736 37 Rb Рубидий 0.3 0,216 38 Sr Стронций 1.5 39 Y Иттрий 0,589 40 Zr Цирконий 5.0 0,903 0,650 41 Nb Ниобий 6.0 1,32 0,736 42 Mo Молибден 5.5 1,53 1,5 44 Ru Рутений 6.5 2,16 45 Rh Родий 6.0 1,246 1,1 46 Pd Палладий 5.0 0,461 0,0373 47 Ag Серебро 2.5 0,251 0,0245 48 Cd Кадмий 2.0 0,203 49 In Индий 1.  0
00,00883 50 Sn Олово 1.5 0,0051 51 Sb Сурьма 3.0 0,294 52 Te Теллур 2.0 0,018 55 Cs Цезий 0.2 0,00014 56 Ba Барий 1.0 57 La Лантан 2.5 0,491 0,363 58 Ce Церий 2.5 0,27 0,412 59 Pr Празеодим 0,4 0,481 60 Nd Неодим 0,343 0,265 62 Sm Самарий 0,412 0,441 63 Eu Европий 0,167 64 Gd Гадолиний 0,57 65 Tb Тербий 0,863 0,677 66 Dy Диспрозий 0,54 0,500 67 Ho Гольмий 0,481 0,746 68 Er Эрбий 0,589 0,814 69 Tm Тулий 0,52 0,471 70 Yb Иттербий 0,206 0,343 71 Lu Лютеций 1,16 0,893 72 Hf Гафний 5.  5
51,76 1,7 73 Ta Тантал 6.5 0,873 0,8 74 W Вольфрам 7.5 3,43 2,57 75 Re Рений 7.0 2,45 1,32 76 Os Осмий 7.0 3,92 77 Ir Иридий 6.5 1,76 1,67 78 Pt Платина 3.5 0,549 0,392 79 Au Золото 2.5 0,216 0,245 81 Tl Таллий 1.0 0,0264 82 Pb Свинец 1.5 0,0383 83 Bi Висмут 2.5 0,0942 90 Th Торий 3.0 0,35 0,4 92 U 6.  0
01,96 2,4 Handbook of the physicochemical properties of the elements / Под ред. Г. В. Самсонова. — New York: IFI-Plenum, 1968.
Wikimedia Foundation. 2010.
Поможем решить контрольную работу
- Список химических журналов
- Список хип-хоп диджеев и продюсеров
Полезное
как, почему и подробные факты
В этом посте будет обсуждаться твердость, физическое свойство материи.
Твердость – это способность материала противостоять воздействующим на него физическим явлениям. Наблюдать и измерять твердость вещества можно, связывая ее только с физическим изменением, но не затрагивая химический состав вещества или химически изменяя материал.
Изучить различные подробные факты о твердости, физическом свойстве.
Как твердость является физическим свойством?Чтобы считаться физическим свойством, которому твердость действительно соответствует, должны быть выполнены некоторые требования.
Основным критерием для отнесения ее к физическим свойствам является то, что твердость не связана с изменением химического состава вещества. А химическая реакция нет необходимости наблюдать и измерять твердость материала, поскольку она не имеет отношения к химическим связям, присутствующим в веществе.
Ниже приведено объяснение того, что означает твердость.
Является ли изменение твердости физическим свойством?Без сомнения, твердость как-то связана с физической природой и ее изменениями, связанными с материей. Для детальное объяснение из этого, во-первых, давайте рассмотрим, что вы подразумеваете под твердостью материала,
Твердость — это мера тенденции материала сопротивляться некоторым физическим явлениям, таким как царапание, придание формы, истирание, вдавливание и т. д. Физическое свойство идентифицируется или наблюдается только тогда, когда физическое изменение вещества связано с физическими аспектами.
Есть некоторые жизненно важные факты, которые нам нужно знать о твердости.
Теперь мы подробно обсудим другие аспекты, по которым жесткость классифицируется.
Твердость – это качественное физическое свойство вещества.поскольку твердость — это физическое свойство материи, которое можно наблюдать с помощью органов чувств, подобно физическому состоянию, цвету, запаху и т. д. Твердость можно даже считать качественным свойством, являющимся признаком материи. В то время как количественные являются мерами значений и счетов.
Твердость – это внутреннее физическое свойство веществаТвердость не зависит от количества присутствующего вещества материала или размера образца. Следовательно, мы можем указать твердость как внутреннее свойство, которое может определяться другими факторами.
Некоторые из применений знания твердости вещества Для оценки других свойств материалаОценка свойств материалов, а именно прочности, эластичности, износостойкости и др.
Как правило, мы можем наблюдать, что металлы являются сложными, а неметаллы – нет. Таким образом, когда вы пытаетесь разрезать неметаллы, такие как сера и уголь, их легко разрезать, в то время как металлы не могут быть легко разрезаны ножом; это различает металлы и неметаллы на основе твердости. Конечно, алмаз можно считать исключением, так как это самый сложный из известных материалов, хотя он и неметалл.
Подробнее о Типы физических изменений: подробный анализ
Назовите основные различия между химическими и физическими свойствами вещества?Мы можем различать физические и химические свойства многими способами. Основные различия между химическими и физическими свойствами указаны ниже;
Одно из наиболее важных различий между физическими и химическими свойствами вещества состоит в том, что химические свойства наблюдаются или измеряются, когда в веществе происходит химическое изменение. В то время как можно измерить физические свойства вещества без изменения химического состава вещества, будет наблюдаться изменение в устройстве материи, даже если структура атомов и молекул останется прежней.
В то время как можно измерить физические свойства вещества без изменения химического состава вещества, будет наблюдаться изменение в устройстве материи, даже если структура атомов и молекул останется прежней.
| химическая | Физический |
| Наблюдать и измерять химические свойства можно только тогда, когда происходит химическое изменение. | Нет необходимости в химическом изменении для контроля физических свойств |
| Для проявления свойства необходимо проведение химической реакции | Химическая реакция не требуется |
Химические связи вещества могут влиять на его химические свойства. | Физические свойства не имеют такой связи с химическими связями. |
| Это может помочь предсказать поведение вещества при наложении на реакции | Как правило, это полезно для идентификации и описания вещества. |
| Некоторые из примеров химических свойств: Токсичность воспламеняемость Реакция с другими химическими веществами Химическая стабильность Энтальпия образования Теплота сгорания и др. | Несколько примеров физических свойств: Внешний вид Текстура Цвет запах Температура плавления Точка кипения Плотность Растворимость и т.д. |
Твердость можно рассматривать как одно из наиболее недостаточно определенных свойств материала.
Твердость можно описать как способность этого материала оказывать сопротивление следующим явлениям::
- Царапины
- Истирание
- вдавливание
- Шейпинг
- Деформация пластика.
Цвет не влияет на твердость материала. Несмотря на то, что и твердость, и цвет физические свойства, они независимы друг от друга, что можно объяснить на простом примере, приведенном ниже,
- Цвет деревянного бруска не влияет на его твердость, так как это эстетическое свойство, тогда как твердость является физической.
- Точно так же цвет камня не имеет ничего общего с его твердостью. Твердость считается физическим свойством, а цвет — нет.
Свойство твердости в основном основано на его пластичности и гибкости. Другими факторами, влияющими на твердость, являются деформация, прочность, ударная вязкость объекта, вязкость материала и т. д.
Другими факторами, влияющими на твердость, являются деформация, прочность, ударная вязкость объекта, вязкость материала и т. д.
Существуют различные виды твердости; некоторые из них приведены ниже;
- Твердость от царапин
- Твердость вдавливания
- Жесткость отскока
У окружающих нас веществ наблюдаются определенные характеристики и свойства, которые помогают их классифицировать и идентифицировать.
Различные вещества можно дифференцировать по их химическим и физическим характеристикам. При изучении материалов эти аспекты имеют первостепенное значение.
Является ли твердость свойством химического или физического аспекта материи?Твердость является одной из основных и выдающихся характеристик материи, которую необходимо учитывать.
Поскольку твердость связана с физическим явлением, связанным с материей, это не химическое, а физическое свойство. Некоторые из других физических свойств материала, а именно,
Некоторые из других физических свойств материала, а именно,
- Цвет
- Плотность
- Текстура
- запах
- Внешний вид и др.
Шкала Мооса является важным инструментом, специально используемым для измерения твердости любого материала.
Твердость измеряется по шкале. Процедура измерения твердости заключается в том, чтобы сначала найти самый твердый материал; затем следует проверить данный материал, твердость которого необходимо найти. Это можно проверить, поцарапав его, или это делается с использованием самого мягкого материала, который может прямо поцарапать материал.
Как размер частиц ижесткость может быть связана?Твердость и размер частиц материала имеют зависимость Холла-Петча.
Экспериментально установлена зависимость твердости от размера частиц: по мере того как мы продолжаем уменьшать размер частиц, твердость материала увеличивается; это связано с тем, что материалы имеют тенденцию поглощать более значительные количества энергии из-за упругих и пластических деформаций; это объясняет, почему хрупкие материалы имеют меньшую прочность.
ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ВОДЫ: ЖЕСТКОСТЬ.
Вода является основным питательным веществом в кормах для животных, она оказывает непосредственное влияние на биологические циклы, усвоение питательных веществ и имеет решающее значение для поддержания адекватных физиологических констант. Вода также является основным компонентом тела животного, составляя от 70% до 80% от общего количества. Физико-химические и микробиологические характеристики нашей воды будут влиять на нормальное развитие наших ферм.
В этой статье мы поговорим о двух физических и химических параметрах, которые существенно влияют на качество воды: ЖЕСТКОСТЬ. Хотя они часто связаны между собой, это две независимые характеристики, которые следует рассматривать по отдельности. Эти два параметра могут вызвать некоторые проблемы со здоровьем и повлиять на биоцидную обработку воды. В некотором роде они могут влиять на хорошую очистку и адекватное распределение воды.
Хотя они часто связаны между собой, это две независимые характеристики, которые следует рассматривать по отдельности. Эти два параметра могут вызвать некоторые проблемы со здоровьем и повлиять на биоцидную обработку воды. В некотором роде они могут влиять на хорошую очистку и адекватное распределение воды.
Жесткость воды.
Жесткость – это сумма растворенных в воде минеральных солей: кальция (Ca++) и магния (Mg++), представленных в эквивалентных количествах карбонатом кальция, карбонатами, бикарбонатами и сульфатами. Соли кальция и магния. Вода, кроме дистиллированной, содержит растворенные соли карбоната кальция и магния. Концентрация этих солей определяет жесткость воды, которую можно выразить как карбонат кальция или карбонат магния. Сумма этих двух значений представляет собой уровень ОБЩЕЙ ЖЕСТКОСТИ.
Наличие растворенных солей связано с тем, что вода часто поступает из подземных источников, которые образуются в результате фильтрации дождя в глубоких слоях земли. Наличие жесткой воды на наших фермах — очень распространенная реальность, для этого нам нужно знать, как определить жесткость, знать, как она влияет на нас, и знать, какие процедуры рекомендуются для такого типа воды.
Наличие жесткой воды на наших фермах — очень распространенная реальность, для этого нам нужно знать, как определить жесткость, знать, как она влияет на нас, и знать, какие процедуры рекомендуются для такого типа воды.
Типы ЖЕСТКОСТЬ:
- Временная жесткость: Определяется содержанием карбонатов и бикарбонатов кальция и магния. Ее можно устранить кипячением воды и последующим устранением образующихся осадков путем фильтрации, она также известна как «Карбонатная жесткость»
- Постоянная жесткость : определяется всеми солями кальция и магния, кроме карбонатов и бикарбонатов. Ее также называют «некарбонатной жесткостью». Постоянную жесткость нельзя удалить кипячением воды.
Измерение жесткости:
Жесткость воды может быть выражена по-разному. Французский градус, все компоненты выражены как CaCO3, и в данном случае 10 мг/л CaCO3 эквивалентны 1 французскому градусу. Еще один способ выразить жесткость в частях на миллион (ppm = мг / л) карбоната кальция или оксида кальция, который является наиболее распространенной формой, используемой в Испании и странах Латинской Америки.
Эквивалентность между различными единицами измерения приведена ниже:
- 1,25 английский градус = 1,78 французский градус = 1,04 американский градус = 17,9 ppm (17,9 мг/л) карбоната кальция = 10 ppm (10 мг/л) оксида кальция .
- 1 французский градус (ºHF) = 4 мг/л Ca или 2,43 мг/л Mg или 10 мг/л CaCO3
Его также можно измерить на основе мг/л карбоната кальция, что является наиболее распространенным измерением . Эти данные рассчитаны по эквивалентности концентрации солей Ca++ и Mg++.
- мг/л Ca x 2,5 + мг/л Mg x 4,2) / 10
Для интерпретации жесткости тип жесткости воды показан в таблице. По их концентрации.
Какие последствия имеет жесткость на наших фермах?
- Прямые последствия для здоровья животных.
Хотя жесткость воды не представляет серьезного расстройства для животных, высокие концентрации общей жесткости в питьевой воде могут нарушать всасывание микроэлементов в кишечнике, снижать эффективность некоторых хелатирующих препаратов (окситетрациклин) Кроме того , наши животные У них есть гомеостатические механизмы, которые позволяют регулировать минерализацию в крови, мы должны помнить, что кальций является основным минералом в быстром развитии, которое наши животные имеют в фазах откорма.
У кур-несушек экстремальные уровни жесткости, более 500 мг карбоната кальция в питьевой воде ограничивают всасывание кальция в кишечнике, необходимого для образования яичной скорлупы
- Технические последствия для оборудования удобства.
Наиболее значительными техническими последствиями наличия жесткой воды на наших фермах будут проблемы, возникающие из-за накипи на трубах и питьевых фонтанчиках, которые уменьшают поток воды. Диаметр труб будет уменьшен, что снизит напор воды и, следовательно, доступность воды для животных, кроме того, он способен блокировать соски и соски, что может вызвать серьезные проблемы с обезвоживанием. Одной из самых распространенных проблем на наших фермах является обызвествление испарительных панелей ферм для охлаждения. Это сокращает продолжительность их жизни и вызывает тепловой стресс у животных.
Минеральные соли кальция и магния не имеют прямого отношения к биопленке, но являются косвенным фактором развития биопленки, так как шероховатость, вызванная осаждением этих солей на водопроводных трубах и поилках, облегчает прилипание биопленка и защита от микроорганизмов. Кальций всегда осаждается больше, когда скорость воды ниже, например, вероятность осаждения кальция выше в первую неделю жизни цыплят из-за низкого потребления воды. Кроме того, в это время температура может достигать 30ºC, и чем выше температура воды, тем обычно больше осадков. Кальций может вызывать проблемы во всех системах водяного тумана, поскольку он блокирует туман, как в системах подачи влаги на ферме, так и в системах подачи влаги в выводных шкафах.
Кальций всегда осаждается больше, когда скорость воды ниже, например, вероятность осаждения кальция выше в первую неделю жизни цыплят из-за низкого потребления воды. Кроме того, в это время температура может достигать 30ºC, и чем выше температура воды, тем обычно больше осадков. Кальций может вызывать проблемы во всех системах водяного тумана, поскольку он блокирует туман, как в системах подачи влаги на ферме, так и в системах подачи влаги в выводных шкафах.
- Технические последствия использования моющих и дезинфицирующих средств
Моющие средства в условиях жесткой воды образуют худшую пену, что вынуждает нас использовать более высокие дозы моющего средства для получения пены того же качества. Если вода очень жесткая, обычно приходится увеличивать дозу моющих средств. При очень жесткой воде некоторые дезинфицирующие средства менее устойчивы в разбавлении, особенно из-за совпадения жесткости воды с высоким рН.
- Умягчение
Существует три основных способа умягчения воды:
- Принудительное осаждение нерастворимых веществ, таких как карбонат кальция CaCO3 и гидроксид магния Mg(OH)2, до того, как они попадут в систему водоснабжения.

- Ионообменные смолы, состоящие из удаления ионов кальция Ca2+ и магния Mg2+ из воды.
- Предотвращает осаждение ионов кальция (Ca2+) из карбоната кальция CaCO3 в результате образования комплексов.
- Чрезмерное размягчение.
При использовании методов полного умягчения воды необходимо соблюдать особую осторожность. Чрезмерное умягчение воды также может оказывать неблагоприятное воздействие на коррозию труб из оцинкованного железа и стали. Очень мягкая вода также может способствовать износу бетонных резервуаров. Для питьевой воды животных полное устранение жесткости не рекомендуется, это может вызвать кишечные проблемы всасывания питательных веществ, вызывая мягкий кал.
РЕКОМЕНДАЦИИ BBZIX ДЛЯ ЖЕСТКОЙ ВОДЫ НА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ФЕРМАХ
Работая на ферме, мы всегда должны помнить о физико-химических характеристиках нашей воды. Давайте помнить, что это питательное вещество с самым высоким потреблением, и поэтому мы должны иметь его технический паспорт, который дается анализом CF. В этих анализах мы будем смотреть на общую жесткость и жесткость кальция и принимать решения.
В этих анализах мы будем смотреть на общую жесткость и жесткость кальция и принимать решения.
Пока общая жесткость не превышает 250 мг/л CO3Ca, мы не рекомендуем никакую очистку питьевой воды. На большинстве ферм у нас есть только один источник воды, и он используется для всего. Системы, которые мы обсудили в этой статье, предполагают высокую стоимость как оборудования, так и химикатов для оптимального обслуживания.
Жесткость, превышающая 300 мг/л CO3Ca и вызывающая у нас постоянные проблемы с отложением кальция в трубах и/или охлаждающих панелях, рекомендуется установить ионообменные смолы, но они действуют только в 50% от общего количества воды, размещая байпас, таким образом, будет обработана только половина воды, в результате чего будет получена вода с половиной исходной жесткости.
При работе с этими уровнями жесткости от 100 до 250 мг/л CO3Ca возможно наличие отложений кальция в некоторых местах (трубы, поилки, панели и т.д.). Гораздо дешевле иметь хорошо зарекомендовавшие себя протоколы очистки и дезинфекции BBZIX.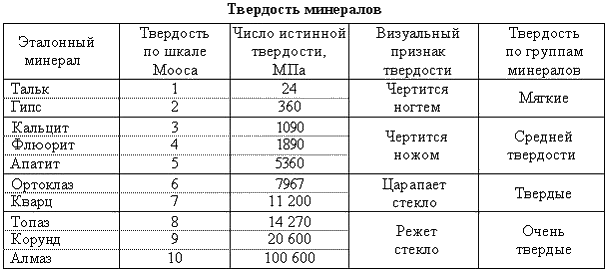
УДАЛЕНИЕ НАКИПИ С ТРУБ: ZIX VIROX И AZIX FORTE
ZIX VIROX
AZIX FORTE
УДАЛЕНИЕ НАКИПИ С ХОЛОДИЛЬНЫХ ПАНЕЛЕЙ: ZIX VIROX, AQUAZIX PLUS.
Zix Virox
Aquazix Plus AG
Azix Forte
Последние посты
Микотоксины, невидимая угроза
Porkamericas Biocidas Zix Zix Agenda 2022
55559912929255555992929255555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555555559н.0005
Жесткая вода — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 601
Жесткая вода содержит большое количество минералов в форме ионов, особенно металлов кальция и магния, которые могут выпадать в осадок и вызывать проблемы в водопроводе или хранении воды в таких сосудах, как трубы.
Типы жесткой воды
Жесткая вода – это вода, содержащая большое количество минеральных ионов. Наиболее распространенными ионами в жесткой воде являются катионы металлов кальция (Ca 2 + ) и магния (Mg 2 + ), хотя железо, алюминий и марганец также могут быть обнаружены в определенных местах. Эти металлы водорастворимы, то есть растворяются в воде. Относительно высокие концентрации этих ионов могут насыщать раствор и, следовательно, вызывать сдвиг равновесия этих растворенных веществ влево, в сторону реагентов. Другими словами, ионы могут осаждаться из раствора. Это вытеснение минералов из раствора является причиной кальцинирования, часто наблюдаемого в водопроводных кранах, которое представляет собой осаждение карбоната кальция или магния. Жесткая вода может также реагировать с другими веществами в растворе, такими как мыло, и образовывать осадок, называемый «накипью». Существует два определенных типа жесткой воды, временная и постоянная, которые описаны ниже.
Жесткая вода может также реагировать с другими веществами в растворе, такими как мыло, и образовывать осадок, называемый «накипью». Существует два определенных типа жесткой воды, временная и постоянная, которые описаны ниже.
Временно жесткая вода
Временно жесткая вода — это жесткая вода, состоящая в основном из ионов кальция (Ca 2 + ) и бикарбоната (HCO 3 – ). При нагревании ион бикарбоната в воде временной жесткости разлагается на ион карбоната (CO 3 2-), диоксид углерода (CO 2 ) и воду (H 2 O). Образовавшийся ион карбоната (CO 3 2 – ) затем может реагировать с другими ионами в растворе с образованием нерастворимых соединений, таких как CaCO 3 и MgCO 3 . Взаимодействия ионов карбоната в растворе также вызывают хорошо известные минеральные отложения, наблюдаемые на стенках горшков, используемых для кипячения воды, ржавчины, известной как «накипь». Повышение температуры временной жесткости воды с последующим разложением иона бикарбоната означает сдвиг в уравнении равновесия (показано ниже). Высокая температура вызывает сдвиг равновесия влево, вызывая осаждение исходных реагентов.
Повышение температуры временной жесткости воды с последующим разложением иона бикарбоната означает сдвиг в уравнении равновесия (показано ниже). Высокая температура вызывает сдвиг равновесия влево, вызывая осаждение исходных реагентов.
Этот сдвиг отвечает за белый налет, наблюдаемый в кипящих емкостях, описанных выше, а также за минеральные отложения, которые накапливаются внутри водопроводных труб, что приводит к неэффективности и даже к взрыву из-за перегрев. CaCO 3 или другие отложения не полностью растворяются обратно в воду при охлаждении, поскольку они относительно нерастворимы, о чем свидетельствует их малая константа растворимости. По этой причине этот тип жесткой воды является «временным», поскольку кипячение может устранить жесткость, вытеснив из раствора вызывающие раздражение ионы. 9{-9} \tag{2b}\]
Вода с постоянной жесткостью
Вода с постоянной жесткостью состоит из высоких концентраций анионов, таких как сульфат-анион (SO 4 2- ). Этот тип жесткой воды называется «постоянной», потому что, в отличие от воды временной жесткости, жесткость нельзя устранить простым кипячением воды и тем самым осаждением ионов минералов. Однако название обманчиво, так как «постоянную» жесткую воду можно смягчить другими способами. Накипь, образующаяся из-за постоянной жесткости воды, имеет пагубные последствия, аналогичные тем, которые наблюдаются при использовании воды с временной жесткостью, например, препятствуют прохождению воды по трубам. Постоянная жесткая вода также является причиной «кольца» в ванне или мыльной пены, видимой после душа или купания. Как упоминалось ранее, постоянная жесткая вода содержит катионы кальция и магния. Эти катионы реагируют с мылом, образуя нерастворимые соединения, которые затем оседают на стенках ванны. Кроме того, реакция этих катионов с мылом является причиной того, что мыло плохо пенится или пенится в жесткой воде. Уравнение ниже дает пример реакции иона магния с компонентами мыла, в данном случае со стеаратом (C 9{2+}_{(водн.
Этот тип жесткой воды называется «постоянной», потому что, в отличие от воды временной жесткости, жесткость нельзя устранить простым кипячением воды и тем самым осаждением ионов минералов. Однако название обманчиво, так как «постоянную» жесткую воду можно смягчить другими способами. Накипь, образующаяся из-за постоянной жесткости воды, имеет пагубные последствия, аналогичные тем, которые наблюдаются при использовании воды с временной жесткостью, например, препятствуют прохождению воды по трубам. Постоянная жесткая вода также является причиной «кольца» в ванне или мыльной пены, видимой после душа или купания. Как упоминалось ранее, постоянная жесткая вода содержит катионы кальция и магния. Эти катионы реагируют с мылом, образуя нерастворимые соединения, которые затем оседают на стенках ванны. Кроме того, реакция этих катионов с мылом является причиной того, что мыло плохо пенится или пенится в жесткой воде. Уравнение ниже дает пример реакции иона магния с компонентами мыла, в данном случае со стеаратом (C 9{2+}_{(водн. )} \longrightarrow Mg(C_{18}H_{35}O_2)_{2 \; (s)} \tag{3}\]
)} \longrightarrow Mg(C_{18}H_{35}O_2)_{2 \; (s)} \tag{3}\]
Воздействие на организм
Хотя вкус жесткой воды может быть для некоторых неприятным, она имеет много преимуществ для здоровья по сравнению с мягкой водой. Двумя наиболее распространенными минералами в жесткой воде являются кальций и магний. И кальций, и магний считаются незаменимыми питательными веществами, а это означает, что они должны присутствовать в рационе для поддержания здоровой функции организма. Кальций является важным компонентом костей и оказывает много положительного воздействия на организм, например, предотвращает серьезные опасные для жизни и болезненные заболевания, такие как остеопороз, камни в почках, гипертония, инсульт, ожирение и ишемическая болезнь сердца. Магний также оказывает положительное влияние на здоровье. Недостаточное количество магния в организме увеличивает риск возникновения некоторых форм проблем со здоровьем, таких как гипертония, сердечная аритмия, ишемическая болезнь сердца и сахарный диабет. Исследования, посвященные влиянию жесткой и мягкой воды на здоровье, показали, что люди, которые пьют больше мягкой воды, имеют гораздо более высокие показатели сердечно-сосудистых заболеваний, а также более высокое кровяное давление и уровень холестерина, а также более высокую частоту сердечных сокращений, чем те, кто пьет в основном жесткую воду. вода. Кроме того, мягкая вода вызывает коррозию труб, что может привести к загрязнению питьевой воды токсичными веществами, такими как свинец.
Исследования, посвященные влиянию жесткой и мягкой воды на здоровье, показали, что люди, которые пьют больше мягкой воды, имеют гораздо более высокие показатели сердечно-сосудистых заболеваний, а также более высокое кровяное давление и уровень холестерина, а также более высокую частоту сердечных сокращений, чем те, кто пьет в основном жесткую воду. вода. Кроме того, мягкая вода вызывает коррозию труб, что может привести к загрязнению питьевой воды токсичными веществами, такими как свинец.
Как смягчить жесткую воду
Некоторые хотят смягчить жесткую воду, чтобы уменьшить ее раздражающее, а во многих случаях и вредное воздействие. Снижение способности мыла к пенообразованию не только раздражает, но и может быть потенциально вредным с экономической точки зрения. Предприятия, которые зависят от пенообразования мыла, такие как автомойки и услуги по уходу за домашними животными, могут смягчить жесткую воду, чтобы избежать чрезмерного использования мыла из-за снижения способности пенообразования. Точно так же часто необходимо смягчать воду, которая контактирует с трубами, чтобы избежать разрушительного и опасного образования отложений. Кроме того, многие люди могут счесть неблагоприятным эффект кальцификации, который жесткая вода оказывает на краны и другие предметы, и решить смягчить воду, чтобы предотвратить образование таких минеральных отложений. Третьим может не понравиться ощущение липкости и сухости, остающееся после осаждения мыльной пены на кожу. Каковы бы ни были причины, существует множество способов смягчения жесткой воды.
Точно так же часто необходимо смягчать воду, которая контактирует с трубами, чтобы избежать разрушительного и опасного образования отложений. Кроме того, многие люди могут счесть неблагоприятным эффект кальцификации, который жесткая вода оказывает на краны и другие предметы, и решить смягчить воду, чтобы предотвратить образование таких минеральных отложений. Третьим может не понравиться ощущение липкости и сухости, остающееся после осаждения мыльной пены на кожу. Каковы бы ни были причины, существует множество способов смягчения жесткой воды.
Ионный обмен
Одним из способов смягчения воды является процесс, называемый ионным обменом. Во время ионного обмена нежелательные ионы «заменяются» на более приемлемые ионы. Во многих случаях желательно заменить ионы жесткой воды, такие как Ca 2 + и Mg 2 + , на более приятные ионы, такие как Na + . Для этого жесткая вода проходит через колонку, содержащую цеолит или смолу, которая связывает нежелательные ионы на своей поверхности и высвобождает более переносимые ионы. В этом процессе ионы жесткой воды становятся «фиксированными» ионами из-за их прикрепления к полимерному материалу. Эти фиксированные ионы вытесняют желательные ионы (Na + ), теперь называемые противоионами, из колонки, таким образом, обменивая ионы в воде. Этот процесс показан на рисунке 1.
В этом процессе ионы жесткой воды становятся «фиксированными» ионами из-за их прикрепления к полимерному материалу. Эти фиксированные ионы вытесняют желательные ионы (Na + ), теперь называемые противоионами, из колонки, таким образом, обменивая ионы в воде. Этот процесс показан на рисунке 1.
К сожалению, недостатком этого процесса является увеличение содержания натрия в питьевой воде, что может быть потенциально опасным для здоровья людей, придерживающихся диеты с ограничением натрия.
Размягчение извести
Другой процесс называется размягчением извести. В этом процессе соединение гидроксида кальция Ca(OH) 2 , добавляется в жесткую воду. Гидроксид кальция, или «гашеная известь», повышает pH воды и вызывает осаждение кальция и магния в CaCO 3 и Mg(OH) 2 . Затем эти осадки можно легко отфильтровать из-за их нерастворимости в воде, что показано ниже малой константой растворимости гидроксида магния (константа произведения растворимости для карбоната кальция показана выше). После осаждения и удаления вредных ионов добавляют кислоту, чтобы вернуть pH воды к норме. 9{-11} \tag{4b}\]
После осаждения и удаления вредных ионов добавляют кислоту, чтобы вернуть pH воды к норме. 9{-11} \tag{4b}\]
Хелирование
Хелатирующие агенты также можно использовать для смягчения жесткой воды. Полидентатные лиганды, такие как популярный гексадентатный лиганд ЭДТА, связывают нежелательные ионы в жесткой воде. Эти лиганды особенно полезны для связывания катионов магния и кальция, которые, как уже упоминалось, широко распространены в растворах жесткой воды. Хелатирующий агент образует очень стабильный кольцевой комплекс с катионами металлов, что предотвращает их взаимодействие с любыми другими веществами, которые могут быть введены в раствор, такими как мыло. Таким образом, хелаторы могут уменьшить негативные последствия, связанные с жесткой водой. Упрощенное уравнение, представляющее хелатирование катиона металлического кальция (Ca 9{10} \tag{5b}\]
Обратный осмос
Последний процесс, обратный осмос, использует высокое давление, чтобы протолкнуть воду через полупроницаемую мембрану. Эта мембрана обычно предназначена для того, чтобы быть непроницаемой для чего-либо, кроме воды. Мембрана служит для фильтрации более крупных ионов и молекул, ответственных за жесткость воды, что приводит к умягчению воды. Во время этого процесса вода вытесняется из области с высокой концентрацией растворенных веществ в виде растворенных ионов металлов и подобных соединений в область с очень низкой концентрацией этих веществ. Другими словами, вода переходит из состояния жесткости в более мягкий состав, поскольку ионы, вызывающие жесткость воды, не проходят через мембрану. Недостатком обратного осмоса является потеря сточных вод по сравнению с другими методами очистки воды. Этот процесс показан на рисунке 2 ниже. Обратите внимание, что на этом рисунке показано опреснение соленой воды. Однако процесс умягчения жесткой воды такой же.
Эта мембрана обычно предназначена для того, чтобы быть непроницаемой для чего-либо, кроме воды. Мембрана служит для фильтрации более крупных ионов и молекул, ответственных за жесткость воды, что приводит к умягчению воды. Во время этого процесса вода вытесняется из области с высокой концентрацией растворенных веществ в виде растворенных ионов металлов и подобных соединений в область с очень низкой концентрацией этих веществ. Другими словами, вода переходит из состояния жесткости в более мягкий состав, поскольку ионы, вызывающие жесткость воды, не проходят через мембрану. Недостатком обратного осмоса является потеря сточных вод по сравнению с другими методами очистки воды. Этот процесс показан на рисунке 2 ниже. Обратите внимание, что на этом рисунке показано опреснение соленой воды. Однако процесс умягчения жесткой воды такой же.
Практические задания
1. Назовите два основных типа жесткой воды. (Выделите синюю область для ответов)
Временный и постоянный.
2. Что делает «жесткую» воду жесткой?
Присутствие высоких концентраций минералов, обычно в форме катионов металлов.
3. Какие два иона наиболее распространены в жесткой воде? Насколько они важны для правильного функционирования организма?
Ион кальция (Ca 2 + ) и магния (Mg 2 + ). Они важны, потому что оба являются незаменимыми питательными веществами, что означает, что они необходимы для правильного функционирования организма, а также важны для предотвращения многих заболеваний и других недугов.
4. Назовите четыре описанных процесса умягчения жесткой воды. Также важно понимать основные этапы каждого процесса.
Ионный обмен, комплексообразование, умягчение известью и обратный осмос
5. Какой главный недостаток ионного обмена, когда в качестве противоиона используется Na + ?
Повышает концентрацию натрия в воде, что представляет потенциальную опасность для людей, придерживающихся диеты с ограничением натрия.
Ссылки
- Кальций и магний в питьевой воде: значение для общественного здравоохранения. Женева, Швейцария: пресса ВОЗ. 2009.
- Влияние технологий очистки питьевой воды на здоровье. Челси, Мичиган: Издательство Льюиса. 1989.
- Льюис Алан, Скотт. Безопасная питьевая вода. Сан-Франциско, Калифорния: Скотт Алан Льюис. 1996.
- Кроуфорд, Т. и М. Кроуфорд (1967). «Распространенность и патологические изменения ишемической болезни сердца в жестководной и в мягководной зоне». Ланцет 289 (7484): 229-232.
- Stitt, F., D. Clayton, et al. (1973). «Клинико-биохимические показатели сердечно-сосудистых заболеваний у мужчин, проживающих в районах с жесткой и мягкой водой». Ланцет 301 (7795): 122-126.
- Гардинер, Дж. (1976). «Комплексообразование микроэлементов с этилендиаминтетрауксусной кислотой (ЭДТА) в природных водах». Исследование воды 10(6): 507-514.
Авторы
- Андреа Кубиш, Кортни Корф (UCD)
Hard Water распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- № на стр.
- Метки
- анионы
- бикарбонат
- ион бикарбоната
- кальций
- Хелирование
- Жесткая вода
- Ионный обмен
- Смягчающий лайм
- осмос
- Постоянная жесткая вода
- Обратный осмос
- Временно жесткая вода
Жесткость воды – MEL Химия
Реагенты
- Хлорид кальция
- Гидрокарбонат натрия
Безопасность
- Наденьте защитные перчатки и очки.

- Проведите эксперимент на подносе.
- Поставьте плиту на пробковую подставку для горячих кастрюль. Не прикасайтесь к плите после эксперимента — подождите, пока она остынет.
- Снимите защитные перчатки перед тем, как зажечь свечу.
Общие правила безопасности
- Не допускайте попадания химических веществ в глаза или рот.
- Держите маленьких детей, животных и тех, кто не носит защитные очки, подальше от экспериментальной зоны.
- Храните этот экспериментальный набор в недоступном для детей младше 12 лет месте.
- Очистите все оборудование после использования.
- Убедитесь, что все контейнеры полностью закрыты и правильно хранятся после использования.
- Убедитесь, что все пустые контейнеры утилизированы надлежащим образом.

- Не используйте оборудование, которое не входит в комплект поставки или не рекомендовано в инструкции по эксплуатации.
- Не заменяйте продукты питания в оригинальной упаковке. Утилизируйте немедленно.
Общая информация по оказанию первой помощи
- При попадании в глаза: Промыть глаза большим количеством воды, при необходимости держать глаза открытыми. Немедленно обратитесь за медицинской помощью.
- При проглатывании: прополоскать рот водой, выпить немного пресной воды. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью.
- При вдыхании: Вынести пострадавшего на свежий воздух.
- При попадании на кожу и при ожогах: промыть пораженный участок большим количеством воды не менее 10 минут.

- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химикат и его контейнер.
- В случае травмы всегда обращайтесь за медицинской помощью.
Консультации для присматривающих за взрослыми
- Неправильное использование химикатов может привести к травмам и ущербу для здоровья. Проводите только те опыты, которые указаны в инструкции.
- Этот экспериментальный набор предназначен для использования только детьми старше 12 лет.
- Поскольку способности детей сильно различаются даже в пределах возрастных групп, наблюдающие взрослые должны проявлять осторожность в отношении того, какие эксперименты подходят и безопасны для них. Инструкции должны позволять наблюдателям оценивать любой эксперимент, чтобы установить его пригодность для конкретного ребенка.

- Перед началом экспериментов надзирающий взрослый должен обсудить предупреждения и информацию о безопасности с ребенком или детьми. Особое внимание следует уделять безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Территория, окружающая эксперимент, должна быть свободна от каких-либо препятствий и вдали от места хранения продуктов питания. Она должна быть хорошо освещена и проветрена, а также находиться рядом с водопроводом. Должен быть обеспечен прочный стол с термостойкой столешницей.
- Вещества в одноразовой упаковке должны быть израсходованы (полностью) в течение одного эксперимента, т.е. после вскрытия упаковки.
Часто задаваемые вопросы и устранение неполадок
Раствор в колбе не мутнеет после шага 6.
Вероятно, раствор в колбе еще недостаточно нагрелся.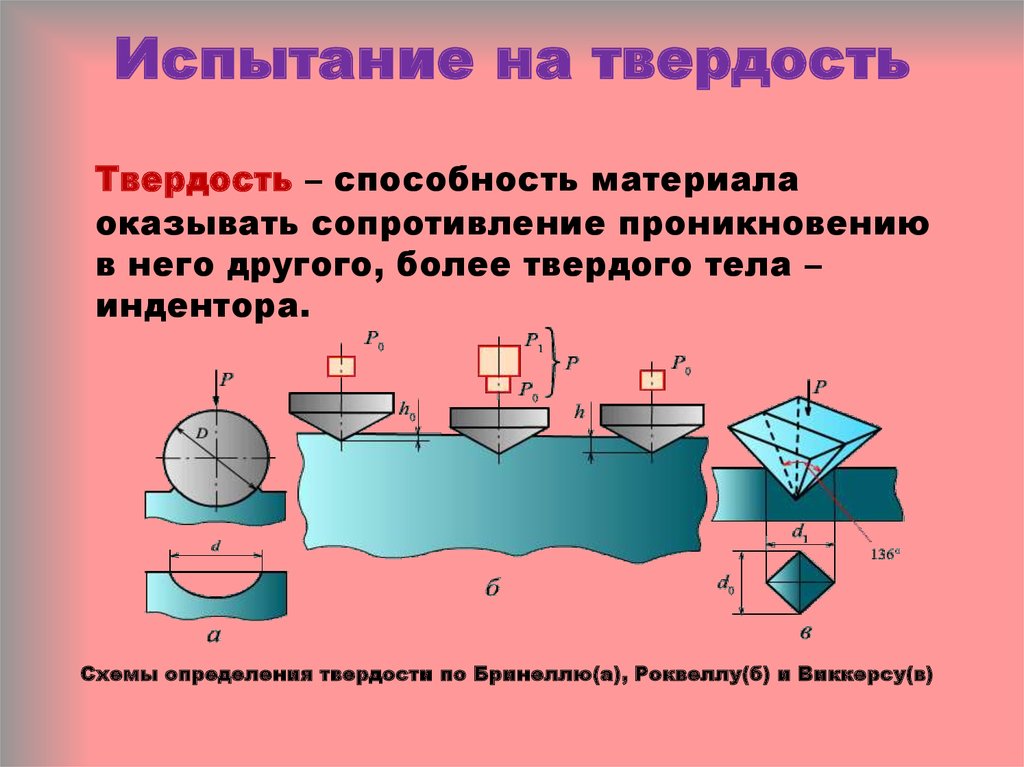 Подождите 5 мин. дольше.
Подождите 5 мин. дольше.
Как пользоваться термостикером?
Наклейте наклейку на флягу или плиту. При температуре около 60–70 o С треугольник меняет цвет с черного на желтый, чтобы предупредить, что предмет, к которому он был прикреплен, горячий и его нельзя трогать! Вы можете взять или прикоснуться к колбе, только когда она остынет и треугольник снова станет черным.
Пошаговые инструкции
- Налейте в колбу воду до отметки «40».
- Добавить туда все 0,2М хлорида кальция CaCl 2 раствор из флакона.
- Возьмите плиту с топливными таблетками и поставьте на нее свечу. Снимите защитные перчатки и зажгите свечу. Установите на плиту рассеиватель пламени, как показано на рисунке.
- Поместите колбу на рассеиватель пламени. Подождите 15 мин.
- Вылейте весь 0,3 М раствор гидрокарбоната натрия NaHCO 3 из флакона.
- Вода в колбе помутнеет.

Утилизация
Твердые отходы утилизировать вместе с бытовым мусором. Вылейте растворы в раковину. Смыть большим количеством воды.
Научное описание
Что такое жесткость воды?
Жесткость воды – это показатель, отражающий количество растворенных в воде солей кальция, магния и железа. Существует временная жесткость (которую можно удалить) и постоянная жесткость. Временная жесткость вызвана бикарбонатами кальция и магния (Ca(HCO 3 ) 2 и Mg(HCO 3 ) 2 ), и постоянная жгут – по их сульфатам ((CaSO 4 и MgSO 4 ) и хлоридам (CaCl 2 и MgCl 2 ).
Таким образом, жесткая вода – это вода, содержащая одновременно много солей кальция, магния и железа.
Почему мы добавляем СаCl
2 ? Добавляя в воду хлорид кальция CaCl 2 , мы искусственно повышаем ее жесткость. Как упоминалось выше, CaCl 2 вызывает постоянную (т.е. неустранимую кипячением) жесткость воды. И первая часть эксперимента продемонстрировала этот факт: при кипячении на стенках не происходит заметных осадков.
Как упоминалось выше, CaCl 2 вызывает постоянную (т.е. неустранимую кипячением) жесткость воды. И первая часть эксперимента продемонстрировала этот факт: при кипячении на стенках не происходит заметных осадков.
Что произойдет, если мы добавим NaHCO
3 ?Добавление бикарбоната натрия NaHCO 3 приводит к образованию бикарбоната кальция в растворе:
2NaHCO 3 + СаCl 2 ↔ Ca(HCO 3 ) 2 + 2NaCl
А за счет образования Ca(HCO 3 ) 2 жесткость нашей воды становится временной – теперь ее можно убрать кипячением.
Что происходит при нагревании воды?
Когда мы нагреваем воду, хорошо растворимый бикарбонат кальция превращается в плохо растворимый карбонат:
Ca(HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Белый налет на дне и стенках колбы – это карбонат кальция.
Почему образуется накипь и как ее удалить?
Накипь (или известковый налет) представляет собой нерастворимый карбонат кальция CaCO 3 , который выпадает в осадок при термическом разложении бикарбоната кальция Ca(HCO 3 ) 2 :
Ca(HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Толстый серый слой накипи хоть и не украшает посуду, но и вреда не приносит. Кроме того, он может устранить чрезмерную жесткость водопроводной воды. Кроме того, накипь легко удаляется с чайников и кастрюль очисткой их лимонной кислотой С 6 H 8 O 7 раствор:
3CaCO 3 + 2С 6 H 8 O 7 → Ca 3 (C 6 H 5 O 7 ) 2 + 3CO 2 + 3H 2 O
В результате реакции образуется цитрат кальция Ca 3 (C 6 H 5 O 7 ) 2 , хорошо растворимый в воде.
Узнать больше
Грязно-бежевый цвет окалины обусловлен присутствием оксида железа Fe 2 O 3 . Водопроводная вода содержит некоторое количество железа в виде ионов Fe 2+ , но при кипячении оно выпадает в осадок.
Интересно, что накипь имеет тот же химический состав, что и природный известковый налет. Иногда находят целые горы, образованные из этого минерала. Обычно в таких массивных природных образованиях есть многочисленные пещеры – излюбленные места спелеологов! Эти пещеры легко образуются в известняке: даже слабокислая природная вода на своем пути растворяет карбонаты, образуя причудливые ходы в минерале.
Кроме того, карбонат кальция является основным компонентом обычного мела, используемого для письма на доске или рисования на асфальте. Кроме того, в качестве пищевой добавки используется мел – пищевой краситель белый Е170.
Вспомните, что карбонат кальция — это вещество, которое делает яичную скорлупу твердой.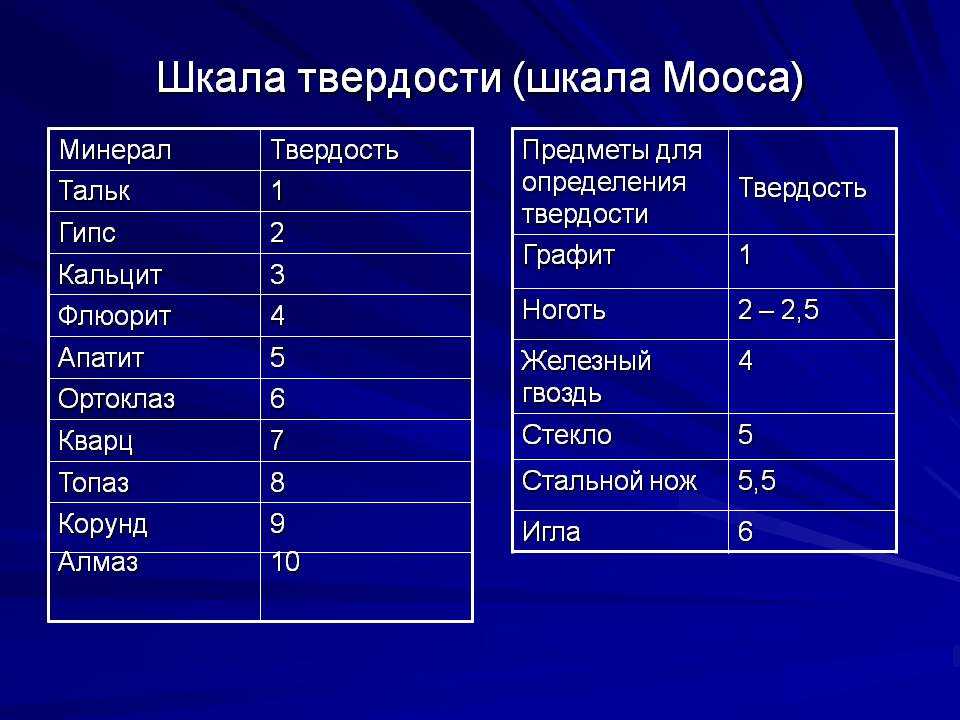 В наборе MEL Chemistry есть опыт «Химия продуктов питания», в котором карбонат кальция растворяют с помощью обычного уксуса (см. опыт «Резиновое яйцо»).
В наборе MEL Chemistry есть опыт «Химия продуктов питания», в котором карбонат кальция растворяют с помощью обычного уксуса (см. опыт «Резиновое яйцо»).
Как смягчить воду?
Вода с низким содержанием солей кальция и магния называется мягкой. А процесс удаления жесткости воды – умягчение.
Самый простой способ умягчить воду, как показал наш эксперимент, это кипячение. При нагревании гидрокарбонаты кальция и магния (Ca(HCO 3 ) 2 и Mg(HCO 3 ) 2 ) подвергаются термическому разложению:
Ca(HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Mg(HCO 3 ) 2 → MgCO 3 + CO 2 ↑ + H 2 O
MgCO 3 + H 2 O → Mg(OH) 2 ↓ + CO 2 ↑
Кипячение (тепловое умягчение) — древнейший способ умягчения воды для бытовых нужд. Конечно, этот процесс устраняет только временную (карбонатную) жесткость. Постоянная жесткость сохраняется, как мы можем наблюдать в первой части нашего опыта: вода, насыщенная хлоридом кальция CaCl 2 не оставляет осадка при кипячении.
Конечно, этот процесс устраняет только временную (карбонатную) жесткость. Постоянная жесткость сохраняется, как мы можем наблюдать в первой части нашего опыта: вода, насыщенная хлоридом кальция CaCl 2 не оставляет осадка при кипячении.
Перегонка тесно связана с кипячением. При перегонке испарившаяся жидкость последовательно конденсируется на охлаждаемой поверхности и, таким образом, собирается в виде капель. Вода, очищенная таким способом, называется дистиллированной и не содержит ионов металлов. Из-за низкой минерализации дистиллированная вода не пригодна для питья, так как «вымывает» минералы из организма. Однако дистиллированная вода широко используется в науке и промышленности.
Ниже вы можете найти более подробную информацию о современных методах смягчения воды.
Узнать больше
Очевидно, что кипячение — один из самых простых способов смягчения воды. Однако такой процесс имеет существенные недостатки, а именно низкий КПД и большие энергозатраты.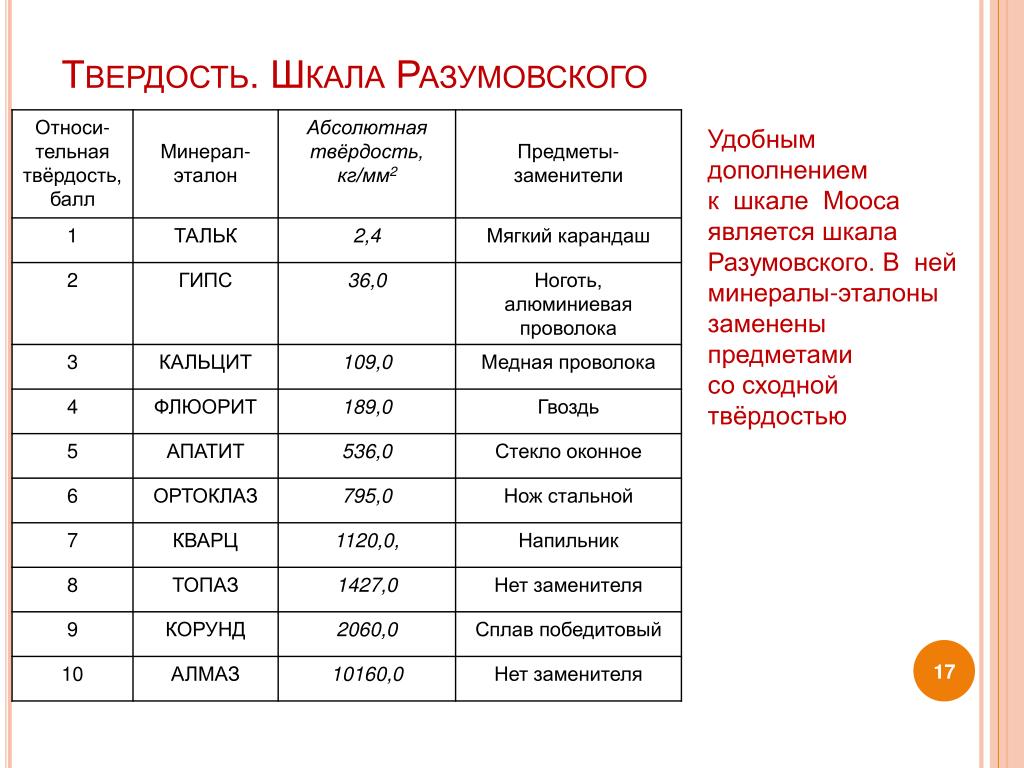
Еще один способ смягчения воды – использование реагентов. Они переводят ионы магния и кальция в нерастворимую форму путем добавления некоторых химических веществ, например, гидроксида кальция Ca(OH) 2 (the process is called lime softening):
Ca(OH) 2 + Ca(HCO 3 ) 2 → 2CaCO 3 ↓ + 2H 2 O
Mg(HCO 3 ) 2 + 2Ca(OH) 2 → Mg(OH) 2 ↓ + 2CaCO 3 + 2H 2 O
Аналогично кипячению, размягчение известью устраняет только карбонатную жесткость. Для того чтобы убрать постоянную (некарбонатную) жесткость необходимо более глубокое умягчение воды, поэтому помимо гашеной извести используют карбонат натрия Na 2 CO 3 :
Ca 2+ + Na 2 CO 3 → CaCO 3 ↓ + 2Na +
Mg 2+ + Na 2 CO 3 → MGCO 3 ↓ + 2NA +
MGCO 3 + CA (OH) 2 → MG (OH) 2 ↓ Intember Empacti ионы кальция и магния из воды, используют «большие пушки» – фосфат натрия Na 3 PO 4 :
3Ca 2+ + 2Na 3 PO 4 → Ca 3 (PO 4 ) 2 ↓ + 6Na +
3Mg 2+ + 2Na 3 PO 4 → Mg 3 (PO 4 ) 2 ↓ + 6Na +
Недостатком этого метода умягчения воды является необходимость точного дозирования реагентов.
Наиболее широко используемый в промышленности метод умягчения воды включает ионообменные смолы . Вода проходит через специальный фильтр, задерживающий ионы кальция Ca 2+ , магния Mg 2+ , железа Fe 2+ и марганца Mn 2+ . Эти «пойманные» ионы замещаются выделившимися в раствор ионами калия K + , натрия Na + или водорода H + .
Этот метод очень эффективен для умягчения воды. Преимуществами этого метода являются низкая стоимость реагентов и отсутствие сложных процедур, таких как осаждение и удаление осадка. Кстати, именно таким способом происходит смягчение воды в посудомоечной машине. Чтобы фильтр прослужил дольше, в посудомоечную машину высыпают соль NaCl, чтобы она заменила там кальций и магний и насытила фильтр ионами натрия.
В лаборатории часто используют другой процесс очистки воды, называемый обратным осмосом. Кроме того, этот метод иногда используется даже в домашних условиях.




 6
6 0
0 0
0 0
0 5
5 0
0




