Углекислый газ физические свойства: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 25.08.1991 | 0 | Разное
Углекислый газ он же углекислота он же двуокись углерода
Углекислый газ — это бесцветный газ, почти без запаха, без токсичного и тяжелее воздуха. Углекислый газ широко распространен. Он растворяется в воде с образованием огитариновой кислоты h3CO3 и имеет кислый вкус. Воздух содержит около 0,03 % углекислого газа. Плотность в 1,524 раза больше воздуха, 0,001976 г/см 3 (нулевая температура, давление 101,3 кПа). Ионизированный потенциал составляет 14,3 В. Химическая формула-CO2.
содержание
Неизвестно, почему этот газ имеет много терминов, но на площадке сварки производства термин «углекислый газ» используется в соответствии с GOST2601. В «Правилах для кровеносных сосудов и безопасной работы» использовался «углекислый газ», а в GOST 8050 был принят «газ углекисленного газа». Поэтому мы будем работать на основе всех этих концепций.
Плотность углекислого газа зависит от давления, температуры и состояния накопления. При давлении воздуха и температур е-78,5 ° C диоксид углерода в состоянии жидкости отдается, что приводит к «сухому льду» с комком, похожим на белый снег.
При температур е-56,6 ° C под давлением 528 кПа диоксид углерода может быть три (та к-названная тройная точка).
Диоксид углерода является тщательно стабильным и в первый раз разделяется на угарный газ и кислород при температуре 2000 ° C или выше.
Сжиженный газовый газ
Жидкий углекислый газ является бесцветной и без запаха жидкостью, и плотность значительно изменяется и з-за изменений температуры. Он существует при комнатной температуре только с давлением 5,85 МПа или более. Плотность углекислого диоксида жидкости составляет 0,771 г/см 3 (20 ° C). При температуре 11 ° C или менее он тяжелее воды, +11 ° C или выше.
Количество диоксида углерода жидкости сильно варьируется в зависимости от температуры, поэтому количество определяется массой и продается. 5,8-22,9 ° C Растворы воды для углекислого газа не превышают 0,05 %.
Когда углекислый газ жидкости вставлен, он превращается в газ.
Когда 1 кг диоксида углерода жидкости испаряется в нормальных условиях (20 ° C, 101,3 кПа), генерируется 509 литров углекислого газа.
В 1823 году Хамфри Дэви и Майкл Фарадей впервые собрали углекислый газ.
сухой лед
Твердый углекислый газ (сухой лед) выглядит как снег и лед. Содержание углекислого газа, полученное из сухого ледяного кирпича, высокого уровня от 99,93 до 99,99 %. Количество воды в пределах от 0,06 до 0,13 %. Контейнеры используются для хранения и транспортировки, потому что сухой лед на открытом воздухе является серьезным. Производство углекислого газа из сухого льда выполняется с выделенным испарителем. Мы поставляем твердый углекислый газ (сухой лед), соответствующий GOST 12162.
Если скорость выбора газа слишком быстрая, давление уменьшается в цилиндре, а отсутствие теплового снабжения охлаждает углекислый газ, скорость испарения уменьшится, и если оно достигнет «Тр и-точки», он станет сухим льдом. Забито в отверстии коробки передач, и даже больше. Вы не можете выбрать газ. Когда сухой лед нагревается, он меняется непосредственно на углекислый газ, избегая жидкого состояния. Для того, чтобы сухой лед испарился, он должен быть гораздо больше тепла, чем испарить углекислый газ жидкости, так что даже если в цилиндре образуется сухой лед, он медленно испаряется.
Для того, чтобы сухой лед испарился, он должен быть гораздо больше тепла, чем испарить углекислый газ жидкости, так что даже если в цилиндре образуется сухой лед, он медленно испаряется.
История открытия углекислого газа
Углекислый газ является первым газом, описанным как прозрачное вещество. В 17 веке химик Фландрии Ян баптистский фанат Хермонт заметил, что после сжигания угля в закрытом контейнере масса золы будет намного меньше массы горящего угля. Он объяснил это как «газ», становясь невидимым комком.
Природа углекислого газа была изучена намного позже в 1750 году. Шотландский физик Джозеф Блэк.
Он обнаружил, что газ генерировался при лихорадке или реагировании с карбонатом кальция (карбонат кальция), и назвал его «связывающим воздухом». Было обнаружено, что «связывание воздуха» имеет более высокую плотность, чем воздух, и не поддерживал сжигание.
Когда связывающий воздух, то есть, CO2 углекислого газа пропускается через водный раствор Ca (OH) 2 извести, карбонат Caco3 удаляется на дне.
Джозеф Блэк доказал этот опыт, что углекислый газ убран в дыхании животных.
Способы получения углекислого газа
Все статьи о том, как получить углекислый газ, подробно описаны, но вот основные способы их получить.
- Из известняка
- Из известняка?
- От газа, полученного в химической промышленности
- Углекислый газ чаще всего используется.
Применение углекислого газа
Создать защитную среду для полуавтоматической сварки.
- При производстве газированных напитков ;; — обеспечить защитную атмосферу для производства газированных напитков.
- Охлаждение, замораживание, сохранение еды;-охлаждение, замораживание, сохранение пищи;
- Для систем огнетую, для охлаждения, охлаждения, хранения, замораживания; -сильная система погашения.
- От загрязнения поверхности продукта и з-за сухой очистки льда.
- Об использовании углекислого газа для сварки
Поскольку плотность углекислого газа довольно высока, даже если потребление углекислого газа в струи является относительно низким, можно защитить зону реакции дуги от контакта с газовым воздухом и предотвратить нитринг металлов сварки. Поскольку потенциал ионизации и теплопроводности низкие, в центре дуговой колонны образуются части с высокой температурой, что приводит к углублению и меньшей ширине сварки. Газ углекислого газа является активным газом, а в процессе сварки он взаимодействует с сварочным металлом и обладает эффектом окисления и погружения металлов сварного бассейна.
Молекула углекислого газа CO2, упавший на порцию сварной части, разлагается на атомный кислород O и угарный угарный газ. В результате металлический сплав в сварке ожога, а основной материал окисляется (появляются слизняк, дросс и дым). Реакция окисления расплавленного сварного металла заключается в следующем.
Реакция окисления расплавленного сварного металла заключается в следующем.
Fe + co2 = feo + co
В прошлом, когда углекислый газ использовался в качестве защитного агента, в сварной части происходили многие дефекты (в основном поры). Поры во время сварки генерируются затвердевшим металлом в сварочном бассейне, высвобождающем угарного газа (CO) и з-за отсутствия окисления и кипения. В то же время поверхность сварки высокой окисленной и з-за атмосферы окисления в сварной дуге, и генерируется большое количество шлака. Если вы не удовлетворены своей эстетикой, но вам нужно применить защитную пленку, вам понадобится больше поверхностной очистки.
При высоких температурах углекислый газ разлагается, производя высоко активного одноэтажного кислорода.
Окисление металла шва, выделяющееся при сварке углекислым газом и свободным кислородом, вызывается легирующими элементами с большим сродством к кислороду, обычно кремнием и марганцем (в дополнение к количеству металла шва), или порошковыми швами ( сварка порошковой проволокой) нейтрализуется.
Ни двуокись углерода, ни окись углерода практически не растворяются в твердых телах или расплавленных металлах. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и их концентрации по уравнению.
Ме + О = Мео, где Ме — металл (марганец, алюминий и т. д.).
Сам углекислый газ также вступает в реакцию с этими элементами. Сварка в углекислом газе приводит к значительному снижению содержания алюминия, титана и циркония и в меньшей степени кремния, марганца, хрома и ванадия.
В частности, при полуавтоматической сварке активно осуществляется окисление примесей. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла и газа происходит, когда капля находится у кромки электрода и в сварочной ванне, а при сварке вольфрамовым электродом — только внутри ванны. является фактическим. Как известно, в дуговом вакууме площадь контакта между металлом и газом велика при высокой температуре, поэтому взаимодействие между газом и металлом чрезвычайно сильное. Сварочную проволоку с высоким содержанием раскислителей (кремний, марганец) следует применять для компенсации потерь легирующих элементов в сварном шве.
Сварочную проволоку с высоким содержанием раскислителей (кремний, марганец) следует применять для компенсации потерь легирующих элементов в сварном шве.
Давно известно, что чем больше сила сварочного тока, тем больше размер капель расплавленного металла. И наоборот, увеличение размера капель металлического электрода увеличивает распыление.
В настоящее время для сварки используется углекислый газ из-за большого количества напыления металла в сварочной ванне. Производители сварочных аппаратов не могут избежать этой проблемы, а сварочные полуавтоматы имеют специальные функции, уменьшающие эффект распыления. Еще один способ решить эту проблему – использовать специальные спреи или жидкости, которые не распыляются в металл окрашиваемой детали. В любом случае для удаления брызг можно использовать любой из этих способов, а не время и расходные материалы удаления брызг при механической зачистке.
При сварке тонких деталей на оптимальном режиме сварки возможно получение минимального разбрызгивания за счет короткого хода металлического электрода. Например, при использовании сварочной проволоки? 1 мм, сварочный ток 150 А, напряжение дуги 16-23 В, мощность передается с небольшим падением за счет поверхностного натяжения.
Например, при использовании сварочной проволоки? 1 мм, сварочный ток 150 А, напряжение дуги 16-23 В, мощность передается с небольшим падением за счет поверхностного натяжения.
Для сварки МАГ толстостенных конструкций рекомендуется использовать проволоку большего диаметра, что приводит к увеличению сопротивления сварочному току, увеличению разбрызгивания и снижению выхода металла электрода. Уменьшите скорость подачи сварочной проволоки, чтобы уменьшить разбрызгивание. Следовательно, использование чистого диоксида углерода отрицательно влияет на производительность и качество сварки. Его рационально использовать в качестве защитного газа при порошковой сварке (FCAW) углеродистой стали из-за короткого времени транспортировки и хорошего качества сварного шва.
Углекислый газ химически активен с вольфрамом, поэтому при сварке в этом газе используются только плавящиеся электроды.
При выборе защитного газа необходимо учитывать не только его стоимость, но и последствия разбрызгивания, последующего расслоения и трудоемкость всего процесса.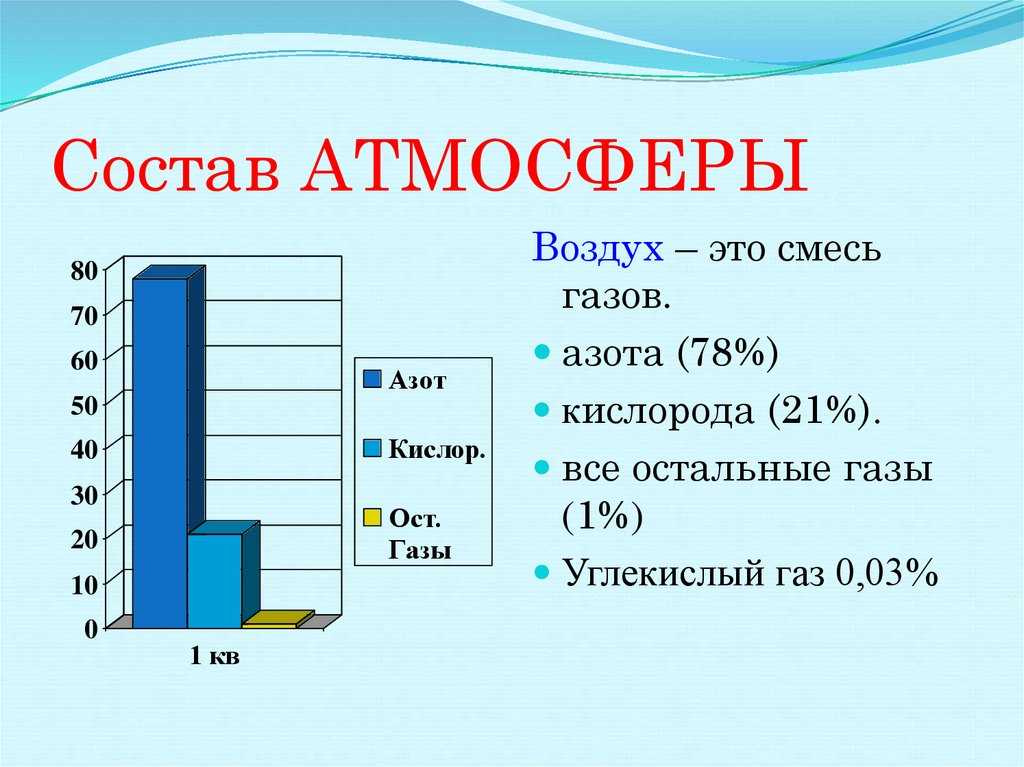
Углекислый газ не токсичен и не взрывоопасен. Углекислый газ тяжелее воздуха, когда его концентрация достигает 5% (92 г/м 3 ) или более, и считается, что он оказывает неблагоприятное воздействие на организм человека, поскольку скапливается у пола в плохо проветриваемых помещениях. В результате объемная доля кислорода в воздухе уменьшается, что может вызвать дефицит кислорода и удушье. В помещениях, где для сварочных работ используется углекислый газ, должна быть предусмотрена общая приточно-вытяжная вентиляция. Предельно допустимая концентрация углекислого газа в воздухе при производстве работ составляет 9,2 г/м 3 (0,5 %).
Вредность и опасность углекислого газа
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов применяют первичные газы более высокого качества и сжиженный углекислый газ.
Хранение и транспортировка углекислого газа
Углекислый газ транспортируют и хранят в жидком виде в стальных баллонах или наливных цистернах по ГОСТ 949, затем газифицируют на заводе и централизованно подают на сварочный пост по рампам.
Если в общий баллон емкостью по воде 40 л налить 25 кг жидкой углекислоты, то при нормальном давлении она займет 67,5% вместимости баллона, а при испарении образуется 12,5 м3 углекислоты.
Воздух собирается в верхней части цилиндра вместе с газообразным углекислым газом. Поскольку вода тяжелее жидкого углекислого газа, она концентрируется на дне цилиндра.
Чтобы уменьшить содержание воды в двуокиси углерода, рекомендуется поместить баллон клапаном вниз и дать ему отстояться в течение 10,15 минут, прежде чем осторожно открыть клапан, чтобы влага вышла из баллона. Перед сваркой необходимо выпустить небольшое количество газа из баллона, в котором он обычно установлен, для удаления воздуха из баллона. Часть влаги задерживается в углекислом газе в виде паров воды и ухудшает качество шва при сварке.
Когда газ выпускается из баллона, он сильно охлаждается за счет эффекта удушения и поглощения тепла при испарении жидкого углекислого газа. При отборе большого количества газа не только сухой лед, но и влага, содержащаяся в углекислом газе, может замерзнуть и заблокировать редуктор. Во избежание этого перед редуктором при отборе углекислого газа ставится газовый обогреватель. Окончательное удаление воды после восстановителя производится специальной сушилкой, наполненной стекловатой и влагопоглотителями, такими как хлористый кальций, силикат гелия, сульфат меди.
Во избежание этого перед редуктором при отборе углекислого газа ставится газовый обогреватель. Окончательное удаление воды после восстановителя производится специальной сушилкой, наполненной стекловатой и влагопоглотителями, такими как хлористый кальций, силикат гелия, сульфат меди.
Цилиндр окрашен в черный цвет и выгравирован желтыми буквами «ДВУОКИСЬ УГЛЕРОДА».
Углекислый газ, содержащийся в воздухе в ничтожных количествах, оказывает серьезное воздействие на человека. В этой статье подробно описаны химические, физические и биологические свойства газов, а также найдено их применение в промышленности и медицине.
Углекислый газ («двуокись углерода», «углекислый газ», «углекислый ангидрид», двуокись углерода) — газ, входящий в состав воздуха в атмосфере. Форма идентификации вещества: CO2.
Что такое углекислый газ
Невидимый при нормальных обстоятельствах, он прозрачен и пропускает ультрафиолетовый и видимый свет. Он сжижается под значительным давлением, что делает его возможным на глубине более 590 м.
Углекислый газ является частью всех глобальных процессов газообмена в атмосфере, почве и воде. Он является частью всех живых организмов и для большинства организмов и растений является одним из основных функциональных компонентов процесса дыхания, поддерживающего жизнь.
Люди используют углекислый газ для различных целей, в частности, в качестве защитной среды во время сварки.
атмосферный углекислый газ
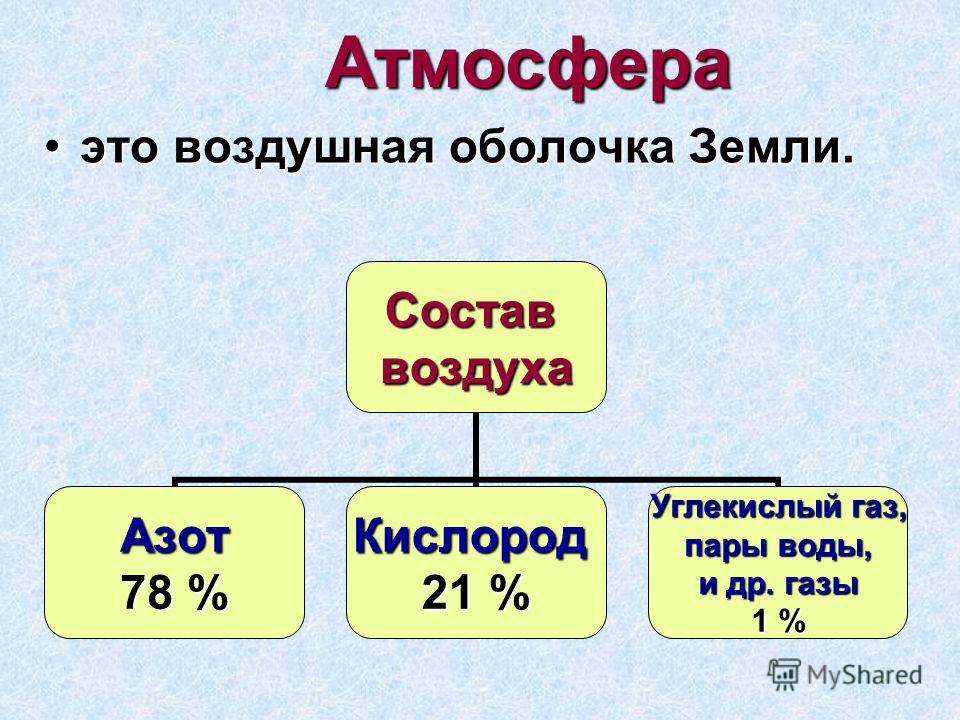
Углекислого газа в атмосфере до 0,045%, или около 800 миллиардов тонн одного только газа. В воде и почве много.
Сегодня это около 400 ppm (400 ppm). Между прочим, этот показатель составлял около 250 ppm 300–350 лет назад, до начала промышленной революции, когда мировая экономика быстро перешла к индустриализации в 17 веке.
Интересно, что в городе он достигает 450-470 промилле, а в бюджетных учреждениях — более 1000-1200 промилле по типу школы. Это показывает негативное влияние транспорта и перенаселенности.
CO2 играет небольшую, но важную роль в биосфере и экосистемах. Основное воздействие — это воздействие в качестве парникового газа.
Основное воздействие — это воздействие в качестве парникового газа.
блокирует инфракрасное излучение планет в окружающее пространство.
- Температура атмосферы с каждым годом повышается.
- Есть также природные явления и изменение климата.
- Современные проявления этих преобразований включают ускоренное таяние ледяных шапок, глобальное повышение уровня моря и изменение состава биосферы.
- По оценкам ученых, без этого явления среднегодовая температура поверхности Земли была бы на 25-30°С ниже.
углекислый газ в помещении
В помещении люди являются основным источником производства CO2. Взрослый человек выдыхает до 20 литров (0,5 м3) газа в час в состоянии покоя и до 35-40 литров при активной физической нагрузке.
В зависимости от характера помещения газовые котлы и печи могут выделять дополнительное количество CO2.
Поэтому необходимо регулярно проветривать все бытовые и технические помещения, включать соответствующую вентиляцию и открывать окна на короткие промежутки времени.
Углекислый газ примерно в 1,5 раза тяжелее свежего воздуха, поэтому он скапливается в подвалах и подвалах.
Свойства углекислого газа таковы, что его невозможно почувствовать в обычных условиях. Запах и вкус проявляются только при увеличении концентрации. Кислый привкус во рту обусловлен выработкой небольшого количества углекислоты из-за влаги слизистых оболочек.
Свойства углекислого газа
Благодаря тому, что углекислый газ растворяется в воде и сиропе, его широко применяют при производстве различных напитков в пищевой промышленности.
Поскольку этот газ не участвует в горении, он, конечно, также используется в современных огнетушителях (таких как углекислотные огнетушители). Он не токсичен, но другие свойства должны быть тщательно оценены для безопасности человека.
Значение физического свойства
Основные свойства углекислого газа:
Преобладающее физическое агрегатное состояние: газ.
- Возможные превращения: переходит в твердое кристаллическое состояние (так называемый «сухой лед») при охлаждении до минус 78°С и в жидкое состояние при давлении около 60 атмосфер.

- Специфические признаки вкуса и запаха в норме: отсутствуют.
- Слаб против электричества: не является проводником, поэтому испускает ярко-зеленую вспышку, когда происходит импульсный разряд.
- Плотность: примерно 1,97 грамма на литр.
- Растворимость в органическом веществе: частичная.
- Воспламеняемость: Отсутствие, редкоземельные элементы, щелочные металлы будут гореть в окружающей среде.
- Практически не имеет теплопроводности.
химическое свойство
Основные химические свойства этого соединения следующие.
Тип вещества: кислотные оксиды (способны образовывать угольную кислоту в присутствии воды).
- Термическое разложение: Да, на кислород (O) и монооксид углерода (CO).
- Химическая активность: взаимодействие с оксидами оснований и активных металлов, взаимодействие с простыми веществами — в присутствии катализаторов.
- Обнаружение: Когда CO2 проходит через воду с лужами, она становится красной, а известковая вода (в которой растворен гидроксид кальция) становится мутной.

- Связь со сгоранием: замена кислорода, отключение глушителя.
- Этот монооксид углерода имеет интенсивность IV, что означает наличие в молекуле двух атомов кислорода, каждый из которых притягивает два свободных электрона, и углерод «связан» с кислородом.
Выхлопные газы и выхлопные газы, продукты различных химических реакций, транспорт и промышленная деятельность, строительство (цементное производство), пищевая промышленность (спиртовое брожение) и т.д. является крупномасштабным образованием Это больше, чем другие.
Получение углекислого газа
Международное сообщество регулярно пишет о сокращении выбросов углекислого газа, но для науки и техники газ имеет важное практическое значение.
природный источник углекислого газа
Естественными источниками углекислого газа являются
Процесс газообмена при дыхании животных и растений: Если для бактерий и млекопитающих все ясно, то зеленые организмы тоже выделяют этот газ.
- Разложение органического вещества: Большое количество CO2 образуется как химическим путем (так называемое естественное разложение), так и термически (сгорание).

- Вулканические, подземные и подводные выбросы: Углекислый газ является компонентом, который выделяет такие газы в высоких концентрациях.
- Он также включает содержание газа в различных углеродистых минералах, от известняка до нефти. Кроме того, значительные количества растворяются в водах морей и океанов.
Как получить в лаборатории
Наиболее стабильным и эффективным методом искусственного производства (сочетающим трудозатраты и объем производства) является киповое устройство.
Это устройство используется для контроля и создания эффекта, который жидкая среда оказывает на твердое тело. В этом случае осколки и куски мрамора следует обработать концентрированной соляной кислотой. Кальцинированная сода и обычный мел также эффективны.
В исследовательских целях проще всего принести готовый газ в баллонах. Он чище и обеспечивает необходимое давление.
Промышленный метод приобретения
«Сырье» для производства и улавливания углекислого газа поступает в результате различных химических реакций в ходе промышленных процессов и переработки ископаемых.
 Углекислый газ получают различными способами.
Углекислый газ получают различными способами.Горячая обработка известняка: сырье разлагается на углекислый газ и оксид кальция во время обжига.
- Физический эффект копченого газа фиксируется мотатрическим карбонатным или моноэттаноламиновым карбонатным раствором, а бикарбонат образуется для тепла или снижения давления, CO2 высвобождается из окружающей площади.
- Воздух в атмосфере разлагается тепло: тепло и электричество разделены на такие компоненты, как углекислый газ, чистый кислород, азот и аргон.
- Тепло разложение алкогольных ферментированных газовых продуктов.
- Многие видео были сняты для этих процессов и некоторых других процессов.
Каковы практические углекислого газа? Это для защиты газа от окружающего воздуха и процесса, вызванного им.
Применение углекислого газа
Транспортировка и хранение без плесени или органического вещества различных продуктов (половина продуктов, мясо, рыбы) и органического вещества.
- Подарки, которые имеют полезное свойство для напитко в-положительное влияние минеральной воды с газированной и шимизу привлекает внимание.

- Создайте пищевую добавку (например, разрыхлитель E290), которая усиливает время и сохранение пищи.
- Производство кофеин а-без кофе (связанный с техническими процессами для удаления растворенных материалов).
- Организация ванн лечения углекислого газа с целью поддержания и восстановления сердечн о-сосудистого здоровья.
- В целом, специализированные задачи в медицинской помощи. Например, работа над формированием тканей и дыханиями.
- Проверьте замороженное сопротивление шин (особенно автомобильные шины, протестированные с помощью сухого льда).
- Тесты по снижению температуры для различных устройств, механизмов, инструментов, испытания на снижение тему для различных устройств, механизмов и инструментов.
- Строительство и подача топлива угасчика углекислого газа (наиболее эффективный метод пожаротушения для огня, такой как электрическая оборудование и легковоспламеняющаяся жидкость).
- Рабочая среда в оружии давления воздуха.
- Используется в качестве реагента для химических реагентов для синтеза и изготовления соли, полимера и различных волокон.

- Очистка загрязнения дренажа.
- Защищает расплавленный металл в сварной ванне.
- Также интересно использовать его как тип источника энергии двигателя с другим объемом (до нескольких десятков CM3) для моделирования аэрокосмической и судостроения.
Углекислый газ находится с кислородом и поддерживает жизнь организма. Суть работы состоит в том, чтобы вернуть кислород, связанный с гемоглобином, чтобы питать ткани и отдельные органы. В случае углекислого газа важно балансировать в основном молекулы CO2 и O2.
Влияние углекислого газа на организм человека
Вещество, которое влияет на кровеносные сосуды и расслабление, и является расширением кровеносного сосуда организма. Это напрямую связано с подачей кислорода для физической активности.
В спокойном состоянии, номинальная зона артерий и капилляров, оптимальная.
- Когда необходимо применять физическую силу (жизнь, полезная работа), содержание углекислого газа в крови слегка увеличивается, что приспособлено, не связанное с намерениями человека.

- Эффект, специфичный для газа, стена корабля ослабнет и смягчает.
- Поперечная площадь кровеносных сосудов увеличивается, а сила кровотока увеличивается.
- В результате количество ценного кислорода, отправленного в ткань, которая питает мышцы, увеличивается, что приводит к увеличению природных ресурсов.
- Существует также феномен неуместного увеличения углекислого газа. Процессы воспаления, повреждение организма и проблемы с системами крови до ишемии. Это интегрированный синтез метаболизма газа и требует медицинских норм.
Однако газы по-прежнему являются компонентом «нормального» дыхания. Переносится кровеносной системой, присутствует в плазме, гемоглобине и тканях. Интересно, что в организме он существует при парциальном давлении, т. е. во всем доступном пространстве, а не накапливается в определенных местах.
Еженедельный синдром особняка
Это явление также относится к тем, кто находится в помещении в течение длительного периода времени.
 Симптомы включают плохое физическое состояние, вялость, тяжесть в голове и даже заложенность носа. Самое смешное, что как только вы оказываетесь в городе, эти вещи быстро исчезают.
Симптомы включают плохое физическое состояние, вялость, тяжесть в голове и даже заложенность носа. Самое смешное, что как только вы оказываетесь в городе, эти вещи быстро исчезают.Корень проблемы — увеличение углекислого газа. Скрытой проблемой для здоровья в любом здании являются концентрации СО2, значительно отличающиеся от нормы. Допустимое значение 600–800 частей на миллион становится 1000–2000 частей на миллион.
Решение — вентиляция. При меньшем поступлении свежего воздуха концентрация СО2 постоянно повышается и должна «вымываться» вентиляцией.
респираторный ацидоз
При избытке углекислого газа в воздухе увеличивается и его содержание в организме. Это изменяет кислотность крови и вызывает респираторный (респираторный) ацидозный комплекс. Это явление характеризуется учащением пульса, снижением физической подготовленности, тревожностью и снижением концентрационных порогов умственной работоспособности. Сильнейшая потеря сознания.
Кратковременное пребывание в атмосфере, «загрязненной» углекислым газом, очищает воздух, а при выходе на улицу негативные симптомы исчезают.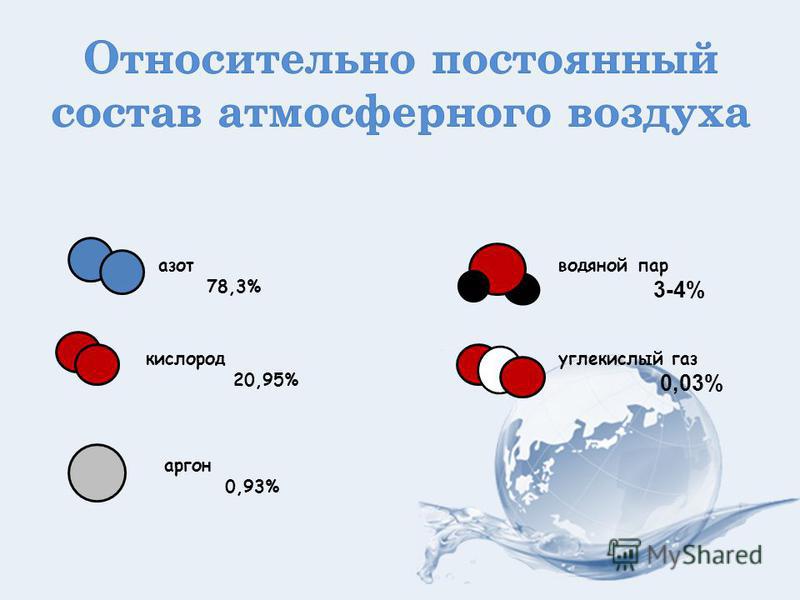 Если такое состояние сохраняется, развивается и ухудшается хронический ацидоз. Наряду с этим наступает ослабление иммунитета, заболевания органов дыхания и кровообращения, нарушения сна, снижение физической работоспособности.
Если такое состояние сохраняется, развивается и ухудшается хронический ацидоз. Наряду с этим наступает ослабление иммунитета, заболевания органов дыхания и кровообращения, нарушения сна, снижение физической работоспособности.
Суть явления заключается в изменении кислотно-щелочного баланса в крови, измеряемом рН.
Состояние человека по концентрации СО2
«Химия» тела интересна тем, что оно ведет себя двояко со всей материей. Углекислый газ не является исключением, он необходим в нормальных естественных количествах и становится токсичным и смертельным для живых организмов при превышении его концентрации в атмосфере.
Так называемая гиперкапния (состояние, вызванное избыточным насыщением организма углекислым газом) характеризуется наличием головной боли, одышки и необходимости поддержания дыхания произвольным усилием, тошнотой, потерей сознания.
Следующей стадией является гипоксия, заметное снижение количества кислорода, необходимого для дыхания. Оба газа одинаково перемещаются по телу с помощью гемоглобина. Поэтому снижение концентрации кислорода напрямую влияет на функцию почти всех клеток, что приводит к заметному снижению здоровья и физической работоспособности.
Поэтому снижение концентрации кислорода напрямую влияет на функцию почти всех клеток, что приводит к заметному снижению здоровья и физической работоспособности.
Эти симптомы возникают, когда концентрация углекислого газа достигает значительных концентраций в несколько тысяч частей на миллион. Однако уже при 1000 ppm усиливаются утомляемость и одышка, и даже возникают головные боли. При 2000 стр/мин становится заметным снижение производительности.
Резюме физиолога: Высокое содержание углекислого газа в воздухе напрямую влияет на деструктивные окислительные процессы, протекающие в организме.
В данной статье рассмотрены основные нормативы, регламентирующие концентрацию углекислого газа в помещениях, и представлены оптимальные и допустимые значения в зависимости от категории помещения.
На примерах покажем содержание углекислого газа в разных ситуациях и ответим на вопрос, как поддерживать оптимальную концентрацию углекислого газа в помещении.
Свежесть воздуха – эмпирическая величина, свидетельствующая о степени насыщения воздуха кислородом, легкости дыхания, комфортности. Однако измерение кислорода затруднено, а датчики сложны и дороги. Именно поэтому климатическая индустрия изначально начала измерять свежесть воздуха по СО2.
Однако измерение кислорода затруднено, а датчики сложны и дороги. Именно поэтому климатическая индустрия изначально начала измерять свежесть воздуха по СО2.
СО2 — основной показатель свежести воздуха
Углекислый газ был выбран для оценки качества воздуха, потому что его можно измерить с высокой точностью и он сильно влияет на состояние организма человека. Его концентрация также определяет содержание других вредных веществ в воздухе.
СО2 — двуокись углерода или двуокись углерода — бесцветный газ, в небольших концентрациях не имеющий запаха. Углекислый газ выделяют люди, животные и растения, например, говорят, что человеческий организм может улавливать около 1 кг углекислого газа в день. Концентрация СО2 и конфронтационное сознание напрямую связаны. Это ощущение возникает уже при 0,08% (=800 PRM) у здоровых людей.
Углекислый газ в высоких концентрациях токсичен, относится к удушающим газам, относится к IV классу опасности. Высокие концентрации СО2 в воздухе (0,15-0,2%, 1500-2000 ppm) вызывают общую вялость, снижение внимания и концентрации, сонливость и слабость. Если содержание CO2 превышает 0,7% или 7000 частей на миллион, это считается вредным для человека.
Если содержание CO2 превышает 0,7% или 7000 частей на миллион, это считается вредным для человека.
Концентрация углекислого газа оценивается в частях на миллион (PPM), количество кубических сантиметров углекислого газа, содержащихся в кубическом метре. Другими словами, «концентрация СО2 в помещении составляет 800 частей на миллион» означает, что 1 м³ воздуха содержит 800 см³ СО2.
Оптимальные и допустимые значения содержания СО2 в помещениях приведены в ГОСТ 30494-2011 «Здания жилые и общественные. Параметры микроклимата в помещениях».
Нормы концентрации углекислого газа в помещении по ГОСТ
Оптимальное содержание углекислого газа в помещении является показателем нормального состояния организма и обеспечения комфортного самочувствия. Приемлемые показатели – это такие значения, которые в долгосрочной перспективе вызывают дискомфорт, ухудшение самочувствия, снижение трудоспособности, но не приводят к ухудшению самочувствия.
Согласно ГОСТу, оптимальное содержание углекислого газа для жилья – до 400 промилле. Однако, поскольку СО2 уже содержится в воздухе, поступающем с дороги, индекс качества воздуха внутри помещений объединяется с индексом степени загрязнения наружного воздуха для расчета допустимого нормативного значения.
Однако, поскольку СО2 уже содержится в воздухе, поступающем с дороги, индекс качества воздуха внутри помещений объединяется с индексом степени загрязнения наружного воздуха для расчета допустимого нормативного значения.
Поэтому для людей, живущих в больших городах, оптимальная концентрация CO2 в помещении составляет 800 частей на миллион. Это считается высоким качеством воздуха. Допустимая концентрация углекислого газа 1000-1400ppm. Концентрации выше этих показателей означают плохое качество воздуха, что вредно для здоровья человека.
По ГОСТ предельные значения СО2 превышаются до 1400ppm, но физиологи рекомендуют считать верхнюю границу допустимых значений 800-1000ppm.
В 60-х годах ХХ века исследования воздействия углекислого газа на организм человека проводил отечественный ученый по имени Эрициба О.В. В работе «Биологическое действие углекислого газа на организм человека и санитарная оценка содержания воздуха в общественных зданиях» изучается влияние углекислого газа на организм человека в концентрациях от 1000 до 5000 ppm.
По его словам, на этих уровнях нарушаются функции дыхательной и кровеносной систем, а также значительно снижается мозговая активность. Он приходит к выводу, что концентрация CO2 в помещении не должна превышать 0,1% (1000 PRM) и в среднем должна составлять около 0,05% (500 PRM).
При оценке качества воздуха в помещении стоит учитывать его категорию. Потому что квартиры и дома более требовательны, чем офисные и промышленные. Это потому, что необходимо обеспечить воздух хорошего качества, чтобы полностью восстановить тело, предполагая, что дом включает отдых.
Нормы концентрации CO2 для разных помещений
К первой категории заведений относятся заведения, в которых отдыхают люди, т.е. резиденции, гостиницы.
Вторая категория — это помещения для умственной работы и учебы, такие как учебные заведения и офисы.
Третья категория – учреждения с большим количеством людей, такие как офисы, производственные предприятия и все общественные учреждения.
К четвертой категории объектов относятся сооружения для мобильных видов спорта, то есть все спортивные залы, тренажерные залы и клубы, спортивные секции и т.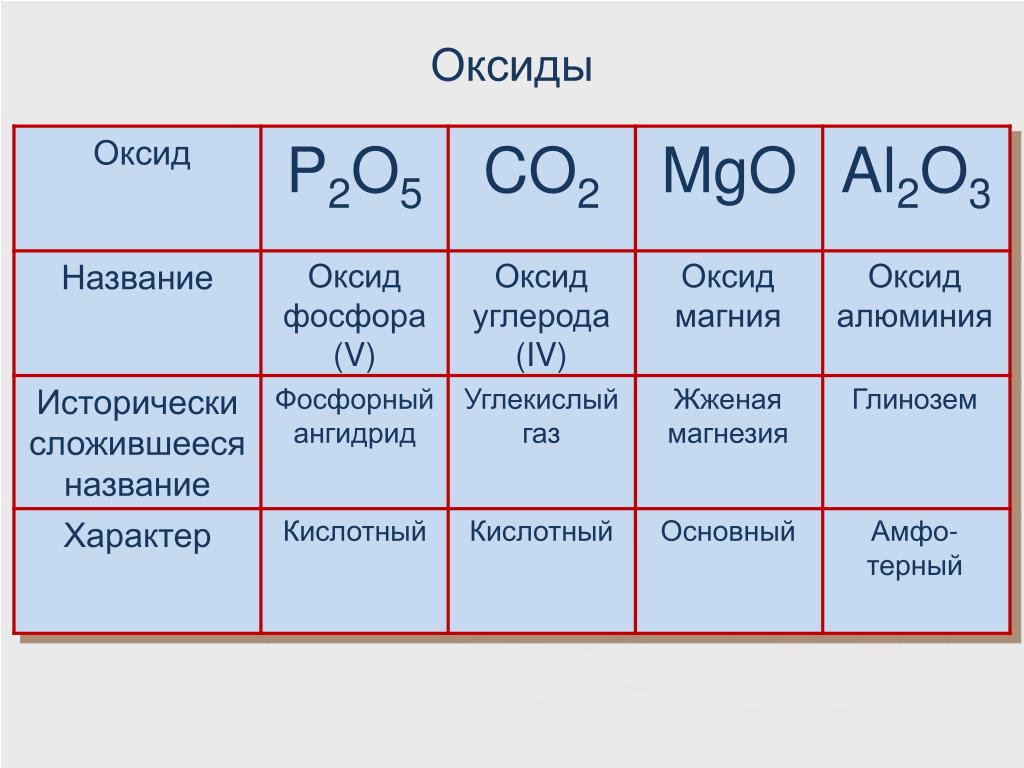 д.
д.
Содержание углекислого газа для бытового оборудования
Жилое оборудование относится к категории 1. Для достижения высокого качества воздуха в квартире в большом городе концентрация СО2 не должна превышать 800 ppm. В случае с виллами условия еще более строгие, и если концентрация CO2 составляет 750 частей на миллион или меньше, это считается воздухом высокого качества.
Оптимальные концентрации можно наблюдать при наличии в помещении одного человека, открытых окон и хорошей вентиляции. Если в помещении будет 2-3 человека, концентрация СО2 начнет повышаться до 1000-1200 ppm и окна не спасут, поэтому следует открыть окна для полного проветривания. А с двумя людьми в комнате с закрытыми окнами концентрация CO2 поднимается до приемлемых 2000 частей на миллион за ночь. Если вы откроете окно микропространства (вакуума), концентрация CO2 будет поддерживаться на уровне 1200-1300 частей на миллион, что на 400-500 частей на миллион выше стандартного значения.
Поэтому для поддержания оптимальной концентрации CO2 в помещениях с большим количеством людей требуется регулярная вентиляция и вентиляционные системы.
Рассмотрим пример. Согласно измерениям, человек выделяет в среднем 20 литров углекислого газа в час, или 0,02 м³. Семья из трех человек в комнате площадью 18 м выдыхает в воздух 0,06 м³ CO2 за один час с закрытыми окнами (0,02 м³/ч на человека). Объем помещения 54м³. В процентном отношении объем СО2 в помещении составляет 0,1111%. Переносим внимание на PPM (частей на миллион) и получаем 1111ppm. Иными словами, количество углекислого газа, выбрасываемого за час семьей из трех человек, превышает ГОСТ-оптимум.
Человечество научилось поддерживать искусственные процессы и реакции, используя газоподобные вещества, и, как следствие, для получения другого химического соединения. Кроме того, для получения определенных физических явлений и физических свойств используются различные газы. Углекислый газ (CO2) обладает множеством свойств, которые можно использовать только в химической и повседневной жизни.
Углеродный деголор (IV) — это тяжелый газ. Плотность углекислого газа примерно в 1,5 раза больше воздуха в атмосфере.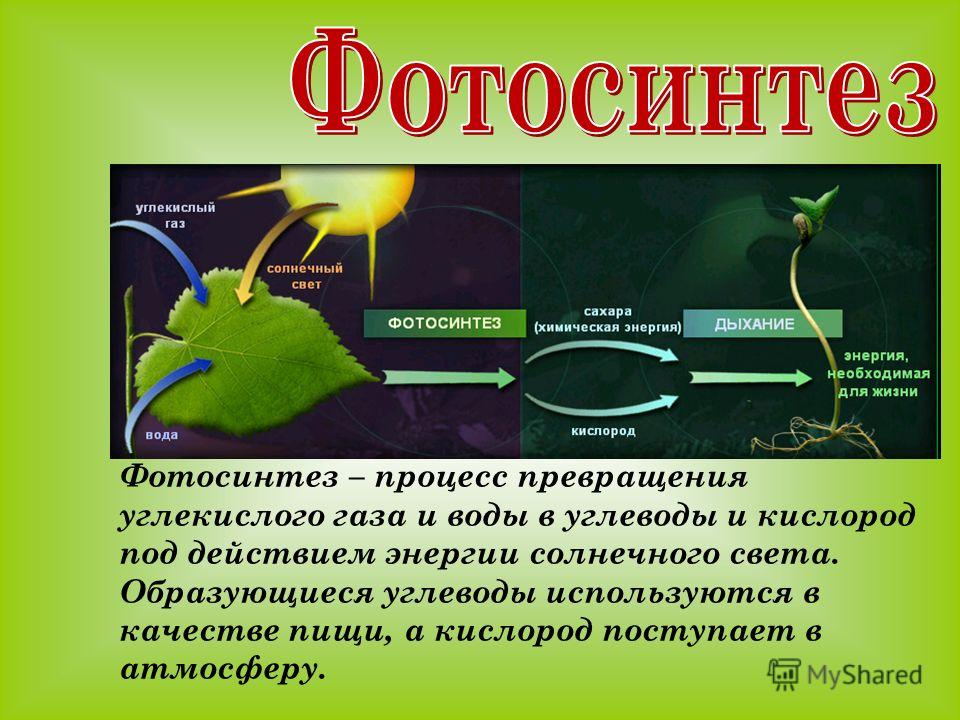 Этот газ уже находится в массе снега при минусе 78,3 градуса, но он не может получить углекислый газ жидкости при нормальном давлении. Таким образом, называемый сухим льдом, быстро переходит от твердого вещества на газ с небольшим повышением температуры. Углекисный диоксид жидкости не может быть получен, если давление не составляет 60 или более. В этих условиях газ конденсируется даже при комнатной температуре, и генерируется бесцветная жидкость.
Этот газ уже находится в массе снега при минусе 78,3 градуса, но он не может получить углекислый газ жидкости при нормальном давлении. Таким образом, называемый сухим льдом, быстро переходит от твердого вещества на газ с небольшим повышением температуры. Углекисный диоксид жидкости не может быть получен, если давление не составляет 60 или более. В этих условиях газ конденсируется даже при комнатной температуре, и генерируется бесцветная жидкость.
Что такое углекислый газ
Углекислый газ не окисляется, но может поддерживать како е-то сжигание металлов. Углекислый газ в окружающей среде может быть зажжен при определенных условиях, в зависимости от активных элементов, таких как магний, кальций и барий. Этот газ имеет высокую степень растворения в воде и содержится в воздухе и з-за дыхания живых существ и растений, вулканической активности на земле и сжигания органического вещества.
Когда CO2 растворяется в воде, образуется углекислота с высокой концентрацией. Это вещество может реагировать с фенолами и органическими соединениями магния. Углекислый газ реагирует с щелочными. В результате таких реакций генерируются углеродная соль и эфир углерода.
Углекислый газ реагирует с щелочными. В результате таких реакций генерируются углеродная соль и эфир углерода.
Углекислый газ не может быть идентифицирован с помощью визуальных или обонятельных органов. Если концентрация CO2 низкая, вкус не будет ощущаться, но если в воздухе много этого газа, он может показаться кислым.
Свойства углекислого газа
Если концентрация углекислого газа в вдыхаемом воздухе высока, это может вызвать отравление. Каковы признаки неблагоприятного воздействия CO2 на человеческое тело?
Есть шум и шум в ушах.
- Шум, шум, шум, шум и шум входят в уши.
- Теряя сознание.
- Учитывая, что углекислый газ более тяжелее воздуха, концентрация на дне комнаты больше. По этой причине могут видеть симптомы животных, детей и очень коротких взрослых. Высокая концентрация CO2 может привести к смерти человека. Если вы потеряете свое сознание, вы можете быть уложены на пол, потому что количество кислорода недостаточно, а нормальное дыхание не может быть выполнено.

Есть много способов приобрести промышленный углекислый газ. Самая высокая прибыльность — это варианты генерации газа, основанные на сборе CO2, генерируемого в виде отходов в химической промышленности.
Углекислый газ: получение в промышленности
Газ угарного газа (IV) получается из промышленного дыма путем высадки моноэттаноламина. Частицы этого вещества отправляются в дренажную трубу, а углекислый газ поглощается. Моноэттаноламин, который прошел смесь CO2, инструментаруется для очистки в специальном резервуаре, который излучает углекислый газ по определенной температуре и индикатору давления.
При производстве спирта ферментирование сырья может обеспечить высококачественный углекислый газ. В такой отрасли газообразной CO2 обрабатывают водородом, калиевой гипермангиновой кислотой и углеродом. В результате реакции получается диоксид углерода жидкости.
Твердый углекислый газ (сухой лед) также можно получить из отходов пивоваренных и винокуренных заводов. Это агрегатное состояние вещества в промышленных масштабах образуется в следующем порядке.
Это агрегатное состояние вещества в промышленных масштабах образуется в следующем порядке.
Из бака, где происходит брожение, газ перекачивается в бак промывки.
- Углекислый газ направляется в газгольдер и подвергается воздействию повышенного давления.
- Специальный холодильник охлаждает CO2 до определенной температуры.
- Полученную жидкость фильтруют через слой угля.
- Углекислый газ отправляется обратно в холодильник, где он дополнительно охлаждается, а затем сжимается.
- Таким образом можно получить качественный «сухой лед» для использования в пищевой промышленности, растениеводстве и быту.
Углекислый газ используется в различных областях благодаря своим физическим и химическим свойствам. Углекислый газ используется в химической промышленности.
Применение углекислого газа
Синтез искусственных соединений
- Для очистки тканей животных и растений.
- Для контроля температуры реакции.
- Нейтрализовать щелочь.

- CO2 используется в металлургии.
Отрегулировать шахтный дренаж
- Создайте лазерный луч для резки металла.
- Осаждение вредных газов.
- Кроме того, CO2 активно используется в бумажной промышленности. Монооксид углерода используется для регулирования pH древесной массы и увеличения мощности производственного оборудования.
Углекислый газ используется в качестве консерванта в пищевой промышленности. CO2 используется в качестве пенообразователя при выпечке. Газированные напитки производятся с использованием углекислого газа, а «сухой лед» используется для сохранения скоропортящихся продуктов.
Углекислый газ также необходим для выращивания овощей и фруктов в теплицах зимой. В таких помещениях в воздухе отсутствует СО2, необходимый растениям для «дыхания», поэтому необходимо искусственное насыщение этим газом.
В медицине углекислый газ применяют при сложных операциях на внутренних органах. Отличительной особенностью этого газа является то, что его можно использовать для реанимации, поскольку он может эффективно стимулировать дыхание пациента за счет увеличения его концентрации.
Сварка металлов использует углекислый газ в качестве инертного облака, чтобы не допустить попадания активного кислорода в зону сварки. При такой обработке сварной шов получается идеально однородным и свободным от окисления.
CO2 используется для тушения пожаров из-за его охлаждающих свойств при испарении. Огнетушители, наполненные этим материалом, эффективны при тушении пожаров на объектах, где нельзя применять сухие химические или пенные огнетушители.
В повседневной жизни углекислый газ используется в качестве сжатого газа в пневматических пистолетах, для отпугивания комаров и избавления от крыс.
CO хранится в черных баллонах, на корпусе которых должна быть маркировка «Углекислый газ».
Углекислый газ: хранение и транспортировка
Кроме того, на контейнере должна быть указана информация о производителе баллона, вес пустого контейнера и дата окончательной проверки. Не используйте баллоны с углекислым газом.
Срок проверки истек.
- Истекший.

- Неисправный клапан.
- Транспортировка цилиндра с газом должна выполняться в соответствии со следующими правилами:
Цилиндры можно переносить только по горизонтали. Вертикальное размещение допускается только в том случае, если есть специальный забор, чтобы предотвратить падение цилиндра во время транспортировки.
- Вам нужно приготовить резиновый куст, чтобы безопасно перемещаться по цилиндру.
- Не дайте механических эффектов или чрезмерного нагрева.
- Транспортировка цилиндров углекислого газа с приобретенным оборудованием запрещена.
- Также запрещено носить вручную или кататься на землю по соображениям безопасности.
Хранение бомб углекислого газа можно выполнить в обоих комнатах и на открытом воздухе с специальным оборудованием. В здании контейнер установлен на расстоянии более 1 м от устройства для отопления. В случае с хранением улицы рекомендуется поместить танк под купол таким образом, так как необходимо защитить контейнер от прямых солнечных лучей и осадков. При хранении цилиндра в комнате без отопления или на открытом воздухе необходимо предотвратить контейнер минус 40 градусов или менее зимой.
При хранении цилиндра в комнате без отопления или на открытом воздухе необходимо предотвратить контейнер минус 40 градусов или менее зимой.
Тип углекислого газа
Углекислый газ, свойства, получение и применение
Углекислый газ, свойства, получение и применение.
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Углекислый газ, формула, молекула, строение, состав, вещество
Физические свойства углекислого газа. Сухой лёд
Получение углекислого газа
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа
Применение углекислого газа
Цена на выбросы CO2
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об. ) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Физические свойства углекислого газа:
| Наименование параметра: | Значение: |
| Химическая формула | CO2 |
| Синонимы и названия иностранном языке | углерода двуокись (рус.) углерода диоксид (рус.) угольный ангидрид (рус.) оксид углерода (IV) carbon dioxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветный газ |
| Цвет | бесцветный |
| Вкус | кисловатый вкус |
| Запах | почти без запаха (в больших концентрациях с кисловатым «содовым» запахом) |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. ) ) | газ |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), кг/м3 | 1561 |
| Плотность (состояние вещества – твердое вещество, при -79 °C и атмосферном давлении 1 атм.), г/см3 | 1,561 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), кг/м3 | 1190 |
| Плотность (состояние вещества – жидкость, при -60 °C и атмосферном давлении 1 атм.), г/см3 | 1,19 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), кг/м3 | 1101 |
| Плотность (состояние вещества – жидкость, при -37 °C и атмосферном давлении 1 атм.), г/см3 | 1,101 |
| Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм.), кг/м3 | 925 |
Плотность (состояние вещества – жидкость, при 0 °C и атмосферном давлении 35,5 атм. ), г/см3 ), г/см3 | 0,925 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,9768 |
| Плотность (состояние вещества – газ, при 0 °C и атмосферном давлении 1 атм.), г/см3 | 0,0019768 |
| Температура сублимации (возгонки), °C | -78,5 |
| Критическая температура*, °C | 31 |
| Критическое давление, МПа | 7,387 |
| Критический удельный объём, м3/кг | 0,468 |
| Критическая точка | 31 °C, 7,38 МПа |
| Тройная точка | −56,6 °C, 0,52 МПа |
| Молярная масса, г/моль | 44,01 |
| Растворимость в воде, г/100 г | 0,3803 при 16 °C, 0,3369 при 20 °C, 0,2515 при 30 °C |
| Теплопроводность, Вт/(м·K) | 0,0166 |
| Удельная теплоемкость, Дж/(кг·К) | 849 |
| Удельная теплота испарения, кДж/кг | 379,5 |
| Удельная теплота плавления, кДж/кг | 205 |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ), кДж/моль | -393,51 |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ), кДж/моль | -394,38 |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 213,68 |
| Стандартная мольная теплоемкость Cp (298 К, для состояния вещества – газ), Дж/(моль·K) | 37,11 |
| Энтальпия плавления ΔHпл, кДж/моль | 8,37 |
| Энтальпия возгонки ΔHвозг, кДж/моль | 25,23 |
| Скорость звука в веществе (при 20°C, состояние среды – газ), м/с | 274,6 |
Давление паров, мм. рт.ст. рт.ст. | 0,000001 (при -186,4°C), 0,00001 (при -180,7°C), 0,0001 (при -174,3°C), 0,001 (при -166,8°C), 0,01 (при -158°C), 2,31 (при -130°C), 9,81 (при -120°C), 34,63 (при -110°C), 104,81 (при -100°C), 279,5 (при -90°C), 672,2 (при -80°C), 1486,1 (при -70°C), 3073,1 (при -60°C), 5127,8 (при -50°C), 7545 (при -40°C), 10718 (при -30°C), 14781 (при -20°C), 19872 (при -10°C), 26142 (при 0°C), 33763 (при 10°C), 42959 (при 20°C), 54086 (при 30°C) |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Получение углекислого газа:
В промышленности углекислый газ образуется в дымовых газах при сжигании различных органических и неорганических веществ или как побочный продукт химических процессов, например, при разложении природных карбонатов (доломита, известняка). Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
Также углекислый газ как побочный продукт получают на установках разделения воздуха с целью получения чистого кислорода, азота и аргона.
В лабораторных условиях углекислый газ получают, например, в результате следующих химических реакций:
1. взаимодействия карбоната кальция и азотной кислоты:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O,
2. в результате взаимодействия карбоната кальция с другими минеральными кислотами,
3. взаимодействия пищевой соды с лимонной кислотой или с кислым лимонным соком,
4. реакции горения углерода:
С + O2 → CO2.
Химические свойства углекислого газа. Химические реакции (уравнения) углекислого газа:
Диоксид углерода относится к кислотным оксидам, поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия оксида углерода (IV) и водорода:
CO2 + 4H2 → CH4 + 2H2O (t ~ 200 °C, kat = Cu2O).
В результате реакции образуются метан и вода.
2. реакция взаимодействия оксида углерода (IV) и углерода:
CO2 + C ⇄ 2CO (t = 700-1000 °C).
В результате реакции образуется оксид углерода (II). Реакция протекает при взаимодействии углекислого газа с раскаленными углями.
3. реакция взаимодействия оксида углерода (IV) и магния:
CO2 + 2Mg → 2MgO + C (t ~ 500 °C).
В результате реакции образуются оксид магния и углерод.
4. реакция взаимодействия оксида углерода (IV) и гафния:
Hf + CO2 → HfC + HfO2 (t = 800-1000 °C).
В результате реакции образуются карбид гафния и оксид гафния.
5. реакция взаимодействия оксида углерода (IV) и германия:
Ge + CO2 → GeO + CO (t = 700-900 °C).
В результате реакции образуются оксид германия и оксид углерода (II).
6. реакция взаимодействия оксида углерода (IV) и цинка:
Zn + CO2 → ZnO + CO (t = 800-950 °C).
В результате реакции образуются оксид цинка и оксид углерода (II).
7. реакция взаимодействия оксида углерода (IV) и индия:
2In + CO2 → In2O + CO (t ~ 850 °C).
В результате реакции образуются оксид индия и оксид углерода (II).
8. реакция взаимодействия оксида углерода (IV) и циркония:
2Zr + CO2 → ZrC + ZrO2 (t = 800-100 °C).
В результате реакции образуются карбид циркония и оксид циркония.
9. реакция взаимодействия оксида углерода (IV) и вольфрама:
W + 2CO2 → WO2 + 2CO (t ~ 1200 °C).
В результате реакции образуются оксид вольфрама и оксид углерода (II).
10. реакция взаимодействия оксида углерода (IV) и оксида лития:
Li2O + CO2 → Li2CO3.
В результате реакции образуется карбонат лития.
11. реакция взаимодействия оксида углерода (IV) и оксида натрия:
Na2O + CO2 → Na2CO3 (t = 450-550 °C).
В результате реакции образуется карбонат натрия.
12. реакция взаимодействия оксида углерода (IV) и оксида калия:
K2O + CO2 → K2CO3 (t ~ 400 °C).
В результате реакции образуется карбонат калия.
13. реакция взаимодействия оксида углерода (IV) и оксида бария:
BaO + CO2 → BaCO3.
В результате реакции образуется карбонат бария.
14. реакция взаимодействия оксида углерода (IV) и оксида кальция:
CaO + CO2 → CaCO3.
В результате реакции образуется карбонат кальция.
15. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
CaCO3 + CO2 + H2O → Ca(HCO3)2.
В результате реакции образуется гидрокарбонат кальция.
16. реакция взаимодействия оксида углерода (IV) и оксида магния:
MgO + CO2 → MgCO3.
В результате реакции образуется карбонат магния.
17. реакция взаимодействия оксида углерода (IV) и оксида кремния (II):
SiO + CO2 → SiO2 + CO (t ~ 500 °C).
В результате реакции образуются оксид кремния (IV) и оксид углерода (II).
18. реакция взаимодействия оксида углерода (IV) и воды:
CO2 + H2O ⇄ H2CO3.
В результате реакции образуется угольная кислота.
19. реакция взаимодействия оксида углерода (IV) и гидроксида лития:
2LiOH + CO2 → Li2CO3 + H2O.
В результате реакции образуются карбонат лития и вода. В ходе реакции используется концентрированный раствор гидроксида лития.
20. реакция взаимодействия оксида углерода (IV) и гидроксида калия:
KOH + CO2 → KHCO3,
2KOH + CO2 → K2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция протекает в первом случае в этаноле и используется разбавленный раствор гидроксида калия, во втором используется концентрированный раствор гидроксида калия.
21. реакция взаимодействия оксида углерода (IV) и гидроксида натрия:
NaOH + CO2 → NaHCO3,
2NaOH + CO2 → Na2CO3 + H2O.
В первом случае в результате реакции образуются гидрокарбонат натрия, во втором – карбонат натрия и вода. В ходе первой реакции используется разбавленный раствор гидроксида натрия, в ходе второй – концентрированный раствор гидроксида натрия.
22. реакция взаимодействия оксида углерода (IV) и гидроксида кальция:
Ca(OH)2 + CO2 → CaCO3 + H2O.
В результате реакции образуются карбонат кальция и вода.
23. реакция взаимодействия оксида углерода (IV) и гидроксида бария:
Ba(OH)2 + CO2 → BaCO3 + H2O.
В результате реакции образуются карбонат бария и вода.
24. реакция взаимодействия оксида углерода (IV) и метана:
CH4 + CO2 → 2CO + 2H2 (t = 800-900 °C, kat = NiO, нанесенный на Al2O3).
В результате реакции образуются оксид углерода (II) и вода.
25. реакция термического разложения оксида углерода (IV):
2CO2 → 2CO + O2 (t > 2000 °C).
В результате реакции образуются оксид углерода (II) и кислород.
26. реакция фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2 (hv, kat = хлорофилл).
В результате реакции образуются глюкоза и кислород.
Применение углекислого газа:
Углекислый газ используется во многих отраслях промышленности и быту:
– как пищевая добавка Е290 в качестве разрыхлителя в пищевом производстве и консерванта в алкогольных и безалкогольных газированных напитках, а также для газирования лимонада, газированной воды и других напитков;
– в системах пожаротушения и в огнетушителях;
– для создания защитной среды при сварке металлов;
– для охлаждения, замораживания и хранения пищевых продуктов при прямом и косвенном контакте с сухим льдом;
– для сушки литейных форм;
– в качестве активной среды углекислотного лазера.
Примечание: © Фото https://www.pexels.com, https://pixabay.com.
Коэффициент востребованности 4 398
Физические и химические свойства углекислого газа: формула,плотность
Применение углекислого газа в сварочной области является очень распространенной. Это один из основных вариантов, которые применяются для различных видов соединения металла. Физические свойства углекислого газа определяют его как универсальную субстанцию для газовой сварки, соединения газовой и электродуговой и так далее. Это относительно недорогое сырье, которое используется здесь на протяжении многих лет. Есть более эффективные варианты, но именно углекислота применяется чаще всего. Она находит применение как для обучения, так и для выполнения самых простых процедур.
Углекислота еще носит название диоксид углерода. Вещество не обладает запахом и бесцветно в обыкновенном состоянии. При нормальном атмосферном давлении, углекислота не состоит в жидком состоянии и из твердого сразу переходит в газообразное.
Область применения углекислого газа
Химическое вещество используется не только для сварки. Физические свойства углекислого газа позволяют применять его как разрыхлитель или консервант в пищевой промышленности. Во многих системах пожаротушения, в частности в ручных огнетушителях. Его применяют для обеспечения питания аквариумных растений. Практически все газированные напитки содержат углекислый газ.
В сварочной сфере применение чистой углекислоты является не совсем безопасным для металла. Дело в том, что при воздействии высокой температуры он распадается и из него выделяется кислород. В свою очередь, кислород является опасным для сварочной ванны и чтобы ликвидировать его негативное воздействие, применяют разнообразные раскислители, такие как кремний и марганец.
Применение углекислоты встречается еще и в баллонах для пневматических пистолетов и винтовок. Как и в сварочных баллонах, углекислота здесь хранится в сжиженном состоянии под давлением.
Баллон с углекислотой для сварки
Химическая формула
Химические свойства углекислого газа, а также его другие характеристики, напрямую зависят от элементов, которые входят в состав формулы. Формула углекислого газа в химии имеет вид CO2. Это означает, что углекислота содержит в себе один атом углерода и два атома кислорода.
Формула углекислого газа в химии имеет вид CO2. Это означает, что углекислота содержит в себе один атом углерода и два атома кислорода.
Химические и физические свойства
Рассмотрев, как обозначается химических газ в химии, стоит более внимательно рассмотреть его свойства. Физические свойства углекислого газа проявляются в различных параметрах. Плотность углекислого газа при стандартных атмосферных условиях составляет 1,98 кг/м3. Это делает его в 1,5 раза тяжелее, чем воздух в атмосфере. Диоксид углерода не имеет запаха и цвета. Если его подвергнуть сильному охлаждению, то он начинает кристаллизоваться в так называемый «сухой лед». Температура сублимации достигает -78 градусов Цельсия.
Химические свойства углекислого газа определяют его к кислотным оксидам, так как он может образовывать угольную кислоту, когда его растворяют в воде. При взаимодействии с щелочами, вещество начинает образовывать гидрокарбонаты и карбонаты. С некоторыми веществами, такими как фенол, диоксид углерода вступает в реакцию электрофильного замещения. С магнийорганическими вещество вступает в реакцию нуклеофильного присоединения. Использование углекислоты в огнетушителях обусловлено тем, что она не поддерживает процесс горения. Использование в сварке обусловлено тем, что в веществе горят некоторые активные металлы.
С магнийорганическими вещество вступает в реакцию нуклеофильного присоединения. Использование углекислоты в огнетушителях обусловлено тем, что она не поддерживает процесс горения. Использование в сварке обусловлено тем, что в веществе горят некоторые активные металлы.
Преимущества
- Использование углекислого газа является относительно недорогим, так как цена на данное вещество достаточно низкая, если сравнивать с другими газами;
- Это очень распространенное вещество, найти которое можно во многих местах;
- Углекислый газ удобен в хранении и не требует сверхсложных мер безопасности;
- Газ хорошо справляется с теми обязанностями, для которых он предназначается.
Недостатки
- Во время использования на металле могут образовываться оксиды, которые выделяет вещество во время нагревания;
- Для нормальной работы нужно использовать дополнительные расходные материалы, которые бы помогли ликвидировать негативное воздействие оксидов;
- Существуют более эффективные газы, применяемые в сварочной сфере.

Применение углекислого газа при сварке
Данное вещество применяется в области сваривания металлических изделий в качестве защитного газа. Он применяется как для автоматических, так и для полуавтоматических сварочных аппаратов. Зачастую его используют не в чистом виде а вместе с аргоном или кислородом в газовой смеси. В производственной сфере существует несколько вариантов снабжения постов. Среди них выделяют следующие методы:
- Поставка из баллона. Это очень удобно, когда речь идет об относительно небольших объемах вещества. Это обеспечивает мобильность, так как не всегда имеется возможность создать трубопровод к посту.
- Транспортная емкость для углекислоты. Это также отличный вариант для потребления вещества в небольших баллонах. Она обеспечивает поставку большего количества газа, чем в баллонах, но менее удобна в транспортировке.
- Стационарный сосуд накопитель. Он применяется для тех, кто использует углекислоту в больших объемах. Их используют при отсутствии на предприятии автономной станции.

- Автономная станция. Это наиболее широкий по объему метод поставки, так как может обслуживать пост практически для любых процедур, вне зависимости от объемов. Таким образом, пост получает вещество непосредственно с места его производства.
Автономная станция представляет собой специальный цех на предприятии, где получают диоксид углерода. Он может работать как исключительно для собственных нужд, так и на поставку другим цехам и организациям. Для обеспечения рабочих точек предприятия, газ поставляет по трубопроводам. В то время, когда на предприятии имеется необходимость в запасании углекислоты, ее перемещают в специальные накопители.
Меры безопасности
Хранение и использование вещества является относительно безопасным. Но для того, чтобы исключить вероятности несчастных случаев, следует придерживаться основных правил:
- Несмотря на то, что углекислота не отличается взрывоопасностью и токсичностью, если ее концентрация будет выше 5%, то человек будет чувствовать удушье и кислородную недостаточность.
 Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении.
Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении. - Если понизить давление, то жидкая углекислота превращается в газообразное состояние. В это время ее температура может составлять -78 градусов Цельсия. Это вредно для слизистых оболочек организма. Также это приводит к обморожению кожи
- Осмотр больших емкостей для хранения углекислоты следует проводить с использованием шлангового противогаза. Цистерна должна быть отогрета до температуры окружающей среды и быть хорошо проветренной.
Заключение
Физические свойства являются не единственным показателем, по которому подбирается газ для сварки. Совокупность всех параметров обеспечивает данному веществу уверенные позиции на современном рынке расходных материалов. Среди самых простых процедур это незаменимый газ, с которым сталкивался практически каждый профессиональный и начинающий сварщик.
Углекислый газ – определение, свойства, использование и воздействие
Углекислый газ – это встречающееся в природе химическое соединение, которое играет неотъемлемую роль в экосистеме Земли. Он необходим для фотосинтеза, необходимого для выживания всех растений. Углекислый газ также помогает регулировать температуру атмосферы и планеты. Их часто называют парниковыми газами, потому что они пропускают солнечный свет, но не позволяют ему выходить, тем самым нагревая нижние слои атмосферы. Углекислого газа много в атмосфере Земли (около 393 ppm, или частей на миллион) и играет жизненно важную роль в регулировании глобального климата. Это помогает удерживать тепло у поверхности Земли, а это означает, что меньшее его количество уходит в космос. Это облегчает процветание жизни на Земле. Он также помогает управлять углеродным циклом, который необходим для существования жизни на Земле.
Он необходим для фотосинтеза, необходимого для выживания всех растений. Углекислый газ также помогает регулировать температуру атмосферы и планеты. Их часто называют парниковыми газами, потому что они пропускают солнечный свет, но не позволяют ему выходить, тем самым нагревая нижние слои атмосферы. Углекислого газа много в атмосфере Земли (около 393 ppm, или частей на миллион) и играет жизненно важную роль в регулировании глобального климата. Это помогает удерживать тепло у поверхности Земли, а это означает, что меньшее его количество уходит в космос. Это облегчает процветание жизни на Земле. Он также помогает управлять углеродным циклом, который необходим для существования жизни на Земле.
Увеличение концентрации двуокиси углерода
Люди сыграли значительную роль в повышении концентрации этого газа путем сжигания ископаемого топлива и вырубки лесов, среди прочего. Сжигание ископаемого топлива возвращает углекислый газ в атмосферу Земли после того, как он хранился глубоко под землей в течение миллионов лет, а вырубка лесов сокращает количество растений, которые его поглощают. Несмотря на это, природных источников углекислого газа гораздо больше, чем искусственных.
Несмотря на это, природных источников углекислого газа гораздо больше, чем искусственных.
Углекислый газ, как полагают, оказывает негативное воздействие на здоровье в больших концентрациях, но возможные последствия жизни при более низких концентрациях еще недостаточно изучены. Однако большинство ученых согласны с тем, что людям было бы опасно дышать воздухом, содержащим более высокие концентрации углекислого газа, чем в прошлом.
Двуокись углерода Определение
Двуокись углерода представляет собой химическое соединение, состоящее из одного атома углерода и двух атомов кислорода, связанных вместе. Это один из важных компонентов фотосинтеза — процесса, посредством которого зеленые растения производят пищу и энергию. Это бесцветный газ без запаха, растворимый в воде, этаноле и ацетоне. Он имеет температуру плавления -55,6°C и температуру кипения -78,5°C. Имеет плотность 1,977 г/мл.
Углекислый газ как парниковый газ
Углекислый газ является важным парниковым газом, который помогает удерживать тепло в нашей атмосфере, но он является второстепенным компонентом атмосферы Земли. Атмосферный CO 2 может быть извлечен из природных источников, таких как выделение вулканических газов, сжигание органических веществ и процессы дыхания живых аэробных организмов, а искусственные источники углекислого газа могут быть получены путем сжигания ископаемого топлива для производства электроэнергии и использование транспорта. Реагирует с водой с образованием угольной кислоты. Он реагирует со щелочами с образованием карбонатов и бикарбонатов в качестве продукта. Он также производится путем ферментации и клеточного дыхания. В этой теме мы обсуждали СО 2 определение. Теперь мы будем изучать свойства и использование углекислого газа.
Атмосферный CO 2 может быть извлечен из природных источников, таких как выделение вулканических газов, сжигание органических веществ и процессы дыхания живых аэробных организмов, а искусственные источники углекислого газа могут быть получены путем сжигания ископаемого топлива для производства электроэнергии и использование транспорта. Реагирует с водой с образованием угольной кислоты. Он реагирует со щелочами с образованием карбонатов и бикарбонатов в качестве продукта. Он также производится путем ферментации и клеточного дыхания. В этой теме мы обсуждали СО 2 определение. Теперь мы будем изучать свойства и использование углекислого газа.
Свойства двуокиси углерода
Это бесцветный газ без запаха.
Это негорючий газ.
Слаботоксичен.

Плотнее воздуха.
Точка плавления -55,6°C и температура кипения -78,5°C.
Имеет плотность 1,977 г/мл.
Растворим в воде, растворимость снижается при повышении температуры.
При растворении в воде образует слабую угольную кислоту. Он превращает известковую воду в молочный цвет.
Equation which shows CO 2 behaves as an acid:
CO 2 + H 2 O → H 2 CO 3 → H+(aq) + HCO 3 – (водн.)
(Реакция носит обратимый характер).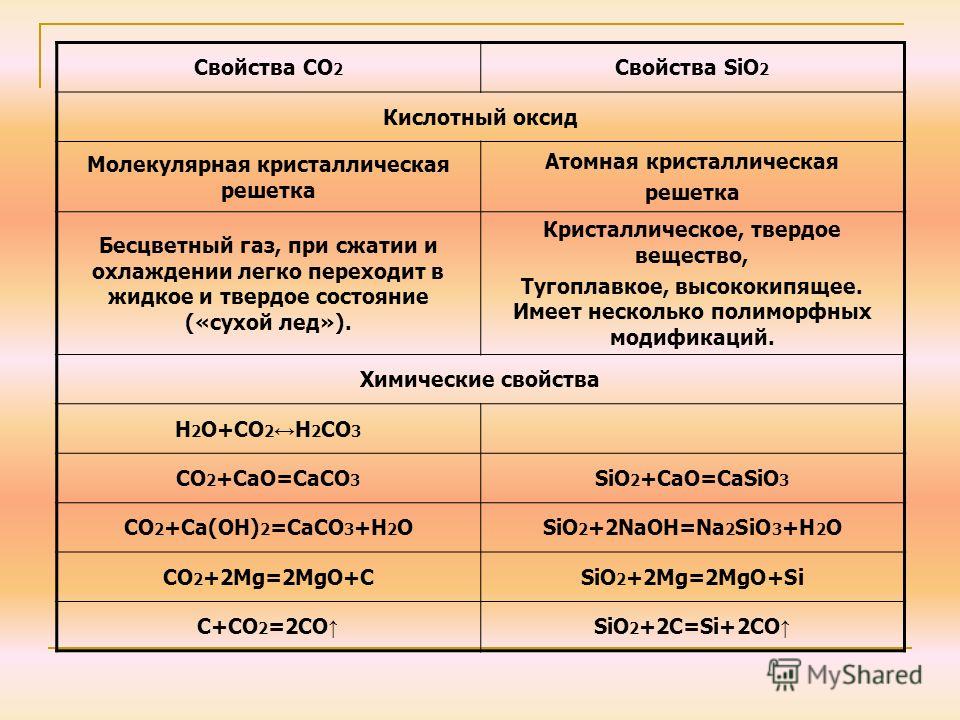
CO 2 +NAOH → NAHCO 3
NAHCO 3 +NAOH ⇒ NA 2 CO 3 +H 2 O
Теперь, дайте нам знать около CO 77777777 O
, дайте нам знать около CO 2 O
. 2 газ.
Использование двуокиси углерода
Растения превращают двуокись углерода в кислород в ходе процесса, называемого фотосинтезом, используя как углерод, так и кислород для производства углеводов.
Двуокись углерода также используется в качестве хладагента.
Используется как огнетушитель.
Используется для стимулирования роста растений в теплицах.
Используется в газированных, безалкогольных напитках и пиве, чтобы сделать их шипучими.

Большие количества твердой двуокиси углерода (в виде сухого льда) используются в крупномасштабном охлаждении.
Является одним из компонентов медицинских газов, так как способствует выдоху.
Углекислый газ, выделяемый разрыхлителем или дрожжами, который заставляет тесто для торта подниматься, является лучшим примером использования углекислого газа в повседневной жизни.
Вредное воздействие двуокиси углерода
Из-за деятельности человека количество CO 2 , выбрасываемого в атмосферу, значительно возросло за последние несколько лет. Концентрация углекислого газа в атмосфере увеличилась примерно с 280 частей на миллион в 1850 году до 364 частей на миллион в 1998 году. Основная причина связана с деятельностью человека во время и после промышленной революции. Люди увеличивают количество углекислого газа в воздухе, сжигая ископаемое топливо, производя цемент, вырубая леса, расчищая землю и сжигая леса. Около 24% текущего атмосферного CO 2 концентрации существуют из-за этой деятельности человека, принимая во внимание, что нет никаких изменений в естественном количестве двуокиси углерода.
Люди увеличивают количество углекислого газа в воздухе, сжигая ископаемое топливо, производя цемент, вырубая леса, расчищая землю и сжигая леса. Около 24% текущего атмосферного CO 2 концентрации существуют из-за этой деятельности человека, принимая во внимание, что нет никаких изменений в естественном количестве двуокиси углерода.
Выбросы, образующиеся при сжигании ископаемого топлива, сочетаются с влажностью воздуха. В результате образуются осадки с высоким содержанием кислоты. Это увеличение CO 2 вредно для людей, водных животных и растений. Неполное сгорание или сжигание углеродосодержащих видов топлива, таких как уголь, нефть, древесный уголь, древесина, керосин, приводит к образованию угарного газа.
Окись углерода
Окись углерода — очень ядовитый газ. Это бесцветный газ без запаха, и его присутствие сразу же обнаруживается. При вдыхании угарный газ легко соединяется с гемоглобином нашей крови. Гемоглобин помогает переносить кислород от легких к тканям. Кислород соединяется с гемоглобином, образуя оксигемоглобин. Точно так же CO соединяется с гемоглобином с образованием карбоксигемоглобина.
Кислород соединяется с гемоглобином, образуя оксигемоглобин. Точно так же CO соединяется с гемоглобином с образованием карбоксигемоглобина.
Сродство СО к гемоглобину значительно больше (примерно в 200 раз), чем к кислороду. В присутствии угарного газа снижается кислородная емкость гемоглобина. Дефицит кислорода в крови может вызвать головные боли, головокружение, проблемы с сердцем и дыханием и даже смерть. По этой причине опасно спать в закрытом помещении с горящим внутри коксовым костром, потому что горящий кокс при недостаточном снабжении кислородом выделяет много угарного газа, который может вызвать смерть.
Превентивные меры
Переход на возобновляемые источники энергии, такие как солнечная энергия, энергия ветра и т. д., сократит использование ископаемого топлива. Это уменьшит выброс углекислого газа в атмосферу.
Крупномасштабная посадка большего количества деревьев может помочь уменьшить выброс углекислого газа в атмосферу.

Правительство должно разработать строгую политику для поддержания общего качества воздуха в городе.
Заключение
Углекислый газ является одной из основных причин изменения климата. Существует несколько вредных воздействий углекислого газа на людей, животных и растения. Сокращение деятельности человека, которая выбрасывает углекислый газ в атмосферу, уменьшит последствия глобального потепления. Глобальное потепление является серьезной проблемой на ближайшие годы. Выбросы углекислого газа в результате деятельности человека, вырубки лесов, изменений в землепользовании и использования ископаемого топлива меняют облик нашей планеты. Углекислый газ является одним из парниковых газов, способствующих глобальному потеплению. На его долю приходится около 80% всех выбросов парниковых газов (ПГ) в США, что делает его очень важной целью при рассмотрении потенциальных стратегий смягчения последствий выбросов парниковых газов. Количество углекислого газа в атмосфере Земли увеличивалось со времен промышленной революции, и в настоящее время оно достигло самого высокого уровня по крайней мере за 800 000 лет.
Количество углекислого газа в атмосфере Земли увеличивалось со времен промышленной революции, и в настоящее время оно достигло самого высокого уровня по крайней мере за 800 000 лет.
Фундаментальные физические свойства и строение диоксида углерода и его производных
Герцберг Г. Электронные спектры и электронное строение многоатомных молекул. М.: Мир, 1969.
Google ученый
I.L.Karle and J.Karle, J.Chem. Phys., 17 , 1057 (1949).
Google ученый
G. Glocker, J. Phys. Chem., 62, 1049 (1958).
Google ученый
Т. Л. Коттрелл, Прочность химических связей, Butterworths Sci. Публикации, Лондон (1958).
Google ученый
“>Р. С. Малликен, ред. мод. физ., 14 , 204 (1942).
Google ученый
В. Моффит, Proc. R. Soc., A196 , 524 (1949).
Google ученый
J. F. Mulligan, J. Chem. Phys., 19, 347 (1951).
Google ученый
Х. В. Лонг и А. Д. Уолш, Пер. Faraday Soc., 43 , 342 (1947).
Google ученый
J.A. Pople and G.A. Segal, J. Chem. Phys., 44, 342 (1966).
Google ученый
C.T. Zahn, Phys. Rev., 27 , 455 (1926).

Google ученый
H.H.Uhlig, J.S.Kirkwood, and F.G.Keyes, J. Chem. Phys., -1, 155 (1933).
Google ученый
J.W.Rabalais, J.M.McDonald, V.Scherr, and S.P.McGlynn, Chem. Rev., 71 , 73 (1971).
Google ученый
K. Siegbahn et al., Nova Acta Regiae, Soc. науч. упс., сер. IV, 20 , 1 (1967).
Google ученый
J.M.McDonald, J.W.Rabalais, and S.P.McGlynn, J. Chem. физ., 52 , 1332 (1970).
Google ученый
C. R. Brundle and D. W. Turner, Int. Дж. Масс-спектр. Ion Phys., 2, 195 (1969).
Google ученый
“>M.I. Al-Jobory, D.P. May и D.W. Turner, J. Chem. соц., 6350 (1965).
Y. Tanaka, A.S. Jursa и F.J. Leblanc, J. Chem. физ. 28 , 350 (1958).
Google ученый
J. M. Sichel and M. A. Whitehead, Theor. Чим. Acta, 11 , 239 (1968).
Google ученый
А. Д. Маклин и М. Йошимине, Таблицы линейных молекулярных волновых функций, Int. Корпорация Business Machines, Сан-Хосе, Калифорния (1967).
Google ученый
A.D. McLean, J. Chem. Phys., 32, 1595 (1960).
Google ученый
“>Ф. М. Филд и Дж. Л. Франклин, Явления электронного удара и свойства газообразных ионов, Academic Press, Нью-Йорк (1957).
Google ученый
K. Watanabe, J. Chem. Phys., 26, 542 (1957).
Google ученый
P.M. Johnson and A.C. Albrecht, J. Chem. Phys., 44, 1845 (1966).
Google ученый
Н. С. Бучельникова, Усп. Физ. наук, 65 , 351 (1958).
Google ученый
J. F. Paulson, J. Chem. Phys., 52, 963 (1970).
Google ученый
“>Берников В.М., Ж.А. Физ. хим., 49 , 2988 (1975).
Google ученый
Р. С. Малликен, Can. J. Chem., 36 , 10 (1958).
Google ученый
J. F. Mulligan, J. Chem. Phys., 19, 1428 (1951).
Google ученый
См. арт. 1, стр. 511–515.
Google ученый
Т. Лайман, Astrophys. Ю., 27 , 87 (1908).
Google ученый
S. W. Leifson, Astrophys., 63 , 73 (1926).
Google ученый
“>Х. С. Хеннинг, Энн. Phys., 13, 599 (1932).
Google ученый
G. Tarhenau, Z. Phys., 87 , 32 (1934).
Google ученый
В. К. Прайс и Д. М. Симпсон, Proc. R. Soc., A169 , 501 (1938).
Google ученый
А. Г. Гейдон, Proc. R. Soc., A176 , 505 (1940).
Google ученый
W. M. Preston, Phys. Обр., 57 , 887, (1940).
Google ученый
P.G. Wilkinson and H.L. Johnson, J. Chem. Phys., 18 , 190 (1950).

Google ученый
E.C.Y. Inn, K. Watanabe, and M. Zelikoff, J. Chem. Phys., 21, 1648 (1953).
Google ученый
Y. Tanaka, A.S. Yursa и F.J. Leblanc, J. Chem. физ., 32 , 1199 (1960).
Google ученый
H. Sun and G.L. Weissler J. Chem. Phys., 23, 1625 (1955).
Google ученый
Р. Н. Диксон, Proc. R. Soc., A275 , 431 (1963).
Google ученый
Ю. Танака и М. Огава, Can. J. Phys., 40 , 879(1962).
Google ученый
Б. А. Томпсон, П. Хартек и Р. Р. Ривз, мл., J. Geophys. Res., 68 , 6431 (1963).

Google ученый
Р. Н. Диксон, Обсудить. Faraday Soc., 35 , 105 (1963).
Google ученый
A.D. Walsh, J. Chem. Соц., 2266 (1953).
L. Sanson and M.C. Bonnelle, Compt. Rend., 250 , 1824 (1960).
Google ученый
С. Мрозовски, Phys. Rev., 60 , 730 (1941).
Google ученый
С. Мрозовски, преп. мод. Phys., 14 , 216 (1942).
Google ученый
С. Мрозовски, Phys. Обр., 62 , 270 (1942).
Google ученый
S. Mrozowski, Phys. Rev., 72 , 682, 691 (1947).

Google ученый
Р. С. Малликен, Phys. Rev., 40 , 60 (1932).
Google ученый
Р. С. Малликен, Proc. R. Soc., A244 , 220 (1958).
Google ученый
T. E. Sharp and H. M. Rosenstock, J. Chem. Phys., 41, 3453 (1964).
Google ученый
В. А. Коряжкин, Докл. акад. АН СССР, 167 , 1035 (1966).
Google ученый
A.S. Newton and A.F. Sciamanna, J. Chem. Phys., 40, 718 (1964).
Google ученый
D.W. Ovenall and D.H. Whiffen, Proc. хим. Соц., 240 (1960).
“>C.D. Cooper and P.N. Compton, Chem. физ. Lett., 14 , 29 (1972).
Google ученый
J. R. Morton, Chem. Рев., 64 , 453 (1964).
Google ученый
K.O. Hartman and I.C. Hisatsune, J. Chem. Phys., 44 , 1913 (1966).
Google ученый
Д. А. Рамзи, Advan. Спектроскопия, 1 , 1 (1959).
Google ученый
A. Sommer, D. White, M.J. Lineevsky, and D.E. Mann, J. Chem. физ., 38 , 87 (1963).
Google ученый
“>M. Krauss and D. Neumann, Chem. физ. Lett., 14 , 2628 (1972).
Google ученый
J.A. Pople and G.A. Segal, J. Chem. физ., 44 , 3289(1966).
Google ученый
J.A. Pople, D.L. Beveridge, and P.A. Dobosh, J. Chem. Phys., 47 , 2026 (1967).
Google ученый
J. N. Bardsley, J. Chem. Phys., 51, 3384 (1969).
Google ученый
C.R. Claydon, G.A. Segal и H.S. Taylor, J. Chem. физ., 52 , 3387 (1970).
Google ученый
“>Вольпин М.Е., Коломников И.С., Pure Appl. Chem., 33, 567 (1973).
Google ученый
M. Baird, G. Hartwell, R. Mason, A.I. Rae и G. Wilkinson, Chem. коммун., 92 (1967).
R. Mason and A.I. Rae, J. Chem. Соц., А, 1767 (1970).
M.C. Baird and G. Wilkinson, Chem. Комм., 514 (1966).
Т. Кашиваги, Н. Ясука и Т. Уэки, Bull. хим. соц. Jpn., 41 , 296 (1968).
Google ученый
Р. Бен-Шошау и Р. Пети, J. Am. хим. Soc., 89 , 2231 (1967).
Google ученый
T.
 G. Hewitt and J.J. De Boer, J. Chem. Соц., А, 817 (1971).
G. Hewitt and J.J. De Boer, J. Chem. Соц., А, 817 (1971).P. Racanelli and G. Allegra, J. Chem. Соц., Д., 361 (1969).
С. Оцука, А. Накамура и К. Тани, J. Organomet. Chem., 14 , 30 (1968).
Google ученый
C.M. Wolf and R. Pertel, J. Phys. Chem., 69, 4047 (1965).
Google ученый
K.V. Krishnamurty, J. Chem. Educ., 44 , 594 (1967).
Google ученый
R.R. Hitch, S.K. Gondal, and C.T. Sears, Chem. Комм., 777 (1971).
B. Clarke, M. Green, R. B. Osborn и F. G. A. Stone, J. Chem. Соц., А, 167 (1968).
Н. Дж. Нельсон, Н. Е. Киме и Д. Ф. Шривер, Дж. Ам. хим. Soc., 91 , 5173 (1969).

Google ученый
Д. Ф. Шривер-старший и А. Алич, координатор. хим. Rev., 8 , 15 (1972).
Google ученый
P.W. Jolly, K. Jonas, C. Kruger, and YH Tsay, J. Organomet. Chem., 33 , 109 (1971).
Google ученый
Коломников И.С., Белопотапова Т.С., Вольпин М.Е. // Тр. XV межд. конф. Координ. хим., Vol. 2 (1973), с. 589.
Google ученый
Коломников И.С., Белопотапова Т.С., Лысяк Т.В., Вольпин М.Е. // Журн. Chem., 67, C25 (1974).
Google ученый
Калинников В.Т., Ларин Г.М., Новоторцев В.М., Белопотапова Т.С., Лысик Т.В. // ДАН. акад. АН СССР, 217 , 1345 (1975).

Google ученый
Г.Г. Александров и Ю.А. Т. Стручков, Ж. Структура хим., 14 , 859 (1973).
Google ученый
И.С. Коломников, Т.С. Лобеева, В.В. Горбачевская, Г.Г. Александров, Ю.В. Стручков, М.Е. Вольпин, Chem. коммун., 1972 (1971).
Коломников И.С., Белопотапова Т.С., Вольпин М.Е. // Журн. общ. хим., 42 , 2232 (1974).
Google ученый
А.И. Гусев и Ю.А. Т. Стручков, Ж. Структура хим., 15 , 282 (1974).
Google ученый
И.С. Коломников, А.И. Гусев, Г.Г. Александров, Т.С. Лобеева, Ю.С. Стручков, М.Е. Вольпин, Журн. органомет. Chem., 59, 349 (1973).
Google ученый
“>А.И. Гусев и Ю.А. Т. Стручков, Ж. Структура хим., 15 , 282 (1974).
Google ученый
И.С. Коломников, А.И. Гусев, Т.С. Белопотапова, М.Х. Григорян, Т.В. Лысяк, Ю.В. Стручков, М.Е. Вольпин, Журн. органомет. Chem., 69, C10 (1974).
Google ученый
D.J.C. Yates, J. Phys. Chem., 65, 746 (1961).
Google ученый
S. Matsushita and T. Nakata, J. Chem. Phys., 36, 665 (1962).
Google ученый
Дж. Х. Тейлор и Ч. Х. Амберг, Can. J.Chem., 39, 535 (1961).

Google ученый
С. Мацусита и Т. Наката, J. Chem. Phys., 32, 982 (1960).
Google ученый
M. Courtois and S.J. Teichner, J. Catal., 1 , 121 (1962).
Google ученый
Р. П. Эйшенс и В. А. Плишин, Adv. Катал., 9, 662 (1957).
Google ученый
Крылов О.В., Маркова З.А., Третьяков И.Н., Фокин Е.А. // Кинет. Katal., 6 , 128 (1965).
Google ученый
W. I. Stuart and TL Shateley, Trans. Faraday Soc., 61 , 2763 (1965).
Google ученый
Л. Х. Литтл и К. Р. Амберг, Can.
 J.Chem., 40, 1957 (1962).
J.Chem., 40, 1957 (1962).Google ученый
N.D. Parkins, J. Chem. Соц., А, 410, (1969).
J. B. Perry, J. Phys. Chem., 70, 3168 (1966).
Google ученый
O. Zecchina, C. Morterra, G. Ghiotty и E. Borello, J. Phys. Chem., 73, 1293 (1969).
Google ученый
J.W. Ward and H.B. Habgood, J. Phys. хим., 70 , 1178 (1966).
Google ученый
L. Bertsch and H.B. Habgood, J. Phys. Chem., 67, 1621 (1963).
Google ученый
C. L. Angell, J. Chem. Phys., 41, 2420 (1969).
Google ученый
“>P.A. Barnes, M.F. O’Connor и F.S. Stone, J. Chem. Соц., А, 3395 (1971).
J.C. Kemp, J. Chem. Phys., 33 , 1269 (1960).
Google ученый
J.A. Brivatti, N. Keen, M.C.R. Symons, and P.A. Trevalian, Proc. хим. Соц., 66 (1961).
S.A. Marshall, A.R. Reinberg, R.A. Serway, and J.A. Hodges, Mol. физ., 8 , 225 (1964).
Google ученый
J. H. Lunsford and J. P. Jayne, J. Phys. Chem., 69, 2182 (1965).
Google ученый
A.L.J. Beckwith and R.O.C. Norman, J. Chem. Соц., Б, 400 (1969).

I.C. Hisatsune, T. Adl, E.C. Beahm, and R.J. Kempf, J. Phys. Chem., 74, 3225 (1970).
Google ученый
D.L.Bernitt, K.O.Hartman, and I.C.Hisatsune, J. Chem. Phys., 42, 3553 (1965).
Google ученый
C. Heller and H.M. McConnel, J. Chem. Phys., 32, 1535 (1960).
Google ученый
D. Pooley and P. H. Whiffen, Mol. Phys., 4, 81 (1961).
Google ученый
Ю. Молин Н., Бубнов Н.Н., Воеводский В.В. // Журн. Структура хим., 2 , 293 (1961).
Google ученый
O. Premovic, O. Gal и B. Radack, J. Chem. Phys., 59, 987 (1973).

Google ученый
N. Getoff, G. Scholes, and J. Weiss, Tetrahedron Lett., 18 , 17 (1960).
Google ученый
J.T. Allan, N. Getoff, H.D. Lehmann, K.E. Nixon, G. Scholes и M. Simic, J. Inorg. Нукл. Chem., 19, 204 (1961).
Google ученый
Н. Гетофф, Опстерр. хим. З., 63 , 376 (1962).
Google ученый
Н. Гетофф, Опстерр. хим. З., 65 , 143 (1964).
Google ученый
Н. Getoff, Z. Naturforsch., 17b , 87 (1962).
Google ученый
N. Getoff, Nature (Лондон), 211 , 408 (1966).

Google ученый
P. Neta, M. Simic, and E. Hayon, J. Phys. Chem., 73, 4207, 4214 (1969).
Google ученый
W.M. Garrison, D.C. Morrison, J.G. Hamilton, A.A. Benson, and M. Calvin, Science, 114 , 416 (1951).
Google ученый
M. Z. Hoffman and M. Simic, Inorg. Chem., 12, 2471 (1973).
Google ученый
Дж. Лили, Г. Бек и А. Хенглейн, Бер. Бунзенгес. физ. Chem., 75, 458 (1971).
Google ученый
F. Güttlauer and N. Getoff, Z. Phys. Chem., 51, 255 (1966).
Google ученый
A.
 L.J. Beckwith and R.O.C. Norman, J. Chem. Соц., Б, 400 (1969).
L.J. Beckwith and R.O.C. Norman, J. Chem. Соц., Б, 400 (1969).E. Abel, R. Jokisch, R. Larisch и H. Sassman, Z. Electrochem., 43 , 629 (1937).
Google ученый
П. С. Рао и Э. Хайон, J. Am. хим. Соц., 96 , 1287 (1974).
Google ученый
Э. Ройер, комп. Ренд., 70 , 731 (1870).
Google ученый
Н. Клобуков, J. Prakt. Chem., 34 , 126 (1887).
Google ученый
А. Либен, Монац. Chem., 16 , 211 (1895).
Google ученый
А. Либен, Монац. Chem., 18, 582 (1897).
Google ученый
“>A. Cohen and S. Jahn, Bericht., 37 , 2836 (1904).
Google ученый
Р. Эренфельд, Берихт., 38 , 4138 (1905).
Google ученый
Патент США. 867575 (1907 г.).
F. Fischer and O. Priziza, Bericht., 47 , 256 (1914).
Google ученый
Патент США 1,185,028 (1916).
К. Бат, З. Электрохим., 25 , 102 (1919).
Google ученый
М. Рабинович и А. Машовец, Z. Elektrochem., 36 , 846 (1930).
Google ученый
“>T. E. Teeter and P. van Rysselberghe, J. Chem. Phys., 22, 759 (1954).
Google ученый
Дж. Джордан и П. Смит, Proc. хим. Соц., 246 (1960).
W. Paik, T. N. Andersen, and H. Eyring, Elektrochem. Acta, 14 , 1217 (1969).
Google ученый
J. Ryu, T. N. Andersen, and H. Eyring, J. Phys. Chem., 76, 3278 (1972).
Google ученый
Чечель П.С., Антропов Л.И., Журн. прикл. Хим., 31 , 1856 (1958).
Google ученый
K. Udupa, G.S. Subramanian, and H.
 V.K. Udupa, Электрохим. Acta, 16 , 1593 (1971).
V.K. Udupa, Электрохим. Acta, 16 , 1593 (1971).Google ученый
Дж. Л. Робертс и Д. Т. Сойер, Дж. Электроанал. Chem., 9, 1 (1965).
Google ученый
U. Kaiser and E. Heitz, J. Electroanal. Хим., 77 , 818 (1973).
Google ученый
Л. В. Хейнс и Д. Т. Сойер, Anal. Chem., 39, 332 (1967).
Google ученый
Х. Ден, В. Гутман, Х. Кирх и Г. Шобер, Монатш. Chem., 33 , 1348 (1962)
Google ученый
А. Бьюик и Г. П. Гринер, Tetrahedron Lett., 391 (1970).
A. Bewick and G.P. Greener, Tetrahedron Lett., 4623 (1969).
“>D. A. Tyssee, J. H. Wagenknecht, M. M. Baizer, and J. L. Chruma, Tetrahedron Lett., 4809 (1972).
Дж. Гинер, Электрохим. Acta, 8 , 857 (1963).
Google ученый
R. Ercoli, M. Guainazzi, G. Silvestri, S. Gambino, G. Filardo, B. Giannici и M. Galluzzo, Chem. Инд., 55 , 156 (1973).
Google ученый
J.P.Petrovich and M.M.Baizer, J. Electrochem. Soc., 118 , 447 (1971).
Google ученый
W.V.Childs, J.T.Maloy, C.P.Keszthelyi, and A.J.Bard, J.Electrochem., 118 , 874 (1971).
Google ученый
С.
 Цуцуми и Т. Муракава, Am. хим. соц., отд. Бензин. хим., преп. 15 (4), В5 (1970).
Цуцуми и Т. Муракава, Am. хим. соц., отд. Бензин. хим., преп. 15 (4), В5 (1970).Google ученый
S. Wawzonek, E.W. Blaha, R. Berkey и M.E. Runner, J. Electrochem. Soc., 102 , 235 (1955).
Google ученый
Р. Дитц и М. Э. Пиовер, Disc. Faraday Soc., 45 , 154 (1968).
Google ученый
Патент США. 3 344 045, Сан Ойл Ко.
С. Вавзонек и Д. Уэринг, Дж. Ам. хим. Soc., 81 , 2067 (1959).
Google ученый
Патент США. 3032489, Sun Oil Co. (1971).
S. Wawzonek and A. Gundersen, J. Electrochem. Soc., 107 , 537 (1960).
Google ученый
“>M.M. Baizer and J.L. Chruma, J. Org. Chem., 37, 1951 (1972).
Google ученый
С. Гамбино и Г. Сильвестри, Tetrahedron Lett., 3025 (1973).
F. A. Henglein and H. Sontheimer, Z. Anorg. Allg. Chem., 267, 181 (1952).
Google ученый
Р. М. Миллер, Х. В. Кнорр, Х. Дж. Фихель, К. М. Майер и Х. А. Таннер, J. Org. Хим., 27 , 2646 (1962).
Google ученый
Смирнов В.А., Семченко В.Д. // Тр. Новочеркасск. Политехн. ин-т, 133 , 113 (1962).
Google ученый
Смирнов В.А., Семченко В.
 Д., Семченко Д.Н., Антропов Л.И., Журн. прикл. хим., 40 , 2345 (1967).
Д., Семченко Д.Н., Антропов Л.И., Журн. прикл. хим., 40 , 2345 (1967).Google ученый
Тушналобова В.А., Смирнов В.А., Семченко Д.П., Журн. прикл. хим., 41 , 275 (1968).
Google ученый
Л. Паолони, Газз. Чим. итал., 91 , 529 (1961).
Google ученый
Л. Паолони, Газз. Чим. итал., 93 , 1605 (1963).
Google ученый
К. Гесс, Берихт., 13 , 166 (1880).
Google ученый
E.A. Hausman и T.W. Davis, J. Am. хим. Soc., 76 , 5341 (1954).
Google ученый
Т. Л.
 Аллен, Дж. Ам. хим. Soc., 73 , 3589 (1951).
Аллен, Дж. Ам. хим. Soc., 73 , 3589 (1951).Google ученый
Э. Бен-Цви и Т. Л. Аллен, J. Am. хим. Соц., 83 , 4352 (1961).
Google ученый
А. Дж. Калб и Т. Л. Аллен, Дж. Ам. хим. Soc., 86 , 5107 (1964).
Google ученый
Х. Ф. Лаунер, Дж. Ам. хим. Soc., 54 , 2597 (1932).
Google ученый
Х. Ф. Лаунер, Дж. Ам. хим. Соц., 55 , 865 (1933).
Google ученый
Х. Ф. Лаунер и Д. М. Йост, J. Am. хим. Soc., 56 , 2571 (1934).
Google ученый
С. Дж. Адлер и Р.
 М. Нойес, Дж. Ам. хим. Soc., 77 , 2036 (1955).
М. Нойес, Дж. Ам. хим. Soc., 77 , 2036 (1955).Google ученый
P. C. Mathur and O. P. Bansal, J. Indian Chem. Соц., 42 , 863 (1965).
Google ученый
Х. Таубе, Дж. Ам. хим. Soc., 69 , 1418 (1947).
Google ученый
Х. Таубе, Дж. Ам. хим. Soc., 70 , 1216 (1948).
Google ученый
Х. Таубе, Дж. Ам. хим. Soc., 70 , 3929 (1948).
Google ученый
Ф. Р. Дьюк, Дж. Ам. хим. Soc., 69 , 2885 (1947).
Google ученый
Д. Х. Волман и Дж. Р. Сид, J. Am. хим. Soc., 86 , 5095 (1964).

Google ученый
E. Abel and H. Schmid, Naturwissenschaften., 23 , 501 (1934).
Google ученый
K.V. Krishnamurty and G.M. Harris, Chem. Rev., 61 , 213 (1961).
Google ученый
C. M. Bamford, GCK Eestmond, and J. A. Rippon, Trans. Faraday Soc., 59 , 2548 (1963).
Google ученый
C. H. Bamford and V. J. Robinson, Polymer, 7 ( 11 ), 573 (1966).
Google ученый
K.V. Krishnamurty, G.M. Harris, and V.S. Sastri, Chem. Rev., 70 , 171 (1971).
Google ученый
C. R. P.
 McColl, Coord. хим. Rev., 4 , 147 (1969).
McColl, Coord. хим. Rev., 4 , 147 (1969).Google ученый
K. Nakamoto, Y. Sarma и H. Ogoshi, J. Chem. Phys., 43, 1177 (1965).
Google ученый
D.L.Bernitt, K.O.Hartman, and I.C.Hisatsune, J. Chem. Phys., 42, 3553 (1965).
Google ученый
G.W. Chantry, A. Horsfield, J.R. Morton, and D.H. Whiffen, Mol. Phys., 5, 589 (1962).
Google ученый
Г. В. Чантри и Д. Х. Шиффен, Мол. Phys., 5, 189 (1962).
Google ученый
J. L. Weeks and J. Rabani, J. Phys. Chem., 70, 2100 (1966).
Google ученый
“>Кузьмин В.А., Чибисов А.К. // Теор. Экспер. хим., 7 , 403 (1971).
Google ученый
Э. Дж. Харт и Дж. В. Боаг, J. Am. хим. Soc., 84 , 4090 (1962).
Google ученый
С. Нехари и Дж. В. Боаг, J. Am. хим. Soc., 67 , 1609 (1963).
Google ученый
J.K.Thomas, S.Gordon and E.J.Hart, J. Phys. Chem., 68, 1524 (1964).
Google ученый
Г. Э. Томас, Дж. В. Боаг и Б. Д. Майкл, Пер. Faraday Soc., 61 , 1674 (1965).
Google ученый
“>I.C. Hisatsune, T. Adl, E.C. Beahm, and R.J. Kempf, J. Phys. Chem., 74, 3225 (1970).
Google ученый
Дж. Ф. МакКеллар и Р. Г. Н. Норриш, Proc. R. Soc., A253 , 154 (1959).
Google ученый
Маркевич А.М., Филлипова Л.Ф., Журн. Физ. хим., 31 , 2649 (1957).
Google ученый
D. Katakis and H. Taube, J. Chem. Phys., 36 , 416, (1962).
Google ученый
N.G. Moll, D.R. Clutter, and W.E. Thompson, J. Chem. Phys., 45, 4469 (1966).
Google ученый
“>B. Schaafsma, F. Steinberg, and L. de Boer, Rec. Трав. Чим., 85 , 1170 (1966).
Google ученый
J. Chatt, M. Kubota, G.J. Leigh, F.C. March, R. Mason и D.J. Yarrow, Chem. Комм., 1033 (1974).
К. Накамото, Инфракрасные спектры неорганических и координационных соединений, Мир, Москва (1971).
Google ученый
Б. Р. Флинн и Л. Васка, J. Am. хим. Соц., 95 , 5081 (1973).
Google ученый
B. R. Flynn and L. Vaska, Chem. Комм., 703 (1974).
Г. Гэттоу и У. Герват, Ангью.
 Chem., 77, 132 (1965).
Chem., 77, 132 (1965).Google ученый
Г. А. Олах и А. М. Уайт, J. Am. хим. Soc., 90 , 1884 (1968).
Google ученый
Г. Юст, З. Физ. Chem., 37 , 342 (1901).
Google ученый
T.W.Dakin, W.E.Good, and D.C.Coles, Phys. Rev., 71 , 640 (1947).
Google ученый
В. Г. Альбано, П. Л. Беллон и Г. Чиани, J. Organomet. Chem., 39 , 75 (1971).
Google ученый
А.Е. Калинин, А.И. Гусев, Ю.А. Т. Стручков, Ж. Структура хим., 14 , 859 (1973).
Google ученый
F.W. Einstein, E.
 Enwoll, N. Fliteroft, and J.M. Leach, J. Inorg. Нукл. Chem., 34 , 885 (1972).
Enwoll, N. Fliteroft, and J.M. Leach, J. Inorg. Нукл. Chem., 34 , 885 (1972).Google ученый
J.A. Evans, M.J. Stacker, R.D.W. Kemmitt, D.R. Russel и J. Stocks Chem. коммун., 72 (1972).
Ю. Вакацуки, Х. Ямасаки и Х. Ивасаки, J. Am. хим. Soc., 95 , 5781 (1973).
Google ученый
F. Cariati, R. Mason, C.B. Robertson, and R. Ugo, Chem. коммун., 408 , (1967).
M. H. Chisholm and M. Extine, J. Am. хим. Soc., 96, 6215 (1974).
Google ученый
М.Х. Chisholm and M. Extine, Chem. Комм., 438 (1975).
M. Aresta, C.F. Nobile, V.G. Albano, E. Forni и M. Monassero, Chem. Комм., 636, (1975).
“>
R. S. Mulliken, J. Chem. Phys., 3 , 720 (1935).
Google ученый
D.W. Turner and D.P. May, J. Chem. Phys., 46, 1156 (1967).
Google ученый
J. F. Mulligan, J. Chem. Phys., 19, 347 (1951).
Google ученый
Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону, Наука, Москва (1974).
Google ученый
Х. Д. Смит, Phys. Rev., 38 , 2000 (1931).
Google ученый
D.W. Ovenall and D.H. Whiffen Mol. Phys., 4, 135 (1961).
Google ученый
WH Zachariasen, J. Am. хим. Soc., 62 , 1101 (1940).
Google ученый
Вольпин М.Е., Коломников И.С. // Органомет. React., 5, 287 (1974).
Google ученый
Коломников И.С., Белопотапова Т.С., Вольпин М.Е. // Журн. общ. Хим., 45 , 1993 (1975).
Google ученый
Ю. Козировски и М. Фолман, Пер. Faraday Soc., 62 , 1431 (1966).
Google ученый
А. Бах, комп. Ренд., 126 , 479 (1898).
Google ученый
Рабинович М.А., Машовец А.П., Укр. хим. ж., 6 , 217 (1931).
Google ученый
S. Meshitsuka, M. Ichikawa, and K. Tamaru, Chem. Комм., 158 (1974).
Н. Л. Вайнберг, А. К. Хоффман и Т. Р. Редди, Tetrahedron Lett., 2271 (19).71).
J. Cunningham, J. Phys. Chem., 71, 1967 (1967).
Google ученый
Каретников Г.С., Сорокина М.Ф., Журн. Физ. хим., 39 , 364 (1965).
Google ученый
NJ Turro, WB Hammond, and P.A. Leermakers, J. Am. хим. Soc., 87 , 2772 (1965).
Google ученый
G. Thiele, G. Liehr, and E. Linder, J. Organomet. Chem., 70, 427 (1974).
Google ученый
Загрузить ссылки
Двуокись углерода: Ответы по охране труда
Ответы по охране труда Информационные бюллетени
Легко читаемые информационные бюллетени с вопросами и ответами, охватывающие широкий спектр тем по охране труда и технике безопасности, от опасностей до болезней и эргономика для продвижения на рабочем месте. ПОДРОБНЕЕ >
Загрузите бесплатное приложение OSH Answers
Искать во всех информационных бюллетенях:
Поиск
Введите слово, фразу или задайте вопрос
ПОМОЩЬ
Каковы другие названия или идентифицирующая информация для двуокиси углерода?
Регистрационный номер CAS : 124-38-9
Другие названия: CO 2 , Сжиженный диоксид углерода, Охлажденный диоксид углерода
Основное применение: Производство других химикатов, пищевая промышленность, множество других применений
Внешний вид: Бесцветный газ.
Запах: Без запаха
Канадский TDG: UN1013, UN2187
Что такое классификация WHMIS 1988?
A — сжатый газ
Класс A
Что важно знать об углекислом газе в случае чрезвычайной ситуации?
Аварийный обзор: Бесцветный газ. Без запаха. Не сгорит. СЖАТЫЙ ГАЗ. Содержит охлажденный газ. Может взорваться при нагревании. ОПАСНОСТЬ В ЗАМКНУТОМ ПРОСТРАНСТВЕ. Может накапливаться в опасных количествах в низинах, особенно в замкнутых пространствах. Удушающий. Высокие концентрации могут вытеснять кислород из воздуха и вызывать удушье. Может вызвать обморожение.
Каково потенциальное воздействие на здоровье углекислого газа?
Основные пути воздействия: Вдыхание
- Вдыхание: Низкие концентрации не опасны. Более высокие концентрации могут влиять на функцию дыхания и вызывать возбуждение с последующим угнетением центральной нервной системы.
 Высокая концентрация может вытеснять кислород в воздухе. Если для дыхания доступно меньше кислорода, могут возникнуть такие симптомы, как учащенное дыхание, учащенное сердцебиение, неуклюжесть, эмоциональные расстройства и усталость. Когда кислорода становится меньше, могут возникнуть тошнота и рвота, коллапс, судороги, кома и смерть. Симптомы возникают быстрее при физической нагрузке. Недостаток кислорода может привести к необратимому повреждению органов, включая мозг и сердце.
Высокая концентрация может вытеснять кислород в воздухе. Если для дыхания доступно меньше кислорода, могут возникнуть такие симптомы, как учащенное дыхание, учащенное сердцебиение, неуклюжесть, эмоциональные расстройства и усталость. Когда кислорода становится меньше, могут возникнуть тошнота и рвота, коллапс, судороги, кома и смерть. Симптомы возникают быстрее при физической нагрузке. Недостаток кислорода может привести к необратимому повреждению органов, включая мозг и сердце. - Контакт с кожей: Не раздражает. Прямой контакт со сжиженным газом может вызвать охлаждение или заморозку кожи (обморожение). Симптомы легкого обморожения включают онемение, покалывание и зуд. Симптомы более тяжелого обморожения включают ощущение жжения и скованность. Кожа может стать восково-белой или желтой. В тяжелых случаях могут развиваться волдыри, отмирание тканей и инфекция.
- Контакт с глазами: Может вызвать легкое раздражение. Прямой контакт со сжиженным газом может заморозить глаза.
 Это может привести к необратимому повреждению глаз или слепоте.
Это может привести к необратимому повреждению глаз или слепоте. - Проглатывание: Нерелевантный путь воздействия (газ).
- Последствия длительного (хронического) воздействия: Безвреден.
- Канцерогенность: Неизвестно, что он вызывает рак.
Международное агентство по изучению рака (IARC): Специально не оценивался.
Американская конференция государственных специалистов по промышленной гигиене (ACGIH): специально не назначена.
- Тератогенность/эмбриотоксичность: – Неизвестно, что он причиняет вред нерожденному ребенку.
- Репродуктивная токсичность: Опасность для репродуктивной системы не установлена.
- Мутагенность: Не известно, что это мутаген.
Какие меры первой помощи при углекислом газе?
Вдыхание: Принимать В случае дефицита кислорода: примите меры предосторожности, чтобы обеспечить собственную безопасность перед попыткой спасения (например, наденьте соответствующее защитное снаряжение). Если дыхание затруднено, обученный персонал должен дать экстренную подачу кислорода. Если сердце остановилось, обученный персонал должен начать сердечно-легочную реанимацию (СЛР) или автоматическую наружную дефибрилляцию (АНД). Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Если дыхание затруднено, обученный персонал должен дать экстренную подачу кислорода. Если сердце остановилось, обученный персонал должен начать сердечно-легочную реанимацию (СЛР) или автоматическую наружную дефибрилляцию (АНД). Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Контакт с кожей: Неприменимо (газ). Сжиженный газ: быстро удалить пострадавшего от источника заражения. НЕ пытайтесь согреть пораженный участок на месте. НЕ трите область и не применяйте прямое тепло. Аккуратно снимите одежду или украшения, которые могут ограничивать кровообращение. Аккуратно разрежьте одежду, которая прилипает к коже, и снимите оставшуюся часть одежды. Неплотно накройте пораженный участок стерильной повязкой. НЕ позволяйте пострадавшему пить алкоголь или курить. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Контакт с глазами: Неприменимо (газ). Сжиженный газ: немедленно и ненадолго промойте тепловатой, слабо проточной водой. НЕ пытайтесь согреть. Закройте оба глаза стерильной повязкой. НЕ позволяйте пострадавшему пить алкоголь или курить. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Сжиженный газ: немедленно и ненадолго промойте тепловатой, слабо проточной водой. НЕ пытайтесь согреть. Закройте оба глаза стерильной повязкой. НЕ позволяйте пострадавшему пить алкоголь или курить. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Проглатывание: Неприменимо (газ).
Первая помощь Комментарии: Некоторые из рекомендуемых здесь процедур первой помощи требуют продвинутого обучения оказанию первой помощи. Все процедуры оказания первой помощи должны периодически проверяться врачом, знакомым с химическим веществом и условиями его использования на рабочем месте.
Что представляют собой пожароопасные вещества и средства пожаротушения двуокиси углерода?
Горючесть Свойства: Не горит.
Подходящие средства пожаротушения : Не горючие. Используйте огнетушащее вещество, подходящее для окружающего пожара.
Особые опасности, исходящие от химического вещества: Может вытеснять кислород из воздуха, вызывая удушье. Газ может скапливаться в опасных количествах в низинах, особенно в замкнутых пространствах, создавая опасность для здоровья. Закрытые контейнеры могут сильно разорваться при нагревании, высвобождая содержимое. При пожаре могут образовываться следующие опасные вещества: очень токсичный угарный газ, двуокись углерода.
Каковы опасности стабильности и реакционной способности двуокиси углерода?
- Химическая стабильность: Обычно стабилен.
- Условия, которых следует избегать: Высокие температуры. Температуры выше 52,0 °C (125,6 °F)
- Несовместимые материалы: Повышенный риск возгорания и взрыва при контакте с: металлическим порошком или пылью. Не вызывает коррозию металлов.
- Опасные продукты разложения: Не известны.
- Возможность опасных реакций: Неизвестно.

Каковы меры по предотвращению аварийного выброса двуокиси углерода?
Меры личной безопасности: Увеличьте вентиляцию помещения или переместите протекающий контейнер в хорошо проветриваемое и безопасное место. Пары или газы могут скапливаться в опасных количествах в низинах, особенно в замкнутых пространствах, если вентиляция недостаточна.
Методы локализации и очистки: : Остановите или уменьшите утечку, если это безопасно. Проветривайте помещение, чтобы предотвратить скопление газа, особенно в замкнутом пространстве.
Какие методы обращения и хранения следует использовать при работе с двуокисью углерода?
Обращение: Предотвращайте случайный контакт с несовместимыми химическими веществами. Используйте регулятор давления, соответствующий давлению и содержимому баллона. Закрепите цилиндр в вертикальном положении. Защищайте цилиндры от повреждений. Используйте подходящую ручную тележку для перемещения баллонов; не перетаскивайте, не катите, не скользите и не роняйте. При использовании в замкнутом пространстве перед входом в помещение и во время работы проверяйте наличие кислородного голодания.
При использовании в замкнутом пространстве перед входом в помещение и во время работы проверяйте наличие кислородного голодания.
Хранение: Хранить в прохладном, сухом, хорошо проветриваемом помещении, вдали от прямых солнечных лучей и источников тепла и воспламенения, с контролируемой температурой, в безопасном месте и отдельно от рабочих зон, на первом этаже или предпочтительно , при хранении в больших объемах, в отдельно стоящем здании. Всегда закрепляйте (например, цепью) цилиндры в вертикальном положении на стене, стойке или другой прочной конструкции.
Какой предел воздействия диоксида углерода рекомендован Американской конференцией государственных специалистов по промышленной гигиене (ACGIH®)?
ACGIH® TLV® – TWA: 5000 частей на миллион
ACGIH® TLV® – STEL [C]: 30000 частей на миллион
Рекомендации по воздействию Комментарии: TLV® = Пороговое предельное значение. TWA = взвешенное по времени среднее значение. STEL = предел кратковременного воздействия. C = предел потолка.
STEL = предел кратковременного воздействия. C = предел потолка.
ПРИМЕЧАНИЕ. Во многих (но не во всех) юрисдикциях Канады пределы воздействия аналогичны ACGIH® TLVs®. Поскольку законодательство зависит от юрисдикции, обратитесь в местную юрисдикцию для получения точной информации. Список доступен в Ответах по охране труда о государственных департаментах охраны труда и техники безопасности Канады.
Список актов и правил, регулирующих пределы воздействия химических и биологических агентов, доступен на нашем веб-сайте. Обратите внимание, что, хотя вы можете ознакомиться со списком законодательных актов бесплатно, для просмотра фактической документации вам потребуется подписка.
Каковы технические средства контроля углекислого газа?
Средства технического контроля: Используйте местную вытяжную вентиляцию, если общая вентиляция недостаточна для контроля количества в воздухе.
Какие средства индивидуальной защиты (СИЗ) необходимы при работе с углекислым газом?
Защита глаз/лица: Надевайте защитные очки для химической защиты.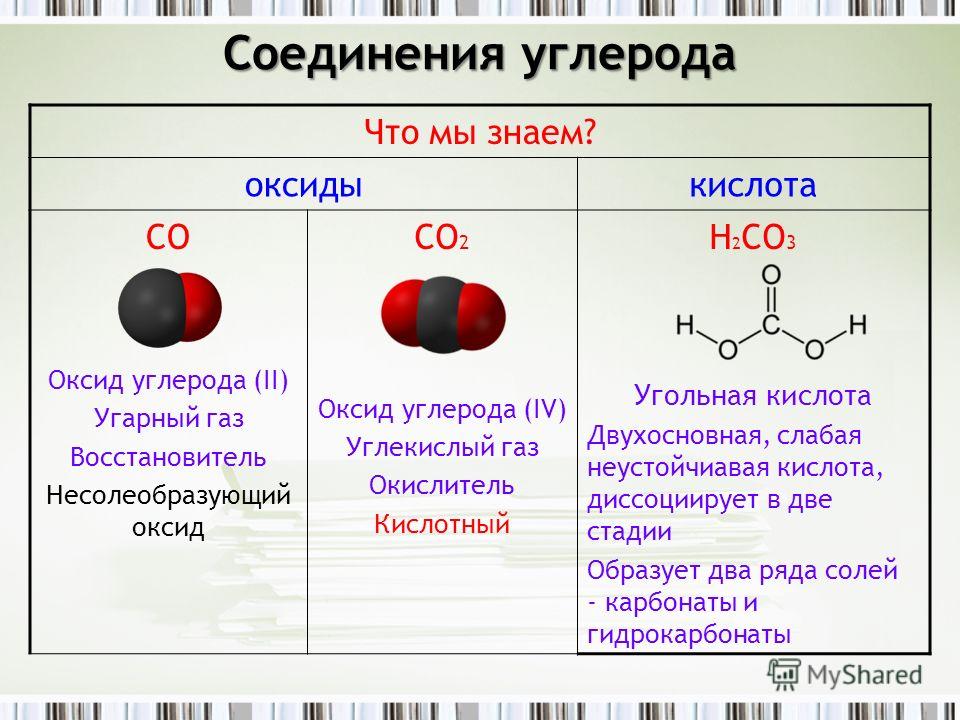 (морозный укус).
(морозный укус).
Защита кожи: Всегда носите изолирующую защитную одежду, если возможен контакт с охлажденным газом.
Защита органов дыхания:
До 40000 ppm:
(APF = 10) Любой респиратор с подачей воздуха.
(APF = 50) Любой автономный дыхательный аппарат с полнолицевой маской.
APF = присвоенный коэффициент защиты
Рекомендации применимы только к респираторам, одобренным Национальным институтом охраны труда и здоровья (NIOSH). Дополнительную информацию см. в Карманном справочнике NIOSH по химическим опасностям.
Последнее обновление документа: 4 января 2017 г.
Добавьте значок на свой веб-сайт или в интранет, чтобы ваши сотрудники могли быстро найти ответы на свои вопросы по охране труда и технике безопасности.
Что нового
Ознакомьтесь с нашим списком «Что нового», чтобы узнать, что было добавлено или изменено.
Нужна дополнительная помощь?
Свяжитесь с нашей информационной линией безопасности
905-572-2981
Бесплатный номер 1-800-668-4284
(в Канаде и США)
Расскажите нам, что вы думаете
Как мы можем сделать наши услуги более полезными для вас? Свяжитесь с нами, чтобы сообщить нам.













 Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении.
Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении.






 G. Hewitt and J.J. De Boer, J. Chem. Соц., А, 817 (1971).
G. Hewitt and J.J. De Boer, J. Chem. Соц., А, 817 (1971).


 J.Chem., 40, 1957 (1962).
J.Chem., 40, 1957 (1962).


 L.J. Beckwith and R.O.C. Norman, J. Chem. Соц., Б, 400 (1969).
L.J. Beckwith and R.O.C. Norman, J. Chem. Соц., Б, 400 (1969). V.K. Udupa, Электрохим. Acta, 16 , 1593 (1971).
V.K. Udupa, Электрохим. Acta, 16 , 1593 (1971). Цуцуми и Т. Муракава, Am. хим. соц., отд. Бензин. хим., преп. 15 (4), В5 (1970).
Цуцуми и Т. Муракава, Am. хим. соц., отд. Бензин. хим., преп. 15 (4), В5 (1970). Д., Семченко Д.Н., Антропов Л.И., Журн. прикл. хим., 40 , 2345 (1967).
Д., Семченко Д.Н., Антропов Л.И., Журн. прикл. хим., 40 , 2345 (1967). Аллен, Дж. Ам. хим. Soc., 73 , 3589 (1951).
Аллен, Дж. Ам. хим. Soc., 73 , 3589 (1951). М. Нойес, Дж. Ам. хим. Soc., 77 , 2036 (1955).
М. Нойес, Дж. Ам. хим. Soc., 77 , 2036 (1955).
 McColl, Coord. хим. Rev., 4 , 147 (1969).
McColl, Coord. хим. Rev., 4 , 147 (1969). Chem., 77, 132 (1965).
Chem., 77, 132 (1965). Enwoll, N. Fliteroft, and J.M. Leach, J. Inorg. Нукл. Chem., 34 , 885 (1972).
Enwoll, N. Fliteroft, and J.M. Leach, J. Inorg. Нукл. Chem., 34 , 885 (1972). Высокая концентрация может вытеснять кислород в воздухе. Если для дыхания доступно меньше кислорода, могут возникнуть такие симптомы, как учащенное дыхание, учащенное сердцебиение, неуклюжесть, эмоциональные расстройства и усталость. Когда кислорода становится меньше, могут возникнуть тошнота и рвота, коллапс, судороги, кома и смерть. Симптомы возникают быстрее при физической нагрузке. Недостаток кислорода может привести к необратимому повреждению органов, включая мозг и сердце.
Высокая концентрация может вытеснять кислород в воздухе. Если для дыхания доступно меньше кислорода, могут возникнуть такие симптомы, как учащенное дыхание, учащенное сердцебиение, неуклюжесть, эмоциональные расстройства и усталость. Когда кислорода становится меньше, могут возникнуть тошнота и рвота, коллапс, судороги, кома и смерть. Симптомы возникают быстрее при физической нагрузке. Недостаток кислорода может привести к необратимому повреждению органов, включая мозг и сердце. Это может привести к необратимому повреждению глаз или слепоте.
Это может привести к необратимому повреждению глаз или слепоте.