Углерод и железо: Диаграмма железо-углерод | ООО КВАДРО
alexxlab | 02.01.2023 | 0 | Разное
Анализ фазовых равновесий в системе «оксиды железа – углерод – CO – CO2»
Михайлов, Г. Г.; Кузнецов, Ю. С.; Качурина, О. И.; Чернуха, А. С.; Mikhailov, G. G.; Kuznetsov, Yu. S.; Kachurina, O. I.; Chernukha, A. S.
URI: http://dspace.susu.ac.ru/xmlui/handle/0001.74/4749
Date: 2013
Abstract:
При расчетах равновесных параметров, реализующихся при восстановлении
оксидов железа в атмосфере «CO – CO2» в присутствии углерода, использовались
термодинамические характеристики реакций восстановления оксидов железа, реакции газификации углерода и диаграмм состояния «железо – кислород» и «железо – углерод». Определены не только состав газовой фазы, но и составы конденсированных фаз (вюстита и насыщенного углеродом железа). Температура полного восстановления железа 955 К. Равновесная температура появления жидкого железа при
косвенном восстановлении оксидов железа около 1427 К. Получающееся при восстановлении железо насыщено углеродом, равновесная концентрация которого при
температурах выше 955 К соответствует диаграмме состояния «железо – углерод».
 Thermodynamic parameters of processes of carburization of iron and decarburization of steels and cast irons correspond to the equilibrium phase diagram of the “FeO1+x – Fe – CO – CO2
– carbon” system.
Thermodynamic parameters of processes of carburization of iron and decarburization of steels and cast irons correspond to the equilibrium phase diagram of the “FeO1+x – Fe – CO – CO2
– carbon” system.Description:
Михайлов Геннадий Георгиевич, доктор технических наук, профессор, заведующий кафедрой физической химии, Южно-Уральский государственный университет. Тел.: (351)2656205. E-mail: mikhailov-gg
@mail.ru.
Кузнецов Юрий Серафимович, кандидат технических наук, профессор кафедры физической химии,
Южно-Уральский государственный университет. Тел.: (351)2679491.
Качурина Ольга Ивановна, кандидат химических наук, доцент кафедры неорганической химии,
Южно-Уральский государственный университет.
Чернуха Александр Сергеевич, студент кафедры физической химии, Южно-Уральский государственный университет.
Mikhaylov Gennadiy Georgievich, doctor of engineering science, professor, head of the Physical Chemistry
Department, South Ural State University.
Show full item record
238. Физические свойства железа. Диаграмма состояния системы железо — углерод. . Общая химия
В 30-х годах XIX века русский инженер П. П. Аносов впервые применил микроскоп для изучения структуры стали и ее изменения после ковки и термической обработки. В 30-х годах XIX века подобные исследования стали проводиться и за границей.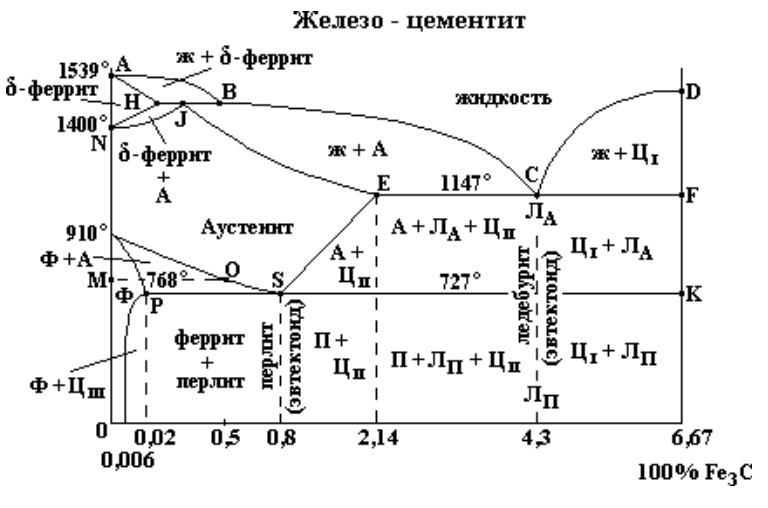
В 1868 г. Д. К. Чернов впервые указал на существование определенных температур («критических точек» ), зависящих от содержания углерода в стали и характеризующих превращения одной микроструктуры стали в другую. Этим было положено начало изучению диаграммы состояния Fe-C, а 1868 г. стал годом возникновения металловедения — науки о строении и свойствах металлов и сплавов. Французский исследователь Ф. Осмонд стал пользоваться только что изобретенным Ле Шателье пирометром и уточнил значения «критических точек». Он описал характер микроструктурных изменений, наблюдаемых при переходе через эти точки, и дал названия важнейшим структурам железоуглеродистых сплавов; эти названия употребляются до сих пор. С тех пор учеными различных стран было выполнено огромное количество работ, посвященных изучению сплавов железа с углеродом и диаграммы состояния системы Fe-C. Такого рода работы проводятся и в настоящее время. В них уточняются положения линий на диаграмме состояния в связи с применением более чистых веществ и более точных и современных методов.
Температура плавления железа равна 1539∓5°C. Железо об разует две кристаллические модификации: α-железо и γ-железо. Первая из них имеет кубическую объемноцентрированную решетку, вторая — кубическую гранецентрированную. α-Железо термодинамически устойчиво в двух интервалах температур: ниже 912°C и от 1394°C до температуры плавления. Между 912 и 1394°C устойчиво γ-железо. Температурные интервалы устойчивости α и γ железа обусловлены характером изменения энергии Гиббса обеих модификаций при изменении температуры (см. рис. 166).
– 653 –
Рис. 166. Температурная зависимость энергии Гиббса α железа (Gα) и γ -железа (Gγ).
Рис. 167. Кривая охлаждения железа.
При температурах ниже 912 и выше 1394°C энергия Гиббса α-железа меньше энергии Гиббса γ-железа, а в интервале 912-1394°C больше.
Температуры фазовых превращений железа хорошо видны на кривой охлаждения в виде остановок — горизонтальных площадок (см. рис. 167). Как видно, кроме площадок, отвечающих перечисленным точкам, на кривой охлаждения имеется еще одна остановка — при 768°C. Эта температура связана не с перестройкой решетки, а с изменением магнитных свойств α-железа. При температурах выше 768°C железо немагнитно, а ниже 768°C — магнитно. Немагнитное α-железо иногда называют β-железом, а модификацию α-железа, устойчивую при температурах от 1392°C до плавления, — δ-железом.
рис. 167). Как видно, кроме площадок, отвечающих перечисленным точкам, на кривой охлаждения имеется еще одна остановка — при 768°C. Эта температура связана не с перестройкой решетки, а с изменением магнитных свойств α-железа. При температурах выше 768°C железо немагнитно, а ниже 768°C — магнитно. Немагнитное α-железо иногда называют β-железом, а модификацию α-железа, устойчивую при температурах от 1392°C до плавления, — δ-железом.
Железо — серебристый пластичный металл. Оно хорошо поддается ковке, прокатке и другим видам механической обработки. Механические свойства железа сильно зависят от его чистоты — от содержания в нем даже весьма малых количеств других элементов.
Твердое железо обладает способностью растворять в себе многие элементы. В частности, растворяется в железе и углерод. Его растворимость сильно зависит от кристаллической модификации железа и от температуры. В α-железе углерод растворяется очень незначительно, в γ-железе — гораздо лучше. Раствор в γ-железе термодинамически устойчив в более широком интервале температур, чем чистое γ-железо. Твердый раствор углерода в α-железе называется ферритом, твердый раствор углерода в γ-железе – аустенитом.
Твердый раствор углерода в α-железе называется ферритом, твердый раствор углерода в γ-железе – аустенитом.
Содержанию в железе 6,67% (масс.) углерода отвечает химическое соединение — карбид железа, или цементит, Fe3C.
– 654 –
Рис. 168. Диаграмма состояния системы железо — углерод.
Это вещество имеет сложную кристаллическую структуру и характеризуется высокой твердостью (близка к твердости алмаза) и хрупкостью. При температуре около 1600°C цементит плавится.
Механические свойства феррита и аустенита зависят от содержания в них углерода. Однако при всех концентрациях углерода феррит и аустенит менее тверды и более пластичны, чем цементит.
Диаграмма состояния системы железо — углерод, дающая представление о строении железоуглеродных сплавов, имеет очень большое значение. С ее помощью можно объяснить зависимость свойств сталей и чугунов от содержания в них углерода и от термической обработки. Она служит основой при выборе железоуглеродных сплавов, обладающих теми или иными заданными свойствами.
Диаграмма состояния системы Fe-C сложнее, чем рассмотренные в главе XVI основные типы диаграмм состояния металлических систем. Однако все ее точки, кривые и области подобны тем, которые были описаны в § 195. Особенности ее обусловлены уже упомянутыми обстоятельствами: существованием двух модификаций кристаллического железа, способностью обеих этих модификаций образовывать твердые растворы с углеродом, способностью железа вступать в химическое соединение с углеродом, образуй цементит.
– 655 –
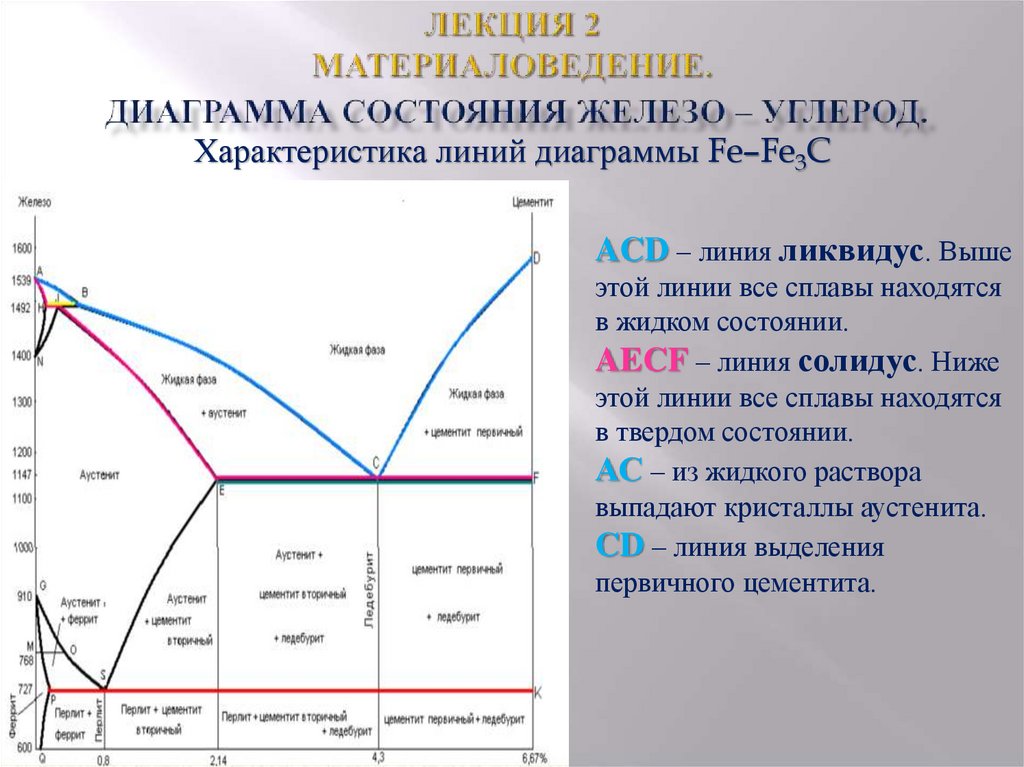
Левая ось диаграммы соответствует чистому железу, правая — карбиду Fe3C(цементиту). Точки А и D показывают температуру плавления железа и карбида, точки G и N — температуры превращений α и γ-железа друг в друга.
Линия ABCD — это кривая температур начала кристаллизации жидких сплавов, линия AHJECF — кривая температур начала плавления твердых сплавов. Все линии, лежащие ниже последней кривой, отвечают равновесиям между твердыми фазами.
Область, лежащая выше линии ABCD, отвечает жидкому сплаву. Области, примыкающие к левой вертикали, соответствуют твердым растворам углерода в железе: линия AHN ограничивает область твердого раствора углерода в α-железе при высоких температурах (область высокотемпературного феррита), линия NJESG ограничивает область твердого раствора углерода в γ-железе (область аустенита), линия GPQ — область твердого раствора углерода в α-железе при низких температурах (область низкотемпературного феррита). Перечисленным областям соответствуют гомогенные системы: структура как расплава, так и твердых растворов однородна в каждой из этих фаз.
Остальным областям диаграммы отвечают гетерогенные системы — смеси кристаллов двух фаз или кристаллов и расплава.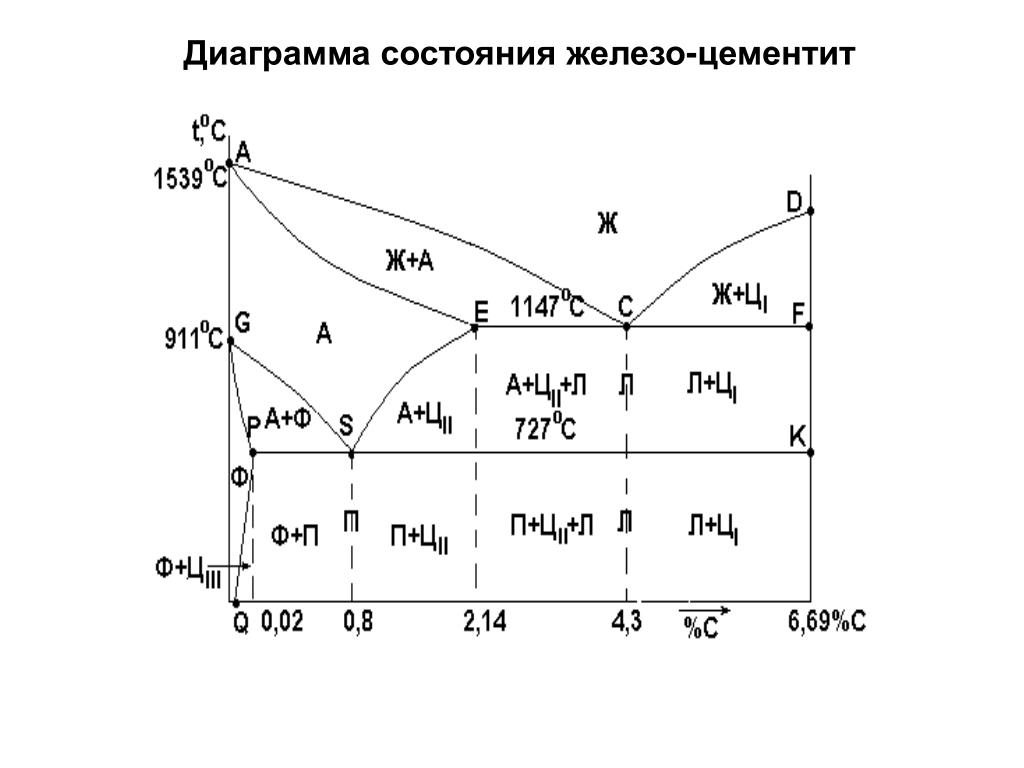
Рассмотрим важнейшие превращения, происходящие при медленном охлаждении расплавов различных концентраций. Это поможет нам разобраться в том, какие сплавы соответствуют областям гетерогенности диаграммы.
Пусть мы имеем расплав, содержащий 0.8% углерода. Его кристаллизация начнется в точке 1 (рис. 169). При охлаждении расплава до температуры, отвечающей этой точке, будут выпадать кристаллы аустенита; их состав отвечает точке 2. Расплав при этом обогащается углеродом, и его состав изменяется по линии ВС. Состав кристаллов в процессе кристаллизации изменяется по кривой JE. Когда состав кристаллов достигнет точки 3, кристаллизация закончится. Как всегда при образовании твердого раствора, одновременно идет процесс диффузии в твердой фазе, в результата чего при медленном охлаждении состав всех кристаллов получается одинаковым.
Далее, образовавшийся аустенит охлаждается без превращения до точки S (рис. 168). Эта точка (температура 727°C) показывает минимальную температуру устойчивого существования аустенита. При 272°C происходит его эвтектоидный распад. Образующийся эвтектоид состоит из чередующихся мелких пластинок феррита и цементита.
При 272°C происходит его эвтектоидный распад. Образующийся эвтектоид состоит из чередующихся мелких пластинок феррита и цементита.
– 656 –
На изломе он при рассматривании под микроскопом напоминает перламутр. Поэтому эта структура — эвтектоидная смесь феррита и цементита — получила название перлит.
Если исходный расплав содержит не 0.8% углерода, а несколько меньше, например 0.7%, то образующийся при кристаллизации аустенит начнет распадаться не при 727°C, а при более высокой температуре (точка 1 на рис. 170). Превращение начнется с выделения кристаллов феррита (точка 2 на рис. 170), содержание углерода в котором очень мало. Вследствие этого остающийся аустенит обогащается углеродом и при дальнейшем охлаждении его состав изменяется по кривой GS. По достижении точки S начинается эвтектоидное превращение при постоянной температуре, по окончании которого сталь будет состоять из феррита и перлита. Из сказанного вытекает, что области 3 на диаграмме (см. рис. 168) соответствует смесь жидкого сплава с кристаллами аустенита, области 5 — смесь кристаллов феррита и аустенита и области 10 — смесь перлита с кристаллами феррита.
рис. 168) соответствует смесь жидкого сплава с кристаллами аустенита, области 5 — смесь кристаллов феррита и аустенита и области 10 — смесь перлита с кристаллами феррита.
Если исходный расплав содержит более 0.8% углерода (но менее чем 2.14%), например 1.5%, то распад аустенита начнется с выделения цементита (точка 3 на рис. 170). Вследствие выделения Fe3C — фазы, богатой углеродом — остающийся аустенит обогащается железом, так что при дальнейшем охлаждении его состав изменяется по кривой ES. В точке S начинается выделение перлита. В итоге получается сталь со структурой, состоящей из цементита и перлита. Таким образом, области 6 на диаграмма (рис. 168) отвечает смесь кристаллов цементита и аустенита, а области 11 — смесь перлита с кристаллами цементита.
Обратимся теперь к сплавам, содержащим более 2.14% углерода. Первичная кристаллизация в этом случае заканчивается эвтектическим превращением при 1147°C, когда из расплава, содержащего 4,3% углерода (точка С на рис. 168), выделяется эвтектический сплав аустенита и цементита.
168), выделяется эвтектический сплав аустенита и цементита.
Если при этом исходить из расплава эвтектического состава (4.3% C), то кристаллизация начнется и закончится при одной и той же температуре 1147°C.
Рис. 169. Часть диаграммы состояния системы железо-углерод.
Рис.170. Часть диаграммы, состояния системы железо -углерод.
– 657 –
В случае сплавов, содержащих меньше 4.3% углерода (но больше 2.14%), образованию эвтектики будет предшествовать выделение аустенита. При содержании углерода выше 4.3% кристаллизация начнется с выделения цементита, но по достижении точки С на диаграмме также будет наблюдаться образование эвтектики. Таким образом, в результате кристаллизации жидких сплавов, содержащих более 2.14% углерода, первоначально получается структура, состоящая либо только из эвтектики, либо из эвтектики с кристаллами аустенита или цементита.
В то же время, как мы видели раньше, при кристаллизации жидких сплавов, содержащих меньше 2. 14% углерода, первоначально получается аустенит. Это различие в структуре при высоких температурах создает различие в технологических и механических свойствах сплавов. Эвтектика делает сплавы нековкими, но ее низкая температура плавления облегчает применение высокоуглеродистых сплавов как литейных материалов. Железоуглеродные сплавы, содержащие меньше 2.14% углерода, называются сталями, а содержащие больше 2,14% углерода — чугунами.
14% углерода, первоначально получается аустенит. Это различие в структуре при высоких температурах создает различие в технологических и механических свойствах сплавов. Эвтектика делает сплавы нековкими, но ее низкая температура плавления облегчает применение высокоуглеродистых сплавов как литейных материалов. Железоуглеродные сплавы, содержащие меньше 2.14% углерода, называются сталями, а содержащие больше 2,14% углерода — чугунами.
Эта граница (2.14% углерода) относится к железоуглеродным сплавам, не содержащим других элементов. В присутствии третьего элемента вид диаграммы состояния изменяется, в частности границы устойчивости аустенита в некоторых случаях смещаются в сторону низких температур.
Закончим рассмотрение превращений, совершающихся в чугунах, при их охлаждении ниже 1147°C. При этой температуре растворимость углерода в γ-железе максимальна. Поэтому к моменту окончания первичной кристаллизации содержащейся в чугуне аустенит наиболее богат углеродом (2,14% ). При охлаждении ниже этой температуры растворимость углерода в аустените падает (кривая ES на рис. 168) и углерод выделяется из него, превращаясь обычно в цементит. По достижении температуры 727°C весь остающийся аустенит, в том числе входящий в состав эвтектики, превращается в перлит. Из сказанного следует, что области 7 отвечает смесь эвтектики с кристаллами аустенита и цементита, образовавшегося при распаде аустенита, области 8- смесь эвтектики с кристаллами цементита. Поскольку при температурах ниже 727°C аустенит эвтектики превращается в перлит, то областям 12 и 13, подобно области 11, отвечает смесь перлита и цементита. Однако сплавы, принадлежащие к той и другой области, несколько различаются по структуре. Это различие обусловлено тем, что цементит сплавов области 13 образуется при первичной кристаллизации, в области 12 — при распаде аустенита. Таким образом, при температурах ниже 727°C чугун состоит из цементита и перлита. Как мы увидим ниже (см. § 241), в некоторых случаях чугун может иметь и другую структуру.
При охлаждении ниже этой температуры растворимость углерода в аустените падает (кривая ES на рис. 168) и углерод выделяется из него, превращаясь обычно в цементит. По достижении температуры 727°C весь остающийся аустенит, в том числе входящий в состав эвтектики, превращается в перлит. Из сказанного следует, что области 7 отвечает смесь эвтектики с кристаллами аустенита и цементита, образовавшегося при распаде аустенита, области 8- смесь эвтектики с кристаллами цементита. Поскольку при температурах ниже 727°C аустенит эвтектики превращается в перлит, то областям 12 и 13, подобно области 11, отвечает смесь перлита и цементита. Однако сплавы, принадлежащие к той и другой области, несколько различаются по структуре. Это различие обусловлено тем, что цементит сплавов области 13 образуется при первичной кристаллизации, в области 12 — при распаде аустенита. Таким образом, при температурах ниже 727°C чугун состоит из цементита и перлита. Как мы увидим ниже (см. § 241), в некоторых случаях чугун может иметь и другую структуру.
Рассматривая превращения, происходящие при охлаждении расплавов различного состава, мы смогли выяснить, какие сплавы соответствуют различным областям диаграммы.
– 658 –
Но мы рассмотрели не все области диаграммы. Пользуясь тем же методом, нетрудно показать, какие сплавы отвечают остальным ее областям: области 1 соответствует смесь жидкого расплава и кристаллов высокотемпературного феррита, области 2 — смесь кристаллов высокотемпературного феррита и аустенита, области 4 — смесь жидкого сплава и кристаллов цементита, области 9 — смесь кристаллов феррита и цементита.
фаз железо-углерод | Металлургия для чайников
Влияние температуры на кристаллическую структуру
Кристаллическая структура стали изменяется с повышением температуры. Для чистого железа это изменение происходит при 910°C. Объемно-центрированные кубические (ОЦК) кристаллы на рис. 2 превращаются в гранецентрированные кубические (ГЦК) кристаллы, как показано на рис. 3. В ГЦК-кристаллах атомы железа находятся на кубе. углах и в центрах каждой грани куба. Позиция центрирования тела пуста.
2 превращаются в гранецентрированные кубические (ГЦК) кристаллы, как показано на рис. 3. В ГЦК-кристаллах атомы железа находятся на кубе. углах и в центрах каждой грани куба. Позиция центрирования тела пуста.
Заданное количество атомов занимает несколько меньший объем при расположении в виде ГЦК-кристаллов, чем при расположении в виде ОЦК-кристаллов. Таким образом, изменение кристаллической структуры сопровождается изменением объема. Это изменение показано на рис. 4. Когда кусок чистого железа нагревается, его расширение происходит обычным образом, пока не будет достигнута температура 910°С. При этой температуре происходит ступенчатое сжатие примерно на ½% по объему, связанное с переходом от ОЦК к ГЦК кристаллической структуре. Дальнейший нагрев приводит к дальнейшему тепловому расширению до тех пор, пока примерно при 1400°C ГЦК структура не вернется в ОЦК форму и не произойдет ступенчатое расширение, которое восстанавливает объем, потерянный при 910°С. Нагрев выше 1400°C приводит к тепловому расширению, пока не произойдет плавление при 1540°C. Кривая обратима при медленном охлаждении.
Кривая обратима при медленном охлаждении.
Свойство металлов иметь различную кристаллическую структуру в зависимости от температуры называется аллотропией.
Раствор углерода в ОЦК и ГЦК кристаллах
Когда атомы двух материалов А и В имеют примерно одинаковый размер, могут образовываться кристаллические структуры, в которых ряд атомов А заменен атомами В. Такой раствор называется замещающим, потому что один атом замещает другой. Например, никель в стали.
Когда атомы двух материалов имеют разный размер, меньший атом может поместиться между большими атомами. Такой раствор называется интерстициальным. Самый известный пример — раствор углерода в железе. Таким образом, высокотемпературные ГЦК-кристаллы могут содержать до 2% углерода в твердом растворе при 1130°С, тогда как в низкотемпературных ОЦК-кристаллах максимальное количество углерода, которое может удерживаться в растворе, составляет 0,02% при 723°С. и примерно 0,002% при температуре окружающей среды.
Так, например, сталь, содержащая 0,5% углерода, может растворить весь углерод в более высокотемпературных ГЦК-кристаллах, но при охлаждении не может сохранить весь углерод в растворе в ОЦК-кристаллах. Избыток углерода реагирует с железом с образованием карбида железа (Fe3C), обычно называемого цементитом. Цементит твердый и хрупкий по сравнению с чистым железом.
Количество цементита и распределение частиц цементита в микроструктуре имеет важное значение для технических свойств стали.
Номенклатура
Металлурги используют следующую номенклатуру:
- Феррит или -Fe ОЦК форма железа, в которой может быть растворено до 0,02% C по весу.
- Цементит Карбид железа Fe3C (содержащий около 6,67%C).
- ПерлитЛаминарная смесь феррита и цементита, описанная ранее. Общее содержание углерода в смеси составляет 0,8% по массе.

- Аустенит или g-Fe ГЦК-форма железа, которая существует при высоких температурах и может содержать примерно до 2% C по весу.
- SteelAlloys, содержащие менее 2% углерода по массе.
- Чугунные сплавы, содержащие более 2% углерода по весу.
Сталь, используемая в таких конструкциях, как мосты, здания и корабли, обычно содержит от 0,1% до 0,25% углерода по весу.
Фазовая диаграмма железо-углерод
Фазовая диаграмма железо-углерод по существу является картой. Наиболее важная часть показана на рис. 5. Более подробная информация представлена на рис. 6.
Любая точка в поле диаграммы представляет собой сталь с определенным содержанием углерода при определенной температуре. Диаграмма разделена на области, показывающие структуры, устойчивые при определенных составах и температурах. Диаграмму можно использовать для рассмотрения того, что происходит, когда сталь с 0,5% С охлаждают от 1000°С (рис.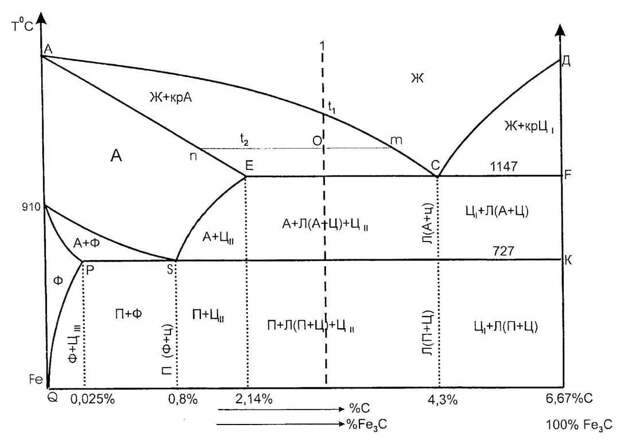 6). При 1000 °С структура представляет собой аустенит, т. е. поликристаллические ГЦК-кристаллы, в которых весь углерод растворен. Никаких изменений не происходит при охлаждении до тех пор, пока температура не достигнет примерно 800°С. При этой температуре происходит пересечение границы из поля, обозначенного как аустенит (г), в поле, обозначенное как феррит + аустенит (а + г), т.е. из ГЦК-железа начинают формироваться кристаллы ОЦК-железа, содержащие очень мало углерода. Поскольку феррит содержит так мало углерода, оставшийся углерод должен концентрироваться в остаточном аустените. Содержание углерода в аустените и относительные пропорции феррита и аустенита в микроструктуре регулируются сами по себе, чтобы сохранить первоначальное общее содержание углерода.
6). При 1000 °С структура представляет собой аустенит, т. е. поликристаллические ГЦК-кристаллы, в которых весь углерод растворен. Никаких изменений не происходит при охлаждении до тех пор, пока температура не достигнет примерно 800°С. При этой температуре происходит пересечение границы из поля, обозначенного как аустенит (г), в поле, обозначенное как феррит + аустенит (а + г), т.е. из ГЦК-железа начинают формироваться кристаллы ОЦК-железа, содержащие очень мало углерода. Поскольку феррит содержит так мало углерода, оставшийся углерод должен концентрироваться в остаточном аустените. Содержание углерода в аустените и относительные пропорции феррита и аустенита в микроструктуре регулируются сами по себе, чтобы сохранить первоначальное общее содержание углерода.
Эти количества можно рассчитать, рассмотрев расширенную часть диаграммы железо-углерод, показанную на рисунке 7. Представьте, что сталь охладилась до 750°C. Сочетание общего содержания углерода и температуры представлено точкой X.
Все составляющие микроструктуры имеют одинаковую температуру. Линия постоянной температуры может быть проведена через X. Она пересекает границы поля аустенита и феррита в точках F и A. Эти точки пересечения дают содержание углерода в феррите и аустените соответственно при определенной температуре. Если теперь представить линию FA в виде жесткой балки, которая может вращаться вокруг точки опоры в точке X, то «вес» аустенита, висящего в точке A, должен уравновесить «вес» феррита, висящего в точке F.
Это так называемое правило рычага:
.
Масса феррита ´ FX = Масса аустенита ´ AX
Тогда отношение феррита к аустениту в микроструктуре определяется как:
Таким образом, по мере охлаждения стали увеличивается доля феррита и увеличивается содержание углерода в оставшемся аустените, пока температура охлаждения не достигнет 723°С. При этой температуре содержание углерода в аустените составляет 0,8% и больше его брать нельзя. Охлаждение чуть ниже этой температуры вызывает разложение аустенита. Он распадается на пластинчатую смесь феррита и Fe3C, идентифицированную ранее как перлит.
Охлаждение чуть ниже этой температуры вызывает разложение аустенита. Он распадается на пластинчатую смесь феррита и Fe3C, идентифицированную ранее как перлит.
Доли феррита и перлита в микроструктуре, скажем, при 722°С, практически такие же, как доли феррита и аустенита непосредственно перед распадом при 723°С.
Таким образом, обращаясь к рисунку 7 и используя правило рычага:
Масса феррита ´ F¢ X¢ = Масса перлита ´ F¢ P
При этом перлита должно быть примерно в два раза больше, чем феррита.
Для других сталей, содержащих менее 0,8%С, объяснение идентично, за исключением долей перлита в микроструктуре ниже 723°С. Это изменяется примерно линейно с содержанием углерода от нуля при 0,02%C до 100% при 0,8%C. Типичная мягкая сталь с содержанием углерода 0,2% будет содержать около 25% перлита.
Для сталей, содержащих более 0,8% углерода, при охлаждении от высоких температур структура становится полностью аустенитной. Первым изменением является образование частиц Fe3C из аустенита. Это изменение снижает содержание углерода в остаточном аустените. При дальнейшем охлаждении содержание углерода в аустените следует линии границы между полем g и полем g + Fe3C. Вновь при достижении 723°С содержание углерода в аустените составляет 0,8%. При дальнейшем охлаждении он по-прежнему распадается на перлит. Следовательно, окончательная микроструктура состоит из нескольких частиц Fe3C, внедренных в массу перлита.
Первым изменением является образование частиц Fe3C из аустенита. Это изменение снижает содержание углерода в остаточном аустените. При дальнейшем охлаждении содержание углерода в аустените следует линии границы между полем g и полем g + Fe3C. Вновь при достижении 723°С содержание углерода в аустените составляет 0,8%. При дальнейшем охлаждении он по-прежнему распадается на перлит. Следовательно, окончательная микроструктура состоит из нескольких частиц Fe3C, внедренных в массу перлита.
Вам также может понравиться
| Глоссарий по металлургии Глоссарий металлургии Деятельность: Функция… | Структура и компоненты из стали Технические свойства стали,.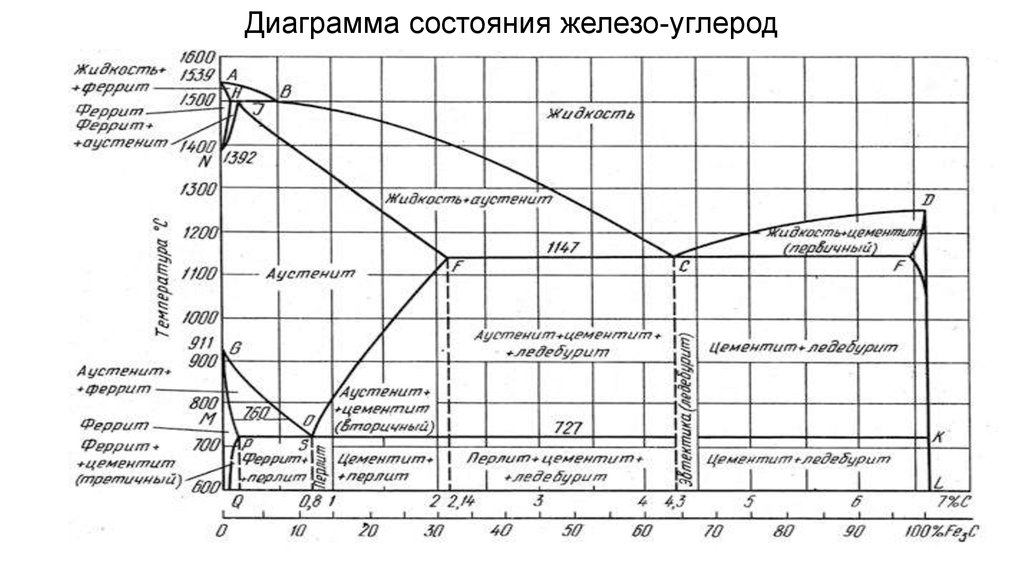 .. .. | Фазовая диаграмма стали Фазовая диаграмма Fe-Fe3C, Материаловедение… | Аустенит (гамма-железо) Аустенит, также известный как гамма-фаза… |
металл – Как сталь может так отличаться от железа, даже если количество углерода невелико?
Свойства упругой деформации, такие как жесткость (модуль Юнга), очень мало зависят от концентрации легирующих элементов, поскольку мы работаем только с прочностью связи до текучести. Чистое железо, углеродистая сталь и высоколегированная сталь будут различаться по жесткости только примерно на 15%. Таким образом, упругие свойства, как вы предполагаете, будут довольно инвариантными при небольших изменениях концентрации сплава.
Чистое железо, углеродистая сталь и высоколегированная сталь будут различаться по жесткости только примерно на 15%. Таким образом, упругие свойства, как вы предполагаете, будут довольно инвариантными при небольших изменениях концентрации сплава.
Но другие механические свойства, зависящие от пластической деформации, такие как предел текучести, твердость, ударная вязкость, отличаются тем, как на них влияет концентрация элементов в сплаве. Пластическая деформация металлов при температуре окружающей среды и ниже 1/3 абсолютной температуры плавления в основном связана с перемещением дислокаций внутри кристаллической структуры. Таким образом, усиление означает поиск эффективных методов, препятствующих нормальному дислокационному течению.
Давайте посмотрим, почему легирование способствует пластичности любого металла.
Слово «легирование» может охватывать ситуации, когда два или более металлов существуют в виде смеси отдельных элементов. Такие смеси будут демонстрировать изменения свойств, грубо представленные правилом уравнения смесей, т. е.
е.
$$ S = v_1 S_1 + v_2 S_2$$, где $v_1$, $v_2$ — объемные доли соответствующих элементов.
Но сплавление в обычном осмысленном смысле будет происходить только тогда, когда преобладающее химическое равновесие благоприятствует либо твердому раствору, либо интерметаллической фазе (например, $Ni_3Al$, $Fe_3C$ и т. д.), а не смеси двух отдельных элементов . Легирование твердого раствора может происходить двумя путями. Это может произойти, когда атом второстепенного компонента заменяет для одного в кристаллической решетке основного компонента элемента. Обычно это происходит, когда второстепенный компонент имеет сравнимую атомную массу, т.е. никель в железе.
Сплавление раствором также может происходить, если второстепенный компонент имеет намного меньшую атомную массу, чем у основного компонента, например углерода в железе. В этом случае атомы второстепенных элементов вписываются в существующую решетку железа, тип раствора, известный как твердый раствор внедрения . Конечно, атом углерода внутри объемно-центрированной кубической формы железа несколько расширит решетку вокруг себя. Таким образом, у нас есть предел температуры окружающей среды 0,002% по весу (или около 1 атома углерода на 10 000 атомов железа) на то, сколько углерода растворяется в твердом b.c.c. железо, известное как феррит или $\alpha$-железо.
Конечно, атом углерода внутри объемно-центрированной кубической формы железа несколько расширит решетку вокруг себя. Таким образом, у нас есть предел температуры окружающей среды 0,002% по весу (или около 1 атома углерода на 10 000 атомов железа) на то, сколько углерода растворяется в твердом b.c.c. железо, известное как феррит или $\alpha$-железо.
Дислокация внутри металлического кристалла представляет собой несоответствие в обычном упорядоченном трехмерно повторяющемся расположении ионов. Практически невозможно кристаллизовать любое вещество, не имея множества дислокаций внутри каждого кристалла. Что еще более важно, поскольку в идеальном кристалле все связи разрываются одновременно, само существование дислокаций позволяет кристаллическим материалам пластически деформироваться при умеренном напряжении, а не ломаться в хрупком режиме при гораздо более высоком напряжении. Таким образом, предел текучести любого кристаллического металлического материала фактически представляет собой напряжение, при котором его дислокации начинают двигаться. Если мы хотим улучшить силу какого-либо элемента, например. железа, нужно найти способ воспрепятствовать движению в нем дислокаций.
Если мы хотим улучшить силу какого-либо элемента, например. железа, нужно найти способ воспрепятствовать движению в нем дислокаций.
Вблизи дислокации решетка растягивается со стороны недостающей полуплоскости ионов и сжимается со стороны лишней полуплоскости. Таким образом, междоузельные растворенные атомы внутри кристалла при соответствующей температуре будут иметь тенденцию к диффузии и оседанию на расширенной стороне зоны дислокации, поскольку здесь они создают минимальное увеличение энергии деформации решетки. Это то, что происходит с атомами углерода в железе.
Поскольку химическое взаимодействие между атомом углерода и окружающими ионами железа будет носить частично ковалентный характер, будет значительно большее сопротивление потоку дислокаций под нагрузкой и, следовательно, более высокий предел текучести.
Концентрация углерода ~ 1 на 10 000 атомов железа будет соответствовать одному атому углерода на куб кристалла железа с длиной ребра 22 межатомных расстояния (~ 60 Ангстрем).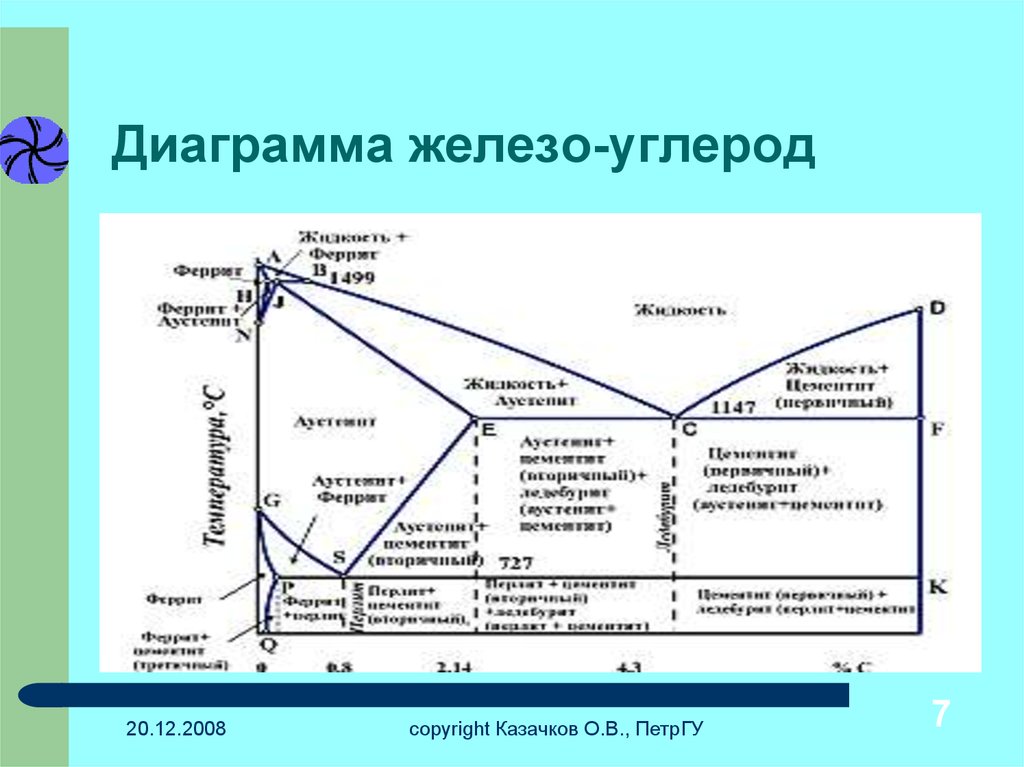 Таким образом, один только атом углерода может значительно ограничить движение дислокационной петли в этом объеме, и этого более чем достаточно для нормальной плотности дислокаций, наблюдаемой в углеродистой стали.
Таким образом, один только атом углерода может значительно ограничить движение дислокационной петли в этом объеме, и этого более чем достаточно для нормальной плотности дислокаций, наблюдаемой в углеродистой стали.
Другим фактором, влияющим на импеданс дислокаций, является другая углеродсодержащая фаза в углеродистых сталях, т.е. $ Fe_3C $ или цементит . Эта фаза выделяется одновременно из $\gamma$-железа ( аустенита ) или пересыщенного углеродом феррита по мере его охлаждения. Этот тип одновременного твердофазного осаждения называется эвтектоидным разложением. Эвтектоидные парные фазы очень тонко перемешаны и часто демонстрируют фиксированное соотношение между их кристаллическими ориентациями. В случае углеродистых сталей эвтектоидная смесь состоит из очень тонких чередующихся пластинок феррита и цементита. Находясь так близко, любое движение дислокации к краю феррита будет механически блокироваться соседними пластинами цементита.
Таким образом, номинально «небольшие» добавки углерода к чистому железу будут иметь два важных эффекта в сдерживании продвижения дислокаций и, следовательно, в упрочнении материала: решетка, которая размещает атомы углерода в «трубах» дислокаций, где их частично ковалентная связь с соседними атомами железа на дополнительных полуплоскостях требует большего напряжения сдвига для перемещения дислокаций внутри зерен феррита.