Установите соответствие изделие из металла способ защиты от коррозии: Установите соответствие: Изделия из металла – А) Кузов автомобиля Б) Консервная банка В)
alexxlab | 05.01.2023 | 0 | Разное
Методы защиты коррозии | Статья в журнале «Молодой ученый»
Библиографическое описание:Тапаева, А. П. Методы защиты коррозии / А. П. Тапаева, Г. Т. Кожагельдиева. — Текст : непосредственный // Молодой ученый. — 2014. — № 1.2 (60.2). — С. 5-7. — URL: https://moluch.ru/archive/60/8920/ (дата обращения: 03.12.2022).
Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
В тех случаях, когда окисление металла необходимо для осуществления какого-либо технологического процесса, термин “коррозия” употреблять не следует. Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окислятся, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется [1].
Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется [1].
Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом. В трудах древнегреческого историка Геродота (V век до нашей эры) уже имеется упоминание о применении олова для защиты железа от коррозии.
Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих её протекание. Коррозия металлов осуществляется в соответствии с законами природы и поэтому ее нельзя полностью устранить, а можно лишь замедлить [2].
По типу разрушений различают коррозию наружную (атмосферная и почвенная) и внутреннюю. Основным видом коррозии наружной поверхности промысловых трубопроводов является язвенная коррозия, а внутренней – равномерная или общая, происходящая в результате окислительно-восстановительныхгетерогенных процессов, происходящие на поверхности раздела фаз.
Коррозию классифицируют: по механизму, по площади повреждения, скорости распространения и виду коррозионного повреждения (3-схема).
3-схема.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью [3].
В производстве широко используется химическое нанесение металлических покрытий на изделия. Процесс химического металлирования является каталитическим или автокаталитическим, а катализатором является поверхность изделия. Используемый раствор содержит соединение наносимого металла и восстановитель. Поскольку катализатором является поверхность изделия, выделение металла и происходит именно на ней, а не в объеме раствора. В настоящее время разработаны методы химического покрытия металлических изделий никелем, кобальтом, железом, палладием, платиной, медью, золотом, серебром, родием, рутением и некоторыми сплавами на основе этих металлов.
Металлические покрытия делят на две группы:
1. коррозионностойкие;
2. протекторные.
Например, для покрытия сплавов на основе железа в первую группу входят никель, серебро, медь, свинец, хром. Они более электроположительны по отношению к железу, то есть в электрохимическом ряду напряжений металлов стоят правее железа. Во вторую группу входят цинк, кадмий, алюминий. Они более электроотрицательны по отношению к железу.
В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а второе – на изготовление консервных банок. Впервые способ хранения пищевых продуктов в жестяных банках предложил повар Н. Ф. Аппер в 1810 году. И то, и другое железо получают, главным образом, протягиванием листа железа через расплав соответствующего металла.
Ф. Аппер в 1810 году. И то, и другое железо получают, главным образом, протягиванием листа железа через расплав соответствующего металла.
Металлические покрытия защищают железо от коррозии при сохранении сплошности. При нарушении же покрывающего слоя коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется работой гальванического элемента железо–металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии) [4].
Применение ингибиторов – один из самых эффективных способов борьбы с коррозией металлов в различных агрессивных средах. Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от латинского inhibere, что означает сдерживать, останавливать. Ещё по данным 1980 года, число известных науке ингибиторов составило более пяти тысяч. Ингибиторы дают народному хозяйству немалую экономию.
Ингибирующее воздействие на металлы, прежде всего на сталь, оказывает целый ряд неорганических и органических веществ, которые часто добавляются в среду, вызывающую коррозию. Ингибиторы имеют свойство создавать на поверхности металла очень тонкую пленку, защищающую металл от коррозии.
Ингибиторы в соответствии с Х. Фишером можно сгруппировать следующим образом:
1) Экранирующие, то есть покрывающие поверхность металла тонкой пленкой. Пленка образуется в результате поверхностной адсорбции. При воздействии физических ингибиторов химических реакций не происходит;
2) Окислители (пассиваторы) типа хроматов, вызывающие образование на поверхности металла плотно прилегающего защитного слоя окисей, которые замедляют протекание анодного процесса. Эти слои не очень стойки и при определенных условиях могут подвергаться восстановлению. Эффективность пассиваторов зависит от толщины образующегося защитного слоя и его проводимости;
3) Катодные – повышающие перенапряжение катодного процесса.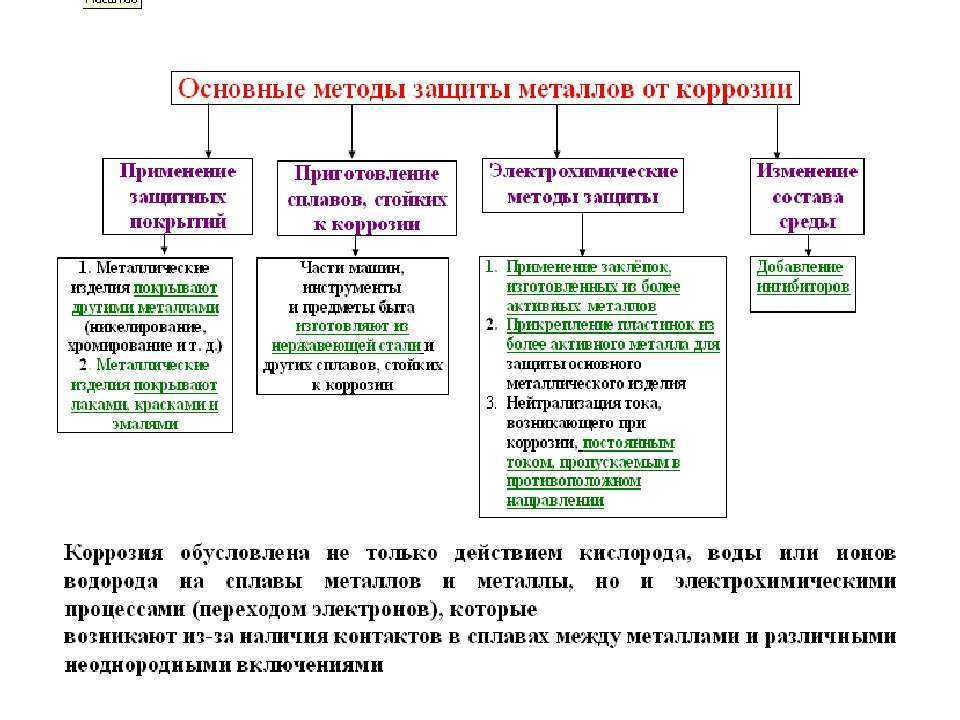 Они замедляют коррозию в растворах неокисляющих кислот. К таким ингибиторам относятся соли или окислы мышьяка и висмута.
Они замедляют коррозию в растворах неокисляющих кислот. К таким ингибиторам относятся соли или окислы мышьяка и висмута.
Эффективность действия ингибиторов зависит в основном от условий среды, поэтому универсальных ингибиторов нет. Для их выбора требуется проведение исследований и испытаний.
Наиболее часто применяются следующие ингибиторы: нитрит натрия, добавляемый, например, к холодильным соляным растворам, фосфаты и силикаты натрия, бихромат натрия, различные органические амины, сульфоокись бензила, крахмал, танин и т. п. Поскольку ингибиторы со временем расходуются, они должны добавляться в агрессивную среду периодически. Количество ингибитора, добавляемого в агрессивные среды, невелико. Например, нитрита натрия добавляют в воду в количестве 0,01-0,05%.
Ингибиторы подбираются в зависимости от кислого или щелочного характера среды. Например, часто применяемый в качестве ингибитора нитрит натрия может использоваться в основном в щелочной среде и перестает быть эффективным даже в слабокислых средах [5, 6].
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
В XXI веке высокие темпы развития промышленности, интенсификация производственных процессов, повышение основных технологических параметров (температура, давление, концентрация реагирующих средств и др.) предъявляют высокие требования к надежной эксплуатации технологического оборудования и строительных конструкций. Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Необходимость осуществления мероприятий по защите от коррозии диктуется тем обстоятельством, что потери от коррозии приносят чрезвычайно большой ущерб. По имеющимся данным, около 10% ежегодной добычи металла расходуется на покрытие безвозвратных потерь вследствие коррозии и последующего распыления. Основной ущерб от коррозии металла связан не только с потерей больших количеств металла, но и с порчей или выходом из строя самих металлических конструкций, т.к. вследствие коррозии они теряют необходимую прочность, пластичность, герметичность, тепло- и электропроводность, отражательную способность и другие необходимые качества. К потерям, которые терпит народное хозяйство от коррозии, должны быть отнесены также громадные затраты на всякого рода защитные антикоррозионные мероприятия, ущерб от ухудшения качества выпускаемой продукции, выход из строя оборудования, аварий в производстве и так далее.
Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства.
Коррозия является физико-химическим процессом, защита же от коррозии металлов – проблема химии в чистом виде [7].
Сегодня говорить о том, что коррозия металла как процесс его разрушения практически побежден, преждевременно. И проблем здесь хватает. Но ученые прилагают все усилия, чтобы коррозия металла как можно меньше доставляла неудобств в процессе эксплуатации металлических конструкций.
Все больше появляется методов борьбы с этим процессом, все больше появляется материалов, которые гарантируют эффективную защиту. На исследования тратятся большие финансовые средства, поэтому коррозия металла должна отступить в будущем, а точнее сказать, сдать свои позиции. Коррозия металлов и меры борьбы с ней – это одна из главных задач, которую ставят перед собой строители, начиная поднимать новый объект.
Литература:
1. Андреев И.Н. Коррозия металлов и их защита. – Казань: Татарское книжное издательство, 2001. – С. 68-70.
2. Лукьянов П.М. Краткая история химической промышленности. – М.: Издательство АН СССР, 1999. – С. 55-56
– М.: Издательство АН СССР, 1999. – С. 55-56
3. Чухарева Н.В., Абрамова Р.Н., Болсуновская Л.М. – Коррозионные повреждения при транспорте скважинной продукции. – Томск, 2009. – С. 5-6.
4. Войтович В.А., Мокеева Л.Н. Биологическая коррозия. – М.: Знание, 2000. – С. 70.
5. Шехтер Ю.Н., Ребров И.Ю., Легезин Н.Е. и др. Некоторые проблемы ингибирования коррозии // Защита металлов, 1998, Т.34. – № 6. – С. 638-641.
6. Козлов А.А., Прохорова Н.П., Бограчев А.М. Новейшие тенденции в разработке и применении ингибиторов коррозии для водоохлаждающих систем // Химическая промышленность. – 1986. – № 1. – С. 40-41.
7. Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. – Л.: Химия, 2000. – С. 30-35.
Основные термины (генерируются автоматически): коррозия, коррозия металлов, ингибитор, коррозия металла, металл, народное хозяйство, нитрит натрия, поверхность металла, процесс, тонкая пленка.
Презентация “Металы” | Образовательная социальная сеть
Слайд 1
Тема 2. 10.2 Металлы. Коррозия металлов. Получение. Государственное бюджетное профессиональное образовательное учреждение Департамента здравоохранения города Москвы «МЕДИЦИНСКИЙ КОЛЛЕДЖ №5» Теоретическое занятие ОУДп.02. Химия Специальность: 34.02.01 Сестринское дело (базовая подготовка) Квалификация выпускника: Медсестра Москва 2021 Е.В. Субботина– преподаватель химии, первая квалификационная категория
10.2 Металлы. Коррозия металлов. Получение. Государственное бюджетное профессиональное образовательное учреждение Департамента здравоохранения города Москвы «МЕДИЦИНСКИЙ КОЛЛЕДЖ №5» Теоретическое занятие ОУДп.02. Химия Специальность: 34.02.01 Сестринское дело (базовая подготовка) Квалификация выпускника: Медсестра Москва 2021 Е.В. Субботина– преподаватель химии, первая квалификационная категория
Слайд 2
Вспомним ранее изученное Что такое простое вещество? Что такое сложное вещество? Чем отличается простое вещество от сложного? оксиды основания кислоты амфотерные гидроксиды соли средние соли кислые соли основные соли Вспомните (усно) основные классы органических веществ. ЗАДАЧА 1.Запишите структурные формулы двух гомологов этиленгликоля. 2.Запишите структурные формулы изомеров состава C4h20O. Дайте им названия, назовите классы веществ, к которым они относятся. 3.Установите соответствие между функциональной группой и классом вещества: Функциональная группа класс вещества 1) -COOH а) спирты 2) -OH б) фенолы 3) -Nh3 в) кетоны 4) -COH г) карбоновые кислоты 5) – C =O д) альдегиды Напишите молекулярную формулу: бутана, метана, формальдегида, ацетилена, нонана, этилена, пентина, амилового спирта, бутадиена-1,3.
Слайд 3
Вспомним ранее изученное Дайте определения понятиям оксиды основания кислоты амфотерные гидроксиды
Слайд 4
Вспомним ранее изученное Дайте определения понятиям соли средние соли кислые соли основные соли
Слайд 5
Вспомним ранее изученное Вспомните (усно) основные классы органических веществ. ЗАДАЧА Запишите структурные формулы двух гомологов этиленгликоля.
Слайд 6
Вспомним ранее изученное Запишите структурные формулы изомеров состава C 4 H 10 . Дайте им названия, назовите классы веществ, к которым они относятся.
Слайд 7
Вспомним ранее изученное Напишите молекулярную формулу: бутана, метана, формальдегида, ацетилена, нонана, этилена, пентина, амилового спирта, бутадиена-1,3.
Слайд 8
Тема:Металлы. Коррозия металлов. Получение Государственное бюджетное профессиональное образовательное учреждение Департамента здравоохранения города Москвы «МЕДИЦИНСКИЙ КОЛЛЕДЖ №5» Теоретическое занятие ОУДп.02. Химия Специальность: 34. 02.01 Сестринское дело (базовая подготовка) Квалификация выпускника: Медсестра Москва 2021 Е.В. Суббиотна– преподаватель химии, первая квалификационная категория
02.01 Сестринское дело (базовая подготовка) Квалификация выпускника: Медсестра Москва 2021 Е.В. Суббиотна– преподаватель химии, первая квалификационная категория
Слайд 9
Содержание учебного занятия Положение металлов в периодической системе и особенности строения их атомов. Общие физические свойства металлов и их восстановительные свойства Оксиды и гидроксиды металлов. Понятие коррозии. Химическая коррозия. Общие способы получения металлов. Значение металлов в природе и жизни организмов
Слайд 10
Изучив эту тему, Вы должны будете: Ориентироваться, где находятся металлы Положение металлов в периодической системе Понимать особенности строения атомов металлов. Знать общие физические свойства металлов и восстановительные свойства
Слайд 11
Изучив эту тему, Вы должны будете: Знать о коррозии и ее видах Знать общие способы получения металлов. Знать значение металлов в природе и жизни организмов
Слайд 12
Металлы – химические элементы , образующие в свободном состоянии простые вещества с металлической связью. М.В. Ломоносов – металлы «светлое тело, которое ковать можно» Что такое металлы Ba Cr K
М.В. Ломоносов – металлы «светлое тело, которое ковать можно» Что такое металлы Ba Cr K
Слайд 13
Роль металлов в жизни человека и общества. В древности человеку были известны только 7металлов: Золото( Au ) ,Серебро( Ag ) ,Медь( Cu ) ,Олово( Sn ) , Свинец( Pb ) ,Железо( Fe ) и Ртуть( Hg ) . Сначала человек познакомился с металлами,которые встречаются в самородном виде – это золото,серебро и медь. Остальные металлы появились после того,как человек научился добывать их из руд с помощью огня. Каменный век → Медный век → Бронзовый век → Железный век.
Слайд 14
Большинство химических элементов – металлы. Граница между металлами и неметаллами-условная. B Si Неметаллы As Те Металлы At
Слайд 15
Металлы Переходный элемент Неметаллы Основный Амфотерный Кислотный оксид оксид оксид Основание Амфотерный Кислота гидроксид Na Al S Na 2 O Al 2 O 3 SO 3 NaOH Al(OH) 3 H 2 SO 4
Слайд 16
Закономерность изменения свойств металлов в группе. Заряд ядра увеличивается,так как увеличивается порядковый номер.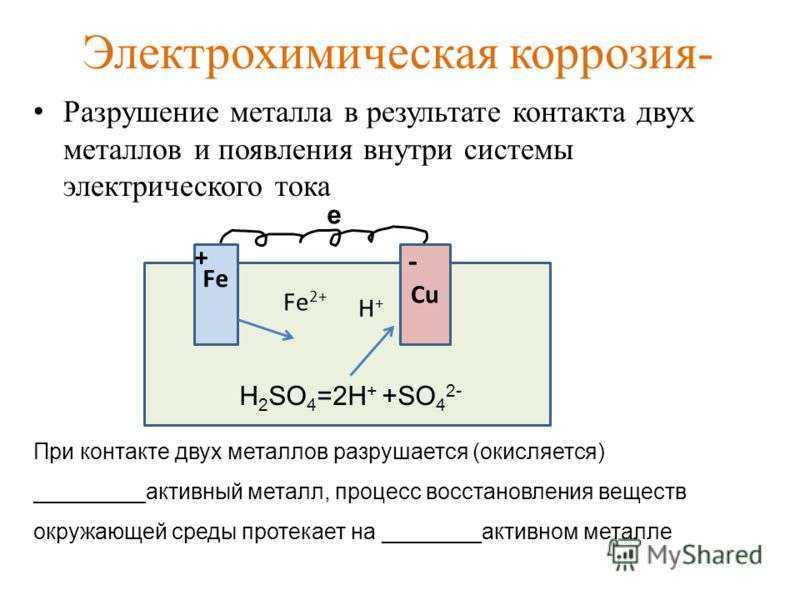 R увеличивается,так как увеличивается количество энергетических уровней. Число электронов на последнем уровне постоянно. Способность к отдаче электронов увеличивается. Восстановительные способности и металлические свойства увеличиваются.
R увеличивается,так как увеличивается количество энергетических уровней. Число электронов на последнем уровне постоянно. Способность к отдаче электронов увеличивается. Восстановительные способности и металлические свойства увеличиваются.
Слайд 17
Физические свойства металлов. Все металлы обладают общими физическими свойствами как во всех металлах существует металлическая химическая связь и металлическая кристаллическая решётка.
Слайд 18
Все металлы обладают металлическим блеском
Слайд 19
Все металлы- твердые вещества, кроме ртути. самый мягкий – калий, самый твердый – хром
Слайд 20
По температуре плавления делятся на Легкоплавкие Hg, Ga, Cs, In, Bi Тугоплавкие W, Mo, V, Cr
Слайд 21
ПО плотности делятся на Легкие Тяжелые ( Li –самый легкий, (осмий – самый K , Na, Mg) тяжёлый Ir, Pb)
Слайд 22
Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются M o – ne =M n+ Al, Be, Mg, Ca, Li, Na, K, Rb, Cs Восстановительная способность возрастает
Слайд 23
Взаимодействуют с простыми веществами С элементами VII группы (при обычных условиях) 2Na + Cl 2 = 2 Na Cl – С элементами VI группы (труднее) Mg + O 2 = 2Mg O C элементами V группы (в жестких условиях) 3Ca + 2P =Ca 3 P 2
Слайд 24
Взаимодействие со сложными веществами С растворами кислот (металлы, стоящие в ряду напряжений до «Н») Zn + H 2 SO 4 = Zn S O 4 + H 2 ↑ C растворами солей металлов, стоящих в ряду напряжений правее Zn + Pb(NO 3 ) 2 = Zn(NO 3 ) 2 + Pb C водой (активные) 2Na + 2H 2 O =2Na OH + H 2 ↑ Реакция идет в том случае, если образуется растворимое основание.
Слайд 25
Причины коррозии металлов . Наличие примесей в металлах, их неоднородность. Наличие во внешней среде агрессивных компонентов ( кислорода, воды, оксидов серы, оксидов углерода, водных растворов солей и кислот). 3. Прохождение во внешней среде физико-химических процессов ( растворения, электролиза). Адсорбция поверхностно активных веществ. 5. Различная активность металлов в ряду напряжения. Воздействие биологических объектов.
Слайд 26
Классификация коррозийных процессов. Коррозия металлов По виду коррозионной среды По процессам По характеру разрушений – газовая – атмосферная – почвенная – жидкостная (кислотная, солевая, щелочная) – химическая – электро- химическая – равномерная – неравномерная (избирательная, местная)
Слайд 27
Химическая коррозия металлов. Взаимодействие металлов с сухими газами и жидкостями – неэлектролитами вызывает химическую коррозию. Такому виду коррозии подвергаются турбины, арматура печей, детали двигателей внутреннего сгорания. На практике этот вид коррозии редок. Сущность коррозии: Meº – nē Me+n Переход атома металла в ионное состояние.
На практике этот вид коррозии редок. Сущность коррозии: Meº – nē Me+n Переход атома металла в ионное состояние.
Слайд 28
Электрохимическая коррозия. Электрохимическая коррозия – это все случаи коррозии, идущие в присутствии воды и жидкостей- электролитов. 1. Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего примеси. 2. Более активный металл(анод) разрушается. 3. Скорость коррозии тем больше, чем сильнее отличаются металлы (чем дальше друг от друга расположены в ряду напряжений ).
Слайд 29
Условия, способствующие электрохимической коррозии. Чем дальше друг от друга в ряду активности расположены контактирующие металлы, тем быстрее и активнее идет коррозия. Ускоряют коррозию: примеси, неровности поверхности и трещины, повышение температуры. Действие агрессивной внешней среды (морская вода, грунтовые воды, среда электролита). 4. Действие микроорганизмов (грибы, бактерии, лишайники).
Слайд 30
Механизм электрохимической коррозии.
Слайд 31
Ущерб народному хозяйству, наносимый коррозией. Общее количество металла произведенного за год человеком. Потеря металла в результате коррозии в год. 10 – 12 %
Слайд 32
Основные методы защиты металлов от коррозии. Применение защитных покрытий Металлические изделия покрывают другими металлами: хромирование оцинковывание золочение Металлические изделия покрывают неметаллическими слоями: лаками красками эмалями
Слайд 33
Обобщения, выводы. Коррозия – окислительно – восстановительный процесс. Коррозия бывает химической и электрохимической. В случае электрохимической коррозии всегда образуется электрический ток. Более активный металл выступает в роли анода; менее активный – катода.
Слайд 34
Получение металлов Пирометаллургический способ – восстановление углеродом, оксидом углерода ( II ), водородом при высокой температуре. Алюминотермический способ – восстановление металлов с помощью алюминия. Гидрометаллургический способ – получение из руды более активным металлом или из растворов Электролиз – с помощью электрического тока из расплавов или растворов
Слайд 35
Подведем итоги изучения темы занятия: Тест по теме Выбираем один правильный ответ: 1. Все металлы: восстановители; окислители; не изменяют степеней окисления;
Все металлы: восстановители; окислители; не изменяют степеней окисления;
Слайд 36
Подведем итоги изучения темы занятия : 2. Самый большой радиус атома имеет металл: литий; мышьяк; уран;
Слайд 37
Подведем итоги изучения темы занятия : Наименьшей электроотрицательностью обладает: дубний; натрий; марганец;
Слайд 38
Подведем итоги изучения темы занятия : 4.Восстановительные свойства наиболее ярко выражены у металла: магния; полония; франция;
Слайд 39
Подведем итоги изучения темы занятия : 5. Самый большой заряд ядра имеет атом металла: индий; лантан; актиний;
Слайд 40
Подведем итоги изучения темы занятия : 6.Во всех металлах вид химической связи: ионная; металлическая; ковалентная;
Слайд 41
Подведем итоги изучения темы занятия : 7.Наиболее пластичным является металл: золото; натрий; ртуть;
Слайд 42
Подведем итоги изучения темы занятия : 8. Наибольшей отражательной способностью обладает: палладий; кальций; хром;
Слайд 43
Подведем итоги изучения темы занятия : 9. Наибольшую электрическую проводимость имеет металл: свинец; медь; марганец;
Наибольшую электрическую проводимость имеет металл: свинец; медь; марганец;
Слайд 44
Подведем итоги изучения темы занятия : 10. Самый легкий металл: литий; кальций; калий;
Слайд 45
Подведем итоги изучения темы занятия : 11. Самый тяжелый металл: свинец; осмий; вольфрам;
Слайд 46
Подведем итоги изучения темы занятия : 12.Самый твердый металл: хром; полоний; калий;
Слайд 47
Подведем итоги изучения темы занятия : 13.К ферромагнетикам относят: гадолиний; рубидий; барий;
Слайд 48
Подведем итоги изучения темы занятия : 14. К благородным металлам относят: платина; аргон; железо;
Слайд 49
Подведем итоги изучения темы занятия : 15 Натрий взаимодействует с: кислородом, галогенами, водородом; кислородом, инертными газами, водородом; азотом, кислородом, оксидом лития;
Слайд 50
Эталоны ответов № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 вопрос a c c c c b a a b c b a a a a
Слайд 51
Критерии оценки: 2 ошибки-оценка 4 3ошибки- оценка 3 4 ошибки и более-оценка 2
Слайд 52
1. Сегодня я узнал… 2. На занятии мне было трудно… 3. Сегодня я понял … 4. Сегодня я научился… 5. Сегодня я смог … 6. Сегодня мне было интересно узнать, что… 7. Сегодня меня удивило … 8. Изучив эту тему, мне захотелось …
Сегодня я узнал… 2. На занятии мне было трудно… 3. Сегодня я понял … 4. Сегодня я научился… 5. Сегодня я смог … 6. Сегодня мне было интересно узнать, что… 7. Сегодня меня удивило … 8. Изучив эту тему, мне захотелось …
Слайд 53
Домашнее задание Габриелян О.С, Остроумов И.Г., Остроумова Е.Е. и др. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений сред.проф. образования. § 8 .2 № 1,3
Слайд 54
Спасибо за внимание
Предотвращение коррозии металла — APX York Sheet Metal
Предотвращение коррозии металла
Когда вы слышите термин «коррозия», вы, скорее всего, думаете о старом ржавом металле. Вы можете подумать об оранжево-коричневых тонах старого колеса телеги или о красноватых оттенках разрушающегося корпуса корабля, нуждающегося в покраске. Или вы можете увидеть автомобильные кладбища, где некогда классические автомобили ржавеют до своего первоначального железного состояния.
Коррозия является естественным явлением, которое со временем происходит со всеми металлическими изделиями. То, что вы могли бы назвать «ржавлением», — это всего лишь одна из форм коррозии, при которой изделия из железа и стали окисляются в присутствии кислорода и воды. Многие другие металлы подвержены угрозе коррозии, включая алюминий, латунь, бронзу и даже самые высокие сорта нержавеющей стали. К счастью, коррозию металла можно предотвратить. Защита от коррозии может сэкономить американской экономике огромные суммы, ежегодно теряемые природным энергетическим циклом, заложенным в металле.
Национальная ассоциация инженеров-коррозионистов (NACE) считается всемирным авторитетом в области коррозии, члены которой по всему миру совместно работают над решениями по борьбе с коррозией. Согласно их международному исследованию IMPACT 2016 года, ущерб от коррозии ежегодно обходится в 2,5 триллиона долларов США — значительную сумму, которую можно было бы сэкономить с помощью надлежащих методов защиты от коррозии.
Несмотря на то, что коррозия наносит огромный ущерб мировой экономике, борьбе с коррозией и ее предотвращению уделяется мало внимания. Коррозия затрагивает почти каждую часть повседневной инфраструктуры от транспорта до поставщиков коммунальных услуг. Это также может привести к катастрофическим событиям, таким как авиакатастрофы и поломки мостов, которые стоят денег и человеческих жизней. Предотвращение коррозии металлов и ее далеко идущих последствий начинается с понимания причин коррозии.
Что вызывает коррозию?
Чтобы понять причины коррозии, необходимо знать, что такое коррозия. Консультативный совет по материалам Национальной академии (NMAB) определяет коррозию в двух отчетах Национального исследовательского совета. Коррозия — это ухудшение или ухудшение физических свойств материала в результате химических реакций в окружающей среде. Хотя неметаллические материалы, такие как стекло, пластик и керамика, технически могут подвергаться коррозии, наиболее распространенные процессы коррозии происходят с промышленными металлами.
Термин «коррозия» происходит от латинского слова corrodere , означающего «разгрызать на куски», которое имеет аналогичный корень слова «грызун». Коррозия — это медленное разрушение или разъедание вещей, которое имеет буквальное применение, например, с ржавлением или абстрактными последствиями, такими как разъедание эмоций или отношений. В материальном мире наибольший риск коррозии представляет металл.
Окисление является наиболее распространенной формой коррозии металлов. Окислительная коррозия возникает, когда металлические предметы реагируют с кислородом и жидкой средой, такой как воздух или вода, чтобы сформировать более стабильное термодинамическое состояние. Синтетические металлы представляют наибольший риск коррозионного окисления, потому что они были изменены по сравнению с исходным состоянием руды путем добавления энергии для создания новых соединений и сплавов.
Эти промышленные продукты существуют в более высоком энергетическом состоянии, чем когда-то были их руды. В рамках естественного цикла эти материалы высвобождают энергию в результате коррозии, возвращаясь к своему первоначальному состоянию в течение длительного времени. Когда атомы металлов, таких как железо, подвергаются окислению, они высвобождают отрицательно заряженные ионы, которые накапливаются в материале и усугубляют коррозионный процесс. В самой основной форме коррозия представляет собой электрохимический процесс. Однако есть разные причины.
В рамках естественного цикла эти материалы высвобождают энергию в результате коррозии, возвращаясь к своему первоначальному состоянию в течение длительного времени. Когда атомы металлов, таких как железо, подвергаются окислению, они высвобождают отрицательно заряженные ионы, которые накапливаются в материале и усугубляют коррозионный процесс. В самой основной форме коррозия представляет собой электрохимический процесс. Однако есть разные причины.
Основные причины коррозии металлов
В общем, может возникнуть пять основных причин коррозии металла, а также некоторые другие менее распространенные причины. Каждый содействующий фактор может действовать отдельно или в унисон с другим. Все это происходит везде, где металл имеет активную среду, подходящую для возникновения коррозии.
1. АТМОСФЕРНАЯ КОРРОЗИЯ
Безусловно, наиболее распространенной формой является атмосферная коррозия. Ее также называют равномерной или общей коррозией. Именно здесь происходит окисление всей поверхности металлического предмета, подвергающегося воздействию атмосферных условий. Эти условия включают воздух или кислород, влажность, такую как дождь, снег, лед или роса, солнечный свет, переносимые по воздуху загрязнители и колебания температуры. Хотя атмосферная коррозия обычно происходит на открытом воздухе, одни и те же процессы происходят под землей и под водой.
Эти условия включают воздух или кислород, влажность, такую как дождь, снег, лед или роса, солнечный свет, переносимые по воздуху загрязнители и колебания температуры. Хотя атмосферная коррозия обычно происходит на открытом воздухе, одни и те же процессы происходят под землей и под водой.
2. ГАЛЬВАНИЧЕСКАЯ КОРРОЗИЯ
Эта причина коррозии возникает, когда два разнородных металла электрически взаимодействуют при их соединении в изготовленном узле. Гальваническая коррозия или биметаллическая коррозия возникает, когда один материал создает электрический заряд, который передается другому, вызывая электрохимическое событие. Термины «благородный» и «активный» связаны с гальванической коррозией. Благородные металлы (катодные) более инертны, чем активные (анодные) металлы. Чем дальше разнесены катодные и анодные электрохимические реакции, тем быстрее они разрушают пораженный металл.
3. ТРЕЩЕВАЯ КОРРОЗИЯ
Это распространенная причина коррозии изделий, изготовленных из металла. Каждое собранное изделие имеет щели, такие как стыки или швы, восприимчивые к агрессивным условиям, вызывающим коррозию. Эти щели также могут быть трещинами, расколами или зазорами, возникающими в результате износа в течение жизненного цикла металлического предмета. Щели в экранированных зонах подвержены наибольшему риску коррозии. Эти микроокружения создают идеальные условия для задержанной влаги, застойных растворов и обедненного кислорода. Нередко щели загрязняются хлоридом или солью, что значительно ускоряет коррозионные электрохимические реакции.
Каждое собранное изделие имеет щели, такие как стыки или швы, восприимчивые к агрессивным условиям, вызывающим коррозию. Эти щели также могут быть трещинами, расколами или зазорами, возникающими в результате износа в течение жизненного цикла металлического предмета. Щели в экранированных зонах подвержены наибольшему риску коррозии. Эти микроокружения создают идеальные условия для задержанной влаги, застойных растворов и обедненного кислорода. Нередко щели загрязняются хлоридом или солью, что значительно ускоряет коррозионные электрохимические реакции.
4. ЯЗЫЧНАЯ КОРРОЗИЯ
Точечная коррозия обычно возникает на внешней стороне металлического объекта, когда он равномерно подвергается воздействию атмосферных условий, но поверхность была защищена пленкой, такой как гальваническое покрытие, краска или порошковое покрытие. Со временем крошечные отверстия прорывают защитное покрытие или прорывают его, что позволяет воде, химическим веществам и кислороду проникать под поверхность. Это также создает мини-окружение под пленкой, практически невидимое невооруженным глазом. Эти ямки растут под поверхностью пленки, пока не покроются пузырями. К тому времени коррозия вызвала значительные структурные повреждения.
Это также создает мини-окружение под пленкой, практически невидимое невооруженным глазом. Эти ямки растут под поверхностью пленки, пока не покроются пузырями. К тому времени коррозия вызвала значительные структурные повреждения.
5. МИКРОБНАЯ КОРРОЗИЯ
Эта форма коррозии возникает, когда незащищенный металл остается в контакте с шламом или почвой. Как воздухоносные (аэробные), так и воздушно-пустотные (анаэробные) условия приводят к коррозионному действию. Чрезмерное присутствие воды ускоряет рост микробов, которые буквально «разъедают» металл. Наиболее агрессивными микробами являются сульфатредуцирующие бактерии. Они могут за короткое время разрушить незащищенное металлическое изделие, если не будут приняты меры электрохимического контроля.
6. ДРУГИЕ ПРИЧИНЫ КОРРОЗИИ
Существуют также менее известные и более редкие причины коррозии. Одним из них является высокотемпературная коррозия, которая происходит, когда металлические предметы постоянно подвергаются сильному нагреву. Ярким примером являются выхлопные отверстия реактивного двигателя. Мета-пыление является еще одной причиной коррозии. Это происходит в условиях высокого содержания углерода и сернистого газа, когда металл быстро подвергается коррозии, превращаясь в мелкий порошок. Распад сварных швов и удары ножом также вызывают коррозию металлического оборудования. Здесь отверстия в швах допускают попадание веществ, вызывающих коррозию.
Ярким примером являются выхлопные отверстия реактивного двигателя. Мета-пыление является еще одной причиной коррозии. Это происходит в условиях высокого содержания углерода и сернистого газа, когда металл быстро подвергается коррозии, превращаясь в мелкий порошок. Распад сварных швов и удары ножом также вызывают коррозию металлического оборудования. Здесь отверстия в швах допускают попадание веществ, вызывающих коррозию.
Коррозия — естественный процесс. Разрушение металла неизбежно и является частью энергетического цикла природы. Это если производители и ремонтники металлов не предпримут превентивные меры для сохранения своей продукции.
Как предотвратить коррозию металла
Ключом к предотвращению коррозии металла является остановка или замедление электрохимических сил, вызывающих коррозию. Некоторые металлы более подвержены коррозии, чем другие. Одним из основных факторов предотвращения коррозии является выбор металлической основы с низким риском коррозии с учетом ее предполагаемого применения и окружающей среды, в которой она используется.
Также крайне важно оценить, какие причины коррозии могут выдержать изделие, чтобы предотвратить электрохимическое разрушение. Надземные приложения имеют самые высокие атмосферные условия, которые угрожают продукту. Как правило, лучшая защита от коррозии — это верхнее покрытие, такое как краска или запекаемый порошок. Подземные приложения также выигрывают от использования, но они обычно нуждаются в антигальванической обработке, чтобы остановить электрическую активность.
Коррозия металла может быть неизбежной при правильном времени и условиях. Однако коррозионные и инженерные исследования позволили найти краткосрочные и среднесрочные решения для замедления кинетического процесса, вызывающего коррозию и ложащегося экономическим бременем на общество. Вот основные типы методов предотвращения коррозии, с которыми работают ученые и инженеры:
- Дизайн продукта: Ученые и инженеры постоянно совершенствуют существующие технологии и разрабатывают новые коррозионностойкие металлы.
 Это включает в себя разработку передовых компьютерных моделей, которые имитируют реальные условия без затрат времени и средств, необходимых для тестирования продуктов в реальных условиях. Конструкторские работы проходят ускоренные испытания в контролируемых условиях. Здесь недавно разработанные металлические сплавы обеспечивают наименьшую коррозионную активность металлов. Кроме того, тестирование передовых покрытий и отделки позволяет точно прогнозировать характеристики без необходимости проведения полевых испытаний.
Это включает в себя разработку передовых компьютерных моделей, которые имитируют реальные условия без затрат времени и средств, необходимых для тестирования продуктов в реальных условиях. Конструкторские работы проходят ускоренные испытания в контролируемых условиях. Здесь недавно разработанные металлические сплавы обеспечивают наименьшую коррозионную активность металлов. Кроме того, тестирование передовых покрытий и отделки позволяет точно прогнозировать характеристики без необходимости проведения полевых испытаний. - Снижение риска: Одни и те же инструменты проектирования изделий и базы данных позволяют металлургам снижать риск отказа изделия в реальном времени. На протяжении многих лет снижение риска коррозии стало результатом длительного изучения и опыта того, какие металлические сплавы и защитные покрытия проявляют наименьшее коррозионное воздействие. Сегодня снижение риска начинается с применения правильных коррозионно-стойких металлов в рабочей среде, а затем с подбора правильной защиты в виде покрытий и электрохимического заземления.

- Обнаружение коррозии: Металлисты и инженеры-конструкторы контролируют существующие продукты, здания и компоненты инфраструктуры для обнаружения коррозии на разных стадиях. Высокотехнические датчики и удаленные мониторы предоставляют информацию о коррозионных реакциях, которые просто не могут быть обнаружены человеческим зрением и прикосновением. Обнаружение коррозии металлов играет большую роль в профилактических программах. Оценка текущих коррозионных повреждений, обнаруженных в существующих материалах, дает прогноз для прогнозирования деградации и предотвращения серьезных отказов.
- Прогноз коррозии: Исследования и разработки, а также методы обнаружения и смягчения последствий позволяют научным моделям прогнозировать, какие металлические изделия будут противостоять воздействиям окружающей среды. Научные данные также позволяют разработчикам прогнозировать, какие материалы обречены на провал. Прогнозы, основанные на свойствах металлов, распространяются на предоставление точных рецептов коррозионно-стойких покрытий и способов их успешного применения для защиты продуктов.
 Благодаря прогнозам, основанным на информации, лучшие материалы и лучшие защитные покрытия продолжают развиваться и делают мир более безопасным.
Благодаря прогнозам, основанным на информации, лучшие материалы и лучшие защитные покрытия продолжают развиваться и делают мир более безопасным.
Какие металлы вызывают наибольшую и наименьшую коррозию?
Истинные металлы редко встречаются в запасах полезных ископаемых Земли. Большинство настоящих металлов, таких как золото, серебро и платина, по своей природе не вызывают коррозии. Они по своей природе устойчивы к коррозии и пользуются большим спросом, поэтому они могут быть такими дорогими.
Другие металлы, такие как медь, алюминий и латунь, также обладают отличной коррозионной стойкостью. Этих материалов больше, чем драгоценных металлов, и они менее затратны по объему. Недостатком латуни, меди и алюминия является то, что для их переработки в полезные продукты требуется значительное количество энергии. Эта энергия накапливается в их молекулярном составе и делает их уязвимыми для природной программы рециркуляции энергии электрохимической коррозии.
Медь — интересный металл. Он находится в относительно большом количестве и с ним легко работать. Однако медь не нуждается в покраске или порошковом покрытии, чтобы защитить ее от коррозии. При контакте с воздухом и водой медь создает собственную защиту, называемую пассивацией. Вспомните знаменитую достопримечательность Америки — Статую Свободы. Его медное покрытие имеет богатую зеленоватую патину, которая естественным образом противостоит коррозии без дополнительной помощи.
Он находится в относительно большом количестве и с ним легко работать. Однако медь не нуждается в покраске или порошковом покрытии, чтобы защитить ее от коррозии. При контакте с воздухом и водой медь создает собственную защиту, называемую пассивацией. Вспомните знаменитую достопримечательность Америки — Статую Свободы. Его медное покрытие имеет богатую зеленоватую патину, которая естественным образом противостоит коррозии без дополнительной помощи.
Алюминий также образует пассивирующий защитный слой. Без сероватой и пятнистой патины блестящий необработанный алюминий несколько вызывает коррозию. Судостроители часто используют алюминий для корпусов и надстроек, отчасти потому, что алюминий легкий, а отчасти потому, что он хорошо работает с продуктами, называемыми расходуемыми анодами. Эти небольшие цинковые или магниевые блоки или аноды поглощают коррозионные электрохимические реакции алюминия и жертвуют собой, сначала подвергаясь коррозии.
Из-за угрозы коррозии даже стойкие металлы, такие как алюминий, часто покрываются защитным слоем. Многие алюминиевые изделия, предназначенные для атмосферного воздействия, проходят обработку на этапе производства. На алюминиевые строительные изделия, такие как сайдинг и водосточные желоба, нанесено порошковое покрытие, которое сохраняется в течение многих лет воздействия суровых погодных условий.
Многие алюминиевые изделия, предназначенные для атмосферного воздействия, проходят обработку на этапе производства. На алюминиевые строительные изделия, такие как сайдинг и водосточные желоба, нанесено порошковое покрытие, которое сохраняется в течение многих лет воздействия суровых погодных условий.
Прочие металлические сплавы хорошо противостоят коррозионным условиям. Нержавеющая сталь представляет собой смесь железа и хрома. Несмотря на коррозионную стойкость нержавеющей стали, изделия, изготовленные из нержавеющей стали, часто требуют нанесения защитных покрытий или регулярного антикоррозионного обслуживания. Вот список распространенных металлов, от наиболее до наименее коррозионных металлов:
- Магний и сплавы: Либо, либо сброшенные, либо издевавшие
- Цинк и сплавы: , вылетел, не нанесенный на лифу или выделению
- : . как нержавеющая сталь
- Алюминий: Плавленный или с кадмиевым покрытием
- Свинец: Цельный или с покрытием
- Олово: Необработанное и припаянное свинцом
- Нержавеющая сталь7: Используется для легированной стали
- Brass: Including bronze and alloys
- Copper: Solid or plated
- Nickel: Including titanium alloys
- Silver: Solid or plated
- Gold: Solid or plated
- Platinum : Включая золото-платиновые сплавы
Лучшие металлы для использования
В большинстве случаев можно использовать четыре надежных и экономичных металла. Каждый из них имеет свои свойства, и выбор металла зависит от вашего конкретного применения. Это может быть изготовление на заказ листового металла, изготовление корпуса на заказ, изготовление из стали или алюминия. Независимо от вашей цели, выбор лучшего металла для использования всегда включает в себя обеспечение надлежащей отделки, такой как порошковое покрытие.
Каждый из них имеет свои свойства, и выбор металла зависит от вашего конкретного применения. Это может быть изготовление на заказ листового металла, изготовление корпуса на заказ, изготовление из стали или алюминия. Независимо от вашей цели, выбор лучшего металла для использования всегда включает в себя обеспечение надлежащей отделки, такой как порошковое покрытие.
Порошковое покрытие — это исключительно надежный процесс защиты от коррозии. Это включает в себя подачу питания на чистый металлический продукт и распыление на него сухого порошка. Электростатическая реакция позволяет порошку прилипать или прилипать к продукту. После этого металлический продукт поступает в духовку, где запекается при температуре 400 градусов по Фаренгейту. Металл с порошковым покрытием является одним из самых экономичных и долговечных способов обработки металлов, доступных на сегодняшний день.
APX York Sheet Metal обеспечивает первоклассное изготовление металла и порошковое покрытие. Наши услуги включают проектирование продукции, гибку металла, прокатку металла, лазерную резку, механическую обработку, резку металла и сварку. Сопротивление коррозии является одним из главных приоритетов APX York Sheet Metal, поэтому мы всегда используем эти четыре лучших металла для создания коррозионно-стойких продуктов:
Сопротивление коррозии является одним из главных приоритетов APX York Sheet Metal, поэтому мы всегда используем эти четыре лучших металла для создания коррозионно-стойких продуктов:
- Оцинкованная сталь
- Углеродистая сталь
- Нержавеющая сталь
- Алюминий
Связаться с APX York Sheet Metal
Мы гордимся тем, что являемся ведущим производителем металлоконструкций на заказ в центральной Пенсильвании и на севере Мэриленда. За более чем 70 лет существования APX York Sheet Metal заработала репутацию благодаря превосходству и надежности как в производстве листового металла, так и в обслуживании клиентов. Как ценный клиент, вы сталкиваетесь с короткими сроками выполнения заказов и растущими затратами. В APX York Sheet Metal мы понимаем это и стремимся обеспечить низкую стоимость и короткие сроки выполнения работ.
Свяжитесь с APX York Sheet Metal сегодня для всех ваших коррозионностойких металлических работ. Нам достаточно позвонить по телефону 717-767-2704, или вы всегда можете связаться с нами онлайн.
Стратегии проектирования для обеспечения коррозионной стойкости
Время чтения: 6 мин.
Коррозия — обычное явление: где есть металл, там будет и ржавчина. С научной точки зрения, коррозия — это химический процесс, в ходе которого очищенные металлы превращаются в более химически стабильную форму.
Четыре основных компонента, присутствующих в домашней среде, вызывают коррозию: химически активный металл, воздух, влага и электролиты. И хотя быстрое распыление WD-40 борется с коррозией, от залипших замочных скважин до застрявших петель, чтобы действительно избежать коррозии, нам нужно начать с конструкции.
Знание причин коррозии облегчит проектирование против нее. В этой статье рассматриваются стратегии повышения коррозионной стойкости металла. Одно примечание: существует несколько нетрадиционных типов коррозии, связанных с микробной активностью полимера, которые мы не будем рассматривать в этом посте.
Пассивное покрытие не пропускает воду и соль Велосипеды — отличный пример того, как можно создать продукт, устойчивый к коррозии.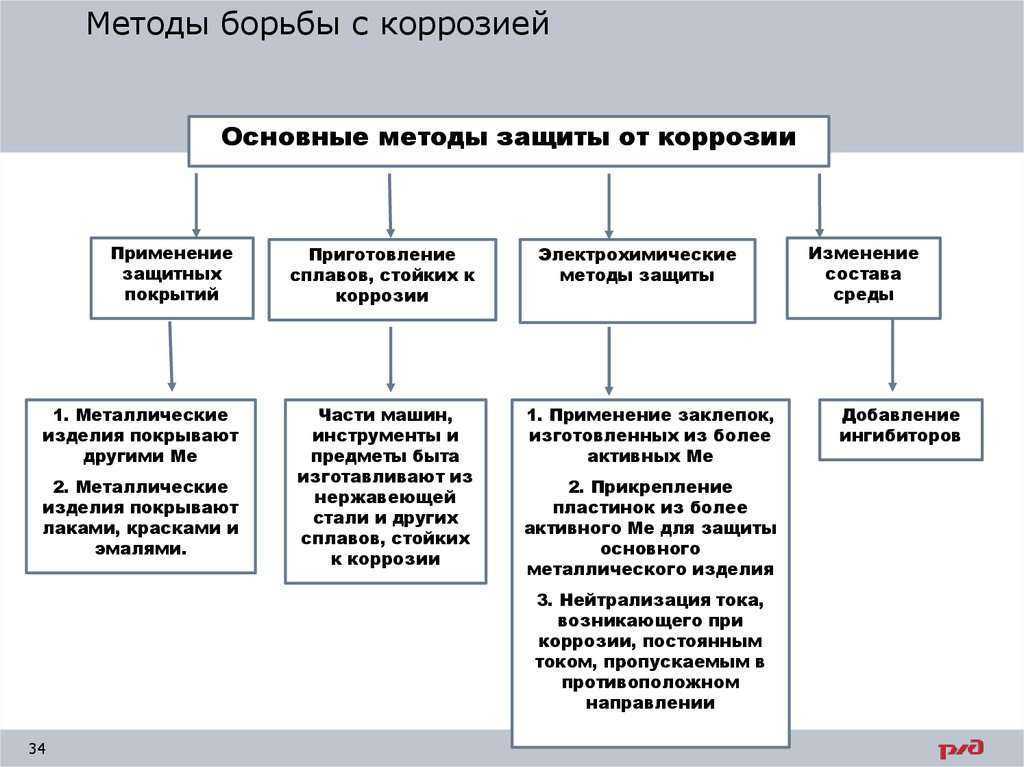 Велосипеды, обычно изготавливаемые из стали, алюминия и углеродного волокна, также регулярно подвергаются воздействию непогоды. Дождь + дорожная пыль = вода + электролиты = коррозия. Добавление физического барьера для предотвращения прямого контакта с внешней средой помогает контролировать коррозию; варианты включают покраску, порошковое покрытие, виниловую пленку, анодирование и даже вощение. Эти методы, называемые пассивным покрытием, служат для защиты от воды и соли, предотвращая коррозию, и важно планировать их при разработке продуктов, которые, как вы знаете, будут проводить время на открытом воздухе.
Велосипеды, обычно изготавливаемые из стали, алюминия и углеродного волокна, также регулярно подвергаются воздействию непогоды. Дождь + дорожная пыль = вода + электролиты = коррозия. Добавление физического барьера для предотвращения прямого контакта с внешней средой помогает контролировать коррозию; варианты включают покраску, порошковое покрытие, виниловую пленку, анодирование и даже вощение. Эти методы, называемые пассивным покрытием, служат для защиты от воды и соли, предотвращая коррозию, и важно планировать их при разработке продуктов, которые, как вы знаете, будут проводить время на открытом воздухе.
Вы можете сделать свою конструкцию устойчивой к коррозии, приняв во внимание потребность в пассивном покрытии, которое производители велосипедов используют для повышения коррозионной стойкости. Велосипедные рамы окрашены так, чтобы образовался защитный слой — окрашивание на чистой сухой поверхности означает, что влага не может попасть под покрытие.
Если вы разрабатываете такой продукт, как велосипедные стойки, многие из которых сделаны из алюминия, вам нужно запланировать порошковое покрытие продукта, чтобы избежать точечной коррозии, которая может возникнуть, когда алюминий поцарапан и контактировал с водой. Порошковое покрытие выполняется путем электростатического распыления слоя сухого порошка (термопласт или термореактивный пластиковый полимер).
При порошковой окраске пистолет для порошковой окраски имеет положительный заряд, а заготовка заземлена. Эта электрическая разница направляет крошечные частицы к заготовке, что-то вроде эксперимента с воздушным шаром, который вы, возможно, проводили в школе. Это обеспечивает равномерное покрытие, за которым следует сеанс отверждения.
Изображение источник Виниловая упаковка Вы рассчитываете на безопасность своего U-образного замка и не хотите, чтобы он подвергался коррозии, поэтому большинство производителей U-образных замков оборачивают замки виниловой пленкой, чтобы защитить их. из элементов — и как дизайнер вы захотите это спланировать. Виниловая упаковка похожа на термоусадочную пленку; нагревание применяется после того, как U-образный замок закрыт винилом (см. черную U-образную трубку на изображении ниже).
из элементов — и как дизайнер вы захотите это спланировать. Виниловая упаковка похожа на термоусадочную пленку; нагревание применяется после того, как U-образный замок закрыт винилом (см. черную U-образную трубку на изображении ниже).
Нержавеющая сталь и алюминий, обработанный на станках с ЧПУ, обладают свойством образовывать защитный оксидный слой. Однако в естественной форме этот слой оксида имеет толщину всего около 4 нм. Анодирование металла — это способ обеспечить дополнительную защиту от коррозии и износа, поэтому обязательно добавьте это в свои планы для стальных и алюминиевых изделий.
В некоторых случаях анодирование используется в качестве декоративного элемента, позволяя дизайнерам добавлять различные оттенки цвета. Apple делает это со своими устройствами разного цвета: Space Grey, Rose Gold и Gold.
Анодирование осуществляется путем помещения заготовки в разбавленный раствор. Заготовка подключается к электрической цепи, где она является анодом. Положительные ионы кислорода будут притягиваться к заготовке, создавая на заготовке дополнительный оксидный слой.
Активное покрытие обеспечивает прочный физический барьер Оцинковка При разработке продуктов, устойчивых к коррозии, вы можете иметь в виду, что оцинковка обеспечивает более сильный физический барьер, чем пассивное покрытие, путем образования химической связи с физической подложкой изделия. материал, а не просто покрытие поверхности. Эта химическая связь намного прочнее, чем то, что может предложить пассивное покрытие, с прочностью связи 3000 фунтов на квадратный дюйм. Лучше всего то, что он имеет двойное действие: он делает основной металл катодным, прикрепляя к поверхности более активный металл. Первым ржавеет тонкий слой покрытия, а не основной металл.
Цинкование лучше всего проводить после завершения всех вторичных процессов, так как любой новый разрез обнажает свежий металл, что позволяет образоваться ржавчине. Помимо столбов уличных фонарей и стальных мостов, оцинковка обычно выполняется на транспортных средствах и крепежных элементах для обеспечения коррозионной стойкости.
Горячее цинкование окунанием — это метод производства, требующий больших объемов. Процесс показан ниже. Каждый объект должен пройти каустическую очистку, за которой следует еще несколько этапов подготовки, прежде чем его погружают в цинковую ванну и охлаждают.
Источник изображенияОбеспечение гальванической совместимости
При разработке крепежа важно обеспечить гальваническую совместимость крепежа и объекта. По гальванической шкале более анодный металл более подвержен коррозии, и когда более анодный металл находится в контакте с металлом, находящимся ниже по шкале, коррозионная активность повышается. Чем больше несоответствие, тем выше скорость коррозии.
Чем больше несоответствие, тем выше скорость коррозии.
Таким образом, вы не хотите смешивать покрытия и металлы; если вы выбираете материал, оцинкованный горячим способом, используйте крепеж и метизы с тем же покрытием. Винты и заклепки являются наиболее часто используемыми методами крепления, и большинство из них сделаны из стали, которая оказывается ниже по гальванической шкале, поэтому вы должны знать об этом.
Если вы начнете комбинировать разные типы, есть шанс, что разные металлы начнут свои собственные коррозионные реакции — это именно то, что вы пытаетесь предотвратить. Нержавеющая сталь разрушает оцинкованную сталь, поэтому не устанавливайте оцинкованные листы с помощью шурупов из нержавеющей стали.
На самом деле, вы можете использовать гальваническую несовместимость в своих интересах. В морской промышленности жертвенные металлы используются для защиты корпусов кораблей от коррозии. Кусочки цинка крепятся прямо на корпус корабля, ниже ватерлинии. Это работает, преднамеренно позволяя коррозии жертвенного цинка вместо стального корпуса корабля.
Одним из способов повышения коррозионной стойкости является замена деталей подходящим инертным материалом, например пластиком. Раньше водопроводные трубы были металлическими, но с тех пор их заменили пластиковыми, как и подшипники. Вы можете избежать коррозии с пластиком, но с пластиком есть уникальные проблемы, такие как проблемы с УФ-разложением, кислотой и теплом, которые важно учитывать, хотя они не будут здесь рассматриваться.
Избегайте щелей в дизайнеНа приведенном ниже рисунке показано, как капли воды на корпусе изделия могут привести к образованию ржавчины. Когда поверхность реактивного металла намокает, концентрация кислорода ниже по сравнению с окружающей средой. Область вокруг капли становится катодом, а поверхность под ней — анодом.
Эта локализация электрической активности является причиной образования пятен ржавчины на кухонном тазу, что усугубляется при использовании нержавеющей стали более низкого качества. Вы можете спроектировать против этой формы коррозии, удалив ловушки, чтобы обеспечить равномерную концентрацию кислорода вокруг кузова.
Вы можете спроектировать против этой формы коррозии, удалив ловушки, чтобы обеспечить равномерную концентрацию кислорода вокруг кузова.
Мы можем поучиться у строительной отрасли, что лучше всего предотвращает щелевую коррозию. Полезны такие правила, как позволить воде и пыли свободно течь, но не застревать на поверхности. Конструкции упрощены, чтобы уменьшить количество щелей, а если щелей нельзя избежать, защита от атмосферных воздействий может помочь в борьбе с коррозией.
Другими словами, уменьшение количества соединительных деталей, покрытий и уплотнений может помочь избежать щелевой коррозии.
Источник изображения Основные выводы Важно понимать, что вызывает коррозию, и использовать стратегии повышения коррозионной стойкости металла в процессе проектирования вашего продукта. Включите планы покрытий, виниловой упаковки и цинкования в процесс проектирования вашего продукта при работе с металлами и избегайте щелей в вашем дизайне.


 Это включает в себя разработку передовых компьютерных моделей, которые имитируют реальные условия без затрат времени и средств, необходимых для тестирования продуктов в реальных условиях. Конструкторские работы проходят ускоренные испытания в контролируемых условиях. Здесь недавно разработанные металлические сплавы обеспечивают наименьшую коррозионную активность металлов. Кроме того, тестирование передовых покрытий и отделки позволяет точно прогнозировать характеристики без необходимости проведения полевых испытаний.
Это включает в себя разработку передовых компьютерных моделей, которые имитируют реальные условия без затрат времени и средств, необходимых для тестирования продуктов в реальных условиях. Конструкторские работы проходят ускоренные испытания в контролируемых условиях. Здесь недавно разработанные металлические сплавы обеспечивают наименьшую коррозионную активность металлов. Кроме того, тестирование передовых покрытий и отделки позволяет точно прогнозировать характеристики без необходимости проведения полевых испытаний.
 Благодаря прогнозам, основанным на информации, лучшие материалы и лучшие защитные покрытия продолжают развиваться и делают мир более безопасным.
Благодаря прогнозам, основанным на информации, лучшие материалы и лучшие защитные покрытия продолжают развиваться и делают мир более безопасным.