Валентность молибдена: Таблица менделеева – Электронный учебник K-tree
alexxlab | 14.07.2023 | 0 | Разное
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Валентность молибдена
Валентность молибдена.
Поделиться в:
Валентность молибдена:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.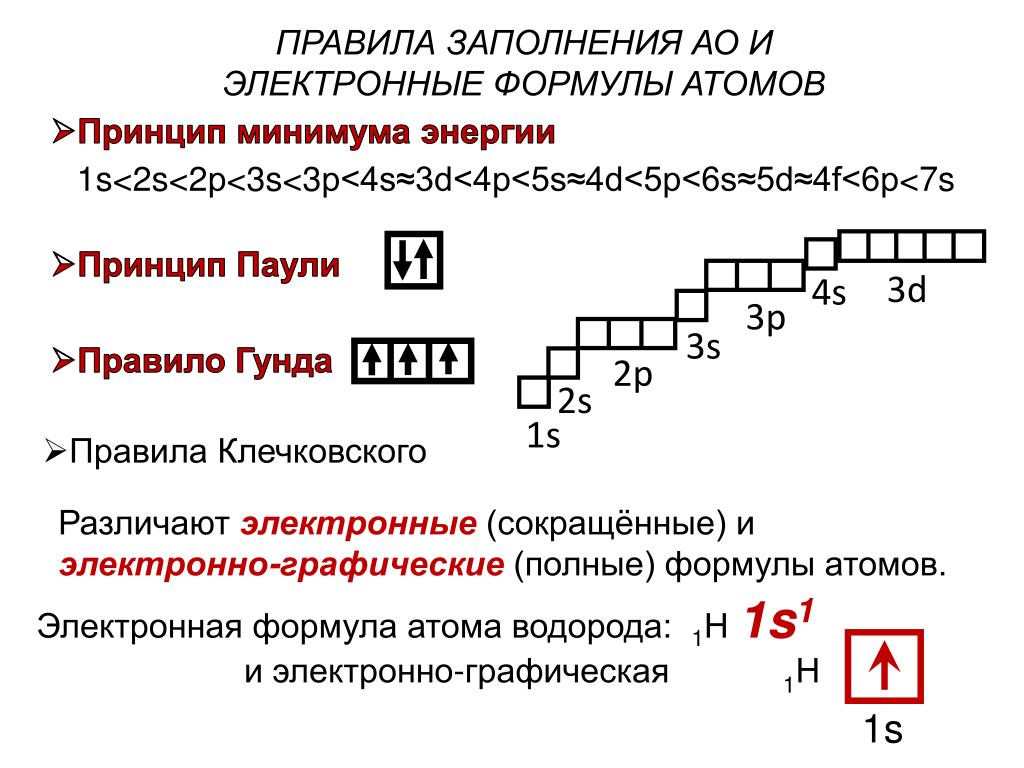
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность молибдена равна II, III, IV, V, VI. Молибден проявляет переменную валентность.
| Валентность молибдена в соединениях | |
| II | MoI2, MoCl2 |
| III | MoBr3, Mo(OH)3 |
| IV | MoO2, MoS2 |
| V | MoCl5 |
| VI | MoF6 |
Все свойства атома молибдена
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности 327
☢️ Валентные электроны в молибдене (Mo) [& Факты, Цвет, Открытие …
Валентный электрон представляет собой электрон внешней оболочки и может участвовать в образовании химической связи. Хорошо, но сколько валентных электронов имеет атом молибдена?
В случае молибдена валентные электроны равны 2,3,6. Теперь давайте проверим факты о молибдене…
Обзор молибдена
Молибден Валентные электроны
2,3,6
Атомный номер
42
Узнайте больше об атомном номере.
Атомная масса
95,94
Узнайте больше об атомной массе.
Атомный символ
Mo
Состояние при 20 °C
Твердый
Описание
Твердый серебристо-белый металл.
Применение
Его сплавы используются в самолетах, ракетах и защитных покрытиях в плитах котлов.
Название Происхождение
Греческий: молибдос (свинец).
Источники
Содержится в минералах молибдените (MoS2) и вульфените (MoO4Pb).
Открытие
Открыт: Карл Вильгельм Шееле
Год: 1778
Местонахождение: Швеция
Хотите узнать больше подробностей и данных о молибдене (Mo)? Проверьте мой полный список элементов.
Видео
У вас возникли проблемы с пониманием основ атомарных элементов? В этом видео вы узнаете:
- Что такое элемент
- Что такое вещество?
- На что похожи элементы? Может быть, добавить школьный логотип, рабочую команду или что-то еще, чтобы ваша газета выглядела круто?
Наряду с основной информацией об атоме/элементе (например, о валентных электронах молибдена и всеми другими атомными данными) он также имеет цветовую кодировку информации о: состоянии (газ, жидкость или твердое тело при комнатной температуре), деталях групп/серий и многом другом.
 …
…Как насчет поощрения поделиться этим постом? (Вы поможете другим коллегам найти этот блог)
Загрузите и наслаждайтесь этой полной и цветной периодической таблицей, которую вы можете редактировать и наслаждаться. Это редактируемый формат Excel или .ods (открытый).
[lock][Скачать excel ##download##]
[Скачать открытый формат .ods ##download##][/lock]Цитирование
Когда вам нужно включить факт или часть информации в задание или эссе, вы также должны указать, где и как вы нашли эту информацию.
Это придает достоверность вашей статье и иногда требуется в высших учебных заведениях.
Чтобы упростить себе жизнь (и цитирование), просто скопируйте и вставьте приведенную ниже информацию в свое задание или эссе:
Luz, Gelson. «Валентные электроны в молибдене (Mo) [и факты, цвет, открытие …» Материалы. Gelsonluz.com. дд мммм. гггг.
Теперь замените дд, мммм и гггг на день, месяц и год, когда вы просматривали эту страницу.
 Также замените URL-адрес фактическим URL-адресом этой страницы (< и > остаются, хорошо?). Этот формат цитирования основан на MLA.
Также замените URL-адрес фактическим URL-адресом этой страницы (< и > остаются, хорошо?). Этот формат цитирования основан на MLA.сообщите об этом объявлении
Введите что-нибудь и EnterМолибден (Mo) Электронная конфигурация и орбитальная диаграмма
Молибден является 42-м элементом в периодической таблице, и его символ — «Mo». В этой статье я подробно обсудил, как легко написать полную электронную конфигурацию молибдена. Я также обсуждал, как нарисовать и написать орбитальную диаграмму молибдена. Надеюсь, прочитав эту статью, вы узнаете больше об этой теме.
Какова электронная конфигурация молибдена?
Общее количество электронов в молибдене – сорок два. Эти электроны располагаются по определенным правилам на разных орбиталях. Расположение электронов в молибдене по определенным правилам на разных орбитах и орбиталях называется электронной конфигурацией молибдена.
The electron configuration of molybdenum is 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 5 5s 1 , если электроны расположены через орбитали.
 Электронная конфигурация может быть выполнена двумя способами.
Электронная конфигурация может быть выполнена двумя способами.- Электронная конфигурация через орбиту (принцип Бора)
- Электронная конфигурация через орбиталь (принцип Ауфбау)
Конфигурация электронов через орбитали следует другим принципам. Например, принцип Ауфбау, принцип Хунда и принцип запрета Паули.
Электронная конфигурация атома молибдена через орбиту
Ученый Нильс Бор первым дал представление об орбите атома. Он представил модель атома в 1913 году. Там дается полное представление об орбите.
Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти орбиты выражаются через n. [n = 1,2,3,4 . . . Порядковый номер орбиты]
K — название первой орбиты, L — второй, M — третьей, N — название четвертой орбиты. Электронная удерживающая способность каждой орбиты составляет 2n 2 .
Electron holding capacity of shellsShell Number (n) Shell Name Electrons Holding Capacity (2n 2 ) 1 K 2 2 L 8 3 M 18 4 N 32 For example,
- n = 1 для K-орбиты.

Максимальная емкость для электронов на K-орбите составляет 2n 2 = 2 × 1 2 = 2, - Для L-орбиты n = 2.
Максимальная емкость для электронов на L-орбите равна 2n 2 = 2 × 2 2 = 8, - n=3 для М-орбиты.
Максимальная вместимость электронов на М-орбите равна 2n 2 = 2 × 3 2 = 18, - n=4 для N-орбиты.
Максимальная вместимость электронов на N-орбите составляет 2n 2 = 2 × 4 2 = 32,
Таким образом, максимальная емкость удерживания электронов в первой оболочке равна двум, второй оболочке — восьми, а на третьей оболочке может быть максимум восемнадцать электронов. Атомный номер – это количество электронов в этом элементе.
Электронная конфигурация атома молибдена (модель Бора)Атомный номер молибдена равен 42. То есть число электронов в молибдене равно сорок двум. Следовательно, атом молибдена будет иметь два электрона на первой оболочке, восемь на 2-й орбите и восемнадцать электронов на 3-й оболочке.
Согласно формуле Бора, четвертая оболочка будет иметь двенадцать электронов, но четвертая оболочка молибдена будет иметь тринадцать электронов, а оставшийся один электрон будет в пятой оболочке.
Следовательно, порядок числа электронов в каждой оболочке атома молибдена(Мо) равен 2, 8, 18, 13, 1. Электроны могут быть правильно расположены по орбитам от элементов с 1 по 18.
Электронная конфигурация Элемент с атомным номером больше 18 не может быть правильно определен в соответствии с атомной моделью Бора. Электронная конфигурация всех элементов может быть сделана через орбитальную диаграмму.
Электронная конфигурация молибдена через орбиталь
Энергетические оболочки атома подразделяются на подэнергетические уровни. Эти подэнергетические уровни также называются орбитальными. Наиболее вероятная область вращения электрона вокруг ядра называется орбитальной.
Подэнергетические уровни зависят от азимутального квантового числа. Выражается буквой «л».
 Значение «l» от 0 до (n – 1). Подэнергетические уровни известны как s, p, d и f.
Значение «l» от 0 до (n – 1). Подэнергетические уровни известны как s, p, d и f.
Orbital number of the subshellOrbit Number Value of ‘l’ Number of subshells Number of orbital Subshell name Electrons holding capacity Electron configuration 1 0 1 1 1s 2 1s 2 2 0
12 1
32s
2p2
62s 2 2p 6 3 0
1
23 1
3
53s
3p
3d2
6
103s 2 3p 6 3d 10 4 0
1
2
34 1
3
5
7
4 с
4p
4d
4f2
6
10
144s 2 4p 6 4d 10 4f 14 For example,
- If n = 1,
(n – 1) = (1–1) = 0
Следовательно, значение ‘l’ равно 0. Итак, подэнергетический уровень равен 1s.
Итак, подэнергетический уровень равен 1s. - Если n = 2,
(n – 1) = (2–1) = 1.
Следовательно, значение «l» равно 0, 1. Таким образом, подэнергетические уровни равны 2s и 2p. - Если n = 3,
(n – 1) = (3–1) = 2.
Следовательно, значение «l» равно 0, 1, 2. Таким образом, уровни подэнергии 3s, 3p и 3д. - Если n = 4,
(n – 1) = (4–1) = 3
Следовательно, значение ‘l’ равно 0, 1, 2, 3. Итак, подэнергетические уровни 4s, 4p, 4г и 4е. - Если n = 5,
(n – 1) = (n – 5) = 4.
Следовательно, l = 0,1,2,3,4. Количество подоболочек будет 5, но 4s, 4p, 4d и 4f в этих четырех подоболочках можно расположить электроны всех элементов таблицы Менделеева.
Число электронов на орбиталиНаименование подсшейло. ) Electrons holding capacity
2(2l+1)s Sharp 0 0 1 2 p Principal 1 − 1, 0, +1 3 6 d Diffuse 2 −2, −1, 0, +1, +2 5 10 f Fundamental 3 −3, −2, −1, 0, +1, +2, +3 7 14 Орбитальное число s-подоболочки равно единице, трем в p-подоболочка, пять в d-подоболочке и семь в f-подоболочке.
 Каждая орбиталь может иметь максимум два электрона.
Каждая орбиталь может иметь максимум два электрона.Подэнергетический уровень «s» может содержать максимум два электрона, «p» может содержать максимум шесть электронов, «d» может содержать максимум десять электронов, а «f» может содержать максимум четырнадцать электронов. электроны.
Электронная конфигурация через принцип AufbauAufbau — это немецкое слово, означающее наращивание. Основными сторонниками этого принципа являются ученые Нильс Бор и Паули. Метод Ауфбау заключается в том, чтобы выполнить конфигурацию электрона через подэнергетический уровень.
Принцип Ауфбау заключается в том, что электроны, присутствующие в атоме, сначала завершают орбиталь с самой низкой энергией, а затем постепенно продолжают завершать орбиталь с более высокой энергией.
Энергия орбитали рассчитывается по значению главного квантового числа «n» и азимутального квантового числа «l». Орбиталь, для которой значение (n + l) ниже, является орбиталью с низкой энергией, и электрон выйдет на эту орбиталь первым.

Энергии. Таким образом, электрон сначала попадет на 4s-орбиталь, а затем перейдет на 3d-орбиталь, когда 4s-орбиталь будет заполнена. Метод ввода электронов на орбитали по принципу Ауфбау: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.Orbital Orbit (n) Azimuthal quantum number (l) Orbital energy (n + l) 3d 3 2 5 4S 4 0 4 Первые два электрона молибдена выходят на 1s-орбиталь. На s-орбитали может быть максимум два электрона. Следовательно, следующие два электрона переходят на 2s-орбиталь.

На p-орбитали может быть максимум шесть электронов. Итак, следующие шесть электронов переходят на 2р-орбиталь. Вторая орбита теперь заполнена. Итак, оставшиеся электроны выйдут на третью орбиту.
Тогда два электрона выйдут на 3s-орбиталь, а следующие шесть электронов окажутся на 3p-орбитали третьей орбитали. Теперь орбиталь 3p заполнена. Итак, следующие два электрона перейдут на 4s-орбиталь, а десять электронов перейдут на 3d-орбиталь.
3-я орбиталь заполнена. Итак, следующие шесть электронов переходят на 4р-орбиталь. Теперь орбиталь 4p заполнена. Затем следующие два электрона выйдут на 5s-орбиталь. Но орбиталь хочет быть наполовину или полностью заполненной электронами.
Потому что атом может находиться в более стабильном состоянии, когда орбиталь заполнена наполовину и полностью. Следовательно, электрон с 5s-орбитали завершает наполовину заполненную 4d-орбиталь, перескакивая на 4d-орбиталь.
Therefore, the molybdenum full electron configuration will be 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 5 5s 1 .
Электронная конфигурация молибдена Электронная конфигурация атомов хрома выполняется по этому правилу.
Электронная конфигурация атомов хрома выполняется по этому правилу.Примечание: Короткая электронная конфигурация молибдена [Kr] 4d 5 5s 1 . При записи электронной конфигурации вы должны писать последовательно.
Как написать орбитальную диаграмму для молибдена?
Чтобы построить орбитальную диаграмму атома, вам сначала нужно знать принцип Хунда и принцип запрета Паули.
Принцип Хунда заключается в том, что электроны на разных орбиталях с одинаковой энергией будут располагаться таким образом, чтобы они могли находиться в неспаренном состоянии максимального числа, а спин неспаренных электронов будет однонаправленным.
Принцип исключения Паули состоит в том, что значения четырех квантовых чисел двух электронов в атоме не могут быть одинаковыми. Чтобы написать орбитальную диаграмму молибдена (Мо), вы должны сделать электронную конфигурацию молибдена.
Подробно обсуждалось выше.
Орбитальная диаграмма молибдена 1s — ближайшая к ядру орбиталь с наименьшей энергией. Следовательно, электрон сначала выйдет на 1s-орбиталь.
1s — ближайшая к ядру орбиталь с наименьшей энергией. Следовательно, электрон сначала выйдет на 1s-орбиталь.Согласно принципу Хунда, первый электрон войдет в орбиту по часовой стрелке, а следующий электрон войдет на 1s-орбиталь в направлении против часовой стрелки. Орбиталь 1s теперь заполнена двумя электронами.
Затем следующие два электрона перейдут на 2s-орбиталь точно так же, как и на 1s-орбиталь. Следующие три электрона войдут на 2p-орбиталь по часовой стрелке, а следующие три электрона войдут на 2p-орбиталь в направлении против часовой стрелки.
Следующие два электрона перейдут на 3s-орбиталь, как и на 1s-орбиталь, а затем следующие шесть электронов перейдут на 3p-орбиталь, как на 2p-орбиталь. Теперь орбиталь 3p заполнена. Итак, следующие два электрона попадут на 4s-орбиталь точно так же, как и на 1s-орбиталь.
4s-орбиталь заполнена. Следовательно, следующие пять электронов войдут на 3d-орбиталь по часовой стрелке, а следующие пять электронов войдут в 3d-орбиталь против часовой стрелки.
 Трехмерная орбиталь теперь заполнена. Итак, следующие шесть электронов попадут на 4p-орбиталь точно так же, как и на 3p-орбиталь.
Трехмерная орбиталь теперь заполнена. Итак, следующие шесть электронов попадут на 4p-орбиталь точно так же, как и на 3p-орбиталь.Теперь орбиталь 4p заполнена. Таким образом, один электрон выйдет на 5s-орбиталь по часовой стрелке, а остальные пять электронов попадут на 4d-орбиталь по часовой стрелке. Это хорошо видно на рисунке орбитальной диаграммы молибдена.
Molybdenum ion(Mo
3+ ) electron configurationThe ground state electron configuration of molybdenum is 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 5 5s 1 .
Эта электронная конфигурация показывает, что на последней оболочке молибдена есть электрон, а на d-орбитали всего пять электронов. Следовательно, валентных электронов молибдена шесть.
Элементы, имеющие 1, 2 или 3 электрона на последней оболочке, отдают электроны на последней оболочке при образовании связи.
Атомный номер молибдена, атомный вес и заряд Элементы, которые образуют связи, отдавая электроны, называются катионами.
Элементы, которые образуют связи, отдавая электроны, называются катионами.Атом молибдена отдает электрон на 5s-орбитали и два электрона на 4d-орбитали для преобразования иона молибдена (Mo 3+ ).
Mo – 3e – → Mo 3+
Электронная конфигурация иона молибдена (Mo 3+ ) IS 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 6 4D 3 .
Электронная конфигурация иона молибдена показывает, что ион молибдена (Mo 3+ ) имеет четыре оболочки, а последняя оболочка имеет одиннадцать электронов. Молибден проявляет степени окисления +4, +6. Степень окисления элемента изменяется в зависимости от образования связи.
Электронная конфигурация для молибдена и иона молибдена (Mo 3+ )Часто задаваемые вопросы
Какой символ обозначает молибден?
Ответ: Обозначение молибдена — «Mo».


