Виды ингибиторов: Виды и свойства ингибиторов коррозии для систем отопления
alexxlab | 09.03.2023 | 0 | Разное
Ингибиторы коррозии металлов: виды и отличия
Ржавчина является одним из злейших врагов многих металлов, а также изделий, созданных с их применением. Снизить вероятность ее появления способны особые вещества – ингибиторы коррозии металлов. Чаще всего они используются в качестве добавок к различным смесям и композициям, предназначенным для создания на поверхности материала покрытия, устойчивого к воздействию ржавчины.
По сути ингибитором нельзя назвать какое-то конкретное вещество, так как это название используют для обозначения определенной группы химических веществ, способных задерживать процесс протекания тех или иных физических и химических явлений. Чаще всего они применяются для задержки цепных или же каталитических химических реакций. Эффект достигается за счет блокировки активного центра катализатора или же при реакции ингибитора с активными частицами вещества. Различные виды таких веществ применяются для того, чтобы предотвратить химические реакции брожения, окисления или же гидролиза.
При этом особое практическое значение получили вещества, относящиеся к ингибиторам коррозии металлов. Их использование позволяет значительно замедлить процесс возникновения ржавчины. Такой эффект достигается за счет того, что ингибитор абсорбируется на поверхности металлического изделия, обеспечивая тем самым активность коррозионной среды и создавая на поверхности материала микроскопическую пленку.
Ингибирование коррозии: какие виды ингибиторов существуют?
В целом такие химические вещества можно условно разделить на две отдельные группы, а именно:
- Адсорбционные. Их применение позволяет создать на поверхности металлического изделия фазовую или же адсорбционную пленку, обеспечивающую замедление определенных электрохимических реакций, которые приводят к появлению ржавчины.
- Пассиваторы. Вещества этого типа не проходят процесс адсорбции на поверхности деталей из металла, а вступают в реакцию с самим материалом, обеспечивая тем самым создание нерастворимых пленочных соединений.
 Благодаря этому поверхность металла становится практически невосприимчивой к развитию коррозийных процессов.
Благодаря этому поверхность металла становится практически невосприимчивой к развитию коррозийных процессов.
Какими отличиями могут обладать ингибиторы коррозии в зависимости от своего химического состава?
Большое распространение получили так называемые летучие ингибиторы, к которым следует причислить нитриты и бензоаты. Они широко применяются для предотвращения коррозии, вызванной атмосферным воздействием. Принцип их работы является достаточно простым и заключается в том, что образуемый химическим веществом пар проникает сквозь воздух к металлической детали, образуя путем адсорбции на поверхности защитную пленку.
Чаще всего к веществам такого плана относятся неорганические ингибиторы, обладающие высокой эффективностью при использовании в агрессивной среде. Это обеспечивается наличием в них катионов или анионов. В то же время существуют и органические вещества, используемые в процессе кислотного травления изделий из металла, а также их очистки. К таким ингибиторам коррозии следует отнести специфические химические соединения, включающие в себя азот, кислород и серу.
В то же время существуют и органические вещества, используемые в процессе кислотного травления изделий из металла, а также их очистки. К таким ингибиторам коррозии следует отнести специфические химические соединения, включающие в себя азот, кислород и серу.
В каких сферах используются ингибиторы?
Ингибирование коррозии с помощью соответствующих химических веществ – это практика, получившая огромное распространение во всем мире. Особенно популярна она в различных видах промышленности, включая машиностроительную и нефтеперерабатывающую. Сами по себе ингибиторы для предотвращения ржавчины используют в качестве компонентов при производстве моторных масел, смазок и различных видов топлива.
– ингибирование – Биохимия
В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме.
Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно. Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность многих ферментов, т.е. действуют неспецифично.
Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность многих ферментов, т.е. действуют неспецифично.
В научной деятельности для более точного описания процессов ингибирования пользуются кинетикой Михаэлиса-Ментен и ее терминами – максимальная скорость (Vmax) и константа Михаэлиса (Km).
Можно выделить два основных направления ингибирования
- по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым.
- по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
Необратимое ингибирование
При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах.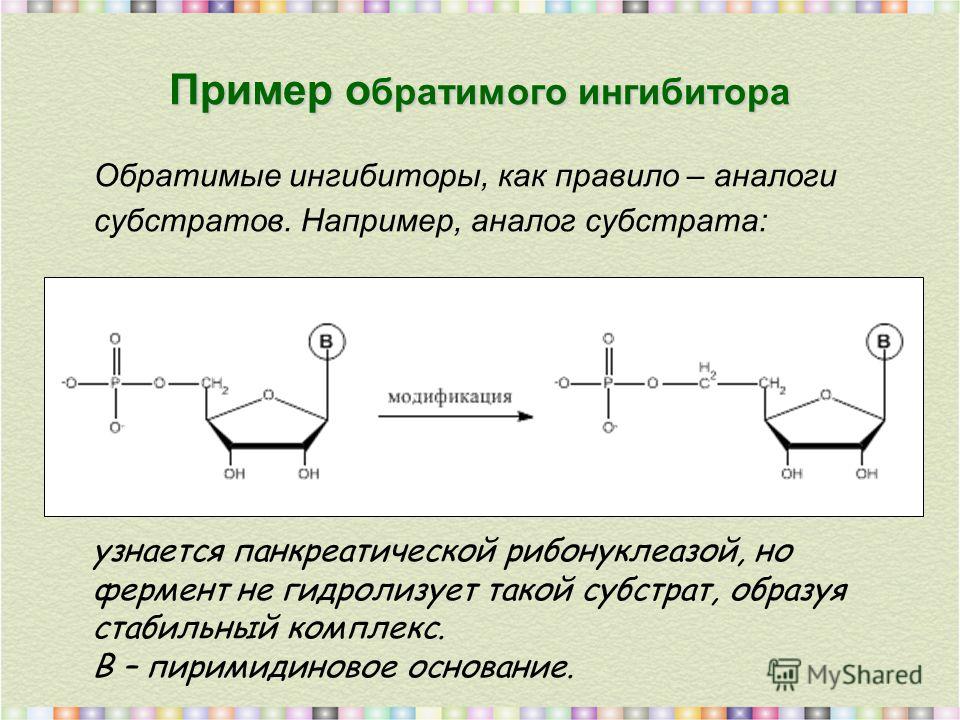 Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию.
Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию.
Аналогично диизопропилфторфосфат ингибирует химотрипсин и другие протеазы, имеющие в активном центре серин (сериновые протеазы).
Диизопропилфторфосфат относится к нервно-паралитическим ядам, аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман). Сюда же относится вещество “малатион”, включенный в инсектициды (карбофос, дихлофос) и превращающийся в организме насекомых в ингибитор ацетилхолинэстеразы, а в организме животных и человека разрушающийся до безвредных продуктов.
Механизм необратимого ингибирования ацетилхолинэстеразы
Еще один пример связан с ингибированием ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
Механизм необратимого ингибирования циклооксигеназы
Третьим показательным примером необратимого ингибирования является влияние антибиотика пенициллина на фермент транспептидазу, сшивающую цепи пептидогликана как последний шаг в синтезе клеточной стенки бактерий.
Обратимое ингибирование
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.
Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Например:
1. Ингибирование фермента цикла трикарбоновых кислот сукцинат-дегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
Конкурентное ингибирование сукцинатдегидрогеназы
2. Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с пара-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке возникает конкуренция между сульфаниламидом и пара-аминобензойной кислотой при синтезе дигидрофолиевой кислоты, что и вызывает лечебный эффект.
3. В качестве других примеров лекарственных конкурентных ингибиторов можно привести
- ингибитор синтеза холестерина ловастатин, обратимо ингибирующий ГМГ-S-КоА-редуктазу,
- противоопухолевый препарат метотрексат, необратимо подавляющий дигидрофолатредуктазу,
- непрямой антикоагулянт дикумарол, конкурент витамина К,
- антигипертензивный препарат метил-ДОФА, подавляющий активность ДОФА-декарбоксилазы,
- средство для лечения подагры аллопуринол, ингибирующий ксантиноксидазу.
Примером конкуренции, но не ингибирования (!), является взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. В данном случае ингибирование, как таковое, отсутствует, но с активным центром фермента связывается тот спирт, концентрация которого больше. Данный эффект используют у пациентов с отравлением метанолом для которого этиловый спирт является антидотом.
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо веществ вне активного и аллостерического центра. Например:
- синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание,
- связывание ионов тяжелых металлов (Cu2+, Hg2+, Ag+) с SH-группами белков.
Также примером может служить фруктозо-1,6-дифосфат, который ингибируя аденилосукцинатсинтетазу (синтез пуриновых нуклеотидов), синхронизирует в мышце функционирование пуриннуклеотидного цикла и гликолиза, поставлющего энергию для мышечного сокращения.
Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор.
Бесконкурентное ингибирование
В этом случае ингибитор связывается в активном центре с фермент-субстратным комплексом. Повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним. Таким образом, бесконкурентное ингибирование более сложно, чем другие типы ингибирования.
В качестве примера бесконкурентного ингибирования обычно называют связывание пенициллина и фермента транспептидазы, обеспечивающей сшивку цепей пептидогликана при синтезе клеточной стенки бактерий.
Пенициллин встраивается в активный центр фермента и его лактамное кольцо мимикрирует под  Хотя ситуация похожа на конкурентное ингибирование, из-за одновременного снижения Vmax и Km этот случай относят к бесконкурентному.
Хотя ситуация похожа на конкурентное ингибирование, из-за одновременного снижения Vmax и Km этот случай относят к бесконкурентному.
На примере пенициллина также рассматривается т.н. суицидное ингибирование. При нем субстрат первоначально связывается с ферментом обратимо, а затем образует устойчивое ковалентное соединение с активным центром, что приводит к ингибированию активности фермента.
Смешанное ингибирование
При таком ингибировании ингибитор способен присоединяться везде – не только в активном центре, но и в других частях молекулы. Но после этого фермент еще способен частично сохранять свою активность. Примером является влияние мертиолата (ртутьорганическое вещество) на сахаразу грибов микромицетов для подавления их роста.
Ингибирование ферментов – Типы ингибирования – Аллостерическая регуляция
звездочка звезда звезда звезда Star_half
на основе 56 рейтингов
Оригинальный автор (S): Josh Turiccki
Последнее обновление: 19 сентября 2022 г.
Ревизии: 18
. Последнее обновление: 19 сентября 2022 г.
Редакции: 18
format_list_bulleted Содержание добавить remove
- 1 Types of Inhibition
- 1.1 Competitive Inhibitors
- 1.2 Non-Competitive Inhibitors
- 2 Allosteric Inhibition
- 3 Phosphorylation
- 4 Zymogens
- 5 Clinical Relevance – Pharmacokinetics
Enzymes are required для большинства, если не для всех процессов, необходимых для жизни. Ферменты катализируют реакцию уменьшает энергию активации , необходимую для протекания реакции. Тем не менее, ферменты должны строго регулироваться, чтобы уровни продукта не повышались до нежелательных уровней. Это достигается ингибированием ферментов.
Типы ингибирования
Обратимые и необратимые ингибиторы представляют собой химические вещества, которые связываются с ферментом для подавления его активности. Один из способов добиться этого – практически постоянно связываться с ферментом. Такие ингибиторы называются необратимыми. Однако другие химические вещества могут временно связываться с ферментом. Их называют реверсивный. Обратимые ингибиторы связываются либо с активным участком (конкурентные ингибиторы), либо с другим участком фермента (неконкурентные ингибиторы).
Один из способов добиться этого – практически постоянно связываться с ферментом. Такие ингибиторы называются необратимыми. Однако другие химические вещества могут временно связываться с ферментом. Их называют реверсивный. Обратимые ингибиторы связываются либо с активным участком (конкурентные ингибиторы), либо с другим участком фермента (неконкурентные ингибиторы).
Калифорния16 (собственная работа) [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)], через Wikimedia Commons
Рис. – конкурентные ингибиторы ферментов.
Конкурентные ингибиторы
Конкурентные ингибиторы конкурируют с субстратом в активном центре и, следовательно, увеличивают км (постоянная Михаэлиса-Ментен). Однако Vmax не изменяется, поскольку при достаточной концентрации субстрата реакция все еще может завершиться. График зависимости активности фермента от концентрации субстрата будет смещен вправо из-за увеличения Km, в то время как график Лайнуивера-Берка будет более крутым по сравнению с отсутствием ингибитора.
Неконкурентные ингибиторы
Неконкурентные ингибиторы связываются с другим местом на ферменте и, таким образом, уменьшают
| Конкуренты | Неконкурентный | |
| Где действует? | Активный сайт | Альтернативный сайт |
| Изменение км | Увеличение | Без изменений |
| Изменение Vmax | Без изменений | Уменьшение |
По CNX OpenStax [CC BY 4.0 (http://creativecommons.org/licenses/by/4.
Рис. 2. Диаграмма, показывающая влияние ингибиторов ферментов на скорость реакции и как она зависит от концентрации субстрата.
Аллостерическое ингибирование
Аллостерические ферменты имеют сигмоидальную кривую , в отличие от гиперболической кривой, отображаемой ферментами Михаэлиса-Ментен. Это связано с тем, что большинство аллостерических ферментов содержат несколько субъединиц, которые могут влиять друг на друга, когда субстрат связывается с ферментом. Ингибирование может влиять либо на K 0,5, , что является концентрацией субстрата для половинного насыщения, либо на Vmax, либо на то и другое. Это приводит к смещению кривой вправо, а в случае уменьшения Vmax смещает кривую вниз.
Аллостерические ферменты имеют два состояния: состояние с низким сродством, называемое состоянием «Т», и состояние с высоким сродством «R». Ингибиторы работают, предпочтительно связываясь с состоянием Т аллостерического фермента, заставляя фермент поддерживать это состояние с низким сродством.
Это чрезвычайно полезно для ограничения количества продукта фермента, так как продукт затем может ингибировать тот же тип фермента, чтобы количество продукта не было чрезмерным. Это известно как подавление обратной связи . Например, АТФ аллостерически ингибирует пируваткиназу, чтобы предотвратить повышенное образование пирувата, поэтому в конечном итоге образуется меньше АТФ. Кроме того, фосфофруктокиназа аллостерически ингибируется цитратом, промежуточным продуктом цикла Кребса. Это означает, что гликолиз будет ограничен при высоком образовании АТФ в цикле Кребса.
Автор CNX OpenStax [CC BY 4.0 (http://creativecommons.org/licenses/by/4.0)], через Wikimedia Commons
Рис. 3 — Схема, показывающая механизм как аллостерического ингибирования, так и активации.
Фосфорилирование
Фосфорилирование обеспечивает еще один механизм ингибирования ферментов. Обычно это происходит под действием киназных ферментов, которые могут либо ингибировать, либо активировать фермент в зависимости от ситуации . Ферменты киназы отщепляют фосфатную группу от АТФ и связывают ее с ферментом. В ситуациях, когда это приводит к увеличению активности фермента, создается реакция каскада , позволяющая генерировать сильный ответ на небольшой стимул.
Ферменты киназы отщепляют фосфатную группу от АТФ и связывают ее с ферментом. В ситуациях, когда это приводит к увеличению активности фермента, создается реакция каскада , позволяющая генерировать сильный ответ на небольшой стимул.
Зимогены
Ферменты также могут секретироваться в неактивном состоянии, известном как зимогены. Зимогены представляют собой полезный механизм, позволяющий безопасно транспортировать ферменты в разные места, при этом фермент не становится активным и не выполняет свою функцию по пути. Они остаются неактивными из-за добавления аминокислот в белок. Следовательно, чтобы активировать зимоген, другой фермент должен отщепить эти дополнительные аминокислоты. Например, химотрипсиноген синтезируется поджелудочной железой, но инактивируется и не может функционировать. По пути в кишечник другой фермент (трипсин) отщепляет дополнительные аминокислоты с образованием активированной формы, химотрипсина.
Автор Kristie. leong (собственная работа) [CC BY 3.0 (http://creativecommons.org/licenses/by/3.0)], через Wikimedia Commons
leong (собственная работа) [CC BY 3.0 (http://creativecommons.org/licenses/by/3.0)], через Wikimedia Commons
Рис. 4. Диаграмма, показывающая активацию химотрипсиногена в желудочно-кишечном тракте и ферменты, участвующие в каждой стадии.
Клиническая значимость – фармакокинетика
Наиболее важным клиническим применением ингибирования ферментов является использование фармацевтических препаратов. Ингибиторы АПФ являются распространенным средством лечения гипертонии. Ангиотензин I превращается в ангиотензин II под действием ангиотензинпревращающего фермента (АПФ). Однако ангиотензин II вызывает многочисленные эффекты, приводящие к повышению артериального давления. Таким образом, ингибиторы АПФ предназначены для конкурентного ингибирования действия АПФ, что приводит к меньшему образованию ангиотензина II и снижению артериального давления.
В качестве альтернативы пенициллин необратимо связывается с активным центром фермента, называемого DD-транспептидазой.
Цианид является примером неконкурентного ингибитора . Цианид связывается с последним ферментом в цепи переноса электронов и не позволяет этому ферменту катализировать реакцию перехода кислорода в воду. Это предотвращает поток электронов вниз по электрон-транспортной цепи, и АТФ не может генерироваться, что приводит к смерти.
распечатать Распечатать эту статью
Справка по биохимии
Студенты, нуждающиеся в помощи по биохимии, получат большую пользу от нашей интерактивной программы.
Мы разбираем все ключевые элементы, чтобы вы могли получить адекватную помощь по биохимии.
Имея под рукой обязательные концепции обучения и актуальные практические вопросы, вы получите много помощи по биохимии в кратчайшие сроки.
Если вы в настоящее время изучаете биохимию или собираетесь изучать ее в будущем, средства обучения Varsity Tutors’ Learning Tools предоставляют ряд ресурсов, которые помогут вам в подготовке к биохимии. Планируете ли вы сдавать предметный тест по биохимии университетского уровня или просто экзамен для класса по биохимии, вы можете укрепить свои знания по этому предмету с помощью помощи по изучению биохимии, доступной для вас на веб-сайте средств обучения.
Некоторым студентам изучение биохимии может показаться трудным и непосильным. Вам нужно будет получить много информации о биохимии, клеточной биологии, молекулярной биологии и генетике. К счастью, у вас есть бесплатный доступ к интерактивной учебной программе по биохимии через ресурс Learn by Concept на веб-сайте Varsity Tutors’ Learning Tools. По мере того, как вы перемещаетесь по бесплатным учебным материалам по биохимии, предоставленным вам через ресурс Learn by Concept, вы заметите, что весь материал разбит на категории и подразделы.
По мере того, как вы будете перемещаться по материалам, предоставленным Learn by Concept, вам будет предложено несколько примеров вопросов по биохимии. Эти вопросы, представленные в формате с несколькими вариантами ответов, предназначены для оценки ваших знаний по важным понятиям биохимии. После ответа на каждый вопрос вы сможете проверить свой ответ и определить, не допустили ли вы каких-либо ошибок.
Learn by Concept не только задает вам вопросы по важному материалу, но и предоставляет важную информацию посредством подробных описаний. Эти описания помогают объяснить, почему предоставленный ответ является правильным, и помогают закрепить уже имеющиеся у вас знания. Используя помощь в изучении биохимии, вы можете точно определить области, над которыми вам нужно больше работать, и полностью настроить свой план изучения биохимии. Кроме того, вы можете узнать много важных формул, определений и словарных терминов, прочитав описания, приведенные в конце каждого примера вопроса по биохимии.
Кроме того, вы можете узнать много важных формул, определений и словарных терминов, прочитав описания, приведенные в конце каждого примера вопроса по биохимии.
Ресурс Learn by Concept облегчает подготовку к биохимии. Вам предоставляется информация о ряде понятий, необходимых для понимания биохимии, таких как эукариоты и прокариоты, преобразование энергии, структуры связей, белки и нейротрансмиттеры. Если вы хотите просмотреть тест или выучить новый материал, полное использование бесплатных учебных материалов по биохимии в средствах обучения Varsity Tutors — идеальный способ дополнить вашу курсовую работу.
Вы можете улучшить свою подготовку к биохимии, используя ресурс Learn by Concept вместе с остальными предоставленными вам средствами обучения. Если вы используете карточки, отвечаете на вопрос дня и оцениваете свои знания с помощью одного из многочисленных практических тестов по биохимии, вы помогаете создать индивидуальный, всесторонний режим обучения. Объедините все инструменты вместе, и вы сможете легко настроить свои учебные планы, отслеживать свои успехи и определять, какие области вам нужно уделить больше времени для улучшения.


 Благодаря этому поверхность металла становится практически невосприимчивой к развитию коррозийных процессов.
Благодаря этому поверхность металла становится практически невосприимчивой к развитию коррозийных процессов.