Википедия ацетилен: Ацетилен — это… Что такое ацетилен (значение, термин, определение) — основные области применения ацетилена, применение в строительстве и промышленности, применение в медицине — ПожВики Портала про Пожарную безопасность
alexxlab | 20.05.2023 | 0 | Разное
Ацетилен — это… Что такое ацетилен (значение, термин, определение) — основные области применения ацетилена, применение в строительстве и промышленности, применение в медицине — ПожВики Портала про Пожарную безопасность
Мы используем cookie (файлы с данными о прошлых посещениях сайта) для персонализации и удобства пользователей. Так как мы серьезно относимся к защите персональных данных пожалуйста ознакомьтесь с условиями и правилами их обработки. Вы можете запретить сохранение cookie в настройках своего браузера.
Для определения категорий помещений и зданий по взрывопожарной и пожарной опасности в соответствии с СП 12.13130 со встроенным справочником веществ и материалов
Сервис RiskCalculator предназначен для определения расчетной величины индивидуального пожарного риска для i-го сценария пожара QB,i в соответствии с «Методикой определения величин пожарного риска в зданиях, сооружениях и строениях различных классов функциональной пожарной опасности», утвержденной приказом МЧС от 30. 06.09 № 382 (с изм.)
06.09 № 382 (с изм.)
Сервис RiskCalculator — расчет пожарного риска для производственного объекта предназначен для оценки величины индивидуального пожарного риска R (год-1) для работника при условии его нахождения в здании. Методика утверждена Приказом МЧС России от 10 июля 2009 года № 404 «Об утверждении методики определения расчетных величин пожарного риска на производственных объектах» с изменениями, внесенными приказом МЧС России № 649 от 14.12.2010
«Пожарная проверка ОНЛАЙН» представляет дополнительный функционал, упрощающий работу с чек-листами. Используя сервис, вы можете провести самопроверку быстро, легко и максимально корректно.
Сервис поиска исполнителя в области пожарной безопасности с лицензией МЧС по регионам
Описание сервиса
Описание сервиса
Описание сервиса
Описание сервиса
Для определения категорий помещений и зданий по взрывопожарной и пожарной опасности в соответствии с СП 12.13130 со встроенным справочником веществ и материалов
Для определения расчетной величины индивидуального пожарного риска для i-го сценария пожара QB,i в соответствии с «Методикой определения величин пожарного риска в зданиях, сооружениях и строениях различных классов функциональной пожарной опасности»
Для производственного объекта предназначен для оценки величины индивидуального пожарного риска R (год-1) для работника при условии его нахождения в здании.
«Пожарная проверка ОНЛАЙН» представляет дополнительный функционал, упрощающий работу с чек-листами. Используя сервис, вы можете провести самопроверку быстро, легко и максимально корректно.
Сервис поиска исполнителя в области пожарной безопасности с лицензией МЧС по регионам
Выбор системы противопожарной защиты (автоматической установки пожарной сигнализации АУПС, автоматической установки пожаротушения АУПТ) для зданий
Выбор системы противопожарной защиты (системы пожарной сигнализации СПС, автоматической установки пожаротушения АУП) для сооружений
Определение требуемого типа системы оповещения и управления эвакуацией
Выбор системы противопожарной защиты (СИСТЕМЫ ПОЖАРНОЙ СИГНАЛИЗАЦИИ (СПС), АВТОМАТИЧЕСКОЙ УСТАНОВКИ ПОЖАРОТУШЕНИЯ (АУП)) для оборудования
Определение необходимого уровня звука системы оповещения и управления эвакуацией людей при пожаре
Ацетилен | это… Что такое Ацетилен?
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Содержание
|
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 2621 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.

- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком)[2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.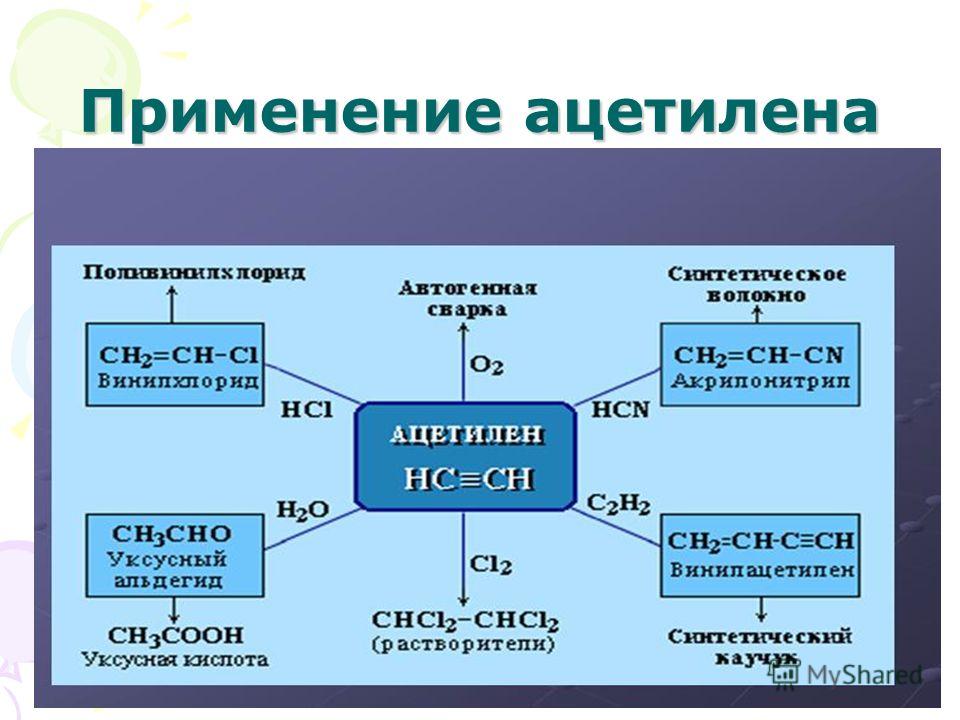 1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Примечания
- ↑ 1 2 ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑ В России разработали ракетный двигатель на аммиаке – Известия
Ссылки
- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Ацетилен — Sciencemadness Wiki
Ацетилен (или этин ) — горючий газ, используемый при сварке и производстве взрывчатых веществ. Он содержит тройную связь между двумя атомами углерода в своей структуре, что делает его простейшим алкином, и имеет формулу C 2 H 2 .
Он содержит тройную связь между двумя атомами углерода в своей структуре, что делает его простейшим алкином, и имеет формулу C 2 H 2 .
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Ацетилен горит в кислороде очень горячим и ярким пламенем с температурой 2534 °C при атмосферном давлении. Температура может быть выше, если используется закись азота.
Воспламеняется при контакте с хлором при стандартных условиях.
Ацетилен используется для изготовления взрывчатых веществ ацетилида меди(I) и ацетилида серебра. Это достаточно чувствительные и умеренно мощные первичные взрывчатые вещества.
Ацетилен реагирует с амидами щелочных металлов в растворе аммиака с образованием водорастворимых ацетилидов щелочных металлов.
Физический
Ацетилен не может существовать в жидком виде при любой температуре при нормальном давлении, и крайне нецелесообразно сжимать газ из-за высокого риска взрыва. В промышленности баллоны с ацетиленом наполняют пористой инертной губкой, чтобы избежать высокого давления газа. Эта губка наполнена ацетоном или диметилформамидом, в котором растворяется газ.
Смеси ацетилена и воздуха чрезвычайно взрывоопасны, причем объемы ацетилена от 2,6% до 80% способны детонировать.
В то время как сам ацетилен может не иметь запаха, любой баллон с газом будет содержать небольшое количество одоранта, а газ, образующийся из карбида кальция и воды, всегда имеет сильный запах из-за примесей.
Наличие
Баллоны с ацетиленом обычно продаются в магазинах сварочных материалов. Баллоны с этим газом находят бытовое применение.
Подготовка
В условиях домашней химии ацетилен образуется в результате реакции карбида кальция и воды. Используемый карбид кальция часто бывает низкого качества, поэтому он будет выделять множество других газов, таких как сероводород и фосфин.
Чтобы повысить чистоту ацетилена от карбида кальция, газ можно провести через промывную бутыль, содержащую гидроксид натрия, а затем через простую воду для удаления любого гидроксида натрия.
Проекты
Ацетилид меди – Chemistry-chemists.com
- Ацетилид меди(I)
- Ацетилид серебра
- Сделать циклооктатетраен
Обращение
Безопасность
Взрывы ацетилена могут быть очень мощными. Он легко способен детонировать под давлением и весьма чувствителен к ударам, а это означает, что ударные волны, создаваемые взрывчатыми веществами, могут привести его в действие. Топливно-воздушные смеси могут очень легко воспламеняться и детонировать или гореть очень горячим и ярким светом.
Хотя маловероятно, но ацетилен может образовывать очень чувствительные взрывчатые вещества при контакте с медью, поэтому использование медных труб нецелесообразно.
Хотя в чистом виде он не очень токсичен, при его производстве из карбида кальция могут образовываться многие другие токсичные газы, такие как сероводород.
Хранение
Ацетилен в промышленных масштабах хранится в баллонах, где он растворен в ацетоне или диметилформамиде (ДМФ), содержащихся в газовом баллоне с пористым наполнением (Агамассан).
В 2009 году был разработан новый метод, при котором ацетон хранится в металлоорганическом каркасе (MOF), решетчатой структуре, состоящей из оксида меди и бензола. [1]
Утилизация
Ацетилен можно безопасно выбрасывать в атмосферу или сжигать.
Ссылки
- «Энциклопедия взрывчатых веществ и связанных с ними предметов» – Федоров, Том 1/10.
- http://en.wikipedia.org/wiki/Ацетилен
- ↑ http://pubs.
 acs.org/doi/abs/10.1021/ja904782h
acs.org/doi/abs/10.1021/ja904782h
Соответствующие нити Sciencemadness
- Синтез ацетилена
- Циклизация ацетилена
- Тримеризация ацетилена до бензола
Ацетон — Sciencemadness Wiki и полезный химикат для многих органическая химия, являясь простейшим кетоном.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 См. также
- 7 Каталожные номера
- 7.1 Соответствующие темы Sciencemadness
Свойства
Химический
Ацетон легко воспламеняется и горит на воздухе с выделением углекислого газа и паров воды.
Реагирует с галогенами с образованием галогенированных органических соединений, т.е. хлорацетона, бромацетона, йодацетона.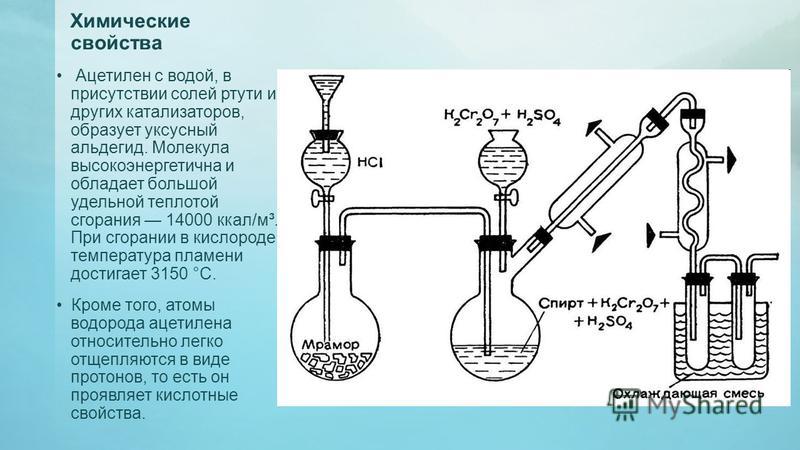 Ацетон очень экзотермически реагирует с галогенами, растворенными в основных растворах, с образованием галоформа указанного галогена, процесс, известный как галоформная реакция. Одним из примеров является использование бытового отбеливателя и других гипохлоритов с образованием хлороформа.
Ацетон очень экзотермически реагирует с галогенами, растворенными в основных растворах, с образованием галоформа указанного галогена, процесс, известный как галоформная реакция. Одним из примеров является использование бытового отбеливателя и других гипохлоритов с образованием хлороформа.
Ацетон образует непредсказуемую и опасную взрывоопасную перекись ацетона при окислении перекисью водорода при определенных условиях, например, с кислотным катализатором.
Ацетон реагирует с холодной концентрированной азотной кислотой с образованием уксусной и муравьиной кислот. В результате реакции выделяется много тепла, из-за чего продукты испаряются из реакционной колбы.
Физический
Ацетон – это прозрачная жидкость с очень низкой вязкостью, смешивающаяся с водой, кипит при 56 °C и замерзает при –9от 5 до −93 °С. Он имеет резкий, несколько сладкий и цветочный аромат, похожий на другие кетоны. Он также смешивается с большинством органических растворителей, таких как ледяная уксусная кислота, бензол, хлороформ, диэтиловый эфир, этанол, гептан, гексан и метанол. Однако ацетон не смешивается с глицерином.
Однако ацетон не смешивается с глицерином.
Доступность
Ацетон можно найти в хозяйственных магазинах в качестве разбавителя краски или жидкости для снятия лака, в чистом виде или в смеси с другими органическими веществами (обычно сложными эфирами). Для очистки ацетона может потребоваться перегонка.
Большинство технических сортов ацетона, как правило, довольно чистые и содержат очень мало воды, если вообще содержат ее. Если вы хотите, чтобы он был более чистым, вы можете перегнать его снова.
Подготовка
В промышленности ацетон получают кумольным процессом, при котором бензол алкилируется пропиленом с получением кумола, который окисляется воздухом с получением фенола и ацетона.
До этого метода ацетон производился путем сухой перегонки ацетатной соли, обычно ацетата кальция или ацетата натрия.
- 2 Na(CH 3 COO) → Na 2 CO 3 + (CH 3 ) 2 CO
- Ca(CH 3 COO) 2 → CaCO 3 + (CH 3 ) 2 CO
Поскольку эта реакция происходит при температуре около 400-500°C и температуре самовоспламенения, ацетона, это должно быть выполнено в бескислородной камере (достаточно углекислого газа или только атмосферы), и, поскольку ацетон образуется в виде паров, его необходимо конденсировать.
Ацетон можно извлечь из водного раствора высаливанием безводным ацетатом натрия, который обычно получают из уксуса и пищевой соды.
Проекты
- Синтез метилметакрилата
- Синтез пероксида ацетона
- Синтез хлороформа
- Органические экстракты
- Сделать этенон
Обращение
Безопасность
Контакт с кожей с ацетоном не рекомендуется, так как длительное воздействие может привести к обезжириванию кожи. Низкая температура кипения ацетона требует работы в проветриваемом помещении. Хотя ацетон летуч и его пары не особенно токсичны, в больших количествах они могут вызывать раздражение. Однако ацетон является одним из наименее токсичных растворителей, и, как показали многие исследования, в случае многократного воздействия не возникает долгосрочного риска.
Основная опасность ацетона связана с его воспламеняемостью. Его пары имеют температуру воспламенения намного ниже комнатной температуры, поэтому смеси воздух/ацетон могут легко взорваться или загореться даже при ударах статическим электричеством.



 acs.org/doi/abs/10.1021/ja904782h
acs.org/doi/abs/10.1021/ja904782h