Вольфрама формула – Свойства вольфрама как металла | СпецМеталлМастер
alexxlab | 30.06.2020 | 0 | Разное
Вольфрам — Википедия
| Внешний вид простого вещества | |
|---|---|
| Тугоплавкий прочный металл, стального цвета или белый | |
| Свойства атома | |
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d4 6s2 |
| Радиус атома | 141 пм |
| Химические свойства | |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 В W ← W6+ 0,68 В |
| Степени окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,25[2] г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F)[2] |
| Температура кипения | 5828 K (5555 °C, 10031 °F)[2] |
| Уд. теплота плавления | 285,3 кДж/кг 52,31[3][4] кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27[5] Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,160 Å |
| Температура Дебая | 310 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 162,8[6] Вт/(м·К) |
| Номер CAS | 7440-33-7 |
| 74 | Вольфрам |
| 4f145d46s2 | |
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом W (лат. Wolframium). При нормальных условиях представляет собой твёрдый блестящий серебристо-серый переходный металл[5].
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод, но он существует в жидком виде только при высоких давлениях. При стандартных условиях вольфрам химически стоек.
История и происхождение названия
В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»).
В 1781 году знаменитый шведский химик Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама)[источник не указан 2094 дня]. В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла[источник не указан 2094 дня]. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Видео по теме
Нахождение в природе
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трёхокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 · mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Получение
Вольфрамовый порошокПроцесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Физические свойства
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C)[2]. Плотность чистого вольфрама составляет 19,25 г/см³[2]. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32·10−9). Твёрдость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжёлых, твёрдых и самых тугоплавких металлов[5]. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддаётся ковке и может быть вытянут в тонкую нить. Металл обладает высокой устойчивостью в вакууме
Химические свойства
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот[10]:
- 2W+4HNO3+10HF⟶WF6+WOF4+4NO↑+7h3O{\displaystyle {\mathsf {2W+4HNO_{3}+10HF\longrightarrow WF_{6}+WOF_{4}+4NO\uparrow +7H_{2}O}}}
Реагирует с расплавленными щелочами в присутствии окислителей [11]:
- 2W+4NaOH+3O2⟶2Na2WO4+2h3O{\displaystyle {\mathsf {2W+4NaOH+3O_{2}\longrightarrow 2Na_{2}WO_{4}+2H_{2}O}}}
- W+2NaOH+3NaNO3⟶Na2WO4+3NaNO2+h3O{\displaystyle {\mathsf {W+2NaOH+3NaNO_{3}\longrightarrow Na_{2}WO_{4}+3NaNO_{2}+H_{2}O}}}
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Применение
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам
Нить накаливания- Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах[12] или более эффективной при равном весе[13]. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др.[14] либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе
Соединения вольфрама
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама[16]
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Биологическая роль
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни[17].
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Изотопы
Природный вольфрам состоит из смеси пяти изотопов (180W — 0,12(1)%, 182W — 26,50(16) %, 183W — 14,31(4) %, 184W — 30,64(2) % и 186W — 28,43(19) %)[18].
На 2016 год известно ещё 36 искусственно созданных и идентифицированных радионуклидов вольфрама (массовые числа 157…179, 181, 185, 187…197)[18]. В 2003 открыта[19] чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180W, имеющего период полураспада 1,8·1018 лет[20].
Интересные факты
- Вольфрам — самый тугоплавкий металл. Температура плавления — 3422 °C, кипения — 5555 °C[2]. Примерно такую же температуру имеет фотосфера Солнца[21]. Критическая температура вольфрама равняется 13 610 °C. Это та температура, при которой вольфрам не может быть сконденсирован в виде жидкости из газа ни при каком давлении. [22]
- Плотность вольфрама почти равняется плотности золота: 19,25 г/см³ против 19,32 г/см³ соответственно[2].
- Существуют публикации в блогах о мошенничестве, при котором настоящие слитки золота якобы подменяются на слитки с заменой внутренней части на вольфрам[23][24]). Подобные подделки гипотетически могли бы пройти тесты, анализирующие лишь поверхность слитка, например, XRF, и близки к слиткам из драгоценного металла по размеру и весу благодаря высокой плотности вольфрама. Однако подделка отличается по плотности и имеет немного более низкую электропроводность, также она будет обнаружена при переплавке слитков, которая производится достаточно регулярно.[25][26].
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 6 7 Tungsten: physical properties (англ.). WebElements. Проверено 17 августа 2013.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — P. 6-134. — 2828 p. — ISBN 1420090844.
- ↑ См. обзор измерений в: Tolias P. (2017), “Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications”, arΧiv:1703.06302
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- ↑ Теплофизические свойства вольфрама
- ↑ О. Д. Липшиц, Карманный немецко-русский словарь, М:”Русский язык”-Leipzig^”VEB Verlag Enzyklopädie” 1983, с.211, 296
- ↑ Rahm on Google
- ↑ Титан – металл будущего (рус.).
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- ↑ Brian Wheeler. Tungsten Shielding Helps at Fukushima Daiichi. Power Engineering Magazine (01 Jul 2011).
- ↑ Murata Taisuke, Miwa Kenta, Matsubayashi Fumiyasu, Wagatsuma Kei, Akimoto Kenta, Fujibuchi Toshioh, Miyaji Noriaki, Takiguchi Tomohiro, Sasaki Masayuki, Koizumi Mitsuru. Optimal radiation shielding for beta and bremsstrahlung radiation emitted by 89Sr and 90Y: validation by empirical approach and Monte Carlo simulations // Annals of Nuclear Medicine. — 2014. — 10 мая (т. 28, № 7). — С. 617—622. — ISSN 0914-7187. — DOI:10.1007/s12149-014-0853-6. [исправить]
- ↑ Kobayashi S., Hosoda N., Takashima R. Tungsten alloys as radiation protection materials // Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. — 1997. — Май (т. 390, № 3). — С. 426—430. — ISSN 0168-9002. — DOI:10.1016/S0168-9002(97)00392-6. [исправить]
- ↑ Soylu H. M., Yurt Lambrecht F., Ersöz O. A. Gamma radiation shielding efficiency of a new lead-free composite material // Journal of Radioanalytical and Nuclear Chemistry. — 2015. — 17 марта (т. 305, № 2). — С. 529—534. — ISSN 0236-5731. — DOI:10.1007/s10967-015-4051-3. [исправить]
- ↑ по данным “Цены на вольфрам”
- ↑ Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь // Палеонтологический журнал. — 2003. — № 6. — С. 33—40
- ↑ 1 2 Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — DOI:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.
- ↑ F. A. Danevich et al. (2003). «α activity of natural tungsten isotopes». Phys. Rev. C 67. DOI:10.1103/PhysRevC.67.014310.
- ↑ C. Cozzini et al. (2004). «Detection of the natural α decay of tungsten». Phys. Rev. C 70. DOI:10.1103/PhysRevC.70.064606.
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81st edition. — CRC press, 2004. — ISBN 0-8493-0485-7.
- ↑ Tungsten Filled 1 kilo Gold Bar Discovered in UK March 26, 2012, по материалам “Gold Finger – A New Take On Operation Grand Slam With A Tungsten Twist” Nov 12, 2009
- ↑ Salted Gold or a Fishy Tale..? (UPDATED + Graphics) (AGAIN) – Screwtape Files blog, March 25, 2012
- ↑ The Drilled Gold Bars Filled With Tungsten – Forbes, MAR 26, 2012 (англ.)
- ↑ The problem of fake gold bars, Felix Salmon blog, March 25, 2012 (англ.)
Ссылки
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
wiki2.red
Химические свойства вольфрама. Характеристики и применение вольфрама
Вольфрам – это химический элемент периодической системы Менделеева, который принадлежит к VI группе. В природе вольфрам встречается в виде смеси из пяти изотопов. В своем обычном виде и при обычных условиях он представляет собой твердый металл серебристо-серого цвета. Он также является самым тугоплавким из всех металлов.
Основные свойства вольфрама
Вольфрам – это металл, обладающий замечательными физическими и химическими свойствами. Практически во всех отраслях современного производства применяется вольфрам. Формула его обычно выражается в виде обозначения оксида металла – WO3. Вольфрам считается самым тугоплавким из металлов. Предполагается, что лишь сиборгий может быть еще более тугоплавок. Но точно пока этого утверждать нельзя, так как сиборгий имеет очень малое время существования.

Этот металл имеет особые физические и химические свойства. Вольфрам имеет плотность 19300 кг/м3, температура плавления его составляет 3410 °С. По этому параметру он занимает второе место после углерода – графита или алмаза. В природе вольфрам встречается в виде пяти стабильных изотопов. Их массовые числа находятся в интервале от 180 до 186. Вольфрам обладает 6-й валентностью, а в соединениях она может составлять 0, 2, 3, 4 и 5. Металл также имеет достаточно высокий уровень теплопроводности. Для вольфрама этот показатель составляет 163 Вт/(м*град). По этому свойству он превышает даже такие соединения, как сплавы алюминия. Масса вольфрама обусловлена его плотностью, которая равна 19кг/м3. Степень окисления вольфрама колеблется от +2 до +6. В высших степенях своего окисления металл имеет кислотные свойства, а в низших – основные.
При этом сплавы низших соединений вольфрама считаются неустойчивыми. Самыми стойкими являются соединения со степенью +6. Они проявляют и наиболее характерные для металла химические свойства. Вольфрам имеет свойство легко образовывать комплексы. Но металлический вольфрам обычно является очень стойким. Он начинает взаимодействовать с кислородом лишь при температуре +400 °С. Кристаллическая решетка вольфрама относится к типу кубических объемноцентрированных.
Взаимодействие с другими химическими веществами
Если вольфрам смешать с сухим фтором, то можно получить соединение под названием “гексафторид”, который плавится уже при температуре 2,5 °С, а закипает при 19,5 °С. Похожее вещество получают при соединении вольфрама с хлором. Но для такой реакции необходима достаточно высокая температура – порядка 600 °С. Однако вещество легко противостоит разрушительному действию воды и практически не подвергается изменениям на холоде. Вольфрам – металл, который без кислорода не производит реакции растворения в щелочах. Однако он легко растворяется в смеси HNO3 и HF. Самые главные из химических соединений вольфрама – это его трехокись WO3, Н2WO4 – вольфрамовая кислота, а также ее производные – соли вольфраматы.

Можно рассмотреть некоторые химические свойства вольфрама с уравнениями реакций. Например, формула WO3 + 3H2 = W+3H2O. В ней металл вольфрам восстанавливается из оксида, проявляется его свойство взаимодействия с водородом. Это уравнение отражает процесс получения вольфрама из его триоксида. Следующей формулой обозначается такое свойство, как практическая нерастворимость вольфрама в кислотах: W + 2HNO3 + 6HF = WF6 + 2NO + 4h3O. Одним из наиболее примечательных веществ, содержащих вольфрам, считается карбонил. Из него получают плотные и ультратонкие покрытия из чистого вольфрама.
История открытия
Вольфрам – металл, получивший свое название из латинского языка. В переводе это слово означает «волчья пена». Такое необычное название появилось из-за поведения металла. Сопровождая добытую оловянную руду, вольфрам мешал выделению олова. Из-за него в процессе выплавки образовывались только шлаки. Об этом металле говорили, что он «поедает олово, как волк ест овцу». Для многих интересно, кто открыл химический элемент вольфрам?
Это научное открытие было сделано одновременно в двух местах разными учеными, независимо друг от друга. В 1781 году химик из Швеции Шееле получил так называемый «тяжелый камень», проводя опыты с азотной кислотой и шеелитом. В 1783 году братья-химики из Испании по фамилии Элюар также сообщил об открытии нового элемента. Точнее, ими был открыт оксид вольфрама, растворявшийся в аммиаке.
Сплавы с другими металлами
В настоящее время различают однофазные и многофазные вольфрамовые сплавы. Они содержат один или несколько посторонних элементов. Самое известное соединение – это сплав вольфрама и молибдена. Добавление молибдена придает вольфраму прочность при его растяжении. Также к категории однофазных сплавов принадлежат соединения вольфрама с титаном, гафнием, цирконием. Самую большую пластичность вольфраму придает рений. Однако практически применять такой сплав – довольно трудоемкий процесс, так как рений очень тяжело добыть.

Так как вольфрам является одним из самых тугоплавких материалов, то получать вольфрамовые сплавы – непростая задача. Когда этот металл только начинает закипать, другие уже переходят в жидкость или состояние газа. Но современные ученые умеют получать сплавы при помощи процесса электролиза. Сплавы, содержащие вольфрам, никель и кобальт, используются для нанесения защитного слоя на непрочные материалы.
В современной металлургической промышленности также получают сплавы, используя вольфрамовый порошок. Для его создания необходимы особенные условия, включая создание вакуумной обстановки. Из-за некоторых особенностей взаимодействия вольфрама с другими элементами металлурги предпочитают создавать сплавы не двухфазной характеристики, а с применением 3, 4 и более составляющих. Эти сплавы особенно прочны, но при четком соблюдении формул. При малейших отклонениях процентных составляющих сплав может получиться хрупким и непригодным к использованию.
Вольфрам – элемент, применяющийся в технике
Из этого металла изготавливают нити накаливания обыкновенных лампочек. А также трубки для рентгеновских аппаратов, составляющие вакуумных печей, которые должны использоваться при крайне высоких температурах. Сталь, в состав которой входит вольфрам, имеет очень высокий уровень прочности. Такие сплавы используются для изготовления инструментов в самых различных областях: для бурения скважин, в медицине, машиностроении.

Главное преимущество соединения стали и вольфрама – износоустойчивость, маловероятность повреждений. Самый известный в строительстве вольфрамовый сплав носит название «победит». Также этот элемент широко используется в химической промышленности. С его добавлением создают краски, пигменты. Особенно широкое применение в этой сфере получил оксид вольфрама 6. Его применяют для изготовления карбидов и галогенидов вольфрама. Другое название этого вещества – триоксид вольфрама. Оксид вольфрама 6 используется как желтый пигмент в красках для керамики и изделий из стекла.
Что такое тяжелые сплавы?
Все сплавы на основе вольфрама, которые обладают высоким показателем плотности, называют тяжелыми. Их получают только при помощи методов порошковой металлургии. Вольфрам всегда является основой тяжелых сплавов, где его содержание может составлять до 98 %. Кроме этого металла, в тяжелые сплавы добавляется никель, медь и железо. Однако в них могут входить и хром, серебро, кобальт, молибден. Самую большую популярность получили сплавы ВМЖ (вольфрам – никель – железо) и ВНМ (вольфрам – никель – медь). Высокий уровень плотности таких сплавов позволяет им поглощать опасное гамма-излучение. Из них изготавливают маховики колес, электрические контакты, роторы для гироскопов.
Карбид вольфрама
Около половины всего вольфрама применяется для изготовления прочных металлов, особенно вольфрамового карбида, который имеет температуру плавления 2770 С. Карбид вольфрама представляет собой химическое соединение, в котором содержится равное количество атомов углерода и вольфрама. Этот сплав имеет особые химические свойства. Вольфрам придает ему такую прочность, что по этому показателю он превосходит сталь в два раза.

Карбид вольфрама широко используется в промышленности. Из него изготавливают режущие предметы, которые должны быть очень устойчивы к высоким температурам и истиранию. Также из этого элемента изготавливают:
- Детали самолетов, двигатели автомобилей.
- Детали для космических кораблей.
- Медицинские хирургические инструменты, которые применяются в сфере полостной хирургии. Такие инструменты дороже обычной медицинской стали, однако они более производительны.
- Ювелирные изделия, особенно обручальные кольца. Такая популярность вольфрама связана с его прочностью, которая для венчающихся символизирует прочность взаимоотношений, а также внешним видом. Характеристики вольфрама в отполированном виде таковы, что он в течение очень длительного времени сохраняет зеркальный, блестящий вид.
- Шарики для шариковых ручек класса люкс.
Победит – сплав вольфрама
Приблизительно во второй половине 1920-х годов во многих странах начали выпускаться сплавы для режущих инструментов, которые получали из карбидов вольфрама и металлического кобальта. В Германии такой сплав назывался видиа, в Штатах – карбола. В Советском Союзе такой сплав получил название «победит». Эти сплавы оказались прекрасными для обработки чугунной продукции. Победит является металлокерамическим сплавом с чрезвычайно высоким уровнем прочности. Он изготавливается в виде пластинок различных форм и размеров.

Процесс изготовления победита сводится к следующему: берется порошок карбида вольфрама, мелкий порошок никеля или кобальта, и все перемешивается и прессуется в специальных формах. Спрессованные таким образом пластины подвергаются дальнейшей температурной обработке. Это дает очень твердый сплав. Эти пластины используются не только для резки чугуна, но и для изготовления бурильных инструментов. Пластинки из победита напаиваются на бурильное оборудование при помощи меди.
Распространенность вольфрама в природе
Этот металл очень мало распространен в окружающей среде. После всех элементов он занимает 57-е место и содержится в виде кларка вольфрама. Также металл образует минералы – шеелит и вольфрамит. Вольфрам мигрирует в подземные воды либо в виде собственного иона, либо в виде всевозможных соединений. Но его наибольшая концентрация в подземных водах ничтожно мала. Она составляет сотые доли мг/л и практически не меняет их химические свойства. Вольфрам также может попадать в природные водоемы из стоков заводов и фабрик.
Влияние на человеческий организм
Вольфрам практически не поступает в организм с водой или пищей. Может существовать опасность вдыхания вольфрамовых частиц вместе с воздухом на производстве. Однако, несмотря на принадлежность к категории тяжелых металлов, вольфрам не токсичен. Отравления вольфрамом случаются лишь у тех, кто связан с вольфрамовым производством. При этом степень влияния металла на организм бывает разной. Например, вольфрамовый порошок, карбид вольфрама и такое вещество, как ангидрит вольфрамовой кислоты, могут вызывать поражение легких. Его главные симптомы – общее недомогание, лихорадка. Более сильные симптомы возникают при отравлении сплавами вольфрама. Это происходит при вдыхании пыли сплавов и приводит к бронхитам, пневмосклерозу.
Металлический вольфрам, попадая внутрь человеческого организма, не всасывается в кишечнике и постепенно выводится. Большую опасность могут представлять вольфрамовые соединения, относящиеся к растворимым. Они откладываются в селезенке, костях и коже. При длительном воздействии вольфрамовых соединений могут возникать такие симптомы, как ломкость ногтей, шелушение кожи, различного рода дерматиты.
Запасы вольфрама в различных странах
Самые большие ресурсы вольфрама находятся в России, Канаде и Китае. По прогнозам ученых, на отечественных территориях располагается около 943 тысяч тонн этого металла. Если верить этим оценкам, то подавляющая часть запасов расположена в Южной Сибири и на Дальнем Востоке. Очень незначительной является доля разведанных ресурсов – она составляет всего лишь порядка 7 %.

По количеству разведанных залежей вольфрама Россия уступает лишь Китаю. Большая их часть расположена в районах Кабардино-Балкарии и Бурятии. Но в этих месторождениях добывается не чистый вольфрам, а его руды, содержащие также молибден, золото, висмут, теллур, скандий и другие вещества. Две трети получаемых объемов вольфрама из разведанных источников заключены в труднообогатимых рудах, где главным вольфрамосодержащим минералом является шеелит. На долю легкообогатимых руд приходится всего лишь треть всей добычи. Характеристики вольфрама, добываемого на территории России, ниже, чем за рубежом. Руды содержат большой процент триоксида вольфрама. В России очень мало россыпных месторождений металла. Вольфрамовые пески также являются низкокачественными, с большим количеством оксидов.
Вольфрам в экономике
Глобальное производство вольфрама начало свой рост примерно с 2009 года, когда стала восстанавливаться азиатская промышленность. Крупнейшим производителем вольфрама остается Китай. Например, в 2013 году на долю производства этой страны приходился 81 % от мирового предложения. Около 12 % спроса на вольфрам связано с производством осветительных приборов. По прогнозам экспертов, использование вольфрама в этой сфере будет сокращаться на фоне применения светодиодных и люминесцентных ламп как в бытовых условиях, так и на производстве.
Считается, что будет расти спрос на вольфрам в сфере производства электронной техники. Высокая износостойкость вольфрама и его способность выдерживать электричество делают этот металл наиболее подходящим для производства регуляторов напряжения. Однако по объему этот спрос пока остается довольно незначительным, и считается, что к 2018 году он вырастет лишь на 2 %. Однако согласно прогнозам ученых, в ближайшее время должен произойти рост спроса на цементированный карбид. Это связано с ростом автомобильного производства в США, Китае, Европе, а также увеличением горнодобывающей промышленности. Считается, что к 2018 году спрос на вольфрам увеличится на 3,6 %.
fb.ru
Строение атома вольфрама (W), схема и примеры
Общие сведения о строении атома вольфрама
Относится к элементам d-семейства. Металл. Обозначение – W. Порядковый номер – 74. Относительная атомная масса – 183,84 а.е.м.
Электронное строение атома вольфрама
Атом вольфрама состоит из положительно заряженного ядра (+74), внутри которого есть 74 протона и 109 нейтронов, а вокруг, по шести орбитам движутся 74 электрона.
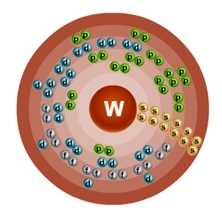
Рис.1. Схематическое строение атома вольфрама.
Распределение электронов по орбиталям выглядит следующим образом:
+74W)2)8)18)32)12)2;
1s22s22p63s23p63d104s24p64f145s25p65d46s2.
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома вольфрама можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
+1/2 |
|
s |
6 |
0 |
0 |
-1/2 |
|
d |
5 |
2 |
-2 |
+1/2 |
|
d |
5 |
2 |
-1 |
+1/2 |
|
d |
5 |
2 |
0 |
+1/2 |
|
d |
5 |
2 |
+1 |
+1/2 |
Наличие четырех неспаренных электронов свидетельствует о том, что степень окисления вольфрама равна +4.
Для вольфрама характерно наличие возбужденного состояния за счет вакантных орбиталей 5p-подуровня (степень окисления +6):
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Вольфрам — Википедия
| Внешний вид простого вещества | |
|---|---|
 Тугоплавкий прочный металл, стального цвета или белый | |
| Свойства атома | |
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d4 6s2 |
| Радиус атома | 141 пм |
| Химические свойства | |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2.3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 В |
| Степени окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,25[2] г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F)[2] |
| Температура кипения | 5828 K (5555 °C, 10031 °F)[2] |
| Уд. теплота плавления | 191 кДж/кг 35 кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27[3] Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| 74 | Вольфрам |
| 4f145d46s2 | |
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом W (лат. Wolframium). При нормальных условиях представляет собой твёрдый блестящий серебристо-серый переходный металл[3].
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек.
История и происхождение названия[править]
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием лат. Spuma lupi («волчья пена») или нем. Wolf Rahm (“волчьи сливки”, “волчий крем”[3][4][5]). Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»).
В 1781 году знаменитый шведский химик Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама)[источник не указан 2408 дней]. В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла[источник не указан 2408 дней]. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Нахождение в природе[править]
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,0013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения[править]
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
 Вольфрамовый порошок
Вольфрамовый порошокПроцесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Физические свойства[править]
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C)[2]. Плотность чистого вольфрама составляет 19,25 г/см³[2]. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32·10−9). Твердость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжелых, твердых и самых тугоплавких металлов[3]. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Химические свойства[править]
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот[6]:
Реагирует с расплавленными щелочами в присутствии окислителей[7]:
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам[править]
 Нить накаливания
Нить накаливания- Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргоно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Соединения вольфрама[править]
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам. ( Р18, Р6М5. от rapid — быстрый, скорость)
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
Другие сферы применения[править]
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама[8][править]
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Биологическая роль[править]
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни[9].
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Природный вольфрам состоит из смеси пяти изотопов (180W, 182W, 183W, 184W и 186W). Искусственно созданы и идентифицированы ещё 30 радионуклидов. В 2003 открыта[10] чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180W, имеющего период полураспада 1,8·1018 лет[11].
Интересные факты[править]
- Вольфрам — самый тугоплавкий металл. Температура плавления — 3422 °C, кипения — 5555 °C[2]. Примерно такую же температуру имеет фотосфера Солнца[12]. Критическая температура вольфрама равняется 13 610 °C. Это та температура, при которой вольфрам не может быть сконденсирован в виде жидкости из газа ни при каком давлении. [13]
- Плотность вольфрама почти равняется плотности золота: 19,25 г/см³ против 19,32 г/см³ соответственно[2].
- В 2009 году рядом инвестиционных банков по отношению друг к другу были совершены мошеннические действия по подлогу слитков золота на позолоченные вольфрамовые[14].
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. —,. —. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ 2,02,12,22,32,42,52,6 Tungsten: physical properties (англ.). WebElements. Проверено 17 августа 2013.
- ↑ 3,03,13,23,3 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- ↑ О.Д. Липшиц, Карманный немецко-русский словарь, М:”Русский язык”-Leipzig^”VEB Verlag Enzyklopädie” 1983, с.211, 296
- ↑ Rahm on Google
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- ↑ по данным “Цены на вольфрам”
- ↑ Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь — Палеонтологический журнал — 2003 — № 6 — с. 33-40
- ↑ F. A. Danevich et al. (2003). «α activity of natural tungsten isotopes». Phys. Rev. C 67. DOI:10.1103/PhysRevC.67.014310.
- ↑ C. Cozzini et al. (2004). «Detection of the natural α decay of tungsten». Phys. Rev. C 70. DOI:10.1103/PhysRevC.70.064606.
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81st edition. — CRC press, 2004. — ISBN 0-8493-0485-7.
- ↑ Жёлтая пресса: (2009). «В Великобритании обнаружен заполненный вольфрамом килограммовый слиток золота».
| Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
wp.wiki-wiki.ru
Область применения, формула и свойства вольфрама
Что представляет собой вольфрам? Основные свойства данного элемента базируются на особенностях его химического строения. Учитывая востребованность вольфрама, необходимо детальнее разобрать его строение.

Положение в таблице Менделеева
Рассматривая основные свойства вольфрамам, начнем с того, что он имеет 74-й порядковый номер. При нормальных условиях он собой представляет переходный металл, имеющий серо-серебристый цвет. Вольфрам твердый, обладает металлическим блеском. Это самый тугоплавкий элемент, большей температурой плавления обладает только углерод. Электронная формула: KLMN5s25p65d46s2, Eион (Ме => Ме+ + e) = 7,98 эВ.

История происхождения
Своему необычному названию данный металл обязан минералу вольфрамиту. «Волчья пена» известна с 16 века. Такое необычное наименование минерала объясняется наличием в нем оловянных руд. Вольфрам мешал выплавлять олово, переводил его в пену из шлаков. Какие физические свойства вольфрама стали основой его широкого применения в промышленности? В США данный металл называли «тяжелым камнем».
В конце 18 века швед Шееле при обработке минерала азотной кислотой получил шеелит, получив триоксид вольфрама. Чуть позже братьям Элиар удалось получить окись вольфрамам из саксонского вольфрамита. Именно этими химиками были выявлены некоторые химические свойства вольфрама.

Нахождение в природе
Есть ли в природе в чистом виде вольфрам? Химические свойства данного металла предполагают его присутствие в земной коре по большей части в виде соединений. Например, есть смесь оксидов марганца, железа, вольфрама. Для промышленного применения выбирают соединения ферберит и гюбнерит. В них помимо вольфрама присутствуют железо и марганец. Физические свойства вольфрама позволяют выделять металл и из вольфрамовых минералов. В них его концентрация не превышает двух процентов. Среди крупнейших месторождений вольфрама отметим Китай, США, Казахстан. Кроме того, выявлены и существенные запасы руд данного металла в Южной Корее, Боливии, России, Португалии. Отличные физические свойства вольфрама предполагают его существенное промышленное производство. В мире ежегодно производят порядка 50 тысяч тонн этого тугоплавкого элемента. Главными экспортерами вольфрама считают Южную Корею, Китай, Австрию. Среди импортеров тугоплавкого металла пальма лидерства принадлежит Великобритании, Японии, США, Германии.

Особенности производства
Получение вольфрама осуществляется через промежуточную стадию, подразумевающую выделение из рудного концентрата триоксида вольфрама. Далее осуществляется восстановление его до порошкообразного металла. Подобный этап происходит при температуре около 700 градусов Цельсия. Какие физические свойства вольфрама лежат в основе данной технологии? Высокая температура его плавления позволяет с помощью порошкообразной металлургии подвергать порошок прессованию, спеканию в атмосфере водорода при температуре около 1300 градусов Цельсия. Далее через полученный вольфрам пропускают электрический ток. При нагревании металла до температуры в 3000 градусов наблюдается монолитный материал. Путем зонной плавки осуществляется последующая очистка и получение монокристаллического металла.
Свойства
Какие характеристики имеет вольфрам? Химические свойства его основываются на высокой температуре плавления. Элемент проявляет валентности от 2 до 6. Самым устойчивым является вольфрам с валентностью шесть. Металл характеризуется повышенной коррозионной стойкостью. Он не окисляется на воздухе при комнатной температуре. В оксид вольфрама он превращается только при достижении температуры белого коленья. В электрохимическом ряду напряжений металлов данный элемент располагается после водорода, поэтому он не растворяется в разбавленной плавиковой и серной кислотах. Вольфрам способен растворяться в пероксиде водорода, а также в смеси плавиковой и азотной кислот.
При наличии окислителей данный металл способен реагировать с расплавленными щелочами. Сначала взаимодействие протекает достаточно медленно, но после достижения температуры 400 градусов наблюдается самопроизвольное разогревание металла, которое ускоряет реакцию. Вольфрам в смеси плавиковой и азотной кислот образует гексафторвольфрамовую кислоту. В максимальном количестве в промышленности применяют вольфрамовый ангидрид. У вольфроматов есть способность к созданию полимерных анионов. Этот металл является основой тугоплавких материалов в современной металлургии.

Сферы применения
Как можно использовать карбид вольфрама? Свойства данного соединения позволяют выделять из него чистый вольфрам. Пластичность и тугоплавкость металла сделали его основой при создании нитей накаливания в многочисленных осветительных приборах. Кроме того, вольфрам используют в вакуумных трубках и кинескопах. Так как у этого элемента высокая плотность, он стал базой для производства тяжелых сплавов. Они незаменимы при создании противовесов, подкалиберных и бронебойных сердечников, сверхскоростных роторов гироскопов для создания баллистических ракет. В больших объемах вольфрам применяют при аргоново-дуговой сварке как электрод. Сплавы, которые в своем составе содержат вольфрам, имеют высокую жаропрочность, кислотостойкость, они устойчивы к механическим деформациях. Подобные характеристики позволяют применять их для производства хирургических инструментов, брони танков, двигателей самолетов, контейнеров для размещения радиоактивных веществ. Именно вольфрам является важным компонентом для изготовления высококачественных марок сталей.
Применяют его и в высокотемпературных вакуумных печах в виде нагревательного элемента. В сплаве с рением из него создают термопары для подобных печей.

Заключение
Именно благодаря высокой плотности вольфрама металл удобен для защиты поверхности от ионизирующего излучения. Повышенная твердость и тугоплавкость металла создают существенные сложности с его обработкой. Для решения проблемы вводят в состав никель, медь, железо. Стойкость вольфрама сделала его востребованным при изготовлении конструкционных материалов в современном машиностроении.
Он необходим при фрезеровании, долблении, точении, бурении скважин. Например, победит состоит из карбида вольфрама. Эта смесь наносится на сверла, применяемые при создании отверстий в бетоне. Сульфид вольфрама выступает в качестве высокотемпературной смазки. Он востребован в производстве. Часть соединений вольфрама используется в виде пигментов и катализаторов. Применяют соединения данного металла и как легирующий элемент в сплавах и сталях на базе железа. Биологической ценности металлический вольфрам не имеет.
fb.ru
Вольфрам — Википедия
| Внешний вид простого вещества | |
|---|---|
 Тугоплавкий прочный металл, стального цвета или белый | |
| Свойства атома | |
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d4 6s2 |
| Радиус атома | 141 пм |
| Химические свойства | |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2.3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 В |
| Степени окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,25[2] г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F)[2] |
| Температура кипения | 5828 K (5555 °C, 10031 °F)[2] |
| Уд. теплота плавления | 191 кДж/кг 35 кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27[3] Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| 74 | Вольфрам |
| 4f145d46s2 | |
Вольфра́м — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом W (лат. Wolframium). При нормальных условиях представляет собой твёрдый блестящий серебристо-серый переходный металл[3].
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек.
История и происхождение названия[править]
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием лат. Spuma lupi («волчья пена») или нем. Wolf Rahm (“волчьи сливки”, “волчий крем”[3][4][5]). Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»).
В 1781 году знаменитый шведский химик Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама)[источник не указан 2408 дней]. В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла[источник не указан 2408 дней]. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Нахождение в природе[править]
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,0013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения[править]
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
 Вольфрамовый порошок
Вольфрамовый порошокПроцесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Физические свойства[править]
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Температура плавления — 3695 K (3422 °C), кипит при 5828 K (5555 °C)[2]. Плотность чистого вольфрама составляет 19,25 г/см³[2]. Обладает парамагнитными свойствами (магнитная восприимчивость 0,32·10−9). Твердость по Бринеллю 488 кг/мм², удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м. Скорость звука в отожжённом вольфраме 4290 м/с.
Вольфрам является одним из наиболее тяжелых, твердых и самых тугоплавких металлов[3]. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Химические свойства[править]
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот[6]:
Реагирует с расплавленными щелочами в присутствии окислителей[7]:
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам[править]
 Нить накаливания
Нить накаливания- Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргоно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Соединения вольфрама[править]
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам. ( Р18, Р6М5. от rapid — быстрый, скорость)
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
Другие сферы применения[править]
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама[8][править]
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Биологическая роль[править]
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни[9].
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Природный вольфрам состоит из смеси пяти изотопов (180W, 182W, 183W, 184W и 186W). Искусственно созданы и идентифицированы ещё 30 радионуклидов. В 2003 открыта[10] чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180W, имеющего период полураспада 1,8·1018 лет[11].
Интересные факты[править]
- Вольфрам — самый тугоплавкий металл. Температура плавления — 3422 °C, кипения — 5555 °C[2]. Примерно такую же температуру имеет фотосфера Солнца[12]. Критическая температура вольфрама равняется 13 610 °C. Это та температура, при которой вольфрам не может быть сконденсирован в виде жидкости из газа ни при каком давлении. [13]
- Плотность вольфрама почти равняется плотности золота: 19,25 г/см³ против 19,32 г/см³ соответственно[2].
- В 2009 году рядом инвестиционных банков по отношению друг к другу были совершены мошеннические действия по подлогу слитков золота на позолоченные вольфрамовые[14].
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. —,. —. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ 2,02,12,22,32,42,52,6 Tungsten: physical properties (англ.). WebElements. Проверено 17 августа 2013.
- ↑ 3,03,13,23,3 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- ↑ О.Д. Липшиц, Карманный немецко-русский словарь, М:”Русский язык”-Leipzig^”VEB Verlag Enzyklopädie” 1983, с.211, 296
- ↑ Rahm on Google
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- ↑ по данным “Цены на вольфрам”
- ↑ Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь — Палеонтологический журнал — 2003 — № 6 — с. 33-40
- ↑ F. A. Danevich et al. (2003). «α activity of natural tungsten isotopes». Phys. Rev. C 67. DOI:10.1103/PhysRevC.67.014310.
- ↑ C. Cozzini et al. (2004). «Detection of the natural α decay of tungsten». Phys. Rev. C 70. DOI:10.1103/PhysRevC.70.064606.
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81st edition. — CRC press, 2004. — ISBN 0-8493-0485-7.
- ↑ Жёлтая пресса: (2009). «В Великобритании обнаружен заполненный вольфрамом килограммовый слиток золота».
| Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
www.wiki-wiki.ru
Вольфрам
Вольфра́м — химический элемент таблицы Менделеева с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium), твёрдый серый переходный металл. Главное применение — как основа тугоплавких материалов в металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
История и происхождение названия
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» по-немецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»). В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»). В 1781 знаменитый шведский химик Шееле , обрабатывая азотной кислотой минерал шеелит, получил желтый «тяжелый камень». В 1783 испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита жёлтой окиси нового металла, растворимой в аммиаке. При этом один из братьев, Фаусто, был в Швеции в 1781 и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Получение
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Свойства
Физические Вольфрам — светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). Вольфрам является одним из наиболее тяжелых, твердых и самым тугоплавким металлом. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить. Химические Валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют. Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOx, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru

