Характеристика химический элемент алюминий – Урок №49. Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
alexxlab | 24.11.2019 | 0 | Разное
Урок по теме “Алюминий — химический элемент, простое вещество”
Цели урока:
Обучающая – изучить физические и химические свойства алюминия и области его применения. Рассмотреть характеристику химического элемента алюминия и изучить строение атома.
Развивающая – развивать умения в проведении эксперимента, перенесении содержания научно-познавательного текста в форму схем; развитие коммуникативных способностей, умения слушать, умение правильно высказывать свои мысли.
Воспитательная – воспитывать культуру работы с химическими веществами, соблюдение правил техники безопасности, воспитывать сознательную дисциплинированность, четкость и организованность в работе.
Учащиеся должны знать:
строение атома алюминия, физические и химические свойства алюминия как простого вещества, области применения.
Учащиеся должны уметь:
давать характеристику алюминия, как химического элемента, так и простого вещества. Записывать уравнения реакций, доказывающие химические свойства алюминия в молекулярном и окислительно-восстановительном виде.
Тип урока:
изучение нового материала.
Форма организации учебной деятельности учащихся:
групповая работа, индивидуальная, химический эксперимент.
Методы и приемы обучения:
поисковый, частично-исследовательский, демонстрационный химический эксперимент, работа в группах, устные ответы у доски, самостоятельная работа с текстами, взаимоконтроль.
Оборудование урока:
научно-познавательные тексты по теме урока, карточки-задания по отдельному вопросы плана изучения материала для каждой группы, ПСХЭ,
Коллекция «Алюминий и его соединения», алюминиевая фольга, соляная кислота и гидроксид натрия, алюминий, лабораторное оборудование.
Содержание урока:
1. Организационный момент.
Учитель приветствует учащихся.2. Актуализация опорных знаний, сообщение темы, задач и структуры проведения урока:
Вступительное слово учителя
Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Мы продолжаем изучение большой и важной темы «Металлы». Сегодня на уроке нам предстоит познакомиться с металлом хорошо известным вами с детства. Данный урок я хочу начать с легенды.
«Однажды к римскому императору Тиберию пришел незнакомец. В дар императору он принес изготовленную им чашу из блестящего, как серебро, но чрезвычайно легкого металла. Мастер поведал, что получил этот металл из «Глинистой земли». Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить». О каком металле идет речь?
(Об алюминии)
Учитель:
– Таким образом, тема нашего урока: «Алюминий – химический элемент и простое вещество».
Формулируются задачи урока.
План изучения темы в группах:
- Характеристика химического элемента алюминия по положению его в ПСХЭ.
- Физические свойства алюминия.
- Химические свойства алюминия.
- Применение алюминия и нахождение его в природе.
План работы в группе:
– изучите текст и выделите сведения, относящиеся к своему вопросу;
– выполните предложенные задания;
Групповая работа по изучению материала.
Подготовка выступления по своему вопросу.
Группа 1.
Характеристика химического элемента алюминия по положению его в ПСХЭ.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Дайте характеристику алюминию по положению в ПСХЭ по плану:
А) порядковый номер.
Б) атомная масса.
В) период (малый, большой).
Г) группа (подгруппа: главная или побочная).
Д) химический знак.
Е) Строение атома (заряд ядра, число протонов, электронов, нейтронов, электронная формула).
И) оксиды.
К) летучие водородные соединения.
2. Обсудите в группе полученные результаты и ответьте на вопросы:
- Сколько электронов находится на внешнем уровне атома алюминия?
- Алюминий будет отдавать или принимать данные электроны?
- Какую степень окисления будет приобретать при этом ион алюминия?
- Сделайте вывод: К какому классу соединений относится алюминий (металл или неметалл)
- Сравните активность химического элемента алюминия с элементами 1 и 2 групп этого же периода.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 2.
Физические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Рассмотрите коллекцию «Алюминий и его сплавы».
- Обсудите в группе вопросы:
- а) Агрегатное состояние, цвет, блеск, плотность (легкий или тяжелый), плавкость (легко –или тугоплавкий), электро- и теплопроводность, пластичный.
- б) Полученные данные изобразите в виде схемы.
5. Подготовьте выступление поданному вопросу, основываясь на краткости четкости изложении.
Группа 3.
Химические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Изучите, как ведет себя алюминий по отношению к сложным веществам?
- Выполните лабораторную работу, используя инструкцию
Инструкция по выполнению лабораторной работы Цель: Изучить отношение алюминия к кислотам и щелочам. Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку, направляя отверстие в сторону от себя и соседа. Спиртовку поджигайте только при помощи спичек. Опыт 1. В пробирку положите 1 гранулу алюминия и прилейте 3-4 мл раствора соляной кислоты. Пробирку слегка прогрейте. Опыт 2. В пробирку положите 1 гранулу алюминия и прилейте 3-4 мл. раствора гидроксида натрия. Пробирку слегка прогрейте |
Задание:
А) Выполните опыты.
Б) Обговорите в группе наблюдаемые явления.
В) Запишите уравнение реакций.
Г) Сделайте выводы.
5. Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 4.
Применение алюминия.
Задание:- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Обсудите в группе следующие вопросы:
а) Какова роль алюминия в жизни человека?
б) Применение алюминия, как простого вещества.
- Составьте схему, характеризующую области применения алюминия.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении
- Отчет групп по изученным вопросам.
Каждая группа, выполнив все задания, представляет схематизированное изложение своего вопроса с обсуждением и комментариями, учащиеся делают записи, переносят предложенные схемы в тетради, в результате всех групп поэтапно составляется опорный конспект по теме урока.
Выводы по теме урока:
– Какое количество электронов находится на внешнем энергетическом уровне атома алюминия.
– Какую степень окисления имеет атом алюминия? Почему? А ион?– При помощи каких опытов мы доказали, что алюминий – это активный металл?
– Какие вещества называются амфотерными?
– На каких свойствах основаны следующие области применения?
– Где в организме больше всего содержится алюминия?
– Можно ли длительное время хранить продукты питания в алюминиевой посуде?
- Домашнее задание: § 13 до стр. 60, ? 1, 4. Подготовить презентацию по применению алюминия.
- Заключительное слово учителя.
Учитель благодарит учащихся за сотрудничество, выставляет оценки выступающим у доски.
Справка.
Алюминий.
В главную подгруппу III группы входят элементы: бор, алюминий, галлий, индий, таллий. На внешнем электронном слое атомы этих элементов содержат три электрона (…ns2np1). Они являются р-элементами. В реакциях атомы этих элементов являются восстановителями, за исключением неметалла бора, он может быть окислителем. Все элементы этой подгруппы проявляют высшую степень окисления +3. Они образуют высшие оксиды Э2О3 и гидроксиды Э(ОН)3, которые проявляют амфотерные свойства. Наибольший интерес в этой подгруппе представляют алюминий.
Алюминий в свободном виде – серебристо-белый металл, обладает блеском, высокой тепло-электропроводностью (уступает в этом отношении меди), легкий (плотность 2,7 г/см3) и одновременно – это прочный металл. Является мягким, пластичным металлом, его можно прокатывать в фольгу, вытягивается в проволоку. Плавится при температуре 6600С. При 6000С алюминий становится хрупким и его можно истолочь в зерна или в порошок.
Алюминий – металл, поверхность которого обычно покрыта тонкой, прочной оксидной пленкой. Виде стружек и порошка он ярко горит на воздухе, выделяя большое количество теплоты.
При комнатной температуре активно реагирует с галогенами, при нагревании взаимодействует с серой (2000С), азотом (8000 С) и другими неметаллами.
Отношение алюминия к сложным веществам:
Алюминий растворяется в соляной кислоте любой концентрации:
Алюминий растворяется в растворах щелочей:
Алюминий играет важную биологическую роль в жизни человека. Он принимает участие в построении эпителиальной и соединительной тканях. Содержание алюминия в организме человека (на 70 кг массы тела) составляет 61 мг. Находится во всех органах и тканях: больше всего в печени, легких, костях головном мозге. Основным поступлением алюминия в организм является пища – это хлебопродукты, чай (от 20 – 200мг на 100г. продукта), картофель – 4 мг на 100г. продукта, желтая репа – 46 мг на 100 г. продукта.
При приготовлении и хранении пищи в алюминиевой посуде содержание алюминия в продуктах увеличивается вдвое. Повышение содержания алюминия в крови вызывает возбуждение центральной нервной системы. При избытке алюминия в организме нарушается двигательная активность, судороги, ослабление памяти, заболевание печени и почек. При понижении содержания алюминия происходит торможение центральной нервной системы.
Области применения алюминия весьма многочисленны. Благодаря легкости и прочности алюминий и его сплавы применяют в самолето- и ракетостроении (алюминий называют крылатым металлом), строительстве судов и автомобилей; в строительстве- для изготовления оконных рам и дверей, легкость и хорошая электрическая проводимость алюминия используется при изготовлении электрических проводов для линии электропередач. Теплопроводность и неядовитость важны при изготовлении алюминиевой посуды и фольги для хранения пищевых продуктов. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии. Способность алюминия гореть в воздухе ярким пламенем, используется при приготовлении красочных фейерверков и изготовление бенгальских огней.
urok.1sept.ru
Презентация к уроку по химии (9 класс) по теме: АЛЮМИНИЙ: ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО
УРОК ХИМИИ В 9 КЛАССЕ ПО ТЕМЕ:
“АЛЮМИНИЙ: ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО”
Урок № 14 в теме “Металлы”, по учебнику О.С. Габриеляна “Химия, 9 класс”, составлен в соответствии с образовательной программой с использованием субъектного опыта учащихся.
Цель урока: изучить особенности строения атома алюминия, а также физические и химические свойства простого вещества.
Задачи урока:
Образовательные: изучение особенностей атома алюминия, его физических и химических свойств,
развитие представления о переходных химических элементах,
Воспитательные: воспитание культуры работы с химическим оборудованием и реактивами,
Развивающие: развитие умения и навыка самостоятельной и групповой деятельности;
Основные понятия: химический знак “Аl”, химический элемент, простое вещество, электронная оболочка, степень окисления, переходный элемент, амфотерные свойства соединения.
Оборудование: Периодическая система химических элементов Д.И.Менделеева, коллекция “Алюминий и его сплавы”, алюминий: фольга, проволока, порошок, растворы соляной кислоты и гидроксида натрия.
Тип урока: изучение нового материала
ХОД УРОКА
І. Организационный момент.
ІІ. Изучение нового материала.
1. Погружение в тему урока.
Учитель: – Мы продолжаем изучение большой и важной темы “Металлы”. Сегодня нам предстоит познакомиться с металлом хорошо знакомым вам с детства. Историю открытия этого металла можно озаглавить как «Серебро из глины».
“Однажды к римскому императору Тиберию пришёл незнакомец. В дар императору он принёс изготовленную им чашу из блестящего, как серебро, но чрезвычайно лёгкого металла. Мастер поведал, что получил этот металл из “глинистой земли”. Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить”.
Только в 1827 году нем. химик Ф. Вёлер получил новый металл. На эти эксперименты ему понадобилось 18 лет! К тому времени металл успел стать популярным, но, поскольку его получали в мизерных количествах, цены на него превышали цены на золото!
О каком металле идёт речь?
(Ответ: об алюминии)
Учитель: – Таким образом, тема нашего урока: “Алюминий – химический элемент и простое вещество”. Запишите тему в тетради.
Цель урока – изучить особенности строения атома алюминия, а также физические и химические свойства простого вещества.
2. Актуализация и обогащение субъективного опыта учащихся.
Учитель: – С чего мы начинаем изучение химического элемента?
Учащийся: – С характеристики его положения в Периодической системе Д.И.Менделеева.
Учитель: – итак, дайте характеристику химического элемента алюминия, используя следующий план
План – характеристика химического элемента |
а) порядковый номер, б) номер периода (малый или большой), в) номер группы (главная или побочная)
а) заряд ядра, б) число протонов, в) число нейтронов, г) число электронов
|
Кратко запишите характеристику элемента в тетради:
Символ AI Порядковый номер ____, Номер периода ________ , Номер группы и подгруппы ___________ . |
Состав атома 27 Al (13 1 р + 14 1 n) 13 ℮ |
Строение электронной оболочки Al +13 )2 )8 )3 |
Рефлексия этапа работы.
После выполнения задания в классе разворачивается коллективное обсуждение по следующим вопросам учителя:
1. Сколько электронов находится на внешнем энергетическом уровне атома алюминия?
Ответ: три электрона.
2. Какую степень окисления проявляет алюминий в сложных веществах?
Ответ: +3
3. Алюминий будет отдавать или принимать электроны? Какие свойства он при этом проявляет?
Ответ: отдавать электроны, проявляет восстановительные свойства.
Значит алюминий это…
Ответ: металл.
Какой же это металл: активный или неактивный?
Ответы могут быть разные: из своего жизненного опыта ребята отвечают, что это неактивный металл (алюминиевые провода не реагируют с водой), другие делают предположение об активности алюминия, так как он находится в электрохимическом ряду напряжения металлов сразу после активных металлов.
Учитель: – Для решения вопроса об активности алюминия, что мы должны рассмотреть?
Учащийся: – Физические и химические свойства алюминия, как простого вещества.
Учитель: – Используя свои наблюдения, жизненный опыт перечислите физические свойства алюминия и область его применения. Заполните таблицу.
Характеристика физических свойств алюминия и область его применения
Таблица. Физические свойства алюминия и область их применения
Физические свойства алюминия | Область применения |
Серебристо- белого цвета | Столовые приборы |
Твердость. Аl – 2,9 | Столовая посуда |
Плотность. Аl – 2,7 , лёгкий | Авиа- и судостроение |
Большая электро- и теплопроводность | Провода, электротехника |
Очень пластичен | фольга |
Учитель: – Смогли ли мы, рассмотрев физические свойства алюминия, ответить на вопрос об его активности?
Учащийся: – Нет.
Учитель: – Рассмотрим химические свойства алюминия.
– Посмотрим, как ведёт себя алюминий по отношению к простым веществам
Учитель демонстрирует «Взаимодействие алюминия с простыми веществами: йодом, серой и кислородом».
Опыт 1. Взаимодействие алюминия с йодом.
Предварительно готовят смесь порошка алюминия с йодом (в массовых соотношениях 1:15). Данную смесь помещают в фарфоровую чашку горкой. Из пипетки на середину смеси капают несколько капель воды. Происходит бурная химическая реакция.
Наблюдают выделение фиолетовых паров йода и горение металла.
Опыт 2. Взаимодействие алюминия с серой.
Смешивают размельченную серу и порошок алюминия в соотношениях 1:1. Смесь поместить в фарфоровую чашку или асбестовую сетку. Горящей лучинкой поджечь смесь. Наблюдаем реакцию.
Опыт 3. Горение алюминия.
Порошок алюминия помещаем в ложечку для сжигания веществ. Сверху кладём кусочек магниевой ленты или в её отсутствии 2–3 спичечные головки. Поджигаем. После начала горения, ложечку вносим в колбу с предварительно набранным кислородом.
Наблюдаем яркое ослепительное пламя.
Учитель: – где можно наблюдать подобное явление?
Ответ: при горение бенгальских огней.
Учитель: – При каких условиях алюминий реагировал с простыми веществами?
Учащийся: – При использовании дополнительной энергии или катализатора (Н2О).
Учитель: – Какой вывод можно сделать об активности алюминия?
Учащийся: – Вывод: алюминий – активный металл.
После демонстрации учащимся предлагается выполнить задание по выяснению отношения алюминия к простым веществам.
Задание в тетрадях (Групповая работа)
Характеристика химических свойств алюминия
Цель: выяснить отношение алюминия к простым веществам – йоду, сере, кислороду, как восстановителя.
Учитель: –
1. Напишите уравнения реакций, происходящих между алюминием и йодом, алюминием и кислородом.
2. Укажите окислитель и восстановитель.
3. Сделайте вывод о химической активности алюминия по отношению к простым веществам.
4. Проверьте друг у друга правильность записей по образцу.
5* Если вы затрудняетесь в написании окислительно-восстановительной реакции, пользуйтесь алгоритмом.
Алгоритм для выполнения заданий на окисление – восстановление |
1. Определите степени окисления элементов в обеих частях уравнения. |
Образец выполнения задания в тетради
2Al0 + 3 I20 = 2 AlI3 (кат. вода) Al0 – 3℮ → Al+3 (восстановитель, процесс окисления) I02 + 2℮ → 2I-1 (окислитель, процесс восстановления) |
4 Al0 + 3 О20 = 2 Al2О3 (нагревание) Al0 – 3℮ → Al+3 (восстановитель, процесс окисления) О02 + 4℮ → 2О-2 (окислитель, процесс восстановления) |
Учитель: – Посмотрим, как ведёт себя алюминий по отношению к сложным веществам: к воде, кислотам, щелочам, к оксидам тяжёлых металлов?
А) Отношение к воде
Учитель: – При комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой оксидной плёнкой, которая и защищает металл от внешних воздействий. Именно из-за наличия оксидной плёнки на поверхности алюминий не способен реагировать ни с водой, ни с концентрированными серной и азотной кислотами. Поэтому эти кислоты перевозят в алюминиевых цистернах.
А теперь посмотрите на экран. Демонстрация видеофрагмента. В9-47
Учитель: – Итак, из видеозаписи видно, что алюминий всё таки взаимодействует с водой. Чем это можно объяснить?
Ученики: – Взаимодействие возможно после удаления с поверхности алюминия оксидной плёнки.
Учитель: – Какие продукты реакции при этом образуются? Запишите уравнения реакции взаимодействия алюминия с водой.
2Al + 6h3O = 2Al(OH)3 + 3h3 ↑ |
Б) Отношение к кислотам и щелочам
Рассмотрим отношение алюминия к растворам кислоты и щелочи.
Выполнение лабораторных опытов
1. «Взаимодействие алюминия с раствором соляной кислоты»,
2. «Взаимодействие алюминия с раствором гидроксида натрия».
Инструкция по выполнению лабораторной работы
Цель: Изучить отношение алюминия к кислотам и щелочам.
Правила работы с кислотами и щелочами: Соблюдайте осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промойте водой! При нагревании, прогрейте сначала всю пробирку.
Опыт 1. В пробирку положите 2 кусочка алюминия и прилейте 3–4 мл раствора соляной кислоты. Пробирку слегка нагрейте.
Опыт 2. В пробирку положите 2 кусочка алюминия и прилейте 3–4 мл раствора гидроксида натрия. Пробирку слегка прогрейте.
Задание:
1. Выполните опыты;
2. Обговорите с соседом по парте, что наблюдали;
3. Запишите уравнения реакций;
4. Сделайте выводы.
5.* Если затрудняетесь записать уравнения реакций, откройте стр. 58-59 учебника.
Фронтальная проверка. Комментированное чтение.
При этом виде работы учащиеся получают возможность участвовать в самопроверке знаний и умений, совершенствуют свою речь, обращают внимание на правильное употребление химических терминов и названий веществ.
Образец выполнения лабораторной работы. (запись в тетради) |
Опыт 1. Наблюдали: алюминий хорошо растворяется в растворе соляной кислоты, выделяется газ водород. |
Опыт 2. |
Вывод: Алюминий – активный амфотерный металл. Вывод: Алюминий образует амфотерные соединения. |
В) Отношение к оксидам тяжёлых металлов
Учитель: Алюминий широко используют в металлургии для получения металлов – хрома, марганца, ванадия, титана, циркония из их оксидов. Этот способ получения металлов носит название алюминотермия.
На практике часто используется смесь Fe3O4 (железной окалины) с порошком алюминия. Если эту смесь поджечь с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты. Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, именно поэтому процесс используют для сварки стальных изделий.
Демонстрация видеоролика «Взаимодействие алюминия с оксидом железа (III)»
Учитель: Запишите уравнение химической реакции взаимодействия алюминия с оксидом железа (III) и разберите его методом электронного баланса самостоятельно.
Взаимодействия алюминия с оксидом железа (III) 2Al + Fe2O3 = 2Fe + Al2O3 Al0 – 3℮ → Al+3 (восстановитель, процесс окисления) Fe+3 +3℮ → Fe0 (окислитель, процесс восстановления) |
Учитель: – давайте сделаем вывод о химической активности алюминия.
Учащиеся: – Алюминий – довольно активный металл, который может взаимодействовать с простыми веществами (кислородом , галогенами, серой), со сложными веществами (с водой, с кислотами, со щелочами, с оксидами металлов). Способность взаимодействовать и с кислотами, и со щелочами объясняет его амфотерные свойства.
ІІІ. Закрепление изученного материала.
- игра в «крестики –нолики» .
Найдите выигрышный путь, состоящий из формул веществ, способных взаимодействовать с алюминием.
О2 | S | Na |
NaCl | HCl | KOH |
h3O | h3SO4 конц. | Fe2O3 |
V. Домашнее задание.
§ 13 до стр.60.
nsportal.ru
Алюминий и его соединения СОДЕРЖАНИЕ Характеристика элемента
 Алюминий и его соединения
Алюминий и его соединения
 СОДЕРЖАНИЕ Характеристика элемента – алюминия Ученые, получившие алюминий Нахождение в природе Физические свойства Химические свойства Применение Соединения алюминия и их свойства Вопросы для проверки
СОДЕРЖАНИЕ Характеристика элемента – алюминия Ученые, получившие алюминий Нахождение в природе Физические свойства Химические свойства Применение Соединения алюминия и их свойства Вопросы для проверки
 Элемент III(A) группы таблицы Д. И. Менделеева Элемент с порядковым № 13, его название образовано от лат. «Aluminis» – квасцы AL Элемент 3 -его периода Третий по распространенности в земной коре
Элемент III(A) группы таблицы Д. И. Менделеева Элемент с порядковым № 13, его название образовано от лат. «Aluminis» – квасцы AL Элемент 3 -его периода Третий по распространенности в земной коре
 Датский физик Ганс Эрстед (1777 -1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
Датский физик Ганс Эрстед (1777 -1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
 Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Современное получение алюминия Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.
Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Современное получение алюминия Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.
 Будучи студентом Оберлинского колледжа, Холл Чарльз он узнал, что можно разбогатеть и получить благодарность человечества, 1914) (1863 – если изобрести способ получения алюминия американский в промышленных масштабах. Как одержимый, Чарльз проводил эксперименты инженер-химик по выработке алюминия путем электролиза криолитно-глиноземного расплава. 23 февраля 1886 года спустя год после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.
Будучи студентом Оберлинского колледжа, Холл Чарльз он узнал, что можно разбогатеть и получить благодарность человечества, 1914) (1863 – если изобрести способ получения алюминия американский в промышленных масштабах. Как одержимый, Чарльз проводил эксперименты инженер-химик по выработке алюминия путем электролиза криолитно-глиноземного расплава. 23 февраля 1886 года спустя год после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.
 Поль Эру (1863 -1914) – французский инженер – химик В 1889 году открыл алюминиевый завод во Фроне (Франция), став его директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов
Поль Эру (1863 -1914) – французский инженер – химик В 1889 году открыл алюминиевый завод во Фроне (Франция), став его директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов
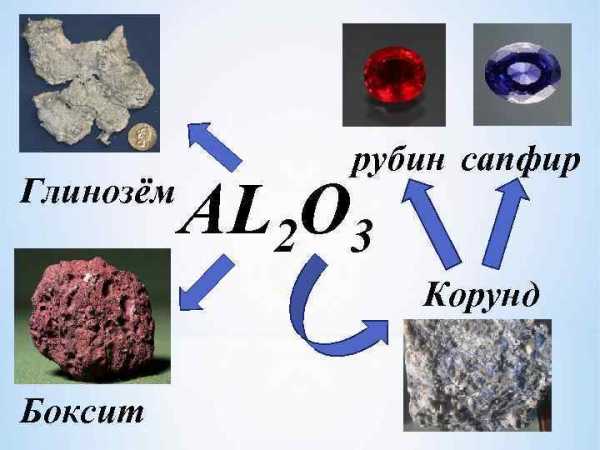
 Нахождение в природе им йш ня не од м аж сег ало я В а н нер ини я ми юм етс ал вля ит я окс б Осн хим овной иче ски ком й пон ент бок сит глин а озем (Al 2 (28 O 3) – 80 %).
Нахождение в природе им йш ня не од м аж сег ало я В а н нер ини я ми юм етс ал вля ит я окс б Осн хим овной иче ски ком й пон ент бок сит глин а озем (Al 2 (28 O 3) – 80 %).
 Физические свойства серебристо-белый с характерным металлическим блеском мягкий легкий (с малой плотностью – 2, 7 г/см 3) с высокой тепло- и электропроводностью легкоплавкий (температура плавления 660°C) ЭТО ВАЖНО: Занимает 1 -е место в земной коре среди металлов Совокупность этих важных свойств позволяет отнести алюминий к числу важнейших технических материалов
Физические свойства серебристо-белый с характерным металлическим блеском мягкий легкий (с малой плотностью – 2, 7 г/см 3) с высокой тепло- и электропроводностью легкоплавкий (температура плавления 660°C) ЭТО ВАЖНО: Занимает 1 -е место в земной коре среди металлов Совокупность этих важных свойств позволяет отнести алюминий к числу важнейших технических материалов
 Химические свойства Взаимодействие с простыми веществами: v с кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 v с серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 v с азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N v с углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 v с хлором, образуя хлорид алюминия: 2 Al + 3 Cl 2 = 2 Al. Cl 3
Химические свойства Взаимодействие с простыми веществами: v с кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 v с серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 v с азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N v с углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 v с хлором, образуя хлорид алюминия: 2 Al + 3 Cl 2 = 2 Al. Cl 3
 Химические свойства Взаимодействие со сложными веществами: 1. с водой (после удаления защитной оксидной пленки) 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 3. c соляной и разбавленной серной кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 4. с оксидами менее активных металлов (алюминотермия) 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
Химические свойства Взаимодействие со сложными веществами: 1. с водой (после удаления защитной оксидной пленки) 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 3. c соляной и разбавленной серной кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 4. с оксидами менее активных металлов (алюминотермия) 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
 В Авиации В Космической технике В Электротехнике В Судостроении В Строительстве Легкий сплав дюраль используется ПРИМЕНЕНИЕ В Автотранспорте АЛЮМИНИЯ в различных областях В быту
В Авиации В Космической технике В Электротехнике В Судостроении В Строительстве Легкий сплав дюраль используется ПРИМЕНЕНИЕ В Автотранспорте АЛЮМИНИЯ в различных областях В быту
 Оксид алюминия (AL 2 O 3) Соединения алюминия Гидроксид алюминия AL(OH)3
Оксид алюминия (AL 2 O 3) Соединения алюминия Гидроксид алюминия AL(OH)3
 Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами AL 2 O 3 + 6 HCL=2 ALCL 3 + 3 H 2 O Реагирует с щелочами AL 2 O 3+ 2 Na. OH +3 H 2 O=2 Na[AL(OH)4]
Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами AL 2 O 3 + 6 HCL=2 ALCL 3 + 3 H 2 O Реагирует с щелочами AL 2 O 3+ 2 Na. OH +3 H 2 O=2 Na[AL(OH)4]
 Глинозём рубин сапфир AL 2 O 3 Корунд Боксит
Глинозём рубин сапфир AL 2 O 3 Корунд Боксит
 Применение сапфиров знаменитые сапфиры английской королевской семьи
Применение сапфиров знаменитые сапфиры английской королевской семьи
 Применение рубинов
Применение рубинов
 Химические свойства гидроксида алюминия Амфотерный Разлагается при нагревании 2 AL(OH)3 = AL 2 О 3+ 3 H 2 O Реагирует с кислотами AL(OH)3 + 3 HCL = ALCL 3+ 3 H 2 O Реагирует с щелочами AL(OH)3 + Na. OH = Nа[AL(OH)4 ]
Химические свойства гидроксида алюминия Амфотерный Разлагается при нагревании 2 AL(OH)3 = AL 2 О 3+ 3 H 2 O Реагирует с кислотами AL(OH)3 + 3 HCL = ALCL 3+ 3 H 2 O Реагирует с щелочами AL(OH)3 + Na. OH = Nа[AL(OH)4 ]
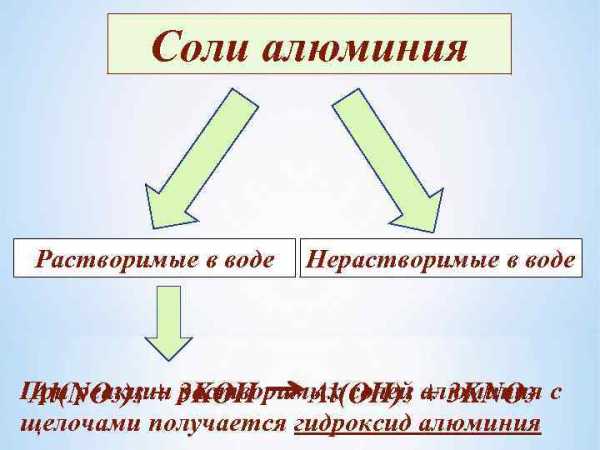 Соли алюминия Растворимые в воде Нерастворимые в воде При реакции 3 KOH Al(NO 3)3 + растворимых солей алюминия с Al(OH)3 + 3 KNO 3 щелочами получается гидроксид алюминия
Соли алюминия Растворимые в воде Нерастворимые в воде При реакции 3 KOH Al(NO 3)3 + растворимых солей алюминия с Al(OH)3 + 3 KNO 3 щелочами получается гидроксид алюминия
 Проверьте себя: Вставьте пропущенные слова в текст: Алюминий – это металл, у которого в соединениях степень окисления равна +3. В природе он встречается в виде оксида алюминия. Алюминий может вступать в реакцию с водой , образуя гидроксид алюминия, который обладает амфотерностью. Алюминий вступает в реакцию алюминотермии для восстановления менее активных металлов из их оксидов
Проверьте себя: Вставьте пропущенные слова в текст: Алюминий – это металл, у которого в соединениях степень окисления равна +3. В природе он встречается в виде оксида алюминия. Алюминий может вступать в реакцию с водой , образуя гидроксид алюминия, который обладает амфотерностью. Алюминий вступает в реакцию алюминотермии для восстановления менее активных металлов из их оксидов
 Какие из соединений вступят в реакцию с алюминием: Cl 2 K 2 O Cu. SO 4 H 2 O S Ba. SO 4 HCL Fe 2 O 3 Cr
Какие из соединений вступят в реакцию с алюминием: Cl 2 K 2 O Cu. SO 4 H 2 O S Ba. SO 4 HCL Fe 2 O 3 Cr
present5.com
Методическая разработка по химии (9 класс) на тему: Алюминий – химический элемент, простое вещество
Тема урока: «Алюминий – химический элемент, простое вещество».
Цели урока:
Обучающая – изучить физические и химические свойства алюминия и области его применения. Рассмотреть характеристику химического элемента алюминия и изучить строение атома.
Развивающая – развивать умения в проведении эксперимента, перенесении содержания научно-познавательного текста в форму схем; развитие коммуникативных способностей, умения слушать, умение правильно высказывать свои мысли.
Воспитательная – воспитывать культуру работы с химическими веществами, соблюдение правил техники безопасности, воспитывать сознательную дисциплинированность, четкость и организованность в работе.
Учащиеся должны знать: строение атома алюминия, физические и химические свойства алюминия как простого вещества, области применения.
Учащиеся должны уметь: давать характеристику алюминия, как химического элемента, так и простого вещества. Записывать уравнения реакций, доказывающие химические свойства алюминия в молекулярном и окислительно-восстановительном виде.
Тип урока: изучение нового материала.
Форма организации учебной деятельности учащихся: групповая работа, индивидуальная, химический эксперимент.
Методы и приемы обучения: поисковый, частично-исследовательский, демонстрационный химический эксперимент, работа в группах, устные ответы у доски, самостоятельная работа с текстами, взаимоконтроль.
Оборудование урока: научно-познавательные тексты по теме урока, карточки-задания по отдельному вопросы плана изучения материала для каждой группы, ПСХЭ,
Коллекция «Алюминий и его соединения», алюминиевая фольга, соляная кислота и гидроксид натрия, алюминий, лабораторное оборудование.
Содержание урока:
- Организационный момент.
Учитель приветствует учащихся.
- Актуализация опорных знаний, сообщение темы, задач и структуры проведения урока:
Вступительное слово учителя
Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а если при труде успеха не будет,
неудача – не беда, попробуйте ещё.
Д. И. Менделеев.
Мы продолжаем изучение большой и важной темы «Металлы». Сегодня на уроке нам предстоит познакомиться с металлом хорошо известным вами с детства. Данный урок я хочу начать с легенды.
«Однажды к римскому императору Тиберю пришел незнакомец. В дар императору он принес изготовленную им чашу из блестящего, как серебро, но чрезвычайно легкого металла. Мастер поведал, что получил этот металл из «Глинистой земли». Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить». О каком металле идет речь?
(Ответ: об алюминии)
Учитель: – Таким образом, тема нашего урока: «Алюминий – химический элемент и простое вещество».
Формулируются задачи урока.
План изучения темы в группах:
- Характеристика химического элемента алюминия по положению его в ПСХЭ.
- Физические свойства алюминия.
- Химические свойства алюминия.
- Применение алюминия и нахождение его в природе.
План работы в группе:
– изучите текст и выделите сведения, относящиеся к своему вопросу;
– выполните предложенные задания;
– подготовьте выступление по своему вопросу, основываясь на краткости, ясности и четкости изложения
3. Групповая работа по изучению материала и подготовке выступления по своему вопросу.
Группа 1. Характеристика химического элемента алюминия по положению его в ПСХЭ.
Задание:
- Ознакомьтесь с текстом (Приложение 1).
- Выделите материал, относящийся к вашему вопросу.
- Дайте характеристику алюминию по положению в ПСХЭ по плану:
А) порядковый номер.
Б) атомная масса.
В) период (малый, большой).
Г) группа (подгруппа: главная или побочная).
Д) химический знак.
Е) Строение атома (заряд ядра, число протонов, электронов, нейтронов, электронная формула).
И) оксиды.
К) летучие водородные соединения.
2. Обсудите в группе полученные результаты и ответьте на вопросы:
- Сколько электронов находится на внешнем уровне атома алюминия?
- Алюминий будет отдавать или принимать данные электроны?
- Какую степень окисления будет приобретать при этом ион алюминия?
- Сделайте вывод: К какому классу соединений относится алюминий (металл или неметалл)
- Сравните активность химического элемента алюминия с элементами 1 и 2 групп этого же периода.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 2. Физические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Рассмотрите коллекцию «Алюминий и его сплавы».
- Обсудите в группе вопросы:
а) Агрегатное состояние, цвет, блеск, плотность (легкий или тяжелый), плавкость (легко –или тугоплавкий), электро- и теплопроводность, пластичный.
б) Полученные данные изобразите в виде схемы.
5. Подготовьте выступление поданному вопросу, основываясь на краткости четкости изложении.
Группа 3. Химические свойства алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Изучите, как ведет себя алюминий по отношению к сложным веществам?
- Выполните лабораторную работу, используя инструкцию
Инструкция по выполнению лабораторной работы
Цель: Изучить отношение алюминия к кислотам и щелочам.
Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку, направляя отверстие в сторону от себя и соседа. Спиртовку поджигайте только при помощи спичек.
Опыт 1. В пробирку положите 1 гранулу алюминия и прилейте 3-4 мл раствора соляной кислоты. Пробирку слегка прогрейте.
Опыт 2. В пробирку положите 1 гранулу алюминия и прилейте 3-4 мл. раствора гидроксида натрия. Пробирку слегка прогрейте.
Задание:
А) Выполните опыты.
Б) Обговорите в группе наблюдаемые явления.
В) Запишите уравнение реакций.
Г) Сделайте выводы.
5. Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении.
Группа 4. Применение алюминия.
Задание:
- Ознакомьтесь с текстом.
- Выделите материал, относящийся к вашему вопросу.
- Обсудите в группе следующие вопросы:
а) Какова роль алюминия в жизни человека?
б) Применение алюминия, как простого вещества.
- Составьте схему, характеризующую области применения алюминия.
- Подготовьте выступление по данному вопросу, основываясь на краткости, ясности и четкости изложении
- Отчет групп по изученным вопросам.
Каждая группа, выполнив все задания, представляет схематизированное изложение своего вопроса с обсуждением и комментариями, учащиеся делают записи, переносят предложенные схемы в тетради, в результате всех групп поэтапно составляется опорный конспект по теме урока.
Выводы по теме урока:
– Какое количество электронов находится на внешнем энергетическом уровне атома алюминия.
– Какую степень окисления имеет атом алюминия? Почему? А ион?
– При помощи каких опытов мы доказали, что алюминий – это активный металл?
– Какие вещества называются амфотерными?
– На каких свойствах основаны следующие области применения?
– Где в организме больше всего содержится алюминия?
– Можно ли длительное время хранить продукты питания в алюминиевой посуде?
- Домашнее задание: § 13 до стр. 60, ? 1, 4. Подготовить презентацию по применению алюминия.
- Рефлексия
1. Что нового вы узнали на уроке?
2. Чему вы научились на этом уроке?
3. Что понравилось?
4. Что запомнилось?
- Заключительное слово учителя.
Учитель благодарит учащихся за сотрудничество, выставляет оценки выступающим у доски.
Приложение 1.
Алюминий.
В главную подгруппу III группы входят элементы: бор, алюминий, галлий, индий, таллий. На внешнем электронном слое атомы этих элементов содержат три электрона (…ns2np1). Они являются р-элементами. В реакциях атомы этих элементов являются восстановителями, за исключением неметалла бора, он может быть окислителем. Все элементы этой подгруппы проявляют высшую степень окисления +3. Они образуют высшие оксиды Э2О3 и гидроксиды Э(ОН)3, которые проявляют амфотерные свойства. Наибольший интерес в этой подгруппе представляют алюминий.
+13 AI ) ) ) 1s22s22p63s23p1
2 8 3
Алюминий в свободном виде – серебристо-белый металл, обладает блеском, высокой тепло – электропроводностью (уступает в этом отношении меди), легкий (плотность 2,7 г/см3) и одновременно – это прочный металл. Является мягким, пластичным металлом, его можно прокатывать в фольгу, вытягивается в проволоку. Плавится при температуре 6600С. При 6000С алюминий становится хрупким и его можно истолочь в зерна или в порошок.
Алюминий – металл, поверхность которого обычно покрыта тонкой, прочной оксидной пленкой. В виде стружек и порошка он ярко горит на воздухе, выделяя большое количество теплоты.
4AI + 3O2 → 2AI2O3
При комнатной температуре активно реагирует с галогенами, при нагревании взаимодействует с серой (2000С), азотом (8000 С) и другими неметаллами.
2AI + 3S → AI2S3 2AI + N2 → 2AIN
сульфид алюминия нитрид алюминия
Отношение алюминия к сложным веществам:
Алюминий растворяется в соляной кислоте любой концентрации:
- 2AI + 6HCI = 2AICI3 + h3↑;
хлорид алюминия
Алюминий растворяется в растворах щелочей:
б) 2AI + 2NaOH + 2h3O = 2NaAIO2 + 3h3↑;
алюминат натрия
Алюминий играет важную биологическую роль в жизни человека. Принимает участие в построении эпителиальной и соединительной тканях. Содержание алюминия в организме человека (на 70 кг массы тела) составляет 61 мг. Находится во всех органах и тканях: больше всего в печени, легких, костях головном мозге. Основным поступлением алюминия в организм является пища – это хлебопродукты, чай (от 20 – 200мг на 100г. продукта), картофель – 4 мг на 100г. продукта, желтая репа – 46 мг на 100 г. продукта. При приготовлении и хранении пищи в алюминиевой посуде содержание алюминия в продуктах увеличивается вдвое. Повышение содержания алюминия в крови вызывает возбуждение центральной нервной системы. При избытке алюминия в организме нарушается двигательная активность, судороги, ослабление памяти, заболевание печени и почек.
При понижении содержания алюминия происходит торможение центральной нервной системы.
Области применения алюминия весьма многочисленны. Благодаря легкости и прочности алюминий и его сплавы применяют в самолето – и ракетостроении (алюминий называют крылатым металлом), строительстве судов и автомобилей; в строительстве- для изготовления оконных рам и дверей, легкость и хорошая электрическая проводимость алюминия используется при изготовлении электрических проводов для линии электропередач. Теплопроводность и неядовитость важны при изготовлении алюминиевой посуды и фольги для хранения пищевых продуктов. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии. Способность алюминия гореть в воздухе ярким пламенем, используется при приготовлении красочных фейерверков и изготовление бенгальских огней.
nsportal.ru
Характеристика химических свойств алюминия. Химия
АЛЮМ˜ИНИЙ (лат. Aluminium), Al (читается «алюминий») , химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3 s 2 p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III). Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В. Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту. С остальными кислотами алюминий активно реагирует: 6НСl + 2Al = 2AlCl3 + 3h3, 3Н2SO4 + 2Al = Al2(SO4)3 + 3h3. Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3h3O = 2Na[Al(OH)4]. Затем протекают реакции: 2Al + 6h3O = 2Al(OH)3 + 3h3, NaOH + Al(OH)3 = Na[Al(OH)4], или суммарно: 2Al + 6h3O + 2NaOH = Na[Al(OH)4] + 3Н2, и в результате образуются алюминаты: Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия) , К [Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О) 2] и К [Al(OH)4(Н2О) 2]. При нагревании алюминий реагирует с галогенами: 2Al + 3Cl2 = 2AlCl3, 2Al + 3 Br2 = 2AlBr3. Интересно, что реакция между порошками алюминия и иода начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора: 2Al + 3I2 = 2AlI3. Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия: 2Al + 3S = Al2S3, который легко разлагается водой: Al2S3 + 6Н2О = 2Al(ОН) 3 + 3Н2S. С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель. В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3. Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например: 3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже 3СаО + 2Al = Al2О3 + 3Са. Такой способ получения металлов называют алюминотермией. Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yh3O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3. В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями: Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4, или за счет добавления соды к раствору соли алюминия: 2AlCl3 + 3Na2CO3 + 3h3O = 2Al(OH)3Ї + 6NaCl + 3CO2, а также добавлением раствора аммиака к раствору соли алюминия: AlCl3 + 3Nh4·h3O = Al(OH)3Ї + 3h3O + 3Nh5Cl.
touch.otvet.mail.ru
Алюминий, общие сведения, химические свойства алюминия, области приминения алюминиевых сплавов (Киев, Украина)
<< Назад
Алюминий. Общие сведения.
Алюминий — химический элемент III группы Периодической системы элементов Д.И. Менделеева. Вследствие высокой химической активности алюминий в природе находится только в связанном виде. По содержанию в земной коре он (в форме его соединений) занимает первое место среди металлов — 8,13 % и третье место после кислорода и кремния. По данным акад. А.Е. Ферсмана, насчитывается более 250 минералов алюминия, которые преимущественно сосредоточены вблизи поверхности земли, и более 40 % из них относится к алюмосиликатам.
Практически единственным методом получения металлического алюминия является электролиз криолитоглиноземного расплава. Основное сырье для этого процесса — глинозем (А12О3) получают различными гидрохимическими методами путем переработки минералов, содержащих соединения алюминия.
Химические свойства. В Периодической системе Д.И. Менделеева порядковый номер алюминия 13, его атомная масса составляет 26,9815 (по углероду 12С) и 26,98974 (по кислороду 16O).
Основным изотопом является 27А1, который устойчив и состоит из 14 нейтронов и 13 протонов. Кроме одного изотопа 26А1, период полураспада которого равен 106 лет, установлено существование еще шести изотопов с массовыми числами 23, 24, 25, 26, 28 и 29 и с малыми периодами полураспада (от 0,13 до 396 с), а также пренебрежимо малой распространенностью в природе (от 2×10-5 до 1,5×10-4 %).
Алюминий трехвалентен, и 13 его электронов распределены на электронных оболочках ls2, 2s2, 2р6, 3s2, 3р1. На внешнем электронном слое М находятся три валентных электрона: два на Зs-орбите с потенциалами ионизации 1800 и 2300 кДж/моль и один на 3p-орбите с потенциалом 574,5 кДж/моль, и поэтому в химических соединениях алюминий обычно трехвалентен (А13+). Так как электрон на p-орбите с ядром атома связан слабее, чем два спаренных электрона на s-орбите, то при определенных условиях, теряя р-электрон, атом алюминия становится одновалентным ионом (А1+), образуя соединения низшей валентности (субсоединения), и еще реже — А12+.
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4 К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86-10-10 м, а атомный объем 9,999×10-6 м3/г-атом. Примеси в алюминии незначительно влияют на величину параметра решетки.
Алюминий обладает большой химической активностью; энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
Расплавленный алюминий активно реагирует с оксидом и диоксидом углерода и парами воды. Наибольший интерес представляет растворимость водорода в алюминии, так как присутствие водорода в металле негативно влияет на механические свойства алюминия и его сплавов. Водород в алюминии в количествах, превосходящих растворимость в твердом состоянии, рассматривается как вредная примесь.
Алюминий обладает амфотерными свойствами, т.е. реагируя с кислотами, образует соответствующие соли, а при взаимодействии с щелочами — алюминаты. Эта особенность существенно расширяет возможности извлечения алюминия из руд различного состава. Алюминий растворяется в серной и соляной кислотах, а также в щелочах, но концентрированная азотная и органическая кислоты на алюминий не действуют.
Алюминий широко представлен в земной коре различными соединениями, которые делятся по количеству видов примерно на две равные группы:
-
первичные минералы, образующиеся при кристаллизации магмы и ее производных. Главная роль в этой группе принадлежит алюмосиликатам, типичными представителями которых являются ортоклаз, альбит, лейцит и нефелин. Менее распространены силикаты алюминия — дистен, силлиманит, андалузит. Относительно редкими являются шпинели и свободный оксид алюминия — корунд;
-
вторичные соединения алюминия, образующиеся под воздействием выветривания в земной коре, характеризуются более высоким содержанием оксида алюминия Среди них широко распространены гидросиликаты алюминия — каолинит и его разновидности, а также гидроксиды и оксигидроксиды алюминия — гиббсит, бемит и диаспор, которые являются важнейшей составной частью основных промышленных алюминиевых руд — бокситов. К этой же группе относится и алунит.
К основным алюминиевым рудам относятся бокситы, нефелины, алуниты и некоторые другие соединения, но важнейшей рудой являются бокситы, на которых практически полностью работают все зарубежные глиноземные заводы. Боксит — сложная горная порода, состоящая из оксидов и гидроксидов Al, Fe, Si и Ti и в качестве примесей присутствуют карбонаты кальция и магния, гидросиликаты (хлориты), сульфиды и сульфаты (в первую очередь, железа) и органические соединения. Основными глиноземосодержащими минералами бокситов являются гиббсит, бемит и диаспор. В природе мономинеральные бокситы чрезвычайно редки, гораздо чаще встречаются руды смешанного типа — гиббсит-бемитовые или бемит-диаспоровые.
Качество бокситов в основном определяется содержанием в них А12О3 и SiO2, и для оценки их качества на практике используют кремниевый модуль mSi — массовое отношение содержания А12О3 к SiO2. Чем больше модуль, тем выше качество боксита.
Области применения алюминиевых сплавов.
Сплавы АД и АД-1. Элементы конструкций и деталей, не несущие нагрузки и требующие применения материала с высокими пластическими свойствами, хорошей свариваемостью, высоким сопротивлением коррозии и высокой тепло- и электропронодностью.
Из этих сплавов изготавливаются трубопроводы разного назначения, витражи, перегородки в комнатах, электропровода, двери, оконные рамы,
корпусы часов, ювелирные поделки, палубные надстройки морских и речных судов, обои, обертки, баки и т. д.
Алюминиевые сплавы применяются также в виде заклепок для средненагружаемых конструкций из алюминиевых сплавов с повышенной коррозионной стойкостью и для конструкций из магниевых сплавов.
Сплав АМц. Сварные детали, трубопроводы, емкости для жидкостей и другие малонагружаемые детали и изделия; изделия, изготовляемые глубокой вытяжкой, гибкой и т. д., а также проволока для заклепок.
Заклепки для средненагружаемых конструкций из алюминиевых сплавом с повышенной коррозионной стойкостью и для конструкций из магниевых
сплавов.
Сплав АМг2. Сварные и клепаные детали, трубопроводы разного на значения, емкости для жидкостей и другие средне- и малонагружаемые детали и изделия. Также изготовляются витражи, перегородки в комнатах, электропровода, двери, оконные рамы, корпусы часов, палубные надстройки морских и речных судов, обои, обертки, баки и т. д.
Проволока применяется в качестве присадочного материала и для изготовления заклепок.
Сплав АМгЗ. Сварные малонагружаемые детали и конструкции, с высокой коррозионной стойкостью, трубопроводы, емкости для жидкостей и другие средне-нагружаемые детали и изделия.
Сплавы АМг5, АМг5В и АМг6. Сварные и клепаные средненагружаемые детали и конструкции, требующие высокой коррозионной стойкости; трубопроводы, емкости для жидкостей и другие детали и изделия.
Сплавы Д16 и Д16П. В конструкциях средней и повышенной прочности, Требующих повышенной долговечности при переменных нагрузках; в строительных конструкциях, не требующих высокой коррозионной стойкости, для изготовления ферм, а также для различных высоконагружаемых деталей и элементов-конструкций, за исключением штамповок и поковок. В сильно нагружаемых т-талях сплав Д16 заменяется сплавом В95. Заклепки ставятся в конструкцию и свсжезакаленном состоянии (не позднее 20-30 мин после закалки). Ставится в конструкциях, работающих при температуре до 250° С.
Сплавы АД31 и АД3З. Применяются для клееных и клепаных конструкций сложной формы, а также для конструкций, где требуется повышенный предел текучести, и для прессованных изделий сложной формы (полые профили).
Сплавы АК4 и АК4-1. Лопатки компрессоров, крыльчатки, диски и кольца турбореактивных и турбовинтовых двигателей, поршни двигателей и другие кованные детали, работающие при повышенных температурах.
Сплавы АК6 и АК6-1. Штампованные и кованые детали сложной формы и средней прочности (крыльчатки большие и малые, подмоторные рамы, фитинги, качалки, крепежные детали).
Сплав АК8. Высоконагружаемые штампованные и кованые детали, подмоторные рамы, стыковые узлы, пояса лонжеронов. Трудности, связанные с горячей обработкой давлением, ограничивают применение этого сплава.
Сплавы В95 и В95-1. Нагружаемые конструкции, работающие длительное время при температурах не выше 100-120° С. Обшивка, стрингеры, шпангоуты, лонжероны самолетов, силовой каркас клепаных строительных сооружений. Из сплава В95-1 изготовляются штампованные лопасти.
<< Назад
melita.com.ua
Алюминий. Общая характеристика | Учеба-Легко.РФ
Свойства 13Al.
Атомная масса | 26,98 | кларк, ат.% (распространненость в природе) | 5,5 |
Электронная конфигурация* | Агрегатное состояние (н. у.). | твердое вещество | |
| 0,143 |
Цвет | серебристо-белый |
0,057 | 695 | ||
Энергия ионизации |
5,98 | 2447 | |
Относительная электроотрицательность |
1,5 | Плотность | 2,698 |
Возможные степени окисления |
+1, +2,+3 | Стандартный электродный потенциал
|
-1,69 |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Алюминий — основной представитель металлов главной подгруппы III группы периодической системы. Свойства его аналогов — галлия, индия и таллия — во многом напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns2np1 и поэтому все они проявляют степень окисления 3+.
Физические свойства. Алюминий — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Поверхность металла покрыта тонкой, но очень прочной пленкой оксида алюминия Аl2Oз.
Химические свойства. Алюминий весьма активен, если нет защитной пленки Аl2Oз. Эта пленка препятствует взаимодействию алюминия с водой. Если удалить защитную пленку химическим способом (например, раствором щелочи), то металл начинает энергично взаимодействовать с водой с выделением водорода:
Алюминий в виде стружки или порошка ярко горит на воздухе, выделяя большое количество энергии:
Эта особенность алюминия широко используется для получения различных металлов из их оксидов путем восстановления алюминием. Метод получил название алюмотермии. Алюмотермией можно получить только те металлы, у которых теплоты образования оксидов меньше теплоты образования Аl2Oз, например:
При нагревании алюминий реагирует с галогенами серой, азотом и углеродом, образуя при этом соответственно галогениды:
Сульфид и карбид алюминия полностью гидролизуются образованием гидроксида алюминия и соответственно сероводорода и метана.
Алюминий легко растворяется в соляной кислоте любой концентрации:
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий (пассивируют). При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
В разбавленной серной кислоте алюминий растворяется с выделением водорода:
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием тетрагидроксоалюминатов:
Оксид алюминия. Al2O3 имеет 9 кристаллических модификаций. Самая распространенная a – модификация. Она наиболее химически инертна, на ее основе выращивают монокристаллы различных камней для использования с ювелирной промышленности и технике.
В лаборатории оксид алюминия получают, сжигая порошок алюминия в кислороде или прокаливая его гидроксид:
Оксид алюминия, будучи амфотерным, может реагировать не только с кислотами, но и с щелочами, а также при сплавлении с карбонатами щелочных металлов, давая при этом метаалюминаты:
и с кислыми солями:
Гидроксид алюминия — белое студенистое вещество, практически нерастворимое в воде, обладающее амфотерными свойствами. Гидроксид алюминия может быть получен обработкой солей алюминия щелочами или гидроксидом аммония. В первом случае необходимо избегать избытка щелочи, поскольку в противном случае гидроксид алюминия растворится с образованием комплексных тетрагидроксоалюминатов [Аl(ОН)4]` :
На самом деле в последней реакции образуются тетрагидроксодиакваалюминат-ионы [Al(OH)4(Н2O)2]` , однако для записи реакций обычно используют упрощенную форму [Аl(ОН)4]` . При слабом подкислении тетрагидроксоалюминаты разрушаются:
Соли алюминия. Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия и сильных кислот хорошо растворимы в воде и при этом сильно гидролизованы.
Галогениды алюминия хорошо растворимы в воде, и по своей структуре являются димерами:
| 2AlCl3є Al2Cl6 |
Сульфаты алюминия легко, как и все его соли, гидролизуются:
Известны также калий-алюминиевые квасцы: KAl(SO4)2Ч 12H2O.
Ацетат алюминия Al(CH3COO)3 используют в медицине в качестве примочек.
Алюмосиликаты. В природе алюминий встречается в виде соединений с кислородом и кремнием – алюмосиликатов. Общая их формула: (Na, K)2Al2Si2O8 –нефелин.
Также природными соединениями алюминия являются: Al2O3 – корунд, глинозем; и соединения с общими формулами Al2O3 Ч nH2O и Al(OH)3Ч nH2O – бокситы.
Получение. Алюминий получают электролизом расплава Al2O3.
uclg.ru

