Химическая металлизация в домашних условиях: оборудование, проведение своими руками, видео
alexxlab | 23.03.2018 | 0 | Разное
Для защиты неустойчивых материалов и их декорирования могут применяться различные технологии обработки. Химическая металлизация – процесс, заключающийся в образовании тонкого защитного слоя на поверхности самой различной формы. У данной технологии есть большое количество особенностей, о которых далее поговорим подробнее.

 Химическая металлизация
Химическая металлизацияСуть технологии
Технология химической металлизации может применяться для достижения самых различных целей, большая часть из них связана с изменением декоративных качеств поверхности. Кроме этого данный метод обработки позволяет скрыть основные дефекты металла или другого материала: микроскопические трещины и поры, другие нарушения структуры. В некоторых случаях технология применяется для восстановления покрытия.
Суть технологии заключается в нанесении металла тонким слоем. Особенности процесса нанесения вещества зависит от конкретной технологии, которых достаточно много.
Металлизация позволяет предать детали определенные эксплуатационные качества. Среди достигаемых характеристик обрабатываемого изделия отметим следующее:
- Повышается твердость. Металл обладает большей прочностью, нежели пластик. Покрывая им поверхность пластиковых или деревянных изделий можно защитить основу от механического воздействия.
- Увеличиваются декоративные свойства. Металлическое глянцевое покрытие выглядит весьма привлекательно.
- Улучшаются износостойкие качества поверхности. Металлизация проводится зачастую для того, чтобы снизить трение между соприкасающимися деталями.


Детали после выполненной химической металлизации
Детали, которые обладают высокой твердостью и износостойкостью применяются в самых различных сферах. Однако обеспечить высокие эксплуатационные качества можно только при условии соблюдения всех рекомендаций.
Классическая технология металлизации имеет следующие особенности:
- Проводится нанесение нескольких реагентов, которые вступают в реакцию для образования поверхностного слоя с определенными эксплуатационными свойствами. Существует много различных методов переноса реагентов на обрабатываемые детали, каждый обладает своими особенностями, достоинствами и недостатками.
- В результате проведения металлизации на подложке формируется защитный слой. При этом между покрытием и подложкой образуется надежная связь, которая сохраняется на протяжении длительного периода.
- Получаемое покрытие может быть самых различных оттенков. При необходимости можно создать переход от одного цвета к другому без четкой границы. В некоторых случаях, когда нужно получить поверхность с особыми декоративными качествами, при металлизации добавляется краситель.


Химическая металлизация разных цветов
Провести рассматриваемую химическую обработку можно в домашней мастерской, несмотря на то, что металлизация считается сложным технологическим процессом. Как правило, дома обрабатываемую деталь подвергают каталитическому хромированию. За счет этого покрытие становится привлекательным и обретает защиту от воздействия влаги.
Востребована химическая металлизация металла также по причине того, что может применяться в домашних условиях. Работа проводится по следующему алгоритму действий:
- Выполняется очищение детали от загрязняющих веществ. Между поверхностным слоем и основанием не должно быть никакой прослойки, так как это существенно снизит эксплуатационные характеристики.
- Проводится обезжиривание. Оно проводится при использовании специального щелочного раствора или специального моющего средства, которые могут удалить с поверхности загрязнения органического происхождения.
- Обезжиренную поверхность дополнительно промывают чистой водой. Подобным образом можно удалить с поверхности ранее используемые составы при обезжиривании.
- Участки поверхности, которые не должны быть подвержены воздействию химического вещества, обрабатываются свинцом. Проведенные тесты указывают на то, что свинец не реагирует на воздействие электролитического раствора.
- К ванной с раствором подводится проводка для подачи электричества, после чего деталь опускается в подготовленные реагенты.
- После прохождения требуемого срока изделие извлекается из раствора, и оно просушивается, а после этого охлаждается. Если покрытие качественное, то оно полируется.
Для проведения рассматриваемого процесса в домашних условиях можно приобрести специальную мини-установку, предназначенную для проведения химической металлизации, которая работает от небольшого компрессора.
Рассматриваемый процесс должен проводится исключительно при соблюдении нижеприведенных рекомендаций:
- Перед погружением детали в ванную и подачей электричества нужно проверить, чтобы все контакты были подведены надежно и смогли выдержать нагрузку.
- Помещение, в котором будет проводиться рассматриваемая работа, должно проветриваться. Для этого проводится установка вентиляционной системы. Данная рекомендация связана с тем, что при процессе металлизации металла выделяются газы, которые могут негативно отражаться на зрении и дыхании.


Детали, подвергнутые химической металлизации
Для соблюдения технологии металлизации следует обладать достаточным количеством опыта. Не стоит ожидать, что впервые проводя сложную операцию переноса одного материала на другой получиться результат, который можно достигнуть при использовании специального промышленного оборудования.
Методы химической металлизации
Тип используемого оборудования определяет особенности технологии. Химическая металлизация может поводится следующим образом:
- Гальванический метод характеризуется применением ванной со специальным электролитам. Среди особенностей этой технологии отметим то, что ее применение позволяет покрывать даже сложные поверхности, имеющие большое количество переходов и граней.
- Электродуговая технология предусматривает использование специальных электродов, которые расплавляются при подаче электричества. Расплавленное вещество подается при помощи сжатого воздуха. Подобная металлизация в домашних условиях проводится крайне редко.
- Газоплазменное напыление – технология, которая заключается в расплавлении реагентов до мелкодисперсного состояния и его нанесения при непосредственном контакте полученного вещества с поверхностью детали. Эта технология достаточно сложна в исполнении, может проводиться только при установке специального оборудования.
- Горячий метод формирования покрытия заключается в полном погружении изделия в ванную со смешенными реагентами.
- Диффузный метод предусматривает проведение процесса при воздействии повышенной температуры. За счет неполного перестроения атомной решетки частицы переносимого сплава проникают в структуру подложки.
- Плакирование – технология, которая заключается в нанесении химических веществ, после чего проводится горячий прокат.
Кроме этого классификация методов обработки проводится по виду наносимого вещества. Наиболее распространенными можно назвать:
- Хром.
- Цинк.
- Алюминий.
Приведенные выше сплавы не реагируют на воздействие влаги и некоторых химических веществ, а также обладают привлекательными декоративными качествами.


Химическая металлизация хромом
Металлизация в домашних условиях зачастую проводится путем нанесения химического вещества, которое вступает в реакцию. Химическая металлизация активатор можно приобрести в специализированном магазине.
Используемые химические реактивы
Химическая металлизация технология предусматривает применение различных веществ, которые в связке образуют защитное покрытие после прохождения химической реакции. Применяя активатор и реактивы при химической металлизации можно обойтись без специального оборудования, однако метод не подходит для больших деталей.
Для проведения рассматриваемой обработки понадобятся:
- Восстановитель является основным компонентом. Химическая металлизация реагенты должны хранится согласно рекомендациям, которые размещают производители.
- Активатор также является важным реагентом, который определяет эксплуатационные качества поверхности. Реактивы химической металлизации имеют этикетки, на которых указывается название металла. Примером назовем золото, мель и хром.
- Грунтовка накладывается на поверхность для обеспечения наиболее благоприятных условий обработки. Она существенно повышает адгезию наносимого металла.
- Лак защищает наносимое покрытие от химического и механического воздействия.
- Для того чтобы придать поверхности определенный цвет используются специальные тонеры. На упаковке тонеров указывается конкретный оттенок.


Реактивы для химической металлизации
Стоит учитывать, что при самостоятельном выполнении работ обеспечить высокое качество поверхности достаточно сложно. В некоторых случаях приходится пользоваться помощью специальных очистительных составов.
Рассматривая минусы химической металлизации отметим, что при проведении данной процедуры используются вредные химические реактивы, работа с которыми должна проходить при строгом соблюдении техники безопасности. Данная технология довольно проста в исполнении, напоминает метод покрытия поверхности лакокрасочным веществом.

Хромирование конструкций и деталей в домашней мастерской
Для защиты деталей разнообразных механизмов или частей металлических конструкций от коррозии, придания им дополнительной износоустойчивости, твердости и улучшения эстетического вида применяются хромирование либо никелирование. Эти способы подразумевают нанесение на поверхности конструкций химически инертного покрытия из хрома или никеля, улучшение эстетичности. Нанесение такой пленки – процесс энергозатратный. Технологически он сложен, но является защитой не на один десяток лет без ощутимых потерь для внешнего вида.
Нередко появляется необходимость в покрытии декоративной пленкой тех изделий, которые изначально не подвергались процессу хромирования. Таким образом при желании можно, к примеру, изменить вид скульптуры, сделать современным интерьер любого жилого помещения. Можно украсить по своему вкусу автомобиль или мотоцикл. Сделать это совсем не трудно даже собственными руками, то есть, не применяя усложненных технологий. Нанести пленку из хрома можно даже на конструкции со сложным рельефом, а не только выпуклые, плоские либо вогнутые.
Основные методы хромирования
- Процесс химической металлизации.
- Гальванизация.
- Вакуумное напыление.
- Высокотемпературная диффузия.
Два последних метода применяются только на предприятиях промышленности. Дома эти процессы выполнить не получится, поскольку для них необходимы технически сложные установки и повышенные энергетические затраты. А вот химическая металлизация и гальванизация – это как раз те самые процессы, которые могут производиться и в личной мастерской. Рассмотрим подробно, как это делается.
Химическая металлизация поверхностей и деталей

В процессе этой работы используются химические реактивы, компрессор и краскопульт. Выполняются практически те же самые операции, что и при покраске поверхностей акриловым лаком либо эмалью. При хромировании таким способом на детали и конструкции наносится не защитная полимерная пленка, а зеркальный тонкий слой металла. Толщина его в пределах 0,075-0,25 миллиметров. Химико-физические характеристики такого покрытия сопоставимы с теми, что получаются при вакуумном напылении.
Как выполнить химическую металлизацию
1-й метод. Поверхность покрывается специальными химикатами. В результате химической реакции образуется осадок, представляющий собой прочный металлический слой. Покрытие можно делать не только из хрома, но также из серебра.
2-й метод. В процессе восстановительной химической реакции из солей образуется слой хрома. Приготовьте набор из уксусной кислоты, хлористого хромила, хлористого хрома, уксуснокислого хрома, гипософита натрия, едкого натра, фосфата хрома. При этом необходимо помнить, что эти вещества очень ядовиты и опасны для здоровья. И потому следует внимательно проштудировать учебник химии, если уж вы решили провести процесс хромирования этим методом. Но достичь высокого качества очень трудно, даже при наличии подробной инструкции. При всех существующих минусах этот метод используется для хромирования поверхностей в домашних мастерских чаще всего.
Очень удобно проводить процесс покрытия с помощью готовых пробных наборов химических препаратов для хромирования. Их предлагает компания Fusion Technologies. Удобство таких наборов заключается в том, что покрытие можно нанести на любой из перечисленных материалов: металл, керамику, дерево, стекло, пластик. Гальванических установок и специальной сложной техники не потребуется. Все, что вам нужно, это просторное помещение, дистиллированная вода, компрессор, распылитель и набор химических препаратов. Кроме этого нужно приготовить газовую горелку с баллоном газа.
Правила техники безопасности
- Устройство вентиляции в помещении мастерской. Открытием дверей и окон проблему не решить. Вмонтируйте в форточку обыкновенный кухонный вентилятор. Этого будет достаточно для любительской работы. Если же вы планируете работу в объемах частного предприятия, хромирование большого количества запчастей для автомобилей, декоративных предметов интерьера, то потребуется установка более эффективной и мощной вентиляции.
- Оборудование канализационных стоков. Работа потребует большого расхода воды для промывки деталей. Дополнительная очистка ее не нужна, так как она в химическом отношении инертна. А вот сток в канализационный канал должен быть оборудован обязательно.
- Чтобы не подвергать органы дыхания и кожу опасному воздействию реактивов, рекомендуется работать с применением защитных средств. Запаситесь респираторами, специальными защитными очками и прочным фартуком. Еще понадобится несколько пар резиновых перчаток.
При выполнении химической металлизации в личной мастерской не забывайте о строгом соблюдении технологии. Реактивы наносить на поверхность следует в указанной очередности. Затем следует нанесение тонкого слоя серебра. Этот металл безопасен в отличие от хрома и соединений. Финишный слой по характеристикам ни в чем не уступает хромированному.
Набор реактивов для металлизации состоит из модификаторов А и Б, восстановителя и активатора. В самом начале работы в указанном объеме дистиллированной воды разводятся реактивы. Пропорции строго соблюдаются. Хранить растворы следует в прохладном месте. Необходимые для работы лаки и пигменты покупать можно в том же магазине, где куплены реактивы.
Порядок выполнения работы

- Подготовка детали или конструкции. Поверхность следует тщательно очистить. Она должна быть максимально ровной. Для этого производится полировка.
- Затем выполняется процесс лакировки с использованием предназначенного для этой цели лака.
- Когда лак полностью высохнет, с помощью газовой горелки обрабатывается поверхность. Данный технологический процесс изменяет структуру лака на молекулярном уровне. Это делается с целью увеличения впитываемости и адгезии для металлизированного покрытия.
- Следом за тепловой обработкой производится распыление активатора. Быстро смывается водой лишний активатор.
- Пока поверхность еще не высохла, наносится модификатор, за ним растворитель. Реакция между ними приводит к образованию необходимого зеркального покрывающего слоя. Снова изделие промывается водой и сушится направленной струей воздуха.
- Процесс металлизации занимает около шести часов. После этого в соответствии с технологией деталь покрывается лаком. Эффект бронзы, хрома или золота достигается добавлением в лак соответствующих пигментов. Если вы решили у себя дома и собственными руками хромировать детали, заказывайте все необходимые химикаты на сайте компании. В случае необходимости специалисты окажут квалифицированную помощь, подскажут подходящие варианты установки оборудования в помещении вашей домашней мастерской.
Гальванизация
Гальванический способ – это покрытие чугунных, стальных, латунных или медных конструкций слоем хрома. Но не только металлические изделия можно подвергать хромированию способом гальванизации. Пользоваться этим способом можно и с целью хромирования также и пластмассовых, деревянных изделий. Но в этих случаях процесс будет дорогим и технологически сложным. Для прочного удержания на поверхности деталей покрытия из хрома даже металлические изделия требуют еще одного предварительного покрытия. Для этой цели используют никель, латунь либо медь.
Гальванизация требует создания гальванической установки. Кроме этого, нужен источник постоянного тока и набор реактивов. Набор этот состоит из ангидрида хрома, серной кислоты, соды кальцинированной и гидроокиси натрия.
Следует учесть, что при работе по этому методу требуется, чтобы не было перепадов силы тока. Также нужно постоянно контролировать уровень концентрации солей в электролите и строго соблюдать температурный режим довольно длительный срок (от 5 до 8 часов). Выполнение всех перечисленных условий в домашних мастерских – задача не из легких. Именно по этой причине описывать процесс гальванизации в подробностях в этом обзоре не станем.
Материалы для хромирования
Примеры наших работ
Химическая металлизация в домашних условиях
Покрытие деталей слоем металла осуществляется по разным методикам и в различных целях. Соответственно, отличаются и технологии работы. Химическая металлизация не является в исполнении сложной, поэтому и применяется более широко, особенно в домашних условиях. О том, в чем смысл данного способа, какие понадобятся реагенты и оборудование, что следует учитывать – со всем этим предметно и разберемся.
Занимаясь самостоятельной обработкой металлических образцов в быту, ориентируются, как правило, на их внешний вид, который они приобретут в результате технологической операции. Именно поэтому, когда говорят о металлизации химической в домашних условиях, априори подразумевается, что это хромирование. Вот на нем и будет сделан акцент. Именно методика покрытия тонким слоем Cr различных деталей (в основном, колесных дисков) интересует большинство автовладельцев.

Автор обращает внимание, что простота химической металлизации, что бы ни утверждалось в статьях данной тематики – кажущаяся. На практике домашнему мастеру придется столкнуться с рядом проблем. Что это за «подводные камни», можно ли их преодолеть – разберемся сначала с этим.
Особенности химической металлизации в домашних условиях
- Деталь, подвергающаяся обработке, помещается в резервуар (ванну). Вывод №1 – хромирование имеет ограничение, связанное с габаритами образца. Если емкость для тех же дисков подобрать еще можно, то металлизацию на дому, к примеру, бампера легкового авто, произвести вряд ли получится.
- В процессе работы происходит интенсивное выделение токсичных испарений. Заниматься металлизацией не рекомендуется даже на открытом воздухе, так как невозможно предугадать, когда и как изменится ветер. А если его нет вообще, полный штиль? Вывод №2 – планируя делать хромирование чего-либо в домашних условиях, необходимо позаботиться о выборе помещения, причем организовать там вентиляцию принудительную, так как естественной будет явно недостаточно.
- После завершения процесса химической металлизации остается электролит. Жидкость достаточно агрессивная. Куда ее девать? Вывод №3 – необходимо заранее определиться с утилизацией отходов производства.
 Исходя из вышесказанного, читателя, который рассчитывает проводить хромировку где-нибудь на кухне, придется разочаровать. Словосочетание «в домашних условиях» не следует понимать буквально. Подразумевается, что металлизация делается не на производстве, на специальном оборудовании, а своими силами, с помощью простейших реагентов и принадлежностей.
Исходя из вышесказанного, читателя, который рассчитывает проводить хромировку где-нибудь на кухне, придется разочаровать. Словосочетание «в домашних условиях» не следует понимать буквально. Подразумевается, что металлизация делается не на производстве, на специальном оборудовании, а своими силами, с помощью простейших реагентов и принадлежностей.
Поэтому придется переместиться в гараж, сарай или еще куда, предварительно подготовив рабочее место. Как вариант – балкон или открытая лоджия, но только при условии, что предполагается покрытие хромом сравнительно небольшой заготовки, с использованием малого количества электролита.
Что понадобится для хромирования
О помещении уже сказано. Теперь об оборудовании и материалах.

Источник постоянного напряжения
Технология металлизации предполагает использование различных электролитов и емкостей, соразмерным габаритам обрабатываемого образца. Следовательно, если речь не идет лишь о хромировании одной-единственной детали, то должна быть возможность регулировки силы тока. Простейший самодельный блок питания, использующийся в домашних условиях – трансформатор + выпрямитель + реостат.
Элементы эл/схемы
В основном это касается сечения проводов. Практика показывает, что 3-х «квадратов» при домашнем хромировании деталей вполне достаточно. Необходимо также приготовить зажимы, которыми они будут скрепляться с электродами. В продаже есть типа «крокодил». Стоимость – копеечная, а удобство работы с ними – максимальное.
Как обеспечить постоянство температуры в ванночке? Способов два. Первый и самый простой – использовать термометр, а корректировать значение силы тока вручную. Второй более сложный в реализации, так как придется устанавливать элемент автоматики – терморегулятор. Его включение в цепь избавит от необходимости контроля над процессом.
Примерное время хромирования известно, поэтому постоянное присутствие рядом с резервуаром не обязательно. Но для этого придется собирать небольшую электронную схему. Для тех, кто в этом не понимает, данный вариант неприемлем.
Ванночка
Ее материал должен быть нейтрален по отношению к жидкостям, тем более агрессивным. Поэтому лучше всего подходит стекло. Но это касается в основном малогабаритных деталей, которые смогут поместиться, скажем, в стандартной 3-литровой банке. Как вариант – емкости от промышленных аккумуляторов, с толстыми стенками. В таких любители аквариумов часто выращивают мальков. Но достать эти сосуды довольно сложно.

«Внешняя» емкость
Исходить нужно из того, что в нее будет устанавливаться выбранный стеклянный сосуд, который снаружи обкладывается утеплителем. Что можно использовать? Например, бочку, бидон, короб или ящик (даже деревянный).

Материал для теплоизоляции
Выбор большой, в зависимости от размеров емкостей – опилки, минвата, песок, стеклоткань. Задача – добиться эффекта «термоса». Поэтому необходимо изготовить крышку, которая должна полностью закрывать «внешний» резервуар. Если это ящик, то подойдет фрагмент, вырезанный из ФК, ОСВ или чего-то подобного. Нужно лишь предусмотреть гидроизоляцию крышки с внутренней стороны, если она из материала, в состав которого входит древесина. Что учесть? Из чего-бы крышка ни делалась, она не должна быть токопроводящей!
Нагревательный элемент
Чтобы упростить себе задачу, его можно приобрести. Ассортимент ТЭН достаточно большой, так что подобрать по конфигурации, размеру и мощности – не проблема.
Электроды
Могут быть пластинчатыми или стержневыми (например, из латуни, меди). В качестве «минусового» в домашних условиях обычно используется зажим, удерживающий обрабатываемый образец.

Кронштейн
Без этой «детали» не обойтись. Заготовка, которая помещается в электролит для металлизации, должна находиться в подвешенном состоянии. В противном случае та еее часть, которая будет примыкать к дну сосуда, останется необработанной. Конструкция кронштейна, способ его фиксации выбирается самостоятельно, в зависимости от условий проведения работы.
Сушильный шкаф
На последнем этапе металлизации деталь необходимо подвергнуть термообработке. Иначе не добиться характерного (и желаемого) блеска.
Порядок приготовления электролита
Методик, как и используемых реагентов, довольно много. Для хромирования в домашних условиях наиболее распространенный вариант электролита – на основе серной кислоты и хромового ангидрида. Соотношение компонентов: 2,5 г H2SO4 + 250 г CrO3 на 1 л чистой воды.
- Сначала наполняется ванночка. Вода (самая лучшая – дистиллированная) заливается примерно на ½. Ее оптимальная температура 60 – 65 ºС. В таких условиях растворение соединения хрома произойдет быстрее.
- Загрузка CrO3 и тщательное перемешивание до исчезновения всех крупиц.
- Если необходимо, доливается еще определенное количество воды (до требуемого объема), далее – серная кислота.

После перемешивания полученного раствора он подвергается «проработке». Она заключается в том, что через него пропускается постоянный ток. Его сила рассчитывается из соотношения: 1л – 6,5 А. Визуально готовность электролита можно определить по его оттенку. Он должен приобрести окрас темно-коричневый. После этого раствор отстаивается в темном и прохладном месте не менее 24 часов.
Подбирая емкость по объему, нужно ориентироваться на мощность блока питания. Соответственно, и он должен выбираться, исходя из размеров деталей, подлежащих металлизации. Это еще одна причина, по которой в домашних условиях хромирование крупногабаритных образцов нецелесообразно и затруднительно.
Подготовка детали к металлизации
Пока электролит отстаивается, самое время заняться этим.
Удаление загрязнений
Чтобы хромирование было качественным и недорогим, покрывающий деталь слой должен быть однородным и тонким. Этого можно добиться, если поверхность зачищена до самой основы. Чем удалять инородные фракции и обезжиривать, решается самостоятельно. Для образцов с ровными гранями достаточно, как правило, «шкурки». В остальных случаях придется подумать, как и чем удалить грязь и ржавчину.
Обезжиривание
Это второй подготовительный этап. Ограничиваться лишь традиционными средствами – бензином, уайт-спиритом, растворителем «666» или чем-то подобным – значит, не добиться качественной металлизации. Хромировка на такой поверхности долго не продержится.
Дополнительная обработка производится в растворе, который специально готовится для этих целей. Рецептов много, но наиболее популярный при металлизации на дому следующий:
150 (едкий натр) + 50 (кальцинированная сода) + 5 (силикатный клей).
*Из расчета г/л воды.
Предварительно обработанная заготовка погружается в этот раствор, который должен быть доведен до температуры 85 (±5) ºС. Время выдержки зависит от рельефности детали и степени ее остаточного загрязнения (от ⅓ до 1,5 часов).

Особенности процесса хромирования
Схема «установки» с полярностью включения напряжения показана на рисунке (см. выше).
- Подача тока после погружения образца в электролит производится с некоторой задержкой. Почему? Качественная металлизация произойдет, только если температуры детали и раствора выровняются. Поэтому придется немного подождать. Это время можно и сократить, если образец предварительно нагреть градусов до 40 – 50. Например, перед рефлектором.
- Рекомендуемый ток в пределах 55 ºС.
- После того, как вся деталь покроется слоем хрома, без «проплешин» (определяется визуально), ее необходимо просушить в эл/шкафу (минимум 2,5 – 3 часа).
 Прежде чем закончить статью, автор с большим сожалением должен добавить пару «ложек дегтя». Тем, кого не пугают перечисленные трудности, нужно учесть и еще ряд проблем, с которыми придется столкнуться.
Прежде чем закончить статью, автор с большим сожалением должен добавить пару «ложек дегтя». Тем, кого не пугают перечисленные трудности, нужно учесть и еще ряд проблем, с которыми придется столкнуться.
Некоторые – например, обеспечение высокого качества полировки, соблюдение абсолютной точности рецептуры, сложность определения оптимальных габаритов и формы электродов, выдержка неизменного режима по току – покажутся незначительными на фоне всего лишь одной.
Где взять ангидрид и «чистую» кислоту? Первый в продаже есть, но только для юр/лиц, с оформлением соответствующих документов. Магазинная H2SO4, которую приобретают с целью приготовления электролита для АКБ, не подходит. Она недостаточно «чистая», поэтому не обеспечит качественной хромировки.
Статья получилась достаточно полной. А заняться или нет металлизацией на дому, решать только вам, уважаемый читатель.
Чтобы защитить металлические конструкции от коррозии, повысить прочностные характеристики и улучшить эстетичность их внешнего вида, применяют технологию хромирования. Она относительно несложная и доступна для освоения, но перед тем, как хромировать любой металл, нужно тщательно изучить технологию обработки, чтобы не допустить ошибок.

 Хромированный металл
Хромированный металлЧто такое хромирование?
Хромирование деталей заключается в нанесении специального покрытия на металлическую поверхность. Существует два основных метода:
- Насыщение поверхностных слоёв диффузионным методом. Максимальное число атомов хрома проникает внутрь металлической кристаллической решётки.
- Электролитический метод. Заключается в катодном осаждении хрома на стальную конструкцию под действием электрического тока.
Покрытие хромом проводится только на чистую подготовленную поверхность. Особенностью процесса является нанесение однородного слоя определённой толщины на конструкции различных форм. Покрытие может выполнять декоративную или защитную функцию.
Толщина образуемого слоя — от 0,075 до 0,25 мм. Твёрдость — 66–70 HRC. Поверхность имеет шероховатости и чем толще наносимое покрытие, тем больше дефектов. Поэтому после хромирования требуется полировка заготовок.
Технология предусматривает применение растворов:
- с хромовым ангидридом;
- с сульфатом или хлоридом хрома.
Зачем нужно хромирование?
Процесс хромирования проводится для следующих целей:
- Защиты металлов от коррозии, резких перепадов температуры.
- Восстановления поверхности металла. Возможно повышение срока эксплуатации конструкций, при условии износа поверхности на глубину до 1 мм.
- Повышения износостойкости. Хромовое покрытие способно стойко переносить трение, механические воздействия, температурные расширения. Позволяет защищать основной металл от негативных внешних факторов.
- Улучшения отражающих свойств. Хромированный слой обладает отражающими свойствами. Применяется в осветительных приборах для улучшения видимости корпусных элементов или знаков.
Технология хромирования деталей
Существуют следующие виды хромирования:
- В электролитической среде. Атомы Cr осаждаются на токопроводящие наружные слои металла. Реакция протекает при подаче напряжения на электроды. Образуемый слой отличается стойкостью к химически активным средам и механическим воздействиям.
- Химическое хромирование. Это восстановительная реакция хрома из солевого раствора в присутствии реагентов. Наличие фосфора позволяет избавиться от серого оттенка на металле. Метод требует обязательного использования защитной экипировки.
- Декоративное хромирование с применением гальванической кисти. Метод простой и не требует наличия опыта проведения подобных работ. Контроль толщины происходит одновременно с процедурой нанесения хромового покрытия.
Оборудование для хромирования
Для хромирования в домашних условиях потребуется:
- Гальваническая ванна. Это ёмкость, покрытая снаружи теплоизоляционным слоем. Подходит любой сосуд, стойкий к химической среде.
- Источник питания для подключения электродов. Он должен иметь мощность до 1 кВт, регулятор по напряжению, рассчитанный на ток 50 А.
- Нагреватель из материала стойкого к кислой среде для подогрева электролита.
- Температурный датчик, откалиброванный для измерений при температурах от 00С до +1000С.
- Свинцовая пластина, выполняющая роль анода. Нужно сделать крепление внутри ёмкости, чтобы она была от стенок на расстоянии. Катодом служит деталь, к которой нужно прочно закрепить контактный провод.
Новичкам рекомендуется использовать набор для хромирования, в котором есть нужные реагенты для химической металлизации. Многие производители в комплект включают подробную инструкцию по нанесению покрытия.
Гальваническая ванна (Фото: Instagram / pt_plast)Как хромировать детали?
Хромирование конструкций своими руками в домашних условиях необходимо выполнять в просторном нежилом помещении. Нужно подготовить инструменты, плотную одежду, очки, респиратор.
Для подготовки раствора нужно использовать неметаллические ёмкости. Связано это с необходимостью применения окислительного раствора.
В качестве катода следует использовать тонколистовой свинец или оловянный сплав. Ванна для электролиза может быть пластиковая цилиндрическая или прямоугольная. Если раствора было приготовлено больше требуемого объёма, его можно хранить в герметичной ёмкости с крышкой.
Для приготовления электролита должны быть использованы только чистые вещества. Хромовый ангидрид недоступен в свободной продаже.
Пошаговое хромирование деталей автомобилей:
- Деталь очистить от грязи и отполировать.
- При обработке стали проводят активацию поверхности. Она заключается в погружении заготовки в соляную кислоту на 5–20 минут. Длительность зависит от размеров и сложности поверхности.
- С детали смываются остатки кислоты.
- После высыхания конструкция погружается в ванну с раствором электролита.
- Внутри ванны устанавливается анодная свинцовая пластинка, к ней подключается плюсовой контакт от источника тока. К детали подсоединяется минусовый провод.
- Включается питание на 20-40 минут. По истечении времени деталь извлекается наружу.
- Через 3 часа хромированную поверхность шлифуют до блеска.
Для получения качественного покрытия нужно обеспечить:
- стабильное электрическое напряжение;
- соблюдение пропорций электролита;
- подготовку детали в соответствии с требованиями технологии;
- контроль и соблюдение температурного режима;
- выдержку электролита под током определённое время (от трех часов).
Подготовка детали
Перед хромированием деталей своими руками нужно:
- Очистить детали от грязи.
- Снять с металлической поверхности слой ржавчины. Зачистка выполняется наждачной бумагой
- Очистительными средствами удалить пятна жира, масел.
Как готовить электролит?
Для хромирования деталей в домашних условиях нужен электролит. Пропорции ингредиентов для приготовления раствора:
- ангидрид в растворе 150–250 г/л;
- серной кислоты от 1,5–2,5 г на литр раствора.
Ангидрид хрома ядовит, его применение смертельно опасно.
Приготовление электролита:
- Стеклянный сосуд на 50% заполняется водой, нагретой до +600С.
- В соответствии с количеством налитой воды добавляется ангидрид. Смесь перемешивается до полного растворения.
- Доливается вода до наполнения сосуда.
- Заливается в пропорции кислота, жидкость тщательно перемешивается.
При электролитическом восстановлении катод присоединяется к заготовке, а анод – погружается в подготовленный раствор.
Раствор, оставшийся после хромирования, нужно утилизировать. Он канцерогенен и может вызывать кожные заболевания, появление опухолей.
Этапы хромирования
Пошаговая процедура хромирования в домашних условиях:
- Раствор электролита нагревают до +52 градусов и выдерживают.
- Подготавливают сосуд для электролиза. В сосуде закрепляют анод, размещают заготовку, фиксируют на равноудалённом расстоянии от стенок. Прогревают до температуры раствора.
- В подготовленную ёмкость заливают электролит.
- На электроды 20–60 минут подаётся напряжение. Длительность зависит от объёма ёмкости, размеров, формы детали.
- Заготовка вынимается, промывается, сушится. Сушить следует на чистой поверхности. Важно исключить контакт с посторонними предметами.
Чтобы нанести хром на пластик декоративным способом, нужно выполнить следующее:
- Обеспечить качественное вентилирование помещения.
- Подобрать кисть с длиной ворса 2,5 см, обмотать её проводом из свинца.
- Закрепить кисть в торцевой части цилиндрической ёмкости.
- С противоположной стороны прикрепить диод.
- В ёмкость залить подготовленный электролит.
- В качестве источника питания в электрическую цепь подключается понижающий трансформатор. Минусовый контакт подключается к хромируемой заготовке, а плюсовый — к анодному диоду.
- На заготовку кистью нанести электролитический раствор. Каждый участок поверхности обрабатывается кистью от 20 раз.
- Отключить питание трансформатора.
- Достать из емкости заготовку, обработать и высушить деталь. Если на поверхности была грязь, её можно удалить при помощи воздушного потока, создаваемого компрессором.
- При сушке деталь не должна контактировать с посторонними предметами или подвергаться загрязнениям.
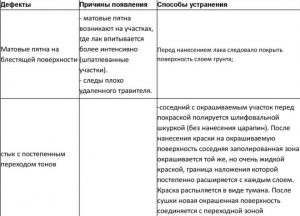
Причины появления дефектов
Причины создания дефектного покрытия:
- несоблюдение пропорций компонентов;
- нарушение температурного режима;
- отклонение от нормированных электрических параметров;
- обработка заготовок из самопассивирующихся металлов, не прошедших травления;
- некачественная очистка поверхности.
При хромировании в домашних условиях повышается риск возникновения дефектов:
- Отсутствует блеск. Основной причиной является повышенное количество ангидрида хрома в смеси. Также возможны ситуации с низкой концентрацией серной кислоты или превышении токового значения.
- Неравномерный блеск. Возникает в результате повышенных значений подаваемого на электроды тока либо несоблюдении температурного нагрева электролита.
- На наружном слое образовались коричневые пятна. В растворе повышенная концентрация хромового ангидрида или недостаточное количество серной кислоты.
- Появились небольшие раковины снаружи заготовки. Результатом такого эффекта является некачественная подготовка детали к обработке: полировка выполнена некачественно. Другая причина — наличие водорода на наружном слое.
- Неравномерность толщины хромового покрытия. Создаётся по причине подачи повышенной силы тока на электроды.
- Покрытие имеет низкую прочность, при механических воздействиях остаются следы. Возникает при недостаточной температуре прогрева.
- Наличие трещин в покрытии. Связано с применением электролита, в котором концентрация железа более 0,15 кг/л.
- Отсутствие хромированного покрытия на некоторых участках детали. В электролите присутствуют растворённые нитраты.
- Происходит отслаивание хромового слоя. В ходе электролиза напряжение, подаваемое от источника тока, было нестабильным или снизилась температура электролита. Другой причиной может быть плохо обезжиренная поверхность.
Любой металл подвержен коррозии, но его можно покрыть защитным слоем. Наиболее простым методом защиты металла считается хромирование. Чтобы правильно провести обработку, нужно изучить нюансы этого процесса и подготовить необходимый инструмент.
Для улучшения характеристик изделий различного назначения используют множество методов, одним из которых является химическое хромирование. Данная технология позволяет значительно улучшить как декоративные характеристики изделия, так и его механические свойства – прочность и износостойкость.
Так выглядит колпак на колесо после нанесения хромового покрытия химическим способом и последующей полировки
Суть технологии
Суть хромирования, выполняемого по любой технологии, заключается в том, что на обрабатываемую поверхность наносится слой хрома, позволяющий значительно улучшить как декоративные, так и механические свойства детали. Покрытие из хрома наделяет изделие следующими качествами:
- исключительными декоративными характеристиками;
- высокой устойчивостью к коррозии;
- жаростойкостью;
- износостойкостью;
- более технологичными электромагнитными и механическими свойствами.
Промышленная линия химического хромирования
Самыми популярными методами, при помощи которых на обрабатываемую поверхность наносится слой хрома, являются гальванический и диффузионный. В отличие от них, хромирование, выполняемое химическим способом, не требует применения специального оборудования и позволяет получать качественные, однородные и надежные покрытия даже на изделиях, отличающихся сложной формой. Химическая металлизация (в частности, хромирование) выполняется с использованием специального водного раствора, нагреваемого до определенной температуры.
Суть химического хромирования заключается в том, что хром, оседающий на обрабатываемой поверхности, восстанавливается из раствора своих солей. Такая восстановительная реакция становится возможной за счет того, что в растворе для химического хромирования содержится гипофосфит натрия. Присутствие в растворе именно данного вещества – это главное отличие химического хромирования от аналогичного процесса, выполняемого с применением электролитического раствора.
Гипофосфит натрия – бесцветные кристаллы, применяемые для химического хромирования в основном металлических изделий, иногда и пластмасс
После проведения химического хромирования готовое покрытие получается матовым, что хорошо заметно даже по видео данного процесса. Чтобы придать такому покрытию характерный хромовый блеск, изделие необходимо подвернуть последующей полировке. Между тем хромовый слой, полученный с помощью данной технологии, хотя и не отличается высокой декоративностью, если сравнивать его с диффузионными и электролитическими покрытиями, обладает более высоким качеством и надежностью. В частности, в таком покрытии содержится фосфор, который придает ему прочность и твердость.
Подготовка к процедуре
За счет своей простоты проведение химического хромирования не требует серьезных финансовых затрат. Выполнить хромирование в домашних условиях при помощи данной технологии несложно, для этого вполне достаточно внимательно изучить теоретический материал и просмотреть соответствующее видео.
Однако следует иметь в виду, что химические реактивы, используемые для хромирования по данной технологии, выделяют токсичные испарения, которые опасны для здоровья человека, поэтому следует строго соблюдать правила техники безопасности.
В процессе химического хромирования следует избегать контакта растворов с незащищенными участками тела
Выполнять такое хромирование в домашних условиях следует только в нежилых помещениях, в которых организована эффективная вентиляция. Кроме того, необходимо использовать средства личной безопасности:
- респиратор, защищающий органы дыхания;
- очки для защиты органов зрения;
- перчатки, одежду и обувь, защищающие кожные покровы;
- клеенчатый фартук.
Растворы для хромирования, выполняемого по химической технологии, а также для проведения всех вспомогательных технологических операций готовятся на основе дистиллированной воды. Реактивы, используемые при этом, должны иметь в своей маркировке букву «Ч», что свидетельствует об их химической чистоте. Посуда, в которой готовят рабочие растворы, может быть только стеклянной или эмалированной.
Реактивы для химического хромирования
Перед началом химического хромирования поверхность изделия следует подвергнуть тщательной очистке и обезжириванию. Надежность и качество хромового покрытия в большой степени определяются тщательностью выполнения данных процедур. Если обрабатываемая поверхность достаточно сильно загрязнена и на ней имеются остатки старого покрытия или следы коррозии, то ее обрабатывают при помощи пескоструйной установки или наждачной шкурки, добиваясь металлического блеска. Сформировать более надежное и качественное хромовое покрытие позволяют предварительные шлифовка и полировка изделия. После выполнения этих технологических процедур обрабатываемую поверхность обезжиривают при помощи водного раствора, включающего в свой состав такие компоненты, как:
- каустическая сода – 100–150 г/л;
- карбонат натрия – 40–50 г/л;
- жидкое стекло – 3–5 г/л.
Промывка и обезжирование деталей перед хромированием
Чтобы выполнить обезжиривание, полученную смесь подвергают нагреву до 60–100° и только после этого опускают в нее обрабатываемое изделие. В зависимости от степени загрязнения поверхности изделие держат в нагретом растворе от четверти часа до 60 минут. Чтобы улучшить сцепление хрома с обрабатываемой поверхностью, можно дополнительно выполнить ее декапирование, которое проводится в растворе соляной и серной кислот.
Следует иметь в виду, что хромовое покрытие будет держаться тем прочнее, чем чище и ровнее поверхность, на которую оно наносится.
При необходимости выполнения химического хромирования алюминия изделие из данного металла подвергают еще и цинкатной обработке, после которой его промывают. Перед химическим хромированием деталей из стального сплава на их поверхность предварительно наносится слой меди. Для этого используется водный раствор, включающий следующие компоненты:
- сульфат меди – 50 г/л;
- концентрированную серную кислоту – 5–8 г/л.
Рабочая температура такого раствора, в котором изделие выдерживается в течение нескольких секунд (5–10), должна составлять 15–25°. После выдержки в растворе для омеднения изделие промывают водой и просушивают. Если сталь после омеднения дополнительно покрыть никелевым слоем, толщина которого будет составлять порядка 1 микрометра, то хромирование, выполняемое в дальнейшем, будет более качественным.
Приготовление рабочих растворов
Растворы для химического хромирования надо готовить в следующей последовательности.
- Все используемые химические реагенты, кроме гипофосфита натрия, смешиваются или растворяются в воде.
- Полученный раствор подвергают нагреву до рабочей температуры.
- В нагретый до рабочей температуры раствор добавляют гипофосфит натрия.
Изделие, которое необходимо подвергнуть хромированию, подвешивают в подготовленном и разогретом растворе и выдерживают в нем в течение 5–8 часов. Время выдержки зависит от требуемой толщины слоя хрома. Чтобы удалить с поверхности только что нанесенного покрытия остатки химических реактивов, обработанное изделие кипятят в воде в течение получаса. Более подробно изучить процедуру химического хромирования позволяет видео на данную тему.
Изделия, на поверхность которых нанесен слой хрома, подвергают термической обработке, способствующей протеканию низкотемпературной диффузии, а значит, улучшающей адгезию нанесенного слоя с основным металлом. Выполняется термообработка при температуре 400°. В таких условиях изделие выдерживается в течение часа.
Печь для сушки и термической обработки хромированных изделий
Отдельные изделия из стали, такие как ножи, рыболовные крючки, пружины и др., после термообработки могут утратить свою твердость, поэтому их выдерживают при температуре 270–300° в течение трех часов. Термообработка после химического хромирования, с порядком осуществления которой также можно познакомиться по соответствующему видео, позволяет повысить твердость нанесенного покрытия.
Готовое хромовое покрытие после просушки изделия, на которое оно нанесено, имеет сероватый матовый налет. Чтобы придать хрому характерный блеск, поверхность детали подвергают полировке.
Химические реактивы
Для химического хромирования используют несколько основных растворов, которые делятся на кислые (pH 4–6,5) и щелочные (pH больше 6,5). Ниже приведены химические составы таких растворов.
Химический состав растворов для хромирования
И в заключение небольшое видео об оборудовании и реагентах, используемых при химическом хромировании.
Оценка статьи:
Загрузка…Поделиться с друзьями:
Тех, кто интересуется защитой сплавов и декоративным напылением, наверняка интересует вопрос, осуществима ли химическая металлизация в домашних условиях? Поговорим об этом подробнее.
1 Что такое металлизация и каковы ее виды?
Что же собой представляет технология металлизации и в каких случаях она осуществляется? Как становится понятно из названия, данный процесс заключается в нанесении на поверхность металлического слоя. Причем в качестве материала основы может выступать как металл, так и неметалл (дерево, стекло и т. д.). В зависимости от покрытия выделяют: самый популярный процесс цинкования (наносится слой цинка), химическое хромирование (слой хрома), не всем знакомое алитирование (алюминиевое покрытие) и т. д.

Что же насчет методов нанесения, они также могут быть самыми различными, в зависимости от того, какое оборудование используется. Широко распространено гальваническое покрытие, когда обрабатываемую деталь помещают в ванну с электролитом. Также к данному процессу можно отнести и газопламенное напыление, и плакирование. В первом случае реагенты наносятся в дисперсном состоянии, а способ плакирования заключается в том, что на одну или же обе стороны изделия наносят слой металла и затем осуществляют горячую прокатку.

Еще существует диффузионная технология и метод горячего покрытия. В первом случае напыление получают путем насыщения верхних слоев детали атомами металла защитного покрытия, которые затем проникают вглубь при нагреве. Второй же метод заключается в том, чтобы погрузить обрабатываемую деталь в раскаленный металл. Как видно, один метод причудливее другого, особенно это отражает используемое оборудование. И последний вид, на котором остановимся более подробно, это хим. металлизация, мы разберем эту технологию и попробуем осуществить ее в домашних условиях.
2 Назначение химической металлизации и ее особенности
Проводится металлизация с различными целями, чаще всего это получение декоративного покрытия. Еще подобным способом можно устранить такие мелкие дефекты, как микротрещины, поры и т. д. Однако это далеко не единственная задача, с помощью хим металлизации иногда производят и восстановление деталей, правда, достаточно редко. Основное же назначение покрытия из определенного металла – улучшение свойств основного материала. Таким образом достигаются великолепные антикоррозионные характеристики, повышается стойкость, увеличивается твердость, осуществляется защита от эрозии. В общем, можно сказать, что с помощью хим металлизации появляется возможность получения покрытий с заданными свойствами.

Итак, выше уже были рассмотрены разные способы нанесения защитных покрытий, осталась без внимания только хим металлизация. На ней сейчас и остановимся более подробно. Данная технология заключается в том, чтобы обеспечить идеальные условия для протекания окислительно-восстановительных реакций. В этом случае атомы, у которых окислительно-восстановительный потенциал находится на более высоком уровне, вырываются наружу. На видео мы не увидим явного процесса перехода, но отчетливо заметим изменение цвета детали.

Технология проведения химической металлизации заключается в следующем: на поверхность наносятся специальные реагенты, которые вступают в реакцию между собой, в результате чего образуется покрытие. Причем последнее может иметь самые разные цвета, при необходимости создаются даже такие покрытия, которые сочетают в себе несколько оттенков, плавно переходящих друг в друга.
Примерно так осуществляется, например, каталитическое хромирование. Если обратить внимание на соответствующие видео процесса хим металлизации, то можно заметить, что метод довольно прост в исполнении, в принципе его можно сравнить с простым нанесением краски.
3 Химическая металлизация – необходимые материалы и оборудование
Некоторые из процессов хим металлизации можно выполнить в домашних условиях, правда, нужно быть очень осторожными, чтобы не навредить здоровью, ведь работать придется с химией, иногда весьма агрессивной. А вот если у вас есть еще и более-менее специализированное оборудование, то можно обрабатывать элементы, имеющию самую различную сложную форму и размеры, начиная от пуговицы и заканчивая огромной статуей, напыление получается не хуже заводского.

Что же насчет материалов, так для химической металлизации понадобятся реактивы со свойствами активатора и восстановителя. Кроме них необходима еще и грунтовка, которой предварительно обрабатывается поверхность изделия, а также лаковое покрытие. Последнее выполняет защитную функцию и является завершающим аккордом в процессе хим металлизации. Оно обладает довольно высокой твердостью и износостойкостью.

Для того чтобы получить какой-то определенный цвет, технология предусматривает добавление еще и красящего тонера. Чтобы повысить адгезионные свойства перед тем как наносить защитный слой металла, поверхность покрывают специальным грунтом. Если эксперимент не удался, и полученный результат далек от ожидаемого, то без труда удалить такое покрытие можно с помощью специального смывочного вещества.
4 Можно ли провести химическую металлизацию в домашних условиях?
Итак, рассмотрев всю теоретическую часть, стоит перейти к практической и выяснить, возможно ли своими руками осуществить химическую металлизацию, где искать оборудование и реагенты, которые понадобятся для этого?
Конечно, подобная обработка деталей может навредить здоровью, но только в том случае, если игнорировать технику безопасности, поэтому данному вопросу отведено отдельное место в статье. Что же насчет ранее описываемого способа хим металлизации, то технология не представляет ничего особо сложного. Как уже говорилось, она очень похожа на простую покраску, там не используется замысловатое оборудование, главное – выдерживать последовательность. Сейчас же более детально рассмотрим иной метод, который несколько сложнее в исполнении.

Нам понадобятся эмалированная емкость, реагенты, паяльная лампа и, желательно, некоторые знания в области химии, для того чтобы точно определиться с необходимыми компонентами. Подготовив все расходные материалы для химической металлизации и простенькое оборудование, приступаем к обработке самой детали. Ее следует хорошенько очистить и обезжирить. Учтите, данная операция весьма важна и не терпит халатного отношения, так что берем щелочной раствор либо же хорошее моющее средство и тщательно удаляем все органические загрязнения. Не забываем и промыть элемент под проточной водой, дабы смыть само моющее средство.
Если не вся деталь подвергается металлизации, то следует заизолировать участки, которые не будут обрабатываться. Для данной цели подойдет свинец, так как он устойчив к электролиту.
Теперь понадобится установка для химической металлизации. Так как к деталям нужно будет подвести ток, то крепить их нужно на проводящие основания. Далее опускаем изделие в ванну с раствором, подаем напряжение и вытаскиваем через час. Если качество покрытия устраивает, отключаем оборудование, и дело остается за малым – просто отполировать остывшую деталь.

Помните, что любое игнорирование мер безопасности может нанести вред вашему здоровью. Итак, перед началом обязательно проверьте качество контактов вашего оборудования, ведь через них проходит достаточно большой ток, и, можно сказать, что именно на них возлагается основная нагрузка. Поэтому они должны быть максимально надежны. Вытаскивая деталь из ванны, не забудьте надеть перчатки, в противном же случае ожогов не избежать. Кроме того, особые требования предъявляются и к помещению, в котором будет проходить металлизация, особенно если работаете в домашних условиях. Оно должно быть открытого типа, так как во время реакции происходит обильное выделение газов, в результате чего возникает туман, который раздражает слизистые человека.

Хромированное покрытие способно изменить качественный и декоративный состав любого предмета. Многие фирмы предлагают услуги по металлизации элементов, но существует альтернатива дорогостоящей процедуре. Вполне реально провести хромирование в домашних условиях, если знать некоторые тонкости и правила производственной технологии.
Процедура хромирования
Хромированием называют сложный физико-химический процесс, представляющий собой зеркальное серебрение отдельных элементов с помощью распыления. Покрытие из хрома не поддаётся окислению и агрессивному напору внешней среды, а также надолго сохраняет насыщенность оттенка. Металлизация хромом применяется не только для обновления автомобильных запчастей, но и для создания интерьерного декора.

Условия для проведения процедуры
Процесс преображения невзрачных деталей в зеркальные предметы сопряжён с использованием химических реагентов. Жилая комната или кухня не подойдут для хромирования в домашних условиях. Для такого опыта стоит создать импровизированную лабораторию в гараже или другом изолированном помещении. Опасные испарения реагентов могут повысить риск возникновения онкологических заболеваний, поэтому выбранная комната должна быть оборудована вентиляцией, а мастер снаряжен защитной одеждой, очками и маской.
Подготовка рабочего места – очень ответственная часть работы, при проведении которой нужно учесть некоторые особенности технологии.

В каких условия безопасно проводить хромирование
Базовое оборудование
К основным инструментам, используемым при обработке металла, относят следующие компоненты:
- электрохимическая ванна или стеклянная ёмкость;
- выпрямитель тока;
- нагревательный элемент;
- термометр.
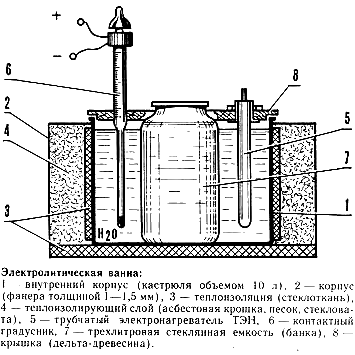
Схема электрохимической ванны для хромирования
Для химической обработки разных металлов предназначена гальваническая ванна. Объёма изолированной ванны хватит для того, чтобы подвергнуть серебрению крупногабаритный металл. Хромирование своими руками мелких деталей можно провести в небольших ёмкостях из стекла.
С помощью обычного термометра можно выдержать нужную для процедуры температуру. Химические реагенты являются основными участниками процесса серебрения металла. Основной компонент – оксид хрома, который в определённой дозировке считается смертельным ядом. К использованию этого вещества стоит отнестись предельно внимательно.
Применение оксида хрома
Химические реагенты
Самостоятельное хромирование также подразумевает поиск надёжных поставщиков, торгующих нужными веществами. Большинство химических компонентов можно приобрести на складах медицинского оборудования, а остальные – купить в аптеке. В стартовый набор включены следующие вещества:
- AgNO3 – азотнокислое серебро – 2 г;
- SnCl2 – двухлористое олово – 2,5 г;
- Глюкоза – 2,5 г;
- NaOH – гидроксид натрия – 22 г;
- NH4OH (аммиак) – 5 мл;
- HCl – соляная кислота – 20 мл;
- Формалин 37% – 0,45 л;
- Дистиллированная вода –2 л.
С помощью кухонных весов или мерных стаканов можно выполнить дозировку каждого препарата. А для самого процесса хромирования своими руками понадобятся одноразовые шприцы и бытовые распылители.
Технология изготовления покрытия
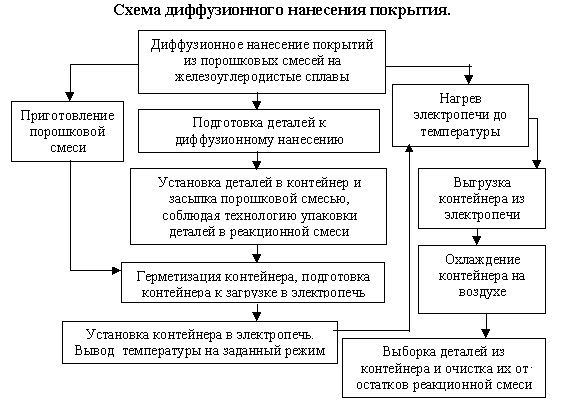
Технология опыления металла хромом включает 4 этапа.
Процесс хромирования
Приготовление растворов
Эта стадия работы начинается с изготовления из химических компонентов специального состава. Раствор двухлористого олова понадобится для активации поверхности металла. Его можно приготовить, использовав следующие компоненты:
- дистиллированная вода – 0,5 л;
- двухлористое олово – 2,5 г;
- соляная кислота – 20 мл.

Приготовление растворов для хромирования
Рецепт восстановителя предполагает следующий набор составляющих:
- дистиллированная вода – 0,5 л;
- формалин – 5 мл;
- глюкоза – 2,5 г.
Рецепт серебрильного раствора:
- дистиллированная вода – 0,5 л;
- азотнокислое серебро – 2 г;
- гидроксид натрия – 2 г;
- аммиак – 5 мл.
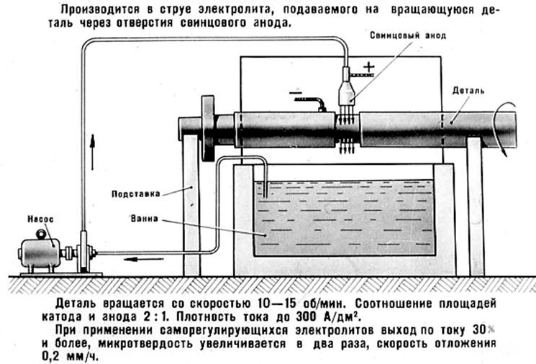
Струйное хромирование
Подготовка поверхности
Подготовка изделия для хромирования своими руками требует обезжиривания поверхности металлической детали. Рецепт обезжиривающего состава: дистиллированная вода – 0,5 л (to – 50-60o) и гидроксид натрия — 20 г.
Покрытие стоит протереть обезжиривающей жидкостью, далее нужно тщательно смыть раствор. Необработанные фрагменты детали не будут поддаваться диффузионной металлизации.
Обезжиривание поверхности
Активация покрытия
Реакцию опыления металла необходимо активировать. Выполнение этого приёма требуется для того, чтобы серебро надёжным слоем покрыло желаемый предмет. Активация покрытия производится с помощью раствора двухлористого олова в течение ровно 1 минуты. Дальше следует охлаждать поверхность металла, путем помещения его в холодную воду на 3 минуты. Несоблюдение временных промежутков опыления ведёт к браку детали.

Помещение металла в раствор
Металлизация
Получение желаемой плёнки серебра на поверхности предмета – самый интересный этап хромирования в домашних условиях. Серебрильный раствор и восстановитель следует распылять по объекту таким образом, чтобы два состава равномерно ложились на поверхности металла.

Металлизация распылителем
Методы проведения
Знание взаимодействия химических элементов и наличие базового оборудования поможет беспроблемно провести хромирование своими руками. Существует 3 способа проведения данной процедуры.
Гальванический
Электрохимический метод серебрения металла подразумевает наличие прокаливающего элемента – катода, среды химической реакции – электролита, обрабатываемой детали – анода. Электролит представляет собой смесь очищенной воды, серной кислоты и хромового ангидрида (CrO3). Погружение объекта металлизации в электролит производится при температуре воды 60-80оС. В результате реакции, на стенках предмета оседают катионы хрома, и деталь покрывается зеркальной плёнкой.
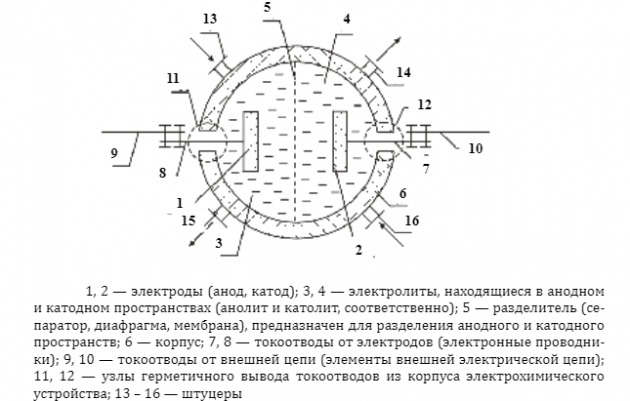
Схема электрохимического устройства
Каталитический
Химический способ обработки металла основывается на взаимодействии реагентов с поверхностью изделия. Атомы с высоким потенциалом поднимаются на верхний слой покрытия в результате реакции с реагентами. Полученное покрытие полируют и доводят до зеркального оттенка.

Диффузионный
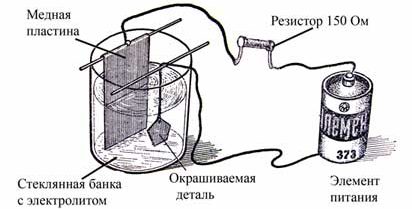
Такой метод хромирования сохраняет базовые принципы напыления хрома, но сама процедура проводится с помощью гальванической установки. Этот тип хромирования своими руками избавляет от необходимости сооружать громоздкую электролитическую ванну. Гальваническая установка представляет собой специальную кисть, в которую заливается электролит, трансформатор и шнур, соединяющий катод и анод. Вместо привычной ворсистой кисти можно использовать пористую губку.
Причины появления изъянов на поверхности деталей
Опытные мастера выделяют несколько основных причин, влияющих на качество хромирования в домашних условиях.
Способы устранения изъянов на поверхности деталей
Превышение силы тока. Избыточный ток, пропущенный через объект, может привести к неравномерному окрашиванию предмета.
Несоблюдение технологии. При нарушении оптимальных температурных показателей и дозировки реактивов металл не обретёт желаемый зеркальный блеск.
Некачественная подготовка изделия-основы. Плохое обезжиривание не позволит катионам хрома равномерно осесть на поверхности предмета, а также уменьшит срок его эксплуатации.
Видео по теме: Химическая металлизация (хромирование)
Химия может быть одной из самых завораживающих, но и опасных наук. Смешивание определенных химикатов может вызвать довольно неожиданные реакции, которые приводят к забавным демонстрациям. В то время как некоторые реакции можно наблюдать ежедневно, например, смешивая сахар в кофе, некоторые требуют контролируемых условий для визуализации эффектов. Но есть некоторые химические реакции, которые просто зрелищно наблюдать, и их легко проводить в химических лабораториях.
Тем не менее, для вашей безопасности самый простой выход – это посмотреть видео таких впечатляющих химических реакций, прежде чем вы начнете копировать их, чтобы лучше понять уровень риска и необходимые меры предосторожности.
Вот список из 19 самых потрясающих химических реакций, которые доказывают, что наука всегда крута.
1. Полиакрилат натрия и вода
Полиакрилат натрия является сверхабсорбирующим полимером. Чтобы подвести итог реакции, ионы полимера притягивают воду путем диффузии.Полимер поглощает воду в течение нескольких секунд, что приводит к почти мгновенному превращению в гелеобразное вещество. Этот химикат на самом деле то, что используется в подгузниках для поглощения жидких отходов. Технически, это не химическая реакция, потому что химическая структура не меняется и не происходит реакции с молекулами воды. Скорее, это демонстрация поглощения в макромасштабе.
2. Диэтилцинк и воздух
Диэтилцинк является очень нестабильным соединением.Когда он вступает в контакт с воздухом, он горит с образованием оксида цинка, CO2 и воды. Реакция происходит, когда диэтилцинк вступает в контакт с молекулами кислорода. Химическое уравнение выглядит следующим образом:
Zn (C2H5) 2 + 5O2 → ZnO + 4CO2 + 5h3O
3. Цезий и вода
 Источник: Giphy
Источник: Giphy Цезий является одним из наиболее активных щелочных металлов. Когда он вступает в контакт с водой, он реагирует с образованием гидроксида цезия и газообразного водорода.Эта реакция происходит настолько быстро, что пузырьки водорода образуются вокруг цезия, поднимаются на поверхность, которая затем подвергает цезий воде, вызывая дальнейшую экзотермическую реакцию, таким образом, воспламеняя газообразный водород. Этот цикл повторяется до тех пор, пока весь цезий не будет исчерпан.
4. Глюконат кальция
Глюконат кальция обычно используется для лечения дефицита кальция. Однако когда он нагревается, это вызывает огромное расширение молекулярной структуры. В результате образуется пена, похожая на серую змею, вызванная испарением воды и дегидратацией гидроксильных групп в соединении.В менее научных терминах при нагревании глюконат кальция быстро разлагается. Реакция следующая:
2C 12 H 22 CaO 14 + O 2 → 22H 2 O + 21C + 2CaO + 3CO 2
5. Трийодид азота
Вы можете сделать это соединение дома, но имейте в виду, что это очень опасно. Соединение образуется в результате осторожной реакции йода и аммиака. После сушки исходных компонентов образуется NI3, который является очень реакционноспособным соединением.Простое прикосновение пера вызовет взрывоопасный контакт.
6. Дихромат аммония
Когда дихромат аммония зажигается, он разлагается экзотермически, образуя искры, пепел, пар и азот.
7. Перекись водорода и йодид калия
Когда перекись водорода и йодид калия смешаны в надлежащих пропорциях, перекись водорода разлагается очень быстро. Мыло часто добавляют к этой реакции, чтобы в результате создать пенистое вещество.Мыльная вода задерживает кислород, продукт реакции, и создает много пузырьков.
8. Хлорат калия и конфеты
липких медведей по сути просто сахароза. Когда липкие медведи попадают в хлорат калия, он вступает в реакцию с молекулой глюкозы в сахарозе, что приводит к сильно экзотермической реакции горения.
9. Реакция Белоусова-Жаботинского (БЖ)
Реакция BZ образуется путем осторожного сочетания брома и кислоты.Реакция является ярким примером неравновесной термодинамики, которая приводит к ярким химическим колебаниям, которые вы видите на видео выше.
10. Оксид азота и сероуглерод
Часто называемая реакцией «лающей собаки», это химическая реакция в результате воспламенения сероуглерода и закиси азота. Реакция производит яркую голубую вспышку и явный громкий звук. Реагенты в реакции быстро разлагаются в процессе сгорания.
11. Сплав NaK и вода
Сплав
NaK представляет собой металлический сплав, образованный смешением натрия и калия вне воздуха – обычно в керосине. Это чрезвычайно реактивное разрешение может реагировать с воздухом, но происходит еще более сильная реакция, когда он вступает в контакт с водой.
12. Термит и Лед
Вы когда-нибудь думали, что смешивание огня и льда может привести к буму?
СВЯЗАННЫЕ: 11 ЛУЧШИХ ХИМИЧЕСКИХ КАНАЛОВ НА YOUTUBE
Это то, что происходит, когда вы получаете небольшую помощь от Thermite, который представляет собой смесь алюминиевого порошка и оксида металла.Когда эта смесь зажигается, происходит экзотермическая реакция окисления-восстановления, то есть химическая реакция, в которой энергия выделяется в форме электронов, которые переходят между двумя веществами. Таким образом, когда термит помещают поверх льда и поджигают с помощью пламени, лед сразу же загорается и выделяется большое количество тепла в виде взрыва. Нет какой-либо сильной научной теории о том, почему термит вызывает взрыв. Но из демонстрационного видео ясно видно одно – не пытайтесь делать это дома.
13. Осциллирующие часы Бриггса-Раушера
Реакция Бриггса-Раушера является одной из немногих колебательных химических реакций. Реакция производит визуально ошеломляющие эффекты, изменяя цвет раствора. Для инициирования реакции три бесцветных раствора смешивают вместе. Полученный раствор будет циклически изменяться, изменяя цвет с прозрачного на янтарный несколько раз в течение 3-5 минут и заканчивая темно-синим. Для этого наблюдения необходимы три раствора: разбавленная смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленная смесь малоновой кислоты (HOOOCCH 2 COOH), моногидрата сульфата марганца (MnSO 4 .Н 2 О) и витексный крахмал и, наконец, разбавленный пероксид водорода (Н 2 О 2 ).
14. Supercool Water
Вы не можете заморозить окрестности, как это сделала Эльза в фильме «Замороженные», но вы, безусловно, можете заморозить воду одним прикосновением к этому классному научному эксперименту. Эксперимент по охлаждению очень холодной водой заключается в охлаждении очищенной воды до -24 ° C (-11 ° F). После охлаждения бутылку можно медленно вынимать и постукивать снизу или по бокам, чтобы начать процесс кристаллизации.Поскольку очищенная вода не содержит примесей, молекулы воды не имеют ядра, образующего твердые кристаллы. Внешняя энергия, обеспечиваемая в форме крана или удара, приведет к тому, что молекулы переохлажденной воды образуют твердые кристаллы в результате зародышеобразования и начнут цепную реакцию, чтобы кристаллизовать воду во всей бутылке.
15. Феррожидкость
Феррофлюид состоит из наноразмерных ферромагнитных частиц, взвешенных в жидкости-носителе, таком как органический растворитель или вода.Первоначально обнаруженный Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов управления жидкостями в космосе, феррожидкости при воздействии сильных магнитных полей будут создавать впечатляющие формы и структуры. Эти жидкости могут быть получены путем объединения пропорций соли Fe (II) и соли Fe (III) в основном растворе с образованием валентного оксида (Fe 3 O 4 ).
16. Гигантский пузырь сухого льда
Сухой лед – это всегда забавное вещество для различных экспериментов.Если вам удастся найти сухой лед, попробуйте этот эксперимент, чтобы создать гигантский пузырь, используя простые материалы. Возьмите миску и наполните ее наполовину водой. Сбрызните жидкое мыло водой и размешайте. Смочите края чаши пальцами и добавьте в раствор сухой лед. Опустите полоску ткани в мыльную воду и протяните ее по всему краю чаши. Подождите немного, чтобы пары сухого льда попали в пузырь, который начнет постепенно расширяться.
17. Змея Фараона
Змея фараона – простая демонстрация фейерверка.Когда тиоцианат ртути зажигается, он разлагается на три продукта, и каждый из них снова распадается на еще три вещества. Результатом этой реакции является растущий змееподобный столб, выделяющий пепел и дым. Хотя все соединения ртути токсичны, лучший способ выполнить этот эксперимент – в вытяжном шкафу. Существует также серьезный риск возникновения пожара. Однако самое простое решение – это посмотреть видео, если у вас нет доступа к материалам.
18.Эффект Мейснера
Охлаждение сверхпроводника ниже его переходной температуры сделает его диамагнитным. Это эффект, при котором объект будет отталкиваться от магнитного поля, а не притягиваться к нему. Эффект Мейснера также привел к концепции транспортировки без трения, когда объект можно поднимать по дорожке, а не прикреплять к колесам. Этот эффект, однако, также может быть воспроизведен в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит вместе с жидким азотом.Охладите сверхпроводник жидким азотом и поместите магнит сверху, чтобы наблюдать левитацию.
19. Сверхтекучий гелий
Охлаждающий гелий для достижения его лямбда-точки (-271 ° C) сделает его сверхтекучим и известен как гелий II. Эта сверхтекучая жидкость образует тонкую пленку внутри контейнера и поднимается против силы тяжести, чтобы найти более теплую область. Тонкая пленка толщиной около 30 нм имеет капиллярные силы, превышающие силу тяжести, которая удерживает жидкость в контейнере.
,PPT – Metallization PowerPoint Presentation, free download
Metallization ECE / ChE 4752: Лаборатория обработки микроэлектроники Gary S. 26 февраля 2004 г.
План • Введение • Физическое осаждение паров • Химическое осаждение паров • Алюминий Металлизация • Металлизация меди
Основы • Цель: сформировать соединения с низким сопротивлением • Типы: • Физическое осаждение из паровой фазы (PVD) – испарение или распыление • Химическое осаждение из паровой фазы (CVD) – включает химическую реакцию
Использует • Ворота MOS • Контакты • Межсоединение
Требования • Однородность и конформное покрытие • Высокая проводимость • Высокая надежность
Контур • Введение • Физическое осаждение паров • Химическое осаждение паров • Металлизация алюминия • Металлизация алюминия
Основы • Также называется «испарение» • Цель: испарение металла; конденсация на поверхности пластины • Процедура: • Преобразование металла из твердой в паровую фазу (расплав + испарение или прямая сублимация) • Транспортировка газообразного материала на подложку • Конденсация газообразного материала на подложке
Испарительное оборудование • Условия: • Высокая температура • Низкое давление (10-6 – 10-7 торр)
Достижение низкого давления • Испарительная камера должна быть «откачана», где: P (t) = давление в камере в момент времени t, P0 = начальное давление, S = скорость откачки, Q = скорость дегазации, V = объем камеры • Насосный аппарат имеет 2 ступени: 1) черновой насос: атм -> 10-3 торр 2) диффузионный насос: 10-3 -> 10-6 торр
Кинетическая теория газа • Закон идеального газа: PV = NavkT, где: k = постоянная Больцмана, Nav = число Авогадро (6.02 x 1023 молекул / моль), P = давление, V = объем, T = температура • Концентрация молекул газа, определяемая как: n = Nav / V = P / kT
Скорость осаждения • Скорость попадания молекул газа ударная поверхность: где: P = давление (Н / м2), M = молекулярная масса (г / моль), T = температура (oK) • Время формирования одного монослоя t = Ns / F, где: Ns = # молекул / см2 в молекулы слоя / см2-с
Геометрическое изменение • Скорость осаждения имеет радиальную зависимость: где: D0 = скорость осаждения в центре пластины
Поверхностная биометрия • Используется для измерения толщины осажденной пленки • Точность = 2 Å
Ограничения испарения 1.Низкая температура плавления Al 2. Трудно достичь очень большой или маленькой толщины (типичный диапазон = 0,05 – 5 мм) • Альтернатива = распыление • Преимущества: • Лучшее покрытие ступеней • Меньшее радиационное повреждение, чем у электронного луча • Лучше при получении слоев соединения материалы
Распыление • Источник ионов ускоряется к цели и падает на ее поверхность
Контур • Введение • Физическое осаждение паров • Химическое осаждение паров • Металлизация алюминия • Металлизация меди
Преимущества • Конформные покрытия • Хорошее покрытие ступеней • Может покрывать большое количество пластин за раз • Пленки с более низким удельным электрическим сопротивлением, чем PVD • Позволяет осаждать тугоплавкий металл (например, W)
Базовая настройка
План • Введение • Физическое осаждение паров • Химическое осаждение паров • Металлизация алюминия • Медь Металлизация
Свойства • Может наноситься методом PVD или CVD • Al и его сплавы имеют низкое удельное сопротивление (2.7 мВт-см для алюминия и до 3,5 мВт-см для сплавов) • Хорошо прилипает к диоксиду кремния • Использование с мелкими соединениями может создать проблемы, такие как всплески или электромиграция
Характеристики эвтектики • Добавление любого компонента снижает Температура плавления системы Al-Si ниже, чем у любого металла (660 ° C для Al и 1412 ° C для Si). • Температура эвтектики (577 ° C) соответствует 11,3% Al и 88,7% Si. • Температура осаждения Al должна быть не более 577 ° C.
Растворимость Al в Si • Si растворяется в Al во время отжига • По истечении времени t Si диффундирует на расстояние (Dt) 0.5 вдоль линии Al от края контакта. • Глубина, на которую расходуется Si, определяемая как: r = плотность, S = растворимость Si и A = ZL
Пик спайк • Растворение Si происходит в только несколько точек, где образуются пики • Один из способов минимизации пиков – это добавление Si в Al путем совместного испарения. Другой метод заключается во введении барьерного металла (такого как TiN) между Al и Si.
Электромиграция • Высокие плотности тока могут вызывать перенос массы в металлах. • Возникает при передаче импульса от электронов к положительным ионам металла. Ионы металлов в некоторых регионах накапливаются, а в других областях образуются пустоты. • Накапливание может привести к короткому замыканию соседних проводников, тогда как пустоты могут привести к обрыву цепи. • плотность (Дж) и энергия активации • Экспериментально Ea = 0.5 эВ для алюминия • Электромиграционное сопротивление Al может быть увеличено путем легирования Cu (например, A1 с 0,5% Cu), герметизации проводника в диэлектрике или включения кислорода во время осаждения.
Краткое описание • Введение • Физическое осаждение паров • Химическое осаждение паров • Металлизация алюминия • Металлизация меди •
Мотивация • Для снижения временной задержки RC межсоединения требуются проводка с высокой проводимостью и диэлектрик-постоянные изоляторы ,• Медь имеет более высокую проводимость и устойчивость к электромиграции, чем Al. • Cu может быть нанесен PVD или CVD, • Недостатки: • Cu имеет тенденцию к коррозии при стандартных условиях обработки • Не поддается сухому травлению • Плохая адгезия к SiO2
Damascene Technology • Траншеи для металлических линий, определенных и травленных в межслойный диэлектрик (ILD) • Осаждение металла из TaN / Cu (TaN служит диффузионным барьером для предотвращения проникновения Cu в диэлектрик) • Избыток Cu на поверхности удаляется для получения плоской структуры.
Графическое представление
Химико-механическая полировка • Позволяет глобальное выравнивание по большим и малым конструкциям • Преимущества: • Снижение плотности дефектов • Отсутствие повреждения плазмы • Состоит из движущейся поверхности образца против прокладки, которая несет пульпу между поверхность образца и накладка.
Химическая реакция , процесс, в котором одно или несколько веществ, реагенты, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов, создавая различные вещества в качестве продуктов.
Жжение в огне. Сжигание древесины является примером химической реакции, при которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу. © chrispecoraro / iStock.comОсновные вопросы
Каковы основы химических реакций?
- Химическая реакция – это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты. Вещества – это либо химические элементы, либо соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в качестве продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воде и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разорваны, и атомы или части молекул собираются в продукты путем образования новых связей.Энергия поглощается, чтобы разрушить связи, и энергия развивается по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и в результате получается поглощение энергии. Следовательно, различные типы связей могут образовываться в реакции. Кислотно-щелочная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая обеспечивает электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару.Аммиак является примером базы Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и осаждения. Многие реакции дают газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы.Повышение теста для кекса вызвано газообразующей реакцией между кислотой и пищевой содой (гидрокарбонат натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов из восстановителя в окислитель. Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, а также удаления и добавления. Цепные реакции и реакции фотолиза являются примерами классификации по реакционному механизму, который дает подробные сведения о том, как атомы перемешиваются и повторно собираются при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и даже самой жизни. Сжигание топлива, выплавка чугуна, производство стекла и глиняной посуды, пивоварение, производство вина и сыра являются одними из многих примеров деятельности, включающей химические реакции, которые были известны и использовались в течение тысячелетий. Химические реакции имеются в большом количестве в геологии Земли, в атмосфере и океанах, а также во множестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений.Физические изменения включают изменения состояния, такие как таяние льда в воде и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Неважно, в каком физическом состоянии находится вода (H 2 O), это одно и то же соединение, каждая молекула состоит из двух атомов водорода и одного атома кислорода. Однако, если вода, такая как лед, жидкость или пар, сталкивается с металлическим натрием (Na), атомы будут перераспределены, чтобы дать новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH).Этим мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции восходит около 250 лет. Он возник в ранних экспериментах, которые классифицировали вещества как элементы и соединения и в теориях, которые объясняли эти процессы. Разработка концепции химической реакции сыграла главную роль в определении науки о химии, как это известно сегодня.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской.Подпишитесь сегодняПервые предметные исследования в этой области были по газам. Идентификация кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священнослужителем Джозефом Пристли имела особое значение. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметно в том, что его понимание подтвердило важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» – вещества, не разбиваемые на более простые сущности.Среди многих своих открытий Лавуазье точно измерил вес, полученный при окислении элементов, и приписал результат объединению элемента с кислородом. Концепция химических реакций, включающих комбинацию элементов, явно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие теории атома.За это большая заслуга английского химика Джона Далтона, который постулировал свою атомную теорию в начале 19-го века. Далтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны, и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, включая закон сохранения вещества (вещество не создано и не разрушено) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций. Сегодня экспериментальная химия предоставляет бесчисленное множество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
При изготовлении нового вещества из других веществ химики говорят, что они либо проводят синтез, либо синтезируют новый материал. Реактивы превращаются в продукты, и процесс обозначается химическим уравнением.Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS). Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Состояние вещества реагентов и продуктов обозначается символом (ами) для твердых веществ, (l) для жидкостей и (g) для газов.
,Метан , бесцветный газ без запаха, который в изобилии встречается в природе и является продуктом определенных видов деятельности человека. Метан является самым простым представителем парафиновых углеводородов и является одним из самых мощных парниковых газов. Его химическая формула CH 4 .
цикл метана Encyclopædia Britannica, Inc.Британика Викторина
Ветер и воздух: факт или вымысел?
Суперячейка – это очень большая батарея.
Химические свойства метана
Метан легче воздуха и имеет удельный вес 0,554. Это только немного растворим в воде. Он легко горит в воздухе, образуя углекислый газ и водяной пар; пламя бледное, слегка светящееся и очень горячее. Температура кипения метана составляет -162 ° C (-259,6 ° F), а температура плавления составляет -182,5 ° C (-296,5 ° F). Метан в целом очень стабилен, но смеси метана и воздуха с содержанием метана от 5 до 14 процентов по объему являются взрывоопасными.Взрывы таких смесей были частыми в угольных шахтах и угольных шахтах и были причиной многих горных бедствий.
структура метана Тетраэдрическая структура метана (CH 4 ) объясняется в теории молекулярной формы VSEPR (отталкивание валентная оболочка-электронная пара), предполагая, что четыре пары связывающих электронов (представлены серыми облаками) ) принять позиции, которые сводят к минимуму их взаимное отталкивание. Encyclopædia Britannica, Inc.Источники метана
В природе метан образуется в результате анаэробного бактериального разложения растительного вещества под водой (где его иногда называют болотным газом или болотным газом).Водно-болотные угодья являются основным природным источником метана, получаемого таким способом. Другими важными природными источниками метана являются термиты (в результате процессов пищеварения), вулканы, жерла на дне океана и отложения гидрата метана, которые происходят вдоль континентальных окраин и под антарктическим льдом и арктической вечной мерзлотой. Метан также является основным компонентом природного газа, который содержит от 50 до 90 процентов метана (в зависимости от источника) и встречается в качестве компонента пламенного огня (горючего газа) вдоль угольных пластов.
химическая структура метана Тетраэдрическая геометрия метана: (A) модель «палка и шар» и (B) диаграмма, показывающая углы связи и расстояния. (Простые связи представляют собой связи в плоскости изображения; клиновые и пунктирные связи представляют собой связи, направленные к зрителю и от него, соответственно.) Encyclopædia Britannica, Inc.Добыча и сжигание природного газа и угля являются основной антропогенной. (связанные с человеком) источники метана. Такие действия, как добыча и переработка природного газа и разрушительная перегонка битуминозного угля при производстве угольного газа и коксового газа, приводят к выбросу значительных количеств метана в атмосферу.Другие виды деятельности человека, связанные с производством метана, включают сжигание биомассы, животноводство и утилизацию отходов (где бактерии производят метан, когда они разлагают шлам на установках по переработке отходов и разлагают вещество на свалках).
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняИспользование метана
Метан является важным источником водорода и некоторых органических химических веществ. Метан реагирует с паром при высоких температурах с образованием оксида углерода и водорода; последний используется при производстве аммиака для удобрений и взрывчатых веществ.Другие ценные химические вещества, полученные из метана, включают метанол, хлороформ, четыреххлористый углерод и нитрометан. Неполное сгорание метана приводит к образованию сажи, которая широко используется в качестве армирующего агента в резине, используемой для автомобильных шин.
Роль в качестве парникового газа
Метан, который производится и выбрасывается в атмосферу, поглощается поглотителями метана, которые включают почву и процесс окисления метана в тропосфере (самая низкая атмосферная область).Большая часть производимого метана компенсируется его поглощением в естественные стоки. Антропогенное производство метана, однако, может привести к увеличению концентрации метана быстрее, чем они компенсируются поглотителями. С 2007 года концентрации метана в атмосфере Земли увеличились на 6,8–10 частей на миллиард (млрд-1) в год. К 2020 году атмосферный метан достиг 1873,5 млрд-1, что примерно в два-три раза выше, чем доиндустриальные уровни, которые колебались на уровне 600–700 млрд-1.
Повышенные концентрации метана в атмосфере способствуют парниковому эффекту, в результате которого парниковые газы (особенно углекислый газ, метан и водяные пары) поглощают инфракрасное излучение (чистую тепловую энергию) и возвращают его обратно на поверхность Земли, потенциально задерживая тепло и производя тепло существенные изменения климата.Увеличение содержания метана в атмосфере также косвенно увеличивает парниковый эффект. Например, при окислении метана гидроксильные радикалы (OH – ) удаляют метан, реагируя с ним с образованием углекислого газа и водяного пара, а по мере увеличения концентрации атмосферного метана концентрации гидроксильных радикалов уменьшаются, что эффективно продлевает атмосферное время жизни метана ,
Editors of Encyclopaedia Britannica Эта статья была недавно отредактирована и обновлена редактором John P. Rafferty.Узнайте больше в этих связанных статьях Britannica:
глобальное потепление: Метан
Метан (CH 4 ) является вторым по важности парниковым газом. CH 4 является более мощным, чем CO 2 , потому что радиационное воздействие, производимое на молекулу, больше.Кроме того, инфракрасное окно менее насыщено в диапазоне длин волн излучения, поглощаемого CH 4 , поэтому больше…
парниковый газ: Метан
Метан (CH 4 ) является вторым по важности парниковым газом.CH 4 является более мощным, чем CO 2 , потому что радиационное воздействие, производимое на молекулу, больше. Кроме того, инфракрасное окно менее насыщено в диапазоне длин волн излучения, поглощаемого CH 4 , поэтому больше…
климат: климат и жизнь
… пар, диоксид углерода, монооксид углерода, метан, озон, диоксид азота, азотная кислота, ионы аммиака и аммония, закись азота, диоксид серы, сероводород, карбонилсульфид, диметилсульфид и сложный комплекс неметановых углеводородов.Из них

