Железо кристаллическая решетка: Металловедение и термообработка
alexxlab | 31.05.2023 | 0 | Разное
Металловедение (Гуляев А. П.)
Металловедение (Гуляев А. П.)
ОглавлениеПРЕДИСЛОВИЕ ТЕОРИЯ СПЛАВОВ ТЕОРИЯ СПЛАВОВГлава I. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ 2. Классификация металлов 3. Кристаллическое строение металлов 4. Кристаллические решетки металлов 5. Реальное строение металлических кристаллов 6. Анизотропия свойств кристаллов 7. Методы изучения строения металлов Глава II. КРИСТАЛЛИЗАЦИЯ 1. Три состояния вещества 2. Энергетические условия процесса кристаллизации 3. Механизм процесса кристаллизации 4. Форма кристаллических образований 5. Строение слитка 6. Превращения в твердом состояние. Полиморфизм 7. Магнитные превращения 8. Закалка из жидкого состояния. Аморфное состояние Глава III. МЕХАНИЧЕСКИЕ СВОЙСТВА. НАКЛЕП И РЕКРИСТАЛЛИЗАЦИЯ 2. Упругая и пластическая деформация. Несовершенства решетки и прочность металлов 3. Сверхпластичность 4. Разрушение 5. Методы определения механических свойств 6. Наклеп 7. Влияние нагрева на строение и свойства деформированного металла (рекристаллизационные процессы) Глава IV. 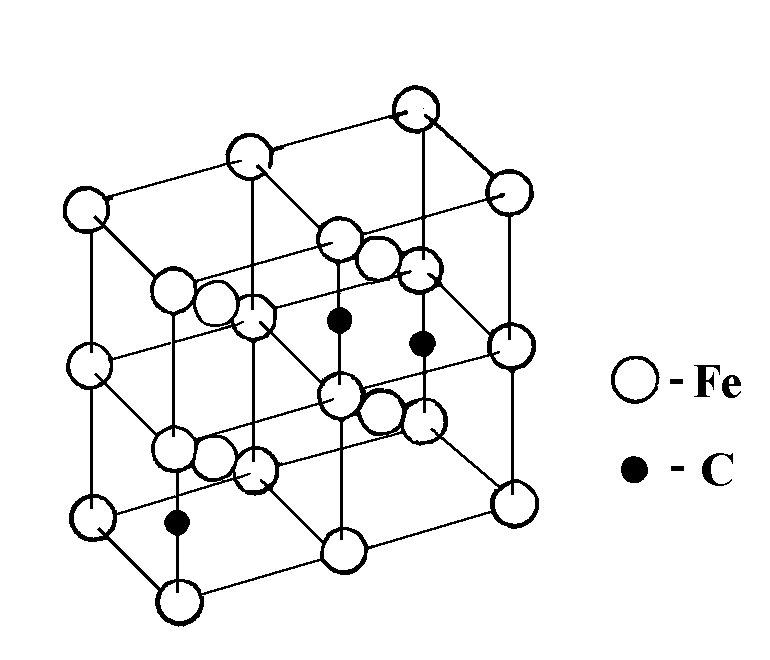 СТРОЕНИЕ СПЛАВОВ СТРОЕНИЕ СПЛАВОВ2. Химическое соединение 3. Твердый раствор на основе одного из компонентов сплава 4. Твердый раствор на основе химического соединения 5. Упорядоченные твердые растворы 6. Электронные соединения (фазы Юм-Розери) 7. Фазы Лавеса 8. Фазы внедрения Глава V. ДИАГРАММА СОСТОЯНИЯ 2. Общие замечания о построении диаграмм состояния 3. Экспериментальное построение диаграмм 4. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода) 5. Правило отрезков 6. Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (II рода) 7. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода) 8. Диаграмма состояния для сплавов, образующих химические соединения (IV рода) 10. Кристаллизация сплавов в неравновесных условиях 11. Системы с тремя компонентами 12.  Упрощенные методы изучения многокомпонентных систем Упрощенные методы изучения многокомпонентных систем13. Связь между свойствами сплавов и типом диаграммы состояния Часть вторая. ЖЕЛЕЗОУГЛЕРОДИСТЫЕ СПЛАВЫ Глава VI. ДИАГРАММА ЖЕЛЕЗО—УГЛЕРОД 2. Железо 3. Цементит 4. Диаграмма состояния Глава VII. УГЛЕРОДИСТЫЕ СТАЛИ 1. Влияние углерода на свойства стали 2. Влияние постоянных примесей на свойства стали 3. Сталь различных способов производства. Чистая сталь 4. Углеродистая сталь общего назначения 5. Нагартованная сталь 6. Листовая сталь для холодной штамповки 7. Обрабатываемость резанием. Автоматные стали Глава VIII. ЧУГУН 2. Структура чугуна. Формы графита 3. Структура и свойства чугуна 4. Примеси в чугуне 5. Марки серых и высокопрочных чугунов 6. Ковкий чугун Часть третья. ТЕРМИЧЕСКАЯ ОБРАБОТКА Глава IX. ОБЩИЕ ПОЛОЖЕНИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ 2. Классификация видов термической обработки 3. Термическая обработка и диаграмма состояния 4 Основные виды термической обработки стали 5.  Четыре основных превращения в стали Четыре основных превращения в сталиГлава X. ТЕОРИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ 2. Рост аустенитного зерна 3. Распад аустенита 4. Мартенситное превращение 5. Бейнитное превращение 6. Превращения при отпуске 7. Влияние термической обработки на свойства стали 8. Термомеханическая обработка Глава XI. ПРАКТИКА ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ 2. Время нагрева 3. Химическое воздействие нагревающей среды 4. Закалочные среды 5. Прокаливаемость 6. Внутренние напряжения 8. Обработка стали холодом 9. Дефекты, возникающие при закалке 10. Отжиг и нормализация Глава XII. ПОВЕРХНОСТНАЯ ЗАКАЛКА СТАЛИ 2. Высокочастотная закалка Глава XIII. ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА СТАЛИ 2. Цементация стали 3. Азотирование стали 4. Цианирование стали 5. Диффузионная металлизация Часть четвертая. ЛЕГИРОВАННЫЕ СТАЛИ И СПЛАВЫ Глава XIV. ВЛИЯНИЕ ЛЕГИРУЮЩИХ ЭЛЕМЕНТОВ 2. Влияние элементов на полиморфизм железа 3. 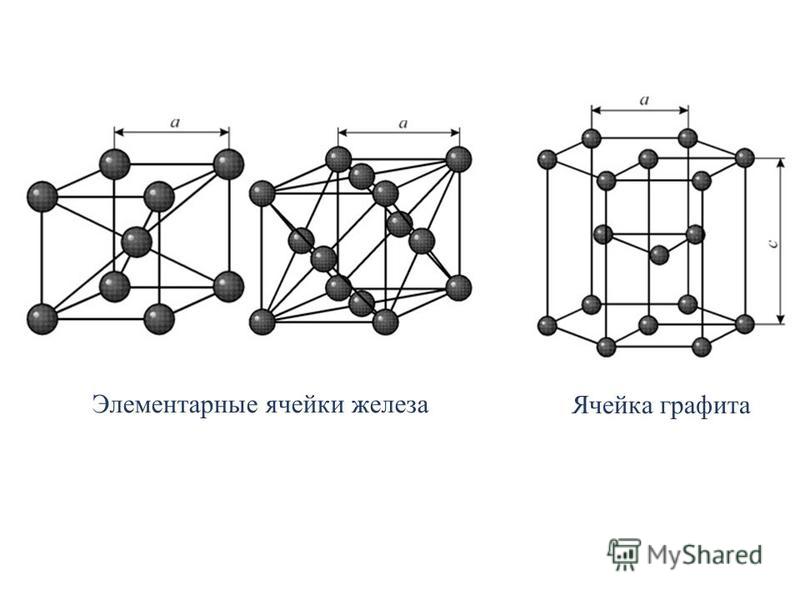 Распределение легирующих элементов в стали Распределение легирующих элементов в стали4. Влияние легирующих элементов на феррит 5. Карбидная фаза в легированных сталях 6. Влияние легирующих элементов на превращения в стали Глава XV. КЛАССИФИКАЦИЯ И МАРКИРОВКА ЛЕГИРОВАННЫХ СТАЛЕЙ 2. Маркировка легированных сталей Глава XVI. КОНСТРУКЦИОННЫЕ СТАЛИ 1. Механические свойства стали, влияние структуры и легирующих элементов 2. Термическая обработка конструкционных сталей 3. Цементуемые (низкоуглеродистые) стали 4. Улучшаемые (среднеуглеродистые) стали 5. Высокопрочные стали 6. Свариваемость стали 7. Строительная сталь 8. Арматурная сталь 9. Пружинная сталь 10. Шарикоподшипниковая сталь 11. Дефекты легированных сталей Глава XVII. ИНСТРУМЕНТАЛЬНЫЕ СТАЛИ 2. Инструментальные стали пониженной прокаливаемости 3. Инструментальные стали повышенной прокаливаемости (легированные инструментальные стали) 4. Быстрорежущие стали 5. Штамповые стали 6. Твердые сплавы Глава XVIII.  ЖАРОСТОЙКИЕ И ЖАРОПРОЧНЫЕ СТАЛИ И СПЛАВЫ ЖАРОСТОЙКИЕ И ЖАРОПРОЧНЫЕ СТАЛИ И СПЛАВЫ2. Жаропрочность 3. Оценка жаропрочных свойств 4. Влияние структуры и состава на жаропрочность 5. Классификация жаропрочных материалов 6. Перлитные и мартенситные жаропрочные стали 7. Аустенитные жаропрочные стали Глава XIX. КОРРОЗИОННОСТОЙКИЕ (НЕРЖАВЕЮЩИЕ) СТАЛИ И СПЛАВЫ 2. Хромоникелевые нержавеющие стали 3. Кислотостойкие стали и сплавы 4. Криогенные стали и сплавы Глава XX. ИЗНОСОСТОЙКИЕ СТАЛИ И СПЛАВЫ 2. Графитизированная сталь 3. Высокомарганцовистая сталь 4. Наплавочные материалы Глава XXI. ТИТАН И ЕГО СПЛАВЫ 2. Легирование титана 3. Фазовые превращения в титановых сплавах 5. Термическая обработка титановых сплавов 6. Примеси в титановых сплавах 7. Коррозионная стойкость титана Глава XXII. ТУГОПЛАВКИЕ МЕТАЛЛЫ 2. Взаимодействие тугоплавких металлов с другими элементами и между собой 3. Механические свойства и жаропрочность 4.  Хладноломкость тугоплавких металлов Хладноломкость тугоплавких металлов5. Сопротивление окислению и защита от окисления 6. Коррозионная стойкость Глава XXIII. СПЛАВЫ С ОСОБЫМИ ТЕПЛОВЫМИ И УПРУГИМИ СВОЙСТВАМИ 2. Сплавы с постоянным модулем упругости Глава XXIV. МАГНИТНЫЕ СТАЛИ И СПЛАВЫ 2. Стали и сплавы для постоянных магнитов (магнитнотвердые сплавы) 3. Магнитномягкие сплавы 4. Немагнитные стали 5. Электротехнические сплавы Глава XXV. СПЛАВЫ АТОМНОЙ ЭНЕРГЕТИКИ 2. Конструкционные материалы. Теплоносители 3. Ядерное горючее (уран, плутоний, торий) Часть пятая. Цветные металлы и сплавы Глава XXVI. ЛЕГКИЕ МЕТАЛЛЫ И ИХ СПЛАВЫ 1. Свойства алюминия 2. Постоянные примеси алюминия (железо и кремний) 3. Термическая обработка сплавов Al-Cu 4. Влияние состава алюминиевых сплавов на процессы, происходящие при термической обработке 5. Классификация алюминиевых сплавов 6. Деформируемые сплавы, не упрочняемые термической обработкой 7. Дюралюминий и другие деформируемые сплавы, упрочняемые термической обработкой 8.  9. Силумины и другие алюминиевые сплавы для фасонного литья 10. Жаропрочные алюминиевые сплавы 11. Магний 12. Сплавы магния 13. Бериллий 14. Сплавы бериллия Глава XXVII. МЕДЬ И ЕЕ СПЛАВЫ 2. Сплавы меди с цинком (латуни) 3. Сплавы меди с оловом (оловянистые бронзы) 4. Сплавы меди с алюминием, кремнием, бериллием и другими элементами ГЛАВА XXVIII. ПОДШИПНИКОВЫЕ СПЛАВЫ И ПРИПОИ 2. Легкоплавкие подшипниковые сплавы (баббиты) 3. Припои 4. Легкоплавкие сплавы Глава XXIX. НЕКОТОРЫЕ СПЛАВЫ ЦВЕТНЫХ МЕТАЛЛОВ 2. Типографские сплавы 3. Благородные металлы |
14) Виды кристаллической решетки железа. Основные виды микроструктуры железоуглеродистых сплавов. Внешний вид микроструктуры различных сталей.
Сталь – железоуглеродистый сплав, содержащий 0,02-2,14% углерода.
Чугун-
железоуглеродистый сплав, содержащий
от 2,14-6,67% углерода.
Основное представление структуры железоуглеродистых сплавов- сталей и чугунов дает диаграмма состояния железоуглерода.
Так как на практике применяются сплавы металлические с содержанием углерода до 5%, то рассматривается часть диаграммы до химического соединения- цементита, содержащего 6,67% углерода.
Железо переходной металл серебристо-светлого цвета, tпл=1539 градусов. Если >911 градусов, то альфажелезо имеет ГЦК. При t=768 градусов железо феромагнитно, а выше-аромагнитно.(Точка Кюри) обозначается А2. Ψ=80%
Железо со многими элементами образует растворы. С металлами- раствор замещения , а с азотом, углеродом, вадародом- растворы внедрения. В сплавах железа и углерода углерод находится в состоянии тв. раствора, а железо в виде химического раствора-цементита(Ц-C). Цементит имеет высокую твердость-800НВ, и черезвычайно низкую пластичность, вещество не устойчивое и при определенных условиях распадается.
Феррид(Ф)-
твердый раствор углерода в альфажелезе. Свойства Ф соответствует свойствам
железа.
Свойства Ф соответствует свойствам
железа.
Аустенит(А)- твердый раствор углерода в гамажелезе. Углерод занимает место в центре ГЦК решетки. А имеет 200-250НВ и пластичен на 40-50%.
Цементит бывает в нескольких фазах Ц1- первичный; Ц2-вторичный; Ц3- третичный.
Ц1-выделяется из жидкой вазы в виде крупных пластичных кристалов.
Ц2- выделяется из аустенита и распологается в виде сетки вокруг его зерен. Ц3- выделяется из феррита и рапологется в виде мелких включений, распологаемых на границе ферритных зерен.
Чугуны обладают боле высокай литейными свойствами,малой способностью к пластической деформации не имеет и не имеет свойство свариваться.
Различают: белы, серы, половинчатый, высокопрочный, ковкий.
Примеси в чугуне: углерод и кремний способствует графитизации а марганец её затрудняет, сера отбеливает, но уменьшает литейные свойств, фосфор – улучшает жидкотекучесть.
Графит
– различной формы более благоприятная
хлопьевидная форома, а оптимальная
шароподобная, от формы зависит
пластичность.
Влияни элементов на свойства стали. Условное обозначение и марки стали. Положителдьные стороны наличия графита в чугуне.
Графит улучшает обработку резанием. Чугун имеет лучшие антифрикционные свойства (скольжения) по сравнению со сталью. Из-за микропустот, заполенных графитом, чугун хорошо гасит вибрации и имеет повышеную циклическую вязкость. Детали из чугунов нечувствительны к внешним концентраторам напряжений. Чугун значитльено дешевле стали, дешевле производство литья.
Серый чугун. Структура не оказывает вляние на плстичность, она сотаёться чрезвычайно низко, хорошо обрабатываеться и обладает хорошим свойствами.
Применяются для изготовление блоков цилиндра , поршневых коле, распред валов, дисколвсцпления, зубчатых колёс.
Высокопрочный чугун. ГОСТ 7293. Получают из серый чугунов в результате модифированнием магния или цезия(0.03-0.07%). Имеет высокие показатели прочсноти, при меньшем значение пластичности.
Ковкий
чугун. Получают отпайкой белого
доэфтектического чугуна. Отливки из
белоого чугуна удерживает при темпретаруе
150-1000С в течении 15 часов печи. Происходит
рахзложение цементита. Fe3C→
Feα(C)+C
КЧ. Имеет fмарок.Гост
12-15.
Получают отпайкой белого
доэфтектического чугуна. Отливки из
белоого чугуна удерживает при темпретаруе
150-1000С в течении 15 часов печи. Происходит
рахзложение цементита. Fe3C→
Feα(C)+C
КЧ. Имеет fмарок.Гост
12-15.
По механическим свойствам КЧ занимает среднее положение между СЧ и сталью. Недостаток КЧ в сравнение с ВЧ. Ограничение для толщины стенок для отливки и отжига. Применяется в изготовлениии деталей работ при удрных и овибрационных нагрузок. Вилки карданных валов, звенье и ролики цепи, тормозные колодки.
Отбеленные и другие чугуны. Отбеленный отливки поверхность осстоит из белого чугуна а внутри СЧ или ВЧ. Отличается пониженныхсодрежание кремния(0.5-0.8%). Имеет высокую поверхностную твёрдость 950 HB и высокую износотсойкость используются: для вагонных колёс. Для работы в условиях износа, при высоких температурах. Обладает коррозионной стойкости.
7.4: Железо и сталь – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 183335
- Химия 310
- Penn State University via Wikibook
Еще одно очень важное место, где важна разница между твердостью ОЦК и плотно упакованного металла, — это производство стали. При температуре от комнатной до 912 o C железо имеет структуру ОЦК и является прочным твердым металлом («твердым, как гвоздь»). Выше 912 o C чистое железо переходит в ГЦК (аустенитную) структуру, которая гораздо более пластична. Таким образом, горячее железо можно согнуть и придать ему различные формы, когда оно очень горячее, но все еще твердое (оно плавится при температуре 1535°С).0032 или С). Быстрая закалка горячего железа, например, когда кузнец погружает раскаленный кусок прямо в холодную воду, охлаждает его до комнатной температуры, но не дает времени для фазового перехода ГЦК -> ОЦК; следовательно, такие детали все еще относительно податливы и им можно придать форму.
При температуре от комнатной до 912 o C железо имеет структуру ОЦК и является прочным твердым металлом («твердым, как гвоздь»). Выше 912 o C чистое железо переходит в ГЦК (аустенитную) структуру, которая гораздо более пластична. Таким образом, горячее железо можно согнуть и придать ему различные формы, когда оно очень горячее, но все еще твердое (оно плавится при температуре 1535°С).0032 или С). Быстрая закалка горячего железа, например, когда кузнец погружает раскаленный кусок прямо в холодную воду, охлаждает его до комнатной температуры, но не дает времени для фазового перехода ГЦК -> ОЦК; следовательно, такие детали все еще относительно податливы и им можно придать форму.
Фазовая диаграмма железо–карбид железа (Fe–Fe 3 C). Ниже 912 °C чистое железо существует в виде альфа-фазы, феррита, имеющего структуру ОЦК. Между 912 и 1394 °C чистое железо существует в виде гамма-фазы, аустенита, имеющего ГЦК-структуру. |
Углерод добавляется (около 1% по весу) к железу для получения «углеродистой стали», которая является очень твердым материалом. Углерод достаточно растворим в ГЦК фазе железа, но не в ОЦК фазе. Следовательно, когда пластичная фаза ГЦК охлаждается и превращается в ОЦК («отпуск» стали, что означает ее достаточно медленное охлаждение, чтобы могло произойти преобразование ГЦК в ОЦК), железо больше не может растворять избыток углерода. Углерод образует слои или зерна дополнительной фазы Fe 9.0046 3 C (“цементит” – очень твердый материал), которые располагаются слоями или точечно по всей матрице зерен ОЦК железа. Эффект всех этих маленьких зерен Fe 3 C заключается в том, чтобы остановить движение дислокаций, делая материал более твердым, но (с более высоким содержанием углерода) все более хрупким. Вот почему ножи и мечи закаливаются из фазы FCC, холодной обработкой придают соответствующую форму, а затем снова нагреваются и закаляются (перед заточкой) при изготовлении. Изделия из чугуна (сковороды, радиаторы и т. д.) имеют более высокое содержание углерода и поэтому очень прочны, но имеют тенденцию к разрушению, а не к изгибу из-за большей доли хрупкого Fe 9.0046 3 С-фаза в сплаве.
Вот почему ножи и мечи закаливаются из фазы FCC, холодной обработкой придают соответствующую форму, а затем снова нагреваются и закаляются (перед заточкой) при изготовлении. Изделия из чугуна (сковороды, радиаторы и т. д.) имеют более высокое содержание углерода и поэтому очень прочны, но имеют тенденцию к разрушению, а не к изгибу из-за большей доли хрупкого Fe 9.0046 3 С-фаза в сплаве.
При охлаждении фаза высокоуглеродистой стали разделяется на смесь микроскопических зерен ОЦК-железа (светло-серый) и Fe3C (темно-серый). |
Эта страница под названием 7.4: Железо и сталь распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Chemistry 310 (Wikibook) с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами. платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Химия 310 Студенты
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- source@https://en.wikibooks.org/wiki/Introduction_to_Inorganic_Chemistry
Фазы железо-углерод | Металлургия для чайников
Влияние температуры на кристаллическую структуру
Кристаллическая структура стали изменяется при повышении температуры. Для чистого железа это изменение происходит при 910°C. Объемно-центрированные кубические (ОЦК) кристаллы на рис. 2 превращаются в гранецентрированные кубические (ГЦК) кристаллы, как показано на рис. 3. В ГЦК-кристаллах атомы железа находятся на кубе. углах и в центрах каждой грани куба. Позиция центрирования тела пуста.
Для чистого железа это изменение происходит при 910°C. Объемно-центрированные кубические (ОЦК) кристаллы на рис. 2 превращаются в гранецентрированные кубические (ГЦК) кристаллы, как показано на рис. 3. В ГЦК-кристаллах атомы железа находятся на кубе. углах и в центрах каждой грани куба. Позиция центрирования тела пуста.
Заданное количество атомов занимает несколько меньший объем при расположении в виде ГЦК-кристаллов, чем при расположении в виде ОЦК-кристаллов. Таким образом, изменение кристаллической структуры сопровождается изменением объема. Это изменение показано на рис. 4. Когда кусок чистого железа нагревается, расширение происходит обычным образом до температуры 9достигается 10°С. При этой температуре происходит ступенчатое сжатие примерно на ½% по объему, связанное с переходом от ОЦК к ГЦК кристаллической структуре. Дальнейшее нагревание приводит к дальнейшему тепловому расширению до тех пор, пока примерно при 1400°С структура ГЦК не вернется к ОЦК-форме и не произойдет ступенчатое расширение, которое восстанавливает объем, потерянный при 910°С. Нагрев выше 1400°C приводит к тепловому расширению, пока не произойдет плавление при 1540°C. Кривая обратима при медленном охлаждении.
Нагрев выше 1400°C приводит к тепловому расширению, пока не произойдет плавление при 1540°C. Кривая обратима при медленном охлаждении.
Свойство металлов иметь различную кристаллическую структуру в зависимости от температуры называется аллотропией.
Раствор углерода в кристаллах ОЦК и ГЦК
Когда атомы двух материалов А и В имеют примерно одинаковый размер, могут образовываться кристаллические структуры, в которых ряд атомов А заменен атомами В. Такой раствор называется замещающим, потому что один атом замещает другой. Например, никель в стали.
Когда атомы двух материалов имеют разный размер, меньший атом может поместиться между большими атомами. Такой раствор называется интерстициальным. Самый известный пример — раствор углерода в железе. Таким образом, высокотемпературные ГЦК-кристаллы могут содержать до 2% углерода в твердом растворе при 1130°С, тогда как в низкотемпературных ОЦК-кристаллах максимальное количество углерода, которое может удерживаться в растворе, составляет 0,02% при 723°С. и примерно 0,002% при температуре окружающей среды.
и примерно 0,002% при температуре окружающей среды.
Так, например, сталь, содержащая 0,5% углерода, может растворить весь углерод в более высокотемпературных ГЦК-кристаллах, но при охлаждении не может сохранить весь углерод в растворе в ОЦК-кристаллах. Избыток углерода реагирует с железом с образованием карбида железа (Fe3C), обычно называемого цементитом. Цементит твердый и хрупкий по сравнению с чистым железом.
Количество цементита и распределение частиц цементита в микроструктуре имеет важное значение для технических свойств стали.
Номенклатура
Металлурги используют следующую номенклатуру:
- Феррит или a-Fe ОЦК форма железа, в которой может быть растворено до 0,02% C по массе.
- Цементит Карбид железа Fe3C (содержащий около 6,67%C).
- ПерлитЛаминарная смесь феррита и цементита, описанная выше.
 Общее содержание углерода в смеси составляет 0,8% по массе.
Общее содержание углерода в смеси составляет 0,8% по массе. - Аустенит или g-Fe ГЦК-форма железа, которая существует при высоких температурах и может содержать примерно до 2% C по массе.
- SteelAlloys, содержащие менее 2% углерода по массе.
- Чугунные сплавы, содержащие более 2% углерода по весу.
Сталь, используемая в таких конструкциях, как мосты, здания и корабли, обычно содержит от 0,1% до 0,25% углерода по весу.
Фазовая диаграмма железо-углерод
Фазовая диаграмма железо-углерод по существу является картой. Наиболее важная часть показана на рис. 5. Более подробная информация представлена на рис. 6.
Любая точка в поле диаграммы представляет собой сталь с определенным содержанием углерода при определенной температуре. Диаграмма разделена на области, показывающие структуры, устойчивые при определенных составах и температурах. Диаграмму можно использовать для рассмотрения того, что происходит, когда сталь с 0,5% С охлаждают от 1000°С (рис. 6). При 1000 °С структура представляет собой аустенит, т. е. поликристаллические ГЦК-кристаллы, в которых весь углерод растворен. Никаких изменений не происходит при охлаждении до тех пор, пока температура не достигнет примерно 800°С. При этой температуре происходит пересечение границы из поля, обозначенного как аустенит (г), в поле, обозначенное как феррит + аустенит (а + г), т.е. из ГЦК-железа начинают формироваться кристаллы ОЦК-железа, содержащие очень мало углерода. Поскольку феррит содержит так мало углерода, оставшийся углерод должен концентрироваться в остаточном аустените. Содержание углерода в аустените и относительные пропорции феррита и аустенита в микроструктуре регулируются сами по себе, чтобы сохранить первоначальное общее содержание углерода.
Диаграмму можно использовать для рассмотрения того, что происходит, когда сталь с 0,5% С охлаждают от 1000°С (рис. 6). При 1000 °С структура представляет собой аустенит, т. е. поликристаллические ГЦК-кристаллы, в которых весь углерод растворен. Никаких изменений не происходит при охлаждении до тех пор, пока температура не достигнет примерно 800°С. При этой температуре происходит пересечение границы из поля, обозначенного как аустенит (г), в поле, обозначенное как феррит + аустенит (а + г), т.е. из ГЦК-железа начинают формироваться кристаллы ОЦК-железа, содержащие очень мало углерода. Поскольку феррит содержит так мало углерода, оставшийся углерод должен концентрироваться в остаточном аустените. Содержание углерода в аустените и относительные пропорции феррита и аустенита в микроструктуре регулируются сами по себе, чтобы сохранить первоначальное общее содержание углерода.
Эти количества можно рассчитать, рассмотрев расширенную часть диаграммы железо-углерод, показанную на рисунке 7. Представьте, что сталь охладилась до 750°C. Сочетание общего содержания углерода и температуры представлено точкой X.
Представьте, что сталь охладилась до 750°C. Сочетание общего содержания углерода и температуры представлено точкой X.
Все составляющие микроструктуры имеют одинаковую температуру. Линия постоянной температуры может быть проведена через X. Она пересекает границы поля аустенита и феррита в точках F и A. Эти точки пересечения дают содержание углерода в феррите и аустените соответственно при определенной температуре. Если теперь представить линию FA в виде жесткой балки, которая может вращаться вокруг точки опоры в точке X, то «вес» аустенита, висящего в точке A, должен уравновесить «вес» феррита, висящего в точке F.
Это так называемое правило рычага: 90 158. Масса феррита ´ FX = Масса аустенита ´ AX
Отношение феррита к аустениту в микроструктуре определяется как:
Таким образом, по мере охлаждения стали увеличивается доля феррита и увеличивается содержание углерода в оставшемся аустените, пока температура охлаждения не достигнет 723°С. При этой температуре содержание углерода в аустените составляет 0,8% и больше его брать нельзя. Охлаждение чуть ниже этой температуры вызывает разложение аустенита. Он распадается на пластинчатую смесь феррита и Fe3C, идентифицированную ранее как перлит.
При этой температуре содержание углерода в аустените составляет 0,8% и больше его брать нельзя. Охлаждение чуть ниже этой температуры вызывает разложение аустенита. Он распадается на пластинчатую смесь феррита и Fe3C, идентифицированную ранее как перлит.
Доли феррита и перлита в микроструктуре, скажем, при 722°С, практически такие же, как доли феррита и аустенита непосредственно перед распадом при 723°С.
Таким образом, обращаясь к рисунку 7 и используя правило рычага:
Вес феррита ´ F¢ X¢ = вес перлита ´ F¢ P
При этом перлита должно быть примерно в два раза больше, чем феррита.
Для других сталей, содержащих менее 0,8%С, объяснение идентично, за исключением долей перлита в микроструктуре ниже 723°С. Это изменяется примерно линейно с содержанием углерода от нуля при 0,02%C до 100% при 0,8%C. Типичная мягкая сталь с содержанием углерода 0,2% будет содержать около 25% перлита.
Типичная мягкая сталь с содержанием углерода 0,2% будет содержать около 25% перлита.
Для сталей, содержащих более 0,8% углерода, структура полностью аустенитная при охлаждении от высоких температур. Первым изменением является образование частиц Fe3C из аустенита. Это изменение снижает содержание углерода в остаточном аустените. При дальнейшем охлаждении содержание углерода в аустените следует линии границы между полем g и полем g + Fe3C. Вновь при достижении 723°С содержание углерода в аустените составляет 0,8%. При дальнейшем охлаждении он по-прежнему распадается на перлит. Следовательно, окончательная микроструктура состоит из нескольких частиц Fe3C, внедренных в массу перлита.
Вам также может понравиться
Глоссарий по металлургии Глоссарий металлургии
Деятельность: Функция. |


 Углерод более растворим в ГЦК-фазе, занимающей область «γ» на фазовой диаграмме, чем в ОЦК-фазе. Процент углерода определяет тип сплава железа, который образуется при охлаждении из фазы ГЦК или из жидкого железа: альфа-железо, углеродистая сталь (перлит) или чугун.
Углерод более растворим в ГЦК-фазе, занимающей область «γ» на фазовой диаграмме, чем в ОЦК-фазе. Процент углерода определяет тип сплава железа, который образуется при охлаждении из фазы ГЦК или из жидкого железа: альфа-железо, углеродистая сталь (перлит) или чугун. Общее содержание углерода в смеси составляет 0,8% по массе.
Общее содержание углерода в смеси составляет 0,8% по массе.