Жидкий углекислый газ: Углекислота жидкая , СО2, двуокись углерода, диоксид углерода
alexxlab | 16.02.1989 | 1 | Разное
Диоксид углерода (углекислый газ жидкий, углерода диоксид охлажденный жидкий, углекислота жидкая, угольный ангидрид, пищевая добавка Е-290) – малоопасное вещество по воздействию на организм при соблюдении правил обращения, вызывает обморожение тканей, при испарении действует наркотически и удушающее. Обладает раздражающим действием на кожу и глаза. При снижении давления до атмосферного превращается в газ и снег с температурой минус 78,5 0С, который вызывает обморожение кожи и поражение слизистой оболочки глаз, а также может вызывать явление кислородной недостаточности и удушья, действует наркотически. Растворимость в воде – слабая. Негорюч, невзрывоопасен, нетоксичен. Газообразный диоксид углерода в 1,5 раза тяжелее воздуха. По физико-химическим показателям диоксид углерода пищевой соответствует требованиям ТУ-2114-051-05761695-2008 (с извещениями № 1-6):
Область примененияДиоксид углерода пищевой предназначен для использования в пищевых целях: в производстве газированных напитков, сухого льда, для охлаждения, замораживания и хранения пищевых продуктов при прямом и косвенном контакте с ними. Процессы производства (изготовления), хранения, маркировки, перевозки (транспортировки), реализации и утилизации пищевой добавки соответствуют требованиям, установленным в Техническом регламенте Таможенного Союза ТР ТС 029/2012 «Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств» (принят Решением Совета Евразийской экономической комиссии от 20.07.2012 № 58)». Химические и физические свойстваХимически инертен. С сильным основанием реагирует, образуя карбонаты. При высокой температуре реагирует сильно с электроположительными металлами, отдавая полностью или частично свой кислород. При температуре красного каления двуокись углерода с кальцием даёт карбид и окись кальция; реагируя с аммиаком, даёт мочевину; при высокой температуре окисляет железо, кремний и сурьму. При 200ºС в присутствии окиси меди реагирует с водородом. Хороший избирательный растворитель большинства ароматических веществ, не растворяет соли, сахара, аминокислоты, пептиды. Реакции между диоксидом углерода и другими соединениями могут происходить только при высоких температурах и в присутствии катализатора. Токсичность и опасностьДиоксид углерода пищевой является негорючим, не поддерживающим горение и не взрывоопасным веществом. Диоксид углерода (газообразный) в полтора раза тяжелее воздуха, поэтому может скапливаться в низких участках поверхности, подвалах, приямках, тоннелях, во внутренних объемах оборудования. При воздействии на кожу наблюдается покраснение, появляется чувство покалывания, пощипывания и тепла в ней, отделение пота. Возможно обморожение. Нельзя медленно и постепенно согревать отмороженные участки кожи холодной водой, так как это вызывает дальнейшее интенсивное охлаждение пораженных внешним холодом участков. Чрезмерно горячая вода может вызвать ожог отмороженных участков, температурная чувствительность которых в период тканевой гипотермии понижена или утрачена вовсе. Вследствие сублимации сжиженной углекислоты, при внезапной разгерметизации емкости от разрушения, может произойти физический взрыв большой мощности. Баллоны (ёмкости) с диоксидом углерода могут взрываться при нагревании и сильных ударах. Нахождение в природеДвуокись углерода является компонентом атмосферного воздуха (0,03 % (об.)). Также является продуктом жизнедеятельности многих почвенных и водных микроорганизмов и высших животных, необходимым сырьём для процесса фотосинтеза растений. Диоксид углерода не оказывает вредного воздействия на воздух, почву и воду, хотя в глобальном масштабе, большое количество диоксид углерода, поступающее в атмосферу от промышленных центров и предприятий вызывает общее потепление климата (так называемый «парниковый эффект»). Диоксид углерода из атмосферы отводится в результате выветривания, а возвращается в неё при вулканических извержениях и выделениях из воды минеральных источников. Методы получения на производствеСущность процесса производства диоксид углерода пищевого заключается в охлаждении сжатого до давления конденсации газообразной двуокиси углерода, получающейся из отбросных газов производства водорода. В зависимости от назначения и применения выпускают диоксид углерода пищевой двух видов: – высокого давления от 3 554 до 7 383 кПа при температуре от 0 до 31,05ºС; – низкотемпературную – от 3 554 до 528,0 кПа при температуре от 0 до минус 56,5ºС Диоксид углерода пищевой – бесцветная жидкость без запаха. Перевозка и хранениеДиоксид углерода пищевой высокого давления в баллонах и баллончиках для бытовых сифонов хранят в специальных складских помещениях или на открытых огражденных площадках под навесом, защищающим баллоны от атмосферных осадков и прямых солнечных лучей. Жидкий низкотемпературный диоксид углерода пищевой хранят в накопительных изотермических емкостях (цистернах). Гарантийный срок хранения– в баллончиках для бытовых сифонов – (по ГОСТ 19136) – 1 год со дня изготовления продукта; – в цистернах – 6 месяцев со дня изготовления. Сертификат соответствия ГОСТ Сертификат соответствия производства и отгрузки диоксида углерода пищевого требованиям FSSC 22000:2011 (ISO 22000+ISO/TS 22002-1) Просмотреть прайс-лист |
Углекислота | Linde Gas Россия
Для удовлетворения всего разнообразия ваших потребностей в двуокиси углерода мы поставляем его в газообразном, жидком и твердом виде (сухой лед).
Purities:
– CO2 3. 0. (purity ≥ 99,9%)
0. (purity ≥ 99,9%)
– Food Grade CO2 – BIOGON C (purity ≥ 99,9%)
CO2 – Supply modes:
– CO2 cylinders and bundles
CO2 gas from Linde can be supplied in gas bottles and cylinders of various sizes to suit your needs. Sizes:
– Liquid CO2
Liquid carbon dioxide is delivered to our customers in liquid form, into onsite storage, for use in high-volume customer applications. Carbon dioxide is stored as a liquid in specialized vessels which can provide several days’ supply and be used on demand as either a liquid or gas.
Наиболее распространенные области применения CO2
-
пищевая промышленность
охлаждение и замораживание пищевых продуктов, газирование и розлив напитков, экстракция пищевых продуктов, упаковка в модифицированной газовой среде
-
сварка
дуговая сварка мягких сталей плавящимся электродом в инертном газе (MIG), сварка углеродистой и легированной стали, прменение в качестве защитного газа при плазменной резке
-
водоподготовка
подготовка воды питьевого качества и pH-контроль сточных вод
-
химическая промышленность
заменитель хлорфторуглеродов при производстве вспененных пластиков
-
повышение урожайности теплиц и борьба с вредителями
Объем баллона/моноблока, л | Кол-во газа в баллоне, кг | Код продукта |
20 | 12 | 1403041200 |
40 | 19 | 1403041900 |
40 | 24 | 1403042400 |
40х12 | 288 | 1403042412 |
50х12 | 432 | 1403053612 |
Спецификация
Наименование показателей | Двуокись углерода жидкая и газообразная ГОСТ |
|
| 1 сорт | 2 сорт |
Объемная доля двуокиси углерода, % не менее | 99,5 | 99,0 |
Наличие минеральных масел и механических примесей | Должна выдерживать испытания | |
Массовая концентрация водяных паров, г/м3 не более | 0,076 | 0,184 |
Температура насыщения углеводорода водяными парами, °С, не выше | -42 | -34 |
Массовая концентрация сернистого ангидрида (SO2), г/м3, не более | 0,004 | 0,005 |
Диоксид углерода
- Без цвета и запаха.
 Может вызывать жжение в носу при больших концентрациях
Может вызывать жжение в носу при больших концентрациях - токсичен при большой концентрации, вызывает удушье
- вызывает коррозию при наличии влаги
- тяжелее воздуха, углекислый газ собирается в низинах, тоннелях
- имеет высокую растворимость в воде при различных давлениях
Примеры применения
- для MIG-сварки конструкционных сталей, для сварки углеродистой стали и легированной стали и нержавеющей стали с использованием сварочной проволоки, в качестве защитного газа при плазменной резке и жидкости для охлаждения подложки чтобы контролировать нагрев при термальном и плазменном распылении
- в машиностроении для дуговой электросварки
- в металлургии для продувки литейных форм при производстве алюминия и других легкоокисляющихся металлов
- в сельском хозяйстве для создания искусственного дождя
- при изготовлении противопожарных средств
Для клиентов с большими объемами потребления углекислоты «Линде Газ Рус» предлагает поставки сжиженного газа в сосудах Дьюара и криоцистернах
Свяжитесь с нами
Где используется углекислый газ — сферы применения
Автор статьи Лебедев Юрий Агафонович
Дата публикации:
16. 11.2021
11.2021
Дата обновления:
15.09.2022
Заместитель директора
Работает в отрасли c 1999 г.
Газовые смеси и чистые газы применяют для проведения реакций, обработки материалов и поверхностей, с их помощью получают химические соединения, которых нет в естественной среде. Разнообразные газы дают возможность получать некоторые физические явления. Широкое применение в производстве и быту находит углекислый газ. Узнайте, зачем и где применяют углекислый газ (двуокись углерода), какие процессы и технологии он поддерживает в промышленности, в том числе пищевой, какими свойствами обладает, для чего нужна углекислота.
Содержание статьи
- Что такое углекислый газ
- Свойства углекислого газа
- Получение углекислого газа
- Природные источники углекислого газа
- Лабораторные способы получения
- Промышленные способы получения
- Получение газообразной двуокиси углерода
- Получение жидкой углекислоты
- Получение твердого диоксида углерода
- Применение углекислого газа
- Химическая промышленность
- Металлургия
- Производство бумаги
- Углекислый газ: хранение и транспортировка
Что такое углекислый газ
Прежде чем говорить о том, где используют углекислый газ, рассмотрим, чем он является. Это тяжелый, то есть плотный газ. Он плотнее атмосферного воздуха примерно на 50%. Хотя при −78,3 °С вещество представляет собой «снег», при нормальном давлении СО2 в виде жидкости не получить. «Снег» при более высокой температуре и нормальном давлении становится газом.
Это тяжелый, то есть плотный газ. Он плотнее атмосферного воздуха примерно на 50%. Хотя при −78,3 °С вещество представляет собой «снег», при нормальном давлении СО2 в виде жидкости не получить. «Снег» при более высокой температуре и нормальном давлении становится газом.
Углекислота не окисляется, не способствует горению ряда металлов. Но она может поддерживать горение магния, бария, кальция. СО2 растворятся в воде, высоко его содержание в воздухе.
При растворении двуокиси углерода в воде получают угольную кислоту, способную взаимодействовать, например, с фенолом, щелочами. Результатом взаимодействия могут стать соли и эфиры.
Свойства углекислого газа
Распознать вещество на вид и запах невозможно. При невысокой концентрации эти характеристики не ощутимы, при высокой — ощутим кисловатый вкус, возможно отравление. Симптомы отравления углекислотой:
- Шум в ушах, голове.
- Потеря сознания, концентрации.
- Холодный пот в большом количестве.

Одно из качеств углекислоты — высокая плотность. Поскольку плотность СО2 выше, чем у воздуха, ближе к полу комнаты его больше, чем под потолком. Вот почему животные и дети чаще страдают от отравления веществом в равных со взрослыми условиях. Пребывание в помещении с высокой концентрацией диоксида углерода может завершиться гибелью человека. Теряя сознание, обычно он падает, вниз, где кислорода еще меньше.
Получение углекислого газа
В промышленности вещество получают различными способами. Самые рентабельные из них относятся к получению СО2 как отходов на химпроизводствах. Извлеченные формы вещества различны. Это и газ, и сухой лед, и вода.
Природные источники углекислого газа
СО2 производят живые организмы. Он образуется при распаде органических веществ, полученных в естественной среде, а также при брожении. СО2 выбрасывают и вулканы. Он выделяет при сжигании топливных материалов.
Лабораторные способы получения
Высококачественный СО2 — это результат брожения содержащих спирт жидкостей. Полученный таким способом газ обрабатывают реагентами, чтобы сформировать диоксид углерода в форме воды.
Полученный таким способом газ обрабатывают реагентами, чтобы сформировать диоксид углерода в форме воды.
В лабораторных условиях извлекается незначительная часть СО2. В ходе реакций с участием гидрокарбонатов, кислот. Углекислота — побочный продукт реакций на производственных установках для извлечения кислорода, азота. СО2 хранят на предприятиях в баллонах, как и на складах. В них же вещество транспортируют.
Промышленные способы получения
- Обработка промышленного дыма.
- Обработка спирт содержащей продукции.
- Продукт взаимодействия веществ с карбонатами.
Дым получают от ТЭЦ и электростанций. Его пропускают через моноэтаноламин, чтобы отсоединить углекислоту от промышленных отходов. В специальных емкостях моноэтаноламин очищают, результатом очистки становится СО2. Из алкогольных изделий его получают при их брожении. Карбонаты для реакций синтезирования углекислоты — естественного происхождения, они есть в природной среде.
Получение газообразной двуокиси углерода
CO2 в виде газа — продукт адсорбции моноэтаноламина при работе с промышленным дымом. Из него выделяют углекислоту и очищают ее от примесей, поддерживая необходимые температуру и давление.
Хотите получить консультацию?
Позвоните нам по телефону!+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Получение жидкой углекислоты
Надежный способ получить вещество в жидком виде из твердой формы извлечения — повысить атмосферное давление — установить его на 60 и более атмосфер. При высоком давлении газ СО2 становится жидкостью без цвета.
Получение твердого диоксида углерода
Твёрдый углекислый газ — продукт переработки пивоваренных и ликероводочных изделий. Его получают на производстве так:
- Под действием брожения выделяется и направляется на промывку углекислый газ.
- Под влиянием повышенного давления вещество промывается.

- В охлаждающих установках углекислота охлаждается.
- Полученная жидкость проходит фильтрацию углем.
- В холодильнике СО2 охлаждается и затем подвергается прессованию.
Готовый «сухой лёд» применяют в пищевой промышленности, используют для выращивания растений, в бытовых целях.
Применение углекислого газа
В промышленности и быту области применения углекислого газа многочисленны и разнообразны. Вот где используется углекислота:
- В пищевой промышленности СО2 — добавка-консервант, разрыхлитель теста, компонент напитков, «сухой лед», позволяющий дольше хранить скоропортящиеся продукты.
- В сельском хозяйстве тоже используют СО2 — в теплицах зимой. Им «дышат» растения, для них атмосферу теплиц насыщают углекислотой искусственно.
- В медицине — при проведении операций, для реанимации пациентов, чтобы стимулировать их дыхание.
- В тушении пожаров двуокись углерода тоже задействуется — охлаждается, испаряясь, поэтому ей заполняют огнетушители.
 Она помогает тушить огонь там, где нет возможности использовать эффективно средства тушения в виде пены или порошка.
Она помогает тушить огонь там, где нет возможности использовать эффективно средства тушения в виде пены или порошка. - В быту СО2 — средство борьбы с мышами, крысами, насекомыми, компонент пневматического оружия.
Химическая промышленность
В химической промышленности углекислота используется для:
- синтезирования химических соединений;
- очищения ткани животного или растения;
- регулировки температурного режима;
- нейтрализации щелочи.
Металлургия
Применение углекислоты в производстве металлоизделий актуально, когда сваривают металлы. Газовое облако защищает расплавленную область от поступления активного кислорода. Оно обеспечивает ровность сварного шва, защиту от окисления. В металлургии CO2 используют также для:
- регулировки водоотвода внутри шахт;
- получения лазерного луча, для резки металла;
- отвода вредных веществ-газов в форме осадков.

Производство бумаги
Бумажная промышленность тоже нуждается в СО2. Как используют углекислый газ для производства бумаги? Им регулируют водородный показатель сырья, повышают мощность промышленного оборудования.
Углекислый газ: хранение и транспортировка
Хранят двуокись углерода в черных баллонах, которые непременно подписывают. Также их маркируют. Данные маркировки — производитель, вес тары без продукта, дата крайнего освидетельствования баллона.
Недопустимо использовать тару с углекислотой, если:
- Срок освидетельствования исчерпан.
- Поврежден баллон.
- Вентили не работают корректно.
Перевозить тару с СО2 нужно по регламенту:
- Баллоны следует располагать только горизонтально. Вертикально их размещают лишь при наличии особых ограждений, защищающих тару от падения.
- Тару нужно снабжать резиновыми кольцами при транспортировке.
- Необходимо избегать механических воздействий на емкости, сильного нагревания баллонов.

Также запрещено переносить тару с углекислотой вручную, катить по земле.
Хранят емкости с двуокисью углерода в специально оснащенных помещениях и на улице под навесом. В помещениях располагают баллоны минимум в 1 метре от приборов отопления. Нужно оберегать тару от воздействия прямых солнечных лучей, дождя, снега. Зимой контролируют содержание баллонов при температуре от минус 40 °С и выше.
Теперь вы знаете, каким образом и где используется углекислый газ, как его получают, хранят и перевозят. Если вашему предприятию нужен СО2, вы можете заказать его в баллонах в ООО «ТАНТАЛ-Д». Мы поставляем чистые газы и газовые смеси, строго соблюдая технику безопасности. У нас широкий ассортимент газов, востребованных в различных отраслях промышленности.
Источники:
- https://ru.wikipedia.org/wiki/Диоксид_углерода
- Теплофизические свойства двуокиси углерода. М. П. Вукалович, В. В. Алтунин
- Особенности хранения баллонов со сжиженным газом.
 Ю. Е. Талянкер
Ю. Е. Талянкер
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
Как получают углекислоту в промышленности?
Путем обработки промышленного дыма или спиртосодержащей продукции, а также в качестве продукта взаимодействия веществ с карбонатами.
Где применяют углекислый газ?
В пищевой промышленности, сельском хозяйстве, медицине или в быту, например, в качестве средства для борьбы с грызунами или насекомыми.
Как перевозят баллоны с углекислотой?
Горизонтально или вертикально при наличии особых ограждений, препятствующих падению. Для большей безопасности емкости снабжают резиновыми кольцами.
Как хранить баллоны с углекислым газом?
В оборудованных для этого помещениях или под навесом от солнца.
Если вам понравилась статья, поделитесь ей в социальных сетях
Общая информация о CO2
Запросы и помощь
Как мы можем вам помочь?
Общий вопрос
State
Select stateAlabamaAlaskaArizonaArkansasCaliforniaCanadaColoradoConnecticutDelawareFloridaGeorgiaHawaiiIdahoIllinoisIndianaIowaKansasKentuckyLouisianaMaineMarylandMassachusettsMexicoMichiganMinnesotaMississippiMissouriMontanaNebraskaNevadaNew HampshireNew JerseyNew MexicoNew YorkNorth CarolinaNorth DakotaOhioOklahomaOregonPennsylvaniaRhode IslandSouth CarolinaSouth DakotaTennesseeTexasUtahVermontVirginiaWashingtonWashington D. C.West VirginiaWisconsinWyoming
C.West VirginiaWisconsinWyoming
Информация о товаре
State
Select stateAlabamaAlaskaArizonaArkansasCaliforniaCanadaColoradoConnecticutDelawareFloridaGeorgiaHawaiiIdahoIllinoisIndianaIowaKansasKentuckyLouisianaMaineMarylandMassachusettsMexicoMichiganMinnesotaMississippiMissouriMontanaNebraskaNevadaNew HampshireNew JerseyNew MexicoNew YorkNorth CarolinaNorth DakotaOhioOklahomaOregonPennsylvaniaRhode IslandSouth CarolinaSouth DakotaTennesseeTexasUtahVermontVirginiaWashingtonWashington D.C.West VirginiaWisconsinWyoming
Тех. Поддерживать
State
Select stateAlabamaAlaskaArizonaArkansasCaliforniaCanadaColoradoConnecticutDelawareFloridaGeorgiaHawaiiIdahoIllinoisIndianaIowaKansasKentuckyLouisianaMaineMarylandMassachusettsMexicoMichiganMinnesotaMississippiMissouriMontanaNebraskaNevadaNew HampshireNew JerseyNew MexicoNew YorkNorth CarolinaNorth DakotaOhioOklahomaOregonPennsylvaniaRhode IslandSouth CarolinaSouth DakotaTennesseeTexasUtahVermontVirginiaWashingtonWashington D. C.West VirginiaWisconsinWyoming
C.West VirginiaWisconsinWyoming
ПОИСК ПРОДУКТОВ
КАТЕГОРИЯ
- Категория
Выберите категорию и найдите нужный продукт ASCO
Металл, сплав, коррозияМасло, жиры, битум, топливоХимические веществаКраска/лак/герметик, антиадгезивТекстильПластики (ПУ/ПЭТ и т.д.)Пищевые остатки/напиткиРезиновые остаткиПрочее
Сколько сухого льда нужно производить в час?
< 220 фунтов/ч320-660 фунтов/ч> 660 фунтов/ч
Какой источник CO2 доступен?
Источник производства сухого льда Источник побочных продуктов CO2 Источник дымовых газов Источник CO2 отсутствует
Сухой лед какой формы следует упаковывать?
Гранулы сухого льда/наггетсы Ломтики сухого льда
Сколько сухого льда следует хранить?
ок. 220 фунтов/коробка прибл. 440 фунтов/коробкаприбл. 770 фунтов/коробка
Какое оборудование CO2 вы ищете?
Оборудование для обеспечения безопасности CO2Испаритель CO2Измерение качества CO2
Какую форму сухого льда вы хотите?
Только гранулы/наггетсыТолько блоки Гранулы и блоки
Какую форму сухого льда вы хотите?
Только гранулы/наггетсыТолько блоки Гранулы и блоки
Какую форму сухого льда вы хотите?
Только гранулы/самородкиТолько блокиПеллеты и блоки
Наше предложение для вас:
ASCO DRY ICE PELLETIZER A30P
Read More
+
ASCO DRY ICE REFORMER A700R
Read more
ASCO DRY ICE PELLETIZER A55P
Read More
+
ASCO DRY ICE REFORMER A700R
Read more
ASCO DRY ICE PELLETIZER P15i
Читать Подробнее
+
ASCO Dry Ice Reformer A700R
Подробнее
Asco Dry Ice Pelletizer P28i
Подробнее
+
ASCO Dry Ice Refformer A700R
. 0003
0003
Читать Подробнее
ASCO Dry Ice Pelletizer P450
Читать больше
+
Asco Dry Ice Reformer A700R
Прочтите больше
Asco Dry Peltearizer P75i
.
Подробнее
Атмосферный испаритель CO2 ASCO
Подробнее
ASCO Системы регенерации побочных продуктов CO2 (BPR)
Подробнее
ASCO Тестер карбонизации CO2
Подробнее
Прибор для измерения точки росы CO2 ASCO
Подробнее
Детектор газа CO2 ASCO
Подробнее
Прибор для определения чистоты газа CO2 ASCO
Подробнее
Система регенерации сухого льда 0 RS CO2 ASCO
Подробнее
ASCO Системы регенерации дымовых газов (SGR)
Подробнее
ASCO Установка по производству CO2 (CPS)
Подробнее
ASCO Dry Ice Box AT126
Подробнее
Asco Dry Lead Container AT240W
Читать Подробнее
ASCO Dry Ice Container AT440
Читать больше
ASCO Dry Ice Machin APM 120
Подробнее
ASCO DRY ICE PELLETIZER A30P
Подробнее
ASCO DRY ICE PELLETIZER A55P
Подробнее
ASCO DRY ICE PELLETIZER 95 3
P100008 Читать Подробнее
Asco Dry Ice Pelletizer P28i
Читать Подробнее
ASCO Dry Ice Pelletizer P55I
Читать больше
ASCO Dry Pelletizer P75I
. PBM 500/1000/1500
PBM 500/1000/1500
Подробнее
ASCOJET 1208
Подробнее
ASCOJET 1701
Подробнее
ASCOJET 1709 000309 908 Combi Blaster 908 Blaster0003
ASCOJET 2008 Combi Pro
Подробнее
Углекислый газ представляет собой комбинацию двух атомов кислорода, соединенных с одним атомом углерода. Его химическая формула CO 2 почти так же хорошо известна, как и у воды, H 2 O, и ее часто называют по формуле, а не по имени.
В природной цепи жизни взаимная зависимость растительного и животного мира поддерживается через звено углекислого газа. Каждый раз, когда мы дышим, мы выделяем этот газ, необходимый растениям для жизни. В процессе фотосинтеза растения отделяют углерод от кислорода. В свою очередь, растения выделяют чистый кислород, необходимый нам для выживания. Мы обращаем процесс вспять и, соединяя кислород с углеродом из пищи, которую мы едим, снова производим углекислый газ.
CO 2 — бесцветный инертный газ, приблизительно в 1 ½ раза тяжелее воздуха и 0,03 % присутствует в земной атмосфере. Он не имеет запаха, имеет сладкий резкий вкус (газированная вода) и очень стабилен (трудно отделить).
Он не имеет запаха, имеет сладкий резкий вкус (газированная вода) и очень стабилен (трудно отделить).
Производится в различных количествах в результате обычного процесса сжигания топлива с высоким содержанием углерода. Наиболее распространенным источником топлива для сгорания является масло, которое при смешивании с воздухом в правильной пропорции сгорает с образованием около 15 % CO 2 в дымовых газах установки CO 2 . После сжигания CO 2 можно отделить от дымовых газов и с помощью простого процесса сделать его доступным для многих коммерческих целей, в которых он может применяться.
CO 2 может существовать в трех формах:
– в газообразной форме: для производства напитков и пищевых продуктов
– в жидкой форме: в резервуаре для хранения под давлением
– в твердой форме: называется сухим льдом (для охлаждения, и т.д.)
Газообразный CO 2 может быть сжижен под давлением при условии, что его температура ниже 31 °C (87,8 °F), эта температура называется КРИТИЧЕСКОЙ ТОЧКОЙ.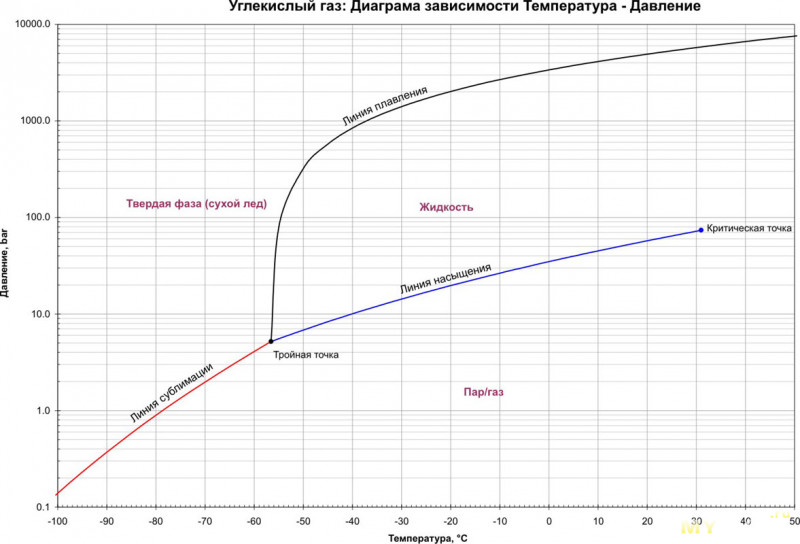 При сжатии и охлаждении ниже критической точки образуется бесцветная жидкость примерно такой же плотности, как вода.
При сжатии и охлаждении ниже критической точки образуется бесцветная жидкость примерно такой же плотности, как вода.
CO 2 останется в жидкой форме, пока его температура остается ниже критической точки, но вернется в газообразное состояние, если его температура поднимется выше этой точки, независимо от приложенного давления.
Жидкий CO 2 может храниться неопределенное время при высоком или низком давлении следующим образом:
CO высокого давления 2
Жидкий CO высокого давления 2 производится путем сжатия газообразного CO 2 в многоступенчатых компрессорах. до давления около 69 бар (1000,76 фунтов на кв. дюйм), а затем охладить его примерно до 18 °C (64,4 °F). Его обычно заливают в специально сконструированные стальные цилиндры. Как и воду, жидкий CO 2 можно взвесить, и это нормальная форма его измерения.
CO низкого давления 2
Жидкость низкого давления является альтернативным методом хранения CO 2 и производится либо путем расширения CO 2 высокого давления до более низкого давления, либо путем охлаждения. Он хранится в специально сконструированных резервуарах для хранения, хорошо изолированных и оснащенных холодильными установками для поддержания внутреннего давления в резервуаре на уровне 21 бар (304,58 фунта на кв. дюйм) или ниже и температуре -18 °C (-0,4 °F). Реле давления встроены для управления холодильными установками и предохранительным механизмом, а электрические аварийные сигналы установлены для сброса давления в резервуаре и подачи сигнала тревоги в случае неисправности системы охлаждения.
Он хранится в специально сконструированных резервуарах для хранения, хорошо изолированных и оснащенных холодильными установками для поддержания внутреннего давления в резервуаре на уровне 21 бар (304,58 фунта на кв. дюйм) или ниже и температуре -18 °C (-0,4 °F). Реле давления встроены для управления холодильными установками и предохранительным механизмом, а электрические аварийные сигналы установлены для сброса давления в резервуаре и подачи сигнала тревоги в случае неисправности системы охлаждения.
Жидкость низкого давления CO 2 (иногда называемая «наливом») транспортируется из одного места в другое в изотермических автоцистернах или трейлерах (или, в некоторых странах, в железнодорожных цистернах), при этом жидкость просто перекачивается из передвижных в статический резервуар насосом или самотеком.
В отличие от воды, углекислый газ не может существовать на открытом воздухе в жидкой форме. Он должен находиться под давлением или в холодильнике (или в сочетании того и другого), чтобы оставаться в жидком состоянии.
Сухой лед является продуктом переработки жидкого CO 2 . Если давление жидкого CO 2 внезапно снизится, часть этой жидкости перейдет в твердое состояние (превратится в сухой лед «снег»), а оставшаяся часть вернется в газообразное состояние (обратный газ). При сжатии снега под действием гидравлического или механического воздействия образуются глыбы или гранулы сухого льда. Возвратный газ (газообразный CO 2 ) может быть легко регенерирован и преобразован обратно в жидкость путем повторного сжатия и повторного сжижения, а затем возвращен в машину для производства блоков сухого льда или в гранулятор для дальнейшей обработки.
Температура сухого льда составляет -79 °C (110,2 °F) и в атмосфере он будет переходить непосредственно из твердого состояния в газообразное, не оставляя никакой влаги или следов своего присутствия, кроме холода.
Много поколений – и отдельных жизней! – опыт усовершенствовал способность ASCO предоставить наиболее полную и наиболее подходящую систему CO 2 .
От завода по производству или регенерации CO 2 до хранения, струйной обработки сухим льдом, наполнения цилиндров, производства сухого льда и даже упаковки сухим льдом — все это ASCO. Эта возможность предоставлять подходящие компоненты приносит пользу клиентам ASCO, поскольку они могут комфортно развивать и расширять свой бизнес, не меняя поставщиков.
Наличие самого большого ассортимента CO 2 и компонентов сухого льда также позволяет клиентам ASCO в полной мере использовать универсальный характер CO 2 и его огромное количество применений, таким образом получая максимальную отдачу от продукта. Например, производитель безалкогольных напитков может легко развить бизнес с дополнительным денежным потоком за счет излишка CO 2 (или избыточной мощности завода), добавив оборудование ASCO для сухого льда и / или оборудование для наполнения баллонов для поставки CO 2 другим пользователям.
Веб-сайт ASCO предоставляет подробную информацию об их самой последней версии CO 9. 0243 2 и установки для производства сухого льда. Все оборудование ASCO компактно, спроектировано так, чтобы его можно было легко обслуживать, и рассчитано на максимальную надежность и срок службы. Компонентные материалы выбираются таким образом, чтобы сбалансировать капитальные затраты и долговечность установки, а от датчика кислорода в дымовых газах на установке до индикатора уровня на резервуаре для хранения CO 2 все элементы управления эффективны, логичны, понятны и связаны с ПЛК.
0243 2 и установки для производства сухого льда. Все оборудование ASCO компактно, спроектировано так, чтобы его можно было легко обслуживать, и рассчитано на максимальную надежность и срок службы. Компонентные материалы выбираются таким образом, чтобы сбалансировать капитальные затраты и долговечность установки, а от датчика кислорода в дымовых газах на установке до индикатора уровня на резервуаре для хранения CO 2 все элементы управления эффективны, логичны, понятны и связаны с ПЛК.
Технология ASCO в сочетании с широким спектром оборудования CO 2 позволяет клиентам легко смешивать и сочетать компоненты и, таким образом, адаптировать свои CO 2 / система сухого льда из одного магазина.
Значительные новые продажи заводов ASCO CO 2 в Африку, Южную Америку и Ближний Восток указывают на то, что многие производители бутылок, пивовары и торговые компании CO 2 предпочитают работать с одним поставщиком, и этим поставщиком является ASCO. Пусть наша жизнь оживит ваш бизнес.
Пусть наша жизнь оживит ваш бизнес.
Углекислый газ находится в трех физических состояниях: газообразном, жидком и твердом, которые зависят от температуры и давления.
Откуда берется CO 2 ?
CO 2 получают из ряда источников, включая сжигание углеродистого топлива, ферментацию, природные колодцы и как побочный продукт промышленных процессов, таких как производство этиленоксида и биоэтанола и синтез аммиака.
Твердое тело (сухой лед):
Ниже тройной точки (5,18 бар, -56,6 °C) (7’512,96 фунтов на кв. дюйм, -69,88 °F) CO 2 может отображаться только в его твердом и газообразном состоянии. Сухой лед — это общепринятое торговое название твердого CO 9 .0243 2 . При атмосферном давлении он имеет температуру ок. -79 °С (-110,2 °F). Твердый CO 2 сразу переходит в газообразное состояние. Это испарение (сублимация) не оставляет никаких остатков. Сухой лед нетоксичен, негорюч, инертен, не имеет запаха и бактериостатичен. Он белого цвета и имеет плотность ок. 1 500 кг/м3 (93,64 фунта/фут3) в компактном состоянии. Сухой лед является идеальным хладагентом, который особенно хорошо подходит для различных применений. Он обладает высокой охлаждающей способностью и очень высокой теплопередачей при прямом контакте с холодным материалом.
Он белого цвета и имеет плотность ок. 1 500 кг/м3 (93,64 фунта/фут3) в компактном состоянии. Сухой лед является идеальным хладагентом, который особенно хорошо подходит для различных применений. Он обладает высокой охлаждающей способностью и очень высокой теплопередачей при прямом контакте с холодным материалом.
ASCO предлагает лучший ассортимент машин для производства сухого льда.
Жидкое состояние:
В диапазоне температур от -56,6 °C (-69,88 °F) до 31 °C (87,8 °F) и давлении от 5,2 бар до 74 бар ( 1’073,28 psi) соответственно CO 2 находится в жидком состоянии, за исключением очень высоких давлений. Это означает, что при давлении ниже 5,2 бар (754,20 фунтов на кв. дюйм) CO 2 существует только в твердом или газообразном состоянии. При 5,2 бар (754,20 фунтов на кв. дюйм) и – 56,6 °C (-69,88 °F) присутствуют все три состояния (твердое, жидкое и газообразное). Это называется тройной точкой.
Критическая точка CO 2 находится при температуре ок. 31 °C (87,8 °F) и давление прибл. 74 бар (1073,28 фунтов на кв. дюйм). Нормальная жидкость CO 2 может образовываться только при температуре ниже 31 °C (87,8 °F). Выше критической точки нет физической разницы между жидкой и газообразной фазами. Это сверхкритическое состояние также называют «жидким». Жидкое состояние важно для хранения и транспортировки CO 2 , а также при охлаждении и заморозке. При выпуске жидкого CO 2 в атмосферу достигается температура -79 °C (-110,2 °F). Это связано с высокой холодопроизводительностью за счет тепла испарения, которое извлекается из окружающей среды при выделении жидкого CO 2 .
31 °C (87,8 °F) и давление прибл. 74 бар (1073,28 фунтов на кв. дюйм). Нормальная жидкость CO 2 может образовываться только при температуре ниже 31 °C (87,8 °F). Выше критической точки нет физической разницы между жидкой и газообразной фазами. Это сверхкритическое состояние также называют «жидким». Жидкое состояние важно для хранения и транспортировки CO 2 , а также при охлаждении и заморозке. При выпуске жидкого CO 2 в атмосферу достигается температура -79 °C (-110,2 °F). Это связано с высокой холодопроизводительностью за счет тепла испарения, которое извлекается из окружающей среды при выделении жидкого CO 2 .
Газообразное состояние:
CO 2 Газ имеет плотность прибл. 1,9 кг/м3 (0,12 фунт/фут3) при атмосферном давлении и +15 °C (+59°F). CO 2 обладает многими уникальными и полезными свойствами, которые делают его ценным при хранении упакованных пищевых продуктов, взрыво- и пожаробезопасности, борьбе с вредителями и в качестве защитного газа при сварке в среде инертного газа. Во всех этих применениях важно, чтобы газ CO 2 вытеснял и замещал атмосферный кислород. Кроме того, газ CO 2 используется для обогащения атмосферы в теплицах, при хранении фруктов и овощей и для контроля pH при очистке питьевой и сточной воды.
Во всех этих применениях важно, чтобы газ CO 2 вытеснял и замещал атмосферный кислород. Кроме того, газ CO 2 используется для обогащения атмосферы в теплицах, при хранении фруктов и овощей и для контроля pH при очистке питьевой и сточной воды.
Производство и утилизация CO2
Производство
CO 2 Производство Установки CPS на основе сжигания ископаемого топлива
Подробнее в полезный и прибыльный источник CO 2
Подробнее
Побочный продукт
CO 2 Технология регенерации газа BPR превращает выбрасываемый побочный газ в прибыльный CO 2
Подробнее
Рекуперация
CO 2 Система рекуперации газа RRS извлекает регенерированный CO 2 газ из производства сухого льда
Жидкая двуокись углерода магматического происхождения и ее роль в вулканических извержениях
- Опубликовано:
- Аллан Р. Чивас 1 ,
- Иван Барнс 2 ,
- Уильям С. Эванс 2 ,
- John E. Lupton 3 & 8
- John E. Lupton 3 & 8
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- .
- . nAff4
Природа том 326 , страницы 587–589 (1987)Цитировать эту статью
230 доступов
68 цитирований
Сведения о показателях
Abstract
Природный жидкий диоксид углерода добывается в промышленных масштабах из скважины глубиной 2,5 км вблизи маарового вулкана возрастом 4500 лет, Маунт-Гамбир, Южная Австралия. Углекислый газ аккумулировался в куполе, расположенном на продолжении линейной цепи вулканической активности. На магматическое происхождение флюида указывают геологические условия, δ 13 C PDB –4,0 ‰, для CO 2 (где PDB представляет стандарт изотопов углерода), и относительно высокое содержание 3 He компонента содержащегося гелия и высокое 3 He/C отношение (6,4 х 10 -10 ). Отношения 3 Не/ 4 Не и Не/Ne в 3,0 и > 1370 раз выше, чем у воздуха, соответственно. CO 2 , собранный на поверхности Земли при 29,5 ° C и 75 бар, расширяется более чем в 300 раз, образуя газ при 1 атм и 22 ° C. Мы предлагаем, чтобы жидкий CO 2 или флюид высокой плотности CO 2 (критическая точка 31,1 °C, 73,9 бар) вулканического происхождения, который эксплозивно расширяется с неглубоких уровней земной коры, может вносить основной вклад в «фреатические» вулканические извержения и мааровые формирование.
Углекислый газ аккумулировался в куполе, расположенном на продолжении линейной цепи вулканической активности. На магматическое происхождение флюида указывают геологические условия, δ 13 C PDB –4,0 ‰, для CO 2 (где PDB представляет стандарт изотопов углерода), и относительно высокое содержание 3 He компонента содержащегося гелия и высокое 3 He/C отношение (6,4 х 10 -10 ). Отношения 3 Не/ 4 Не и Не/Ne в 3,0 и > 1370 раз выше, чем у воздуха, соответственно. CO 2 , собранный на поверхности Земли при 29,5 ° C и 75 бар, расширяется более чем в 300 раз, образуя газ при 1 атм и 22 ° C. Мы предлагаем, чтобы жидкий CO 2 или флюид высокой плотности CO 2 (критическая точка 31,1 °C, 73,9 бар) вулканического происхождения, который эксплозивно расширяется с неглубоких уровней земной коры, может вносить основной вклад в «фреатические» вулканические извержения и мааровые формирование. Менее сильный выброс магматического CO 2 в кратерные озера может вызвать взрывы газа с такими же катастрофическими последствиями, как, например, на озере Ньос, Камерун, в августе 1986 года.
Менее сильный выброс магматического CO 2 в кратерные озера может вызвать взрывы газа с такими же катастрофическими последствиями, как, например, на озере Ньос, Камерун, в августе 1986 года.
0003
Варианты доступа
Подписка на журнал
Получить полный доступ к журналу на 1 год
199,00 €
всего 3,90 € за выпуск
Подписаться
Расчет налогов будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
$32,00
Купить
Все цены указаны без учета стоимости.
Ссылки
Smith, B.W. & Prescott, J. авг. Дж. Науки о Земле. (в печати).
Ollier, CD Bull. вулкан. 31 , 45–73 (1967).
ОБЪЯВЛЕНИЯ Статья Google ученый
Sheard, M.
 J. Trans. Р. Соц. С. Ост. 102 , 125–139 (1978).
J. Trans. Р. Соц. С. Ост. 102 , 125–139 (1978).Google ученый
Блэкберн Г., Эллисон Г. Б. и Лини Ф. В. Дж. Пер. Р. Соц. С. Ост. 106 , 163–167 (1982).
Google ученый
Wopfner, H. & Thornton, RCN in The Otway Basin, Юго-Восточная Австралия (eds Wopfner, H. & Douglas, JG) 377–384 (Spec. Bull. geol. Surveys of South Australia and Victoria, 1971 ).
Google ученый
Герлах, Т. М. и Томас, Д. М. Природа 319 , 480–483 (1986).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Пино Ф., Джавой М. и Боттинга Ю. Планета Земля. науч. лат. 29 , 413–421 (1976).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Мур, Дж.
 Г., Батчелдер, Дж. Н. и Каннингем, К. Г. Дж. Волкан. геотерм. Рез. 2 , 309–327 (1977).
Г., Батчелдер, Дж. Н. и Каннингем, К. Г. Дж. Волкан. геотерм. Рез. 2 , 309–327 (1977).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Эксли, Р. А., Мэтти, Д. П., Клаг, Д. А. и Пиллинджер, К. Т. Планета Земля. Научный латыш. 78 , 189–199 (1986).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Крейг Х. Геохим. космохим. Acta 3 , 53–92 (1953).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Wickman, F. E. Geochim. космохим. Acta 9 , 136–153 (1956).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Соболев Н.В., Ефимова Е.С., Лаврентьев Ю.Г., Соболев В.С. Докл. (Труды) акад. науч. СССР 274 , 148–153 (1985) (пер.
 из ДАН СССР, 19).84.)
из ДАН СССР, 19).84.)Google ученый
Галимов Е.М. Геохим. Междунар. 22 (1), 118–142 (1985).
Google ученый
Des Marais, D.J. в The Carbon Cycle and Atmospheric CO2: Natural Variations Archean to Present (eds Sundquist, ET & Broecker, WS) 602–611 (Geophys. Monogr. 32, Am. Geophys. Union, Washington , 1985).
Google ученый
Каменский И.Л., Лобков В.А., Прасолов Е.М., Бескровный Н.С., Кудрявцева Е.И., Ануфриев Г.С., Павлов В.П. Геохимия. Междунар. 13 (3), 35–48 (1976).
Google ученый
Сано Ю. и Вакита Х. J. geophys. Рез. 90 , 8729–8741 (1985).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Торгерсен, Т.
 , Луптон, Дж. Э., Шеппард, Д. С. и Гиггенбах, В. Ф. J. volcan. геотерм. Рез. 12 , 283–298 (1982).
, Луптон, Дж. Э., Шеппард, Д. С. и Гиггенбах, В. Ф. J. volcan. геотерм. Рез. 12 , 283–298 (1982).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Велхан, Дж. А. и Крейг, Х. в Гидротермальные процессы в центрах распространения на морском дне (редакторы Рона, П.А. и др.) 391–409 (Пленум, Нью-Йорк, 1983).
Книга Google ученый
Ким, К.Р., Велхан, Дж. А. и Крейг, Х. Trans. Являюсь. геофиз. ООН. (Эос) 65 , 973 (1984).
Google ученый
Дейнес, П. в Справочник по изотопной геохимии окружающей среды 1, The Terrestrial Environment , A (под редакцией Fritz, P. & Fontes, JC) 329–406 (Elsevier, Amsterdam, 1980).
Google ученый
Боттинга Ю.
 Геохим космохим. Acta 33 , 49–64 (1969).
Геохим космохим. Acta 33 , 49–64 (1969).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
McKirdy, D. Rep. Aust. шахтер. Дев. лаборатория (AMDEL) F 6433/86 (AMDEL, Аделаида, 1986 г.).
Баэрчи, П. Майнер. петрогр. Рукавица 37 , 73–152 (1957).
КАС Google ученый
Bottinga, Y. J. phys. хим. 72 , 800–808 (1968).
КАС Статья Google ученый
Puchelt, H. в поднятии плато . Рейнский щит — история болезни (изд. Фукс, К., фон Гелен, К., Мельцер, Х., Муравски, Х. и Земмель, А.) 152 (Springer, Berlin, 1983).
Google ученый
Оллиер, К. Д. и Джойс, Э. Б. Проц.
 Р. Соц. Вик. 77 , 357–376 (1964).
Р. Соц. Вик. 77 , 357–376 (1964).Google ученый
Андерсен, Т., О’Рейли, С.Ю. и Гриффин, В.Л. Contr. Шахтер. Домашний питомец. 88 , 72–85 (1984).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Wopfner, H., Kenley, P.R. & Thornton, R.C.N., The Otway Basin, Юго-Восточная Австралия (ред. Wopfner, H. & Douglas, JG) 385–435 (Spec. Bull. Geol. Surveys of South Australia and Victoria, 1971).
Google ученый
Олье, CD в Physical Volcanology (под редакцией Civetta, L., Gasparini, P., Luongo, G. & Rapolla, A.) 289–310 (Elsevier, Amsterdam, 1974).
Книга Google ученый
Лоренц В. в кимберлитах. I: Кимберлиты и родственные породы (изд.
 Kornprobst, J.) 299–307 (Elsevier, Амстердам, 1984).
Kornprobst, J.) 299–307 (Elsevier, Амстердам, 1984).Книга Google ученый
Лоренц, В. Пер. геол. соц. С. Афр. 88 , 459–470 (1985).
Google ученый
Бейли, Д. К. Фил. Транс. Р. Соц. А 297 , 309–322 (1980).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Bailey, DK Trans. геол. соц. С. Афр. 88 , 449–457 (1985).
Google ученый
Cloos, H. Geol. рдш. 32 , 703–800 (1941).
Google ученый
Макдональд, Джорджия Вулканы (Прентис-Холл, Нью-Джерси, 1972).
Google ученый
Мюллер, Г.
 и Вейл, Г. 20-й междунар. геол. конгр. (Мексика) (изд. Гарсия, А.) 1 (2), 375–396 (Editorial Stylo, Мехико, 1957).
и Вейл, Г. 20-й междунар. геол. конгр. (Мексика) (изд. Гарсия, А.) 1 (2), 375–396 (Editorial Stylo, Мехико, 1957).Google ученый
Барнс, И. и Маккой, Г. А. Геология 7 , 434–435 (1979).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Сигурдссон Х., Дивайн Дж. Д., Чуа Ф. М., Прессер Т. С., Прингл М. К. У. и Эванс У. К. Дж. Вулкан. геотерм. Рез. 31 , 1–16 (1987).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Katzoff, J. A. Trans. Являюсь. геофиз. ООН. (Эос) 67 , 689 (1986).
ОБЪЯВЛЕНИЯ Статья Google ученый
Сеть оповещения о научных событиях (SEAN) Bull. 11 , 2–5 (Смитсоновский институт, Вашингтон, 1986).

Freeth, SJ & Kay, RLF Nature 325 , 104–105 (1987).
ОБЪЯВЛЕНИЯ Статья Google ученый
Tuttle, M. L. et al. Геол. Отчет об открытых файлах обзора 87–97 (1987).
Скачать ссылки
Информация об авторе
Примечания автора
Джон О. Стоун
Текущий адрес: Институт Энрико Ферми, Чикагский университет, Чикаго, Иллинойс, 60637, США
Авторы и филиалы
Исследовательская школа наук о Земле, Австралийский национальный университет, G.P.O. Box 4, Canberra, A.C.T., 2601, Австралия
Аллан Р. Чивас и Джон О. Стоун
Отдел водных ресурсов, Геологическая служба США, Менло-Парк, Калифорния, 94025, США
Иван Барнс и Уильям К. Эванс
Институт морских наук и факультет геологических наук Калифорнийского университета, Санта-Барбара, Калифорния, 93106, USA
John E.
 Lupton
Lupton
Авторы
- Allan R. Chivas
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ivan Barnes
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- William C. Evans
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- John E. Lupton
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- John O. Stone
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Взаимодействие глубоких и неглубоких систем подземных вод в районах, затронутых четвертичной тектоникой (Центральная Италия): геохимический и изотопный подход
- Марко Петитта
- Паоло Примавера
- Рамон Аравена
Экологические науки о Земле (2011)
Геохимические свидетельства газовых источников богатых CO2 холодных источников из Удалянчи, Северо-Восточный Китай.

- Сюмэй Мао
- Янсинь Ван
- Сюнь Ван
Журнал наук о Земле (2009)
О потоке флюида CO2 и поведении теплообмена в недрах после утечки из геологического резервуара-хранилища
- Карстен Прюсс
Экологическая геология (2008)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
ДВУОКИСЬ УГЛЕРОДА ОХЛАЖДЕННАЯ ЖИДКОСТЬ | CAMEO Chemicals
Добавить в MyChemicals Версия для печати Страница
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора включают общие идентификационные номера, алмаз NFPA Знаки опасности Министерства транспорта США и общий описание хим. Информация в CAMEO Chemicals поступает из множества источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
| никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| Углекислый газ |
| ||
NFPA 704
нет данных
Общее описание
Бесцветная жидкость. Относительно тяжелее воздуха и может задохнуться от вытеснения воздуха. При длительном воздействии тепла или огня контейнер может сильно разорваться и взорваться. Используется в качестве хладагента и при приготовлении газированных напитков. Используется для замораживания продуктов, контроля химических реакций и в качестве средства пожаротушения.
Относительно тяжелее воздуха и может задохнуться от вытеснения воздуха. При длительном воздействии тепла или огня контейнер может сильно разорваться и взорваться. Используется в качестве хладагента и при приготовлении газированных напитков. Используется для замораживания продуктов, контроля химических реакций и в качестве средства пожаротушения.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
нет
Реакции с воздухом и водой
Растворим в воде. Образует угольную кислоту, слабую кислоту в воде.
Пожароопасность
Выдержка из Руководства ERG 120 [Газы – Инертные (включая охлажденные жидкости)]:
Невоспламеняющиеся газы. Контейнеры могут взорваться при нагревании. Разорванные цилиндры могут взлететь. (ЭРГ, 2020)
Контейнеры могут взорваться при нагревании. Разорванные цилиндры могут взлететь. (ЭРГ, 2020)
Опасность для здоровья
Выдержка из Руководства ERG 120 [Газы – Инертные (включая охлажденные жидкости)]:
Пары могут вызвать головокружение или удушье без предупреждения. Пары сжиженного газа изначально тяжелее воздуха и распространяются по земле. Контакт с газом или сжиженным газом может вызвать ожоги, серьезные травмы и/или обморожение. (ЭРГ, 2020)
Профиль реакционной способности
Пыль магния, лития, калия, натрия, циркония, титана и некоторых магниево-алюминиевых сплавов, а также нагретые алюминий, хром и магний во взвешенном состоянии в двуокиси углерода являются воспламеняющимися и взрывоопасными. Это особенно верно в присутствии сильных окислителей, таких как пероксиды. Наличие двуокиси углерода в растворах гидрида алюминия в эфире может вызвать бурное разложение при нагревании остатка [J. амер. хим. Соц., 1948, 70, 877]. Рассмотрены опасности, возникающие при использовании углекислого газа в системах предотвращения и тушения замкнутых объемов воздуха и горючих паров. Опасность, связанная с его использованием, заключается в том, что могут создаваться сильные электростатические разряды, которые инициируют взрыв [Quart. Саф. Сумм., 1973, 44(1740, 10). Контакт с водой, содержащей очень холодную жидкую/твердую двуокись углерода, может привести к сильному или сильному кипению продукта и чрезвычайно быстрому испарению из-за большой разницы температур. Если вода горячая, возможность взрыва “перегрева” жидкости Давление может возрасти до опасного уровня, если сжиженный газ контактирует с водой в закрытом контейнере С водой образует слабую углекислоту в неопасной реакции
Рассмотрены опасности, возникающие при использовании углекислого газа в системах предотвращения и тушения замкнутых объемов воздуха и горючих паров. Опасность, связанная с его использованием, заключается в том, что могут создаваться сильные электростатические разряды, которые инициируют взрыв [Quart. Саф. Сумм., 1973, 44(1740, 10). Контакт с водой, содержащей очень холодную жидкую/твердую двуокись углерода, может привести к сильному или сильному кипению продукта и чрезвычайно быстрому испарению из-за большой разницы температур. Если вода горячая, возможность взрыва “перегрева” жидкости Давление может возрасти до опасного уровня, если сжиженный газ контактирует с водой в закрытом контейнере С водой образует слабую углекислоту в неопасной реакции
Принадлежит к следующей реакционной группе(ам)
- Не химически активный
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа
включают в себя расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных
источники данных.
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 120 [Газы – Инертные (включая охлажденные жидкости)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки на расстоянии не менее 100 метров (330 футов) во всех направлениях.
КРУПНЫЙ РАЗЛИВ: Рассмотрите начальную эвакуацию по ветру на расстояние не менее 100 метров (330 футов).
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 120 [Газы – Инертные (включая охлажденные жидкости)]:
Используйте огнетушащее вещество, подходящее для типа окружающего пожара. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня. С поврежденными баллонами должны обращаться только специалисты.
С поврежденными баллонами должны обращаться только специалисты.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ: Тушить пожар с максимального расстояния или использовать беспилотные устройства основного потока или контрольные сопла. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Не направляйте воду на источник утечки или предохранительные устройства; может произойти обледенение. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 120 [Газы – Инертные (включая охлажденные жидкости)]:
Не прикасайтесь к пролитому материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. Не направляйте воду на разлив или источник утечки. Если возможно, переверните контейнеры с протечками так, чтобы выходил газ, а не жидкость. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Дайте веществу испариться. Проветрите помещение. ВНИМАНИЕ! При контакте с охлажденными/криогенными жидкостями многие материалы становятся хрупкими и могут неожиданно сломаться. (ЭРГ, 2020)
Не направляйте воду на разлив или источник утечки. Если возможно, переверните контейнеры с протечками так, чтобы выходил газ, а не жидкость. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Дайте веществу испариться. Проветрите помещение. ВНИМАНИЕ! При контакте с охлажденными/криогенными жидкостями многие материалы становятся хрупкими и могут неожиданно сломаться. (ЭРГ, 2020)
Защитная одежда
Выдержка из Карманного справочника NIOSH по углекислому газу:
Кожа: ОБМОРОЖЕНИЕ – Сжатые газы могут создавать низкие температуры при быстром расширении. Утечки и использование, которые допускают быстрое расширение, могут вызвать опасность обморожения. Носите соответствующую одежду для индивидуальной защиты, чтобы предотвратить замерзание кожи.
Глаза: ОБМОРОЖЕНИЕ – Используйте соответствующие средства защиты глаз, чтобы предотвратить попадание в глаза жидкости, которая может привести к ожогам или повреждению тканей в результате обморожения.
Мытье кожи: Нет рекомендаций, определяющих необходимость смывания вещества с кожи (немедленно или в конце рабочей смены).
Снять: Нет рекомендаций, указывающих на необходимость снятия влажной или загрязненной одежды.
Смена: Нет рекомендаций, указывающих на необходимость смены работником одежды после рабочей смены.
Обеспечьте: ПРОМЫВКУ ОТ ОБМОРОЖЕНИЯ. В непосредственной близости от рабочей зоны должны быть предусмотрены средства для быстрого обливания и/или фонтанчики для промывания глаз для использования в экстренных случаях, когда существует вероятность контакта с очень холодными или быстро испаряющимися жидкостями. (НИОСХ, 2022 г.)
Костюмные ткани DuPont Tychem®
Информация отсутствует.
Первая помощь
Выдержка из Карманного справочника NIOSH по углекислому газу:
Глаза: ОБМОРОЖЕНИЕ – Если ткань глаза замерзла, немедленно обратитесь за медицинской помощью; если ткань не замерзла, немедленно и тщательно промыть глаза большим количеством воды в течение не менее 15 минут, время от времени приподнимая нижнее и верхнее веко. Если раздражение, боль, отек, слезотечение или светобоязнь сохраняются, как можно скорее обратитесь за медицинской помощью.
Если раздражение, боль, отек, слезотечение или светобоязнь сохраняются, как можно скорее обратитесь за медицинской помощью.
Кожа: ОБМОРОЖЕНИЕ – Если произошло обморожение, немедленно обратитесь за медицинской помощью; НЕ трите пораженные участки и не промывайте их водой. Во избежание дальнейшего повреждения тканей НЕ пытайтесь снять замерзшую одежду с обмороженных участков. Если обморожения НЕ произошло, немедленно и тщательно промойте загрязненную кожу водой с мылом.
Дыхание: ПОДДЕРЖКА ДЫХАНИЯ – Если человек вдыхает большое количество этого химического вещества, немедленно выведите пострадавшего на свежий воздух. Если дыхание остановилось, сделайте искусственное дыхание. Держите пострадавшего в тепле и в покое. Как можно скорее обратитесь за медицинской помощью. (НИОСХ, 2022 г.)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников. источники данных.
источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: -109°F (Возвышенное) (NIOSH, 2022)
Давление паров: 56,5 атм (NIOSH, 2022)
Плотность пара (относительно воздуха): 1,53 (NIOSH, 2022)
Удельный вес: данные отсутствуют
Температура кипения: Возвышает (NIOSH, 2022)
Молекулярный вес: 44 (NIOSH, 2022)
Растворимость в воде: 0,2 % при 77°F (НИОСХ, 2022 г.)
Энергия/потенциал ионизации: 13,77 эВ (NIOSH, 2022)
IDLH: 40000 частей на миллион (NIOSH, 2022)
AEGL (Рекомендуемые уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.
PAC (критерии защитных действий)
Информация о PAC отсутствует.Нормативная информация
Что это за информация?
Поля нормативной информации включить информацию из Сводный список III Агентства по охране окружающей среды США списки, Химический завод Агентства кибербезопасности и безопасности инфраструктуры США антитеррористические стандарты, и Управление по охране труда и здоровья США Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами (подробнее об этих источники данных).
Сводный перечень списков EPA
Отсутствует нормативная информация.
Антитеррористические стандарты CISA Chemical Facility (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.


 1 Внешний вид и запах углекислоты (твердая фаза – в виде «снега»)
1 Внешний вид и запах углекислоты (твердая фаза – в виде «снега») 1 Объемная доля оксида азота, млн-1 (ррm), не более
1 Объемная доля оксида азота, млн-1 (ррm), не более 



