Zn что это за элемент: Мегаэнциклопедия Кирилла и Мефодия
alexxlab | 18.07.2023 | 0 | Разное
Цинк (Zn). Минералы. Компливит
Биологическая роль
Цинк является важным элементом для функционирования широкого спектра физиологических функций живых организмов. Его среднее совокупное содержание в тканях организма человека составляет около 2—3 г, преимущественно в связанном с белками виде. Необходимость и незаменимость цинка для человека была установлена 100 лет тому назад. По приблизительной оценке, около 10% генов всего человеческого генома кодирует белки, способные связывать цинк. На данный момент известно свыше 300 металлоэнзимов и 2000 факторов транскрипции, которым для функционирования требуется цинк.
Наибольшее внимание привлекают два цинксодержащих фермента: карбоксипептидаза А и карбоангидраза. Карбоксипептидаза А катализирует гидролиз концевой пептидной связи в белках в процессе пищеварения.
Цинк участвует в углеводном обмене посредством цинксодержащего гормона – инсулина. Только в присутствии цинка действует витамин А. Этот элемент необходим для формирования костей. Кроме того, он проявляет иммуномодулирующее действие.
Этот элемент необходим для формирования костей. Кроме того, он проявляет иммуномодулирующее действие.
Цинк влияет на вкус и обоняние. Из-за недостатка цинка, необходимого для полноценного развития плода, многие женщины в первые 3 месяца беременности жалуются на капризы вкуса и обоняния.
У больных ревматизмом и артритом наблюдается понижение уровня цинка в крови.
Цинк также обладает противовоспалительными свойствами.
Известны антиоксидантные свойства цинка. Цинк способствует уменьшению вызванного УФ-облучением повреждения клеток и их генетического аппарата и повышает устойчивость фибробластов кожи к окислительному повреждению. В определенной мере этот эффект обусловлен действием содержащих цинк ферментов и белков, которые участвуют в элиминации активных кислородных радикалов, в частности супероксиддисмутазы (СОД), но антиоксидантный потенциал цинка этим не ограничивается. Цинк может замещать собой металлы, активно участвующие в реакциях образования свободных радикалов (железо, медь).
В исследованиях воздействия йонов цинка на возрастные изменения кожи было показано, что цинк обладает антиоксидантными свойствами и способен проявлять видимый омолаживающий эффект на состояния кожи, вызванные возрастом, такие как фотостарение и гиперпигментация.
В коже человека содержится 6% цинка от его общего содержания в организме — по этому показателю кожа уступает только мышечным волокнам и костной ткани. Концентрация цинка в эпидермисе (50—70 мкг на 1 г сухой массы) выше, чем в дерме (5—10 мкг на 1 г сухой массы), что, вероятно, отражает активность цинкзависимых ДНК- и РНК-полимераз в клетках базального слоя эпидермиса с высоким митотическим индексом.
Цинк обладает свойством регенерации и принимает важное участие в процессе заживления ран. Этот эффект опосредован несколькими механизмами. Прежде всего для нормального процесса заживления необходимы цинксодержащие ферменты – металлопротеиназы (MMP) и щелочная фосфатаза.

Заболевания, вызываемые дефицитом минерала цинк (Zn)
Дефицит цинка может развиваться при недостаточном поступлении этого элемента в организм (1 мг/день и менее). Недостаточное потребление приводит к анемии, вторичному иммунодефициту, циррозу печени, половой дисфункции, наличию пороков развития плода.
Впервые клинические проявления системной недостаточности цинка были описаны A. Prasad и соавт. в 1961 г.– авторы описали ряд клинических случаев в Иране и Египте. Истинное цинкдефицитное состояние чаще всего бывает связано с алиментарными факторами (растительная диета на фоне общего недоедания). Эти явления сопровождаются кожными симптомами: сухость кожи, экзематозный дерматит, алопеция, язвы ротовой полости и замедленное заживление ран. Все указанные симптомы полностью проходят при назначении цинка внутрь.
Еще одна категория пациентов, у которых часто наблюдается умеренная недостаточность цинка, это лица пожилого возраста; очевидно, что в последние десятилетия в развитых странах есть тенденция к увеличению доли этой категории граждан в общей популяции. Дополнительный прием цинка внутрь может привести к существенному снижению заболеваемости инфекционными заболеваниями кожи у этих пациентов.
Дополнительный прием цинка внутрь может привести к существенному снижению заболеваемости инфекционными заболеваниями кожи у этих пациентов.
Дефицит цинка может быть вызван нарушением деятельности щитовидной железы, болезнями печени, плохим усвоением, недостатком цинка в воде и пище, возникновением повышенной потребности при беременности, физических нагрузках, стрессах, больших потерях при диарее, нарушениях всасывания, гемодиализе, а также слишком большим количеством фитина в продуктах питания (фитин связывает цинк, затрудняя его усвоение). Риск дефицита цинка увеличивается при приеме некоторых лекарственных препаратов (например, эстрогенов, кортикостероидов, мочегонных препаратов). Для лучшего усвоения цинка организмом необходимы витамины А и В6. Усвоению цинка препятствует медь, марганец, железо и кальций (в больших дозах). Кадмий способен вытеснять цинк из организма. Алкоголь также понижает уровень цинка в организме, особенно в мышцах и плазме крови.
В настоящее время отмечен дефицит потребления цинка практически во всех регионах Российской Федерации. Несмотря на значительное поступление цинка в биосферу в результате деятельности промышленных предприятий, в России наблюдается дефицит подвижных форм цинка в почвах большинства регионов, что ведет к обеднению рациона жителей этим микроэлементом. 80% пахотных земель России бедны цинком. Это особенно выражено в Саратовской, Иркутской, Брянской, Московской областях, Башкортостане и Красноярском крае. Пищевые продукты, полученные в этих регионах, изначально содержат недостаточное количество цинка.
Несмотря на значительное поступление цинка в биосферу в результате деятельности промышленных предприятий, в России наблюдается дефицит подвижных форм цинка в почвах большинства регионов, что ведет к обеднению рациона жителей этим микроэлементом. 80% пахотных земель России бедны цинком. Это особенно выражено в Саратовской, Иркутской, Брянской, Московской областях, Башкортостане и Красноярском крае. Пищевые продукты, полученные в этих регионах, изначально содержат недостаточное количество цинка.
Восполнить недостаток цинка можно с помощью витаминно-минеральных комплексов, биологически активных добавок к пище.
Источники цинка
Традиционными пищевыми источниками цинка являются: говядина, печень, морские продукты, морковь, лук, рисовые отруби, овсяная мука, молоко, яйца.
Содержание цинка в пищевых продуктах в России находится в следующих пределах (мг/кг): яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зеленые овощи, минеральная вода – около 0,25; мед – 0,31; малина, черная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свекла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб – от 2 до 8; некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца – от 8 до 20; овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зеленый чай, сушеные дрожжи, кальмары – от 20 до 50; говяжья печень, некоторые виды рыб – от 30 до 85; отруби из пшеницы, проросшие зерна пшеницы, тыквенные семечки, семечки подсолнечника – от 130 до 202.
Эссенциальные микроэлементы: что это, их роль в жизнедеятельности человека
Общие сведения
Минеральный состав внутриклеточной жидкости строго поддерживается на определенном уровне.
Элементы вместе с водой являются строительным материалами, кофакторами и катализаторами биохимических реакций, стабилизаторами белков и ферментов, обеспечивая постоянство осмотического давления, кислотно-щелочного баланса, процессов всасывания, секреции, кроветворения, костеобразования, свертывания крови. Благодаря присутствию элементов осуществляется процесс мышечного сокращения, нервной проводимости и внутриклеточного дыхания. Химические элементы в организме находятся в виде различных соединений и солей, их влияние на организма обусловлено дозой элемента. Для каждого элемента существует свой физиологический рабочий диапазон концентраций, обеспечивающий нормальное протекание физиологических реакций в организме.
Нарушенная экология, возросший темп жизни с неизбежным нарастанием стрессовых ситуаций, методы обработки продуктов питания, «убивающие» биологически активные вещества ведут к нарушению металло-лигандного гомеостаза и сдвигу равновесия в сторону увеличения или уменьшения концентрации элемента. Накопление элементов или их дефицит способствует активации альтернативных путей метаболизма, который в ряде случаев приводят к патологическим состояниям.
Накопление элементов или их дефицит способствует активации альтернативных путей метаболизма, который в ряде случаев приводят к патологическим состояниям.
Химические элементы классифицируются в зависимости от их роли в организме. 98% тела человека состоит из органических элементов: H, C, N, O. Вместе с неорганическими элементами Na, Mg, K, Ca, P, S, Cl они составляют основу клеток и тканей, выполняя структурообразующую функцию. К эссенциальным или жизненно необходимым микроэлементам относятся Mn, Fe, Co, Ni, Cu, Zn, Mo, Se, I, при их отсутствии нарушаются базовые реакции деления и размножение клеток. К условно-эссенциальным микроэлементам относятся Li, V, Cr, B, F, Si, As, их роль до конца не определена. Существуют также «токсические металлы», которые в минимальных концентрациях способны оказывать стимулирующее воздействие на организм, но в высоких концентрациях проявляют токсические эффекты.
Микроэлементы составляют лишь 0,02% организма, но способны изменять протекание важнейших биологических реакций.
Железо (Fe)
Железо является жизненно необходимым элементом для организма. Железо входит в состав гемсодержащих белков (гемоглобин и миоглобин) и участвует в переносе кислорода. Железо также входит в состав цитохромов (сложные белки, относящиеся к классу хромопротеидов), участвующих в процессах тканевого дыхания.Общее содержание железа в организме человека составляет 3-5 г. Из этого количества 57% находится в гемоглобине крови, 23% — в тканях и тканевых ферментах (ферритин и гемосидерин), а остальные 20% — депонированы в печени, селезенке, костном мозге, мышцах и представляют собой “физиологический резерв” железа. Железо существует в двух формах: окисленной (Fe3+) и воcстановленной (Fe2+). Восстановленная форма лучше усваивается организмом. Только 10 % поступившего железо всасывается в кишечнике.
Железо существует в двух формах: окисленной (Fe3+) и воcстановленной (Fe2+). Восстановленная форма лучше усваивается организмом. Только 10 % поступившего железо всасывается в кишечнике.
Физиологическая потребность в железе:
- мужчины: 8–10 мг/сут;
- женщины: 15–20 мг/сут;
- беременных женщины: 30–40 мг/сут;
- дети: 4–18 мг/сут.
В больших количествах восстановленная форма железа (гемовое железо), содержится: в свиной печени, говяжьих почках, сердце и печени. Окисленная форма железа (негемовое железо) содержится в неживотных продуктах: непросеянной муке, сушеных персиках, орехах, бобах, спарже, овсяном толокне.
Недостаток железа приводит к тяжелым расстройствам, наиболее важным из которых является железодефицитная анемия. Железодефицитная анемия может привести к сердечной недостаточности.
Избыточное накопление железа приводит к отложению металла в органах (печень, поджелудочная железа, суставы, сердце). Явления отравления железом выражаются рвотой, диареей, падением артериального давления, параличом ЦНС и воспалением почек. При лечении железом могут развиться запоры, так как железо связывает сероводород, что ослабляет моторику кишечника. Избыток железа в организме может привести к дефициту меди, цинка, хрома и кальция, а также к избытку кобальта.
Явления отравления железом выражаются рвотой, диареей, падением артериального давления, параличом ЦНС и воспалением почек. При лечении железом могут развиться запоры, так как железо связывает сероводород, что ослабляет моторику кишечника. Избыток железа в организме может привести к дефициту меди, цинка, хрома и кальция, а также к избытку кобальта.
Йод необходим на всех этапах жизнедеятельности. Период младенчества и раннего детства являются критическими в отношении дефицита йода. Йод входит в состав гормонов щитовидной железы тироксина (T4) и трийодтиронина (T3). Йод необходим для роста и дифференцировки клеток всех тканей организма человека, внутриклеточного дыхания, регуляции трансмембранного транспорта натрия и гормонов.
Общее количество йода в организме составляет 25 мг, из них 15 мг аккумулирует щитовидная железа. Значительное количество йода содержится в печени, почках, коже, волосах, ногтях, яичниках и предстательной железе.
Физиологическая потребность в йоде:
- взрослые: 100–150 мкг/сут;
- беременные: 175–200 мкг/сут;
- дети: от 60 до 150 мкг/сут.
Богатым источником йода являются водоросли, овощи, выращенные на почве обогащенной йодом, лук, морепродукты.
При недостаточном поступлении йода у взрослых увеличиваются размеры щитовидной железы, замедляется основной обмен, наблюдается падение артериального давления. У детей недостаток йода сопровождается резкими изменениями всей структуры тела: ребенок отстает в умственном и физическом развитии.
Избыток йода в организме наблюдается при гипертиреозе. Развивается Базедова болезнь, сопровождающаяся экзофтальмом, тахикардией, раздражительностью, мышечной слабостью, потливостью, исхуданием, склонностью к диарее. Повышение основного обмена ведет к гипертермии, дистрофическим изменениям кожи и ее придатков, раннему поседению, депигментации кожи на ограниченных участках (витилиго), атрофии мышц.
Марганец (Mn)
Важен для репродуктивных функций и нормальной работы центральной нервной системы. Марганец участвует в синтезе нейромедиаторов, улучшает мышечные рефлексы, обеспечивает развитие соединительной и костной ткани, увеличивает утилизацию жиров, усиливает эффекты инсулина.
3–5 % поступившего марганца всасывается. Наиболее богаты марганцем трубчатые кости и печень, поджелудочная железа. Марганец содержится в клетках, богатых митохондриями.
Физиологическая потребность в марганце:
- взрослые: 2–5 мг/сут;
- для детей в 2 раза выше.
Особенно богаты марганцем чай, растительные соки, цельные злаковые, орехи, зеленые овощи с листьями, горох, свёкла.
При недостатке марганца нарушаются процессы окостенения во всем скелете, трубчатые кости утолщаются и укорачиваются, суставы деформируются. Нарушается репродуктивная функция яичников и яичек.
Избыток марганца усиливает дефицит магния и меди.
Медь принимает участие в поддержание эластичности связок, сухожилий, кожи и стенок легочных альвеол, стенок капилляров, а также прочности костей. Медь входит в состав защитных оболочек нервных волокон, участвует в процессах пигментации, так как входит в состав меланина. Медь влияет на углеводный обмен, посредством усиления процессов окисления глюкозы и торможения распада гликогена мышц и печени. Медь обладает противовоспалительными действиями, помогает при борьбе с бактериальными агентами. Медь является кофактором ферментов антиоксидантной защиты и помогает нейтрализовать действие свободных радикалов.
Общее содержание меди в организме человека составляет примерно 100–150 мг. Лучше всего организм усваивает двухвалентную медь. В тонком кишечнике всасывается до 95% меди, поступившей с пищей. Основное “депо” меди в организме — печень, поскольку синтезирует белок-переносчик меди церулоплазмин.
Физиологическая потребность в меди:
- взрослые: 1 мг/сут;
- дети: от 0,5 до 1 мг/сут.

Медь содержится в овощах, бобовых, морепродуктах, яблоках.
При недостатке меди в организме наблюдаются: задержка роста, анемия, дерматозы, депигментация волос, частичное облысение, потеря аппетита, сильное исхудание, понижение уровня гемоглобина, атрофия сердечной мышцы. Избыток меди приводит к дефициту цинка и мoлибдена, а также марганца.
Молибден (Мо)
Способствует метаболизму углеводов и жиров, является важной частью фермента, отвечающего за утилизацию железа, в связи с чем помогает предупредить анемию. Принимает участие в обмене мочевой кислоты, включении фтора в состав эмали зубов, гемопоэзе.
Биодоступность молибдена составляет 50%. Молибден не депонируется в организме, а распределяется между клетками крови.
Физиологическая потребность в молибдене:
- взрослые: 45–100 мкг/сут;
- дети: от 0,5 до 1 мг/сут.
Содержится в темно-зеленых листовых овощах, неочищенном зерне, бобовых. Проявления недостаточности изучены плохо. Повышенное содержание в организме встречается очень редко.
Проявления недостаточности изучены плохо. Повышенное содержание в организме встречается очень редко.
Селен (Sе)
Элемент антиоксидантной защиты, хорошо сочетается с витамином Е. Селен помогает поддерживать должную эластичность тканей. Селен усиливает иммунитет, поэтому активно используется в онкологической практике, в лечении гепатитов, панкреатитов, кардиомиопатий. Селен защищает организм от тяжёлых металлов.
Всасывается в тонком кишечнике, депонируется в почках, печени, костном мозге.
Физиологическая потребность в селене:
- женщины: 50 мкг/сут;
- беременные: 65 мкг/сут;
- мужчины: 70 мкг/сут;
- дети: 10-50 мкг/сут.
В чистом виде встречается в природе редко, главным образом в виде примеси к сернистым металлам. Присутствует в чесноке, сале, отрубях, белых грибах, растительных маслах, морских водорослях.
При дефиците селена в организме усиленно накапливаются мышьяк и кадмий, которые, в свою очередь, еще больше усугубляют его дефицит.
Избыток селена приводит к гепато- и холецистопатиям, изменениям работы нервно-мышечного аппарата (боли в конечностях, судороги, чувство онемения). Избыток может привести к дефициту кальция.
Цинк (Zn)
Цинк входит в состав более 300 ферментов, чем объясняет его влияние на углеводный, жировой и белковый обмен веществ, на окислительно-восстановительные процессы, регуляцию активности генов. Цинк связан с правильным функционированием репродуктивной, неврологической, иммунной систем, ЖКТ и кожи. Присутствие микроэлемента важно для нормального сперматогенеза, органогенеза, работы нейромедиаторов и панкреатических ферментов, правильного развития тимуса, эпителизации ран в процессе заживления и ощущения вкуса.
В организме содержится около 1,5–3 г цинка. Цинк всасывается в тонком кишечнике. Медь является антагонистом цинка, и конкурирует с цинком за всасывание в кишечнике. 99% цинка находится внутриклеточно, 1% — в плазме. Цинк присутствует во всех органах и тканях, но в большей степени цинк депонируют предстательная железа, семенники, мышцы, кожа, волосы.
Физиологическая потребность в цинке составляет: 12 мг/сут для взрослых, 3–2 мг/сут для детей.
Наиболее богаты цинком дрожжи, пшеничные, рисовые и ржаные отруби, зерна злаков и бобовых, какао, морепродукты, грибы, лук, картофель.
При дефиците цинка наблюдается задержка роста, перевозбуждение нервной системы и быстрое утомление. Поражение кожи происходит с утолщением эпидермиса, отеком кожи, слизистых оболочек рта и пищевода, ослаблением и выпадением волос. Недостаточное поступление цинка приводит к бесплодию. Дефицит цинка может приводить к усиленному накоплению железа, меди, кадмия, свинца.
При цинковом отравлении наступает фиброзное перерождение поджелудочной железы. Избыток цинка задерживает рост и нарушает минерализацию костей.
Кобальт (Co)
Входит в состав витамина В12, участвует в обмене гормонов щитовидной железы, подавляет обмен йода, регулирует гемопоэз, усиливает всасываемость железа.
В организме 1,5 г кобальта. Биодоступность кобальта 20%. В организм кобальт депонируется в печени, костной ткани и мышцах.
Биодоступность кобальта 20%. В организм кобальт депонируется в печени, костной ткани и мышцах.
Физиологическая потребность в кобальте составляет: 10 мкг/сут для взрослых.
Кобальт содержится в печени, молоке, овощах.
Дефицит кобальта связан с В12-дефицитной анемией, вегетарианством или паразитарной инвазией. Избыток кобальта наблюдается при интоксикации кобальта (вредное производство, разрушение ортопедических имплантантов).
Никель (Ni)
Никель пролонгирует эффекты инсулина, участвует в окислении аскорбиновой кислоты, ускоряет образование дисульфидных групп.
Никель всасывается в кишечнике, биодоступность от 1 до 10 %. Запасы никеля находятся в поджелудочной железе, легких, сердце.
Физиологическая потребность в никеле составляет: 100–200 мкг/сут для взрослых.
Богаты никелем чай, гречиха, морковь и салат.
Дефицит никеля не описан. Избыток никеля наблюдается при его токсическом поступлении, злокачественных новообразованиях легких, ожогах, инсультах и инфарктах. Избыток может проявлять потерей пигментацией кожи.
Избыток может проявлять потерей пигментацией кожи.
Пикантный элемент Цинк | ChemTalk
Знакомство с элементом Цинк
Цинк — это элемент, известный науке уже некоторое время и нашедший применение на протяжении всей истории. Сегодня цинк остается важнейшим элементом для функционирования современных технологий и биологии человека.
10 интересных фактов о цинке
- Латунь — это сплав цинка и меди, который в древние времена был одним из важнейших соединений металлов.
- Цинк используется в различных повседневных продуктах, включая краску, шампунь и дезодорант.
- Современные ученые используют различные изотопы цинка для изучения пищевых сетей и экосистем, почти как углеродный анализ!
- Пенни США сделаны в основном из цинка, только тонкое внешнее покрытие сделано из меди.
- Цинк — 24 й наиболее распространенный элемент в земной коре, около 0,01%.
- Название «цинк» происходит от немецкого слова zinke , означающего «зуб» или «зуб».

- Дефицит цинка затрагивает более 2 миллиардов человек во всем мире, что делает его важной частью глобальных целей в области здравоохранения.
- Диэтилцинк был первым известным соединением, содержащим сигма-связь углерод-металл.
- Очистка цинка представляет опасность для окружающей среды, поскольку при этом выделяется диоксид серы.
- Простуда на самом деле лечится добавками цинка.
Элемент Цинк в периодической таблице
Цинк, атомный символ Zn, имеет атомный номер 30 и является последним переходным металлом четвертого периода. Он лежит справа от меди и слева от галлия и выше кадмия. Он имеет электронную конфигурацию [Ar]4s 2 3d 10 .
Цинк является одним из немногих переходных металлов, имеющих только одну основную степень окисления: +2. Хотя технически он может формировать состояние +1, эта конфигурация чрезвычайно нестабильна и сложна в обслуживании. С электроотрицательностью 1,65 по шкале Полинга элемент легко связывается с большинством электроотрицательных неметаллов, включая кислород, хлор и азот.
Цинк в электрохимии
В области электрохимии некоторым элементам уделяется большое внимание. Хорошие и электрически активные элементы полезны в конструкции гальванических элементов — цинк идеально подходит для этой цели, потому что он в изобилии и легко окисляется (восстановительный потенциал -0,76 В). Ячейки Zn / Cu чаще всего встречаются при изучении основной электрохимии. Как и в этом научном контексте, именно электрохимические свойства цинка делают его таким полезным в реальном мире, как мы обсудим позже.
Цинк в организме
Цинк — один из самых важных металлов в организме. Он имеет решающее значение для функционирования около 10% белков в нашем организме, играя роль в передаче сигналов клетками, экспрессии генов и апоптозе (контролируемая гибель клеток). В макромасштабе цинк важен для правильной иммунной функции и пищеварения, а также для роста детей.
Цинк доказал свою эффективность в лечении различных заболеваний. Помимо простуды, цинк помогает набрать вес тем, кто страдает анорексией, а также предотвращает дегенерацию желтого пятна (процесс потери зрения с возрастом). Этот элемент является дешевым и эффективным способом улучшения здоровья, особенно в развивающихся странах, где распространен дефицит.
Помимо простуды, цинк помогает набрать вес тем, кто страдает анорексией, а также предотвращает дегенерацию желтого пятна (процесс потери зрения с возрастом). Этот элемент является дешевым и эффективным способом улучшения здоровья, особенно в развивающихся странах, где распространен дефицит.
Применение цинка в современном мире
Защита от непогоды (буквально)
Одной из самых больших угроз общественной инфраструктуре является ржавчина. Из-за солей, воды или старого воздуха открытое железо и сталь со временем разлагаются, в результате чего транспортные сети и большие здания становятся ненадежными. Цинк помогает нам, предотвращая это окисление. Основное применение цинка сегодня – это расходуемый анод . Покрытие железа или стали слоем цинка (так называемая оцинковка 9).0023) предотвратит окисление (ржавление) металла под ним, потому что цинк более «охотно» окисляется, чем металл, который он покрывает. Большая часть открытого металла, который мы видим изо дня в день, в том числе в заборах, мостах, крышах и кузовах автомобилей, защищена этим тонким слоем металлического цинка.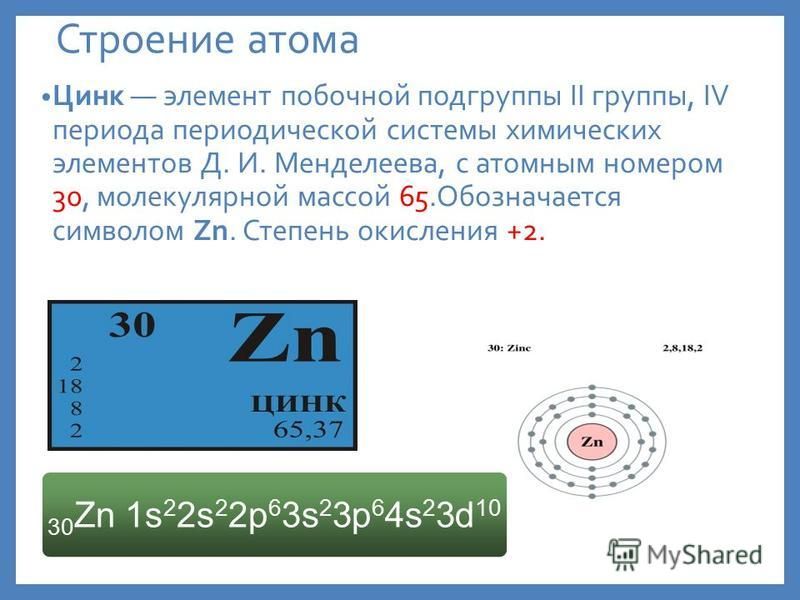
В дополнение к физическому покрытию металлической поверхности цинк может обеспечивать электрохимическую защиту через провод. Открытые и недоступные металлические поверхности, такие как подземные трубопроводы и корпуса кораблей, часто защищаются цинком, который заменяет электроны, потерянные при окислении. Структурная целостность современного мира не в последнюю очередь благодаря цинку.
Аккумулятор энергии
Помимо инфраструктуры, легкость окисления цинка используется в батареях. Поскольку это просто гальванические элементы, характеристики, которые мы видели ранее, делают их идеальными в качестве анода в одноразовых батареях. В качестве восстановителя используется порошок металла — белая паста, которая иногда вытекает из старых аккумуляторов, часто представляет собой смесь этого цинка с графитом и другими электролитами.
Где содержится цинк?
Цинк можно найти по всему миру. Его основная руда, сфалерит (ZnS), встречается довольно часто, часто в смеси с другими серосодержащими рудами. Китай вносит наибольший вклад в производство, за ним следуют австралийские и перуанские горнодобывающие предприятия.
Китай вносит наибольший вклад в производство, за ним следуют австралийские и перуанские горнодобывающие предприятия.
Когда и как был открыт этот элемент?
Цинк был известен на протяжении тысячелетий и широко использовался в древнем мире. Сплавы цинка, особенно латунь (Zn + Cu), использовались различными древними цивилизациями — иудейская латунь была найдена еще в 14 веке до нашей эры.
Цинк был выделен в Индии около 1300 г. н.э. После этого его завезли на Запад, но серьезное научное изучение металла не начиналось еще несколько сотен лет. Швейцарский врач Парацельс был первым жителем Запада, который примерно в 1526 году идентифицировал этот элемент как уникальный металл. Его название происходит от немецкого 9.0022 zinke , или зуб, благодаря игольчатой структуре чистого металла. В последующие столетия различные европейцы внесли свой вклад в изучение этого элемента. Братья Уильям и Джон Чэмпион открыли новые и эффективные способы очистки цинка, которые будут использоваться в течение многих лет.
В конце 18 века Луиджи Гальвани использовал цинк в своих экспериментах, которые проложили путь к современному электричеству. Его друг, Алессандро Вольта, использовал ставшее уже классическим сочетание цинка и меди для создания мощной, но примитивной батареи, которая тогда называлась Вольтова батарея. Названия гальванического элемента и процесса гальванизации отдают дань уважения работе Гальвани. Наследие Вольты продолжается в самой единице электрического потенциала, Вольте.
Первоначальная «гальваническая батарея»Биологическое значение цинка было открыто только в двадцатом веке. В настоящее время он признан ключевым игроком в структуре и функции ферментов.
Химия цинка
Степени окисления
Переходные металлы, находящиеся ближе к концу d-блока, нарушают традиционные правила электронной конфигурации. В своих ионных состояниях эти металлы часто сохраняют свои d-орбитальные электроны в пользу потери своих s-орбитальных электронов. Вот почему медь, серебро и золото имеют степень окисления +1. По той же причине цинк (почти) всегда будет терять свои s-электроны, а не d-электроны, придавая ему степень окисления +2. С химической точки зрения это заставляет его вести себя очень похоже на щелочноземельный элемент, такой как кальций или магний. Электронная конфигурация Zn 9Ион 0018 2+ представляет собой [Ar]3d 10 , то же, что и кальций, если игнорировать электроны d-оболочки.
По той же причине цинк (почти) всегда будет терять свои s-электроны, а не d-электроны, придавая ему степень окисления +2. С химической точки зрения это заставляет его вести себя очень похоже на щелочноземельный элемент, такой как кальций или магний. Электронная конфигурация Zn 9Ион 0018 2+ представляет собой [Ar]3d 10 , то же, что и кальций, если игнорировать электроны d-оболочки.
Хотя технически возможно иметь степень окисления +1, эта форма нестабильна. Подобно ртути, предпочтительным является ионный димер Zn 2 2+ . Без тщательной стабилизации этот ион распадается на Zn 2+ и металлический цинк. Во всех смыслах этот элемент находится только в степени окисления +2.
Химические свойства
Будучи электроположительным металлом, цинк легко окисляется многими элементами. Образцы металла будут быстро покрыты слоем ZnO при воздействии газообразного кислорода в результате реакции 2Zn (т) + O 2 (г) → 2ZnO (т).
Металл может реагировать с водой при высоких температурах с образованием ZnO и газообразного водорода: Zn (т) + H 2 O (г) → ZnO (т) + H 2 (г).
Он также реагирует с серой, образуя зеленое пламя.
При горении цинка образуется зеленое пламяСоединения цинка
Глюконат цинка
Это соединение является основной добавкой цинка, используемой сегодня. Он поставляет свободный цинк для использования в организме, дешев и прост в производстве.
Хлорид цинка
ZnCl 2 — очень распространенная и полезная форма этого элемента. Он полезен в качестве флюса и осушителя, хотя есть и более эффективные варианты. Он также используется в органической химии в качестве кислоты Льюиса, являясь обычной альтернативой AlCl 3 в реакции Фриделя-Крафтса.
Гидроксид цинка
Zn(OH) 2 используется в медицине в качестве хирургической повязки для ускорения заживления. Это также побочный продукт обычного процесса, используемого для обнаружения минералов цинка.
Сульфид цинка
ZnS в основном используется для взаимодействия со светом. Большинство светящихся в темноте пигментов представляют собой ZnS со следовыми количествами другого металла. Классический зеленоватый светящийся в темноте цвет исходит от ZnS, легированного медью. Марганец и серебро используются для получения оранжевого и синего цветов соответственно. В дополнение к своим фосфоресцентным свойствам ZnS используется в таких пигментах, как литопон, один из наиболее распространенных белых пигментов. ZnS также является фотокатализатором, что означает, что он может позволить протекать некоторым реакциям в присутствии света, включая образование газообразного водорода из воды.
Оксид цинка
И последнее, но не менее важное: оксид цинка играет ключевую роль в существующих и новых технологиях. Он используется в производстве вулканизированной резины, основного материала. Он также очень полезен благодаря своим свойствам полупроводника. Новые технологии, такие как тонкопленочные транзисторы и спинтроника, а также новые светодиодные и ЖК-дисплеи, зависят от среды ZnO. Кроме того, ZnO перспективен в качестве анода в литий-ионных батареях, поскольку он более эффективен и безвреден для окружающей среды, чем традиционные материалы, такие как кобальт. Оксид цинка также можно использовать в микроволокнах для выработки электричества, открывая путь к электрически автономным наномашинам.
Кроме того, ZnO перспективен в качестве анода в литий-ионных батареях, поскольку он более эффективен и безвреден для окружающей среды, чем традиционные материалы, такие как кобальт. Оксид цинка также можно использовать в микроволокнах для выработки электричества, открывая путь к электрически автономным наномашинам.
Изоляция цинка
Цинковые руды, такие как сфалерит, добываются по всему миру. После сбора эти материалы тонко измельчаются, а затем разделяются, используя различия в их гидрофобности. После выделения руда (на данном этапе в основном ZnS) обжигается, превращаясь в ZnO. Оттуда он либо восстанавливается до металлического цинка углеродом и монооксидом углерода, либо выделяется электролизом после обработки серной кислотой. Стоит отметить, что на стадии обжига, превращающей ZnS в ZnO, выделяются оксиды серы, наносящие вред окружающей среде. Таким образом, рафинация предлагает некоторые проблемы, поскольку мир движется к более экологичным и более зависимым от цинка методам.
К сожалению, не существует эффективного и практичного способа выделения этого элемента в лабораторных условиях.
Физические свойства
- Обозначение: Zn
- Температура плавления: 419,5 °C
- Температура кипения: 907,0 °C
- Плотность: 7,14 г/см 3 9 900 Масса атомов: 900 38 Da
- Атомный номер: 30
- Электроотрицательность: 1,65
- Классификация: Переходный металл
- Естественное содержание в земной коре: 0,0075% или 75 частей на миллион
- Электронная конфигурация: [Ar] 4s 2 3d 10
- Изотопы: 64 Zn, 66 Zn, 67,90 Zn, 90 0018 70 Zn
- Встречается в природе в минералы сфалерит (сульфид цинка), смитсонит (карбонат цинка) и гемиморфит (силикат цинка)
- Токсичность: Токсичен в избытке, что приводит к дефициту меди и железа. Глотание/переваривание пенни США очень опасно из-за высокого содержания цинка.

Где я могу купить цинк?
Металлический цинк можно приобрести в различных сетевых и физических магазинах, включая Amazon и Home Depot. Добавки цинка доступны практически в каждой аптеке или аптеке.
Если вам понравилось узнавать о цинке, ознакомьтесь с другими элементами в нашей интерактивной периодической таблице!Элемент Цинк — Атом цинка
| |||||
| Общие | |||||
|---|---|---|---|---|---|
| Имя, символ, номер | цинк, Zn, 30 | ||||
| Химическая серия | переходные металлы | ||||
| Группа, период, блок | 12, 4, д | ||||
| Плотность, твердость | 7140 кг/м 3 , 2,5 | ||||
| Внешний вид | голубоватый бледно-серый | ||||
| Атомные свойства | |||||
| Атомный вес | 65,409 а. е.м. е.м. | ||||
| Атомный радиус (расч.) | 135 (142) вечера | ||||
| Ковалентный радиус | 131 вечера | ||||
| Радиус Ван-дер-Ваальса | 139 вечера | ||||
| Электронная конфигурация | [Ar]3d 10 4s 2 | ||||
| e – на уровень энергии | 2, 8, 18, 2 | ||||
| Степени окисления (оксид) | 2 (амфотерный) | ||||
| Кристаллическая структура | шестигранник | ||||
| Физические свойства | |||||
| Государство материи | твердый (диамагнитный) | ||||
| Температура плавления | 692,68 К (419,52 С / 787,15 F) | ||||
| Точка кипения | 1180 К (907,2 °С / 1665 °F) | ||||
| Молярный объем | 9,16 10 -6 м 3 /моль | ||||
| Теплота парообразования | 115,3 кДж/моль | ||||
| Теплота плавления | 7,322 кДж/моль | ||||
| Давление паров | 192,2 Па при 692,73 К | ||||
| Скорость звука | 3700 м/с при 293,15 К | ||||
| Разное | |||||
| Электроотрицательность | 1,65 (шкала Полинга) | ||||
| Удельная теплоемкость | 390 Дж/(кг*К) | ||||
| Электропроводность | 16,6 10 6 /(МОм) | ||||
| Теплопроводность | 116 Вт/(м*К) | ||||
| 1 st потенциал ионизации | 906,4 кДж/моль | ||||
| 2 nd потенциал ионизации | 1733,3 кДж/моль | ||||
| 3 rd потенциал ионизации | 3833 кДж/моль | ||||
| 4 й потенциал ионизации | 5731 кДж/моль | ||||
Единицы СИ
& STP используются, если не указано иное. | |||||
Цинк — химический элемент в периодической таблице, который имеет символ Zn и атомный номер 30.
Известный характеристики
Цинк является умеренно химически активным металлом, который соединяется с кислородом и другими неметаллами и вступает в реакцию разбавленными кислотами с выделением водорода. Одна распространенная степень окисления цинка +2.
Области применения
Цинк является четвертым по распространенности используемым металлом, уступая только железу, алюминию и меди в тоннах металла, производимого в год.
- Цинк используется для гальванизации металлов, таких как сталь, для предотвращения их коррозия.
- Цинк используется в таких сплавах, как латунь, нейзильбер, пишущая машинка металл, различные формулы припоя, нейзильбер и т.д.
- Латунь, в свою очередь, имеет широкое применение благодаря своей прочности
и коррозионная стойкость.

- Цинк используется в литье под давлением, особенно в автомобильной промышленности.
- Прокат цинковый применяется в составе тары аккумуляторных батарей.
- Оксид цинка используется в качестве белого пигмента в акварелях и красках, и как активатор в резиновой промышленности. В качестве безрецептурного мазь, наносится тонким слоем на открытые участки кожи лица и носа, чтобы предотвратить обезвоживание и тем самым защитить против солнечных ожогов летом и обветриваний зимой. Применяемый тонко к области подгузника ребенка (промежности) при каждой смене подгузника, защищает от сыпи. Как определено в Age-Relationed Eye Исследование заболеваний, это часть эффективного лечения возрастных дегенерация желтого пятна в некоторых случаях.
- Хлорид цинка используется в качестве дезодоранта и консерванта для древесины.

- Сульфид цинка используется в люминесцентных пигментах, для изготовления стрелки часов и другие предметы, которые светятся в темноте.
- Метил цинка (Zn(CH 3 ) 2 ) используется в ряде органических синтезов.
- Лосьоны из каламина, смеси Zn-(гидрокси-)карбонатов и силикаты, используются для лечения кожной сыпи.
- Металлический цинк входит в состав большинства запатентованных безрецептурных препаратов. ежедневные витаминно-минеральные препараты. Наряду с некоторыми другими металлов, считается, что он обладает антиоксидантными свойствами, которые защищают от преждевременного старения кожи и мышц тела. В больших количествах, взятых в виде одного цинка в других патентах, считается, что он ускоряет процесс заживления после травмы.
- Глюконат цинка глицин принимают в виде леденцов в качестве лечебного средства.
 для простуды.
для простуды.
История
Цинковые сплавы веками использовались для датировки латунных изделий до 1000-1400 до н.э. были найдены в Палестине и цинковые предметы с 87% цинка было найдено в доисторической Трансильвании. Из-за низкая температура кипения и химическая активность этого металла (изолированный цинк будет стремиться уйти в дымоход, а не быть захваченным), истинная природа этого металла не была понята в древние времена.
Изготовление латуни было известно римлянам около 30 г. до н.э., с использованием техники, при которой каламин и медь нагревались вместе в тигле. Оксиды цинка в каламине были восстановлены, а свободный металлический цинк был захвачен медью, образуя сплав. полученная латунь была либо отлита, либо закована в форму.
Осуществлялась плавка и извлечение нечистых форм цинка
уже в 1000 году нашей эры в Индии и Китае. К концу 14 в.
Индусы знали о существовании цинка как отдельного металла.
из семи известных древним. На Западе открытие
чистого металлического цинка чаще всего приписывают немцу Андреасу
Маргграф, в 1746 году, хотя вся история значительно
более вовлечены.
К концу 14 в.
Индусы знали о существовании цинка как отдельного металла.
из семи известных древним. На Западе открытие
чистого металлического цинка чаще всего приписывают немцу Андреасу
Маргграф, в 1746 году, хотя вся история значительно
более вовлечены.
Описания производства латуни встречаются в Западной Европе в
сочинения Альберта Великого, ок. 1248 г., а к 16 в.
понимание и осведомленность о новом металле значительно расширились.
Агрикола в 1546 году заметил, что белый металл может быть сконденсирован.
и соскребали стенки печи при плавке цинковой руды.
В своих заметках он добавил, что аналогичный металл под названием «цинк»
производится в Силезии. Парацельс (умер в 1541 г.) был первым в
Уэст, чтобы сказать, что этот «цинк» был новым металлом и что он
отдельный набор химических свойств от других известных металлов.
В результате цинк был известен к тому времени, когда Маргграф сделал свой открытий, и на самом деле цинк был выделен двумя годами ранее другим химиком, Антоном фон Швабом. Однако отчеты Маргграфа были исчерпывающими и методичными, а качество его исследований его репутация первооткрывателя цинка.
До открытия метода флотации сульфида цинка каламин был минеральным источником металлического цинка.
Пищевые продукты и специи, содержащие незаменимый минерал цинк
Биологические роль
Цинк является важным элементом в организме человека, необходимым для поддержания жизнь. Дефицит цинка оказывает заметное влияние на увеличение веса у животные. Цинк содержится в инсулине, белках цинковых пальцев и т. ферменты, такие как супероксиддисмутаза.
Согласно некоторым источникам, прием таблеток цинка может
иммунитет против простуды и гриппа, хотя это оспаривается.
Зрение, вкус, обоняние и память также связаны с цинком а дефицит цинка может вызвать сбои в работе этих органов и функции.
Натуральные пищевые источники цинка включают устриц, красное мясо и птицу, бобы, орехи, цельные зерна, семена тыквы или подсолнечника.
У мужчин цинк важен для производства спермы. Вплоть до Во время эякуляции теряется 5 мг цинка. Дефицит цинка в мужчины могут привести к снижению количества сперматозоидов и полового влечения. Частые эякуляции может привести к дефициту цинка.
Распространенность
Цинк является 23-м наиболее распространенным элементом в земной коре. наиболее сильно добываемые руды, как правило, также содержат примерно 10% железа. как 40-50% цинка. Минералы, из которых извлекают цинк, включают сфалерит, цинковая обманка, смитсонит, каламин и франклинит.
По всему миру есть цинковые рудники, крупнейшие производители
будучи Австралией, Канадой, Китаем, Перу и США Шахты в Европе
включают Vieille Montagne в Бельгии и Zinkgruvan в Швеции.
Соединения
Оксид цинка, пожалуй, самый известный и широко используемый цинк. состав, так как он является хорошей основой для белых пигментов в краске. Это также находит промышленное применение в резиновой промышленности и продается как непрозрачный солнцезащитный крем. Ряд других соединений цинка находит применение в промышленности, такие как хлорид цинка (в дезодорантах), сульфид цинка (в люминесцентных красок) и метил цинка в органической лаборатории. Примерно один четверть всего производимого цинка потребляется в виде соединений цинка.
Изотопы
Встречающийся в природе цинк состоит из 4 стабильных изотопов Zn-64,
Zn-66, Zn-67 и Zn-68, причем 64 является наиболее распространенным (48,6% природного происхождения).
избыток). 22 радиоизотопа были охарактеризованы наиболее
{обильный и/или стабильный} представляет собой Zn-65 с периодом полураспада 244,26
дней, а Zn-72 с периодом полураспада 46,5 часов.

