Золото теплопроводность: Плотность золота, его теплоемкость и теплопроводность
alexxlab | 23.06.2023 | 0 | Разное
Физические и химические свойства золота — Answr
Характеристики золота, определяющие его реакцию на физическое и химическое воздействие.
Физические свойства золотаЗолото — блестящий металл желтого цвета с высокой плотностью, тепло- и электропроводностью, низкой твердостью, хорошей пластичностью и ковкостью.
Плотность золотаЗолото обладает высокой плотностью и относится к группе тяжелых металлов. Плотность химически очищенного золота 999 пробы 19,32 г/см³, а «самородного золота» колеблется в диапазоне от 18 до 18,5 г/см³. 585 проба, используемая в ювелирной промышленности, обладает относительно небольшой плотностью — от 12,85 до 14,76 г/см³, так как это сплав золота, палладия, серебра, никеля и меди.
Твердость золотаЗолото — мягкий металл, по десятибальной шкале Мооса твердость золота находится в диапазоне от 2,5 до 3 баллов. Очищенное и «самородное» золото легко царапается, а при усилии режется острым ножом.
Золото относится к группе металлов с высоким коэффициентом теплопроводности — при температуре 0ºC 311 Вт/(м∙К). При нагревании его теплопроводность ухудшается. Удельное электрическое сопротивление золота 0,023 Ом∙мм²/м, что на 25% выше электрического сопротивления меди.
Температура плавления золотаЗолото относится к среднеплавким металлам, температура плавления 999 пробы 1064ºC, точка кипения чистого золота — 2947ºC. Температура плавления 585 пробы 840ºC, благодаря этому ювелиры могут проводить его переплавку в домашних условиях.
Ковкость и пластичность золотаВысокая пластичность золота позволяет ему сохранять свои свойства при растяжении, прокатке, шлифовании, сжатии и скручивании. Золото вытягивается в проволоку с линейной плотностью 2 мг/м, а при ковке можно получить сусальное золото — листы толщиной 100 нм.
Химические свойства золотаВ нормальных условиях золото не вступает в реакцию с большинством химических элементов природного происхождения, не подвержено коррозии, не окисляется и не растворяется в щелочах и кислотах.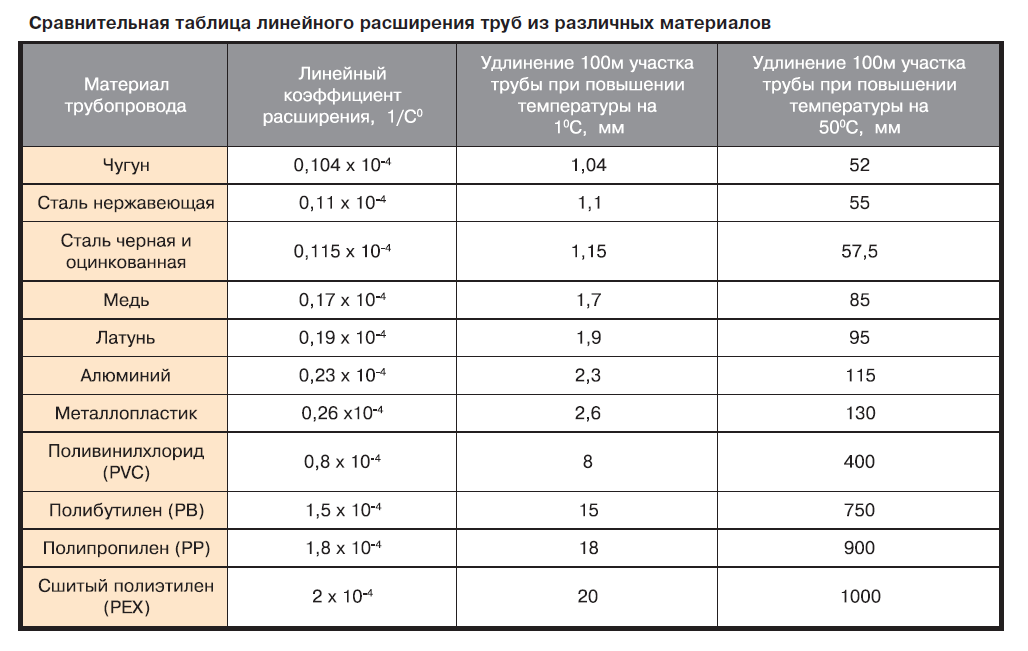
Золото взаимодействует с:
- царской водкой — смесью концентрированных соляной и азотной кислот с образованием золотохлористоводородной кислоты;
- хромовой кислотой в присутствии бромидов и хлоридов щелочных металлов;
- растворами цианида калия и натрия в присутствии кислорода образуя дицианоаураты золота;
- горячей концентрированной селеновой кислотой с образованием селената золота;
- растворами тиомочевины, тиосульфата в смеси йодида калия и йода;
- теллуром при повышенной температуре;
- галогенами, например, при комнатной температуре с порошком брома образуя трибромида золота или при нагревании с хлором с образованием трихлорида золота.
Соединения золота способны образовывать следующие комплексы:
- хлоридные;
- гидроксокомплексы;
- смешанные гидроксохлоридные;
- бромидные;
- йодидные;
- фторидные;
- сульфидные;
- гидросульфидные;
- тиосульфатные;
- цианидные;
- комплексы с органическими соединениями.

Все растворимые соединения золота характеризуются высокой токсичностью и легко восстанавливаются до металла.
Свойства золота — физические и химические
Золото, так же как серебро и шесть металлов платиновой группы, относится к благородным, или драгоценным металлам.
Первое определение (благородные металлы) отражает свойство золота крайне неохотно вступать в соединения с неметаллическими элементами, в частности с кислородом. С большинством кислот золото также не реагирует. У неблагородных металлов (меди, железа и так далее) взаимодействие с кислородом вызывает окисление — изменения структуры и внешнего вида. Золото в обычных условиях не реагирует с какими-либо природными веществами, и поэтому абсолютно не меняет внешний вид с течением времени.
Второе определение (драгоценные металлы) относится к сочетанию редкости, долговечности и красоты. Именно это позволило золоту с начала истории человечества и до 19 века оставаться самым дорогим металлом.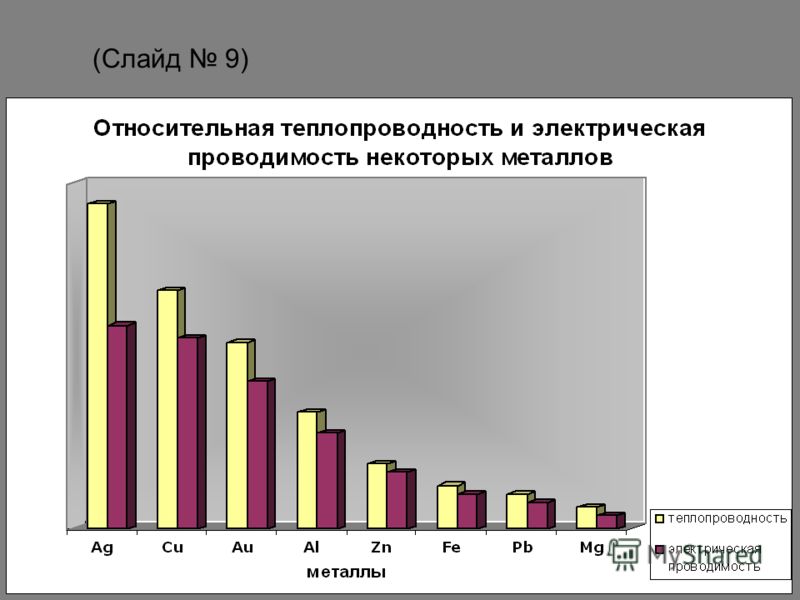
Физические свойства золота
Золото — элемент 11 группы Периодической системы химических элементов. Из известных 37 изотопов золота, в природе встречается только один стабильный изотоп – 197Au с атомным весом 197, атомным номером 79. Остальные изотопы, получаемые в атомных реакторах, нестабильны и обладают максимальным периодом полураспада в 186 дней (195Au).
В 1947 году в результате эксперимента в ядерном реакторе была осуществлена древняя мечта человечества, которую сделали своей главной целью средневековые алхимики – превращение ртути в золото. Американские физики Ингрем, Гесс и Гайдн получили 35 мг настоящего золота из ртути. Впоследствии было несколько попыток спекуляции на тему промышленного производства искусственного золота. Однако уже тогда ученые однозначно заявляли о том, что получение золота таким образом настолько дорогостоящий процесс, что он не имеет никакого экономического смысла. В итоге, кусочек искусственного золота выставлен в Музее науки и промышленности (Museum of Science and Industry) в Чикаго, и ситуация остается прежней – получать золото искусственным путем нецелесообразно.
Золото представляет собой металл желтого цвета, очень тяжелый, но при этом мягкий и пластичный.
Золото единственный металл, который в чистом виде обладает желтым цветом. Цвет золота яркий, теплый и приятный. Благодаря цвету, люди с самой древности связывали золото с солнцем.
Плотность золота составляет 19,32 г/см3 , то есть золото — очень тяжелый металл. Тяжелее его только платина, иридий, осмий и рений. Кубик золота со стороной всего 3,7 см весит 1 кг. Один кубический метр золота весит 19 320 кг, такой же объём железа будет весить почти в три раза меньше – 7 874 кг.
Температура плавления золота составляет 1064,43 °С, температура кипения — 2947°С. Золото в расплавленном состоянии имеет бледно-зеленый цвет. При нагревании выше температуры плавления начинает улетучиваться.
Золото очень мягкий металл, твердость по шкале Мооса 2,5-3,0. Сталь обладает твердостью 4,0-4,5, поэтому чистое золото можно разрезать ножом. В сплавах твердость золота значительно увеличивается, поэтому мы часто можем видеть в исторических фильмах или книгах, как раньше золото пробовали «на зуб». Действительно, выпускавшиеся ранее золотые монеты состояли почти из чистого золота и на них можно было оставить след при надкусывании. На поддельных монетах, в которых содержание золота было меньше, оставить зубами след не возможно.
В сплавах твердость золота значительно увеличивается, поэтому мы часто можем видеть в исторических фильмах или книгах, как раньше золото пробовали «на зуб». Действительно, выпускавшиеся ранее золотые монеты состояли почти из чистого золота и на них можно было оставить след при надкусывании. На поддельных монетах, в которых содержание золота было меньше, оставить зубами след не возможно.
Золото является наиболее ковким металлом. Его можно не нагревая расковать в полупрозрачные листочки, толщиной примерно от 1 до 0,1 мкм (толщина человеческого волоса от 80 до 110 мкм), которые при этом сохранят цвет и все свойства золота. Это так называемое «сусальное» золото, которым покрывают купола церквей и предметы интерьера. Из одного грамма золота получается лист площадью примерно в 0,5 м2. Таким образом, золотом можно декорировать значительные площади и практически любые материалы. При этом, стоимость самого золота будет относительно невелика и большая часть затрат уйдет на оплату работы мастера и сопутствующих материалов.
Золото очень пластичный и тягучий металл, который позволяет придавать ему любую форму, растягивать и сжимать, сгибать не ломая. К примеру, из одного грамма золота получают 100 метров проволоки диаметром 0,025 мм, которую используют в электронной промышленности для создания электрических цепей в микросхемах.
Также, широкое применение золота в производстве микроэлектроники обеспечивается его низким сопротивлением электричеству, хорошей теплопроводностью и устойчивостью к окислению.
Золото прекрасно отражает инфракрасный свет. Это свойство используют в системах остекления высотных зданий, покрывая стекла тончайшим золотым напылением, не позволяющим инфракрасным лучам проникнуть внутрь и тем самым снижая расходы на охлаждение здания. Золотым напылением покрыты визоры шлемов космонавтов. Золото в комбинации со специальным пластиком полностью защищает глаза космонавтов от агрессивных инфракрасных и ультрафиолетовых излучений, пропуская при этом видимую часть света.
Золото прекрасно поддается различным видам обработки, полировке, пайке, легко образует сплавы с другими металлами. Все эти свойства обусловили широкое применение золота для изготовления ювелирных изделий с самых древних времен.
Химические свойства золота
Химический символ золота — Au, происходит от латинского слова «aurum» — «сияющая заря».
Золото является одним из самых инертных веществ. В обычных условиях оно не реагирует с какими-либо природными веществами. Исключение составляет лишь ртуть, с которой золото при взаимодействии образует амальгаму.
Золото не растворяется в кислотах и щелочах. Исключение составляет царская водка (смесь концентрированных азотных и соляных кислот). Алхимики иллюстрировали растворение золота царской водкой изображением льва, пожирающего солнце.
Также, золото растворяется в жидком броме и в водных растворах цианидов при доступе кислорода. Медленно растворяется при взаимодействии с хлорной и бромной водой, растворе йода в йодистом калии (спиртовой раствор йода обычная вещь в бытовых аптечках).
При нагревании реакционность золота значительно возрастает. К примеру, его можно растворить в горячей концентрированной селеновой кислоте, серной кислоте при добавлении окислителя. При нагреве идет взаимодействие с галогенами и их соединениями, а также с некоторыми другими веществами.
Все соединения золота непрочны и оно достаточно легко восстанавливается до чистого металла. К примеру, соединение ртути с золотом (амальгаму) достаточно просто нагреть до температуры 750-800 °С.
В обычных бытовых условиях мало что химически может повлиять на золотые украшения, однако не следует допускать их взаимодействия с веществами, содержащими ртуть, хлор, йод.
ЮВЕЛИРНЫЕ МЕТАЛЛЫ — КАТАЛОГ | ЮВЕЛИРНЫЕ МЕТАЛЛЫ — СПРАВОЧНИК
Всё о золоте | Все о серебре | Все о платине | Все о палладии
Золотые сплавы и их цвета | Пробы для золота | Таблица физико-химических свойств драгоценных металлов | Как проверить золото на подлинность? | Как проверить платину? | Где в природе встречается золото | Основные золотые месторождения и их виды
Поделитесь статьей с друзьями
Работы дизайнеров из каталога ЮВЕЛИРУМ
Золото – Термические свойства – Температура плавления – Теплопроводность
О золоте
Золото – яркий, слегка красновато-желтый, плотный, мягкий, ковкий и пластичный металл. Золото является переходным металлом и элементом 11 группы. Это один из наименее реакционноспособных химических элементов, твердый при стандартных условиях. Считается, что золото образовалось в результате нуклеосинтеза сверхновых в результате столкновения нейтронных звезд.
Золото является переходным металлом и элементом 11 группы. Это один из наименее реакционноспособных химических элементов, твердый при стандартных условиях. Считается, что золото образовалось в результате нуклеосинтеза сверхновых в результате столкновения нейтронных звезд.
Термические свойства золота
Золото – точка плавления и температура кипения
Температура плавления золота 1064°C .
Температура кипения золота 2970°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Золото – Теплопроводность
Теплопроводность Золото составляет 320 Вт/(м·К).
Характеристики теплопередачи твердого материала измеряются свойством, называемым теплопроводность , k (или λ), измеренная в Вт/м.K . Это мера способности вещества передавать тепло через материал за счет теплопроводности. Обратите внимание, что закон Фурье применим ко всей материи, независимо от ее состояния (твердое, жидкое или газообразное), поэтому он также определен для жидкостей и газов.
Обратите внимание, что закон Фурье применим ко всей материи, независимо от ее состояния (твердое, жидкое или газообразное), поэтому он также определен для жидкостей и газов.
Коэффициент теплового расширения золота
Коэффициент линейного теплового расширения золота 14,2 мкм/(м·K)
Тепловое расширение обычно это склонность материи изменять свои размеры в ответ на изменение температуры. Обычно его выражают в виде доли изменения длины или объема на единицу изменения температуры.
См. также: Механические свойства золота
Температура плавления элементов
Теплопроводность элементов
Тепловое расширение элементов
О температуре кипения и температуре кипения0010 Температура кипения
В общем, кипение является фазовым переходом вещества из жидкой фазы в газовую. температура кипения вещества — это температура, при которой происходит это фазовое превращение (кипение или испарение). Температура, при которой начинает происходить испарение (кипение) при заданном давлении, также известна как температура насыщения , и при этих условиях смесь пара и жидкости может существовать вместе. Можно сказать, что жидкость насыщена тепловой энергией. Любое добавление тепловой энергии приводит к фазовому переходу. точка кипения две фазы вещества, жидкость и пар, имеют одинаковую свободную энергию и, следовательно, с одинаковой вероятностью существуют. Ниже точки кипения жидкость является более стабильным состоянием из двух, тогда как выше предпочтительна газообразная форма. Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения . Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Температура, при которой начинает происходить испарение (кипение) при заданном давлении, также известна как температура насыщения , и при этих условиях смесь пара и жидкости может существовать вместе. Можно сказать, что жидкость насыщена тепловой энергией. Любое добавление тепловой энергии приводит к фазовому переходу. точка кипения две фазы вещества, жидкость и пар, имеют одинаковую свободную энергию и, следовательно, с одинаковой вероятностью существуют. Ниже точки кипения жидкость является более стабильным состоянием из двух, тогда как выше предпочтительна газообразная форма. Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения . Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Как видно, температура кипения жидкости варьируется в зависимости от давления окружающей среды. Жидкость в частичном вакууме имеет более низкую температуру кипения, чем когда эта жидкость находится при атмосферном давлении. Жидкость при высоком давлении имеет более высокую температуру кипения, чем при атмосферном давлении. Например, вода кипит при 100°C (212°F) на уровне моря, но при 93,4°C (200,1°F) на высоте 1900 метров (6233 фута). С другой стороны, вода кипит при 350°C (662°F) при 16,5 МПа (типичное давление PWR).
Жидкость в частичном вакууме имеет более низкую температуру кипения, чем когда эта жидкость находится при атмосферном давлении. Жидкость при высоком давлении имеет более высокую температуру кипения, чем при атмосферном давлении. Например, вода кипит при 100°C (212°F) на уровне моря, но при 93,4°C (200,1°F) на высоте 1900 метров (6233 фута). С другой стороны, вода кипит при 350°C (662°F) при 16,5 МПа (типичное давление PWR).
В периодической таблице элементов элемент с самой низкой температурой кипения — гелий. Обе точки кипения рения и вольфрама превышают 5000 К при стандартном давлении. Поскольку трудно точно и беспристрастно измерить экстремальные температуры, в литературе упоминаются оба вещества с более высокой температурой кипения.
Точка плавления
В общем, плавление является фазовым переходом вещества из твердого состояния в жидкое. Точка плавления вещества – это температура, при которой происходит это фазовое превращение. Точка плавления также определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое тело в жидкость без изменения температуры. В точке плавления две фазы вещества, жидкая и паровая, имеют одинаковую свободную энергию и поэтому с равной вероятностью существуют. Ниже точки плавления твердое состояние является более стабильным из двух, тогда как при температуре выше точки плавления предпочтительна жидкая форма. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
Точка плавления также определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое тело в жидкость без изменения температуры. В точке плавления две фазы вещества, жидкая и паровая, имеют одинаковую свободную энергию и поэтому с равной вероятностью существуют. Ниже точки плавления твердое состояние является более стабильным из двух, тогда как при температуре выше точки плавления предпочтительна жидкая форма. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
См. также: Понижение точки плавления
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебания атомов в кристалле для объяснения перехода плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничивается колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы колеблются быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушительные колебания частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничивается колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы колеблются быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушительные колебания частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Как и в случае с точками кипения, точка плавления твердого тела зависит от силы этих сил притяжения. Например, хлорид натрия (NaCl) представляет собой ионное соединение, состоящее из множества сильных ионных связей. Хлорид натрия плавится при 801°С. С другой стороны, лед (твердый H 2 O) представляет собой молекулярное соединение, молекулы которого удерживаются вместе водородными связями, что является эффективным примером взаимодействия между двумя постоянными диполями. Хотя водородные связи являются самыми сильными из межмолекулярных сил, прочность водородных связей намного меньше, чем у ионных связей. Температура плавления льда 0°С.
Например, хлорид натрия (NaCl) представляет собой ионное соединение, состоящее из множества сильных ионных связей. Хлорид натрия плавится при 801°С. С другой стороны, лед (твердый H 2 O) представляет собой молекулярное соединение, молекулы которого удерживаются вместе водородными связями, что является эффективным примером взаимодействия между двумя постоянными диполями. Хотя водородные связи являются самыми сильными из межмолекулярных сил, прочность водородных связей намного меньше, чем у ионных связей. Температура плавления льда 0°С.
Ковалентные связи часто приводят к образованию небольших наборов лучше связанных атомов, называемых молекулами, которые в твердых телах и жидкостях связаны с другими молекулами силами, которые часто намного слабее, чем ковалентные связи, удерживающие молекулы вместе внутри. Такие слабые межмолекулярные связи придают органическим молекулярным веществам, таким как воски и масла, их мягкий объемный характер и низкие температуры плавления (в жидкостях молекулы должны прекратить наиболее структурированный или ориентированный контакт друг с другом).
О теплопроводности
Характеристики теплопередачи твердого материала измеряются свойством, называемым теплопроводностью , k (или λ), измеряемой в Вт/м·K . Это мера способности вещества передавать тепло через материал за счет теплопроводности. Обратите внимание, что закон Фурье применим ко всей материи, независимо от ее состояния (твердое, жидкое или газообразное), поэтому он также определен для жидкостей и газов.
Теплопроводность большинства жидкостей и твердых тел зависит от температуры. Для паров это также зависит от давления. В общем:
Большинство материалов почти однородны, поэтому обычно мы можем написать k = k (T) . Аналогичные определения связаны с теплопроводностями в направлениях y и z (ky, kz), но для изотропного материала теплопроводность не зависит от направления переноса, kx = ky = kz = k.
Теплопроводность металлов
Перенос тепловой энергии в твердых телах обычно может быть обусловлен двумя эффектами:
- миграцией свободных электронов
- решеточные колебательные волны (фононы)
Когда электроны и фононы переносят тепловую энергию, приводящую к теплопроводности в твердом теле, теплопроводность может быть выражена как:0014 являются твердыми телами и поэтому обладают кристаллической структурой, в которой ионы (ядра с окружающими их оболочками остовных электронов) занимают трансляционно эквивалентные позиции в кристаллической решетке. Металлы обычно имеют высокую электропроводность , высокую теплопроводность и высокую плотность. Соответственно перенос тепловой энергии может быть обусловлен двумя эффектами:
Металлы обычно имеют высокую электропроводность , высокую теплопроводность и высокую плотность. Соответственно перенос тепловой энергии может быть обусловлен двумя эффектами:
- миграцией свободных электронов
- решетчатые колебательные волны (фононы).
Когда электроны и фононы переносят тепловую энергию, приводящую к теплопроводности в твердом теле, коэффициент теплопроводности может быть выражен как: структура связана с наличием носителей заряда, в частности  Напротив, для сплавов вклад k ph в k больше не является незначительным.
Напротив, для сплавов вклад k ph в k больше не является незначительным.
Теплопроводность неметаллов
Для неметаллические твердые вещества , k определяется, прежде всего, k ph , которое увеличивается по мере уменьшения частоты взаимодействий между атомами и решеткой. Фактически, решеточная теплопроводность является доминирующим механизмом теплопроводности в неметаллах, если не единственным. В твердых телах атомы колеблются вокруг своих положений равновесия (кристаллическая решетка). Колебания атомов не независимы друг от друга, а довольно сильно связаны с соседними атомами. Регулярность расположения решетки оказывает важное влияние на k ph , с кристаллическими (хорошо упорядоченными) материалами, такими как кварц , имеющими более высокую теплопроводность, чем аморфные материалы, такие как стекло. При достаточно высоких температурах k ph ∝ 1/T.
квантов колебательного поля кристалла называются « фононов ». Фонон — это коллективное возбуждение в периодическом упругом расположении атомов или молекул в конденсированных средах, таких как твердые тела и некоторые жидкости. Фононы играют важную роль во многих физических свойствах конденсированного вещества, таких как теплопроводность и электропроводность. Фактически, для кристаллических неметаллических твердых тел, таких как алмаз, k ph может быть довольно большим, превышая значения k, связанные с хорошими проводниками, такими как алюминий. В частности, алмаз обладает самой высокой твердостью и теплопроводностью (k = 1000 Вт/м·К) среди всех объемных материалов.
Теплопроводность жидкостей и газов
В физике жидкость — это вещество, которое постоянно деформируется (течет) под действием приложенного напряжения сдвига. Жидкости являются подмножеством фаз материи и включают жидкости , газы , плазму и, в некоторой степени, пластичные твердые тела. Поскольку межмолекулярное расстояние намного больше, а движение молекул более хаотично для жидкого состояния, чем для твердого состояния, транспорт тепловой энергии менее эффективен. Следовательно, теплопроводность газов и жидкостей обычно меньше, чем у твердых тел. В жидкостях теплопроводность обусловлена атомной или молекулярной диффузией. В газах теплопроводность обусловлена диффузией молекул с более высокого энергетического уровня на более низкий уровень.
Поскольку межмолекулярное расстояние намного больше, а движение молекул более хаотично для жидкого состояния, чем для твердого состояния, транспорт тепловой энергии менее эффективен. Следовательно, теплопроводность газов и жидкостей обычно меньше, чем у твердых тел. В жидкостях теплопроводность обусловлена атомной или молекулярной диффузией. В газах теплопроводность обусловлена диффузией молекул с более высокого энергетического уровня на более низкий уровень.
Теплопроводность газов
Влияние температуры, давления и химических веществ на теплопроводность газа можно объяснить с точки зрения кинетической теории газов . Воздух и другие газы обычно являются хорошими изоляторами при отсутствии конвекции. Таким образом, многие изоляционные материалы (например, полистирол) функционируют просто благодаря большому количеству заполненных газом карманов , которые предотвращают широкомасштабную конвекцию . Чередование газового кармана и твердого материала приводит к тому, что тепло должно передаваться через множество поверхностей раздела, что приводит к быстрому снижению коэффициента теплопередачи.
Чередование газового кармана и твердого материала приводит к тому, что тепло должно передаваться через множество поверхностей раздела, что приводит к быстрому снижению коэффициента теплопередачи.
Теплопроводность газов прямо пропорциональна плотности газа, средней молекулярной скорости и особенно средней длине свободного пробега молекулы. Длина свободного пробега также зависит от диаметра молекулы, причем более крупные молекулы с большей вероятностью столкнутся, чем мелкие молекулы, что представляет собой среднее расстояние, пройденное энергоносителем (молекулой) до столкновения. Легкие газы, такие как водород и гелий обычно имеют высокую теплопроводность . Плотные газы, такие как ксенон и дихлордифторметан, обладают низкой теплопроводностью.
Как правило, теплопроводность газов увеличивается с повышением температуры.
Теплопроводность жидкостей
Как уже писалось, в жидкостях теплопроводность обусловлена атомной или молекулярной диффузией, но физические механизмы объяснения теплопроводности жидкостей изучены недостаточно.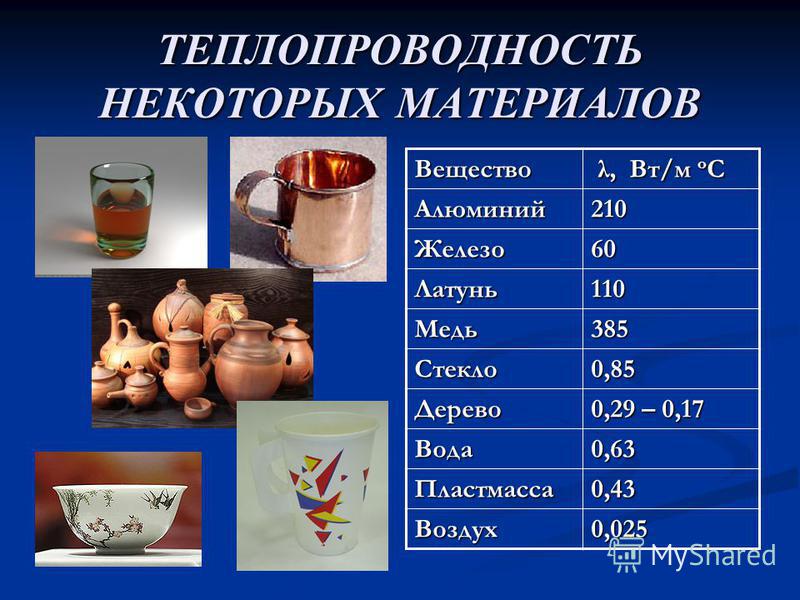 Жидкости, как правило, обладают лучшей теплопроводностью, чем газы, а способность течь делает жидкость подходящей для отвода избыточного тепла от механических компонентов. Тепло можно отводить, пропуская жидкость через теплообменник. Теплоносители, используемые в ядерных реакторах, включают воду или жидкие металлы, такие как натрий или свинец.
Жидкости, как правило, обладают лучшей теплопроводностью, чем газы, а способность течь делает жидкость подходящей для отвода избыточного тепла от механических компонентов. Тепло можно отводить, пропуская жидкость через теплообменник. Теплоносители, используемые в ядерных реакторах, включают воду или жидкие металлы, такие как натрий или свинец.
Теплопроводность неметаллических жидкостей обычно уменьшается с повышением температуры.
О тепловом расширении
Тепловое расширение обычно это тенденция материи изменять свои размеры в ответ на изменение температуры. Обычно его выражают в виде доли изменения длины или объема на единицу изменения температуры. Тепловое расширение характерно для твердых тел, жидкостей и газов. В отличие от газов или жидкостей, твердые материалы, как правило, сохраняют свою форму при тепловом расширении. А коэффициент линейного расширения обычно используется для описания расширения твердого тела, в то время как коэффициент объемного расширения более полезен для жидкости или газа.
Коэффициент линейного теплового расширения определяется как:
, где L – это конкретная длина, а dL/dT – скорость изменения этого линейного размера на единицу изменения температуры.
Коэффициент объемного теплового расширения является основным коэффициентом теплового расширения и наиболее важным для жидкостей. Как правило, вещества расширяются или сжимаются при изменении их температуры, причем расширение или сжатие происходит во всех направлениях.
Коэффициент объемного теплового расширения определяется как:
, где л является объемом материала, а dV/dT является скоростью изменения этого объема на единицу изменения температуры.
В твердом теле или жидкости существует динамическое равновесие между силами сцепления, удерживающими атомы или молекулы вместе, и условиями, создаваемыми температурой. Поэтому более высокие температуры подразумевают большее расстояние между атомами. Разные материалы имеют разную силу сцепления и, следовательно, разные коэффициенты расширения. Если кристаллическое твердое тело изометрично (имеет во всем одинаковую структурную конфигурацию), расширение будет равномерным во всех измерениях кристалла. Для этих материалов коэффициент площади и объемного теплового расширения соответственно примерно в два и три раза больше линейного коэффициента теплового расширения ( α V = 3α L ). Если он не изометричен, могут быть разные коэффициенты расширения для разных кристаллографических направлений, и кристалл будет менять форму при изменении температуры.
Разные материалы имеют разную силу сцепления и, следовательно, разные коэффициенты расширения. Если кристаллическое твердое тело изометрично (имеет во всем одинаковую структурную конфигурацию), расширение будет равномерным во всех измерениях кристалла. Для этих материалов коэффициент площади и объемного теплового расширения соответственно примерно в два и три раза больше линейного коэффициента теплового расширения ( α V = 3α L ). Если он не изометричен, могут быть разные коэффициенты расширения для разных кристаллографических направлений, и кристалл будет менять форму при изменении температуры.
Сводка
| Элемент | Золото |
| Точка плавления | 1064 °С |
| Точка кипения | 2970 °C |
| Теплопроводность | 320 Вт/мК |
| Коэффициент теплового расширения | 14,2 мкм/мК |
| Плотность | 19,3 г/см3 |
Источник: www. luciteria.com
luciteria.com
Свойства других элементов
Другие свойства Gold
Измерение теплопроводности золотых нанопроволок и нанопленок
Abstract
Создание сложных интегральных схем и устройств путем миниатюризации до наномасштаба все больше зависит от понимания тепловых свойств материалов, используемых в этих компонентах. Проводники в наномасштабе обладают свойствами, которые существенно отличаются от их объемных или тонкопленочных аналогов. Например, наноструктурированное золото в настоящее время используется в самых разных областях, включая межсоединения, солнечные элементы, гибкие экраны, обнаружение раковых клеток и накопление энергии. Управление температурой в наномасштабе поставило перед отраслью серьезные проблемы, которые напрямую влияют на максимальный ток и мощность, скорость, надежность и срок службы устройств, где важным фактором является так называемый самонагрев.
Эта диссертация посвящена разработке и тестированию метода, используемого для получения прямых экспериментальных данных по теплопроводности для нанопленок и нанопроволок. Подход применяется к золоту с размерами толщины 50 и 100 нм. Исследованные латеральные размеры находятся в диапазоне от 74 до 720 нм, таким образом охватывая микро- и нано-режимы. Основными компонентами этого исследования являются методология изготовления и измерения для прямых исследований теплопроводности на наноуровне. Как проектирование, так и анализ данных основаны на обширном моделировании методом конечных элементов.
Основными компонентами этого исследования являются методология изготовления и измерения для прямых исследований теплопроводности на наноуровне. Как проектирование, так и анализ данных основаны на обширном моделировании методом конечных элементов.
Экспериментальные результаты включают наблюдаемое снижение теплопроводности по мере уменьшения толщины пленки для любого исследованного поперечного размера. При большой латеральной ширине, соответствующей микромасштабу, значения теплопроводности составляют 280 и 200 Вт/мК для толщин 100 и 50 нм соответственно. Их следует сравнить с принятым значением теплопроводности объемного золота 317 Вт/мК. Кроме того, по мере уменьшения последней для любой толщины наблюдается характерное уменьшение, начиная с ширины ~300 нм. Для самой маленькой исследованной нанопроволоки толщиной 50 нм и шириной 74 нм получено значение теплопроводности = 56 Вт/мК. Полученные тенденции подтверждаются данными, имеющимися в литературе. Уменьшение теплопроводности с уменьшением размера также согласуется с теоретическими расчетами для золота, тем самым подтверждая заявленный подход к уравнению переноса Больцмана.

