Формула металлический цинк – Формула цинка в химии
alexxlab | 06.09.2016 | 0 | Вопросы и ответы
Металлический цинк
Когда впервые был выплавлен металлический цинк, точно не установлено. Известно, что в Индии его получали еще в V в. до н.э. Получение металлического цинка (под названием тутии или фальшивого серебра) описано у римского историка Страбона (60-20 годы до н.э.). Позже, однако, искусство выплавки цинка в Европе было утрачено. Правда, цинк ввозили из стран Востока, но в очень небольших количествах, и до середины XVIII в. он оставался редкостью.
Лишь в 1743 г. в Бристоле заработал первый в Европе цинковый завод. А ведь еще в конце XIII в. Марко Поло описывал, как получают этот металл в Персии. Крупнейшие ученые XVI в. Парацельс и Агрикола в своих трудах уделяли место выплавке цинка. В том же XVI в. были предприняты первые попытки выплавлять его в заводских условиях. Но производство «не пошло», технологические трудности оказались непреодолимыми. Цинк пытались получать точно так же, как и другие металлы. Руду обжигали, превращая цинк в окись, затем эту окись восстанавливали углем…
Цинк, естественно, восстанавливался, взаимодействуя с углем, но. не выплавлялся. Не выплавлялся потому, что этот металл уже в плавильной печи испарялся — температура его кипения всего 906°С. А в печи был воздух. Встречая его, пары активного цинка реагировали с кислородом, и вновь образовывался исходный продукт — окись цинка.
Наладить цинковое производство в Европе удалось лишь после того, как руду стали восстанавливать в закрытых ретортах без доступа воздуха. Примерно так же «черновой» цинк получают и сейчас, а очищают его рафинированием. Пирометаллургическим способом сейчас получают примерно половину производимого в мире цинка, а другую половину — гидрометаллургическим.
Следует иметь в виду, что чисто цинковые руды в природе почти не встречаются. Соединения цинка (обычно 1-5% в пересчете на металл) входят в состав полиметаллических руд. Полученные при обогащении руды цинковые концентраты содержат 48-65% Zn, до 2% меди, до 2% свинца, до 12% железа. И плюс доли процента рассеянных и редких металлов.
Сложный химический и минералогический состав руд, содержащих цинк, был одной из причин, по которым цинковое производство рождалось долго и трудно. В переработке полиметаллических руд и сейчас еще есть нерешенные проблемы… Но вернемся к пирометаллургии элемента № 30 — в этом процессе проявляются сугубо индивидуальные особенности этого элемента.
При резком охлаждении пары цинка сразу же, минуя жидкое состояние, превращаются в твердую пыль. Это несколько осложняет производство, хотя элементный цинк считается нетоксичным. Часто бывает нужно сохранить цинк именно в виде пыли, а не переплавлять его в слитки.
В пиротехнике цинковую пыль применяют, чтобы получить голубое пламя. Цинковая пыль используется в производстве редких и благородных металлов. В частности, таким цинком вытесняют золото и серебро из цианистых растворов. Как ни парадоксально, но и при получении самого цинка (и кадмия) гидрометаллургическим способом применяется цинковая пыль — для очистки раствора сульфата цинка от меди и кадмия. Но это еще не все. Вы никогда не задумывались, почему металлические мосты, пролеты заводских цехов и другие крупногабаритные изделия из металла чаще всего окрашивают в серый цвет?
Главная составная часть применяемой во всех этих случаях краски — все та же цинковая пыль. Смешанная с окисью цинка и льняным маслом, она превращается в краску, которая отлично предохраняет от коррозии. Эта краска к тому же дешева, эластична, хорошо прилипает к поверхности металла и не отслаивается при температурных перепадах. Мышиный цвет тоже скорее достоинство, чем недостаток. Изделия, которые покрывают такой краской, должны быть немарки и в то же время опрятны.
На свойствах цинка сильно сказывается степень его чистоты. При 99,9 и 99,99% чистоты цинк хорошо растворяется в кислотах. Но стоит «прибавить» еще одну девятку (99,999%), и цинк становится нерастворимым в кислотах даже при сильном нагревании. Цинк такой чистоты отличается и большой пластичностью: его можно вытягивать в тонкие нити. А обычный цинк можно прокатать в тонкие листы, лишь нагрев его до 100-150°С. Нагретый до 250°С и выше, вплоть до точки плавления, цинк опять становится хрупким — происходит очередная перестройка его кристаллической структуры.
Применение цинка
Листовой цинк широко применяют в производстве гальванических элементов. Первый «вольтов столб» состоял из кружочков цинка и меди. И в современных химических источниках тока отрицательный электрод чаще всего делается из элемента № 30.
Значительна роль этого элемента в полиграфии. Мы уже упоминали о типографских сплавах на основе цинка, но главное в другом. Из цинка делают клише, позволяющие воспроизвести в печати рисунки и фотографии. Специально приготовленный и обработанный типографский цинк воспринимает фотоизображение. Это изображение в нужных местах защищают краской, и будущее клише протравливают кислотой. Изображение приобретает рельефность, опытные граверы подчищают его, делают пробные оттиски, а потом эти клише идут в печатные машины.
К полиграфическому цинку предъявляют особые требования: прежде всего он должен иметь мелкокристаллическую структуру, особенно на поверхности слитка. Поэтому цинк, предназначенный для полиграфии, всегда отливают в закрытые формы. Для «выравнивания» структуры применяют отжиг при 375°С с последующим медленным охлаждением и горячей прокаткой. Строго лимитируют и присутствие в таком металле примесей, особенно свинца. Если его много, то нельзя будет вытравить клише так, как это нужно. Если же свинца меньше 0,4%, то трудно получить нужную мелкокристаллическую структуру. Вот по этой кромке и «ходят» металлурги, стремясь удовлетворить запросы полиграфии.
natural-museum.ru
свойства, характеристики и применение элемента
Цинк – это металл, стоящий в таблице Менделеева, под номером 30 и имеет обозначение Zn. Плавится при температуре 419 °С градусов, если же температура кипения 913 °С – начинает превращаться в пар. При температурном обычном режиме, состояние хрупкое, а при ста градусах начинает гнуться.
Цвет цинка сине-белый. При воздействии кислорода появляется окисление, а также покрытие карбоната, предохраняющего металл от дальнейшей реакции окисления. Появление на цинке гидроокиси обозначает то, что вода на химический элемент не действует.
Цинк — химический элемент, имеет свои отличительные свойства, преимущества и недостатки. Он широко применяется в повседневной жизни человека, в фармацевтике и металлургии.
 Цинк
ЦинкОсобенности цинка
Металл является необходимым и широко применяемым практически во всех отраслях повседневной жизни человека.
Добыча в основном, производится в Иране, Казахстане, Австралии, Боливии. В России изготовителем является ОАО «ГМК Дальполиметалл».
Это переходной металл, имеет степень окисления +2, радиоактивный изотоп, период полураспада 244 дня.

Водный арсенат кадмия, цинка и меди
В чистом виде элемент не добывается. Содержится в рудах и минералах: клейофане, марматите, вюртците, цинките. Обязательно присутствует в сплаве с алюминием, медью, оловом, никелем.
Химические, физические свойства и характеристики цинка
Цинк – металл, обладает рядом свойств и характеристик, отличающих его от иных элементов периодической таблицы.
К физическим свойствам цинка относится его состояние. Основным фактором выступает температурный режим. Если при комнатной температуре это хрупкий материал, плотность цинка 7130 кг/м3 (˃ плотности стали), который практически не гнётся, то при повышении он легко изгибается и прокатывается в листах на заводах. Если взять более высокий температурный режим – материал приобретает жидкое состояние, а если еще поднять температуру на 400-450 °С градусов, тогда он просто испарится. В этом уникальность – менять своё состояние. Если же подействовать кислотами и щелочами, он может рассыпаться, взорваться, расплавиться.

Цинк в жидком состоянии
Формула цинка Zn – zincum. Атомная масса цинка 65.382 а.е.м.
Электронная формула: ядро атома металла содержит 30 протон, 35 нейтрон. В атоме 4 энергетических уровня – 30 электронов. (рис. строение атома цинка)1s22s22p63s23p63d104s2.
Кристаллическая решётка цинка – шестиугольная кристаллическая система с плотно прижатыми атомами. Данные решётки: A=2.66У, С=4.94.
Структура и состав цинка
Добытый и не переработанный материал имеет изотопы 64, 66, 67, электроны 2-8-18-2.
По применению среди всех элементов периодической таблицы металл стоит на 23 месте. В природе элемент выступает в виде сульфида с примесями свинца Pb, кадмия Cd, железа Fe, меди Cu, серебра Ag.

Сульфид цинка
В зависимости от того, какое количество примесей, металл имеет маркировку.
Производство цинка
Как было сказано выше, чистого вида данного элемента в природе нет. Он добывается из иных пород, таких как руда – кадмий, галлий, минералы – сфалерит.
Металл получают на заводе. Каждый завод имеет свои отличительные особенности производства, поэтому оборудование для получения чистого материала различно. Оно может быть таким:
- Роторы, расположенные вертикально, электролитные.
- Специальные печи с достаточно высокой температурой для обжига, а также специальные электропечи.
- Транспортёры и ванны для электролиза.
В зависимости от принимаемого метода добычи металла, задействовано соответствующее оборудование.
Получение чистого цинка
Как упоминалось выше – в природе чистого вида нет. В основном добыча производится из руд, в которых он идет с различными элементами.
Для получения чистого материала задействован специальный флотационный процесс с избирательностью (селективностью). После проведения процесса руда распадается на элементы: цинк, свинец, медь и так далее.
Добытый таким методом чистый металл обжигается в специальной печи. Там при определенных температурах сульфидное состояние материала переходит в оксидное. При обжиге выделяется газ с содержанием серы, направляемый для получения серной кислоты.

Чистый цинк
Есть 2 способа получения металла:
- Пирометаллургический – идет процесс обжигания, после — полученная масса восстанавливается с помощью чёрного угля и кокса. Конечным процессом является отстаивание.
- Электролитический – добытая масса обрабатывается серной кислотой. Полученный раствор подвергают электролизу, при этом металл оседает, его плавят в печах.
Выплавка цинка в печи
Температура плавления цинка в печи 419-480 °С градусов. Если же температурный режим превышен, тогда материал начинает испаряться. При данной температуре допускается примесь железа 0.05%.
При процентной ставке 0.2 железа, лист невозможно будет прокатать.
Применяются различные способы выплавки чистого металла, вплоть до получения цинковых паров, которые направляются в специальные резервуары и там вещество опадает вниз.
Применение металла
Свойства цинка позволяют его применение во многих сферах. В процентном соотношении:
- Цинкование – до 60%.
- Медицина – 10%.
- Различные сплавы, содержащие данный металл 10%.
- Выпуск шин 10%.
- Производство красок – 10%.

Медно-цинковый сплав
А также применение цинка необходимо для восстановления таких металлов, как золото, серебро, платина.
Цинк в металлургии
Металлургическая промышленность задействует данный элемент периодической таблицы как основной для достижения определенных целей. Выплавка чугуна, стали является главной во всей металлургии страны. Но, данные металлы подвержены негативному влиянию окружающей среды. Без определенной обработки идет быстрое окисление металлов, что приводит к их порче. Наилучшей защитой служит оцинкование.
Нанесение защитной плёнки на чугун и сталь является лучшим средством от коррозии. На оцинкование уходит около 40% всего производства чистого материала.
Способы оцинкования
Металлургические заводы отличительны не только своим оборудованием, но и применяемыми методами производства. Это зависит от ценовой политики, и месторасположения (природных ресурсов, используемых для металлургической промышленности). Есть несколько методов оцинкования, которые рассматриваются ниже.
Горячий способ оцинкования
Данный способ заключается в обмакивании металлической детали в жидком растворе. Происходит это так:
- Деталь или изделие обезжиривается, очищается, промывается и сушится.
- Далее, цинк расплавляется до жидкого состояния при температуре до 480 °С.
- В жидкий раствор опускается подготовленное изделие. При этом оно хорошо смачивается в растворе и образуется покрытие толщиной до 450 мкм. Это является 100% защитой от воздействия внешних факторов на изделие (влага, прямые солнечные лучи, вода с химическими примесями).

Горячее цинкование металлоконструкций
Но, данный метод имеет ряд недостатков:
- Цинковая пленка на изделии получается неравномерного слоя.
- Нельзя использовать данный метод для деталей, отвечающих точным стандартам по ГОСТу. Где каждый миллиметр считается браком.
- После горячего оцинкования, не каждая деталь останется прочной и износостойкой, поскольку после прохождения высокой температуры появляется хрупкость.
А также данный метод не подходит для изделий, покрытых лакокрасочными материалами.
Холодное оцинкование
Этот метод носит 2 названия: гальванический и электролитический. Методика покрытия изделия защитой от коррозии такова:
- Металлическая деталь, изделие подготавливается (обезжиривается, очищается).
- После этого проводится «метод окрашивания» — применяется специальный состав, имеющий главный компонент – цинк.
- Деталь покрывается данным составом методом распыления.

Холодное цинкование
Благодаря этому методу защитой покрываются детали с точным допуском, изделия, покрытые лакокрасочными материалами. Повышается стойкость к внешним факторам, приводящим к коррозии.
Недостатки данного метода: тонкий защитный слой – до 35 мкм. Это приводит к меньшей защите и небольшим срокам защиты.
Термодиффузионный способ
Данный метод делает покрытие, которое является электродом с положительной полярностью, в то время как металл изделия (сталь) становится отрицательной полярности. Появляется электрохимический защитный слой.
Метод применим только в случае, если детали произведены из углеродистой стали, чугуна, стали с примесями. Цинк используется таким образом:
- При температуре от 290 °С до 450 °С в порошковой среде, поверхность детали насыщается Zn. Здесь маркировка стали, а также тип изделия имеют значение – выбирается соответствующая температура.
- Толщина защитного слоя достигает 110 мкм.
- В закрытый резервуар помещается изделие из стали, чугуна.
- Добавляется туда специальная смесь.
- Последним шагом является специальная обработка изделия от появления белых высолов от солёной воды.

Термодиффузионное цинкование
В основном данным методом пользуются в случае, если требуется покрыть детали, имеющие сложную форму: резьбу, мелкие штрихи. Образование равномерного защитного слоя является важным, поскольку данные детали претерпевают множественное воздействие внешней агрессивной среды (постоянная влага).
Данный метод дает самый большой процент защиты изделия от коррозии. Оцинкованное напыление является износостойким и практически нестираемым, что очень важно для деталей, которые время о времени крутятся и разбираются.
Иные сферы применения цинка
Помимо оцинкования, металл применяется и в других сферах промышленности.
- Цинковые листы. Для производства листа выполняется прокатка, в которой важна пластичность. Это зависит от температурного режима. Температура в 25 °С дает пластичность только в одной плоскости, что создает определенные свойства металла. Тут главное для чего изготавливается лист. Чем выше температура, тем тоньше получается металл. В зависимости от этого идет маркировка изделия Ц1, Ц2, Ц3. После этого из листов создаются различные изделия для автомобилей, профиля для строительства и ремонта, для полиграфии и так далее.
- Цинковые сплавы. Для улучшенных свойств металлических изделий, добавляется цинк. Данные сплавы создаются при высоких температурах в специальных печах. Чаще всего производятся сплавы из меди, алюминия. Данные сплавы применяются для производства подшипников, различных втулок, которые применимы в машиностроении, судостроении и авиации.
В домашнем обиходе оцинкованное ведро, корыто, листы на крыше – это норма. Применяется цинк, а не хром или никель. И дело не только в том, что оцинкование дешевле, чем покрытие другими материалами. Это наиболее надёжный и продолжительный по службе эксплуатации защитный материал нежели, хром или другие применяемые материалы.
В итоге – цинк наиболее распространенный металл, применяемый широко в металлургии. В машиностроении, строительстве, медицине – материал применим не только как защита от коррозии, но и для увеличения прочности, продолжительного срока эксплуатации. В частных домах оцинкованные листы защищают крышу от осадков, в зданиях выравниваются стены и потолки гипсокартонными листами на основе оцинкованных профилей.
Практически у каждой хозяйки в доме есть оцинкованное ведро, корыто, которым она пользуется длительное время.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
Цинк — общая характеристика элемента, химические свойства цинка и его соединений

В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d104s2. В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2;
ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl 2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см3, при температуре выше 125°С разлагается:
Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
himege.ru
нахождение в природе, получение, производство. Физические и химические свойства цинка
Своё название цинк получил с лёгкой руки Парацельса, назвавшего этот металл «zincum» («zinken»). В переводе с немецкого это означает «зубец» – именно такую форму имеют кристаллиты металлического цинка.
Нахождение цинка в природе
В чистом виде цинк в природе не встречается, однако он содержится в земной коре, в воде и даже практически в каждом живом организме. Его добыча чаще всего осуществляется из минералов: цинкита, виллемита, каламина, смитсонита и сфалерита. Последний является наиболее распространенным, а его основную часть составляет сульфид ZnS. Сфалерит в переводе с греческого – обманка. Такое название он получил из-за трудности определения минерала.
Zn можно обнаружить в термальных водах, где он постоянно мигрирует, осаждаясь в виде того же сульфида. В роли главного осадителя цинка выступает сероводород. В качестве биогенного элемента цинк активно участвует в жизни многих организмов, причем некоторые из них концентрируют в себе этот элемент (отдельные виды фиалок).
Наиболее крупными месторождениями минералов с содержанием Zn располагают Боливия и Австралия. Основные месторождения цинка в России находятся в Восточно-Сибирском и Уральском регионах. Общие прогнозируемые запасы страны – 22,7 млн. т.
Цинк: производство
Главное сырье для добычи цинка – это полиметаллическая руда, содержащая сульфид Zn в количестве 1-4 %. В дальнейшем это сырьё обогащается селективной флотацией, позволяющей получить цинковый концентрат (до 50-60 % Zn). Его помещают в печи, превращая сульфид в оксид ZnO. Затем обычно применяется дистилляционный (пирометаллургический) способ получения чистого Zn: концентрат обжигается и спекается до состояния зернистости и газопроницаемости, после чего восстанавливается коксом или углем при температуре 1200-1300°C. Простая формула показывает, как из оксида цинка получить цинк:
ZnO+С=Zn+CO
Данный способ позволяет добиться 98,7-процентной чистоты металла. Если же необходима чистота в 99,995%, применяется технологически более сложная очистка концентрата ректификацией.
Физические и химические свойства цинка
Элемент Zn, с атомной (молярной) массой 65,37 г/моль занимает в таблице Менделеева ячейку под номером 30. Чистый цинк – это металл сине-белого цвета с характерным металлическим блеском. Его основные характеристики:
- плотность – 7,13 г/см3
- температура плавления – 419,5оС (692,5 К)
- температура кипения – 913оС (1186 К)
- удельная теплоемкость цинка – 380 дж/кг
- удельная электропроводность – 16,5*10-6 см/м
- удельное электрическое сопротивление – 59,2*10-9 ом/м (при 293 К)
Контакт цинка с воздухом приводит к образованию оксидной пленки и потускнению поверхности металла. Элемент Zn легко образует оксиды, сульфиды, хлориды и фосфиды:
2Zn+О2=2ZnО
Zn+S=ZnS
Zn+Сl2=ZnСl2
3Zn+2Р=Zn3Р2
Цинк взаимодействует с водой, сероводородом, отлично растворяется в кислотах и щелочах:
Zn+Н2О=ZnО+Н2
Zn+Н2S=ZnS+Н2
Zn+Н2SO4=ZnSO4+Н2
4Zn+10НNО3=4Zn(NО3)2+NН4NО3+3 Н2О
Zn+2КОH+2Н2О=К2[Zn(ОН) 4]+Н2
Также цинк взаимодействует с раствором CuSO4, вытесняя медь, поскольку она менее активна, нежели Zn, а значит, первой выводится из раствора соли.
Цинк может находиться не только в твердом или пылеобразном виде, но и в виде газа. В частности, пары цинка возникают при сварочных работах. В данном виде Zn представляет собой яд, который становится причиной появления цинковой (металлической) лихорадки.
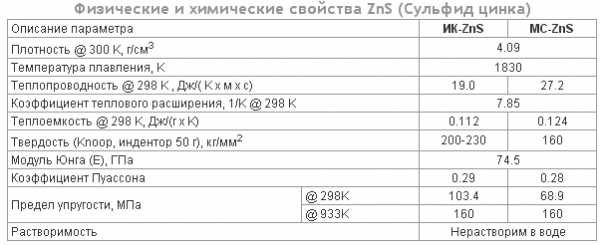
Сульфид цинка: физические и химические свойства
Свойства ZnS представлены в таблице:
fx-commodities.ru
Цинк. Описание, свойства, происхождение и применение металла
 Цинк — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Эссенциальный (незаменимый) микроэлемент тканей человека. По количественному соотношению в организме занимает второе, после железа, место. Ему принадлежит ключевая роль в регенерации поврежденных тканей, так как без цинка нарушается синтез нуклеиновых кислот и белка.
Цинк — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Эссенциальный (незаменимый) микроэлемент тканей человека. По количественному соотношению в организме занимает второе, после железа, место. Ему принадлежит ключевая роль в регенерации поврежденных тканей, так как без цинка нарушается синтез нуклеиновых кислот и белка.
СТРУКТУРА
Кристаллы цинка имеют гексагональную упаковку атомов. Но в отличие от плотнейшей гексагональной упаковки сферических атомов решетки цинка вытянуты в одном направлении. Каждый атом окружен шестью другими атомами, лежащими в одной плоскости или слое. Расстояние между центрами соседних атомов в этом плоском слое а равно 0,26649 нм. Внешняя электронная конфигурация атома 3d104s2. Не полиморфен.
СВОЙСТВА
 При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). Имеет низкую температуру плавления. Объем металла при плавлении увеличивается в соответствии со снижением плотности. С повышением температуры уменьшается кинетическая вязкость и электропроводность цинка и возрастает его удельное электрическое сопротивление. При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). Имеет низкую температуру плавления. Объем металла при плавлении увеличивается в соответствии со снижением плотности. С повышением температуры уменьшается кинетическая вязкость и электропроводность цинка и возрастает его удельное электрическое сопротивление. При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА
 Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его несколько больше (1,3·10-2%), чем в кислых (6·10-3%). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его несколько больше (1,3·10-2%), чем в кислых (6·10-3%). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
ПРОИСХОЖДЕНИЕ
 Цинк в природе как самородный металл не встречается. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Цинк в природе как самородный металл не встречается. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
ПРИМЕНЕНИЕ
 Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Цинк (англ. Zinc) — Zn
| Молекулярный вес | 65.39 г/моль |
| Происхождение названия | Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.04-10 |
| Nickel-Strunz (10-ое издание) | 1.AB.05 |
| Dana (7-ое издание) | 1.1.8.1 |
| Dana (8-ое издание) | 1.1.5.1 | Hey’s CIM Ref | 1.8 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | белый металлический |
| Цвет черты | белый и слегка сероватый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | весьма совершенная по 0001 |
| Твердость (шкала Мооса) | 2 |
| Прочность | хрупкий |
| Излом | зазубренный |
| Плотность (измеренная) | 6.9 — 7.2 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 6/mmm (6/m 2/m 2/m) — дигексагональная дипирамидальная |
| Пространственная группа | P63/mmc |
| Сингония | гексагональная |
| Параметры ячейки | a = 2.665Å, c = 4.947Å |
Интересные статьи:
mineralpro.ru 13.07.2016mineralpro.ru
Цинк (химический элемент) — Мегаэнциклопедия Кирилла и Мефодия — статья
Цинк (лат. Zincum), Zn (читается «цинк»), химический элемент с атомным номером 30, атомная масса 65, 39. Природный цинк состоит из смеси пяти стабильных нуклидов: 64Zn (48, 6% по массе), 66Zn (27, 9%), 67Zn (4, 1%), 68Zn (18, 8%) и 70Zn (0, 6%). Расположен в четвертом периоде в группе IIВ периодической системы. Конфигурация двух внешних электронных слоев 3s2p6d104s2. В соединениях проявляет степень окисления +2 (валентность II).
Радиус атома Zn 0, 139 нм, радиус иона Zn2+0, 060 нм (координационное число 4), 0, 0740 нм (координационное число 6) и 0, 090 нм (координационное число 8). Энергии последовательной ионизации атома соответствуют 9, 394, 17, 964, 39, 7, 61, 6 и 86, 3 эВ. Электроотрицательность по Полингу 1, 66.Сплавы цинка с медью — латуни — были известны еще древним грекам и египтянам. Цинк получали в 5 в. до н. э. в Индии. Римский историк Страбон в 60-20 годах до н. э. писал о получении металлического цинка, или «фальшивого серебра». В дальнейшем секрет получения цинка в Европе был утерян, так как образующийся при термическом восстановлении цинковых руд цинк при 900°C переходит в пар. Пары цинка реагируют с кислородом воздуха, образуя рыхлый оксид цинка, который алхимики называли «белой шерстью».В 1743 в Бристоле открылся первый завод по получению металлического цинка, где цинковую руду восстанавливали в ретортах без доступа воздуха. В 1746 А. С. Маргграф разработал способ получения металла прокаливанием смеси его окиси с углем без доступа воздуха в ретортах с последующей конденсацией паров цинка в холодильниках.Слово «цинк» встречается в трудах Парацельса и других исследователей 16-17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Название этого металла за его историю несколько раз менялось. Общеупотребительным название «цинк» стало только в 1920-х гг.Содержание цинка в земной коре 8, 3·10–3% по массе, в воде Мирового океана 0, 01 мг/л. Известно 66 минералов цинка, важнейшие из них: сфалерит, клейофан, марматит, вюртцит, смитсонит ZnCO3, каламин Zn4(OH)4Si2O7·H2O, цинкит ZnO, виллемит. Цинк входит в состав полиметаллических руд, которые содержат также медь, свинец, кадмий, индий, галлий, таллий и другие. Цинк — важный биогенный элемент: в живом веществе содержится 5·10–4% по массе.Цинк добывают из полиметаллических руд, содержащих 1-4% Zn в виде сульфида. Руду обогащают, получая цинковый концентрат (50-60%). Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в ZnO. От ZnO к Zn идут двумя путями. По пирометаллургическому методу концентрат спекают, а затем восстанавливают углем или коксом при 1200-1300°C. Затем испарившиеся из печи пары цинка конденсируют.
ZnO + C = Zn + CO.
Основной способ получения цинка гидрометаллургический. Обожженные концентраты обрабатывают серной кислотой. Из полученного сульфатного раствора удаляют примеси, осаждая их цинковой пылью. Очищенный раствор подвергают электролизу. Цинк осаждается на алюминиевых катодах. Чистота электролитного цинка 99, 95%.
Цинк — голубовато-белый металл.
Обладает гексагональной решеткой с параметрами а = 0, 26649 нм, с = 0, 49468 нм. Температура плавления 419, 58°C, температура кипения 906, 2°C, плотность 7, 133 кг/дм3. При комнатной температуре хрупок. При 100-150°C пластичен. Стандартный электродный потенциал –0, 76 В, в ряду стандартных потенциалов расположен до железа Fe.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO.2Zn + O2 = 2ZnO
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH (сплавление)= Na2ZnO2 + Н2О
В этой реакции образуется цинкат натрия Na2ZnO2.
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Основная часть производимого цинка расходуется на изготовление антикоррозионных покрытий железа и стали. Цинк применяют в аккумуляторах и сухих элементах питания. Листовой цинк используют в типографском деле. Сплавы цинка (латунь, нейзильбер и другие) применяются в технике. ZnO служит пигментом в цинковых белилах. Соединения цинка являются полупроводниками. Раствором хлорида цинка ZnCl2 пропитывают железнодорожные шпалы, предохраняя их от гниения.
Цинк входит в состав более 40 металлоферментов, катализирующих в организме человека гидролиз пептидов, белков и других соединений. Цинк входит в состав гормона инсулина. В организм человека цинк поступает с мясом, молоком, яйцами.Растения при недостатке цинка в почве заболевают.
Металлический цинк мало токсичен. Фосфид и оксид цинка ядовиты. Попадание в организм растворимых солей цинка приводит к расстройству пищеварения, раздражению слизистых оболочек. ПДК для цинка в воде 1, 0 мг/л.
- Живописцев В. П., Селезнева Е. А. Аналитическая химия цинка. М., 1975.
- Зайцев В. Я., Маргулис Е. В. Металлургия свинца и цинка. М., 1985.
- Карлов В. И. Технологические расчеты по металлургии цинка. – Владикавказ: Изд-во СКГТУ, 2002.
- Рудные ресурсы и их размещение по геоэпохам. Цветные металлы. – М.: Недра, 1994.
- Цинк и кадмий в окружающей среде. – М.: Наука, 1992.
megabook.ru
Цинковые сплавы: описание, структура и свойства
Металлы и сплавы так тесно вошли в нашу жизнь, что порой мы даже не задумываемся о них. Еще в 4-3 тысячелетиях до нашей эры произошло первое знакомство человека с самородками. С тех пор прошло много времени, и с каждым годом обработка металла только совершенствовалась.

Большую роль в этом сыграл такой металл, как цинк. Сплавы на его основе используются во многих отраслях. В данной статье мы рассмотрим цинковые сплавы и их роль в нашей жизни.
Переходный металл
Известно, что цинк – это голубовато-белый хрупкий переходный металл. Его добывают из полуметаллических руд. Процесс получения чистого цинка достаточно сложный и трудоемкий. В первую очередь руду, содержащую от 1-4% цинка, обогащают селективной флотацией. Благодаря этому процессу получают концентраты (55% Zn). Далее необходимо получить оксид цинка. Для этого в печах в кипящем слое обжигают полученные концентраты. Только из оксида цинка можно получить этот металл в чистом виде, и для этого существует два способа.
Получение цинка
Первый – электролитический, основывается на обработке оксида цинка серной кислотой. В результате этой реакции образовывается сульфатный раствор, который очищают от примесей и подвергают электролизу. На алюминиевых катодах осаживается цинк, который затем плавят в индукционных печах. Чистота цинка, полученного таким образом, составляет около 99,95%.

Второй способ, наиболее давний – дистилляционный. Концентраты нагревают до очень высокой температуры (около 1000°С), выделяются пары цинка, которые путем конденсации оседают на глиняных сосудах. Но этот способ не дает такой чистоты, как первый. В полученных парах содержится около 3% различных примесей, включая такой ценный элемент, как кадмий. Поэтому дальше Zn очищают ликвацией. При температуре 500°С его отстаивают некоторое время и получают чистоту 98%. Для дальнейшего изготовления сплавов этого достаточно, ведь потом цинк все равно легируют этими же элементами. Если этого недостаточно, применяют ректификацию и получают цинк с чистотой 99,995%. Таким образом, оба способа позволяют получить высокочистый цинк.
Неразлучная пара металлов
Как правило, свинец присутствует в составе цинковых сплавов в качестве примеси. В природе эта неразлучная пара металлов встречается достаточно часто. Но на самом деле, большое содержание свинца в цинковом сплаве ухудшает его физические свойства, создавая склонность к межкристаллитной коррозии, если его содержание превышает 0,007%. Чаще всего свинец и цинк встречаются вместе в оловянных бронзах и латуни.
Если говорить об эвтектике этих двух элементов, то важно заметить, что до температуры 800°С они не смешиваются между собой и представляют две разные жидкости. При быстром охлаждении происходит равномерное распределение Pb в виде округлых включений по границам зерен. Сплав цинк-свинец используется для изготовления типографского клише благодаря тому, что он очень быстро растворяется в кислоте. Чаще всего примеси свинца удаляют из цинка при помощи дистилляционного способа.
Сплав меди с цинком
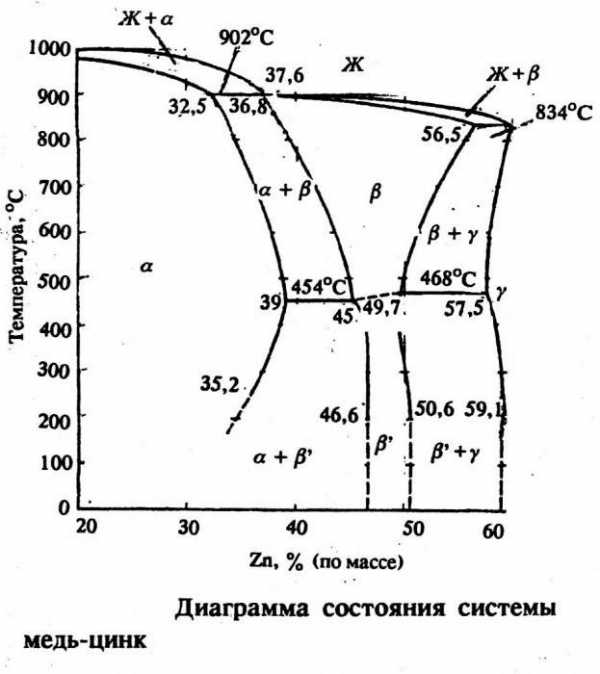
Латунь – это сплав, известный еще до нашей эры. В те времена цинк еще не был открыт, но руда использовалась достаточно широко. Раньше получали латунь, сплавляя смитсонит (цинковую руду) и медь. Только в XVIII веке впервые изготовили этот сплав с использованием металлического цинка.

В наше время существует несколько разновидностей латуни: однофазные и двухфазные. Первые содержат в себе около 35% цинка, а вторые – 50% и 4% свинца. Однофазные латуни очень пластичны, в то время как вторая разновидность характеризуется хрупкостью и твердостью. Рассмотрев диаграмму состояния этих двух элементов, можно сделать вывод, что они образуют ряд фаз электронного вида: β, γ, ε. Интересная разновидность латуни – это томпак. Он содержит всего до 10% цинка и за счет этого отличается очень высокой пластичностью. Томпак с успехом применяется для плакирования стали и получения биметаллов. Раньше его использовали для изготовления монет и имитации золота.
Цинк и сталь
Практически в каждом доме можно встретить оцинкованные вещи: ведра, кастрюли, выварки и пр. Все они надежно защищены от ржавчины именно благодаря цинку. Образно выражаясь, конечно, на сталь наносится напыление этого металла, и по логике вещей речь не идет о сплаве. С другой стороны, зная, как происходит оцинкование, можно утверждать обратное. Дело в том, что цинк плавится при очень низкой температуре (около 400°С), а когда он в жидком состоянии попадает на поверхность стали, то диффундирует в неё.
Атомы обоих веществ очень крепко связываются между собой, образуя железоцинковый сплав. По этой причине можно смело сказать, что Zn не «уложен» на изделие, а «внедрен» в него. Это можно наблюдать в обычной бытовой ситуации. К примеру, на оцинкованном ведре появляется царапина. Начинает ли оно в этом месте ржаветь? Ответ однозначный – нет. Это происходит потому, что при попадании влаги начинают разрушаться соединения цинка, но при этом они образуют некую защиту для стали. Так, в большинстве случаев такие цинковые сплавы предназначены для защиты изделий от коррозии. Конечно, для этих целей можно использовать и другие вещества, такие как хром или никель, но стоимость этих изделий будет в разы больше.
Олово и цинк
Данный сплав не менее популярен, чем другие, уже рассмотренные нами ранее. В 1917-1918-х годах в Болгарии он широко использовался для изготовления специальных сосудов, которые держали теплую жидкость долгое время (аналоги современных термосов). В наше время сплав цинк-олово очень широко используется в радио- и электропромышленности. Это связано с тем, что состав с содержанием Zn 20% очень хорошо паяется, и полировка осадка сохраняется продолжительное время.

Конечно же, как антикоррозионное покрытие данный сплав также может быть использован. По своим характеристикам он очень похож на кадмиевое покрытие, но при этом менее дорогостоящий.
Свойства цинковых сплавов
Конечно же, все составы с этим металлом отличаются между собой его процентным содержанием. В целом цинковые сплавы имеют хорошие литейные и механические свойства. Первое и самое главное – коррозионная стойкость. Больше всего она проявляется в атмосфере сухого чистого воздуха. Возможные проявления коррозии можно заметить в промышленных городах. Это обуславливается наличием в воздухе паров соляной кислоты, хлора и оксидов серы, которые, конденсируясь влагой, затрудняют образование защитной пленки. Медь-олово-цинк – сплав, который характеризуется высокими защитными свойствами. Именно такой состав наименее подвержен коррозии, особенно в условиях промышленной атмосферы. Если говорить о литейных свойствах цинка, то, конечно же, они зависят от легирующих элементов в его сплавах.

Так, например, алюминий делает их структуру однородной, мелкозернистой, облагораживает её, уменьшает отрицательное влияние железа. Еще один важный легирующий элемент – медь. Он увеличивает прочностные характеристики и уменьшает межкристаллическую коррозию. Медно-цинковый сплав обладает высокой ударной вязкостью, но при этом частично теряет свои литейные свойства.
Области применения цинка и его сплавов
На самом деле, детали из цинковых сплавов достаточно распространены и в наше время. Несмотря на то что пластик вытесняет металлические изделия, в некоторых случаях без них не обойтись. Например, автомобилестроение – отрасль, в которой не обойтись без цинковых сплавов. Фильтры, отстойники, корпуса карбюраторов и бензонасосов, надколесные кожухи, глушители – всё это и многое другое изготавливается при помощи соединений этого химического элемента.

Благодаря тому что цинковые сплавы имеют хорошие литейные свойства, из них отливают сложные детали различных форм с минимальной толщиной стенок. Строительство – еще одна область, в которой не обойтись без этих сплавов. Цинковый прокат используют для кровельных покрытий, изготовления труб и сточных желобов. Несмотря на то что существует тенденция снижения производства цинковых сплавов, отказаться от их изготовления не представляется возможным из-за относительной дешевизны и механических свойств материала.
fb.ru

