Гальваническое меднение – Меднение в домашних условиях: химическое, гальваническое
alexxlab | 22.09.2018 | 0 | Вопросы и ответы
Меднение в домашних условиях: химическое, гальваническое
В современном мире больше распространение получил медный сплав. Он наносится на поверхность для придания внешней привлекательности различных изделий. Меднение в домашних условиях зачастую проводится для существенного повышения показателя электропроводности. В некоторых случаях рассматриваемый процесс является промежуточной операцией, которая позволяет нанести другое вещество на поверхность.
 Меднение в домашних условиях
Меднение в домашних условияхИспользование меднения
Покрытие медью различных заготовок в последнее время часто проводится в домашних условиях. В большинстве случаев технология применяется для достижения следующих целей:
- Декорирование металла или пластика. Меднение металла в домашних условиях часто проводится для того, чтобы получить старинные на вид изделия, которые пользуются большой популярностью. Специальная процедура состаривания позволяет создать эффект длительного использования изделия. Кроме этого, медь после нанесения напоминает золото. Именно поэтому небольшой слой можно нанести для получения статуэтки или сувенира.
- Гальванопластика. Меднение стали подобным образом также может проводиться в домашних условиях. Суть технологии заключается в создании восковой или пластиковой основы, которая покрывается слоем рассматриваемого сплава. Гальванопластика часто применяется для получения ювелирных изделий или сувениров, матриц и волноводов. Применение специальных материалов позволяет существенно повысить качество покрытия.
- Получение деталей, используемых при создании различных механизмов. Меднение чугуна или другого металла проводят на производственных площадках при различных технологий. Покрытие заготовки медью позволяет существенно повысить электротехнические качества. Подобным образом можно получить клеммы или прочие подобные элементы, которые будут эксплуатироваться под напряжением. Изделия из чистой меди обходятся очень дорого. Именно поэтому часто применяется рассматриваемая технология.

Меднение стали
Меднение пластика в домашних условиях проводится крайне редко, так как подобный материал не выдерживает воздействие высокой температуры. Кроме этого, пластичность основания приводит к появлению структурных трещин.
Особенности меднения в домашних условиях
Меднение металла – особая технология нанесения слоя меди толщиной 1-300 мкм и больше. Особенности применяемых технологий определяют то, что медное покрытие будет прочно держаться на поверхности металла. Среди особенностей, которые приобретает заготовка, отметим следующие моменты:
- Пластичность.
- Высокая электропроводность. Медные изделия хорошо известны с тем, что могут проводить электричество и при этом не нагреваются. Именно поэтому часто создаются изделия, которые покрываются подобным сплавом.
- Более привлекательный вид. Медь блестит на солнце, на поверхности появляются блики.
- В атмосферных условиях сплав легко окисляется и покрывается налетом. Этот момент стоит учитывать при рассмотрении того, где и как именно будет использоваться изделие.
- Медная пленка со временем покрывается пятнами и радужными разводами.

Окисление стали
Обмеднение в домашних условиях может проводиться при применении специального раствора. Стоит учитывать, что процесс предусматривает использование специальных реагентов. Поэтому нужно предусмотреть наличие эффективной приточной вентиляции, а также индивидуальных средств защиты. Меденение пластика несколько отличается, предусматривает применение особой технологии.
Разновидности меднения
Рассматриваемая процедура доступна для выполнения даже новичкам в сфере металлургии. Для получения качественной поверхности нужно знать все особенности процесса. Меднение свинца и других металлов в домашних условиях может проводиться при применении двух различных технологий:
- С погружением в электролит. Подобная технология предусматривает окунание заготовки в подготовленный раствор, после чего подводится напряжение. Зачастую применяется в том случае, если размеры заготовки небольшие, так как требуется меньшее количество специального электролита. Для погружения заготовки требуется ванная или другая емкость, которая не реагирует на воздействие применяемого раствора.
- Без погружения в заранее подготовленную емкость. Она сложна в исполнении, но также позволяет достигнуть высокое качество медной поверхностной пленки.
В обоих случаях предусматривается подвод электричества, за счет чего вещество активизируется.
Наиболее подходящий способ обработки выбирается в зависимости от того, какой нужно достигнуть результат. Примером назовем:
- Получение защитно-декоративного слоя. В этом случае часто проводится смешивание хрома с никелем и медью. За счет подобного сочетания сплавов можно получить надежную поверхность.
- Для защиты поверхности на момент цементирования. Нанесение тонкого слоя меди позволяет защитить заготовку от цементирования. Покрывается раствором поверхность, которая в дальнейшем будет обрабатываться резанием.
- Восстановление и ремонт деталей. При восстановлении хромированных деталей автомобиля и мотоциклов может применяться рассматриваемая технология. При нанесении слоя не более 250 мкм можно скрыть поверхностные дефекты металла.
Обе технологии обработки характеризуются своими определенными особенностями, которые нужно учитывать.
Меднение в растворе с электролитом
Гальваническое покрытие медью в домашних условиях с погружением проводится крайне часто. Подобная технология позволяет получить равномерное покрытие. К особенностям подобного способа обработки можно отнести следующие моменты:
- Для удаления оксидной пленки перед меденением заготовка обрабатывается наждачной бумагой. После этого изделие промывается и обезжиривается горячей смесью из соды. Если не уделить внимание подготовительному этапу, то проводимый процесс не позволит получить устойчивое к механическому воздействие изделие. Металл, который подвержен воздействию коррозии, должен быть хорошо очищен, так как даже мелкая крошка может сделать поверхность неоднородной.
- В банку или другую емкость на медных проволоках опускается две пластины из этого же сплава. Они выступают в качестве анода. Применяемая тара должна быть из стекла.
- Между двумя анодами подвешивается обрабатываемая деталь, которая подключается к минусу, а пластины к плюсу. В качестве источника питания может использоваться батарея, выдающее напряжение 6В.
- Гальваническое меднение предусматривает применение определенного раствора. Он является связующим элементом между деталью и анодами. Раствор для гальванического меднения можно создать изготовить, для чего берется 20 грамм медного купороса и 3 миллилитра серной кислоты. Для разбавления и смешивания этих ингредиентов можно использовать 100 миллилитров дистиллированной воды. При работе с полученным раствором нужно быть крайне внимательным, так как при попадании вещества на открытые участки кожи могут возникнуть ожоги.
- Меднение алюминия медным купоросом в домашних условиях может проводиться только в том случае, если электроды были полностью покрыты раствором. Если они будут находиться в сухом состоянии, то они могут нагреться и расплавиться. При длительной обработке вещество может нагреться и его объем уменьшится.

Гальваническое меднение
При применении рассматриваемой технологии сила тока устанавливается на уровне 15 мА на каждый квадратный сантиметр. На покрытие всей поверхности специальным сплавом, как правило, уходит не менее 20 минут. При увеличении протяженности срока покрытие становится толще.
Меднение без опускания в раствор
Подобный метод применяется для покрытия стали, цинка или алюминия. Покрытие изделия медью в домашних условиях в этом случае проводится проводом, с которого предварительно снимается изоляция для получения своеобразной кисти. Обратный конец провода подключают к плюсу источнику энергии. Химическое меднение в домашних условиях также предусматривает использование специального раствора, который повышает эффективность процесса.
Среди особенностей создания требующего раствора можно отметить следующие моменты:
- Используется раствор медного купороса. Его можно приобрести в специализированных магазинах. Кроме этого, специальный электролит изготавливается при смешивании различных химических элементов.
- Состав немного подкисляют. За счет этого существенно повышается эффективность проводимой процедуры.
Вещество наносится на поверхность, после чего подготавливается металлическая поверхность. Она очищается от загрязняющих веществ, после чего обезжиривается. После этого подготовленная заранее пластина укладывается в ванночку и к ней подводится минус от источника тока.

Меднение алюминия
Подобный процесс предусматривает, чтобы между собранными проводками и пластиной постоянно был слой электролита. За счет этого обеспечивается высокая степень проводимости. Для того чтобы покрыть изделие небольших размеров требуется сего несколько секунд.
После нанесения покрытия изделие сушится на воздухе. Нельзя допускать попадания различных загрязняющих веществ. Следующий шаг заключается в натирании медной прослойки шерстяной тряпкой или другим сукном. В большинстве случаев рассматриваемая технология применяется в том случае, когда изделие имеет большие размеры и не может погружаться в ванную.
Необходимое оборудование
Медное покрытие может наноситься в домашних условиях при применении даже самого обычного оборудования. Установка ванной для проведения рассматриваемой процедуры проводится примерно также, как и гальванических. Стоит учитывать, что существует два типа активных растворов: кислые и щелочные.
При работе может применяться:
- Небольшие медные пластины в качестве электродов.
- Проволока для подачи тока.
- Источник тока, к примеру, АКБ, который рассчитан на подачу тока напряжением 6 В.
- Для регулировки силы тока может устанавливаться реостат.
Меднение алюминия и других сплавов в домашних условиях не требует большого количества времени. Для очистки получаемой поверхности могут применяться различные ткани.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
Химическое и гальваническое меднение: состав и подготовка
Современная техника выдвигает жесткие требования к характеристикам конструктивных элементов, во многих случаях эти задачи решает химическое меднение. Использование специальных покрытий поверхностей деталей выгодно экономически, так как гальваническое меднение позволяет понизить металлоемкость изделий из дорогостоящих металлов.
Физико-механические характеристики меди и сферы использования меднения
Плотность меди 8,96 г/см3, атомная масса 693,54, удельное электрическое сопротивление 1,68×10-8 Ом×м, температура плавления +1083°С. На открытом воздухе в присутствии агрессивных химических соединении медь окисляется, при контакте с сернистыми соединениями покрывается пленкой сульфида меди темно-коричневого или серого оттенков. Под влиянием углекислоты и влаги пленка приобретает зеленый цвет, верхний слой состоит из гидрокарбонатов. Медь легко растворяется в растворе азотной кислоты, разбавленная серная кислота на химическое меднение негативного влияния почти не оказывает. Но наличие кислорода увеличивает скорость протекания химических реакций. При наличии открытых пор в покрытии образуется гальванопара, что нужно учитывать при меднении. Железо в этом случае является анодом, коррозионные процессы протекают очень интенсивно.
В связи с такими особенностями, процесс меднения в большинстве случаев должен завершаться дополнительной обработкой поверхностей. Покрытия шлифуются или полируются до зеркального блеска. Медь имеет высокую адгезию с различными металлами: алюминий, серебро, цинк, никель, свинец, хром и т. д. В связи с этими особенностями химическое меднение часто используется для создания подслоя при серебрении, никелировании, хромировании поверхностей деталей. Меднение получило широкое распространение в качестве метода эффективной защиты отдельных участков деталей от появления эффекта науглероживании при процессе цементации. В зависимости от назначения деталей или изделий гальваническое нанесение меди может иметь следующую толщину:
Толщина слоя меди на поверхности обрабатываемых деталей
Сравнительные показатели растворов
В процессе меднения используется большое количество специальных технологических растворов, разделяемых на две большие группы:
- Простой кислый электролит. Из простых применяется фторборатный, кремнефторидный, сульфатный, хлоридный и сульфамидный раствор.
- Комплексный электролит. Преимущественно щелочные, медь присутствует как положительно или отрицательно заряженные комплексные ионы.
График поляризационных кривых осаждения меди из различных типов электролитов
Процесс осаждения в кислых электролитах происходит при высокой плотности по току, они устойчивы, просты по химическому составу. Главными составляющими являются соответствующие кислоты и соли, осадки меди из них достаточно плотны и имеют крупнокристаллическую структуру. Недостатки – непосредственное меднение стали, цинковых сплавов и иных металлов происходит с более низким отрицательным потенциалом, чем медь.
Обработка деталей в комплексных электролитах выполняется за счет комплексных ионов, для них требуется высокая катодная поляризация. Выход по току меньше, что способствует более равномерному осаждению, структура мелкокристаллическая. Используются пирофосфатные, цианидные, аммонийные, триполифосфатные, цитратные и другие растворы.
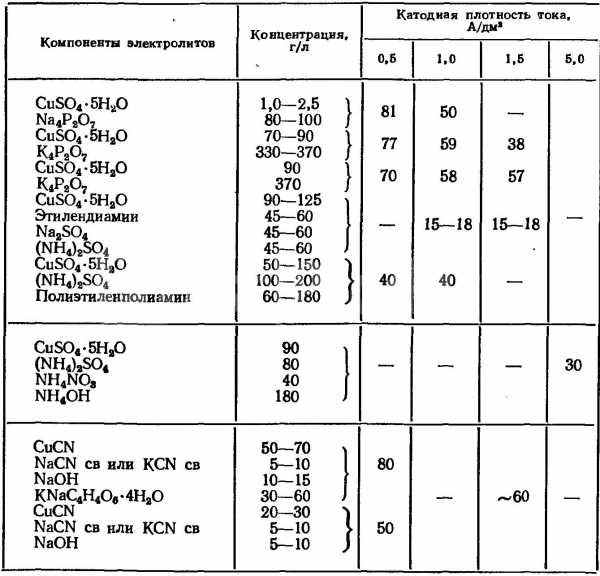
Способность рассеивания электролитов для меднения
Простые кислые составы
- Сульфатные. Главные компоненты серная кислота и сульфат меди. Сернокислое соединение отличается невысокой электропроводимостью, для повышения параметра добавляется серная кислота. Выход меди по току достигает 100%, на катоде не выделяется водород. За счет повышения концентрации кислоты уменьшается растворимость сульфата, что понижает верхний предел максимально допустимой плотности тока.
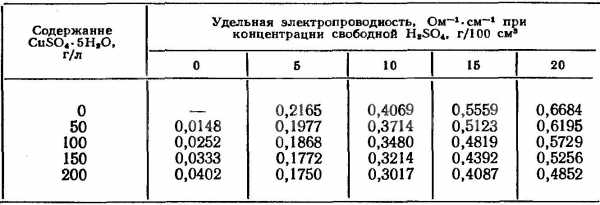
Влияние содержания серной кислоты на электропроводность электролита
При перемешивании увеличивается концентрация медных ионов на катодном слое. При повышении температуры возрастает растворимость сульфата меди, электролит повышает кислотность, что приводит к получению мелкокристаллических осадков.
Для улучшения катодной поляризации в электролит добавляются поверхностно активные вещества. Дополнительно они уменьшают образование наростов на острых краях.

Режимы и состав сульфатных электролитов для меднения
Для образования блестящего покрытия используются аноды АМФ, не допускающие образование шлама, или аноды из особо чистой рафинированной меди.
Влияние концентрации меди на плотность тока с перемешиванием (1) и без перемешивания (2). Электролит фторборатный.

Электролит фторборатный.
Для недопущения попадания шлама аноды помещаются в чехлы, изготовленные из кислотоустойчивого материала, дополнительно раствор постоянно фильтруется.
- Фторборатные. Отличаются высокой устойчивостью, гальваническое нанесение получается плотным и мелкокристаллическим, рассеивающие показатели такие же, как при сульфатном меднении. За счет большой растворимости увеличивается плотность тока, осаждать медь непосредственно на детали нельзя.
Состав и режим работы фторборатных электролитов
При непрерывном перемешивании допускается повышать плотность тока. Контроль технологически параметров меднения осуществляется измерением кислотности раствора. Для повышения качества меднения используется карбонат натрия, для понижения медный купорос.
- Нитратные. Электролит используется при гальванопластике, обеспечивает повышенное качество осадка.
Режимы и состав нитратных электролитов
Комплексные электролиты
- Цианидные. Условия обработки значительно отличаются от осаждения из кислых, в них медь существует в виде комплексных ионов, что заметно понижает ее активность. Увеличение плотности тока принуждает катодный потенциал резко смещаться в поле отрицательных значений. Но процесс меднения нельзя производить при увеличенной плотности тока в связи с тем, что выход меди может падать до нуля. Главными компонентами раствора являются свободный цианид натрия и комплексный цианид калия. Во время работы содержание меди понижается из-за недостаточной их растворимости.
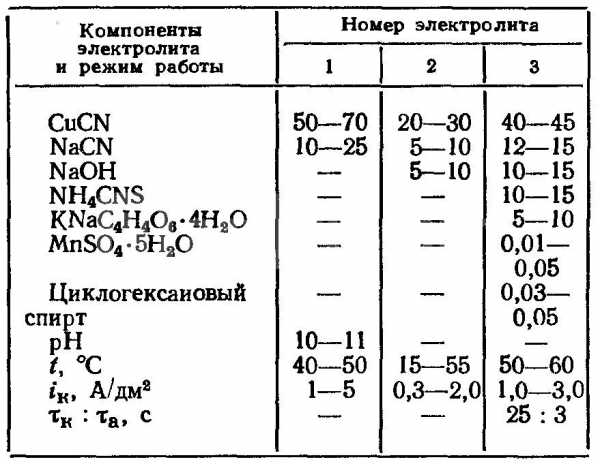
Режим и состав цианидных электролитов для меднения
- Пирофосфатные. Медные осадки имеют мелкокристаллическую структуру, гладкие, блестящие или полублестящие. Для улучшения качества обработки и повышения катодной и анодной плотностей может добавляться медный купорос. Катодный потенциал в пирофосфатных растворах имеет более отрицательные параметры, чем у кислотных.
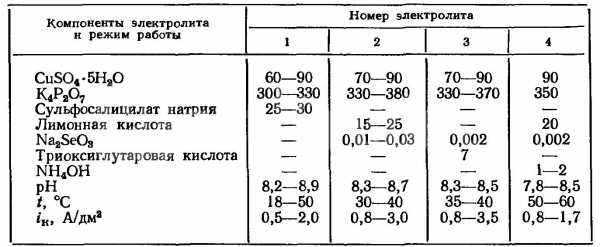
Режим и состав пирофосфатных электролитов
- Этилендиаминовые. Процесс меднения может осуществляться непосредственно по поверхности стали, при низких плотностях тока катодная поляризация достигает больших значений. Рассеивающие характеристики выше, чем у сульфатных, но ниже, чем имеет цианидный раствор.
Режим и состав этилендиаминовых электролитов
Загрузка и выгрузка деталей должна выполняться при минимальной силе тока, в первые 40–50 секунд дается толчок тока, в три раза превышающий рабочие значения меднения.
- Полиэтиленполиаминовые. Во время обработки деталей потенциалы смещаются в поле отрицательных значений, электролит применяется вместо цианидных.
Режим работы и составы полиэтиленполиаминовых электролитов
- Аммонийные. В состав входит аммиак, сульфат аммония и сульфат меди. При невысоких плотностях тока уменьшается выход по току, улучшение меднения осуществляется за счет добавления нитрата аммония. Осадки равномерные по толщине, плотные и полублестящие.
Режимы работы и состав аммонийного электролита
Без специальной обработки поверхностей медные осадки имеют недостаточную адгезию, причина – пассивирование стали раствором аммиака. Улучшение параметров покрытия достигается введением в раствор нитрата меди.
Устройство ванны медненияЛинейные параметры и конструктивные особенности должны отвечать требованиям ГОСТ 23738-85. Гальваническая ванна изготавливается из модифицированных особо устойчивых пластиков, конкретные марки подбираются с учетом параметров технологических процессов.
Ванна без кармана. Наиболее простая конструкция, применяется как в отдельности, так и на производственных линиях.
Ванна без кармана
Ванна с карманом. Обработка может выполняться с одновременными процессами удаления верхнего загрязненного слоя электролита.
Ванна с карманом
Конкретный выбор ванны меднения осуществляется в зависимости от особенностей предприятия, характеристик подлежащих меднению деталей и общих производственных мощностей.
Во время проектирования рассчитываются максимальные нагрузки с учетом объема раствора, длина, высота и ширина может изменяться по желанию заказчиков. При необходимости на ванны меднения устанавливается дополнительное оборудование и водопроводная арматура. За счет специальных механизмов улучшается качество процесса меднения. Используемые пластики адаптируются к химическому составу электролита и температурным режимам меднения.
Механическая подготовка поверхностей
Перед меднением с поверхности должна удаляться окалина, заусеницы и раковины. Качество обработки регламентируется положениями действующего ГОСТа 9.301-86. Конкретные параметры шероховатости устанавливаются в зависимости от назначения покрытия. После механической обработки деталей с поверхности должны быть удалены все дефекты, оказывающие негативное влияние на качество меднения. В обязательном порядке удаляется техническая смазка и эмульсия, металлическая стружка, продукты коррозионных процессов и пыль.
Подготовка к меднению производится при следующих технологических операциях:
- Шлифование. Верхний слой деталей снимается абразивными элементами, может быть тонким, декоративным или грубым.
- Полирование. Во время операции сглаживаются мельчайшие выступы, поверхность блестящая зеркальная.
- Крацевание. Для очистки поверхностей применяются металлические щетки.
- Галтовка. Детали обкатываются в специальных колоколах.
- Химическое и электрохимическое обезжиривание. Для обработки используют органические и неорганические растворы.
От качества предварительной подготовки поверхностей во многом зависит процесс меднения и физические показатели осадков.
plast-product.ru
Гальваническое покрытие медью в домашних условиях: стали, свинца, латуни
Основной задачей гальванического покрытия медью в домашних условиях или по-другому меднения является подготовка поверхности металла к его дальнейшей обработке. Такой операции могут подвергаться различные металлы, и не металлы, среди которых следует выделить:- сталь,
- латунь,
- никель и другие.
Использование меди
Благодаря своим многочисленным преимуществам данный металл получил широкое распространение. На сегодняшний день медь и ее многочисленные сплавы широко используются в промышленности. Металл актуальный для авиастроения, автомобилестроения, приборостроения и других отраслей. Не меньшей популярностью металл и изделия из него пользуются и в бытовой сфере. Меднение само по себе является одним из лучших способов покрытия тонким слоем металлической поверхности. В домашних условиях меднение можно выполнить нескольким способами.
Гальваническое меднение в домашних условиях
Для этого понадобится:
- Медный купорос;
- Вода;
- Соляная кислота в чистом виде.
Гальваническое меднение в домашних условиях
Приготовления раствора
Медный купорос
Делаем насыщенный раствор медного купороса, после чего нужно будет добавить 1/3 этого раствора в соляную кислоту. После приготовления раствора медного купороса его следует тщательно размешать, чтобы не было частиц. Далее нужно соляную кислоту тонкой струйкой добавить в этот раствор. Не следует забывать про технику безопасности и использовать перчатки и защитные очки. После того, как вы добавили в раствор соляную кислоту, его следует тщательно перемешать.
Итак, раствор готов и можно приступать к меднению в домашних условиях. Для этого нужно взять металлическую деталь, на которую вы собрались наносить слой меди и подготовить ее к работе. Подготовка включает в себя ее обработку наждачной бумагой. Данная процедура позволяет не только зачистить металлическую поверхность, но и обезжирить ее. Такая же процедура будет актуальна и для детали из латуни или свинца. После этого, покрытие нужно тщательно промыть в растворе кальцинированной соды. Это позволит более тщательно обезжирить материал.

Кальцинированная соды для обезжиривания материала
Далее поверхность нужно погрузить в раствор медного купороса и соляной кислоты. Следует обратить внимание на то, что первый слой меди является очень тонким и слабым, поэтому его желательно снять при помощи металлической щетки. После того, как вы это сделали, поверхность стали или свинца следует повторно промыть в растворе кальцинированной соды и опять погрузить в раствор для меднения. Данные манипуляции приведут к тому, что слой меди в домашних условиях на поверхности будет гораздо толще и гораздо крепче, поскольку его убрать можно будет с предмета, только используя наждачную бумагу, а не металлическую щетку как прошлый раз.
Этот способ позволяет сделать очень качественное медное покрытие, которое можно снять только наждачкой. Для улучшения медного покрытия в домашних условиях следует деталь еще раз погрузить в раствор. Указанный способ отличается своей простотой и высокой эффективностью в том числе и для изделий из свинца.
Процедура меднения
Меднением принято называть процедуру гальванического нанесения меди, толщина слоя меди в таких случаях может составлять-от 300 мкм и больше. Меднение стали это один из наиболее важных процессов в гальванике, поскольку используется, как дополнительный процесс перед нанесением других металлов для хромирования, никелирования, покрытие серебром.
Слой меди прекрасно держится на стали и способен выравнивать различные дефекты на поверхности.
Для медных покрытий характерно высокое сцепление с другими поверхностями, изделиями из свинца особенно металлическими, а также высокая электропроводность и пластичность. Нанесенное недавно покрытие имеет ярко-розовый матовый или же блестящий цвет. Под воздействием влияний атмосферы медные покрытия могут окисляться, покрываться налетом окислов с различными пятнами радужного вида.
Сферы использования омеднения
 Как правило, гальваническое омеднение может использоваться:
Как правило, гальваническое омеднение может использоваться:
- В декоративных целях. С учетом огромной популярности в нынешнее время старинных изделий из меди. Существуют методы искусственного состаривания изделий из стали;
- В гальванопластике. Широко распространена в ювелирной сфере, среди сувенирной продукции, для изготовления барельефов и т.д;
- В технической отрасли. Меднение металла очень важно в электротехнической области. Низкая стоимость меднения по сравнению с покрытиями из золота или серебра позволяет снизить расходы на изготовление электродов, электротехнических шин, контактов и других элементов из сталии свинца.
Меднение происходит вместе с нанесением других гальванических покрытий
- Если нужно нанести многослойное защитно-декоративное покрытие на слой стали. В подавляющем большинстве случаев здесь медь используют вместе с никелем и хромом. Это позволяет улучшить сцепление с основным металлом и получить блестящее покрытие высокой прочности;
- Во избежание цементации участка. Меднение свинца позволит избежать появления углероживания на стальных участках. Для нанесения медного слоя используют только те участки, на которых будет проводиться обработка резанием;
- При выполнении реставрационных и восстановительных работ. Данный метод наиболее часто используется для восстановления хромированных частей автомобилей и мотоциклов. Для этих целей наносится довольно толстый слой меди, порядка 100-250 мкм и более того, что позволяет закрыть все дефекты и повреждения металла для нанесения последующих покрытий;
Разновидности меднения
- Используя погружение в электролит;
- Без погружения в электролит.
Первый способ предполагает обработку металлического изделия наждачной бумагой, щеткой и промывки водой. После чего обезжиривания в горячем содовом растворе с повторной промывкой. Далее в стеклянную емкость опускают на медных проволочках две медные пластины –аноды. Между пластинками на проволоке подвешивают деталь, после чего пускается ток.
Второй способ актуальный для изделий из стали, алюминия и цинка.
Домашнее омеднение
Данная процедура актуальна для различных случаев, поскольку нанесение слоя меди может использоваться для алюминиевых столовых приборов, сувениров, подсвечников и т. д. Неповторимый эффект оказывают изделия не из металла, на которые был нанесен слой меди. Это могут быть стебли растений, листья и др. Ввиду того, что в покрываемых предметах отсутствует токопроводящий слой, вместо него используется специальный электропроводный лак, который наносят на поверхности.
В состав лака входит ряд органических растворителей, пенкообразователей и тонкодисперсионный графитовый порошок, благодаря которому создается электропроводность. Лак наносят тонким слоем на сухую поверхность, и после высыхания через час можно приступать к омеднению. При желании можно меди придавать различные цветовые оттенки, используя для этого специальные способы. Высокое качество и уникальность таких изделий вполне заслуженно приравнивается к настоящим ювелирным украшениям.
Видео: Меднение в домашних условиях
ecology-of.ru
Гальваническое меднение печатной платы
Этапы гальванического меднения
В прошлой статье мы покрыли нашу плату слоем химической меди. Так как у меня не было времени для дальнейшего изготовления платы, я просто положил высушенную плату между двумя листами на хранение.
Если у вас есть время, то лучше конечно сразу после химического меднения заняться гальваникой платы, если времени нет, то сделайте так же как я. Хранить плату в таком состоянии можно сколь угодно долго с одним условием, помещение должно быть сухим.
После химического меднения плату нужно покрыть слоем гальванической меди, так как толщины слоя химической меди не достаточно для изготовления качественной печатной платы. О данном процессе нанесения меди на плату, пойдет речь в этой статье.
Предварительная затяжка
Этот этап нужно делать только при изготовлении платы по технологии металлорезиста. Для технологии тентования, данный процесс пропускается и плата покрывается медью полностью без предварительных подготовок.
Для чего нужна предварительная затяжка
Итак, для чего нужен этап предварительной затяжки медью при использовании метода металлорезиста?
1. Наращивание гальванической меди идет по рисунку, который был сделан с помощью фоторезиста. После нанесения, засветки, проявки фоторезиста, в порах химической меди (это в том случае, если мы не сделаем предварительную затяжку медью, а нанесем фоторезист прямо на химическую медь) может остаться не смытый слой фоторезиста, который приведет к плохой адгезии наращенной гальванической меди к слою химической меди.
Плата после основной гальваники в таком исполнении, будет шелушится. Пример шелушения можно посмотреть в этой статье на фото.
2. Плату после проявки фоторезиста, нужно немного протравить в растворе травителя, в данном случае в персульфате аммония + серная кислота. Это нужно для того, что бы на 100% избавится от фоторезиста.
Если не будет сделан этап предварительной затяжки (фоторезист нанесен на химическую медь), то после опускания платы в травитель, химическая медь моментально стравится из отверстий, что приведет к полному отсутствию металлизации в нашей печатной плате, а нам это не нужно.
Какой ток выставлять
Расчет тока для предварительной затяжки.
Для осаждения гальванической меди, как правило применяют плотность тока 2А/дм2 (плотность тока зависит от применяемого электролита и у вас она может отличаться от указанной, имейте в виду). Для того чтобы рассчитать нужную величину тока для нашей платы, нужно знать её площадь. Важно понимать, что нужно считать не площадь платы, а площадь всей заготовки.
Измеряем длину и ширину всей заготовки, у меня получилось 16 х 13 см. Фото замеров у меня нет, прошу поверить на слово.
Посчитаем площадь меди данной заготовки, 16 * 13 = 208 см2. Так как у нас две стороны у платы, то общая площадь меди равна 208 * 2 = 416 см2 или 4.16 дм2. Теперь осталось умножить общую площадь, на плотность тока, 4.16 * 2 = 8.36 ампер. В итоге этот ток нужно выставить на источнике, он будет соответствовать плотности тока 2А/дм2 для наших размеров платы.
Меднение печатной платы
Приступим собственно к самому процессу предварительной затяжки.
Напомню, если после химического меднения перед гальваникой, не было пауз, то плату достаем из раствора декапирования (аккуратно, чтобы штаны не были дырявые потом) и переносим ее в ванну для гальваники без промывки в воде.
Если была пауза, то делаем так. Опускаем плату в горячий раствор обезжиривания буквально на 5 минут. После промываем плату в горячей и холодной воде. Затем опускаем ее в раствор декапирвания на 1 минуту и только после этого (без промывки в воде) опускаем в ванну с гальваникой.
– Раствор декапирования (пропорции: аккумуляторный электролит 100 мл, вода 200 мл)
1. Устанавливаем на источнике необходимый ток, 8.38 ампера в данном случае, погружаем плату в ванну и держим ее там ровно 10 минут. За это время на поверхности платы нарастет слой меди порядка 3..5 мкм, которого достаточно для следующего этапа в изготовлении.
Как сделать такую ванну и электролит для гальваники медью, читайте в этой статье.
Не забываем навести мышкой на изображение, чтобы прочитать описание к нему, также кликнуть по изображению для его увеличения.
Фото этого процесса.
2. После 10 минут гальваники, вынимаем плату из ванны, промываем ее в воде, затем декапируем ее и промываем в воде.
– Раствор декапирования (пропорции: аккумуляторный электролит 100 мл, вода 200 мл)
Этап предварительно затяжки можно считать оконченным. После предварительной затяжки сразу можно судить о качестве металлизации отверстий.
Фото после гальваники.
Рисунок печатной платы
Далее формируем рисунок будущих дорожек печатной платы.
Нанесение фоторезиста
Клеим негативный фоторезист на печатную плату с обеих сторон. Затем готовим шаблоны для засветки, они должны быть позитивными. Это значит, что там где должны быть дорожки на будущей плате, эти места должны быть черными на фотошаблоне. На фото ниже это видно, не перепутайте.
Шаблоны для засветки печатной платы
Клеим шаблоны на глицерин и по очереди засвечиваем фоторезист с обоих сторон платы ультрафиолетовым источником. Время засветки я не оговариваю, у вас оно должно быть своим, за ранее подобранным.
Фото приклейки фоторезиста и шаблонов.
Проявка фоторезиста
После засветки проявляем плату в растворе кальцинированной соды или в растворе силикатного клея. Рецептура этих растворов предоставлена ниже, выбирайте любой из них:
А.
Кальцинированная сода 10 гр или чайная ложка
Дистиллированная вода – 1 литр
Б.
Силикатный клей – 6 чайных ложек
Дистиллированная вода – 1 литр
Готовим три емкости с растворами. Проявитель фоторезиста, травитель – персульфат аммония с серкой, раствор декапирования.
Состав травителя.
Персульфат аммония – 250 гр
Аккумуляторный электролит – 50 мл
Вода дистиллированная – 500 мл
Фото проявки фоторезиста.
Контроль качества смывки фоторезиста
После проявки фоторезиста, промываем плату в проточной 20 градусов воде.
Затем опускаем плату в раствор персульфата аммония с серкой на 20 секунд, не более!! Этот процесс нам покажет, до конца ли вы смыли фоторезист с поверхности меди или нет. Это буде видно по блестящим точкам или полигонам, там где блестит, значит там не смыли. Если эти проблески есть, то плату нужно будет до проявить в проявителе и повторить этап опускания в персульфат.
Если проблесков нет, значит все хорошо, отмыто нормально и можно приступать к следующему шагу изготовления.
Фото этапа.
Активация меди
Промываем плату в проточной воде, затем в растворе декапирования и на этом заканчиваем процедуру нанесения рисунка будущих дорожек на печатную плату.
– Раствор декапирования (пропорции: аккумуляторный электролит 100 мл, вода 200 мл)
Фото платы с нанесенным рисунком.
Данная статья опубликована на сайте whoby.ru. Постоянная ссылка на эту статью находится по этому адресу http://whoby.ru/page/galvanicheskoe-mednenie-pechatnoj-platy
Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Основная гальваника медью
Чтобы качественно сделать основную гальванику, нужно по новой рассчитать площадь поверхности меди. Как мы видим из фото, половина меди закрыта фоторезистом, половина открыта.
Как в этом случае рассчитать площадь открытой меди? Все просто, есть такая программа, называется gerbv, скачать ее можно по этой ссылке5 с Яндекс диска.
Хочу обратить внимание, что скачать нужно именно этот дистрибутив и сделать все, как написано в инструкции, которая находится в архиве, иначе подсчет площади не будет работать. Также в архиве имеется файл pdf с инструкцией по работе.
Расчет площади проводников
Как посчитать площадь с помощью данной программы? Открываем программу, устанавливаем единицы измерения мм, импортируем один гербер, выделяем мышкой все проводники и программа нам показывает площадь этих проводников и ток для источника. Тоже самое делаем с гербером другой стороны платы. Ток для источника рассчитывается в программе из условия плотности тока 2А/дм2, что очень удобно в нашем случае, не придется пересчитывать его по полученной из программы площади проводников.
Если плотность тока для вашего электролита всё же другая (выше или ниже 2А/дм2), то имея площадь проводников, которую показывает программа, можно легко пересчитать ток для источника по методе, приведенной выше в статье.
Скриншоты измерения площади проводников в программе gerbv.
Как видно из скриншотов, а именно третьего и пятого, ток для первой стороны равен 0.88 ампера, для другой стороны ток равен 1.14 ампера. Сложив вместе, получаем суммарный ток 0.88 + 1.14 = 2.02 ампера.
Порядок выполнения операций по гальванике
1. Вынув плату из раствора декапирования, зажимаем ее в держатель и опускаем в ванну для гальваники. На источнике устанавливаем ток в 2 ампера, который только что получили из программы и выдерживаем плату в ванне ровно 1 час.
За это время, на проводниках осядет слой меди толщиной порядка 25 мкм.
Фото процесса основной гальваники.
2. Прошел 1 час, вынимаем плату из ванны, промываем ее в проточной воде.
Фото этапа.
3. Опускаем плату в раствор декапирования на 1 минуту, затем промываем ее в проточной воде.
Фото этапа.
Заключение
На этом можно считать гальванику завершенной и плата готова к следующему этапу изготовления, о котором я расскажу в следующей статье.
Ну и как всегда, всем удачных плат.
Статью написал: Admin Whoby.Ru
Здесь можно поставить оценку статье!
Еще записи по теме
whoby.ru
Меднение в домашних условиях: технология и материалы
Обработка поверхности различных предметов производится для придания декоративного эффекта или в качестве промежуточной процедуры, предваряющей дальнейшие действия. Многие процессы доступны для выполнения и не требуют большого количества оборудования. Один из наиболее популярных способов обработки — меднение, его можно выполнить и в домашних условиях.
Что представляет собой процесс меднения
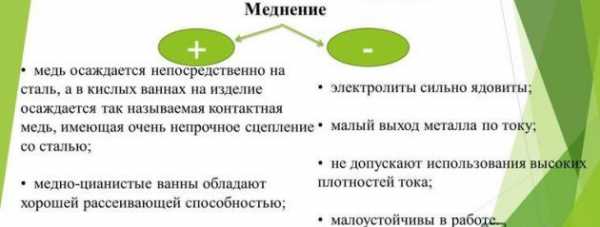
Меднение — это процесс нанесения на поверхность предмета тонкого слоя меди. Оно выполняется гальваническим методом, т. е. путем переноса ионов меди от положительно заряженного источника на обрабатываемую поверхность, заряженную отрицательно. Чаще всего процесс гальванического нанесения меди является подготовительным этапом перед покрытием никелем и хромом, но нередко меднение металла становится самостоятельным видом финишной отделки. Широко используется гальванопластика, для которой требуется создать покрытие из меди.
Разновидности меднения
Существует два варианта меднения в домашних условиях:
- С погружением обрабатываемой детали в электролит.
- Без погружения.
С погружением обрабатываемой детали в электролит. Для выполнения процедуры надо иметь емкость с электролитом, имеющую достаточный объем. После предварительной подготовки, состоящей в очистке поверхности наждачной бумагой и промывке в горячем растворе соды, предмет подключается к отрицательному электроду и погружается в электролит на определенное время.

Меднение с погружением детали в электролит
Без погружения. Можно обработать сталь, алюминий, свинец, цинк. Обработка производится без погружения в емкость, обычно такой вариант применяется для крупных деталей.
Оба варианта вполне доступны для самостоятельного выполнения в домашних условиях.

Меднение стали
Оборудование и материалы, необходимые для нанесения медного покрытия
Чтобы выполнять меднение стали или других металлов, придется запастись кое-какими материалами и устройствами. Понадобятся:
- Соляная кислота.
- Медный купорос (сернокислая медь).
- Дистиллированная вода.
- Источник постоянного тока, желательно с регулируемым напряжением (один из вариантов — ЛАТР), но подойдет и обычный трансформатор на 6–12 В.
- Емкость для электролита (оптимально — стеклянный резервуар).
- Две медных пластины, которые могут свободно поместиться в емкость.
- Соединительные провода.
Из воды, медного купороса и соляной кислоты надо изготовить электролит. Сначала в воду добавляется медный купорос, до получения насыщенного раствора. Его надо тщательно перемешивать, чтобы не оставалось твердых частиц. Затем в раствор тонкой струйкой добавляется соляная кислота (не наоборот!). Всего для нанесения покрытия понадобится:
- Вода — 980 г.
- Сернокислая медь — 190 г.
- Серная кислота — 40 г.
Теперь все готово, можно приступать к меднению в домашних условиях.
Внимание! Необходимо учитывать, что соляная кислота — химически активный реагент, поэтому следует запастись средствами защиты — перчатками, очками, максимально подготовить рабочее место.
Технология меднения
Порядок действий при нанесении покрытия:
Схема гальванического меднения
- Надо удалить тонкую пленку окислов с поверхности детали, подлежащей обработке. Используется наждачная бумага, металлическая щетка или иные абразивные материалы. Необходимо действовать очень аккуратно, поскольку сильные повреждения металла останутся заметными. В идеале, поверхность должна быть отполирована.
- Затем изделие тщательно промывается в горячем растворе кальцинированной соды. Это действие позволяет обезжирить поверхность.
- Подготовленное изделие подключается к отрицательному электроду от источника питания и помещается в раствор электролита.
- В раствор электролита опускаются медные пластины с присоединенным к ним положительным электродом от источника питания (анод). Необходимо следить, чтобы анод и катод не соприкасались. В идеале, расстояние между ними должно быть во всех участках одинаковым, но на практике этого сложно добиться.
- Меднение металла производится в несколько приемов. Первый слой покрытия, полученный в течение нескольких минут, рекомендуется удалить и вновь промыть деталь в содовом растворе. Это усилит сцепление слоя омеднения с основным металлом. Деталь выдерживается в растворе около 20–30 минут. Толщина слоя покрытия может достигать 300 мкм.
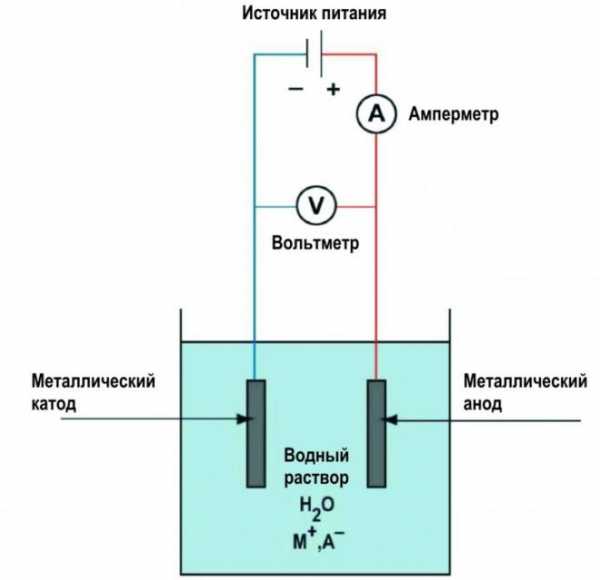
Схема осаждения металла
Нередко бывает необходимо удалить слой покрытия с хромированных частей. Для этого на деталь подается отрицательный заряд, а на положительный электрод наматывается тряпочка, смоченная в растворе серной кислоты (5%). Ею протирается поверхность детали, слой хромирования снимается. При выполнении процедуры необходимо защищать кожу, органы зрения и дыхания от паров кислоты.
Меднение деталей без погружения в раствор
Меднение алюминиевой детали без погружения в раствор
Гальваническое омеднение может выполняться без погружения детали в емкость с электролитом. Для этого надо подключить к ней отрицательный электрод. В качестве положительного контакта берется медный многожильный провод, конец которого освобождается от изоляции на 1–2 см и разминается так, чтобы получилось некое подобие кисти.
Для нанесения слоя медного покрытия «кисточка» обмакивается в электролит, затем ее концом проводят по поверхности детали, не прикасаясь к ней, но стараясь, чтобы между ними находилась прослойка. Постоянно обмакивая анод в электролит, покрывают слоем меди всю поверхность. Процедура требует навыка и времени, но результат того стоит.
Гальванопластика
Процесс гальванопластики
Покрытие медью может быть выполнено не только на металлических предметах. Широко распространена гальванопластика, когда меднение выполняется по различным засушенным растениям, насекомым и прочим неметаллическим предметам.
Технология нанесения покрытия мало отличается от обычной, только вначале процесса на поверхность надо нанести электропроводный лак. После засыхания лакового покрытия производятся обычные действия по нанесению слоя меди. Полученные изделия обладают высокими декоративными или художественными качествами и высоко оцениваются зрителями.
Видео по теме: Как сделать меднение своими руками в домашних условиях
vtorexpo.ru
Меднение в домашних условиях: алюминия, стали медным купоросом
Меднение – это процесс нанесения на поверхность медного слоя гальваническим способом.
Медный слой придает изделию внешнюю привлекательность, что позволяет использовать прием гальванического покрытия медью в дизайнерских проектах. Также он придает металлу высокую электропроводность, что позволяет подвергать изделие дальнейшей поверхностной обработке.

Меднение можно использовать в качестве основного процесса для создания поверхностного слоя, а также как промежуточную операцию для дальнейшего нанесения другого металлического слоя. К такому способу можно отнести, например, процесс серебрения, хромирования или никелирования.
Меднение можно проводить в домашних условиях. Это дает возможность решить много бытовых проблем.
Гальваника в домашних условиях: оборудование и материалы
Чтобы выполнить покрытие медным слоем самостоятельно, нужно приобрести необходимое для процесса оборудование и материалы.

Прежде всего, нужно подготовить источник электрического тока. Разные домашние мастера советуют использовать силу тока, разброс которой в большом диапазоне. Работа должна проводиться на постоянном токе.
В качестве источника тока можно взять батарейку КБС-Л напряжением 4,5 вольт или новую батарейку марки «Крона» с рабочим напряжением 9 вольт. Можно также вместо нее использовать выпрямитель малой мощности, дающий напряжение не более 12 вольт, или автомобильный аккумулятор.
Обязательным является использование реостата для регулировки напряжения и плавного выхода из процесса.
Для раствора электролита должна быть заготовлена нейтральная емкость, например из стекла, а также пластиковая широкая посуда, имеющая достаточные размеры для размещения в ней детали. Емкости должны выдерживать температуру не менее 80оС.
Также понадобятся аноды, обеспечивающие покрытие всей поверхности детали. Они предназначены для подведения тока в электролитный раствор и его распределение по всей площади детали.
Для проведения гальваники в домашних условиях понадобятся также химреактивы для приготовления раствора:
- медный купорос,
- соляная или другая кислота,
- дистиллированная вода.
Заготовив все необходимое, можно приступать к работе.
Видео:
Меднение стальных изделий
Меднение стали медным купоросом является одним из основных процессов в области гальваники потому, что оно используется для предварительного покрытия медью. Она отличается высокой адгезией к стальной поверхности, в отличие от других металлов, которые не обладают хорошим сцеплением со сталью. Медный слой при соблюдении технологии держится на стальных изделиях прекрасно.
Есть две технологии нанесения покрытия: с погружением изделия в электролитный раствор и способ неконтактного покрытия поверхности медью без помещения в жидкий электролитный раствор.
Меднение путем погружения в раствор

Процесс выполняется с соблюдением следующих этапов:
- С поверхности стальной детали удаляется окисная пленка с помощью наждачной бумаги и щетки, а затем деталь промывается и обезжиривается содой с финишной промывкой водой.
- В стеклянную банку помещаются две медные пластины, подсоединенные к медным проводникам, которые служат анодом. Для этого их соединяют вместе и подводят к положительной клемме прибора, используемого в качестве источника тока.
- Между пластинами свободно подвешивается обрабатываемая деталь. К ней подводится отрицательный полюс клеммы.
- В цепь встраивается тестер с реостатом, чтобы регулировать силу тока.
- Готовится электролитный раствор, в состав которого обычно входит медный купорос – 20 грамм, кислота (соляная или серная) – от 2 до 3 мл, растворенная в 100 мл (лучше дистиллированной) воды.
- Готовый раствор заливается в подготовленную стеклянную банку. Он должен покрыть помещенные в банку электроды полностью.
- Электроды подключаются к источнику тока. С помощью реостата устанавливается ток (10-15 мА должны приходиться на 1см2 площади детали).
- Через 20-30 минут ток отключается, и деталь, покрытая медью, достается из емкости.
Видео:
Покрытие медью без помещения в электролитный раствор
Такой способ используется не только для стальных изделий, но и алюминиевых предметов и изделий из цинка. Процесс осуществляется так:
- Берется многожильный медный провод, с одного конца которого снимается изоляционное покрытие, а проводкам из меди придается вид своеобразной кисточки. Для удобного использования «кисть» закрепляют на ручке — держателе (можно взять деревянную палку).
- Другой конец провода без кисти подсоединяется к положительной клемме используемого источника напряжения.
- Готовится электролитный раствор на основе концентрированного медного купороса с добавлением небольшого количества кислоты. Он наливается в широкую емкость, необходимую для удобного окунания кисти.
- Подготовленная металлическая деталь, очищенная от оксидной пленки и обезжиренная, помещается в пустую ванночку и подсоединяется к отрицательной клемме.
- Кисть смачивается приготовленным раствором и водится вдоль поверхности пластины, не прикасаясь к ней.
- После достижения необходимого медного слоя, процесс заканчивается, а деталь промывается и сушится.
Между поверхностью детали и импровизированной медной кистью всегда должен быть слой из раствора электролита, поэтому кисть необходимо обмакивать в электролит постоянно.
Меднение алюминия медным купоросом
Нанесение на поверхность меди – отличный способ обновления алюминиевых столовых приборов и других изделий из алюминия, используемых дома.
Меднение алюминия медным купоросом можно провести самостоятельно. Упрощенный вариант для демонстрации процесса – это покрытие медью алюминиевой пластинки простой формы.

На этом примере можно потренироваться. Выполнение процесса происходит так:
1. Поверхность пластинки необходимо сначала зачистить, а затем обезжирить.
2. Затем нужно нанести на нее немного концентрированного раствора сернокислой меди (медного купороса).
3. Следующим действием является подсоединение к алюминиевой пластинке провода, подсоединенного к отрицательному полюсу. Подсоединять провод к пластинке можно с помощью обычного зажима.
4. Положительный заряд подается на устройство, состоящее из оголенного медного провода с диаметром от 1 до 1,5 мм, конец которого распределяется между щетинами зубной щетки.
Во время работы этот конец провода не должен касаться поверхности алюминиевой пластины.

5. Обмакнув щетину в раствор медного купороса, начинают водить щеткой в подготовленном для покрытия медью месте. При этом не нужно допускать замыкания цепи, прикасаясь к поверхности алюминиевой пластины концом медного провода.
6. Омеднение поверхности сразу становится визуально заметно. Чтобы слой был качественным, с окончанием процесса не нужно торопиться.
7. После завершения работы слой меди нужно выровнять дополнительной очисткой, удалив остатки медного купороса и протерев поверхность спиртом.
Гальванопластика в домашних условиях
Гальванопластикой называют процесс электрохимического воздействия на изделие с целью придания ему необходимой формы осаждаемым на поверхности металлом.

Обычно эту технологию используют для покрытия металлом неметаллических изделий. Широко применяют ее в ювелирной области и дизайне бытовых предметов.
Покрытие рабочего изделия должно обладать электропроводящими свойствами. При отсутствии такого слоя сначала предмет покрывают графитом или бронзой.
Основными металлами, используемыми для гальванопластики, являются медь, никель, серебро и хром. Также используют металлизацию поверхностей сплавами из стали.
Гальванопластика в домашних условиях особенно популярна среди мастеров. Чтобы создать нужную форму, с копии делается ее слепок. Для этого используют легко плавящийся металл, графит и гипс.
Видео:
После изготовления формы предмет подвергают покрытию металлом с использованием электролита.
Загрузка…plavitmetall.ru
Гальваническое покрытие медью в домашних условиях
№ 5
Меднение. Никелирование Меднение Меднение стали
Медные покрытия, как правило, не применяются в качестве самостоятельного покрытия ни для декоративных целей, ни для защиты стальных деталей от коррозии.
Это связано с тем, что медь в атмосферных условиях легко окисляется, покрываясь налетом окислов.
Однако благодаря хорошему сцеплению осажденной меди с различными металлами медное покрытие применяется в многослойных защитно-декоративных покрытиях в качестве промежуточного подслоя, а также для защиты стальных деталей от цементации.
В гальванопластике медные осадки применяются для изготовления металлических копий, барельефов, волноводов и матриц.
Электролиты меднения подразделяют на кислые и щелочные. Из кислых электролитов используют сернокислые и борфтористоводородные. Наибольшее применение нашли сернокислые электролиты, отличающиеся простотой состава, устойчивостью и высоким выходом по току (до 100%). Недостатком этих электролитов является невозможность непосредственного покрытия стальных и цинковых деталей вследствие контактного выделения меди, имеющей плохое сцепление с основным металлом.
Поэтому перед меднением стальных детален в кислых электролитах их предварительно меднят в цианистых электролитах или осаждают тонкий подслой никеля. К недостаткам сернокислых электролитов относятся также их незначительная рассеивающая способность и более грубая: структура осадков по сравнению с другими электролитами.
К щелочным электролитам меднения относятся цианистые, пирофосфатные и другие электролиты.
Цианистые медные электролиты обладают высокой рассеивающей способностью, мелкокристаллической структурой осадков, возможностью непосредственного меднения стольных деталей. К недостаткам относятся низкая плотность тока и неустойчивость состава вследствие карбонизации свободного цианида под действием двуокиси углерода воздуха. Кроме того, цианистые электролиты характеризуются пониженным выходом по току (не более 60-70%).
Кислые электролиты меднения
Медь сернокислая — 150-250 г/л
Никель хлористый — 50-70 г/л
Температура = 18-25°С
Плотность тока = 1-4 А/дм2
При перемешивании электролита сжатым воздухом можно довести катодную плотность тока до 6-8 А/дм2.
Для приготовления сернокислого электролита меднения растворяют медный купорос, фильтруют его в рабочую ванну и при непрерывном помешивании добавляют серную кислоту.
При нанесении медных покрытий из сернокислого электролита медные аноды растворяются в основном с образованием двухвалентных ионов, которые, разряжаясь на катоде, осаждаются в виде металлической меди.
Однако наряду с этими процессами происходят п другие, нарушающие нормальное течение электролиза. Возможно также анодное растворение с образованием одновалентных ионов, хотя и в меньшей степени.
В электролите, омывающем металлическую медь, идет также химический обратимый процесс: Cu + Cu2+ = 2Cu+.
Накопление в растворе ионов одновалентной меди в больших количествах приводит к сдвигу реакции влево, в результате чего выпадает металлическая губчатая медь.
В растворе, кроме того, происходит окисление сернокислой одновалентной меди за счет кислорода воздуха н серной кислоты, особенно при воздушном перемешивании: Cu2SO4 + ½O2 + h3SO4 = 2CuSO4 + h3O.
На катоде процесс заключается в разряде двухвалентных и одновалентных ионов меди, но в связи с тем, что концентрация ионов одновалентной меди приблизительно в 1000 раз меньше концентрации ионов двухвалентной меди, катодный процесс выглядит так: Cu2+ + 2е- = Cu. Выход по току составляет 100%.
Для получения плотного гладкого осадка в электролите необходимо присутствие серной кислоты.
Меднение гальваникой и гальванопластика в домашних условиях
Серная кислота выполняет ряд функций:
значительно повышает электропроводность электролита;
понижает активность ионов меди, что способствует образованию мелкозернистых осадков;
предотвращает гидролиз сернокислой закисной меди, который сопровождается образованием рыхлого осадка закиси меди.
Дефекты при эксплуатации сернокислого электролита меднения и способы их устранения
Дефект | Причина дефекта | Способ устранения |
Грубая крупнокристаллическая структура осадков | Недостаток кислоты | Добавить кислоту |
Высокая плотность тока | Снизить плотность тока | |
Шероховатые осадки | Загрязнение электролита механическими примесями | Отфильтровать электролит |
Черные и коричневые полосы на покрытии | Присутствие в электролите примесей тяжелых металлов, мышьяка, сурьмы | Проработать электролит, при большом содержании примесей электролит заменить |
Пористые, рыхлые осадки | Наличие в электролите солей железа | Отфильтровать электролит, проработать его током |
Светлые блестящие полосы на покрытии, осадки хрупкие | Присутствие в электролите органических примесей | Отфильтровать электролит, проработать его током |
Борфтористоводородный электролит обладает несколько более высокой рассеивающей способностью, чем сернокислый.
Кроме того, в борфтористоводородных электролитах можно применять высокие плотности тока. Состав электролита (г/л) и режим меднения:
Медь борфтористоводородная – 35-40 г/л
Кислота борная – 15-20 г/л
Кислота борфтористоводородная – 15-20 г/л
Никель хлористый – 50-70 г/л
Температура = 18-25°С
Плотность тока = до 10 А/дм2
Электролит перемешивают сжатым воздухом или механической мешалкой.
Для приготовления борфтористоводородного электролита в борфтористоводородную кислоту небольшими порциями вводят свежеосажденную углекислую медь.
Раствор углекислой меди готовят подливанием подогретого концентрированного раствора соды к раствору сернокислой меди при перемешивании. Полученный осадок декантируют, промывают и растворяют в борфтористоводородной кислоте. В приготовленный раствор добавляют свободную борфтористоводородную и борную кислоту до требуемого значения рН (1-1,5). В ванну с полученным электролитом доливают воду до рабочего уровня.
(Деканта́ция, деканти́рование — в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка.)
Электрохимический процесс — электро-тип, то есть. осаждение более толстого массивного слоя металла на поверхность объекта, форма которого должна быть распространена, скопирована, достаточно распределена. Например, гальванопластика используется в тех случаях, когда металлическая деталь имеет очень сложную форму и ее трудно или невозможно изготовить обычными способами (литье или механическая обработка).
Таким образом, скульптуры иногда воспроизводятся по образцам (автомобиль «Аполлон» на пьедестале Большого театра выполнен гальванопластикой).
Этот процесс относительно прост и может быть легко воспроизведен в домашних условиях.
Печать копируется из статьи или статьи для копирования, то есть из легкого металла, воска, пластика или гипса. Субъект, который нужно скопировать, вымыть с мылом, добавляется к картонной коробке и выливается низкоплавким сплавом из древесины или других сплавов.
После литья объект удаляют и полученную форму обезжиривают и ударяют путем литья в электролитической ванне.
Чтобы не откладывать металл по бокам формы, где нет никакого впечатления, они покрываются щеткой с расплавленным воском или парафином. После литья меди низкоплавкий металл растворяется в кипящей воде и получается матрица. Матрица заливается штукатуркой или свинцом, и копия готова. Следующая композиция для воска используется для изготовления пресс-форм:
Воск …………… 20 веков.
Гальванический. Бейкер, покрывающий алюминий.
час
Парафин ……… 3 v. час
Графит ……….. 1 v. час
Если форма изготовлена из диэлектрика (воск, пластик, парафин, гипс), его поверхность
покрытый электропроводящим слоем.
Передаточный слой может быть осажден с извлечением определенных металлов (серебра, меди, никеля) или механическими средствами — путем протирания поверхности графитом в виде листьев из щетки мягких волос.
Графит тщательно измельчают в фарфоровом растворе, просеивают через сито или марлю и наносят на поверхность продукта мягкой кистью или ватой. Графит лучше держит глину. Формы гипса, дерева, стекла, пластика и папье-маше покрыты раствором воска в бензине. На поверхности, которая не успевает высохнуть, поместите графит в порошок и излишек, без контроля графита.
Гальваническое покрытие просто отделено от графитовой формы. Если форма выполнена из металла, необходимо создать проводящую фольгу из оксида, сульфида или другой нерастворимой соли, такую как серебро — серебросодержащий хлорид свинца — сульфид свинца, чтобы обеспечить хорошее отделение от покрытия.
Медь, серебро и свинцовые поверхности обрабатываются 1% раствором сульфида натрия, что приводит к образованию нерастворимых сульфидов.
Отложение металла на поверхности пресс-формы. Готовая форма погружается в гальваническую ванну, схема которой находится под напряжением, так что снимаемая пленка не растворяется. Во-первых, «уплотнение» (покрытие) проводящего слоя меди осуществляется при низкой плотности тока в растворе этого
состав:
Серокислотная медь (сульфат меди) … 150-200 г.
Серная кислота 7-15 г
Этиловый спирт 30-50 мл
Вода …………………………………………. 1000 мл
Рабочая температура электролита составляет 18-25 ° С, плотность тока составляет 1 — 2 А / дм2.
Алкоголь необходим для
увеличить смачиваемость поверхности. Когда вся поверхность «подталкивается» медным слоем, форма переносится на электролит, предназначенный для гальванопластики. При гальванизации (медь) рекомендуется следующая композиция:
Серийно кислотная медь (сульфат меди) …..
340 c. час
Серная кислота 2 v. час
Вода …………………………………………. .1000 v. час
Температура электролита составляет 25-28 ° С. Плотность тока составляет 5-8 А / дм2.
Используя метод электроформовки, вы можете взять металлическое кружево для декоративно-художественного декоративно-художественного оформления различных предметов. Кружево растягивается на раме и пропитано парафином.
Затем вы протираете их между бумажными листами, чтобы удалить лишний парафин. Затем наносят электропроводящий слой тонкого графита, а избыток тщательно подталкивают кружевом. Путь провода — край кружева, он прикреплен к пластиковой раме или раме толстой проволоки с изолированным винилхлоридом вместе с кружевом, погруженным в электролит.
Лак, покрытый медью, обрабатывается латунной щеткой. Припаяйте их свинцовым припоем.
Гальваноспециальная обработка металлических кружев — использование декоративного слоя из серебра или золота или окисления.
<<<Вернуться назад
Технологии -> пекарь
пекарь
Покрытие баком
Медные покрытия обычно не используются как самостоятельное покрытие для декоративных целей, а также для защиты стальных деталей от коррозии. Это связано с тем, что медь в атмосферных условиях легко окисляется, покрывается окислением.
Однако из-за хорошей адгезии осажденной меди к различным металлам медное покрытие используется в многослойных защитных и декоративных покрытиях в качестве промежуточных подошв, а также для защиты стальных деталей от газификации.
Для электроформования медные нанотрубки используются для изготовления металлических копий, рельефов основания, волноводов и матриц.
Медные электролиты делятся на кислотные и щелочные.
Кислотные электролиты используются сульфатными и борфтористоводородными. Наибольшее применение было доступно для сульфатных электролитов, характеризующихся их простым составом, стабильностью и высокой силой тока (до 100%).
Недостатком этих электролитов является невозможность непосредственного применения стальных и цинковых деталей для отделения медных контактов, которые плохо склеиваются с основным металлом.
Поэтому перед нанесением меди на стальные детали в кислотных электролитах они предварительно сохраняются в цианидных электролитах или наносимых тонких никелевых пластин. Недостатки сульфатных электролитов также являются их незначительной рассеивающей способностью и более грубыми: структура осаждения по сравнению с другими электролитами.
Электролиты щелочной меди покрывают цианидом, пирофосфатом и другими электролитами.
Цианид-медные электролиты обладают высокой дисперсионной способностью, мелкокристаллической структурой осаждения, возможностью непосредственных медных табличных объектов. К недостаткам относятся низкая плотность тока и нестабильность состава за счет карбонизации свободного цианида под воздействием углекислого газа в воздухе.
Быстрое накопление меди.
Кроме того, цианидные электролиты характеризуются сниженной мощностью тока (не более 60-70%).
Будьте осторожны! Компания «LV-Engineering» не предоставляет услуги по гальванизации! Наша организация осуществляет проектирование гальванических изделий, производство гальванических ванных комнат и полипропиленовых линий, монтажные и пуско-наладочные работы в данном направлении.
Кислотные электролиты
Сульфат меди — 150-250 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока составляет 1-4 А / дм2
Когда электролит смешивается со сжатым воздухом, плотность катодного потока может быть подключена к 6-8 А / дм2.
Для приготовления медносульфатного электролита растворите сульфат меди, процедите в рабочую пантеру и добавьте серную кислоту при непрерывном перемешивании.
Когда медные покрытия наносят из сульфатного электролита, аноды меди сначала растворяются с образованием двухвалентных ионов, которые осаждаются в виде металлической меди при выгрузке на катод.
Однако наряду с этими процессами существуют и другие, которые препятствуют нормальному течению электролиза. Анодное растворение возможно также при образовании одновалентных ионов, хотя и в меньшей степени.
В электролите, который удаляет медный металл, существует также химически обратимый процесс: Cu + Cu2 + = 2Cu +.
Накопление ионов иона иона в растворе в больших количествах приводит к тому, что реакция перемещается влево, а это означает, что к нему принадлежит медная медь.
Раствор также окисляет сульфаты меди из-за атмосферной серной кислоты N, особенно воздуха во время смешивания: Cu2SO4 + 1 / 2O2 + h3SO4 = 2CuSO4 + h3O.
На катоде в процессе отходящий двухвалентных и одновалентных ионов меди, но из-за того, что концентрация ионов одновалентной меди около 1000 раз ниже, чем концентрация ионов двухвалентной меди, катодная методом электроосаждения выглядит следующим образом: Cu 2+ + 2e = Cu. Токовый выход составляет 100%.
Присутствие сорбиновой кислоты требуется для получения плотного гладкого осадка в электролите.
Серная кислота выполняет множество функций: она значительно увеличивает электропроводность электролита; он уменьшает активность ионов меди, что способствует образованию мелких зерен; предотвращает гидролиз сульфата железа, что сопровождается образованием свободного осадка из оксида меди.
Ошибки электролита медно-сульфатного электролита и методы их устранения
| ошибка | Причина ошибки | средство |
| Грубая структура грубых осадков | Кислотный дефицит | Добавить кислоты |
| Высокая плотность тока | Уменьшить плотность тока | |
| Грубые сквозняки | Загрязнение электролита механическими примесями | Фильтровать электролит |
| Черные и коричневые линии на обложке | Наличие в электролитных примесях тяжелых металлов, мышьяка, сурьмы | Проверьте электролит с высоким содержанием примесей, замените электролит |
| Пористые, рыхлые отложения | Присутствие солей железа в электролите | Фильтруйте электролит и заряжайте его электричеством |
| На крышке есть яркие блестящие линии, которые являются хрупкими | Присутствие органических примесей в электролите | Фильтруйте электролит и заряжайте его электричеством |
Борфторогидроэфир имеет немного большую мощность распыления, чем серная кислота.
Кроме того, флюсы высокой плотности могут использоваться в борфтористоводных электролитах. Состав электролита (г / л) и способ применения меди:
Гидрохлорид борфторида меди — 35-40 г / л
Борная кислота — 15-20 г / л
Соляная кислота — 15-20 г / л
Никель-хлорид — 50-70 г / л
Температура = 18-25 ° C
Плотность тока = до 10 А / дм2
Электролит смешивают со сжатым воздухом или механической мешалкой.
Свежую измельченную углеродную медь вводили небольшими порциями для приготовления скважинного углеводородного электролита в борфтористовородной кислоте.
Раствор углеродной меди готовят путем нагревания нагретого концентрированного раствора сульфата натрия в раствор сульфата меди путем смешивания. Полученный осадок декантируют, промывают и растворяют в борфтористой кислоте. К желаемому раствору добавляют свободную бороновую кислоту и борную кислоту до желаемого значения рН (1-1,5). Добавить воду на рабочую поверхность в ванне с электролитом.
Если перед вами стоит задача омеднения каких-либо деталей в автомобиле, то оказывается это вполне возможно сделать в домашних условиях. Для этого не потребуется особых знаний и умений, да и все материалы и реагенты вполне можно найти в магазинах или своих запасах. Что же, давайте посмотрим как можно сделать омеднение.
Когда делают омеднение и можно ли его использовать для коррозионного покрытия
Прежде чем рассказать о самом процессе, хотелось бы сказать пару слов о прагматичности такой операции.
Многие из автолюбителей не особо знакомых с химией сейчас скажут о необходимости омеднения всего чего попадется под руку, но мы вас предостерегаем от этого! Почему!? Да потому что все металлы между собой образуют гальваническую пару. Такая гальваническая пара образуется даже при попадании воды, а если средой будет еще и кислота, то процесс пойдет в разы быстрее.
Суть процесса в гальванической паре сводится к следующему. Более активный металл отдает свои электроны, а менее активный принимает. Вот так и образуется самая простая «батарейка» в которой протекает электрический ток.
Давайте теперь взглянем на стандартные электродные потенциалы:
— для меди Е0(Сu2+/Cu)=0,34В;
— для железа E0(Fe2+/Fe)=-0,44В.
В итоге получается не все так гладко.
Ведь в такой гальванической паре У железа электродный потенциал более активным. Опять же у меди электродный потенциал более положителен, чем у железа, поэтому она будет менее активна.
В итоге электроны потекут от железа к меди, что приведет к коррозии железа.
Все это мы рассказали к тому, что бездумно покрывать медью все что вам попадется под руку на машине не рекомендуется. Ведь в этом случае вы можете значительно сократить жизненный цикл многих железных деталей (крепеж, кузовные детали).
Гальваническое меднение
Не зря для сохранения железа применяют цинк, там ситуация с электродными потенциалами обратная.
Однако омеднение может применяться для декоративной отделки железа, если покрытие будет находиться в сухости.
Также медь может применяться в случаях, где необходимо обеспечить передачу электрического тока между контактами. Опять же надо следить за их чистотой.
Медь может применяться в условиях применения пар с незначительным трением скольжения. Все это в целом вполне жизнеспособные варианты. А значит и омеднение все же имеет шанс на его реализацию.
Тогда не будем более медлить, расскажем непосредственно о процессе омеднения.
Процесс омеднение деталей в домашних условиях (расчет слоя покрытия при определенном токе)
Омеднение происходит в растворе. По сути этот процесс обратный гальванической паре, то есть тому, о чем мы рассказывали в абзаце выше.
Для раствора нам понадобиться кислота, можно взять электролит используемых для аккумуляторов. Воду и медный купорос.

Для раствора берется 100 мл электролита на 20 мл воды и добавляется 20 г медного купороса.
В качестве донора меди можно взять медные пластинки или обычный медный провод, предварительно очищенный от изоляции. Итак, именно в этот самый раствор и помещаем медь. При этом подключаем блок питания постоянного напряжения питания к меди (+) и к железу (-). Ток на блоке питания выставляем тот, при котором мы планируем за определенный период времени нанести определенный слой меди. Это уже задача по химии школьной программы.
И получается все так…
I= (плотность меди (8920 кг/м3)*площадь детали (скажем 0,1 м3)*(требуемый слой (скажем 0,0001 м, то есть 0,1 мм))/ (электрохимический эквивалент для меди это 6,6*〖10〗^(-7)
* желаемое время, скажем 3 часа – 10800 секунд). Считаем…
I=8920*0,1*0,0001/0,0000066*10800=0,0892/0,07128=1,25 А
То есть за 3 часа при токе 1,25 А у нас будет покрытие в 0,1 мм на детали площадью 0,1 м3. Вот как-то так и считаем все аналогичные вариации.

А да, время от времени не забываем помешивать раствор, чтобы процесс шел равномерно.

После того как омеднение завершено, вытаскиваем детали из раствора и отмываем хорошо с щелочью, то есть с мылом.

Если есть каике-то заусенцы и отклонения от формы, то их вполне можно пройтись наждачной бумагой и заполировать.
Собственно вы теперь не меньше знаете, как производить омеднение поверхности.
Надо сказать, что по тому же принципу производится и оцинкование и хромирование… В итоге понимая принцип происходящего процесса можно перенести процесс покрытия поверхности и на другие металлы.
Состояние электрического тока растворов цианистого меди значительно отличается от тех, которые считаются наиболее благоприятными в кислотных растворах. Из-за того, что образуются сильные сложные ионы и очень низкая скорость диссоциации, активность ионов меди в цианидном растворе настолько мала, что потенциал около 1 В становится более отрицательным, чем раствор серной кислоты.
Увеличивая плотность тока, катодный потенциал меди в цианидных электролитах, в отличие от кислоты, сильно изменяется в направлении электроотрицательных значений (рис.
84), который определяет условия кристаллизации и распределения металла на поверхности катода; С этой точки зрения условия в цианидных электролитах чрезвычайно благоприятны.
Но именно из-за потенциала катода быстро растет с плотностью тока, это не может быть существенно увеличено, в противном случае выходной ток металла может быть сведен к нулю.
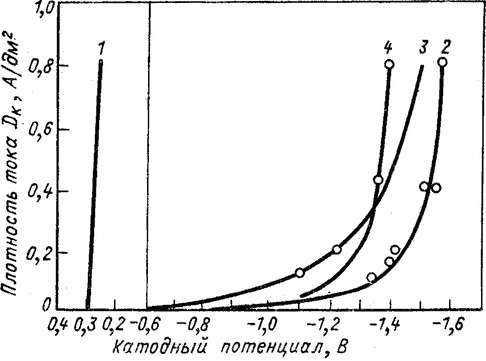
Рис. 84. Кривые поляризации медных электролитов:
1-сульфатного электролита 1,5-n. CuSO4 + 1,5-n.
h3S04; 2-цианидный электролит композиции 0,25-n.
CuCN + 0,6-n. NaCN + 0,25-n. Na2C03; 3 — тот же электролит при 45 ° C; 4 представляет собой тот же электролит в присутствии Na2S2O3
Еще одно важное различие в кислотности цианидных электролитов следует рассматривать как значительные изменения в характеристиках меди в зависимости от концентрации свободного цианида, в то время как свободная серная кислота оказывает очень мало влияния на характеристики меди в кислотных электролитах.
Если в растворе, содержащем 9 г меди на литр в форме цианидной соли (0,1 м.
Гальванизация собственными руками дома: технологии и оборудование
CuCN) и 13 г / л KCN, медный потенциал -0,60 В, в присутствии 26 г / л KCN этот потенциал равен -0,964 В и в присутствии 65 г / л -1,169 В.
Катодная поляризация также сильно зависит от концентрации солей меди в электролите, в то время как кислотные электролиты оказывают незначительное влияние.
Анодный процесс в цианидных электролитах также сопровождается значительной поляризацией, размер которой в основном определяется содержанием свободного цианида.
Отсутствие цианидного анода неактивно до полного растворения их растворения. Таким образом, содержание свободного цианида оказывает диаметрально противоположное воздействие на процессы катодного и анодного; Сначала требуется минимальное содержание свободного цианида (катодная плотность тока может быть выше, чем ниже цианид в электролите), второй — по величине (анод пассивации начать с самой высокой плотностью тока, тем выше содержание цианида).
Это значительно ограничивает выбор концентрации цианида, который является основным компонентом электролита из соли меди.
Для большинства цианидов электролиты не могут полностью использовать методы, которые позволяют им использовать увеличенную плотность тока, такую как смешивание или значительное повышение температуры, по той причине, что эти процессы ускорили гидролиз цианида. Даже в состоянии покоя при комнатной температуре цианид электролита разрушается быстрее, чем кислота, что приводит к абсорбции углекислого газа из воздуха.
Электролиты из цианид-меди, нанесенные на катод, извлечение из одновалентных ионов, т. Е. При 1 Ач теоретически получают в два раза больше меди, чем в кислотных электролитах, где медь присутствует в виде двухвалентных ионов.
Тот факт, что цианистые электролитный баланс потенциал медь сильно отрицательная с более высоким потенциалом плотности тока переместился от электрических величин служат в качестве основы для суждения невозможности осаждения меди из цианистых электролитов при высоких плотностях тока (по заказу 10 А / дм 2) с теоретическим или вблизи теоретического выхода поток.
На самом деле это справедливо только для разбавленных цианидных электролитов, не страдают от перемешивания и нагрева. При определенных условиях медь может выделяться на электролитах с цианидным катодом, особенно при низком содержании свободного цианида в электролите при высоких температурах и при смешивании при достаточно высокой плотности тока и эффективности тока, близкой к теоретической.
stroitel12.ru

