Методы защиты от коррозии – Основные способы защиты металлов от коррозии
alexxlab | 29.03.2017 | 0 | Вопросы и ответы
Методы защиты металлов от коррозии
Потери железа вследствие ржавления достигают 20% от его ежегодного производства. Поэтому в технике широко используют различные меры защиты металлов, позволяющие свести коррозию к минимуму. Выбор метода защиты зависит от эффективности и экономической целесообразности.
Для защиты металлов от коррозии применяют следующие методы:
1. Легирование – введение добавок, повышающих коррозийную стойкость металлов. Например, при введении в состав стали до 12% хрома получают нержавеющую сталь, устойчивую к коррозии. Добавление цветных металлов – кобальта, никеля, меди усиливает антикоррозийные свойства стали, поскольку повышается склонность сплава к пассивации.
2. Обработка коррозийной среды – уменьшение содержания деполяризатора, нейтрализация кислых сред, удаление из воды кислорода (деаэрация), ее проводят на станциях водоочистки. Для этого воду пропускают через слой железной стружки, которая поглощает кислород из воды. В теплотехнике проводят обессоливание воды, так как соли – активаторы коррозии – значительно ускоряют коррозийный процесс. Для замедления коррозии металла в электролит вводят вещества, которые называются
3. Изоляция металлов от окружающей среды – различного рода покрытия. Покрытия бывают неметаллические, металлические, химические.
В качестве неметаллических покрытий используют самые разнообразные материалы: лаки, краски, эмали, битум, резину, синтетические смолы, полимерные материалы и т.п. Необходимым условием эффективности этого метода является чистота поверхности металла и отсутствие на ней влаги перед обработкой.
Химические покрытия получают путем химической или электрохимической обработки поверхности металла.
Например, оксидирование – обработка поверхности металла раствором кислот, щелочей, различных окислителей и восстановителей. Металл после такой обработки становится «пассивным», т.е. не подвергается коррозии и даже не растворяется в кислотах. Вещества, способствующие возникновению на поверхности металла защитной пленки обычно называют пассивирующими агентами (конц. HNO3, K2Cr2
Фосфатирование – химическая обработка металлической поверхности, приводящая к образованию труднорастворимых фосфатов, которые характеризуются высокой степенью сцепления (адгезии) с основным металлом и хорошо защищает его от коррозии.
Из металлических покрытий широко распространены хромирование, никелирование, лужение, цинкование, серебрение, золочение. Металлические покрытия подразделяются на анодные и катодные.
Анодные покрытия изготавливают из металлов, имеющих меньшие значения электродных потенциалов, чем защищаемый металл.
Например, в случае оцинкованного железа (рисунок 3.1) поверхность железа (3) покрыта слоем цинка (2). До тех пор, пока целостность покрытия не нарушена, поверхность цинка изолирует основной металл (железо) от окружающей среды. Однако как только на цинковой поверхности образуется трещина, царапина или другое механическое повреждение, то кислота (1) входит в контакт с металлами, начинает работать микрогальванический элемент, в котором функцию анода выполняет цинк (Е° = – 0,763 В), а функцию катода – железо (Е° = – 0,440 В).
Рисунок 3.1. Схема разрушения оцинкованного железа в кислой среде
Составим схему и работу этого микрогальванического элемента в кислой
среде:
А (–) Zn | HСl | Fe (+) K A(–): Zn – 2ē = Zn2+ – окисление K(+): 2Н+ + 2ē = Н2 – восстановление Zn + 2Cl– = ZnCl2 |
В этом случае разрушается слой покрытия, а стальная деталь не корродирует.
Подбирая анодные покрытия, необходимо учитывать то обстоятельство, что наиболее эффективно «работают» в роли анодных покрытий те металлы, электродные потенциалы которых максимально отличаются от электродных потенциалов основного металла (другими словами, металл-покрытие и основной металл должны стоять в таблице стандартных электродных потенциалов (см. приложение В) как можно дальше друг от друга).
Разновидностью анодной защиты является протекторная защита (см. рисунок 3.2). В переводе с латинского protector – защитник, покровитель. В этом методе к защищаемой металлической детали (3) припаивают или присоединяют металлическим проводником (2) пластины из более активного металла (1). При этом создается гальванопара, анодом которой является более активный металл, т.е. протектор. В качестве протекторов используют магний, алюминий, магниево-алюминиевые сплавы, цинк (его активность не столь высока, но он имеет низкую стоимость).
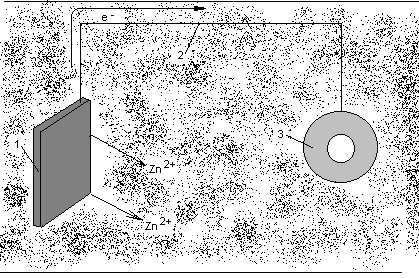
Рисунок 3.2 Схема протекторной защиты.
Металлы, применяемые для изготовления катодных покрытий, имеют больший электродный потенциал, чем защищаемый металл. Например: в случае луженого железа (белая жесть) железо (Е° = – 0,440 В), покрыто оловом (Е° = – 0,136 В).
Защитная роль катодного покрытия существенно отличается от действия анодных покрытий. На первой стадии (до нарушения целостности покрытия) особых различий нет, но как только возникают условия для работы гальванического элемента (оба металла вступают в контакт с агрессивной средой), функцию анода берет на себя основной металл, т.к. его потенциал имеет меньшее значение. В этих условиях коррозийному разрушению подвергается основной металл, а металл покрытия этому разрушению способствует, поляризуясь катодно.
Рассмотрим, как протекает процесс коррозии железа (3), находящегося в контакте с медью (2), во влажном воздухе (3) при нарушении покрытия (см. рисунок 3.3).
Рисунок 3.3 Схема атмосферной коррозии железа, находящегося в контакте с медью
А (–) Fe | H2O, O2 | Cu (+) K A(–): Fe0 – 2ē = Fe2+ K(+): 2Н2О + О20 + 4ē = 4ОН– 2Fe + O2 + 2H2O = 2Fe(OH)2 При дальнейшем окислении железа получим: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 |
Катодное покрытие защищает основной металл от разрушения только при отсутствии повреждений на поверхности покрытия.
Для катодных покрытий целесообразно подбирать те металлы, электродные потенциалы которых в наименьшей степени отличаются от электродного потенциала основного металла (т.е. в таблице стандартных электродных потенциалов (см. приложение В) эти металлы должны находиться как можно ближе друг к другу).
4. Электрохимический метод защиты – катодная защита (метод внешнего потенциала). В этом методе (см. рисунок 3.4) защищаемое изделие (1) подключают к отрицательному полюсу внешнего источника постоянного тока (2), поэтому оно становится катодом, а анодом служит металлолом (3).
Например, защищаемая железная конструкция и вспомогательный (стальной) электрод образуют электрохимическую схему в воде:
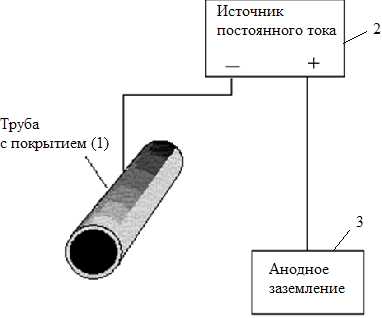
Рисунок 3.4. Схема катодной электрозащиты.
А (–) Fe | H2O | Fe (+) K
A(–): Fe0 – 2ē = Fe2+
K(+): 2Н2О + 2ē = H20 + 2ОН–
Fe + 2H2O = H2 + Fe(OH)2
При дальнейшем окислении железа:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Вспомогательный электрод разрушается и его периодически заменяют новым, а на защищаемой конструкции (катоде) восстанавливается среда (в данном случае – вода), получая электроны не от металла, а от источника тока.
С явлением «коррозия» мы встречаемся постоянно, поскольку изделия из металлов встречаются повсюду: автомобили, самолеты, мосты, станки, водопроводные трубы, железобетонные конструкции, предметы домашнего обихода и др. Борьба с коррозией в настоящее время приобрела особое значение, т. к. в промышленности и в технике применяют высокие температуры и давление, различные агрессивные среды – растворы кислот, солей, щелочей.
Коррозия наносит не только прямой ущерб – разрушение металла, но и косвенный – это связано с выходом из строя различных приборов, машин, металлоконструкций, которые являются более ценными, чем сам металл. Например, при коррозийном разрушении поршней автомобильного двигателя или шасси приводит к тому, что автомобиль теряет свое предназначение. Иногда коррозия приводит к авариям, например, в котельных установках могут происходить взрывы котлов.
Эффективность борьбы с коррозией основана на понимании механизма коррозийных процессов и должна решаться комплексным подходом – применением комбинированных методов защиты с учетом эффективности действия каждого из них в данных конкретных условиях.
studfiles.net
Лекция 11. Коррозия металлов и методы защиты от коррозии
Химическая и электрохимическая коррозия. Способы защиты металлов от коррозии
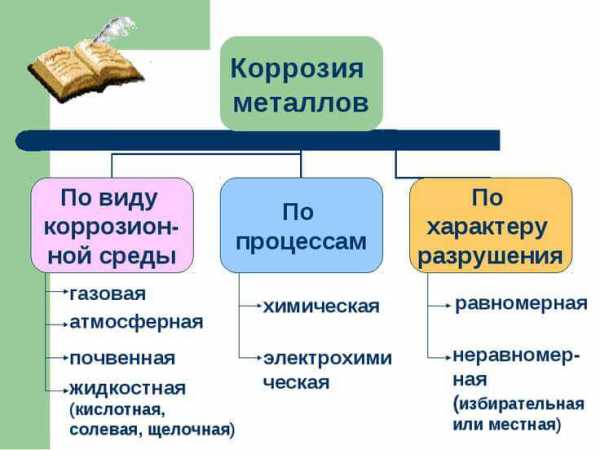
Коррозией называется процесс самопроизвольного разрушения металлов под воздействием внешней среды. Все случаи коррозии принято делать на два вида: химическую и электрохимическую.
Химическая коррозия – это окисление металлов, не сопровождающееся возникновением электрического тока. Примером химической коррозии является образование окалины на железе при высокой температуре без участия электролитов,
Электрохимическая коррозия – разрушение металла, обусловленное его окислением в среде электролита и сопровождающееся возникновением электрического тока в результате образования гальванического элемента, который в этом случае называют коррозионным гальваническим элементом. Работа коррозионного гальванического элемента обусловлена разностью потенциалов активного (анодного) участка и пассивного (катодного) участка. На анодных участках коррозионного гальванического элемента происходит окисление (растворение) основного металла
Анод: Me – Ze = Mez+ .
На катодных участках, в зависимости от состава-среды, может протекать восстановление кислорода, воды или ионов водорода, которые всегда содержатся в воде и растворах, соприкасающихся с воздухом.
Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. Она описывается уравнениями:
Анодный процесс: Me – Ze = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
О2 + 4Н+ + 4ё=2Н2O;
б) в нейтральной и щелочной среде (рН > 7)
О2 + 2Н2О + 4e = 4OH.
Коррозия, сопровождающаяся выделением водорода на катоде, называется коррозией с водородной деполяризацией и описывается уравнениями:
Анодный процесс: Me – Z e = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
2Н+ + 2e = Н2↑;
б) в нейтральной и щелочной среде (рН ≥ 7)
2H2O + 2e = H2↑ + 2OH..
Таким образом, электрохимическая коррозия возможна при условии, когда электроны с анодных участков постоянно отводятся на катодные, а затем удаляются с них окислителем. Коррозионный гальванический элемент изображают следующим образом:
(A) MI| Н2О/Окислитель(О2 или Н+)| МII (примеси) (К).
Выделяемая иногда в отдельный вид грунтовая (почвенная) коррозия может быть сведена к одному из вышеперечисленных случаев.
Примеры решения задач
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов находится в кислой среде (НСl). Составьте схему образующегося при этом гальванического элемента. Какой процесс будет протекать на катоде?
Решение. Исходя из положения металлов в ряду напряжений, находим, что хром более активный металл: (φ0Cr2+/Cr = -0,74 В,φ0Cu2+/Cu = +0,34 В). В образующемся гальваническом элементе он будет выполнять роль анода, а медь – катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод растворяется, а на медном катоде выделяется водород:
Анод:Сr-3е =Сr3+
Катод: 2Н2+ 2е =Н2↑
Пример 2. Какие процессы протекают при коррозии технического железа в атмосферных условиях?
Решение. Техническое железо содержит примеси углерода и некоторых металлов, которые, как правило, менее активны, чем железо, и выполняют роль катода в образующемся гальваническом элементе, основная масса железа является анодом. Адсорбированная на поверхности железа вода, с растворенными в ней кислородом и другими газами, образует пленку электролита.
Схема, образующегося гальванического элемента имеет вид
(A)Fe|H2O/O2|Me(K).
При работе гальванического элемента протекают процессы:
Анод:Fе-2е =Fe2+
Катод: 2Н2О + О2 + 4 e – 4ОH.
Вторичные процессы: Fe2+ +2ОH. = Fe(OH)2,
4Fe(OH)2 + О2 + Н2О = 4Fe(OH)3.
На скорость коррозии влияют как внутренние факторы (наличие дефектов кристаллической решетки металла, механические напряжения и др.), так и внешние: температура, природа и состав электролита. С повышением температуры скорость коррозии, как и большинства химических реакций, возрастает. Усиливают коррозию содержащаяся в атмосфере промышленных городов пыль, SO2, СO2 и другие газы. Поэтому в городах коррозия протекает в 5-10 раз быстрее, чем в сельской местности. Ионы Сl–, присутствующие в морской воде, являются катализаторами коррозии железа и его сплавов, так как адсорбируясь на поверхности металла, разрушают или препятствуют образованию на нем защитных слоев. Кроме того, скорость коррозии двух контактирующих металлов будет тем больше, чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют способы защиты металлов от коррозии.
1. Изменение коррозионной среды – этот метод пригоден для тех случаев, когда защищаемые изделия эксплуатируются в небольшом объеме. Суть метода состоит в удалении из электролита растворенного кислорода или добавлении к этому раствору веществ, замедляющих коррозию – ингибиторов.
2. Легирование металлов. Это введение в состав сплавов компонентов, повышающих химическую стойкость. Наибольшее применение находят нержавеющие стали, в состав которых входит хром (до 15 %) и никель (до 10 %). Кроме того, в качестве легирующих компонентов используют марганец, кремний, вольфрам, молибден, титан и другие металлы.
3. Неметаллические покрытия. Механически защищают металлы от коррозии, изолируя их от влияния внешней среды. Неметаллические покрытия делятся на неорганические и органические. Из неорганических покрытий наиболее распространены оксидные и фосфатные пленки. Так, при кипячении железа в растворе солей фосфорной кислоты (обычно солей Fe и Мn) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере. Среди органических, покрытий наиболее распространенными являются масляные краски, лаки, полимерные пленки. Лакокрасочные покрытия – самый дешевый метод защиты от коррозии.
4. Металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. Анодным является покрытие металлом, электродный потенциал которого меньше, чем у защищаемого металла. Покрытие из металла менее активного (с большим электродным потенциалом), чем защищаемый металл, называется катодным. Если покрытие не нарушено и полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодными и катодными покрытиями нет. При нарушении слоя защищающего металла возникают коррозионные гальванические элементы, в которых защищаемый металл может играть роль или инертного катода, или активного анода. Так, при нарушении в атмосферных условиях алюминиевого покрытия на медном изделии (φ0Al3+/Al= -1,67 В, φ0 Cu2+/Cu = +0,34 В) возникает гальванический элемент (А)А1|Н2О/О2|Cu(К).
В этом элементе, покрывающий металл Аl является анодом, он разрушается (окисляется) и, растворяясь, защищает основной металл, несмотря на нарушение целостности покрывающего слоя:
Анод: Аl – 3 е = Аl3+
Катод: 2Н2О + О2 + 4 е = 4ОН.
Катодное же покрытие (например, свинцовое покрытие железа) в аналогичном случае перестает защищать основной металл и, создавая с ним гальванический элемент, усиливает своим присутствием его коррозию:
(А)Fе|Н2О/О2|Рb(К)
Анод: Fe – 2 e = Fe2+
Катод: Н2О + О2 + 4 е = 4ОН.
5. Электрохимическая защита:
а) катодная защита. Защищаемую конструкцию присоединяют к катоду внешнего источника тока, в результате она становится катодом, не окисляется, на ней идет восстановление компонентов среды. В качестве анода применяют любой металлический лом, ко-торый присоединяют к аноду внешнего источника тока. Таким способом защищают, например, подземные трубопроводы;
б) протекторная защита. Защищаемый металл соединяют с более активным металлом, имеющим меньший электродный потенциал. Последний служит анодом, растворяется и защищает основной металл. Так цинк является протектором для стального корпуса судна:
(А) Zn | Н2О/ О2| Fe (К)
Анод:Zn-2е =Zn2+
Катод: Н2О + О2 + 4e =4ОН.
Для более активной защиты металлических конструкций можно совмещать несколько способов защиты от коррозии, например, покрытие и катодную электрозащиту.
studfiles.net
20_Методы защиты металлов от коррозии
Методы защиты от коррозии
Содержание
Методы защиты металлов от коррозии …………………………………… …….2 Коррозионностойкое легирование………………………………………… …. 2 Обработка коррозионной среды…………………………………………… …. 3 Обработка растворов электролитов……………………………………… …… 3
Ингибиторы…………………………………………………………………… … 3 Номенклатура………………………………………………………………… 4 Механизм ………………………………………………………………………6 Анодные ингибиторы …………………………………………………………7 Катодные ингибиторы …………………………………………………………8
Электрохимическая защита ……………………………………………………..9 Катодная защита внешним током……………………………………………10
Протекторная защита…………………………………………………………10 Защитные покрытия …………………………………………………………….11
Неметаллические защитные покрытия ……………………………..………12 Металлические защитные покрытия…………………………………….…. 13
ЛИТЕРАТУРА ……………………………………………………………….……15
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Методы защиты металлов от коррозии
Для борьбы с коррозией принимают самые разнообразные методы, учитывающие особенности не только самого металла, но и условия эксплуатации металлического изделия. В большинстве случаев можно подобрать тот или иной конструкционный материал для его эксплуатации в коррозионных средах. Когда этот выбор сделать нельзя, приходится защищать металл от коррозии. Выбор того или иного способа защиты определяется его эффективностью и экономической целесообразностью.
Все используемые в практике меры по защите металлов от коррозии можно разделить на несколько групп:
1.Повышение коррозионной стойкости металлов и сплавов легированием.
2.Снижение агрессивности коррозионной среды.
3.Защита электрическим током (электрохимическая защита).
4.Нанесение защитных покрытий.
5.Комбинированные методы защиты и рациональное конструирование.
Коррозионностойкое легирование
К числу мер борьбы с коррозией, основанных на повышении коррозионной стойкости металлов можно отнести термообработку и коррозионностойкое легирование. Термообработка, повышающая коррозионную стойкость металла, способствует гомогенизации структуры металла, снятию внутренних напряжений, предотвращению выпадения карбидов по границам зерен и др.
Во многих случаях высокая коррозионная стойкость металлических конструкций достигается правильным выбором материалов – металлов и сплавов, устойчивых в данной коррозионной среде.
Примером повышения коррозийной стойкости металла легированием являются сплавы меди с золотом (анодное легирование). Для надежной защиты меди необходимо добавлять к ней значительное количество золота (не менее 52,2 ат.%).
Введение хрома в количестве нескольких процентов резко увеличивает коррозионную стойкость сталей. Такие добавки (хрома, никеля, титана, молибдена, меди, кремния, алюминия, бериллия и др.), в большинстве случаев уменьшают анодную активность сплава за счет его пассивации в определенных коррозионных средах.
В отдельных случаях повышение коррозионной стойкости достигается легированием катодными добавками, когда снижение скорости коррозии достигается за счет торможения катодного процесса.
Обычно легирование проводят в том случае, когда металл конструкции не позволяет применять другие методы защиты.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Обработка коррозионной среды
Одним из факторов, определяющих скорость коррозии и характер коррозионных разрушений металлов, является состав коррозионной среды. Понижение агрессивности среды путем ее соответствующей обработки широко используется для предотвращения коррозионных разрушений металлоконструкций.
Обработка коррозионной среды с целью уменьшения ее коррозионной активности по отношению к металлу целесообразна только при ее ограниченном объеме, когда это технологически и экономически оправдано.
Обработка растворов электролитов
Скорость электрохимической коррозии в значительной степени зависит от содержания деполяризатора (ионов водорода или растворенного кислорода) в коррозионной среде. Обработка коррозионной среды с целью снижения ее агрессивности сводится к уменьшению содержания в ней деполяризатора и введения в нее замедлителей (ингибиторов) коррозии металлов.
Уменьшение содержания деполяризатора достигается нейтрализацией кислых растворов, вызывающих коррозию с водородной деполяризацией, или удалением из раствора электролита кислорода, вызывающего коррозию с кислородной деполяризацией.
Обескислороживание воды в замкнутых системах проводят термическим, химическим или десорбционным методами.
Термический – коррозионную среду нагревают до определенной температуры, при которой происходит деаэрация среды за счет удаления кислорода и углекислого газа, что способствует уменьшения скорости коррозии.
Десорбционный – воду перемешивают с инертным газом (азотом). При барботировании кислород переходит в инертный газ и затем уже жидкую и газообразную фазы разделяют.
При химическом способе обескислороживания в воду добавляют восстановители, которые взаимодействуют с растворенным кислородом, связывая его в различные соединения.
В качестве восстановителей используют гидросульфит натрия, сульфит натрия, гидразин, карбогидразид, тиосульфат натрия, сернистый газ (SO2) и др.
Na2SO3 + O2 = 2Na2SO4
Ингибиторы
Ингибирование атмосферной коррозии как черных, так и цветных металлов требует применения химических соединений, выраженной склонностью к по-
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
верхностной адсорбции, и способностью к образованию прочных и устойчивых связей с поверхностью металла.
Ингибиторы коррозии представляют наиболее экономически выгодное, и при этом чрезвычайно мощное средство для борьбы с ущербом, наносимым атмосферной коррозией металлам и сплавам.
Номенклатура
По Фишеру [1], ингибиторы коррозии делятся на две категории:
1.Поверхностные ингибиторы. Поверхностные ингибиторы уменьшают скорость физических, электрохимических и/или химических процессов электродных реакций, протекающих непосредственно на поверхности раздела металл/электролит.
2.Ингибиторы поверхностного слоя. Ингибиторы слоя электролита могут уменьшать физических и химических процессов электродных реакций,
протекающих в слое электролита, примыкающего к поверхности раздела фаз. Этот слой может представлять собой часть двойного слоя, диффузионный слой Нернста или пограничный слой Прандтля. Вещества, растворенные или диспергированные в слое электролита, вызывают ингибирование в слое электролита.
Далее, в зависимости от происхождения активных защитных частиц, Фишер подразделяет ингибиторы на первичные и вторичные:
1.Первичные ингибиторы. Вещества, изначально присутствующие в слое электролита и не изменяющиеся химически.
2.Вторичное ингибирование.Вызывается веществами, которые не присутствуют в электролите изначально. Они генерируются на поверхности раздела фаз или в поверхностном слое электролита путем химических или электрохимических процессов.
Ингибиторы коррозии разделяют, в зависимости от условий их применения, на жидкофазные и парофазные или летучие. Жидкофазные ингибиторы делят в свою очередь на ингибиторы коррозии в нейтральных, щелочных и кислых средах.
В качестве ингибиторов кислотной коррозии применяются почти исключительно органические вещества, содержащие азот, серу или кислород в виде амино-,имино-,тиогрупп, а также в виде карбоксильных, карбонильных и некоторых других групп. Согласно наиболее распространенному мнению, действие ингибиторов кислотной коррозии связано с их адсорбцией на границе раздела металл – кислота. В результате адсорбции ингибиторов наблюдается торможение катодного и анодного процессов, снижающие скорость коррозии.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Влияние того или иного фактора структуры молекулы ингибитора определяется зарядом и природой металла, рН среды, характером адсорбции ингибитора и образующихся связей при взаимодействии металл-ингибитор.
Из вышеприведенного видно, что одним из важных факторов строения молекул органических ингибиторов содержащих гетероатомы азота, кислорода и серы определяющих их защитную способность при коррозии железа, является взаимодействие неподеленной пары электронов гетероатома с незавершенными d- уровнями атома железа.
Введение в молекулу ингибитора электронодонорных заместителей приводит обычно к усилению защитного эффекта ингибитора. Донорная функция соединения в химической реакции, как правило, характеризуется энергией образования их возбужденного состояния за счет перехода неподеленных электронов с несвязывающих орбиталей на разрыхляющие p-орбитали.
При рассмотрении защитного эффекта ингибитора коррозии наряду с электронной плотностью на гетероатомах необходимо учитывать и структурные факторы строения молекулы ингибитора. Структура молекул ингибитора может способствовать увеличению защитного эффекта (образование хелатных структур на поверхности металла, увеличение площади покрываемой молекулой ингибитора), а может снижать защитное действие ингибитора (разветвленность молекулы).
Адсорбция, однако, является лишь необходимым условием проявления ингибирующего действия органических веществ, но не определяет полностью фактического эффекта ингибиторов. Последний зависит также от многих других факторов – электрохимических особенностей протекания данного коррозионного процесса, характера катодной реакции, величины и природы перенапряжения водорода (при коррозии с водородной деполяризацией), возможных химических превращений ингибитора в ходе коррозии и т.д.
Действие большинства ингибиторов кислотной коррозии усиливается при одновременном введении добавок поверхностно – активных анионов: галогенидов, сульфидов и роданидов.
В качестве ингибиторов для нейтральных растворов чаще всего применяются неорганические вещества анионного типа. Их тормозящее действие связано, повидимому, или с окислением поверхности металла (нитриты, хроматы), или с образованием пленки труднорастворимого соединения между металлом, данным анионом и, возможно, кислородом (фосфаты, полифосфаты).
Для ингибирования железа полифосфатами необходимо присутствие растворенного кислорода в коррозионной среде (вода). В отсутствие растворенного кислорода, при содержании в растворе полифосфата натрия в количестве 60 мг/л, коррозия ускоряется. В случае комплексов фосфорсодержащих соединений с 2-хвалентными катионами (Zn, Ca, Mg) защитное действие ингибитора
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

увеличивается. Это объясняется образованием на поверхности металла трудно растворимых пленок гидроксокомплексов катионов щелочноземельных металлов.
Все ингибиторы для нейтральных сред тормозят преимущественно анодную реакцию, смещая стационарный потенциал в положительную сторону.
До настоящего времени еще не удалось найти эффективных ингибиторов коррозии металлов в щелочных растворах. Некоторым тормозящим действием обладают лишь высокомолекулярные соединения.
Летучие ингибиторы коррозии – вторичные ингибиторы поверхностного слоя электролита, обладающие достаточным давлением насыщенного пара в атмосферных условиях, и обеспечивающие таким образом заметный перенос веще- ства-ингибитораиз паровой фазы.
По определению, к ЛИК можно отнести только вещества, обладающие достаточным давлением насыщенного пара в атмосферных условиях, и способные действовать как ингибиторы поверхностного слоя электролита путем электрохимического изменения кинетики электродных реакций.
Механизм
Процесс замедления коррозии железа сопровождается адсорбцией молекул ингибитора на активных центрах поверхности металла. Действие ингибитора выражается в экранировании поверхности металла и изменении энергии активации коррозионного процесса.
Балезин [2] подчеркивает, что каждый ингибитор коррозии, в том числе и летучие ингибиторы, должны обладать следующими свойствами:
1.Способностью образовывать устойчивую связь с поверхностью металла при данном составе окружающей среды и в определенном диапазоне кислотности и давления.
2.Создавать слой, непроницаемый для ионов, вызывающих коррозию.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Механизм ингибирования проиллюстрирован на рисунке.
Функциональная группа R1, связанная с ядроммолекулы-ингибитораR0, обеспечивает адсорбцию на поверхности при данном составе окружающей среды. Функциональная группа R2, также связанная с ядром R0, отвечает за толщину и непроницаемость образующейся пленки. При разработке ингибиторов для определенного состава окружающей среды необходимо вначале варьировать функциональную группу R1 до тех пор. пока не будет получено вещество, прочно адсорбирующееся на поверхности металла. После выбора группы R1, группа R2 варьировалась до достижения удовлетворительной устойчивости к проникновению агрессивных ионов. Использование такого подхода позволило разработать ингибиторы коррозии, эффективные для большого числа металлов и различных составов окружающей среды.
По механизму своего действия на процесс электрохимической коррозии ингибиторы делятся на катодные и анодные, в зависимости от того, каким электродным процессом в локальных гальванических элементах они препятствуют, а также экранирующие (изолирующие активную поверхность металла от коррозионной среды).
Анодные ингибиторы
Как правило, способствуют переходу анодного участка локального гальванического элемента в пассивное состояние или образованию на них защитных пленок, представляющих собой труднорастворимые продукты взаимодействия ингибитора с переходящими в раствор ионами металла. Образование сплошных нерастворимых пленок на металле препятствует дальнейшему протеканию анодного процесса при коррозии металлов.
Анодные ингибиторы чаще всего используют в нейтральных средах при коррозии с кислородной деполяризацией. К таким ингибиторам относятся неорганические вещества-окислители:хроматы, бихроматы, нитриты, молибдаты, вольфраматы щелочных металлов.
Являясь деполяризаторами, они легко восстанавливаются на катодных участках поверхности металла и способствуют возрастанию плотности коррозионного тока. Увеличение на анодных участках плотности тока, превышающей величину необходимую для пассивации металла, сдвигает потенциал металла в область пассивации и скорость анодного процесса растворения металла резко снижается.
Ингибирующее действие фосфатов, полифосфатов, боратов, силикатов, солей бензойной и адипиновой кислот проявляется только при наличии в электролите растворенного кислорода, который и играет роль пассиватора. Эти вещества способствуют адсорбции кислорода на поверхности металла, переводя его в пассивное состояние. Помимо этого, они тормозят анодный процесс растворе-
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ния металла за счет образования труднорастворимых защитных пленок самого разнообразного характера.
Для обеспечения эффективной защиты металлов от коррозии с помощью анодных ингибиторов необходимо поддерживать концентрацию ингибитора выше предельного во всех участках защищаемого изделия. В противном случае пассивация может не наступить или будет неполной. Неполная пассивация приводит к сокращению анодных участков, увеличению скорости и глубины разрушения металла на локализованных участках.
При определенных условиях анодные ингибиторы коррозии могут превратиться в ее стимуляторы. Это характерно для коррозионных процессов, протекающих с катодным контролем. В этом случае окислители легко восстанавливаются на катодных участках и тем самым увеличивают как скорость катодного процесса, так и скорость коррозии металла. Поэтому анодные ингибиторы относятся к категории опасных.
Применение анодных ингибиторов разнообразно. Хроматы и бихроматы используют для защиты стальных конструкций в оборотных охлаждающих водах резервуаров, баков, башенных холодильников, в двигателях внутреннего сгорания, а также для защиты алюминия, магния и их сплавов в нейтральных и щелочных растворах. Нитриты используются как ингибиторы в антифризах. Фосфаты и полифосфаты применяют как ингибиторы стали в воде и холодильных рассолах. Большой эффект достигается при совместном присутствии фосфатов и хроматов.
Катодные ингибиторы
Не изменяют числа и площади анодов локальных гальванических элементов, а замедляют вызывающие коррозию анодные процессы за счет снижения эффективности катодного процесса или сокращения площади катодов коррозионной гальванопары. Катодные ингибиторы, прочно адсорбируясь на катодных участках поверхности металла, обычно увеличивают перенапряжение катодного процесса, препятствуя перемещению деполяризующего вещества (ионов водорода или кислорода) к катодным участкам корродирующей поверхности. Снижение скорости катодного процесса при коррозии с кислородной деполяризацией может быть достигнуто за счет уменьшения содержания кислорода в коррозионной среде, а при коррозии с водородной деполяризацией за счет повышения перенапряжения реакции выделения водорода.
Уменьшение содержания растворенного в жидкой коррозионной среде кислорода тормозит реакцию его катодного восстановления, а следовательно, и скорость коррозии металла.
Перенапряжение катодной реакции выделения водорода может быть достигнуто при введении в коррозионную среду солей тяжелых металлов, обладающих
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
высоким перенапряжением для водорода, и органических веществ, в молекулах которых содержатся полярные группы.
Катионы тяжелых металлов (Hg, Pb, Bi, As), контактно восстанавливаются на катодных участках, затрудняя реакцию выделения водорода и соответственно коррозию металла, протекающую с водородной деполяризацией.
Катодные ингибиторы коррозии чаще всего применяют при травлении металлов в металлургическом производстве для удаления окалины и ржавчины с поверхности металла. При введении органических ингибиторов в травильный раствор скорость растворения металла значительно уменьшается, а растворяются преимущественно оксиды (окалина или ржавчина), на которых катодные ингибиторы не адсорбируются (или адсорбируются очень слабо) и потому не мешают их растворению.
В качестве катодных ингибиторов кислотной коррозии применяют азотсодержащие и серосодержащие органические вещества, ацетиленовые соединения, например, диэтиламин, уротропин, тиокрезол и др.
Катодные ингибиторы по защитному действию менее эффективны, чем анодные. Однако, они совершенно безопасны, так как не вызывают усиления коррозии при их недостаточном содержании.
Электрохимическая защита
Сущность электрохимической защиты заключается в том, что металлоконструкции подвергают внешней поляризации (катодной или анодной). В зависимости от вида поляризации различают катодную и анодную защиту.
Все электрохимические методы защиты основаны на изменении скорости протекания анодных или катодных процессов при электрохимической коррозии металлов. Материальный эффект (разрушение металла) связан с протеканием анодной реакции:
Ме – nе = Меn+ | Анодный процесс |
2Н+ + 2е = Н2 | Катодный процесс |
Подавая из внешней среды на металл электроны, можно менять скорость электрохимических реакций: уменьшать скорость анодной реакции, увеличивать скорость катодной реакции. При этом можно подобрать такие условия, при которых ток анодного растворения ja = 0. В этом случае коррозии наблюдаться не будет.
Наиболее распространенным случаем электрохимической защиты является катодная защита: внешним током или протекторная.
Сущность катодной защиты сводится к подаче на защищаемое сооружение избытка электронов, которые затрудняют окисление металла. Катодную поляризацию можно осуществлять путем присоединения защищаемой конструкции к
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отрицательному полюсу внешнего источника постоянного тока или к металлу имеющему более электроотрицательный электродный потенциал. В последнем случае нет необходимости во внешнем источнике тока, так как образуется гальванический элемент с тем же направлением тока, т.е. защищаемая деталь становится катодом, а более отрицательный металл (протектор) – анодом.
Катодная защита внешним током
Катодная защита внешним током заключается в том, что защищаемую металлическую конструкцию присоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу вспомогательный электрод, который работает как анод. При пропускании электрического тока через систему потенциал защищаемого металла смещается в отрицательную сторону, что приводит к ослаблению работы локальных анодов или превращению их в катоды, на которых восстанавливается окислитель (деполяризатор), что приводит к уменьшению или полному прекращению коррозионного разрушения. Для полного прекращения электрохимической коррозии металла его нужно катодно заполяризовать до равновесного или более отрицательного значения потенциала.
Анод подвергается активному разрушению. В качестве материала анода используют металлический лом (старые трубы, рельсы и др.). Для защиты более ответственных сооружений (газо- и нефтепроводов) используют устойчивые к растворению материалы и сплавы (графит, уголь, кремнистые чугуны, легированные медью).
Для снижения при прохождении электрического тока переходного сопротивления системы почва-анодслой почвы в непосредственной близости от анода поливают соленой водой или же анод помещают в толстый слой кокса, в который добавляют поваренную соль.
Катодную защиту внешним током применяют для защиты от коррозии подземных металлических сооружений – газо- и нефтепроводов, резервуаров, подводных поверхностей металлических сооружений – обшивки судов, свай и др. В последнее время расширилось применение катодной защиты для предупреждения коррозии заводской аппаратуры – реакторов, теплообменников, варочных котлов и др.
Катодную защиту внешним током широко применяют как дополнительное средство защиты к изоляционному покрытию. Эффективность защиты при этом значительно увеличивается, так как улучшается распределение защитного тока, который протекает в основном по обнаженным участкам металла.
Протекторная защита
Протекторная защита металлических конструкций от коррозии заключается в том, что к защищаемой конструкции присоединяют металл, потенциал которого
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
studfiles.net
Лучшие способы защиты от коррозии металлов
 Под воздействием внешних факторов (жидкости, газы, агрессивные химические соединения) разрушаются любые материалы. Не являются исключением и металлы. Коррозийные процессы нейтрализовать полностью невозможно, но вот снизить их интенсивность, повысив тем самым эксплуатационный срок металлоконструкций или иных, в состав которых входит «железо», вполне возможно.
Под воздействием внешних факторов (жидкости, газы, агрессивные химические соединения) разрушаются любые материалы. Не являются исключением и металлы. Коррозийные процессы нейтрализовать полностью невозможно, но вот снизить их интенсивность, повысив тем самым эксплуатационный срок металлоконструкций или иных, в состав которых входит «железо», вполне возможно.
Способы антикоррозийной защиты
Все способы защиты от коррозии можно условно классифицировать как методики, которые применимы или до начала эксплуатации образца (группа 1), или уже после его ввода в строй (группа 2).
Первая
- Повышение сопротивляемости «химическому» воздействию.
- Исключение прямого контакта с агрессивными веществами (изоляция поверхностная).
Вторая
- Снижение степени агрессивности окружающей среды (в зависимости от условий эксплуатации).
- Использование ЭМ полей (к примеру, «наложение» внешних эл/токов, регулирование их плотности и ряд других методик).
Применение того или иного способа защиты определяется индивидуально для каждой конструкции и зависит от нескольких факторов:
- вид металла;
- условия его эксплуатации;
- сложность проведения антикоррозийных мероприятий;
- производственные возможности;
- экономическая целесообразность.
В свою очередь, все методики подразделяются на активные (подразумевающие постоянное «воздействие» на материал), пассивные (которые можно охарактеризовать как многоразового применения) и технологические (использующиеся на этапе изготовления образцов).
Активные
Катодная защита
Целесообразно использовать, если среда, с которой контактирует металл – электропроводящая. На материал подается (систематически или постоянно) большой «минусовой» потенциал, который делает в принципе невозможным его окисление.
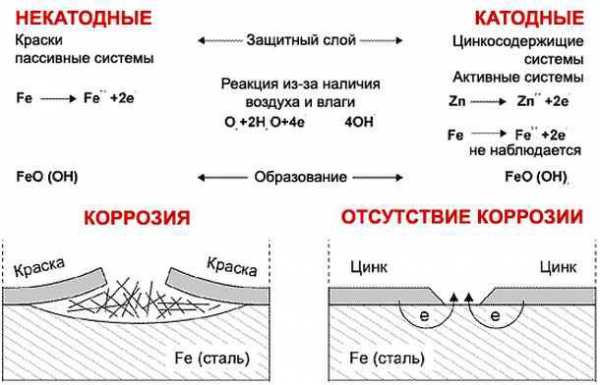
Протекторная защита
Заключается в катодной поляризации. Образец связывается контактом с материалом, который более подвержен окислению в данной токопроводящей среде (протектором). По сути, он является своего рода «громоотводом», принимая на себя весь «негатив», который создают агрессивные вещества. Но такой протектор нуждается в периодической замене на новый.
Поляризация анодная
Применяется крайне редко и заключается в поддержании «инертности» материала по отношению к внешним воздействиям.

Пассивные (поверхностная обработка металла)
Создание защитной пленки
Одна из самых распространенных и малозатратных методик борьбы с коррозией. Для создания поверхностного слоя используются вещества, которые должны соответствовать следующим основным требованиям – быть инертными по отношению к агрессивным хим/соединениям, не проводить эл/ток и обладать повышенной адгезией (хорошо скрепляться с основой).
Все используемые вещества в момент обработки металлов находятся в жидком или «аэрозольном» состоянии, от чего зависит и способ их нанесения – окраска или напыление. Для этого применяются лакокрасочные составы, различные мастики и полимеры.
Прокладка металлоконструкций в защитных «желобах»
Это характерно для разного вида трубопроводов и коммуникаций инженерных систем. В данном случае роль изолятора играет воздушная «прослойка» между внутренними стенками канала и поверхностью металла.
Фосфатирование
 Металлы подвергаются обработке специальными средствами (окислителями). Они вступают с основой в реакцию, в результате чего на ее поверхности происходит отложение малорастворимых хим/соединений. Довольно эффективный способ защиты от влаги.
Металлы подвергаются обработке специальными средствами (окислителями). Они вступают с основой в реакцию, в результате чего на ее поверхности происходит отложение малорастворимых хим/соединений. Довольно эффективный способ защиты от влаги.
Покрытие более устойчивыми материалами
Примерами использования такой методики служат часто встречающиеся в быту изделия с хромировкой (о хромировании читайте здесь), с серебрением, «оцинковкой» и тому подобное.
Как вариант – защита керамикой, стеклом, покрытие бетоном, цементными растворами (обмазка) и так далее.
Пассивация
Смысл заключается в том, чтобы резко снизить химическую активность металла. Для этого производится обработка его поверхности соответствующими спецреактивами.
Снижение агрессивности среды
- Использование веществ, которые снижают интенсивность коррозийных процессов (ингибиторов).
- Осушка воздуха.
- Его хим/очистка (от вредных примесей) и ряд других методик, которые могут применяться и в быту.
- Гидрофобизация почвы (засыпки, введение в нее спецвеществ) с целью снижения агрессивности грунта.
Обработка ядохимикатами
Используется в случаях, когда есть вероятность развития так называемой «биокоррозии».
Технологические способы защиты
Легирование
Самый известный способ. Смысл в том, чтобы на основе металла создать сплав, инертный по отношению к агрессивным воздействиям. Но реализуется только в промышленных масштабах.
Как следует из приведенной информации, не все методики антикоррозийной защиты можно применять в быту. В этом плане возможности «частника» существенно ограничены.
ismith.ru
Способы защиты металлов от коррозии
Человечество за десятки сотен лет возвело вокруг себя большое множество техники. Но стартом для такого широкого развития послужила эпоха, когда люди научились добывать и обрабатывать металл. Благодаря его свойствам стало возможным достигать больших вершин в технике, строить транспортные средства, которые могли доставлять человека на другой конец мира, оружие, чтобы защищается. Но сейчас техника дошла до такого уровня, что одни механизмы создают другие.
Несмотря на то, что в центре всей (или почти всей) техники находится металл, это не самый совершенный материал. С течением времени и влияния на него окружающей средой, он поддается ржавлению. Это явление наносит большей вред данному материалу, и как следствие – ухудшает работу техники, что часто может привести к аварии или катастрофе. В этой статье будет указано все о ржавеющей стали, как происходит этот процесс, и что делать, чтобы его избежать (или устранить).

Что такое ржавчина?
«Ржавчина» – так называют любые виды разрушения этого материала в быту. Если говорить конкретно, то это те покраснения, которые образовываются на металле после реакции с кислородом. Окисление пагубно влияет на этот материал, делая его хрупким, грани – рыхлыми, и уменьшают его твердость, как и эксплуатационные характеристики.
Поэтому на многих заводах используют разные составы для уменьшения трения, защиты от коррозии и других негативных воздействий окружающей среды. Об этом немного позже. Чтобы перейти к защите от такого воздействия, нежно разобраться с тем, как «гниение» влияет на сталь, и как убивает ее кристаллическую решетку.
Природное разрушение может наносить самые разные повреждения:
- Полное повреждение;
- Нарушение плотности кристаллической решетки;
- Избирательное повреждение;
- Подповерхностное.
В зависимости от характера повреждении, могут принимается разные методы борьбы с коррозией. Каждый из возможных повреждений вредит по-своему, и неприемлем в различных направлениях техники и производства. В энергетике подобные разрушения непозволительна вообще (это может привести к утечкам газа, распространению радиации, и так далее).
Видео ролик о том, что такое ржавчина и как от нее защищаться:
Воздействие ржавчины
Чтобы эффективно подбирать механизмы противодействия разрушению структуры металла, необходимо понять, как действует само ржавление. Она может быть двух видов: химической и электрохимической.
К первой – химической – можно отнести процесс того, как грань образца уничтожается просто под воздействием окружающей среды (газами чаще всего). Такая ржавчина на металле образуется за очень долгое время, и как правило, ее весьма легко избежать. Деталь необходимо чистить и наносить антикоррозионные покрытия (краски, лаки и так далее).
Кроем этого, такой процесс порчи железа возникает в влажных, мокрых средах, а также при контакте с органическими веществами, типа нефти, например. Последний случай особенно важно учитывать, так как ржавчина на нефтяных вышках недопустима.
Электрохимическая коррозия более редкая, и происходит в электролитах. Только в данном случае важна не среда, а ток, который производится в результате электризации. Именно он и разрушает металл и его поверхность (по большей части). Поэтому отличить ее можно легко по рассыпчатой поверхности металла.
Чтобы защитить металл от ржавчины нужно учитывать все эти особенности.
Как создать правильную защиту?
Коррозия металлов и способы защиты тесно связаны между собой. Поэтому все процессы защиты можно разделить на всего лишь две группы: улучшение металла во время производства, и нанесение защиты в процессе эксплуатации. К первому можно отнести изменения химического состава, который сделает деталь более стойкой к окружающему влиянию. Такую технику или предметы не нужно дополнительно защищать.
Ко второй же группе защити можно отнести различные покрытия и изоляции рабочего процесса. Избежать разрушения можно несколькими способами: избежать среды, которая ее провоцирует, или добавить что-то, что поможет избавится от распространения порчи металла, вне зависимости от среды и окружения. В домашних условиях возможен только второй вариант, так как повлиять уже готовое изделие человек без специального оборудования, печи и прочего, просто не может.

Как подготовится к воздействию ржавчины
Во время создания металлических изделий, есть два способа, как убрать коррозию или свести к минимуму ее появление. Для этого в структуру либо добавляют вещества (цинк, медь и так далее), которые стойкие к воздействию газов и других негативных раздражителей. Также часто можно встретить обратный эффект.
Как уже упоминалось, есть такой тип коррозии, как избирательный. Он разрушает определенные элементы в складе элементов. Как известно, металл состоит из разных атомов, которые образуют элементы, каждый из которых в разной степени поддается негативным воздействиям. Например, в железе это сера. Чтобы деталь из этого материала служила как можно дольше, из ее химического состава удаляется сера, из которой начинается избирательное разъединение структуры. В домашних условиях такой надежный способ невозможен.
Еще одна антикоррозионная защита может быть при производстве. При производстве наносятся специальные покрытия, которые будут защищать поверхность от внешних повреждений от химической реакции. Конструкционные материалы, которые используются при этом, могут быть только на производстве, так как в общем доступе их приобрести почти нельзя. К тому же, такое нанесение часто производится на автоматических линиях, что повышает надежность и скорость покрытия материала.

Но как бы металл не усовершенствовался, этот материал все равно будет поддаваться негативному давлению со стороны влажности, воздуха, разных газов и в процессе эксплуатации будет портится. Поэтому необходима антикоррозионная защита, которая будет не только влиять на него, но и защищать его от внешнего мира.
Очень сильно на распространение ржавчины влияет кислород. Защита металлов от коррозии также является замедление, а не только предотвращение, распространения такого негативного явления. Для этого в структуру окружающей среды вводятся специальные молекулы – ингибиторы – которые, приникая в поверхность металла, обеспечивают своего рода щит для него.
Также часто используется антикоррозийная пленка, которая может наносится разными способами. Но проще всего (и надежнее), когда ее наносят путем распыления. Используют для этого различные полимерные материалы, краски, эмали и подобное. Они также обволакивают деталь, и ограничивают к нему доступ разрушительной среды. Борьба с коррозией металла может быть самой разнообразной, несмотря на схожесть в процессе. Этот химический процесс неизбежен, и практически всегда достигает цели. Поэтому так много усилий и уходит на то, чтобы предотвратить коррозию. Способы защиты в виду этого могут комбинироваться.

Это основные методы защиты. Они популярны из-за простоты, надежности и удобства. К ним также можно отнести покрытие лаками и эмалями, но про это немного ниже.
Так, например, перед нанесением краски или эмали, работники смазывают изделие грунтовкой, чтобы краска лучше «легла» на поверхность, и между ней и изделием не осталось влаги (которую грунтовка вбирает). Эти методы защиты металлов от коррозии не всегда делаются на производстве. Домашних инструментов вполне хватит, чтобы сделать такие операции самостоятельно.
Антикоррозионная защита порой бывает весьма необычной. Например, когда один металл защищен другим. К такому приему часто прибегают, когда химический сплав нельзя изменить. Его поверхность покрывается другим материалом, который переполнен вкраплениями элементов, неподдающихся коррозийным воздействиям. Это так называемым антикоррозийный слой помогает очень надежно сохранить поверхность более чувствительного материала. К примеру, покрытие может быть из хрома.
К подобному относят и протекторную защиту металлов от коррозии. В данном случае защищаемая поверхность покрывается металлом, у которого низкая проводимость электричества (которое является одной из основных причин коррозии). Но это применяется тогда, когда контакт с окружающей средой сводится к минимуму. Поэтому подобная защита металлов от ржавчины и других опасных химических процессов, используется в комбинации, например, с ингибиторами.

Такие способы защиты применяются для того, чтобы избежать механических воздействий. То, как защитить металл надежнее всего – сказать сложно. Каждый метод может давать свои положительные результаты.
Как добиться качественного покрытия?
Не всегда защиты металла от коррозии ложится на плечи производителей. Часто заботиться о таком изделии нужно самостоятельно, и тогда лучшей схемой усовершенствования стойкости детали становится нанесение покрытия.
Первым делом, оно должно быть полностью чистым. К «грязи» можно отнести:
- Жиры
- Остатки масла
- Окислы
Устранять их нужно правильно и полностью. К примеру, нужно брать специальную жидкость на основе спирта или бензина, чтобы вода дополнительно не повредила структуру. К тому же, влажность на поверхности может остаться, и нанесенная поверх нее краска попросту не будет выполнять свои функции.
В замкнутой среде (между поверхностью и краской) коррозия железа будет развивается еще активнее, поэтому такая защита металла от коррозии скорее нанесет ему вред, чем поможет. Поэтому важно избегать также и влаги. После устранения грязи необходимо просушить его.

После этого можно наносить необходимое покрытие. Но все же это лучший способ защиты от ржавчины в домашних условиях. Хоть способы защиты от коррозии металлов могут быть разными, всегда нужно помнить, что неправильное их использование может привести к неприятностям. Поэтому не нужно придумывать что-то неординарное, лучше использовать уже проверенные и надежные методы защиты от коррозии металлов.
Также стоит отметить, что поверхность агрегата может быть обработана несколькими способами:
- Химическими
- Электрохимическим
- Механическим
Последний является самым простым методом того, как остановить коррозию. Первые два пункта из списка представляют собой более сложные (в техническом плане) процессы, от чего антикоррозионная защита становится надежнее. Ведь они обезжиривают металл, что делает его более удобным для нанесения на него защитного покрытия. До покрытия должно пройти не более 6-7 часов, так как за это время контакт со средой «восстановит» предыдущий результат, который был до обработки.
Защита от коррозии должна производится – по большей части – на заводе и при производстве. Но не нужно полагаться только на нее. Домашнее средство от коррозии также не повредит.

Можно ли навсегда избавится от коррозии?
Несмотря на простоту ответа, он должен быть развернутым. Коррозию и защиту металлов от коррозии нельзя отделять друг от друга, так как в их основе лежит химический состав как самого изделия, так и его окружающей атмосферы. Не зря способы борьбы с коррозией основываются именно на этих показателях. Они либо убирают «слабые» частицы кристаллической решетки (либо добавляют в нее более надежные вкрапления), либо же помогают «спрятать» поверхность изделия от газов и воздействий извне.
Антикоррозионная защита не являет собой ничего хитрого. В ее основе простая химия, и законы физики, которые также указывают на то, избежать каких-либо процессов во взаимодействии элементов невозможно. Противокоррозионная защита уменьшает вероятность развития такого исхода, повышает долговечность металла, но все же – окончательно его не спасает. Какой бы ни была она, ее все равно нужно обновлять, улучшать и комбинировать, и использовать дополнительные способы защиты металлов от коррозии.
Сказать, как предотвратить коррозию можно, но вот стремится к тому, чтобы железо вообще было ей не подвластно – не стоит. Покрытие также поддается разрушительной силе окружающего мира, и, если за этим не следить, газы и влажность доберутся и до защищенной поверхности, который под ней прячется. Коррозия и защита металлов крайне необходима (как на производстве, так и в процессе эксплуатации), но к ней тоже нужно относится с умом.
oxmetall.ru
Защита от коррозии металлов: способы, методы, советы

Применение защиты от коррозии металлов — актуальный вопрос для многих.
Коррозия, по сути, является самопроизвольным процессом разрушения металлов, причиной которого является неблагоприятное воздействие окружающей среды, вследствие чего происходят химические, физико-химические процессы, приводящие к печальным последствиям.
Коррозия, воздействуя на металл, может полностью уничтожить его. Поэтому необходимо бороться с возникающей ржавчиной.
И не только в момент ее появления. Также важна профилактическая работа по предупреждению возникновения коррозии у металлов.
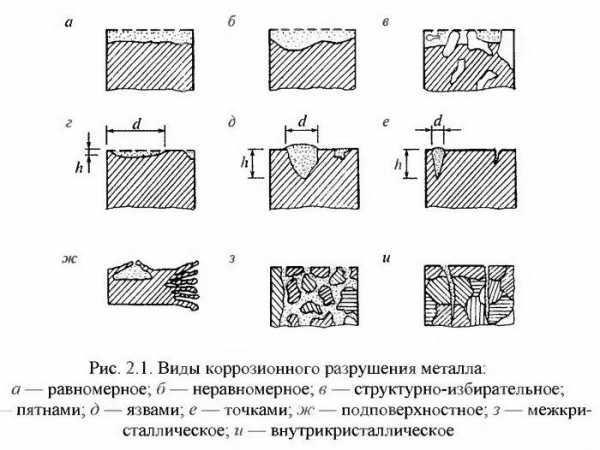
По своему типу различают следующие виды коррозии:
- точечную;
- сплошную;
- сквозную;
- пятнами или язвами;
- послойную;
- подповерхностную и другие.
Возникает коррозия не только под воздействием воды, но и почвы, технического масла. Как мы видим, виды коррозии представлены широко, а вот методы защиты не так многочисленны.
Основные способы защиты
Антикоррозийные способы можно сгруппировать, опираясь на следующие методы:
- электрохимический метод — позволяет уменьшить разрушительный процесс на основе закона гальваники;
- уменьшение агрессивной реакции производственной среды;
- химическое сопротивление металла;
- защита поверхности металла от неблагоприятного воздействия окружающей среды.
Защиту поверхности и гальванический метод применяют уже в момент эксплуатации металлических конструкций и изделий.
К ним относятся следующие способы защиты: катодная, протекторная, а также ингибиторная.
Электрохимическая защита основана на действии электрического тока, под его постоянным воздействием коррозия прекращается.
Внедрение ингибиторов в агрессивную среду, которая соприкасается с металлом, позволяет снизить скорость коррозийных процессов.
Видео:
Химическое сопротивление и защита поверхности относятся к пленочным способам сохранения. Они уже могут применяться как на стадии изготовления металлоизделий, так и в момент эксплуатации.
Выделяют следующие способы: лужение, оцинковку, покраску и прочее. Краска, как защитное покрытие от ржавчины — самый распространенный и используемый метод.
Протекторная антикоррозийная защита металлов
Основной принцип, который определяет протекторная защита — это перенос возникновения коррозии с основной металлоконструкции на заменитель.
То есть к защищаемому металлу присоединяют другой, обладающий отрицательным электрическим потенциалом. Протектор, находясь в рабочем состоянии, разрушается и заменяется на другой.
Актуальна протекторная защита для конструкций, длительное время находящихся в нейтральных средах: воде, земле, грунте.
В качестве протектора используют цинк, магний, железо, алюминий. Яркий пример, где используется протекторная защита — это морские суда, постоянно находящиеся в воде.
Ингибиторное средство
При помощи этого средства снижается агрессивное воздействие масла, кислот, других химических жидкостей. Используется в трубопроводах, металлических цистернах.
Ингибитор хорошо зарекомендовал себя для защиты черных металлов, как покрытие для длительной консервации металлов.
Представлен в виде средства, которое состоит из борной кислоты с диэтаноламином и растительного масла. Входит в состав дизельного топлива, авиационного керосина.
Видео:
При помощи ингибитора металлы хорошо защищены от коррозии в таких средах как трансформаторные масла, нефтяные и содержащие сероводород массы.
Однако активная основа этого средства не растворима в среде минерального масла, тем самым не защищает металл от атмосферной коррозии.
Лакокрасочное покрытие металлов
Краска на сегодняшний день самый доступный и наиболее используемый антикоррозийный материал.
Лакокрасочное покрытие создает механический слой, который создает препятствие для воздействия агрессивной среды на металлоконструкцию или изделие.
Краска может использоваться как до возникновения ржавчины, так и на этапе коррозии.
Во втором случае, перед тем как нанести покрытие, обрабатываемую поверхность нужно подготовить: очистить возникшие коррозийные повреждения, произвести герметизацию трещин, только после этого наносится краска, образуя защитный слой.
При помощи этого средства защищают водопроводные трубы, металлические элементы жилых построек — перила, перегородки.
Еще один плюс этой защиты — краска может быть различна по цветовой гамме, следовательно, покрытие будет служить еще оформлением.
Совместное использование антикоррозийных способов защиты
Различные антикоррозийные методы защиты металла могут применяться совместно. Наиболее часто используется лакокрасочное покрытие и протектор.
Краска, сама по себе, достаточно непрактичный антикоррозийный материал, так как механические, водные, воздушные воздействия могут повредить ее слой.
Протектор обеспечит дополнительную защиту, если лакокрасочное покрытие будет нарушено.
Видео:
Современная краска одновременно может являться протектором или ингибитором. Протекторная защита возникает, если краска в своем составе содержит порошковые металлы: алюминий, цинк, магний.
Эффект ингибитора достигается, если краска содержит ортофосфорную кислоту.
Защиту на производстве определяет СНиП
На производстве защита от коррозии — важный момент, так как ржавчина может привести не только к поломке, но и к катастрофе. СНиП 2.03.11 — 85 — это норма, которой должны руководствоваться на предприятиях, чтобы предотвратить неблагоприятные последствия.
Проведенная лабораторная работа позволила описать в СНиП виды коррозийных повреждений, источники возникновения коррозии, а также рекомендации по обеспечению нормальной эксплуатации металлоконструкций.
В соответствие со СНиП используют следующие методы защиты:
- пропиткой (уплотняющего типа) материалами с повышенной химической стойкостью;
- оклейкой пленочными материалами;
- применением разнообразных лакокрасочных, мастичных, оксидных, металлизированных покрытий.
Таким образом, СНиП дает возможность применять все методы.
Однако, в зависимости от того, где находится конструкция, в какой среде (сильноагрессивной, средне, слабой или полностью неагрессивной) СНиП конкретизирует использование защитных средств, а также оговаривает их состав.
При этом СНиП выделяет еще другое деление сред на твердые, жидкие, газообразные, химические и биологически активные.
По сути СНиП для каждого строительного материала: алюминий, металл, сталь, железобетон и другие, предъявляет свои требования.
СНиП также дает рекомендации по использованию того или иного материала и конструкции, в зависимости от места нахождения – в воде, грунте и др.
В домашних условиях к металлам, к сожалению, применимы не все способы защиты. Основным используемым методом остается покрытие изделия краской.
Остальные же способы используется на производстве.
Похожие статьи
stroyremned.ru
Способы защиты от коррозии
Коррозия — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Более всего подвержены коррозии чистые металлы. Сплавы, пластики и прочие материалы в этом отношении характеризуются термином «старение». Вместо термина «коррозия» также часто применяют термин «ржавление».
Виды коррозии
Коррозионный процесс портит жизнь людям многие века, поэтому он изучен достаточно широко. Существуют различные классификации коррозии в зависимости от типа окружающей среды, от условия использования коррозирующих материалов (находятся ли они под напряжением, если контактируют с другой средой, то постоянно или переменно и пр.) и от множества других факторов.
Электрохимическая коррозия
Коррозировать могут два различных металла, соединенных между собой, если на их стык попадет, например, конденсат из воздуха. У разных металлов различные окислительно-восстановительные потенциалы и на стыке металлов образуется фактически гальванический элемент. При этом металл с более низким потенциалом начинает растворяться, в данном случае, коррозировать. Это проявляется на сварочных швах, вокруг заклепок и болтов.
Для защиты от такого вида коррозии применяют, например, оцинковку. В паре металл-цинк коррозировать должен цинк, но при коррозии у цинка образуется оксидная пленка, которая сильно замедляет процесс коррозии.
Химическая коррозия
Если поверхность металла соприкасается с коррозионно-активной средой, и при этом нет электрохимических процессов, то имеет место т.н. химическая коррозия. Например, образование окалины при взаимодействии металлов с кислородом при высоких температурах.
Борьба с коррозией
Несмотря на то, что сгнивающие на дне моря корабли с сундуками не так уж и плохи для экологии, коррозия металлов ежегодно приносит огромные убытки людям. Поэтому неудивительно, что уже давно существуют различные методы защиты от коррозии металлов.
Различают три вида защиты от коррозии:
Конструкционный метод включает в себя использование сплавов металлов, резиновых прокладок и др.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод — использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.
Пассивная борьба с коррозией – это применение эмалей, лаков, оцинковки и т.п. Покрытие металлов эмалями и лаками направлено на изоляцию металлов от окружающей среды: воздуха, воды, кислот и пр. Оцинковка (как и другие виды напыления) кроме физической изоляции от внешней среды, даже в случае повреждения ее слоя, не даст развиваться коррозии металла, т.к. цинк коррозирует охотнее железа (см. «электрохимическая коррозия» выше по тексту).
Наносить защитные покрытия на металл можно различными способами. Оцинковку можно проводить в горячем цеху, «на холодную», газотермическим напылением. Окраску эмалями можно проводить распылением, валиком или кистью.
Большое внимание надо уделять подготовке поверхности к нанесению защитного покрытия. От того, насколько качественно будет очищена поверхность металла, во многом зависит успех всего комплекса мер по защите от коррозии.
real-color.ru

