Полирование химическое – :
alexxlab | 27.01.2018 | 18 | Вопросы и ответы
Электрохимическое полирование – Химическая обработка
Электрохимическое полирование
Категория:
Химическая обработка
Электрохимическое полирование
Электрохимическое полирование представляет собой процесс, обратный гальваническому осаждению металлов: обрабатываемую деталь помещают в качестве анода в ванну с электролитом и при заданном режиме (плотности тока, температуре и времени погружения) осуществляют съем металла. Процесс анодного растворения используют в операциях очистки поверхности металла, удаления заусенцев и грата, заострения, полирования.
Наибольший интерес представляет электрохимическое полирование. Такое полирование наиболее широко распространено в промышленности, но оно весьма трудоемко, плохо поддается механизации и автоматизации. Этим процессом определяются такие важнейшие критерии качества поверхностного слоя, как макро- и микрогеометрия, наклеп, микроструктура, остаточные напряжения. В прямой зависимости от этих критериев находятся эксплуатационные свойства деталей машин и механизмов — усталостная прочность, отражательная, теплоизлучающая и теплопоглощающая способность, обтекаемость жидкостями и газами, коррозийная стойкость.
Полирование определяет также эстетику изделия.
Сущность процесса
Электрохимическое полирование основано на анодном растворении обрабатываемой поверхности при режимах, которые обеспечивают интенсивное растворение микровыступов шероховатой поверхности и замедленное растворение во впадинах. В результате неравномерной скорости растворения шероховатая поверхность сглаживается, и появляется заметный блеск.
Только в случае преимущественного растворения микровыступов на поверхности металла происходит полирование (сглаживание).
Преимущественное растворение микровыступов может происходить тогда, когда у поверхности металла в результате электролиза образуется пленка низкой электропроводности, состоящая из продуктов анодного растворения.
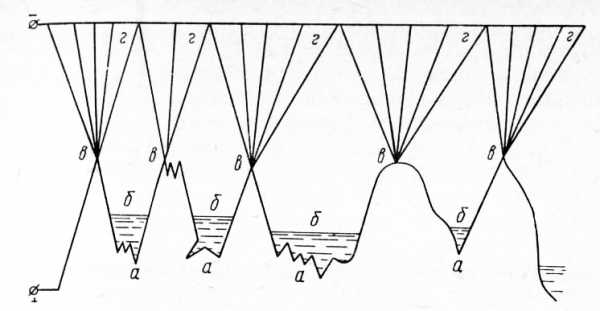
Рис. 1. Схема образования вязкой пленки:
а — впадины; б — вязкая пленка; в — выступы; г — силовые линии тока.
В этом случае толщина пленки, а следовательно, и электрическое сопротивление ее в микровпадинах будут больше, чем на выступах, что и приведет к более интенсивному растворению выступов.
Растворимость анодных продуктов в электролите, скорость диффузии их в электролит, состав и физико-химические свойства анодной пленки имеют существенное значение для процесса полирования. Поэтому этот процесс у различных материалов происходит неодинаково. У многих металлов и сплавов (медь, никель, алюминий, нержавеющие хромистые и хромоникелевые стали) сглаживание сопровождается появлением блеска на обработанной поверхности. У некоторых сплавов (стали карбидного класса, бронзы, латуни) наблюдается блеск без заметного сглаживания шероховатостей. Ряд металлов и сплавов (олово, свинец, серый чугун, высококремнистые стали) вовсе не полируется. Вместо сглаживания образуется’ сильно травленая поверхность с толстыми темными пленками.
Существует несколько гипотез, по-разному объясняющих процесс электрохимического полирования, причем следует отметить, что ни одна из них не объясняет полностью все данные опыта. Наиболее вероятной и логически объясняющей сущность процесса является гипотеза вязкой пленки. Согласно этой гипотезе, электрохимическое полирование может происходить лишь при образовании на поверхности анода в процессе анодного растворения вязкой пленки.
Вязкая пленка состоит из продуктов анодного растворения, обладающих высоким электрическим сопротивлением. Покрывая тонким слоем шероховатую поверхность полируемого металла, эта пленка приобретает неодинаковую толщину на различных участках поверхности. На выступах толщина пленки и соответственно ей критическое сопротивление меньше, чем во впадинах.
Вследствие различного сопротивления пленки и способности электрического тока концентрироваться на остриях плотность тока на выступах будет больше, чем во впадинах. Поэтому скорость растворения вершин выступов будет больше скорости растворения дна впадин. В результате неравномерного распределения плотности тока и вследствие этого различной скорости растворения возникает сглаживание шероховатой поверхности.
Достоинства и недостатки электрохимического полирования
Электрохимическое полирование металлов имеет свои достоинства и недостатки. Главное достоинство метода — высокая производительность. Время полирования практически составляет не более 10 мин., причем габариты детали и форма ее не влияют на производительность. Возможна одновременная обработка такого количества деталей, какое помещается в ванне. Производительность процесса не зависит от твердости и вязкости обрабатываемого материала. Электрохимическое полирование позволяет обрабатывать детали не только простых очертаний, но и сложного профиля, а также внутренние полости, трудно доступные или вовсе не доступные при механическом полировании.
Основное отличие электрохимически полированной поверхности от механически полированной — отсутствие на ней каких-либо следов деформации и структурных изменений. Это — естественное следствие сущности электрохимического процесса, который осуществляется не только без приложения каких бы то ни было механических усилий к обрабатываемой поверхности, но и вовсе без физического прикосновения к ней.
Больше того, электрохимическое полирование удаляет механически деформированный поверхностный слой металла и восстанавливает его истинное строение. В результате анодного растворения поверхность оказывается свободной от механических и термических изменений. Улучшается микрогеометрия; блеск поверхности оказывается больший, чем у механически полированной.
Электрохимическое полирование выявляет дефекты в металле (неметаллические включения, трещины, волосовины, неоднородность структуры).
Поверхности, электрохимически полированные, пассивируются и благодаря этому в 4—6 раз лучше сопротивляются коррозии; они обладают повышенными оптическими свойствами.
Процесс не требует применения полировальных станков, фетровых кругов, абразивных порошков, паст. Возможны автоматизация обработки и одновременное обслуживание нескольких ванн. Значительно облегчаются и оздоровляются условия труда.
Перечисленные достоинства характеризуют несомненное превосходство электрохимического метода над механическим. Однако на нынешней ступени развития этому методу присущи и серьезные недостатки, которые ограничивают применение электрохимического полирования.
Один из основных недостатков — незначительная эффективность сглаживания. Электрохимическим полированием можно улучшить чистоту поверхности на 1—2 класса, причем оно эффективно, если исходная шероховатость не грубее 4—5-го классов. Поэтому при необходимости достигнуть 12—13-го классов приходится механически подготовлять поверхности до 10—11-го классов. Грубо обработанная поверхность (после точения, фрезерования, шлифования), подвергнутая электрохимическому полированию, почти сохраняет макрорельеф поверхности. Сглаживаются полностью лишь отдельные микровыступы и наблюдается закругление гребешков.
Попытки многих исследователей повысить эффективность сглаживания и, по существу, решить задачу электрохимического шлифования практически не привели к положительным результатам. Повышение эффективности сглаживания требует прежде всего применения высоких плотностей тока (более 100 а/см2), что, в свою очередь, приводит к растворению больших толщин металла (0,5—1 мм).
Необходимое время полирования обычно определяется опытным путем и находится, как правило, в пределах 8—10 мин. при полировании сталей. Увеличение производительности полирования сверх 10 мин. не только не ведет к улучшению качества поверхности, но часто, наоборот, ухудшает ее.
Сглаживание следов механической обработки происходит постепенно: после первых 3—4 мин. электрохимического полирования наблюдается уничтожение мелких рисок и появление гладких полированных площадок; после 10 мин. на поверхности остается рельеф грубых рисок, которые в дальнейшем полностью не исчезают, а лишь закругляются, образуя волнистую поверхность. Мы проводили исследования сглаживания при изменении времени полирования от 2 до 20 мин.
Увеличение времени полирования приводит к еще большему растворению металла. Кроме того, оно может вызвать в сплавах вытравливание отдельных структурных составляющих.
Данные этой таблицы показывают, что при возрастании времени полирования шероховатость поверхности улучшается. Однако, начиная с 10 мин. выдержки, улучшение это незначительно, и через 15 и 20 мин. сглаживание наших образцов (сталь У10 закаленная) происходило примерно с одинаковой эффективностью. К этому следует добавить, что значительная эффективность сглаживания сопровождается большим съемом металла. В процессе полирования за 10 мин. растворяется слой металла толщиной 60—100 мк.
Это резко искажает форму и размеры деталей, подвергаемых полированию, и превосходит припуски, оставляемые обычно на полирование.
Кроме того, интенсивное растворение металла приводит к накоплению в электролите большого количества железа (Ре20з). При накоплении Fe203 в количестве 6% к весу электролита полирование становится невозможным.
Так, например, ванна емкостью 10 л при полировании деталей с поверхностью 0,5 дм2 способна практически работать 4—6 суток. Затем железо должно быть удалено из раствора или электролит следует заменить вновь приготовленным.
Однако еще задолго до полного насыщения электролита железом состав электролита в процессе эксплуатации изменяется. Контроль его производят ежедневно, определяя удельный вес, и соответственно корректируют. Убыль воды в результате испарения восполняют довольно частым добавлением горячей воды.
Помимо контроля удельного веса электролита необходимо периодически осуществлять анализ на содержание Сг03, Cr203, h3S04, Н3РО4 и Fe203 и корректировать состав электролита.
При накоплении в электролите 1,5% Сг20з производят под действием тока окисление трехвалентного хрома в шестивалентный, а после окисления электролит прогревают в течение часа при 90—110 °С.
Анализ и корректировка кислот и удаление железа из электролита являются еще более затруднительными операциями. Таким образом, сложность корректировки состава электролита и, в конечном счете, короткий срок службы электролита являются еще одним весьма существенным недостатком электрохимического полирования. Расчеты показывают, что в результате непродолжительного действия электролита и, следовательно, большого удельного расхода кислот электрохимическое полирование в ряде случаев оказывается экономически нерентабельным.

Рис. 2. Зависимость съема металла от времени полирования (углеродистые стали).
Оборудование для электрохимического полирования
Оборудование, предназначенное для осуществления процесса электрохимического полирования, весьма сходно по конструкции с оборудованием, имеющимся в цехах металлопокрытий для операции хромирования.
Основным оборудованием являются ванны, источники постоянного тока низкого напряжения и приборы для измерения и регулирования электрического режима.
Ванны.
Ванны должны быть снабжены электронагревателями, помещенными в защитных, химически стойких, оболочках внутри самой ванны, и водяной рубашкой. Применение двойного нагрева необходимо потому, что при приготовлении и проработке электролита приходится нагревать его до 110—120°С, а в процессе полирования необходимо поддерживать температуру 70—80 °С. Применение водяной рубашки исключает возможность перегрева электролита. Кроме того, она используется для охлаждения проточной водой электролита, который часто перегревается в процессе полирования.
Внутренняя поверхность ванны должна быть облицована химически и температуростойким материалом. В качестве таких материалов для наиболее агрессивного сернофосфорнохромового электролита следует применять свинец, фторопласт-4 либо покрытия из суспензии фторопласта ЗМ или химически стойкой силикатной эмали марки ЛК-1.
В лабораторных условиях могут быть использованы жаростойкое стекло, фарфор, керамика.
Источником питания ванн обычно служат выпрямители селеновые марки ВСГ-ЗМ, купрокеный ВКГ-100 либо германиевый ВАГЗ-9/12-600. При необходимости возможна совместная работа нескольких выпрямителей.
Регулирование тока осуществляется по-разному, в зависимости от режима работы ванны и источника питания. В последнее время в промышленности применяется плавное бесступенчатое регулирование тока изменением напряжения в первичной обмотке трансформатора. Трансформатор смонтирован совместно с селеновым или германиевым выпрямителем. Подробное описание оборудования и схем для регулирования электрического режима можно найти в специальной литературе.
Составы электролитов, их приготовление и корректирование
Для электрохимического полирования предложены сотни различных по составу электролитов.
Это свидетельствует прежде всего о том, что до сих пор не найден состав электролита, который бы удовлетворял следующим основным требованиям:
1) высокой сглаживающей способностью;
2) длительной работоспособностью;
3) способностью полирования многих металлов и сплавов;
4) безопасностью в эксплуатации.
В результате испытаний разных электролитов установлено, что наиболее универсальным в современной технике является электролит, основой которого служит фосфорная кислота с добавлением серной кислоты и хромового ангидрида (фосфорносернохромовый электролит). Всестороннее изучение указанного электролита показало, что в нем практически возможно полировать большое количество марок сталей — от углеродистых до высоколегированных, включая нержавеющие и инструментальные стали. В этом электролите также возможно полировать медь, алюминий и некоторые марки сплавов на их основе.
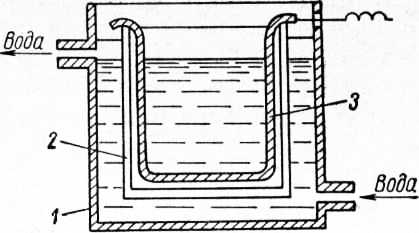
Рис. 3. Ванна для электрохимического полирования:
1 — корпус наружной ванны; 2 — корпус внутренней ванны; 3 — нагреватель.
Приготовление и корректирование электролита
Порядок приготовления электролита следующий: смешивают фосфорную кислоту уд. веса 1,54 и серную кислоту уд. веса 1,82.
В отдельном сосуде растворяют в воде хромовый ангидрид. После отстаивания сливают его в ванну полирования. Затем вливают в ванну расчетное количество ортофосфорной кислоты уд. веса 1,54, а затем серной уд. веса 1,82. Полученную смесь прогревают при 140° С в течение примерно 1,5—2 час. до достижения уд. веса 1,73—1,74 (для полирования углеродистых сталей) и при 110—120 °С — до удельного веса 1,64 (для полирования нержавеющих сталей).
Опыт эксплуатации фосфорносернохромового электролита показывает, что работоспособность его во многом зависит от того, насколько поддерживается в процессе полирования соотношение соединений шестивалентного и трехвалентного хрома.
Если прикатодное пространство не изолировано от общего объема ванны, то в процессе полирования на катоде происходит восстановление хромовой кислоты, причем продукты восстановления повышают вязкость электролита, доводя его до непригодного состояния. Поэтому рекомендуется прикатодную зону изолировать пористой диафрагмой.
Диафрагма представляет собой узкий керамический пористый сосуд (прямоугольный или цилиндрический), в который помещается катод. Материалом для изготовления диафрагм служит смесь красной и шамотной глины (30% шамотной глины) и песка. В зависимости от габаритов катодов и ванны диафрагма формуется с возможно более тонкими стенками и обжигается при 1000— 1100 °С.
При пользовании диафрагмой срок службы электролита возрастает в 5—6 раз. Анодное окисление трехвалентного хрома при накоплении его свыше 2% ведут при анодной плотности тока 10—15 а/дм2, напряжении 10—12 в и температуре электролита 60 °С. Соотношение анода к катоду 1 : 10. Материалом анодов и катодов служит свинец. После окисления электролит рекомендуют прогреть в течение часа при 90—110 °С.
Особенности электрохимического полирования
Исследование работы фосфорносернохромового электролита показывает, что все три кислоты оказывают взаимно благоприятное влияние. Увеличение содержания фосфорной кислоты позволяет понизить плотность тока и напряжение, тогда как увеличение содержания серной кислоты повышает пределы плотности тока. Изменяя концентрацию и соотношение кислот, возможно установить области полирования для заданной марки материала.
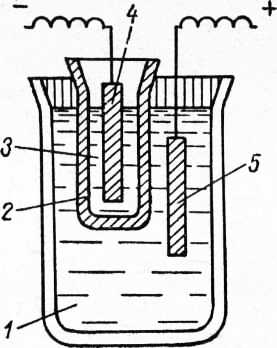
Рис. 4. Схема изоляции прикатодной зоны:
1 — электролит в ванне; 2 — диафрагма; 3 — электролит прикатодной зоны; 4 — катод; 5 — анод.
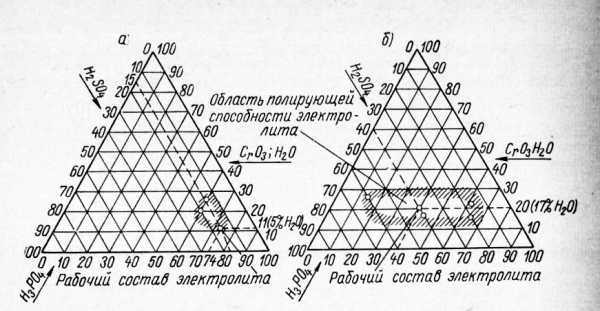
Рис. 5. Полирующая способность фосфорносернохромовых электролитов при полировании:
а — углеродистых и низколегированных сталей; б — нержавеющих хромистых сталей.
Полирование сталей. Фосфорносернохромо-вые электролиты обладают полирующей способностью в широких пределах концентраций: от 60 до 85% фосфорной кислоты и от 15 до 40% —серной кислоты. На рис. 26 приведены диаграммы, иллюстрирующие области полирующей способности электролита углеродистых и нержавеющих групп сталей. Электрохимическое полирование каждой группы сталей имеет свою особенность. При полировании углеродистых сталей, если необходимо максимально сгладить шероховатости и не требуется блеск, следует увеличить содержание воды в электролите до 30—35%, а хромовой кислоты — до 12—15%. В этом случае при плотности тока 15—25 а/дм2 и температуре электролита 70 °С обрабатываемая поверхность приобретает серебристый цвет. Если необходимо сгладить шероховатость с получением блеска, то целесообразнее осуществить процесс в двух растворах: сгладить в электролите с большим содержанием воды и придать блеск в другом электролите с меньшим содержанием воды.
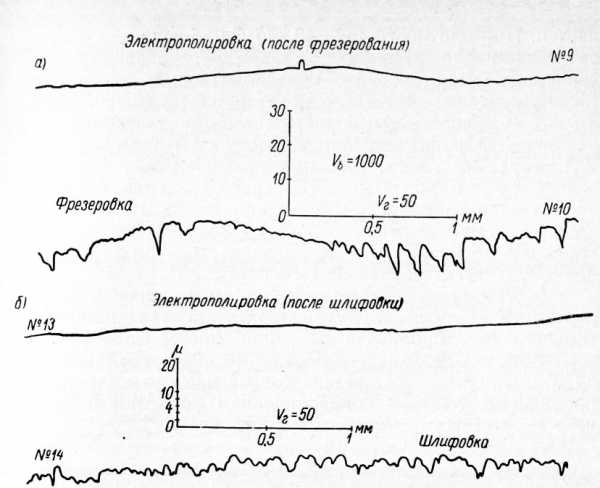
Рис. 6. Профилограммы шероховатости механически обработанных и электрохимически полированных поверхностей нержавеющей стали:
а — фрезерованная и электрохимически полированная после фрезерования; о — шлифованная и электрохимически полированная после шлифования.
Качество поверхности зависит от содержания углерода в стали и ее структуры. Наиболее легко полируются стали со структурой равномерно распределенного феррита и перлита. С увеличением содержания углерода в стали изменяется величина предельного тока, при котором наступает анодная пассивность.
Наименьший ток соответствует низкоуглеродистой стали (0,1%) с почти ферритной структурой; наибольший — среднеуглеродистой стали (0,45%) при соотношении феррита и перлита 1:1. При дальнейшем увеличении содержания углерода, когда структура становится более однородной и преобладает перлитная составляющая, предельный ток вновь снижается.
При полировании хромистых нержавеющих сталей в электролите при плотности тока 20—30 а/дм2 поверхность получается травленой и сглаживания не наблюдается. При плотности тока 40 а/дм2 наблюдается блеск без сглаживания. Наиболее эффективное сглаживание, сопровождаемое блеском, происходит при плотности тока в пределах 50—70 а/дм2. Этой плотности соответствуют профилограммы шероховатости поверхностей различно обработанной нержавеющей стали марки 2X13.
Из профилограмм следует, что поверхность, шлифованную абразивным кругом зернистостью 12 до 7-го класса, возможно отполировать до 9-го класса. Фрезерованную поверхность с шероховатостью 6-го класса возможно отполировать до 9-го класса.
Следует заметить, что в ряде случаев волнистость поверхности не мешает улучшению ее эксплуатационных свойств. Так, например, исходная фрезерованная поверхность после электрохимического полирования, будучи волнистой, обладает повышенной усталостной прочностью, лучшим сопротивлением коррозии и полным отсутствием деформированного слоя.
Температура электролита
Значительное влияние на качество поверхности оказывает температура. При низких температурах (30— 40 °С) полирования не происходит, и поверхность оказывается травленой, матовой. С повышением температуры поверхность становится более блестящей, но травление сохраняется. При температурном интервале 70—80°С получены лучшие результаты.
Для каждого электролита, режима полирования и полируемого сплава существуют пределы температур электролита, отвечающие лучшему качеству поверхности. При чрезмерном снижении температуры электролита против оптимальной повышается вязкость электролита и соответственно вязкость пленки на аноде, а также затрудняется диффузия продуктов анодного растворения. В результате замедляется процесс анодного растворения, полирующее действие электролита ослабляется или полностью прекращается и наблюдается травленая поверхность.
Чрезмерное повышение температуры ускоряет процесс анодного растворения, снижает вязкость электролита и пленки на аноде, облегчает диффузию и уменьшает омическое сопротивление электролита. С повышением температуры усиливается газообразование, на обрабатываемой поверхности появляются полосы и наблюдаются травленые участки.
Несоблюдение главным образом электрического и температурного режимов приводит к появлению различных дефектов при электрохимическом полировании.
Расстояние между электродами и их перемешивание
Расстояние между электродами оказывает заметное влияние на равномерность удаляемого слоя. Так, при расстоянии 20—40 мм происходит значительное растворение (от 0,2 до 0,6 мм). Увеличение расстояния до 150 мм не приводит к существенному улучшению равномерности съема. Увеличение расстояния не позволяет использовать необходимый ток вследствие высокого удельного сопротивления электролита.
Перемешивание электролита ухудшает качество поверхности, покрывая ее темным налетом, причем эффективность сглаживания не возрастает.
Особенности полирования меди
Возможно полирование меди и некоторых ее сплавов (латуней) и в одной ортофосфорной кислоте уд. веса 1,5 (716 г/л Н3Р04). Однако добавление к ортофосфорной кислоте хромового ангидрида позволяет осуществлять процесс полирования в широких пределах плотности тока (20—70 а/дм2) и сократить время полирования до 1—3 мин. Катодами служат свинцовые пластины. Соотношение поверхностей анода и катода 1 : 3.
В процессе полирования меди, как и при полировании сталей, уменьшается содержание воды, кислоты и происходит восстановление Сг03 до Сг20з. Корректирование электролита осуществляется так же, как и при полировании сталей. Вода добавляется до необходимого удельного веса, а кислота — по данным химического анализа. Сгг03 окисляется на аноде в Сг03.
Эффективность сглаживания электролита невелика. Поэтому подготовка механическим шлифованием должна заканчиваться на зернистости 5. Хорошо полируется без всякой предварительной подготовки листовой холоднокатаный материал. В этом случае должна быть проявлена забота о тщательном сохранении поверхности листа от царапин, забоин и других повреждений.
Следует иметь в виду, что раковины, поры и включения хорошо выявляются электрохимическим полированием. Скорость растворения меди при плотности тока 50 а/дм2 составляет 1 мк/мин, причем снижение удельного веса электролита с 1,5 до 1,3 ускоряет процесс растворения.
Особенности полирования алюминия
Характерная особенность полирования алюминия — интенсивное пассивирование полируемой поверхности и вследствие этого снижение плотности тока до очень малых плотностей (1—2 а/дм2) и повышение напряжения до 15—25 в. Эта особенность не должна смущать, хотя она наступает через 2—4 мин. после завешивания детали и несколько ухудшает блеск.
Если полирование осуществляется с целью получения высокой отражательной способности, рекомендуется в этом случае разрушать образующуюся окисную пленку кратковременным переключением тока с анода на катод (реверсированием) либо выключением тока на несколько секунд.
Резкое ухудшение качества полированной поверхности алюминия наступает в результате анодного растворения алюминия. При накоплении в электролите 30 г/л алюминия, по существу, прекращается работа ванны. Контроль и корректирование раствора осуществляют так же, как и в процессе полирования сталей.
Применение электрохимического полирования
Несмотря на существенные недостатки электрохимического полирования и все продолжающиеся исследования в данной области, этот процесс уже сейчас находит эффективное применение в некоторых производствах.
В то же время из-за отсутствия объективных данных и незнания особенностей электрохимического полирования часто возникают значительные затруднения или принимаются ошибочные решения в выборе этого метода.
Применение электрохимического полирования на нынешней стадии развития целесообразно прежде всего там, где затруднено или невозможно механическое полирование (недостаточные для механического полирования поверхности, недопустим нагрев или силовое воздействие, дефекты материала или механической обработки). Так, например, электрохимическому полированию подвергают различные детали арматуры.
Электрохимически полируют детали карбюратора (в частности, клапан подачи горючего из нержавеющей стали или фольги), тончайшую ленту, проволоку и трубы. Особый интерес представляет полирование труб длиной 6—8 м из нержавеющей стали Х18Н9Т. Механическая очистка внутренней поверхности длинных труб вызывает значительные трудности. Химическая очистка труб не решает задачи—она растравливает поверхность и не полностью очищает от окалины. Электрохимическим полированием внутренняя поверхность становится более гладкой, блестящей, повышается коррозийная стойкость, уменьшается трение жидкости и газов о стенки, обеспечивается высокая производительность процесса.
При полировании длинных труб крупного диаметра (больше 100 мм) и других крупных полых деталей внутренняя полость используется в качестве ванны-электро-лизера. Катод в этом случае монтируется в центре трубы. Полирование ведется с протоком электролита через трубу. Трудности полирования больших поверхностей труб заключаются в необходимости применения тока порядка 10 000 а. Столь большой ток вызывает чрезмерный разогрев электролита и выделение большого количества газов. К тому же трудно выполнима подводка большого тока, поэтому трубы крупных диаметров полируют на небольших участках, непрерывно подвигая катод вдоль трубы. Длина катода зависит от диаметра трубы. Например, для трубы диаметром 200 мм длина катода должна быть 170 мм. Электролит циркулирует под давлением до 4 атм, скорость перемещения катода — до 8 м/мин.
В настоящее время разработано несколько конструкций установок для полирования внутренней и наружной поверхностей труб различных диаметров.
Электрохимическое полирование находит применение и в производстве режущего инструмента. Образующийся при шлифовании инструмента дефектный слой легко снимается электрохимическим полированием. В результате повышаются стойкость инструмента и защита от коррозии. Например, электрохимическое полирование канавок сверл обеспечивает более легкий сход стружки при сверлении и меньший разогрев сверла.
Полирование сверл осуществляется партиями, а не по одному сверлу, как при механическом полировании. Объем ванны емкостью 150 л позволяет загружать одновременно до 30 сверл диаметром 10— 15 мм. Для быстрой загрузки сверл сконструированы приспособления — рамки.
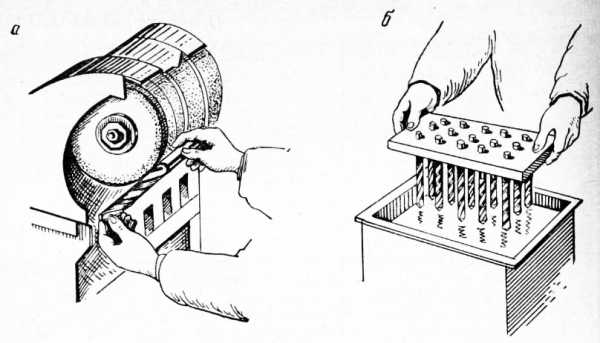
Рис. 7. Полирование сверл:
а — механическое; б — электрохимическое.
Для полирования 1000 сверл диаметром 10 мм в среднем расход электролита составляет 8,7 кг. Соответственно расходуется ортофосфорной кислоты 5,4 кг, серной кислоты — 2,5 кг и хромового ангидрида — 0,8 кг.
Уже указывалось, что электрохимическое полирование удаляет поверхностный слой металла, а многие дефекты материала выступают наружу. Когда преследуют цель декоративной отделки деталей, это свойство является недостатком метода. В случаях необходимости контроля качества поверхности это — несомненное достоинство.
Высокая чувствительность электрохимического полирования к неоднородности состава все больше используется в практике металловедческих лабораторий для контроля качества сталей: выявления микро- и макроструктуры, трещин, флокенов, волосовин, неметаллических включений и других нарушений сплошности металла; определения карбидной неоднородности, склонности сплавов к интеркристаллитной коррозии; обнаружения деформированных участков, явлений термического отпуска тонкого поверхностного слоя. При подготовке шлифов для микроскопического исследования достоинства электрохимического полирования особенно заметны. Поверхность шлифа, полированная электрохимически, освобождается от всех термических и механических изменений (наклепа), неизбежных при механических способах обработки. Она свободна также от каких-либо загрязнений полирующими веществами и пленок, в том числе и окисных, образовавшихся ранее. И хотя полированная поверхность анодно пассивированная, она остается чистой и активной.
Отсутствие на поверхности следов термических воздействий и деформаций и повышенная чистота полированной поверхности позволяют наблюдать истинную, неискаженную структуру исследуемого материала. Электрохимически полированная поверхность особенно удобна для рассмотрения при больших увеличениях. Здесь отчетливо выявляются тончайшие детали структуры, обычно искаженные при механической подготовке (первичное зерно, микроликвация). Электрохимическое полирование в сочетании с химико-механическим методом ускоряет процесс приготовления шлифов.
Реклама:
Читать далее:
Электро-химико-механическая обработка
Статьи по теме:
pereosnastka.ru
Химическое полирование позволяет быстро и качественно обработать поверхности металлических деталей. Большое преимущество такой технологии заключается в том, что с помощью ее (и только ее!) удается отполировать в домашних условиях детали со сложным профилем. Составы растворов для химического полирования Для углеродистых сталей (содержание компонентов указывается в каждом конкретном случае в тех или иных единицах (г/л, процентах, частях)
Для нержавеющей стали
Последний состав применим для полирования чугуна и любых сталей. Для меди
Внимание! В растворы хлористый натрий вводят в последнюю очередь, причем раствор должен быть предварительно охлажден!
Для латуни
Для бронзы
Для никеля и его сплавов (мельхиора и нейзильбера)
Для алюминия и его сплавов
Автор: Л.А. Ерлыкин Читайте еще: |
www.sdelaysam.info
Полировка нержавеющей стали – методы и их отличия + видео
Полироль для нержавеющей стали помогает нам обновить поверхность и очень быстро сделать ее блестящей простым механическим способом. Но это не всегда эффективно. Какие методы более действенные и насколько они доступны для бытового применения?
1 К каким изменениям приводит полирование?
Полировка – финишная стадия при изготовлении различных изделий. Заключается этот процесс в оплавлении поверхностного слоя толщиной 0,01–0,03 мм. В результате устраняются все мелкие дефекты (микротрещины, царапины, раковины и т. д.). Поверхность получается идеально гладкой и отражает свет. Подобный эффект достигается благодаря тому, что глубина неровностей менее длины волны видимого света.

Полировка различных изделий
Рекомендуем ознакомиться
Добиться зеркальной поверхности металла можно и другими способами, например, хонингованием. Но они обычно требуют специального оборудования, материалов и знаний. Поэтому их применение оправдано только когда необходимо обеспечить заданную точность. С полированием все намного проще. Для этой операции используются довольно простые станки, а полировальный инструмент можно сделать даже в домашних условиях. Отлично проявили себя войлок, кожа, мягкая ткань. На рынке и в магазинах продаются специальные пасты, сделанные на основе окиси хрома, трепела или крокуса. Эти материалы используются для механического метода, но существуют еще и химические способы обработки поверхности в специальных растворах.

Зеркальная поверхность металла
Правильно подготовить изделие очень важно. На поверхности не допускается наличие различных дефектов, поэтому перед полированием следует стадия шлифования (снятие более толстого слоя). Чтобы найти скрытые изъяны, полирование начинается с наиболее “слабых” участков. Например, в сварных конструкциях это швы, где чаще всего обнаруживаются микротрещины или раковины. Полировку нержавеющей стали, впрочем, как и иных материалов, делают в несколько подходов, каждый раз подбирая рабочий материал меньшей зернистости. Причем желательно свести количество операций к минимуму.
2 Механические методы – классика, доступная каждому
Это наиболее простой способ добиться зеркально гладкой поверхности. Заключается он в следующем. Высокая скорость вращения полировального материала и возникающее при этом трение приводит к повышению температуры, в результате тончайший поверхностный слой оплавляется и становится идеально гладким.

Механическое полирование материала
Существует два вида полировки – черновая и чистовая. Первая делается более крупнозернистыми материалами и необходима для устранения шероховатости поверхности. В качестве рабочего инструмента выступают специальные пасты или ленты, на которые нанесены абразивные частички. Чистовое полирование – финишный этап. В этом случае нашли свое применение специальные порошки, тонкие полировальные пасты, в состав которых дополнительно входят и поверхностно-активные вещества. Они наносятся только на мягкие круги из эластичного материала, которыми и натирают обрабатываемое изделие.
Делать полирование можно и вручную, но это займет очень много времени. Поэтому придется обзавестись специальной шлифовальной машинкой. Начинается обработка наиболее крупнозернистым материалом, а затем каждый последующий раз необходимо уменьшать размер абразива вдвое. При этом лучше не устанавливать скорость больше 4500 об/мин. Финишное полирование начинают с участков, где заметны мелкие риски.

Специальная шлифовальная машинка
Однако если речь идет о мелких элементах незамысловатой формы, тогда возможно избежать электрополировки нержавеющей стали и использовать ручной метод. В этом случае специальная паста наносится на кусочек войлока либо иной мягкой ткани, и поверхность натирается круговыми движениями. Также ручного способа не избежать при обработке труднодоступных мест, куда шлифовальная машинка не сможет достать.
3 Химическое полирование – особенности и рецепты
При этом способе изделие погружают в химический раствор и держат определенное время. Также очень важно соблюдать температурный режим. В результате протекания химических процессов микронеровности на поверхности расплавляются, и она получается идеально гладкой. Главное преимущество этого способа – скорость полировки, обычно процесс занимает несколько минут. Еще вам не понадобится специальный электроинструмент, источник тока. Вы прилагаете минимум усилий в отличие от ручного метода. Кроме того, поверхность равномерно полируется независимо от конфигурации. Жидкий раствор проникает даже в самые укромные места детали.
При этом всем обилии плюсов есть и некоторые недостатки. Во-первых, это меньший блеск, поэтому такое полирование применимо только когда деталь не нуждается в зеркальной поверхности. Во-вторых, раствор недолговечен, так что придется работать интенсивно после его приготовления. В-третьих, смесь очень агрессивная, поэтому особое внимание необходимо уделить технике безопасности. Работы проводятся только в специальной одежде и при хорошей вентиляции помещения. Для химполировки нержавеющей стали используются растворы на основе кислот.

Химполировка нержавеющей стали
Состав № 1
Смешивается 660 г/л соляной, 230 г/л серной кислоты и 25 г/л кислотного оранжевого красителя. Нагреваем раствор до 70–75 °C и погружаем в него деталь. Достаточно подержать ее около 3 мин. При этом смесь желательно периодически перемешивать либо встряхивать изделие, в противном случае на некоторых участках поверхности могут скапливаться пузырьки газов, что негативно скажется на качестве полировки.
Во всех рецептах предполагается использование концентрированных кислот.
Состав № 2
Еще в раствор можно добавить поверхностно-активные вещества (ПАВ), глицерин и бензиловый спирт. Смесь включает 25–35 частей фосфорной, по 5 ч. азотной и соляной, 0,5 ч. сульфосалициловой кислот и 0,5 ч. двунатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). Также необходимо 1 ч. глицерина, а содержание бензилового спирта не превышает 0,1 ч. В качестве ПАВ используются триэтаноламин, этиленгликоль и оксифос, содержание этих веществ не более 0,015; 0,017 и 0,01 частей соответственно. Изделие из нержавеющей стали предварительно обезжиривается щелочным раствором, затем промывается в проточной воде и высушивается. Тем временем нагреваем смесь до 80 °C и погружаем в нее деталь максимум на 3 минуты.

Погружение изделия в раствор
Состав № 3
В этом случае берется 20–30 % ортофосфорной, 4–5 % азотной и около 4 % соляной кислоты, также в состав входит 1,5 % метилоранжа. Все остальное – дистиллированная вода. Раствор нагревается максимум до 25 °C, а время обработки колеблется от 5 до 10 минут. Чтобы улучшить качество полирования, изделие необходимо периодически шевелить.
4 Электрохимическая полировка – что изменит присутствие тока?
При электрохимической полировке нержавеющей стали изделие тоже погружается в раствор, но только в этом случае через него пропускают электрический ток. На металле есть тонкая оксидная пленка, ее толщина неодинакова на всей поверхности из-за наличия микровпадин и микровыступов. В углублениях она более толстая. Кислотный раствор интенсивней реагирует в местах, где этот защитный слой утончается. Из-за такой разности скорости реакции поверхность получается идеально гладкой и значительно лучшего качества, чем после механической обработки. Покрытия имеют мелкозернистую структуру и лишены пор, благодаря чему значительно снижается коэффициент трения.
К достоинствам этого метода относится высокое качество поверхности, отличная производительность. Электрохимическое полирование не требует физических усилий как при механической обработке, к тому же можно исключить этап обезжиривания. Поверхность полируется очень быстро. Плюс ко всему гальванические покрытия обладают превосходной прочностью сцепления с поверхностями, отполированными механическим методом.

Процесс электрохимической полировки
А вот в недостатки можно записать зависимость от электроэнергии и ее расход. Кроме того, изделие необходимо предварительно отшлифовать механическим способом. Электрохимическая полировка чувствительна к качеству состава, температуре электролита, времени выдержки и плотности пропускаемого тока. Как и в химическом методе, работать придется с вредными для организма составами, поэтому обязательно уделяем должное внимание технике безопасности. Для электрохимического полирования нержавеющих сталей преимущественно используются электролиты на основе серной, хромовой и фосфорных кислот.
Состав № 1
Берется 730 г/л фосфорной и не более 700 г/л серной кислоты. Добавляется триэтаноламин 4–6 г/л и совсем немного катапина (0,5–1,0). Раствор нагревают до температуры не менее 60 °C и не более 80 °C. Через изделие проводится ток плотностью от 20 до 50 А/дм2. Делать электрохимическое полирование нужно около пяти минут.

Состав для полирования
Состав № 2
Детали из хромоникельмолибденовой или хромоникелевой нержавеющей стали помещают в состав из ортофосфорной и серной кислот, взятых в соотношении 65 % и 15 % соответственно. Еще добавляется 12 % глицерина, 5 % хромового ангидрида и очищенная вода (оставшиеся 3 %). Процесс протекает при температуре от 45 до 70 °C и плотности тока около 7 А/дм2. Время выдержки зависит от ряда факторов. Сварные изделия достаточно полировать всего 10–12 минут, а после пескоструйной обработки нужно выдержать в растворе около получаса.
5 Плазменная полировка – сложно, но эффективно
Есть еще один метод обработки поверхности, основанный на процессах в металле при его погружении в раствор и одновременном воздействии высокого напряжения. В отличие от предыдущего метода используются только экологически чистые составы на основе солей аммония.

Плазменный метод обработки изделий
Сущность плазменной полировки нержавеющих сталей заключается в следующем. Изделие обязательно должно быть положительным анодом. При воздействии высоких напряжений более 200 В электролит начинает закипать прямо у поверхности детали, что приводит к образованию тонкой парогазовой оболочки (50–100 мкм). Электрический ток, когда проходит через эту пленку, способствует возникновению плазменных процессов. В местах микровыступов значительно возрастает напряженность электрического поля, что приводит к возникновению импульсных разрядов.

Закипание электролита у поверхности детали
Плазменная полировка удаляет с изделия тончайший слой с повышенным содержанием инородных включений. В результате поверхность имеет зеркальный блеск, обладает высокими адгезионными свойствами. Кроме того, этот метод объединяет в себе сразу три операции: обезжиривание, травление и активацию поверхности. Однако чтобы достичь желаемого результата, поверхность изделия должна быть тщательно подготовлена. Любые дефекты, риски, царапины и прочее после подобной обработки не устранятся, а, наоборот, станут еще более заметными. Поэтому предварительного грубого ручного полирования не избежать.
tutmet.ru
Химическое полирование – Большая Энциклопедия Нефти и Газа, статья, страница 1
Химическое полирование
Cтраница 1
Химическое полирование заключается в том, что обрабатываемую деталь загружают на некоторое время в сосуд с химически активным раствором, где в результате возникающих химических и местных электрохимических процессов происходит растворение металла. [1]
Химическое полирование в отличие от электрохимического не получило еще широкого применения в промышленности, так как с его помощью не удается достигнуть интенсивного блеска. Однако в тех случаях, где механическая полировка затруднена, а поверхность изделий не требует зеркального блеска ( изделия из цветных металлов сложной формы и малых размеров), следует отдать предпочтение химическому полированию. [2]
Химическое полирование применяется реже, чем электрохимическое, так как оно не обеспечивает зеркального блеска поверхности. Однако оно более экономично и проще в выполнении, поэтому обладает несомненными преимуществами перед электрохимическим и механическим полированием, особенно при обработке изделий сложной формы. Электролиты для химического полирования отличаются сильным окислительным действием, почти все они содержат азотную кислоту. Механизм процесса точно не установлен. Предполагают, что он подобен механизму электрохимического полирования. [3]
Химическое полирование наиболее часто применяют для отделки меди и ее сплавов ( бронза, латунь, мельхиор и др.) – Процесс производится в два приема. [4]
Химическое полирование применимо только для чистых металлов или однофазных сплавов, так как в сплавах с гетерогенной структурой идет преимущественно растворение одной из фаз. Более часто применяют метод электролитического полирования. Обычно образец электролитически полируют до тех пор ( при остроконечной форме катодов), пока в нем не возникнут дыры. Тонкие участки вблизи краев дыр вполне пригодны для наблюдения. [5]
Химическое полирование применимо только для чистых металлов или однофазных сплавов, так как в сплавах с гетерогенной структурой идет преимущественно растворение только одной из фаз. Более часто применяют метод электролитического полирования. Обычно образец электролитически полируют до тех пор ( при остроконечной форме катодов), пока в нем не возникают дыры. Тонкие участки вблизи краев дыр вполне пригодны для наблюдения. [6]
Химическое полирование не требует применения электрического тока, что упрощает использование его в производстве. [7]
Химическое полирование целесообразно использовать для декоративной отделки поверхности деталей, в особенности небольших размеров, и подготовки перед осаждением покрытий. Оно менее трудоемко, чем анодная обработка, не требует энергозатрат и применения специальных подвесных приспособлений, но не лишено недостатков, прежде всего – это малый срок службы растворов, трудность их корректирования, а также невозможность регулировать толщину снимаемого металла. Область применения электрохимического полирования значительно шире, так как этот процесс позволяет не только достигнуть высокого блеска и некоторого сглаживания поверхности деталей, но и улучшить ряд важных их эксплуатационных характеристик. [8]
Химическое полирование применяется реже, чем электрохимическое, так как оно не обеспечивает зеркального блеска поверхности. Однако в отношении экономичности и простоты выполнения химическое полирование имеет несомненные преимущества перед электрохимическим и механическим, особенно при обработке изделий сложной формы. Электролиты отличаются сильным окислительным действием, почти все они содержат азотную кислоту. Механизм процесса точно не установлен. Предполагается, что он подобен механизму электрохимического полирования. [9]
Химическое полирование основано на способности стекла растворяться в плавиковой кислоте. Для полирования изделие поочередно погружают в промывную и кислотную ванны. Продолжительность одного погружения в кислотную ванну составляет 2 – 5 сек, в промывную – 10 – 15 сек. Число погружений в полирующую ванну зависит от ее концентрации и производится от 8 до 20 раз. После последнего погружения изделий в кислотную ванну их промывают в промежуточной, а затем в щелочной ванне при температуре 40 – 45 С. [11]
Химическое полирование – новый способ обработки поверхности металлических изделий, принципиально отличающийся от механического полирования. [12]
Химическое полирование также представляет собой электрохимический процесс: здесь имеет место интенсивная деятельность множества гальванопар на поверхности металла, в результате чего идет ее выравнивание. [13]
Химическое полирование в отличие от электрохимического не получило еще широкого применения в промышленности, так как с его помощью не удается достигнуть интенсивного блеска. Однако в тех случаях, где механическая полировка затруднена, а поверхность изделий не требует зеркального блеска ( изделия из цветных металлов сложной формы и малых размеров), следует отдать предпочтение химическому полированию. [14]
Химическое полирование применяется реже, чем электрохимическое, так как оно не обеспечивает зеркального блеска поверхности. Однако оно более экономично и проще в выполнении, поэтому обладает несомненными преимуществами перед электрохимическим и механическим полированием, особенно при обработке изделий сложной формы. Электролиты для химического полирования отличаются сильным окислительным действием, почти все они содержат азотную кислоту. Механизм процесса точно не установлен. Предполагают, что он подобен механизму электрохимического полирования. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Полирование химическое – Справочник химика 21
Полирование химическое деталей из меди и ее сплавов [c.267]Полирование химическое деталей из алюминия и его сплавов [c.267]
Обобщенная теория структурной коррозии металлов, основанная на дифференциальных анодных кривых, позволяет объяснить большое многообразие явлений структурной коррозии, анодное растворение и поверхностную обработку гетерогенных сплавов и агрессивных средах (межкристаллитную коррозию, коррозию под напряжением, ножевую коррозию, точечную и язвенную коррозию, экстрагивную коррозию, коррозию в зазорах, электрополи-рование, химическое полирование, химическое фрезерование , электрохимическое фрезерование и др.) с учетом природы металла и раствора. [c.79]
Полирование химическое поверхности— [c.242]
Химическое полирование. В связи с тем что качество полирования химическим способом ограничено, этот процесс, вероятно, правильнее было бы назвать химическим глянцеванием. При химическом полировании невозможно получить зеркальную поверхность, хотя общая отражательная способность улучшается. [c.63]
Химическое полирование. Химический способ более производителен, чем электрохимический, не требует сложного оборудования и позволяет полировать детали сложной формы и размеров. Недостаток химического полирования — небольшой срок службы полирующих растворов. Из полирующих растворов по мере их работы (особенно при нагревании) испаряются основные составные части пары уксусной кислоты, окислы азота, хлористый водород и т. д. Так как эти вещества обладают различной [c.111]
Хотя принципиально и нет различия между гальванической обработкой непроводника после того, как он сделан проводящим, и гальванической обработкой металла, тем не менее процесс обработки непроводника несколько сложнее. Это объясняется двумя причинами проводящий слой бывает очень тонким и многие непроводники чувствительны к химикалиям, содержащимся в обычных ваннах. Толщина металлического покрытия, нанесенного непосредственно на проводящий слой, зависит главным образом от дальнейшей обработки (например, полирования, химического глянцевания) и от назначения изделия. [c.413]
В отдельных случаях весьма эффективным способом снижения коррозионного разрушения керамических материалов является обработка поверхности механическая (шлифование или полирование), химическая (травление), термическая или химико-термическая. Применяют также защитные покрытия и обмазки. [c.48]
Технологический процесс изготовления фирменных знаков состоит из операций механической подготовки (шлифования и полирования), химической подготовки (Обезжиривания и в зависимости от требований матирования или химического полирования), оксидирования и фотохимической обработки — нанесения светочувствительного слоя, копирования, проявления и закрепления изображения, обжига эмульсии, вторичного оксидирования и окрашивания фона изображения. [c.66]
Ниже будут подробно рассмотрены два метода полирования—химический И электролитический, при которых алюминий подвергается окислительным реакциям. Эти методы являются основой для методов, окончательной обработки алюминия. Они имеют целью вызвать рост оксидной пленки значительной толщины, которая предотвращает доступ атмосферы к метал/1у, а также коррозию, Это достигается применением растворов, содержащих кислоты, которые медленно растворяют образующуюся пленку и под влиянием которых последняя делается пористой, в результате чего открывается доступ для среды, образующей пленку нц металле. При энодном окислении, [c.40]
Полирование химическим методом 1 поверхности в 20 раз дещевле, чем электрохимическим. [c.32]
Бологнези [1901, сравнивая алюминий, электрополиро-ванный в ванне Жаке с алюминием, полированным химически в смеси кислот, нащел, что в 1-н. растворе НС1 в присутствии ртути, злектрополированная поверхность разъедается более быстро, чем химически полированная. [c.81]
На сегодня электрополирование применяется широко для нержавеющих сталей — особенно в случае небольших деталей. Для этого материала механическое полирование относительно дорого, и электролитический метод имеет экономическое преимущество. Для алюминия электрополирование, а также полирование химическим путем используется все шире и шире, особенно на сверхчистом металле. [135]. Лакомб ссылается на фактический отказ от механической полировки во Франции в пользу химического или электролитического метода повсюду, где желательно получить конечную блестящую поверхность, т. е. пленку, которая не меняет отражательную способность находящегося под ними металла [136]. [c.239]
Это относится в равной степени к электролитическим и химическим методам полирования. Химические методы разработаны сравнительно недавно. В связи с тем, что они не требуют применения электрического тока, стоимость их может быть значительно ниже стоимости электрополирования, так как не требуется больших затрат на выпрямители или мотор-генераторы. При химических методах полирования может произойти весьма незначительное ухудшение качества поверхности по сравнению с электрополирован-ной поверхностью после механического полирования ухудшение качества поверхности происходит в меньшей степени. [c.40]
chem21.info
Химические технологии полировки | Inoxgrup
 Что такое химическая полировка?
Что такое химическая полировка?
Химическая полировка является одним из методов отделки поверхности металла. Процесс растворяет и удаляет утолщения микроскопически неровной поверхности путем погружения компонентов в химическую ванну. По сути, это представляет собой химический процесс травления. По сравнению с поверхностью перед полировкой, неровности уменьшаются и поверхность становится более гладкой.
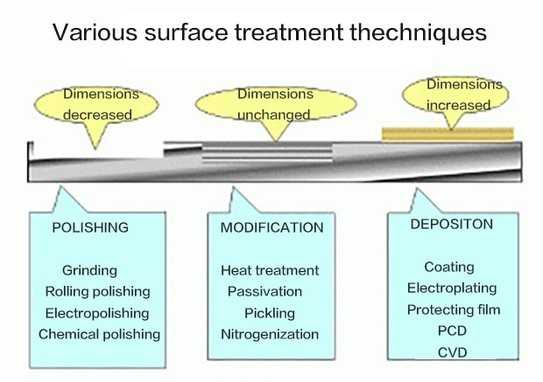
Различные методы обработки поверхности металла
Существует большое количество методов обработки поверхности металла. Некоторые методы, такие как гальванические технологии увеличивают размеры материала. Термическая обработка (отжиг), пассивирование и травление не изменяют размеры. Химическая полировка и Электрополировка являются примерами технологий, которые уменьшают размеры металла.
Электрополировка против химического полирования
В процессе электрохимической полировки (ЭХП), используется низкое напряжение (V~12v) от источника питания постоянного тока в кислой ванне. Металлическая пластина соединена с катодом (-), а деталь, подлежащая полированию соединена с анодом (+). Когда подается напряжение, происходит электрохимическая реакция, и начинается травление металлической поверхности анода. Электрический заряд выше в местах выступов, тем самым процесс устраняет заусенцы, образующиеся после механической обработки. ЭХП улучшает скорость потока внутри трубы, так как микро полости и шероховатости в трубах могут значительно замедлить скорость потока. Кроме того, образование и рост бактериальных колоний будет устранен. Процесс ЭХП также улучшает коррозионную стойкость металла.
Химическая полировка (ХП) использует специальные химические составы (электролиты), куда погружают изделия из нержавеющей стали. Нет необходимости в использовании электроэнергии, процесс не растворяет вытянутые вершины поверхности. После серии промывок и погружений в электролит, изделия становятся яркими и блестящими, что указывает на значительное качество полировки поверхности. Этот процесс является простым, позволяющий достичь высоких результатов полирования внутренних поверхностей трубы.
Из-за особенности процесса, электрохимполированию подлежат трубы относительно большого диаметра. Трубы с маленьким внутренним диаметром (<16мм) и изогнутые трубы не могут быть обработаны ЭХП, не возможно достичь желаемых результатов. Кроме того, процесс ЭХП является более сложным, чем ХП.
Химическому полированию (ХП) подлежат трубы с диаметрами в диапазоне от 3 мм до 400 мм, с длиной 6 м или более. Степень полирования может варьироваться от Ra 0,01 ~ 0,05 мм, с шероховатостью поверхности от 0,05 до 0,25 мкм. Результаты показывают, что конечные результаты полировки, проведенные ХП соответствуют или даже превзошли результаты, достигнутые с ЭХП.
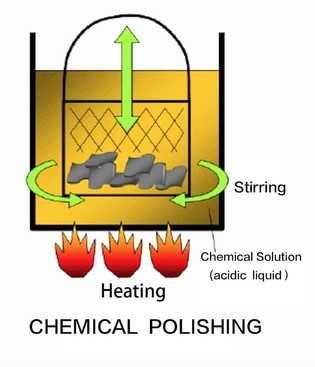 |  |
Преимущества и недостатки различных методов Полировки
Ниже таблица суммирует преимущества и недостатки различных типов методов полировки металлов
| метод | Проблемы | Подходящие приложения |
| Механическая шлифовка | Оставшиеся частицы, и фрагменты остаются на компонентах внутри впадин на поверхности не удаляются. Большое пылевое воздействие на окружающую среду. | Подходит, когда высокий уровень декоративной или гигиенической отделки не требуется. Труд и стоимость оборудования высока. Невозможно отполировать изнутри. |
| Электрохимический | Каждая часть должна быть подвешена и подключена к электродам. Крепление электрода внутри трубы затруднено или не возможно. Требуется нагрев до 70 С и регуляция концентрации раствора. Требуется жесткий экологический контроль и надлежащее нейтрализация сточных вод. | Подходит для относительно больших и простых компонентов Очень низкая эффективность Некоторые компоненты невозможно обработать Некоторые компоненты невозможно заменить химической полировкой |
| Химическая полировка | Любая форма нормально, не нужно подвешивать отдельные части, нет необходимости в электроде. Просто загрузить компоненты в ванну.
Внутренние полости погруженные в химическом растворе становится отполированы.
Требуется, нагрев до 96℃ , нуждается в жестком контроле экологического контроля и надлежащее нейтрализация сточных вод. | Могут быть отполированы внутренние поверхности длинной трубы, из различных компонентов, изогнутые части. Применяется для маленьких и тонких деталей, требующих сверкающей поверхности, деталей не имеющих заусенцев, максимальной чистоты и деталей, которые невозможно отполировать электролитическим способом. Эффективность очень высокая. Вполне возможно заменить Электрополировку, но не наоборот |
Недостатки механической полировки
Механические обработки, такие, как шлифовка, полировка, механическая придают поверхности из нержавеющей стали жесткость. Тому есть несколько причин: наличие посторонних элементы на поверхностях нержавеющей стали вызвано:
(1) поверхностным загрязнением,
(2) физическим или химическим поглощением на поверхности,
(3) образованием нового соединения на поверхности,
(4) чужеродные тела , падающие на поверхность, и влекущие изменения в метаморфический слой во время процесса путем формирования новой структуры поверхности
2. аморфный слой , созданный в связи с изменением структуры решетки. В результате, структура решетки может легко создать деградированный слой:
3. Остаточным поверхностным электростатическим напряжением.
Дефектные поры и остаточные примеси в трубах из нержавеющей стали после галтовки
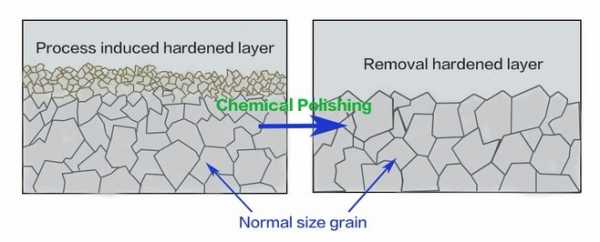
Удаление стресс-индуцированного упрочненного слоя с помощью химической полировки
Закаленный поверхностный слой, вызванный вышеуказанными причинами может быть удален с помощью химической полировки. Компоненты ХП могут восстановить характеристики исходного материала.
Дополнение ионов наружный слой после механической обработки
Каждый химический элемент в нержавеющей стали расположен в соответствии с его собственным потенциалом валентной связи, образуя подходящую структуру металлической решетки. После механической обработки, полировки, шлифовальные процессы, элементы, расположенные на наружном слое, удаляются и деградируют, и эти дефекты в значительной степени снижают коррозийную стойкость нержавеющей стали, агрессивные среды, легко проникают и поглощаются поверхностью обрабатываемой детали. В результате, чистота и стойкость к коррозии поверхности скомпрометированы, зачастую технические характеристики не отвечают требованиям заказчика.
Химическая полировка, электрополирование и пассивирование дополняют гидроксильные и водородные группы.
Сравнение эффективной площади поверхности среди различных труб
| Полировка методы | Шероховатость поверхности | Геометрическая площадь поверхности | эффективная площадь поверхности | Отношение площади поверхности |
| Типичные пластины 2B | 0,20 ~ 0,50 | 16 | 34 | 2,1 |
| Типичная продезинфицировать трубку | 0,20 ~ 0,30 | 16 | 21 | 1,3 |
| Типичная блестящая полированная трубка | 0.10 ~ 0.03 | 16 | 21 | 1,3 |
| 2B Химически полированные гальваническое покрытие трубки | 0.05 ~ 0.20 | 16 | 16 | 1,0 |
После того, как обычная пластина из нержавеющей стали или труба проходит через серию химических процессов, внутренние и наружные поверхности стен будут изменять их характеристики такие как шероховатость, заусенцы, закаленность слоя и т.д. В результате, эффективная площадь поверхности трубы из нержавеющей стали без электролитического или химической полировки гораздо больше ,чем геометрическая площадь поверхности, которая является определяется простым расчетом площади относительно идеальной поверхности. (Смотрите таблицу выше)
шероховатость поверхности и вызывает слипание заусенцев и адсорбцию мелких частиц, замедление скорости потока среды, засорение трубки, рост бактериальной колонии и многих других нежелательных характеристик. Электролитический (EP) или процесс химической полировки (CP) должны быть использован для удовлетворения высоких требований высокоточных технологий изготовления оборудования в.
Например, после того, как трубы ,используемые на заводе по переработке молока заменяются на химполированные, время хранения молока значительно увеличивается, за счет уменьшения нежелательных веществ в молоке, вызывая преждевременное скисание.
Cr / Fe, изменение содержания поверхностного слоя 316L (V / V)
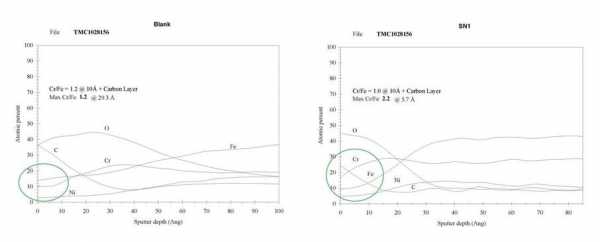
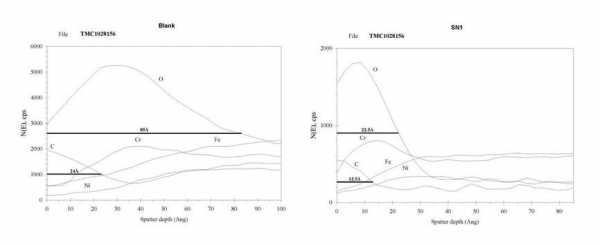
Для ASIS304 / 316 / 316L нержавеющей стали, типичное отношение Cr / Fe, составляет около 0,4. Поскольку молекулы Fe являются более активными, они более склонны вызывать химическую реакцию с внешними веществами и подвержены коррозии нержавеющей стали; химические свойства элемента Cr являются более стабильными, чем соединения Fe и являются более устойчивыми к воздействию агрессивных растворов. После химической полировки, поверхностные элементы, отношение Cr / Fe, достигает 1,0 или выше, и более высокое содержание Cr элемента в поверхностном слое повышает коррозионную стойкость и характеристики стали становятся существенно выше.
| Перед химической полировки | После химической полировки | Высокие стандарты чистоты | Ультра высокиестандарты чистоты |
| ≦ 0,4 ( 0,8 ) | ≧ 3,0 ( 4,0 ) | ≧ 1,0 ( 2,0 ) | ≧ 3,0 (4,0) |
отношение Cr / Fe, (стандарты соответствуют нержавеющей стали)
Изменение характеристик стойкости к коррозии после химической полировки
Шероховатость поверхности Изменение
Изменение поверхности после химической полировки (100х)

Сравнение поверхности из нержавеющей стали после механической полировки (слева) и химической полировки (справа). 20 * 3500
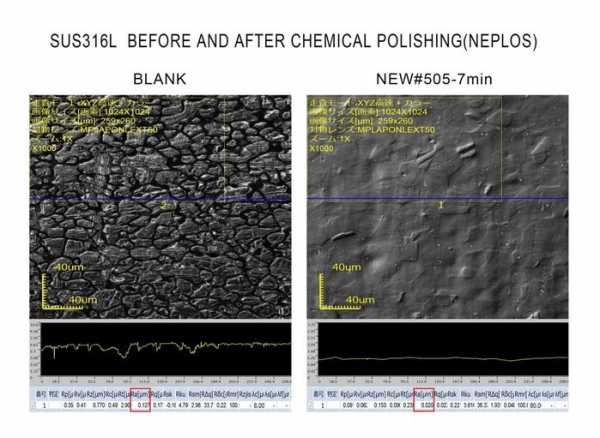
По материалам зарубежных изданий Ansing Engineering.
inoxgrup.ru
Промышленные методы электрохимического и химического полирования металлов
Электрохимический и химический методы полирования в настоящее время наиболее широко применяют для обработки поверхности изделий, изготовленных из алюминия и его сплавов. Это объясняется широким применением алюминия в электротехнической, машиностроительной и приборостроительной промышленности. В ряде случаев полированный электрохимическим или химическим способом алюминий подвергается последующему анодированию и окрашиванию, в результате чего поверхность изделий приобретает красивый (декоративный) вид. Электрополированный алюминий высокой чистоты имеет высокий коэффициент отражения света в весьма большом диапазоне как в красном, так и в ультрафиолетовом спектре.
Для электролитического полирования алюминия различают три основных процесса: Бриталь-процесс, разработанный в Англии, Альзак- и Баттель-процессы, разработанные в США. Во всех этих процессах съем металла весьма незначителен и правильнее называть их процессами глянцевания. Процессы электрополирования сопровождаются образованием на поверхности тонкой окисной пленки, которой, однако, недостаточно для защиты от коррозии основного металла, а также для сохранения оптических показателей электрополированной поверхности. Поэтому изделия подвергают дополнительному кратковременному анодированию, в результате чего коэффициент отражения света несколько снижается, но остается практически постоянным; кроме того, искусственно полученная окисная пленка является хорошим адсорбентом органических красителей и электрополированные изделия можно окрашивать в красивые тона (рис. 9).
Рис. 9. Влияние анодирования электрополированного алюминия на коэффициент отражения света:
1 — зеркальное отражение; 2 — диффузное отражение
Бриталь-процесс предусматривает электрополировку алюминия высокой чистоты в растворе, содержащем 15—30% (по массе) безводного Na2CO3 и 5—10% Na3PO4. Процесс протекает при температуре 80—90° С и плотности тока 5—6 А/дм2.
В Альзак-процессе основным компонентом является борофтористоводородная кислота (2,5%-ная HBF4).
Напряжение поддерживается в пределах 10—25 В, плотность тока 2—6 А/дм2, температура около 30° С, продолжительность процесса 5—10 мин. Для охлаждения электролита в процессе полирования через медный змеевик, который может быть одновременно использован в качестве катода, пропускают холодную воду.
Баттель-процесс применим для электролитического полирования технического алюминия и деформированных сплавов на его основе, типа дюралюминия, АМГ, АМЦ и др. Постоянным компонентом электролитов служит ортофосфорная кислота; помимо нее, присутствуют серная, хромовая или азотная кислоты в различных соотношениях. В отличие от щелочных электролитов рекомендуется перемешивание путем движения анодных штанг. В табл. 9 приведены типичные составы электролитов, режимы.
Хромовая кислота пассивирует поверхность полируемых изделий и предупреждает их разъедание в момент выключения тока. Серная кислота повышает электропроводность раствора и предупреждает образование питтинга.
Для электролитического полирования алюминия применяют электролиты, содержащие фосфорную кислоту и другие компоненты, а также смесь хлорной кислоты с уксусным ангидридом.
В литературе приводятся также электролиты для химического полирования алюминия и его сплавов. Американская алюминиевая компания (AlCoA) предложила раствор состава, % (объемн):
H3РO4 (плотность 1,7) . . 73—83
HNO3 (плотность 1,52) . . 2—5
H2O……… 14-23
При температуре 90° С время выдержки в пределах 1—5 мин. В настоящее время лучшими растворами для химического полирования алюминия считаются алюполь IV и алюполь V. Ниже приводятся составы этих растворов, % (по массе):
К раствору алюполь V в качестве смачивающего вещества добавляют 0,05% (по массе) карбоксилметил-целлюлозы. Процесс протекания при температуре 100° С в течение 1—4 мин. Съем металла составляет 3,75 мкм/мин.
В ФРГ большое применение получил способ «Эрфт-верк».
Ниже приводится состав раствора, % (по массе) и его режим:
HNO3….. 13—14 Температура, °С . 55—75
NH4HF2 …. 16 Выдержка, с . . 15—20
Pb(NO3)2 ….0,02 Съем металла, мкм 2,5—5
В этом растворе хорошо полируется алюминий высокой чистоты и сплавы типа АМГ (коэффициент отражения ~90%). Полирующий эффект резко снижается после обработки 167 дм2 поверхности в 3,8 л электролита; после добавления 4 г HF на каждые 10 дм2 обработанной поверхности восстанавливаются прежние показатели.
Второе место после алюминия и его сплавов в области электрополировки занимают стали, в особенности высоколегированные. Коррозионная стойкость электрополированной стали в результате дополнительной пассивации повышается. Изделия из стали типа нержавеющей, да еще сложной формы, механически трудно полируются.
Одним из главных компонентов электролита для полирования стальных изделий является ортофосфорная кислота, которая в сочетании с серной кислотой часто дает надлежащий эффект. Стали некоторых марок можно электролитически полировать в одной серной кислоте, но для этого плотность тока необходимо повысить до 250 А/дм2, что связано с большими затруднениями эксплуатационного характера, да и результаты получаются невоспроизводимыми. То же можно сказать относительно применения одной фосфорной кислоты. При смешивании одна кислота оказывает благоприятное влияние на другую, что сокращает продолжительность полировки, понижает необходимую плотность тока и расширяет номенклатуру марок сталей, поддающихся эффективной полировке. Кстати, можно отметить, что в смеси фосфорной и серной кислот эффективно полируются не только стали, но и ряд металлов и сплавов, трудно полируемых механически. Концентрация серной кислоты в зависимости от состава стали (или другого сплава) может колебаться от 15 до 60% (по массе), концентрация фосфорной кислоты — соответственно от 70 до 30% (по массе), содержание воды около 10%. Иногда вводят ангидрид хромовой кислоты, который благоприятно сказывается на течении процесса.
Повышенное содержание фосфорной кислоты позволяет понизить плотность тока и напряжение, повышение содержания серной кислоты позволяет расширить допустимые пределы изменения плотности и тока. Наиболее широкий рабочий интервал соответствует смеси, состоящей из 16—40% H2SO4 и 44—67% H3РO4. При содержании в электролите 63—67% (по массе) фосфорной кислоты минимальная плотность тока для стали 18—8 равна 7—12,5 А/дм2. Рекомендуется поддерживать плотность тока в пределах 10—50 А/дм2 и температуру 45— 65° С. С изменением основных легирующих компонентов должен быть изменен и режим.
Существенным недостатком электролитов, приготовленных на основе фосфорной и серной кислот, является их ограниченный срок службы. Электролиты выходят из строя по мере накопления в них продуктов анодного растворения, связывающих кислоты в соли, в то время как на катодах в сильно кислой среде разряжаются ионы гидроксония. Сульфаты железа и никеля не растворяются в таких количествах, которые могут отрицательно сказываться на результатах электролитической полировки, но растворимость их повышается в присутствии хромовой кислоты, наличие которой в электролите не зависит от того, вводился хромовый ангидрид или не вводился, так как при электрополировке нержавеющей стали хром растворяется в виде шестивалентных ионов.
Шестивалентные ионы хрома восстанавливаются на катодах до трехвалентных, а на анодах (полируемых изделиях) вновь окисляются до шестивалентных. Вредное влияние оказывает трехвалентный хром, который при содержании в электролите в количестве 2% нарушает нормальное течение процесса. Рассчитать точно поверхность, которую можно обработать до выхода электролита из строя, нельзя, так как состояние исходной поверхности не всегда одинаково.
Хорошие результаты дает электролит примерного состава: 70% H3РО4. 12% H2SO4, 9% CrO3 и 9% H2O; температура 70—90° С, плотность тока 15—20 А/дм2 и выше. Этот электролит можно применять для широкой номенклатуры сталей как легированных, так и углеродистых.
Электролиты, содержащие в качестве компонента глицерин, можно успешно применять для электролитической полировки нержавеющей стали и других сплавов. Глицерин оказывает положительное влияние в смеси с фосфорной кислотой, с серной или смесью обеих кислот, а также с фтористоводородной кислотой. Лучшие результаты получаются при электролитической полировке нержавеющей стали 18—8 в смеси фосфорной кислоты с глицерином. Преимущества таких электролитов сводятся к следующему: 1) можно получить поверхность с высоким коэффициентом отражения света при сравнительно низкой плотности тока; 2) полированная поверхность получается при небольшом съеме металла; 3) точечное разъедание наблюдается редко. При хорошо подготовленной предварительно механическим путем поверхности в результате последующей электрополировки можно получить поверхность с хорошим зеркальным отражением.
На рис. 10 показано влияние на отражение света нержавеющей стали концентрации 85%-ной H3РO4 (плотности 1,71) в 96%-ном глицерине (плотности 1,25) при анодной плотности тока 7,8 А/дм2, температуре 100° С и продолжительности обработки 15 мин. Лучшие показания (93% зеркального отражения) получаются при концентрации фосфорной кислоты 35—45% (объемн.)
Рис. 10. Влияние концентрации 85%-ной H3РO4, (плотность 1,71) в 96%-ном глицерине (плотность 1,25) при анодной плотности тока 7,8 А/дм2, температуре 100° С на коэффициент зеркального отражения света нержавеющей стали
В Японии применяют в промышленности электролиты, в которых главным компонентом является фосфорная кислота, а процесс протекает при комнатной температуре и переменном токе. Так, для полирования изделий из углеродистой стали применяют следующий состав электролита и режим процесса:
при
H3РO4 (плотность 1,7), мл….. 1000
Желатина, г………. 10
H2C2O4, г……….. 40
H6C4O6 г………… 15
Температура, °С……… 20
Плотность переменного тока, А/дм2 . 8
Для полирования пружинной стали состав электролита и режим процесса следующие:
H3РO4 (плотность 1,7), мл . . . . . 1000
Желатина, г……….. 1
Температура, °С . . . …… 20
Плотность переменного тока, А/дм2 . . 10—20
Напряжение, В………. 15
При электролитическом полировании быстрорежущей стали встречаются затруднения, поскольку она содержит такие элементы, как вольфрам, который растворяется в щелочах, и кобальт, растворяющийся в кислотах. Для этой цели используют постоянный ток высокой плотности. Главным компонентом таких электролитов является азотная кислота. Помимо нее, вводят фтористоводородную, щавелевую, хромовую, серную кислоты, а также соли железа, никеля, кобальта. Ниже приводится состав (мл) одного из таких электролитов и режим:
HNO3 …. 1000
HF….. 100—360
H2C2O4 . . . 20—40
H2O….. 600
Плотность тока, А/дм2. . . 140—160
Напряжение, В 6
Температура, °С……….20—50
Время, с . . . 10—30
Коррозионная стойкость аустенитных хромоникелевых и хромистых сталей повышается в результате электрополировки. Электронографически установлено, что в результате селективного растворения на поверхности хромоникелевой стали образуется пленка NiO·Cr2O3, а на поверхности хромистой стали FeO·Cr2O3. Эти пленки и повышают сопротивление коррозии полируемых изделий.
Турбинные лопатки изготовляют из жаропрочной хромомарганцовистой стали. Электролитическая полировка повышает их механические и химические свойства. Процесс осуществляется при следующем режиме и составе электролита.
H2SO4, мл … 300
H3РO4, мл . . . 700
CrO3, г/л …. 50—100
Температура, °С . 100
Плотность постоянного тока, А/дм2 10—50
Время, мин . . . 2—6
Химическое полирование стальных изделий не применяется столь широко, как электрохимическое, однако для изделий малых размеров и сложной формы этот метод имеет определенные преимущества.
Для изделий из низкоуглеродистой стали предложен электролит следующего состава, г/л:
H2O2 (30%-ная) . . 13
H2C2O4·2H2O … 25
H2SO4 … 0,1
Температура процесса 20° С, продолжительность 30—60 мин.
За 1 ч снимается слой металла около 10 мкм. Эффект выравнивания поверхности тем больше, чем грубее исходная поверхность.
В Японии для химического полирования углеродистых сталей применяют электролит состава (объемных частей):
H3РO4 ….400
H2SO4 ….200—600
HNO3 …. 100—200
HCl …. 25
Продолжительность процесса зависит от температуры следующим образом:
Температура, °С . 80 100 120
Продолжительность процесса, с . 60 30 10
С повышением температуры улучшается блеск и повышается интенсивность выделения окислов азота. Чем выше содержание углерода в стали, тем меньше воды должно быть в полируемом растворе и выше температура.
Химическое полирование мелких деталей в оптической и часовой промышленности успешно осуществляется в обезвоженной H3РO4. Для этого ее длительно нагревают при температуре 250° С так, что она частично переходит в пирофосфорную кислоту. Реакция длится около 1,5 ч, конец ее узнается по прекращению выделения водорода. После охлаждения добавляют около 10% H2SO4. Точное соотношение кислот выбирают в зависимости от содержания углерода в полируемых деталях — чем оно больше, тем меньше должно быть содержание серной кислоты. Процесс протекает при 200° С и длится от нескольких секунд до нескольких минут. Выгруженные детали тщательно промывают в слабощелочном растворе. Оптимальный полирующий эффект наблюдается при содержании в стали 0,6% С, т. е. при чисто перлитной структуре. В дегидратированной смеси фосфорной и серной кислот можно химически полировать также хромистую сталь (13% Cr) и хромоникелевую сталь (18% Cr, 8% №).
Хотя основные закономерности электролитического полирования металлов были установлены на основе анодного поведения меди в растворах ортофосфорной кислоты и первые промышленные установки были рассчитаны на обработку изделий из меди и ее сплавов, в настоящее время этот процесс находит ограниченное применение. В значительной степени это объясняется тем, что для неответственных целей изделия из меди и медных сплавов быстро подвергают травящей полировке (химической) в смеси серной и азотной кислот в присутствии небольших количеств соляной кислоты. В ответственных случаях медные изделия анодно полируют в концентрированной фосфорной кислоте.
Начиная с пятидесятых годов, промышленное применение получил запатентованный в США способ химического полирования меди и латуни в растворе состава, % (объемн.):
H3РO4 (плотность 1,75) … 65
СH3СООН (ледяная) …. 20
HNO3 (плотность 1,42) … 15
Главный недостаток этого электролита, в котором процесс протекает при температуре 60—70° С, заключается в большом съеме металла (25—40 мкм), а также в выделении вредных газов и в ограниченном сроке службы — явлении, характерном для всех электролитов, содержащих уксусную кислоту и работающих при повышенных температурах.
Хорошие результаты получаются при химическом полировании медных или латунных изделий в растворе состава, мл:
H3РO4 (плотность 1,7) . . 550
СНзСООН (ледяная) … 250
HNO3 (плотность 1,4) . . . 200
Тиомочевина, г…..0,2
при комнатной температуре в течение 2—6 мин.
Рекомендуется покачивание обрабатываемых изделий.
Электролитическое полирование никеля успешно осуществляется в растворах серной кислоты (плотность 1,6) при температуре 35° С, плотность тока 40 А/дм2 и продолжительности 3—5 с. Применительно к никелированным изделиям процесс не получил промышленного применения из-за возможности оголения основного металла в углублениях, где толщина покрытия меньше средней и из-за выявления различного рода дефектов, которые при механической полировке «замазываются».
Серебряные и серебренные изделия можно электрополировать в цианистом электролите для серебрения при анодной плотности тока 2—3 А/дм2. Рекомендуется прерывать ток (через 3—4 с), чтобы дать возможность раствориться образующейся пленке AgCN и вновь образоваться. При электрополировке серебренных изделий удобнее поступать следующим образом. После окончания процесса серебрения изделия в той же ванне включают в качестве анодов, а штангу с серебряными анодами соединяют с отрицательным полюсом. Ток прерывают через 3—4 с; анодная плотность тока должна быть в 4— 5 раз больше, чем в процессе серебрения. Общая продолжительность такой обработки составляет 1—3 мин.
Золото можно электрополировать в растворе состава, г/: 67,5—KCN; 15—KNaC4H4O6·4H2O; 18,5—H3РO4; 0,9 NH4OH, температура до 60° С; напряжение на ванне 5—10 В, катоды — медные. Необходимо сильное перемешивание электролита.
Другой электролит для электрополировки золота имеет состав, г/л: 10СH3СООН; 3H2SO4; 25C6H5NH2S, температура процесса 25—45° С, плотность тока 1,5—3,5 А/дм2.
www.stroitelstvo-new.ru

