Стальной угол диаграммы железо углерод – Метастабильная диаграмма состояния железо-углерод
alexxlab | 19.01.2021 | 0 | Вопросы и ответы
3.2 Диаграмма фазового равновесия «железо – углерод»
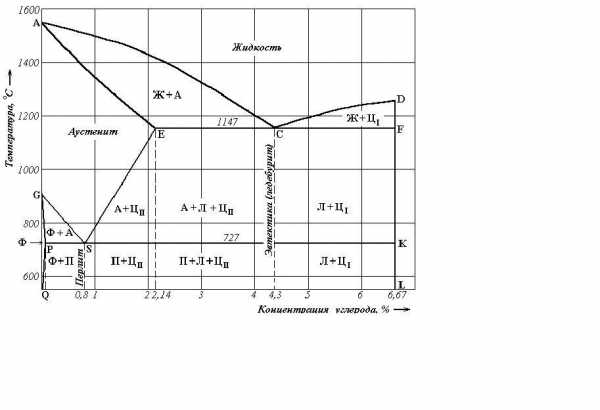
Современный вариант диаграммы состояния «железо – углерод» приведен на рис. 3.1. Характерной особенностью этой диаграммы является то, что на ней нанесены две системы одновременно: система Fe – Fe3C (железо – цементит) – метастабильная – и (железо – графит) – стабильная. Большое практическое значение имеет метастабильная диаграмма, т.к. с помощью этой диаграммы объясняют превращения, происходящие в сталях и белых чугунах. Диаграмма является основой для рационального выбора оптимальных режимов термической обработки железоуглеродистых сплавов.
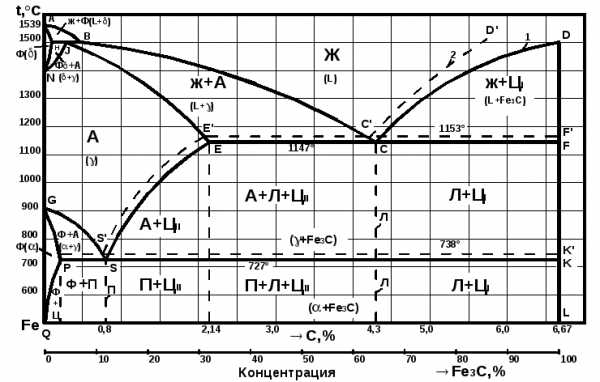
Рис. 3.1. Диаграмма состояния «железо-углерод»:
1 – метастабильная; 2 – стабильная
3.3. Основные фазы, области, линии и точки диаграммы
В сплавах системы «железо – углерод» встречаются следующие фазы:
1. Жидкий раствор.
2. Твердые растворы на основе различных кристаллических модификаций железа.
3. Химическое соединение Fe3C (цементит).
4. Структурно-свободный углерод (графит).
Жидкая фаза представляет собой неориентированный раствор Fe и С, распространяющийся выше линии ликвидус АВСД от 0 до 6,67% см.
ФЕРРИТОМ (Ф) называется твердый раствор углерода в αжелезе. У него сохраняется решетка Feα (ОЦК). Феррит занимает на диаграмме узкую область, примыкающую к железу – GPQ. Максимальная растворимость углерода в нем не более 0,02% (точка Р), при комнатной температуре она равна 0,006%. Твердость феррита 65-130 НВ, δ = 40%.
Раствор углерода в высокотемпературном δ-железе называется дельта ферритом. Область устойчивости дельта феррита AHN, концентрация углерода достигает 0,1% (точка Н).
АУСТЕНИТ (А) – твердый раствор внедрения углерода в γ-железе (с решеткой ГЦК). Однофазная область аустенита на диаграмме ограничена линией NJESG. Максимальная растворимость углерода в аустените составляет 2,14% (11470С, точка Е).
ЦЕМЕНТИТ (Ц) – химическое соединение железа с углеродом, соответствующее формуле Fe3C с концентрацией углерода 6,67% (вертикальная линия
DFKL). Температура плавления цементита точно не определена, т.к. при нагревании он легко распадается на аустенит и графит.
Все остальные области диаграммы за исключением перечисленных, являются двухфазными. В двухфазных областях в равновесии находятся: в области АВН – жидкий раствор и кристаллы феррита; HJM – кристаллы феррита и аустенита; JBC – жидкий раствор и кристаллы аустенита; ESECFK – кристаллы аустенита и цементита; QPSKL – кристаллы феррита и цементита.
Горизонтальные
линии на диаграмме отвечают равновесным
трехфазным состояниям сплавов. В сплавах
с концентрацией углерода от 0.1 до 0,51%
при температуре 1499
L(B) + Ф(H) A(J).
Перитектическое превращение в сплавах, расположенных левее точки J (С = 0,1 – 0.16%), идет до исчезновения жидкой фазы, а в сплавах, расположенных правее точки J (С = 0,16 – 0,51%), – до исчезновения феррита.
При температуре 11470С (линия ECF) в сплавах с концентрацией углерода от 2,14 до 6,67% происходит эвтектическое превращение:
L(С) А(Е) + Ц(F)
В процессе превращения жидкий раствор затвердевает в виде механической смеси кристаллов аустенита и цементита, которая называется ледебуритом (Л).
Во всех сплавах системы с концентрацией углерода более 0,02% при температуре 7270С (линия PSK) происходит эвтектоидное превращение, заключающееся в распаде аустенита на дисперсную механическую смесь чередующихся пластинок феррита и цементита, которая называется перлитом (П):
А(S) Ф(Р) + Ц(К).
Причиной эвтектоидной реакции является полиморфное превращение Feγ в Feα и резкое уменьшение растворимости углерода с 0,8% в γ-фазе до 0,02% в αфазе.
Цементит может образовываться из жидкой и твердой фаз при различных температурах. Цементит, выделяющийся из жидкой фазы, называется первичным (ЦI), из аустенита – вторичным (ЦII), а из феррита – третичным (ЦIII).
Железоуглеродистые сплавы при температурах, соответствующих перитектическому, эвтектическому или эвтектоидному превращению находятся в трехфазном равновесном состоянии. Согласно правилу фаз (С = К – Ф + I) равновесие является нонвариантным (С = 2 –3 +I = 0). Все эти превращения происходят при определенных температурах и характеризуются остановкой (горизонтальным участком) на кривой охлаждения сплавов. Во всех остальных областях диаграммы в равновесии находятся две фазы. Эти равновесия моновариантные (С = 2 – 2 + I = I), т.е. превращения в сплавах происходят в интервалах соответствующих температур.
Концентрация углерода в характерных точках диаграммы железоцементит и линии трехфазного равновесия дана в таблицах 3.1 и 3.2.
Таблица 3.1 – Концентрация углерода в характерных точках диаграммы.
Индекс линии | Температурный интервал, 0С | Интервал концентраций углерода, % | Основные свойства |
А | 1539 | 0,00 | Точка затвердевания чистого железа |
В | 1499 | 0,51 | Состав жидкой фазы при перитектическом равновесии с -ферритом и аустенитом |
С | 1147 | 4,30 | Состав жидкой фазы при эвтектическом равновесии с аустенитом и цементитом |
H | 1499 | Предельное содержание углерода в -феррите. Состав феррита при перитектическом равновесии с жидкостью В и аустенитом J | |
J | 1499 | 0,16 | Состав аустенита при перитектическом равновесии |
Е | 1147 | 2,14 | Предельное содержание углерода в аустените. Состав аустенита при эвтектическом равновесии с жидкой фазой и цементитом |
S | 727 | 0,80 | Состав аустенита при эвтектоидном равновесии с ферритом и цементитом |
P | 727 | 0,02 | Предельное содержание углерода в феррите при эвтектоидном равновесии с аустенитом и цементитом |
Q | Комнатная | 0,006 | Предельное содержание углерода в феррите при комнатной температуре |
Таблица 3.2 – Линии трехфазного равновесия
Индекс линии | Температура равновесия | Фазы, находятся в равновесии | Название превращения | Взаимодействие фаз |
HУB | 1499 | ЖВ+H+ AJ | Перитектическое | LB + H = J |
EСF | 1147 | ЖС + АЕ + ЦР | Эвтектическое | LC = Е + Fe f |
E’С’F’ | 1153 | ЖС + АЕ +Гр | Эвтектическое | LC =Е + C |
PSK | 727 | АS + ФР + ЦК | Эвтектоидное | S = P + Fe3 C |
P’S’K’ | 738 | АS + ФР + Гр | Эвтектоидное | S’ = P’ + С |
3.4. Построение кривой охлаждения сплава заданной концентрации
с использованием диаграммы
Формирование фаз или структур в сплавах можно изучить, рассматривая по диаграмме процессы, происходящие в них при охлаждении или нагреве.
В
качестве примера проследим за формированием
структур сплава с содержанием углерода
1,5 % при медленном охлаждении с 1600
Сплав до температуры 14500 С (точка 1) находится в жидком состоянии. Кристаллизация его начинается при 14500 С с выделением из жидкого раствора кристаллов аустенита. По мере охлаждения сплава концентрация компонентов в аустените изменяется согласно линии JE от точки 1 к точке 2, а в жидкости – согласно линии ВС от точки 1 к точке 2, что можно записать следующим образом:
Ж(1-2) А(1-2)
Составы и количество фаз в этой области диаграммы (точка m) можно определить по правилу отрезков
А
= 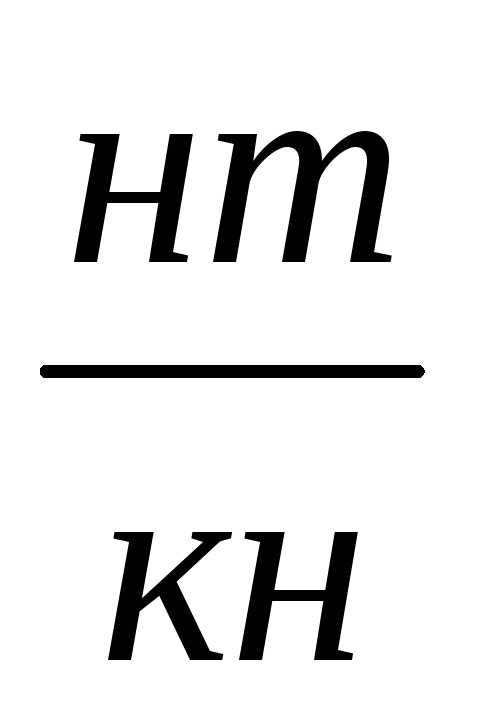 ∙
100 %; Ж =
∙
100 %; Ж = ∙
100 %; ????
∙
100 %; ????
Кристаллизация сплава заканчивается в точке 2 (12500 С). В интервале температур 1250 – 9500 С (точки 2, 3). Сплав охлаждается, не претерпевая никаких изменений. При охлаждении сплава ниже 9500 С (точка 3) аустенит с концентрацией углерода 1,5 % становится пересыщенным. Избыточный углерод из зерен аустенита диффундирует к их границам и выделяется в виде цементита вторичного. Концентрация углерода в аустените при охлаждении сплава от 950 до 7270 изменяется согласно линии ES от точки 3 к точке S:
А(8-S) ЦII
При температуре 7270 С (точка 4) в сплаве происходит эвтектоидное превращение. Аустенит (0,8 % С) распадается на ферритоцементитную смесь – перлит:
АS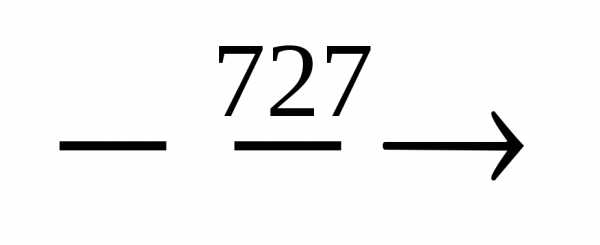 Фр + Цк ???
Фр + Цк ???
С понижением температуры сплава ниже 7270 С растворимость углерода в феррите уменьшается (линия PQ). В связи с этим избыточный углерод из феррита выделяется в виде цементита третичного:
Ф(р-Q) ЦIII
Однако выделяющийся цементит третичный в структуре стали металлографически не различается, т.к. сливается с цементитом эвтектоида. В структуре сплава с концентрацией углерода 1,5 % при комнатной температуре наблюдаются зерна перлита, окаймленные тонкой сеткой цементита вторичного.
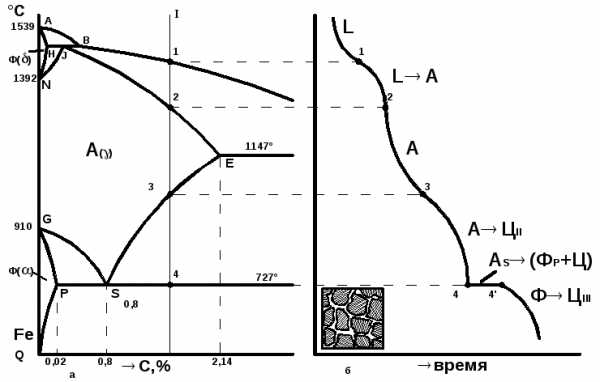
Рис. 3.2. Схема для изучения превращений, происходящих в сплаве 1 при охлаждении: а – диаграмма состояния; б – кривая кристаллизации сплава и конечная структура
Основными компонентами железоуглеродистых сплавов являются железо и углерод. Кроме того, в них всегда содержатся кремний, марганец, сера и фосфор. В зависимости от содержания углерода сплавы называют сталями (если углерода менее 2,14%) или чугунами (при содержании углерода от 2,14% до 6,67%).
В сталях углерод присутствует в виде цементита, а в чугунах в виде цементита (белый чугун) или графита (обыкновенный серый, ковкий и высокопрочный).
В структуре сталей и чугунов присутствуют также твердые растворы феррит и аустенит, механические смеси перлит и ледебурит.
studfiles.net
Основные линии и точки на диаграмме железо – углерод
Линия ABCD является ликвидусом системы, линия AHJECF – солидусом.
Три горизонтальные линии на диаграмме (HJB, ЕСF и PSK) указывают на протекание трех превращений.
При 1499 °С (линия HJB) протекает перитектическая реакция:
LB + ФH ↔ AJ.
В результате этой реакции образуется аустенит. Реакция эта наблюдается только у сплавов, содержащих углерода от 0,1 до 0,5%.
При 1147 ºС (горизонталь ECF) протекает эвтектическая реакция:
LС ↔ AЕ. + ЦI.
В результате этой реакции образуется эвтектическая смесь аустенита и первичного цементита, которая называется ледебуритом. Реакция эта происходит у всех сплавов системы, с содержанием углерода более 2,14 %.
При 727 °С (горизонталь РSК) протекает эвтектоидная реакция:
АS ↔ ФР + ЦIII.
Продуктом превращения является эвтектоидная смесь феррита и третичного цементита, которая называется перлитом.
Перлитное (эвтектоидное) превращение происходит во всех сплавах, содержащих свыше 0,02 % углерода, т. е. практически во всех промышленных железоуглеродистых сплавах.
AHN – линия предельной растворимости углерода в-феррите.
ES – линия предельной растворимости углерода в аустените.
GPQ– линия предельно растворимости углерода вα-феррите.
DFKL – линия однофазного существования цементита (6,67%).
МО – линия магнитного превращения (768С).
А – температура плавления железа – 1539С.
D– температура плавления цементита.
B– содержание углерода в жидкой фазе, претерпевающей перитектическое превращение (0,51%).
C– содержание углерода в жидкой фазе, претерпевающей эвтектическое превращение (4,3%) –эвтектическая точка.
H– содержание углерода в-феррите, претерпевающем перитектическое превращение (0,1%).
J– содержание углерода в аустените, образующемся в результате перитектического превращения –перетектическая точка.
E– предельное содержание углерода в аустените, образующемся в результате эвтектического превращения (2,14%).
S– содержание углерода в аустените, претерпевающей эвтектоидное превращение (0,8%) –эвтектоидная точка.
P– предельное содержание углерода вα-феррите, образующемся в результате эвтектоидного превращения (0,025%).
Q– предельное содержание углерода вα-феррите, при комнатной температуре (≤ 0,006 %).
Анализ процессов охлаждения железоуглеродистых сплавов различного состава
Кристаллизацию низкоуглеродистых сталей удобнее рассматривать на увеличенной части диаграммы Fe-C в области перитектического превращения, приведенной на рисунке 3.
Рассмотрение начнем со сталей, содержащих менее 0,006% С. Это стали ферритного класса. При температуре близкой к 1539 ºС из жидкости начинают выделяться кристаллы твердого раствора углерода в железе (δ-феррита), содержащие очень малое количество углерода. В области АВН сосуществуют жидкость и кристаллы δ-феррита. Состав и относительное количество сосуществующих фаз определяются по правилу рычага в соответствии с положением линий на диаграмме, т.е. линий АВ и АН.
При температуре, соответствующей точке пересечения линии АН с линией 1-2, кристаллизация заканчивается и до температуры, соответствующей точке 3 существует одна фаза δ-феррит. Дальнейшее охлаждение приводит к выделению из δ-феррита кристаллов аустенита. Этот процесс осуществляется в области температур и концентраций, ограниченной линиями NH и NJ. При дальнейшем охлаждении до температуры, соответствующей точке 4, весь феррит превращается в аустенит. Однофазная аустенитная область рас полагается ниже линии NJ до линии GP.
При температурах ниже 911 °С (рис. 1) происходит еще одно фазовое превращение аустенита в α-феррит. В области температур и составов, заключенной между линиями GOS и GMP сосуществуют кристаллы феррита и аустенита.
Следует отметить, что при температуре, соответствующей линии МО (температура Кюри), чистое железо и его сплавы с углеродом претерпевают магнитное превращение и во многих учебниках немагнитные кристаллы железа и феррита (решетка ОЦК) называют β-железом и β-ферритом.
По мере охлаждения до температуры около 850°С кристаллы аустенита полностью превращаются в α-феррит и сталь вплоть до комнатной температуры будет иметь ферритную структуру.
Теперь перейдем к более высокоуглеродистым сталям, содержащим от 0,10 до 0,16% С (в соответствии с положениями точек H и J на диаграмме состояния). Сталь, содержащая 0,16% С, претерпевает перитектическое превращение при температуре 1499 °С, т.е. переход жидкости состава соответствующего точке В и δ-кристаллов состава точки H в γ-кристаллы (аустенит), отве-
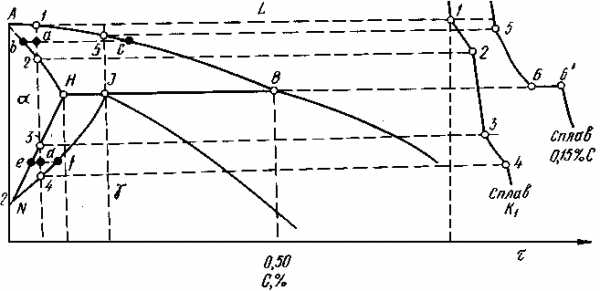
Рис. 3 Область перитектического превращения диаграммы
железо – углерод
чающие составу точки J. Другими словами, жидкость, взаимодействуя с кристаллами δ-феррита, превращается в аустенит. При этом расходуются кристаллы δ-феррита, имеющие состав, отвечающий точке H. При отклонении состава сплавов от состава точки J (т.е. в сплавах с меньшим содержанием углерода), часть кристаллов δ-феррита превращения не претерпевают. Если состав сплава точно соответствует точке J, то все кристаллы δ-феррита, состава соответствующего точке H и вся жидкость состава В переходит в аустенит состава J, т.е. происходит перитектическая реакция:
ЖВ + δН ↔ γJ (аустенит).
При дальнейшем охлаждении стали, содержащей 0,16% С, в ней происходят превращения несколько отличающиеся от ранее рассмотренных.
Эта сталь при температуре 727 °С испытывает так называемое эвтектоидное превращение. Превращение этого типа протекает только с участием твердых фаз. Суть рассматриваемого эвтектоидного превращения заключается в распаде γ-кристаллов (аустенита) в кристаллы третичного цементита и феррита. Смесь пластинчатых кристаллов Fе3СIII и α-феррита, содержащая 0,83% С называется перлитом (эвтектоидом). Температура начала его образования соответствует точке S на диаграмме Fе– Fе3С.
As ↔ Фр + Ц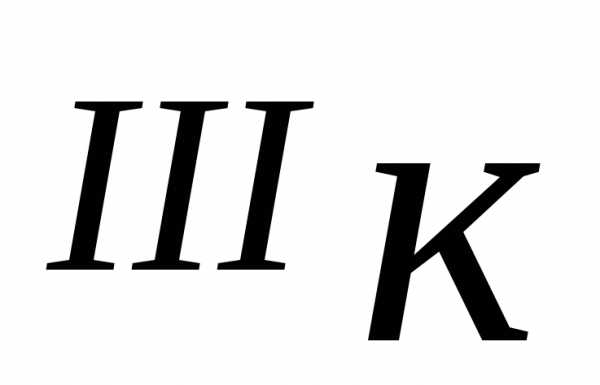
Перлит
Если стали содержат углерода от 0,16 до 0,53 %, т.е. их составы располагаются между точками J и B на диаграмме состояния, то для них перитектическое превращение характеризуется неполным использованием жидкости. Кристаллы δ и часть жидкости состава B образуют аустенит состава J. Оставшаяся жидкость того же состава B, но в меньшем количестве, сохраняется и при охлаждении ниже линии HJB. Температура окончания кристаллизации определяется линией JE.
Дальнейшее превращение сталей этой группы мало отличается от превращений, характерных для большинства доэвтэктоидных сталей. Только количество перлитной составляющей возрастает по мере приближения состава к точке S. Стали, содержащие больше 0,53 % с, не претерпевают перитектического превращения.
Кристаллизация стали, содержащей 0,8% углерода, начинается сразу с выделением аустенита, что в дальнейшем приводит к образованию одной структурной составляющей – перлита.
Перейдем теперь к рассмотрению фазовых превращений заэвтектоидных сталей. К этой группе относятся стали, содержащие от 0,8 до 2,14%. Кривая охлаждения для заэвтектоидных сталей представлена на рис. 4. Для этих сталей, как и для эвтектоидных, не наблюдается перитектического превращения. При кристаллизации таких сплавов (0,8 – 2,14% С) из жидкости выделяются кристаллы аустенита. По мере охлаждения состав жидкости изменяется по линии ВС, а состав аустенита – по линии JE. Каждой температуре соответствуют вполне определенные составы существующих кристаллов аустенита и капель жидкого металла.

Рис. 4 Диаграмма состояний системы железо-углерод (а) и кривые
охлаждений (б) для заэвтектоидных сталей и чугунов
При охлаждении сплавов ниже температур, соответствующих линии SE, растворимость углерода в аустените падает и из него начинает выделяться вторичный цементит. На микроструктуре это проявляется в том, что каждое зерно аустенита, превращающееся затем в перлит, окружено оторочкой из цементита. При температуре 727 °С аустенит принимает состав, соответствующий эвтектоиду (точке S диаграмме). При дальнейшем охлаждении аустенит этого состава превращается в перлит. Выделения цементита существенно повышают прочность стали, но одновременно снижают пластичность.
При содержании углерода больше 2,14%, аустенит уже не является единственной фазовой составляющей и присутствует в металле одновременно со вторичным цементитом, образуя эвтектическую смесь, называемую ледебуритом (эвтектика). Поэтому металл, содержащий более 2,14% С, относят к чугунам, для которых ледебурит является характерной составляющей.
Жс ↔ AE + Ц
Ледебурит
Представленные на диаграмме состояния линии и соответствующие им превращения, часто обозначают буквами с присвоенным им номером, увеличивающимся с ростом температуры и называют критическими точками. Так, например, превращение, происходящее при 727 °С обозначают А1. В тех случаях, когда превращение происходит в процессе нагрева, его обозначают с индексом с например Ас1 (рис 5).
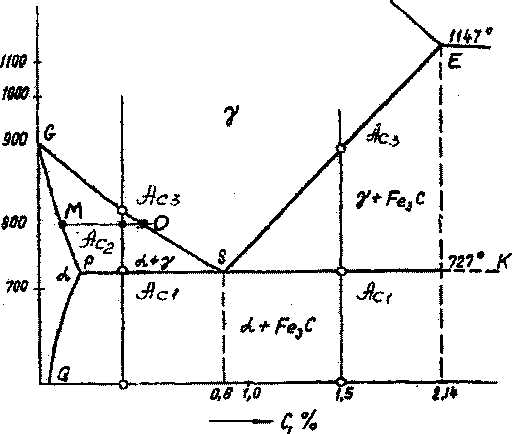
Рис. 5 «Стальной угол» диаграммы «железо – углерод»
Критические точки принадлежащие линии PSK обозначаются Ac1, соответствуют эвтектоидной реакции и началу превращения перлита в аустенит. На линии МО точка Ас2 соответствуетмагнитному превращению феррита. На линии GS точка Ас3 соответствует концу превращения феррита в аустенит для доэвтектоидных сталей. Для заэвтектоидных сталей точка Ас3 принадлежащая линии SE соответствует окончанию растворения вторичного цементита в аустените.
В соответствии с тем, что фазовые превращения при нагреве и охлаждении протекают с некоторым температурным гистерезисом, то при охлаждении критические точки обозначают с индексом r, например Ar1. Точке Ас2 соответствует магнитное превращение при температуре 768 °С, происходящее при нагреве образца. Напротив, точке Аr2 соответствует магнитное превращение, происходящее при охлаждении образца.
Точке Ас3 соответствует определенной температуре только при заданном составе и соответствует переходу α → γ. Следовательно, обратный переход γ→α характеризуется точкой Аr3. Наконец, точка Ас4 соответствует переходу от кристаллической решетки γ-аустенита к решетке δ-феррита. Обратное превращение δ→γ обозначается точкой Аr4.
Из рассмотренных процессов кристаллизации можно сделать следующий важный вывод: во всех сплавах, содержащих менее 2,14% С, в результате первичной кристаллизации получается структура аустенита; во всех сплавах, содержащих более 2,14 % С структура состоит из ледебурита с избыточным аустенитом или цементитом. Разница в структуре предопределяет и свойства материалов, образующихся в системе Fe–C, сплавы с эвтектикой при концентрации углерода более 2,14 % С называютчугунамии они, как правило, малопластичны и не пригодны для обработки давлением, однако за счет низкой температурой плавления у них хорошая жидкотекучесть и их поэтому используют в качестве литейных.
Железоуглеродистые сплавы, содержащие менее 2,14 % С, называют сталями, и они, напротив, при плохой жидкотекучести, хорошо обрабатыватся давлением.
В зависимости от концентрации углерода различают три группы сталей: эвтектоидные, содержащие около 0,8 % С, структура которых состоит только из перлита; доэвтектоидные, содержащие меньше 0,8 % С, структура которых состоит из феррита и перлита, и заэвтектоидные, содержащие от 0,8 до 2 % С, структура которых состоит из перлита и цементита.
Для чугунов различают также три группы: эвтектические, содержащие 4,3 % С, доэвтектические с содержанием углерода от 2,14 до 4,3 % С и заэвтектические, с содержанием более 4,3 % С.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Как называется структура, представляющая собой твердый раствор углерода в α – железе?
Как называется структура, представляющая собой твердый раствор углерода в γ – железе?
Как называется структура, представляющая собой карбид железа – Fe3C?
Как называется структура, представляющая собой механическую смесь феррита и цементита?
Как называется структура, представляющая собой механическую смесь аустенита и цементита?
Как с увеличением концентрации углерода изменяется структура сталей?
Как влияет увеличение концентрации углерода на твердость сталей?
На какой линии диаграммы железо – цементит протекает эвтектоидная реакция?
На какой линии диаграммы железо – цементит протекает эвтектическая реакция?
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Изучить предложенную теоретическую часть.
Выбрать вариант задания в соответствии с порядковым номером в учебном журнале
По координатам критических точек в системе Fe – Fe3C построить на миллиметровой бумаге диаграмму состояния указанной системы (используя бумагу формата А4). Указать структуру во всех областях диаграммы.
Рассчитать концентрацию углерода в сплаве, для которого в задании (таблица 1 в ПРИЛОЖЕНИИ 1) указан вес железа и углерода (формулы для расчетов смотри в справочной литературе). Указать сплав на построенной диаграмме состояния. Определить фазовый состав сплава при указанной температуре Т1.
Разобрать процесс кристаллизации заданного сплава, письменно отразить характерные стадии процесса и схематично изобразить структуру сплава при комнатной температуре. Охарактеризовать структурные составляющие.
Рассчитать относительное соотношение фаз (феррита и цементита) в заданном сплаве при комнатной температуре.
Рассчитать интегральную твердость заданного сплава при комнатной температуре. Для расчетов примите:
– твердость феррита НВFe() 800 МПа;
– твердость цементита НВFe3С 800 кг/мм2;
предельной растворимостью углерода в феррите при комнатной температуре можно пренебречь (СмахFe(C)~0.006%)
Письменно ответить на теоретический вопрос (таблица 3 в ПРИЛОЖЕНИИ 1).
Все полученные результаты занести в таблицу 2 в соответствии с номером варианта задания.
Сделать вывод по результатам работы.
Оформить отчет
СОДЕРЖАНИЕ ОТЧЕТА
Тема работы.
Построенная диаграмма состояния системы «железо – углерод.
Заполненная таблица 2 (для своего варианта)
Описание процесса кристаллизации заданного сплава.
Расчет интегральной твердости.
Ответ на теоретический вопрос.
Вывод по работе.
ПРИЛОЖЕНИЕ 1
Таблица 1
Варианты заданий
№ варианта | Массы компонентов | Фазовый состав | |
Fe | C | Т1, ºС | |
1 | 2 | 3 | 7 |
1 | 1498,5 г | 1,5 г | 1300 |
2 | 598,8 кг | 1,2 кг | 1510 |
3 | 13,87 кг | 730 г | 1160 |
4 | 596,4 г | 3,6 г | 1100 |
5 | 396,8 кг | 3,2 кг | 650 |
6 | 118,8 т | 1,2 т | 750 |
7 | 798,4 г | 9,6 г | 1400 |
8 | 19,68 кг | 320 г | 1100 |
9 | 98 т | 2 т | 800 |
10 | 1,627 кг | 40 г | 700 |
11 | 416,6 кг | 12 кг | 1200 |
12 | 59 т | 1,95 т | 900 |
13 | 200 г | 7,5 г | 1300 |
14 | 700 кг | 33,8 кг | 1160 |
15 | 0,9 т | 53,4 кг | 650 |
16 | 2,12 т | 150 кг | 1200 |
17 | 3,323 кг | 10 г | 1200 |
18 | 10,945 т | 55 кг | 1455 |
19 | 12,777 т | 0,09 т | 1435 |
20 | 1,652 кг | 15 г | 1400 |
21 | 1,798 т | 20 кг | 1360 |
22 | 9,11 т | 0,12 т | 1400 |
23 | 8451 кг | 120 кг | 1335 |
24 | 1,132 кг | 35 г | 1050 |
25 | 1,486 т | 70 кг | 1100 |
Таблица 2
Варианты заданий
№ варианта | Массы компонентов | Концентрация углерода, Сс, масса % | Доля фаз при Т2= 295ºС | Фазовый состав | Расчетная твердость НВ, кг/мм2 | |||
Fe | C | Fe(C) | Fe3C | Т1, ºС | фазы | |||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
Таблица 3
Варианты теоретических вопросов
№ варианта | Вопрос |
1 | 2 |
1 | Чем можно объяснить большую растворимость углерода в -железе (ГЦК) по сравнению с-железом (ОЦК) ? Расшифруйте марку стали, назовите ее структуру и назначение: ВСт2кп |
2 | Какие фазы образуются в системах Fe–Fe3CиFe–C? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 35 |
3 | Почему с ростом концентрации углерода в сплавах Fe–Fe3Cувеличивается их твердость. Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 08 |
4 | Почему с ростом концентрации углерода в сплавах Fe–Fe3Cувеличивается их твердость. Расшифруйте марку стали, назовите ее структуру и назначение: ВСт6пс |
5 | Что собой представляет критическая точка А1? Изменяется ли ее значение в зависимости от концентрации углерода в сталях? Расшифруйте марку стали, назовите ее структуру и назначение: У7 |
6 | Что такое полиморфное превращение? Поясните по диаграмме “Fe–Fe3C”. Расшифруйте марку стали, назовите ее структуру и назначение: ВСт3кп |
7 | Что такое магнитное превращение в сталях? При каких условиях оно протекает. Расшифруйте марку стали, назовите ее структуру и назначение: ВСт4пс |
8 | В чем разница между эвтектическим и эвтектоидным превращением (на примере диаграммы “Fe–Fe3C”)? Расшифруйте марку стали, назовите ее структуру и назначение:У10А |
9 | К какому виду соединений относится цементит? Каковы его свойства. Расшифруйте марку стали, назовите ее структуру и назначение: ВСт2пс |
10 | К какому виду соединений относится аустенит? Каковы его свойства. Расшифруйте марку стали, назовите ее структуру и назначение: У12 |
11 | К какому виду соединений относится феррит? Каковы его свойства. Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 18кп |
12 | Как с изменением концентрации углерода изменяется структура сталей. Расшифруйте марку стали, назовите ее структуру и назначение: У8 |
13 | Термодинамические условия образования стабильной фазы графита в системе Fe–Fe3C. Расшифруйте марку стали, назовите ее структуру и назначение: У13А |
14 | Как изменится структура перлита при уменьшении концентрации углерода меньше эвтектоидной? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 10 |
1 | 2 |
15 | Почему сера, фосфор, кислород и водород относятся к вредным примесям в сталях? Расшифруйте марку стали, назовите ее структуру и назначение: У10 |
16 | Как изменится структура перлита при увеличении концентрации углерода выше эвтектоидной? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 45 |
17 | В чем различия между перетектической и эвтектической реакциями (на примере системы “Fe–Fe3C”)? Расшифруйте марку стали, назовите ее структуру и назначение: У7А |
18 | В чем различия между перетектической и эвтектоидной реакциями (на примере системы “Fe–Fe3C”)? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 50 |
19 | Какие фазы и какие структуры формируются при кристаллизации в системе “Fe–Fe3C”? Расшифруйте марку стали, назовите ее структуру и назначение: У8А |
20 | Что собой представляет критическая точка А3? По какой линии диаграммы она изменяет свое значение для доэвтектоидных сталей? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 20кп |
21 | При какой концентрации углерода формируется структура ледебурита? Каков ее фазовый состав, морфология и свойства? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 60 |
22 | При какой концентрации углерода формируется структура перлита? Какой ее фазовый состав, морфология и свойства? Расшифруйте марку стали, назовите ее структуру и назначение: Сталь 08Ю |
23 | При каких условиях возможно образование чисто ферритной структуры сталей? Расшифруйте марку стали, назовите ее структуру и назначение: У13 |
24 | При каких условиях возможно образование чисто аустенитной структуры стали при комнатной температуре? Расшифруйте марку стали, назовите ее структуру и назначение: ВСт 3сп |
25 | В чем различия между твердыми растворами –Fe(феррит),–Fe(аустенит) и химическим соединениемFe3C(цементит)? Расшифруйте марку стали, назовите ее структуру и назначение: У9А |
Приложение 2
studfiles.net
Диаграмма состояния железо-углерод
Железо и его сплавы – важнейшие конструкционные материалы в технике, и в особенности в машиностроении. Разнообразие фазовых и структурных составляющих в системе железо-углерод способствует получению сталей и чугунов с заданными механическими свойствами.
В виду того, что в машиностроении нельзя использовать сплавы с содержанием углерода свыше 6,67 % С ввиду их очень высокой хрупкости, то диаграмму состояния обычно изображают для соединения Fe3C – цементита, содержащего 6,67 % углерода.
Диаграмма состояния железо-цементит
Компоненты диаграммы
Железо – серебристо-серый металл, принадлежащий к VIII группе периодической системы, температура плавления Т=1536 С. Железо в твердом состоянии может находиться в двух полиморфных модификациях: объемноцентрированного (а) и гранецентрированного (б) куба.
| |
объемноцентрированная решетка (ОЦК) -железо | гранецентрированная решетка (ГЦК) -железо |

в
Из схемы изменения свободной энергии (в) следует, что с интервале температур 910-1392С меньшую свободную энергию и большую стабильность имеет -железо с кристаллической решеткой ГЦК. Ниже 910 С и 1392 С устойчиво -железо с ОЦК решеткой. Высокотемпературную модификацию -железа иногда называют -железом, хотя оно не представляет собой новой кристаллической формы. Ниже температуры 768 С железо магнитно, выше этой температуры железо теряет свои магнитные свойства.
Углеродв железоуглеродистых сплавах находится в химически связанном или свободном состоянии. Принадлежит к IV группе периодической системы, является неметаллом. Температура плавления 3500 С. Имеет две кристаллические модификации – графита и алмаза. При нормальных условиях стабилен графит, он имеет гексагональную решетку. Алмаз получается при высоких давлениях и температурах, имеет кубическую (метастабильную) решетку.
Фазовые составляющие:
Ф – феррит – твердый раствор внедрения углерода в -железе, магнитен до 768С. Максимальная растворимость углерода в феррите составляет 0,02 % при Т=727С, при комнатной температуре растворимость углерода в феррите уменьшается до 0,006 %. Твердость феррита НВ=80-100, высокопластичен, хорошо обрабатывается давлением в холодном состоянии.
А – аустенит – твердый раствор внедрения углерода в -железе, немагнитен. Максимальная растворимость углерода в -железе составляет 2,14 % при температуре 1147С. Высокопластичен, но более тверд, чем феррит (твердость аустенита НВ=160-200).
Ц – цементит – карбид железа Fe3C, в котором содержится 6.67 % С. Магнитен до 210 С. Температура плавления 1252 С. Обладает высокой твердостью (около 800 НВ). Очень хрупок, имеет почти нулевую пластичность. В зависимости от условий образования различают:
первичный ЦI – выделяется непосредственно из жидкой фазы, наиболее грубые выделения;
вторичный ЦII – выделяется из аустенита при достаточно высоких температурах и высокой скорости диффузии, в виде сетки по границам зерен;
третичный ЦIII – выделяется из феррита при сравнительно низких температурах, обычно внутри зерен в виде дисперсных включений, которые увеличивают прочность феррита.
studfiles.net
Диаграмма состояния системы железо – углерод
Металлические сплавы — это сложные по составу вещества на основе металлов, сохраняющие их основные свойства: высокую электро — и теплопроводность, литейные свойства, ковкость и др. Сплав может быть в жидком и твердом состоянии. В жидком состоянии существует только одна жидкая фаза, а в твердом у сплавов может быть несколько фаз в виде твердых растворов, химических соединений и механических смесей.
Твердые растворы состоят из двух и более компонентов, в которых атомы растворимого компонента располагаются в кристаллической решетке основного компонента, замещая его атомы, либо внедрясь в кристаллическую решетку.
Химические соединения могут быть в виде металлов с неметаллами (Fe3C) или металлов с металлами (CuAl2, CuNi). Они обладают конкретными физико — механическими свойствами. Например, цементит (Fe3C) имеет высокую твердость, повышенную хрупкость и низкую электропроводность.

Механические смеси состоят из нескольких компонентов, которые при затвердевании (кристаллизации) не взаимодействуют друг с другом. Каждая из фаз сохраняет свою кристаллическую решетку. Например, у сталей могут одновременно быть смеси феррита и аустенита, или перлита и цементита. Диаграммы состояния строятся на основе кривых нагрева и охлаждения. Рассмотрим сплав (рис. 1.25) медь- никель (Cu — Ni). Атомы Cu и Ni могут соединяться в любых пропорциях (0…100%), образуя твердый раствор, при этом атомы Ni могут замещать в кристаллической решетке Cu все атомы. По горизонтальной оси откладывается содержание компонентов в твердом растворе, а по вертикальной- температура. Точка 1083 °C показывает температуру плавления меди, а точка 1452 °C –никеля. Нижняя линия (солидус) –это граница твердого раствора. Ниже ее оба металла и смесь находятся в твердом состоянии (в кристаллическом виде). Выше верхней линии (ликвидуса) располагается область жидкого раствора обоих этих металлов и сплавов. В «чечевице», очерченной нижней и верхней линиями, лежит область смеси кристаллов и более тугоплавкового металла с капельками более легкоплавкого.
В правой части рисунка 1.25 находятся кривые нагрева и охлаждения смеси (в данном случае представлена 50% смесь) этих металлов. На основании таких кривых, полученных для различных смесей в интервале 0…100% и построена диаграмма состояний. На кривых нагрева и охлаждения видны горизонтальные линии: при разрушении кристаллов тепло подводится, но повышения температуры нет, т.к. это тепло расходуется на разрушение кристаллов; при кристаллизации, наоборот, выделяется тепло, поэтому температура сплава по времени не снижается.
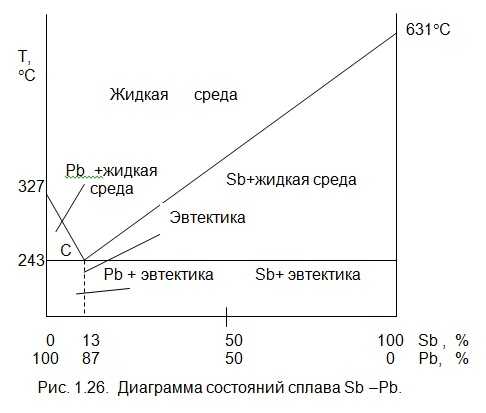
Для компонентов (пример для смеси свинец –сурьма), неограниченно растворимых в жидком состоянии и совершенно нерастворимых в твердом состоянии, с образованием механической смеси (эвтектики), диаграмма представлена на рис. 1.26.
На первом участке диаграммы ниже линии температур 327…243 °C кристаллизуется свинец, а далее на участке температур 243…631 °C — сурьма. В точке С кристаллизуется свинец и сурьма, и жидкость без промежуточных фаз переходит в твердое состояние. Эта смесь называется эвтектикой. До нее будет доэвтектический сплав (Рb + Э), а после заэвтектический сплав (Sb + Э). В точке С самая низкая температура плавления (243 °C) сплава.
Имеется связь характера диаграмм состояний со свойствами (электропроводность, твердость, прочность и т. д.). Так для первой группы сплавов –твердых растворов, с ростом концентрации компонента (например, Ni на рис. 1.25) механические свойства (твердость., прочность) увеличиваются, а для второй группы (рис. 1.26) имеется точка экстремума, т. е. сначала механические характеристики повышаются, а далее снижаются.
Структурные составляющие железо — углеродистых сплавов представлены в виде твердых растворов (рис. 1. 27) (феррит и аустенит), химического соединения (цементит) и механических смесей (перлит, ледобурит.,…).
Феррит это твердый раствор внедрение углерода в a—железо. Он очень мягкий и пластичный, хорошо проводит тепло и электричество, сильно магнитен. Углерода в нем очень мало (около 0,002%). В микроструктурах металла цементит имеет белый цвет. Углерод замещает центральный атом объемно — центрированной кубической решетки (a — железо) или вакансии кристаллической решетки.

Фазовые превращения (рис. 1.28) происходят по мере изменения температуры. При нагреве до 768 °С a — железо теряет свои магнитные свойства, но кристаллическая решетка не меняется.
При 898 °С – эта решетка превращается в гранецентрированную кубическую решетку, называемую g — железом. Аустенит это твердый раствор внедрения углерода в y –железо. Он не магнитен, сравнительно мягкий, углерода содержится в нем максимально до 2%.
При 1401 °С g — железо превращается в s — железо с объемно — центрированной решеткой, существующей до температуры плавления железа (1539 °С).
Цементит — это химическое соединение (карбид железа Fe3C), содержащее 6,67% углерода и имеющее высокую твердость и хрупкость, плохо проводящее электрический ток и тепло. Цементная сетка является светлой на микроструктурах сплава. Цементит является неустойчивым химическим соединением и при высоких температурах происходит его распад на железо и углерод:
Fe3 C ® Fe + C.
Ледебурит—это механическая смесь (эвтектика) , состоящая из аустенита и цементита и содержащая 4,3% углерода, образуется при температурах ниже 1147 °С, имеет высокую твердость и хрупкость.
Перлит – механическая смесь (эвтектоид), состоящая из тонких пластинок или зерен цементита и феррита, образуется в результате распада аустенита при температурах ниже 727 °С. Углерода в перлите 0,8%.
На основе кривых (рис. 1.28) охлаждения и нагрева сплавов Fe-C строится диаграмма состояний (рис.1.29) системы железо-углерод. На ней имеются линии: ликвидуса –АСД ; солидуса — AECF. Выше линии ликвидуса металл находится в жидком состоянии, а ниже линии солидуса- в твердом (кристаллическом) состоянии. Остальные линии отражают превращения в сплавах, происходящие после затвердевания. Ниже линии солидуса, при дальнейшем снижении температуры происходят структурные изменения, т.е. перекристаллизация уже в твердом состоянии (вторичная кристаллизация).
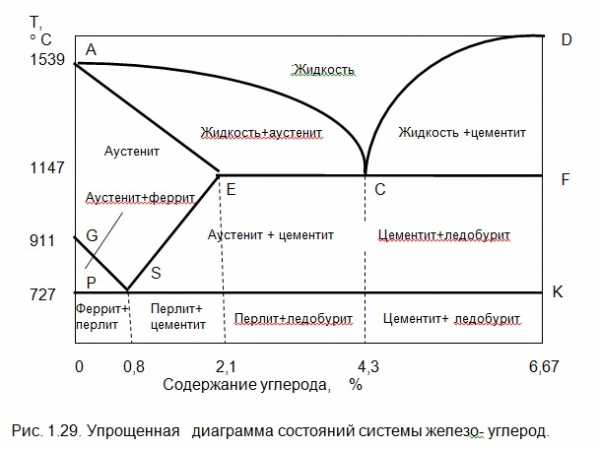
В точке S аустенит распадается на твердую однородную смесь кристаллов феррита и цемента — перлит. Сплав в точке S — эвтектоидный, при содержании углерода меньше 0,8% доэвтектоидный, а более 0,8% — заэвтектоидный. После 0,8% происходит распад аустенита с выпаданием из него вторичного цементита.
Точка А –это температура плавления чистого железа Fe, а точка Д — температура плавления цементита Fe3C. Точка Е (2,14% С) делит сплав на две группы: стали и чугуны. Левее точки Е будут стали, а правее- чугуны.
Температура плавления стали с увеличением количества углерода С в ней снижается, а чугунов после 4,3% — увеличивается.
Сразу после затвердевания структура сталей состоит из аустенита, а чугунов из смесей: аустенит + ледебурит ; цементит + ледебурит.
При охлаждении доэвтектоидных сталей (С < 0,8%, т.е. левее точки S) аустенит распадается, из него выделяется феррит.
В эвтектоидной точке С будет механическая смесь кристаллов аустенита и цементита — ледебурит. Правее точки С выделяется цементит. Сплавы чугунов левее точки С — доэвтектоидные, правее — заэвтектоидные.
Белые чугуны (белый оттенок на изломе). состоят из ледебурита и цементита Они твердые, хрупкие, трудно механически обрабатываются. Используются для передела в сталь.
Если углерод в сплаве находится в свободном состоянии, т.е. в виде графита, то это серые чугуны.
Диаграмма железо — углерод имеет большое практическое значение для инженеров. По ней можно определить температуру плавления и затвердевания сталей и чугунов, интервалы температур при обработке сталей давлением (ковка, штамповка,…) и термической обработке (закалка, отпуск,…), т.е.. она нужна металлургу, кузнецу и термисту.
www.npokz.ru
Diagram of the system state iron-carbon
 Mechanical mixture It consists of several components, kotoryya at zatverdevanyy (crystallization) do not interact with each other. Each phase retains its crystal lattice. Например, Steels can simultaneously be a mixture of ferrite and austenite, or perlite and cementite. state diagrams are based on the hot and cold curves. Consider alloy (rice. 1.25) copper- nickel (Cu – Ni). Cu and Ni atoms can be joined in any proportions (0…100%), forming a solid solution, wherein Ni atoms can substitute into the crystal lattice of all the atoms of Cu. The horizontal axis of components in the solid solution, and the vertical- температура. Точка 1083 ° C shows a melting point of copper, and point 1452 ° C -nikelya. bottom line (solidus) is the boundary of a solid solution. Here, both metal and its mixture in the solid state (in crystalline form). Above the top of the line (liquidus) It is the area of a liquid solution of both metals and alloys. The “lentils” , delineated by upper and lower lines , lying area a mixture of crystals and a refractory metal with droplets of fusible more.
Mechanical mixture It consists of several components, kotoryya at zatverdevanyy (crystallization) do not interact with each other. Each phase retains its crystal lattice. Например, Steels can simultaneously be a mixture of ferrite and austenite, or perlite and cementite. state diagrams are based on the hot and cold curves. Consider alloy (rice. 1.25) copper- nickel (Cu – Ni). Cu and Ni atoms can be joined in any proportions (0…100%), forming a solid solution, wherein Ni atoms can substitute into the crystal lattice of all the atoms of Cu. The horizontal axis of components in the solid solution, and the vertical- температура. Точка 1083 ° C shows a melting point of copper, and point 1452 ° C -nikelya. bottom line (solidus) is the boundary of a solid solution. Here, both metal and its mixture in the solid state (in crystalline form). Above the top of the line (liquidus) It is the area of a liquid solution of both metals and alloys. The “lentils” , delineated by upper and lower lines , lying area a mixture of crystals and a refractory metal with droplets of fusible more.
In the right part of the figure 1.25 are the curves of heating and cooling the mixture (in this case, represented 50 % mixture) these metals. On the basis of these curves, obtained for different mixtures in the range of 0 … 100%, and the diagram of the states. In the heating and cooling curves visible horizontal lines: the destruction of the crystals heat is applied , but no increase in temperature, tk. this heat is spent on the destruction of crystals; upon crystallization, conversely, выделяется тепло, therefore, the time temperature of the alloy is not reduced.
For components (for example a mixture of lead-antimony), infinitely soluble in the liquid state and a completely insoluble solid, to form a mechanical mixture (eutectic), diagram is shown in Figure. 1.26.
In the first section of the diagram below the line temperature 327 … 243 ° C crystallizes lead, and then on a plot of temperatures 243 … 631 ° C – antimony. At point C crystallizes lead and antimony, and without intermediate liquid phase passes into the solid state. This mixture is called evtyektikoand. Before it will be hypoeutectic alloy (urban + Э), and then hypereutectic alloy (Sb + Э). At point C the lowest melting temperature ( 243 °C ) alloy.
There is a link with the nature of state diagrams properties (conductivity, hardness, strength, etc.. д.). So for the first group of solid solutions alloys, with increasing concentrations of component (eg, Ni на рис. 1.25) mechanical properties (hardness, strength) increase, and the second group has an extreme point, t. it is. first mechanical characteristics increase, and further reduced.
Structural components of the iron — carbon alloys presented in the form of solid solutions (rice. 1. 27) ( ferrit and austenite), chemical compound (cementite) and mechanical mixtures (perlite, Ice screws,…).
Ferrite It is a solid solution of carbon in the implementation of a-iron. He is very soft and ductile, good conductor of heat and electricity, silyno magnetic. Carbon there are very few ( about 0,002 % ). The metal microstructures cementite is white. The carbon atom replaces a central volume — centered cubic lattice (a – iron) or lattice vacancies.
 Phase transformations (rice. 1.28) occur as the temperature changes. Upon heating to 768 ° C a – iron loses its magnetic properties, but the crystal lattice does not change.
Phase transformations (rice. 1.28) occur as the temperature changes. Upon heating to 768 ° C a – iron loses its magnetic properties, but the crystal lattice does not change.
При 898 °С – This lattice is transformed into a face-centered cubic lattice, called g – iron. austenite this is a solid solution of carbon in y-iron. On no magnetic, relatively mild, carbon contained therein to maximize 2 %.
При 1401 °С g – the iron is converted into s – iron with volumetric – centered lattice, existing iron to a melting temperature (1539 °С ).
cementite – A chemical compound (карбид железа Fe3C), containing 6,67 % carbon and having high hardness and fragility, poorly conducting electricity and heat. Cement is a light grid of the alloy microstructures. Cementite chemical compound is unstable at high temperatures and its decomposition occurs at the iron and carbon:
Fe3 C ® Fe + C.
Ledeburitis a mechanical mixture ( eutectic ), consisting of cementite and austenite and containing 4,3 % carbon , is formed at temperatures below 1147 °С, has high hardness and fragility.
perlite – A mechanical mixture (evtektoid), consisting of thin plates or ferrite and cementite grains, formed as a result of the collapse of the austenite at temperatures below 727 °С. Carbon pearlite 0,8 %.
On the basis of the heating and cooling curves Fe-C alloys constructed constitution diagram iron-carbon system. It has a line: liquidus-ASD; solidusa — AECF. Above the liquidus line of the metal is in a liquid state, and below the solidus line in the solid (crystalline) a position to. The rest of the lines reflect the transformations in alloys, occurring after solidification. Below the solidus line, with a further decrease in temperature structural changes, ie. recrystallization in the solid state (secondary crystallization).
The point S austenite decomposes into solid homogeneous mixture of ferrite crystals and cement – perlite. Fusion point in S – eutectoid, when the carbon content is less than 0,8% doevtektoidnyh, and more 0,8% – hypereutectoid. After 0,8% there is decomposition of austenite to drop out of his secondary cementite.
Point A is the melting point of pure iron Fe, and the point D – the melting point of the cementite Fe3C. section E ( 2,14 % С) Alloy divides into two groups: steel and cast iron. To the left of point E will become, and right- chuguny.
The melting point of steel with an increase in the amount of carbon C in it is reduced, and after iron 4,3 % – increases. Immediately after solidification steel structure consists of austenita, and mixtures of iron: austenite + ledeburit ; cementite + ledeburit.
Upon cooling doevtektoidnyh steels (С < 0,8%, ie. left of the point S) austenite decomposes, it emits a ferrite.
The eutectoid point C is a mechanical mixture of austenite and cementite crystals – Ledebour. To the right of the point stands cementite. Alloys of iron to the left of point C – hypoeutectoid, right – hypereutectoid classes.
white cast irons (white color on a break). It consists of ledeburite and cementite These solid, fragile, it is difficult to mechanically processed. Used for conversion into steel.
If the carbon in the alloy is in a free state, ie. graphitic, it is gray cast iron.
The diagram iron – carbon has great practical importance for engineers. As it is possible to determine the melting temperature and the solidification of cast irons and steels, temperature ranges when processing steel pressure (forging, stamping,…) and thermal treatment (hardening, holiday,…), ie. .it is necessary metallurgist, blacksmith and treater.
tehnar.net.ua
Диаграммы состояния сплавов железо ¦углерод
Для выбора режимов термической обработки стали, интервала температур горячей обработки давлением и др. пользуются диаграммой состояния сплавов железо—углерод. [c.35]Начало разработки диаграммы состояния сплавов железо—углерод было положено в 1868 г. учением о критических точках стали великим русским. металловедом Д. К. Черновым. [c.114]
Температурный интервал деформации углеродистых сталей определяется по диаграмме состояния сплавов железо — углерод (рис. 104). [c.250]
Одной из характерных точек диаграммы состояния сплавов железо—углерод является точка Е (см. рис. 33), указывающая наибольшее количество углерода (2%), которое может в себе растворить у-железо при 1130° С. С понижением температуры растворимость углерода в у-железе уменьшается по линии Е8 и при температуре 723° С (точка 5) становится равной 0,83%. От точки Е вправо линия конца затвердевания идет горизонтально, т. е. все сплавы, содержащие больше 2% С, имеют постоянную температуру конца затвердевания (1130°С). [c.118]
При разработке технологического процесса обработки давлением температурный интервал деформации углеродистых сталей определяется по диаграмме состояния сплавов железо — углерод (рис. 107, заштрихованная область). Следует отметить, что температура обработки заэвтектоидных сталей находится ниже линии ЕЗ (двухфазное состояние). Это вполне допустимо, так как в [c.301]
Диагональное зубошевингование 405 Диаграммы состояния сплавов железо — углерод 531 —точечные — Графики 62 — Статистический метод 61 Дисбаланс деталей машин — Устранение 769—772 [c.859]
Одной из наиболее важных точек диаграммы состояния сплавов железо — углерод является точка Е (фиг, 49), лежащая при температуре ИЗО и соответствующая содержанию 2,0% С. Точка Е характеризует наибольшее количество углерода, которое может в себе растворить у Ж – езо при 1130° С понижением температуры растворимость углерода в у-железе уменьшается по линии ES и при температуре 723° (точка S) становится равной 0,83%. От точки Е вправо линия конца затвердевания идет горизонтально, т. е. все сплавы, содержащие больше 2,0% С, имеют постоянную температуру конца затвердевания (1130°). Эвтектоидная точка S, соответствующая содержанию [c.123]
Диаграмма состояния сплавов железо—углерод [c.20]
К 1910 г. металловедение вполне оформилось как наука. Диаграмма состояния сплавов железо — углерод была разработана с большой степенью точности. К этому моменту стала совершенно очевидной связь между макро- и микроструктурой металлов и их механическими свойствами. Последнее обстоятельство заставило еще теснее увязывать металловедение с технологией не только термической обработки, но также и с технологией обработки давлением — ковки, прокатки (Д. К. Чернов, [c.12]
Структура стали в равновесном состоянии определяется содержанием углерода, как это показывает диаграмма состояния сплавов железо—углерод (рис. 173). [c.255]
| Фиг. 2. Левый нижний ( стальной ) угол диаграммы состояния сплавов железо—углерод (область вторичной кристаллизации стали). |  |
Диаграмма состояния сплава железо — углерод изображена на рис. 26. По горизонтальной оси диаграммы откладывается содержание углерода в стали в процентах, по вертикальной — температура в градусах Цельсия. Каждая точка на диаграмме характеризует определенный состав сплава при определенной температуре. В зависимости от температуры и содержания углерода сплавы [c.63]
Диаграмма состояния сплавов железо — углерод, представленная на рис. 26, охватывает не все сплавы железа с углеродом, а лишь содержащие от О до 6,67% углерода, т. е. от чистого железа до цементита. Железоуглеродистые сплавы, содержащие более 5% углерода, не представляют практического интереса. Число 6,67% взято в качестве предела на том основании, что при таком содержании углерода образуется химическое соединение — цементит. [c.65]
ДИАГРАММА СОСТОЯНИЯ СПЛАВОВ ЖЕЛЕЗО—УГЛЕРОД [c.72]
В результате этих работ мы располагаем в настоящее время диаграммой состояний сплавов железо—углерод, позволяющей судить о строении этих сплавов в зависимости от состава, температуры в равновесных условиях, а равно и предвидеть возможные изменения в строении и свойствах в случаях практически неизбежного или необходимого отклонения от условий равновесия. [c.144]
Без знания этой диаграммы невозможно разобраться в процессах, происходящих при различных видах теплового воздействия на сплавы железо — углерод, назначать правильные режимы проведения различных технологических процессов. Диаграмма состояний сплавов железо — углерод нужна для установления правильных условий литья деталей и их последующей термической обработки, для назначения правильных режимов горячей деформации изделий (ковка, щтамповка, прокатка) и их последующей термической обработки, правильной технологии сварки и последующей термической обработки сварных изделий и т. д. Диаграмма состояний железо — углерод является основой для назначения рациональных режимов термической и химико-термической обработки стали и чугуна. Вследствие огромной теоретической и практической значимости диаграммы состояний железо—углерод она будет подробно рассмотрена на базе уже ранее изложенных основ теории сплавов. [c.144]
Диаграмма состояний сплавов железо — углерод приведена на фиг. 133, а. [c.144]
ДИАГРАММА СОСТОЯНИЙ СПЛАВОВ ЖЕЛЕЗО — УГЛЕРОД [c.101]
Главной примесью в стали, определяющей ее основные свойства, является углерод. Взаимодействие углерода с а-или -модификациями железа приводит к образованию различных по строению и свойствам железоуглеродистых сплавов. Представление о температурных и концентрационных границах существования этих сплавов дает диаграмма состояния сплавов железо — углерод (фиг. 2). [c.101]
О 10 20 30 40 50 60 70 80 Фиг. 27. Диаграмма состояния сплавов железо — углерод. [c.74]Все превращения в сплавах, происходящие по диаграмме состояния сплавов железо — углерод, протекают при очень медленном охлаждении, поэтому они успевают полностью завершиться при температурах, указанных на диаграмме. Если условия охлаждения изменить, то положение критических точек также изменится и в результате получатся совсем иные структуры. [c.83]
Структуры, получаемые при медленном охлаждении и фиксируемые по диаграмме состояния сплавов железо — углерод, называются равновесными, а структуры, получаемые при быстром охлаждении (сорбит, троостит и мартенсит), — неравновесными. [c.84]
Выбор температуры нагрева. Температура нагрева при закалке углеродистых сталей зависит от положения критических точек Л и Лз на диаграмме состояния сплавов железо — углерод. [c.87]
| Рис. 7. Диаграмма состояний сплава железо-углерод (изображена только левая часть, относящаяся к стали и щироко применяемым чугунам) | 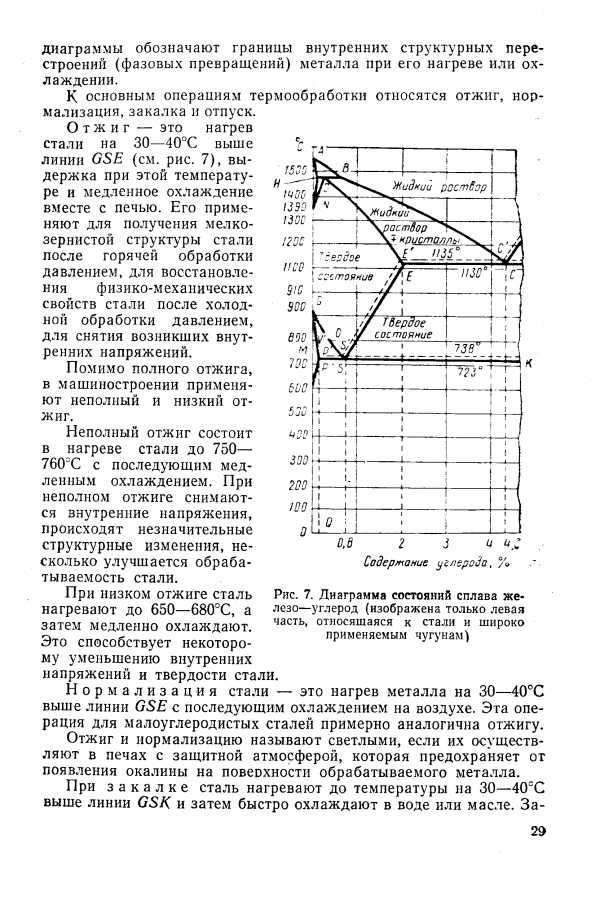 |
В результате всех этих работ диаграмма состояния сплавов железо—углерод была установлена в том виде, в каком она принята в настоящее время (не считая небольших поправок, не имеющих принципиального значения). [c.10]
Диаграмма состояния сплава железо — углерод показана на рис. 2.1. Она имеет сложный вид и отображает состояния сплавов в зависимости от температуры и соотношений компонентов Ре и С. Оба компонента обладают аллотропией, каждый имеет отличные от другого строение и свойства при различных температурах. [c.29]
| Рис. 40. Диаграмма состояния сплавов железо—углерод (участок стали) с указанием температурных интервалов ковки углеродистых сталей |  |
Общие сведения о температурных и кон-целтрац. границах существования фаз (феррита, цементита, перлита и аустени-та) дает диаграмма состояния сплавов железо — углерод. [c.196]
Одной из характерных точек диаграммы состояния сплавов железо — углерод является точка Е (см. рис. 42), указываюш,ая наибольшее количество углерода — 2,0%, которое может в себе раст- [c.98]
На лис. 109 — диаграмма состояния сплавов железо—углерод для ста Дей. При температуре выше линии Л С —стали находятся в жидком состоянии в интервале температур между линиями АС и АЕ — ИЙ жидкого расплава выпадают кристаллики аустенита и чем ниже уемпература, тем больше аустенита и меньше жидкого расплава. [c.145]
Настоящая книга представляет собой учебник по термической обработке металлов для машиностроительных техникумов. Для изучения термической обработки по этой книге от учащегося требуется знание основ металловедения в объеме книги А. И. Самохоц-кого и М. П. Кунявского Металловедение или книги М. С. Ароновича и Ю. М. Лахтина Основы металловедения и термической обработки. или книги Б. С. Натапова Металловедение , представляющих собой также учебники для техникумов. Предполагается, что учащийся хорошо знаком с основными типами двойных диаграмм состояния, с кристаллическим строением металлов и сплавов, с элементарными структурами сталей и чугунов, с методикой металлографического исследования и с механическими испытаниями. Эти вопросы в настоящей книге не рассматриваются вовсе. Не рассматривается в настоящей книге и оборудование для термической обработки печи, закалочные баки, закалочные прессы и т. п., так как эти вопросы изучаются в отдельном курсе. В первой главе кратко, но несколько подробнее, чем в упомянутых учебниках по металловедению, рассмотрены классификация и характеристика сталей и диаграмма состояния сплавов железо—углерод. [c.3]
В углеродистых сталях и чугунах углерод образует обычно карбид железа химическое соединение РезС, называемое в металловедении цементитом, которое содержит 6,67% углерода. Рассмотрим часть диаграммы железо—углерод от железа до цементита, который ввиду его стойкости можно считать самостоятельным компонентом. В этом случае часть диаграммы состояния сплавов железа с углеродом, содержащих до 6,67% углерода, превращается в диаграмму сплавов железо—цементит (рис. 2-1). [c.35]
mash-xxl.info


