Аргон атомная масса: Аргон — Википедия
alexxlab | 03.06.2018 | 0 | Разное
Аргон – это… Что такое Аргон?
| Внешний вид простого вещества | |
|---|---|
| Свойства атома | |
| Имя, символ, номер | Арго́н / Argon (Ar), 18 |
| Атомная масса (молярная масса) | 39,948 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Радиус атома | ? (71)[1] пм |
| Химические свойства | |
| Ковалентный радиус | 106[1] пм |
| Радиус иона | 154[1] пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации | 1519,6(15,75) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,784·10−3 г/см³ |
| Плотность при т. п. | 1,40 г/см³ |
| Температура плавления | 83,8 К (-189,35 °C) |
| Температура кипения | 87,3 К (-185,85 °C) |
| Теплота испарения | 6,52 кДж/моль |
| Молярная теплоёмкость | 20,79[2] Дж/(K·моль) |
| Молярный объём | 24,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,0177 Вт/(м·К) |
Арго́н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440-37-1) — инертный одноатомный газ без цвета, вкуса и запаха.
История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырек газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота [3].
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос[3][4].
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)[4].
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа [3].
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[3].
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[3].
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %)[3][4]. Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон [3].
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии[3].
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность[3].
Распространённость
Во Вселенной
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе[6].
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе[4][7], его запасы в атмосфере оцениваются в 4·1014 т[2][4]. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона)[4][7].
Содержание аргона в литосфере — 4·10−6 % по массе[2]. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10−5 — 9,7·10−5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т[7].
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O 2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа[2].
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. Плотность при нормальных условиях составляет 1,7839 кг/м
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO[8]. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы
Аргон представлен в земной атмосфере тремя стабильными изотопами: [4][7]. Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона[7].
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
Применение
 Заполненная аргоном и парами ртути газоразрядная трубка
Заполненная аргоном и парами ртути газоразрядная трубкаНиже перечислены области применения аргона:
- в аргоновых лазерах
- в лампах накаливания и при заполнении внутреннего пространства стеклопакетов
- в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов (например, титана), так и неметаллов
- в качестве плазмаобразователя в плазматронах при сварке и резке
- в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа
- в качестве огнетушащего вещества в газовых установках пожаротушения
- в медицине во время операций для очистки воздуха и разрезов, так как аргон почти не образует химических соединений
- в качестве составной части атмосферы эксперимента Марс-500[9] с целью снижения уровня кислорода для предотвращения пожара на борту космического корабля при путешествии на Марс
- из-за низкой теплопроводности аргон применяется в дайвинге для поддува сухих гидрокостюмов, однако есть ряд недостатков:
- высокая цена газа (кроме этого нужна отдельная система для аргона)
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа[10].
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания)[11].
Примечания
Ссылки
аргон – Argon – qwe.wiki
Химический элемент с атомным номером 18
Эта статья о химическом элементе. Для использования в других целях, см Аргон (значения) .Химический элемент с атомным номером 18
 | |||||||||||||||
| аргон | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | Ɑːr ɡ ɒ п / | ||||||||||||||
| Внешность | бесцветный газ демонстрируя сирень / фиолетовое свечение при помещении в электрическом поле | ||||||||||||||
| Стандартный атомный вес г, станд (Ar) | [ 7001397920000000000 ♠39,792 , 7001399630000000000 ♠39,963 ] обычный: 7001399480000000000 ♠39,948 | ||||||||||||||
| Аргон в периодической таблице | |||||||||||||||
| Атомный номер ( Z ) | 18 | ||||||||||||||
| группа | Группа 18 (благородные газы) | ||||||||||||||
| период | период 3 | ||||||||||||||
| блок | п-блок | ||||||||||||||
| категория Элемент | благородный газ | ||||||||||||||
| Электронная конфигурация | [ Н ] 3s 2 3p 6 | ||||||||||||||
Электроны в оболочке | 2, 8, 8 | ||||||||||||||
| Физические свойства | |||||||||||||||
| Фаза на STP | газ | ||||||||||||||
| Температура плавления | 83.81 К (-189,34 ° С, -308,81 ° F) | ||||||||||||||
| Точка кипения | 87,302 К (-185,848 ° С, -302,526 ° F) | ||||||||||||||
| Плотность (при НТД) | 1,784 г / л | ||||||||||||||
| когда жидкость (в п.н. ) | 1,3954 г / см 3 | ||||||||||||||
| Тройная точка | 83,8058 К, 68,89 кПа | ||||||||||||||
| Критическая точка | 150,687 К, 4,863 МПа | ||||||||||||||
| Теплота плавления | 1,18 кДж / моль | ||||||||||||||
| Теплота парообразования | 6,53 кДж / моль | ||||||||||||||
| Молярная теплоемкость | 20,85 Дж / (моль · К) | ||||||||||||||
Давление газа
| |||||||||||||||
| Атомные свойства | |||||||||||||||
| Окислительные состояния | 0 | ||||||||||||||
| Электроотрицательность | Полинг шкала: нет данных | ||||||||||||||
| энергия ионизации |
| ||||||||||||||
| радиус Ковалентного | 106 ± 10 вечера | ||||||||||||||
| Ван-дер-Ваальса радиус | 188 ч | ||||||||||||||
 Спектральные линии аргона Спектральные линии аргона | |||||||||||||||
| Другие свойства | |||||||||||||||
| Естественное явление | исконный | ||||||||||||||
| Кристальная структура | гранецентрированной кубической (ГЦК) | ||||||||||||||
| Скорость звука | 323 м / с (газ, при 27 ° C) | ||||||||||||||
| Теплопроводность | 17,72 × 10 – 3 Вт / (м · К) | ||||||||||||||
| Магнитное упорядочение | диамагнитный | ||||||||||||||
| магнитная восприимчивость | -19,6 · 10 -6 см 3 / моль | ||||||||||||||
| Количество CAS | 7440-37-1 | ||||||||||||||
| история | |||||||||||||||
| Открытие и первый изоляции | Лорд Рейли и Уильям Рамсей (1894) | ||||||||||||||
| Основные изотопы аргона | |||||||||||||||
| 36 Ar и 38 Ar содержание может быть столь же высоким , как 2,07% и 4,3% соответственно , в природных образцах. 40 Ar является остатком в таких случаях, содержание которых может быть столь же низким , как 93,6%. | |||||||||||||||
| | Рекомендации | |||||||||||||||
Аргон является химическим элементом с символом Ar и атомным номером 18. Это находится в группе 18 периодической таблицы и представляет собой благородный газ . Аргон является третьим наиболее распространенным газа в атмосфере Земли , на 0,934% (9340 млн – ). Это более чем в два раза , как обильные , как водяной пар (который составляет в среднем около 4000 объемных частей на миллион, но сильно варьирует), 23 раз , как обильные , как диоксид углерода (400 промилле по объему), и более чем в 500 раз , как обильные , как неон (18) промилле по объему. Аргон является наиболее распространенным благородным газом в земной коре, содержащая 0,00015% от коры.
Почти все аргона в атмосфере Земли является радиогенный аргон-40 , полученный от распада на калий-40 в земной коре. Во вселенной, аргон-36 на сегодняшний день является наиболее распространенным аргона изотопа , как это наиболее легко получают путем звездного нуклеосинтеза в сверхновых .
Название «аргон» происходит от греческого слова ἀργόν , стерилизуют единственная форма ἀργός означает «ленивый» или «неактивный», в качестве ссылки на тот факт , что элемент подвергается практически нет химических реакций. Полный октет (восемь электронов) во внешней оболочке атома аргона делает стабильным и устойчивым к склеиванию с другими элементами. Его тройная точка температурой 83.8058 K является определяющей фиксированной точкой в международной температурной шкале 1990 года .
Аргон получают промышленно с помощью фракционной перегонки из жидкого воздуха . Аргон в основном используются в качестве инертного защитного газа при сварке и других промышленных высокотемпературных процессах , где обычно инертные вещества становятся реактивными; например, в атмосфере аргона используется в графитовых электрических печах , чтобы предотвратить графит от горения. Аргон также используется в ламп накаливания , люминесцентное освещение , и других газоразрядных трубок. Аргон делает отличительный сине-зеленый газовый лазер . Аргон также используется в люминесцентных стартеров тлеющего.
Характеристики
 Небольшой кусочек быстро плавильного твердого аргона
Небольшой кусочек быстро плавильного твердого аргонаАргон имеет приблизительно такую же растворимость в воде , как кислород и в 2,5 раза больше , растворим в воде , чем азот . Аргон бесцветен, не имеет запаха, нетоксичен и негорюч в виде твердого вещества, жидкости или газа. Аргон химически инертен при большинстве условий и формах ни одного подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон является инертным газом , он может образовывать несколько соединений при различных экстремальных условиях. Гидрофторид аргон (Harf), соединение аргона с фтором и водородом , который стабилен ниже 17 К (-256.1 ° C; -429,1 ° F), был продемонстрировано. Несмотря на то, что нейтральное основном состоянии химических соединения аргона в настоящее время ограничены HArF, аргон может образовывать клатраты с водой , когда атомы аргона в ловушке в решетке молекул воды. Ионы , такие как ArH +
И возбужденные состояния комплексы , такие как ArF, были продемонстрированы. Теоретический расчет предсказывает несколько больше аргона соединений , которые должны быть стабильными , но еще не были синтезированы.
история
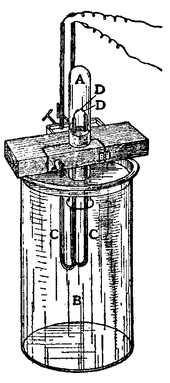 Лорд Рейли «метод с для выделения аргона, на основе эксперимента Генри Кавендиш » ы. Газа содержится в пробирке (А) , стоя слишком большое количество слабой щелочи (В), а ток подаются в проводах изолированных от U-образных стеклянных трубок (CC) , проходящих через жидкость и вокруг устья тест-трубка. Внутренние концы платины (DD) проволок получают ток от батареи из пяти клеток Grove и катушки Румкорфа среднего размера.
Лорд Рейли «метод с для выделения аргона, на основе эксперимента Генри Кавендиш » ы. Газа содержится в пробирке (А) , стоя слишком большое количество слабой щелочи (В), а ток подаются в проводах изолированных от U-образных стеклянных трубок (CC) , проходящих через жидкость и вокруг устья тест-трубка. Внутренние концы платины (DD) проволок получают ток от батареи из пяти клеток Grove и катушки Румкорфа среднего размера.Аргон ( греческий ἀργόν , стерилизуют единственная форма ἀργός означает «ленивый» или «неактивный»), назван в отношении его химической активности. Это химическое свойство этого первого благородного газа , чтобы быть обнаруженными впечатлить namers. Инертное газ предположительно компонент воздуха Генри Кавендиш в 1785 Аргоне впервые был выделена из воздуха в 1894 годом Рэлея и сэр William Ramsay в University College London путем удаления кислорода , углекислого газ , воды и азот из образца чистый воздух. Они установили , что азот получают из химических соединений составляла 0,5% легче , чем азот из атмосферы. Разница была небольшой, но это было достаточно важно , чтобы привлечь их внимание в течение многих месяцев. Они пришли к выводу , что существует другой газ в воздухе , смешанный с азотом. Аргон также встречается в 1882 году в ходе независимого исследования ВЧ Ньюолл и WN Хартли. Каждые обнаружены новые линии в спектре излучения воздуха , который не соответствует известным элементам.
До 1957 года, символ для аргона не было «А», но теперь «Ар».
Вхождение
Аргон составляет 0.934% по объему и 1.288% по массе земной атмосферы , и воздух является основным промышленным источником очищенных продуктов аргона. Аргон изолирован от воздуха путем фракционирования, наиболее часто путь криогенной фракционной перегонки , процесс , который также производит очищенный азот , кислород , неон , криптон и ксенон . В земной коре и морской воды содержат 1,2 м.д. и 0,45 м.д. аргона, соответственно.
Изотопы
Основные изотопы аргона , найденные на Земле 40
Ar (99,6%), 36
Ar (0,34%), и 38
Ar (0,06%). Встречающиеся в природе 40
К , с периодом полураспада 1,25 × 10 9 лет, распадается на стабильный 40
Ar (11,2%) путем захвата электрона или позитронов , а также стабильный 40
Са (88,8%) с помощью бета – распада . Эти свойства и соотношения используются для определения возраста пород с помощью K-Ar датирования .
В атмосфере Земли, 39
Ar производится луче космической деятельности, в первую очередь нейтронного захвата 40
Ar с последующим испусканием двух нейтронов. В среде подповерхностного, также производится путем захвата нейтронов на 39
К , с последующим испусканием протона. 37
Ar создается из захвата нейтронов на 40
Ca сопровождается альфа – частиц излучения в результате подземных ядерных взрывов . Она имеет период полураспада 35 дней.
Между мест в Солнечной системе , изотопный состав аргона сильно варьирует. Там , где основной источник аргона является распадом 40
K в породах, 40
Ar будет доминирующим изотопом, так как она находится на Земле. Аргон производится непосредственно звездным нуклеосинтезом , доминируют альфа-процесс нуклида 36
Ar . Соответственно, солнечный аргон содержит 84,6% 36
Ar (согласно солнечным ветру измерениям), а отношение трех изотопов 36 Ar: 38 Ar: 40 Ar в атмосферах внешнего планета 8400: 1600: 1. Это контрастирует с низкой численностью изначальных 36
Ar в атмосфере Земли, что только 31,5 промилле (= 9340 × 0,337 млн.%), сравнимые с этим неоном (18,18) млн – на Земле и с межпланетными газами, измеренных с помощью зондов .
Атмосферы Марс , Меркурий и Титан (самый большой луны Сатурна ) содержат аргон, преимущественно в виде 40
Ар , и его содержание может быть столь же высоким , как 1,93% (Mars).
Преобладание радиогенных 40
Ar является причиной стандартный атомный вес земного аргона больше , чем у следующего элемента, калия , факт , который был загадочным , когда был обнаружен аргон. Менделеева расположены элементы на его периодической таблицы в порядке атомного веса, но инертность аргона предложили размещение до того реактивного щелочного металла . Мозли позже решил эту проблему, показав , что периодическая таблица фактически расположены в порядке атомным номером (см История периодической таблицы ).
соединений
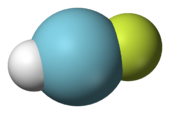
Полный октет Аргон о электронов указывает на полное s и р Подоболочки. Эта полная валентная оболочка делает аргон очень стабильный и чрезвычайно устойчив к связи с другими элементами. До 1962 г., аргон и другие благородные газы считались химически инертны и не способны образовывать соединения; Однако, с тех пор были синтезированы соединения тяжелых благородных газов. Первый аргон соединение с вольфрамовым пентакарбонилом W (CO) 5 Ара, был выделен в 1975 г. Тем не менее он не получил широкое признание в то время. В августе 2000 года , еще одного соединения аргона, гидрофторид аргон (HArF), было сформировано исследователями из Университета Хельсинки , сияя ультрафиолетовый свет на замороженном аргон , содержащий небольшое количество фтористого водорода с йодидом цезия . Это открытие привело к признанию того, что аргон может образовывать слабо связанные соединения, даже если он не был первым. Он стабилен до 17 Кельвина с (-256 ° С). Метастабильное ArCF 2+
2 дикатиона, который валентный изоэлектронный с карбонилфторидом и фосгеном , наблюдались в 2010 году Аргона-36 , в виде гидрида аргона ( argonium ионов), было обнаружено в межзвездной среде , связанную с Крабовидной туманностью сверхновой ; это была первая молекула благородного газа обнаружены в космическом пространстве .
Твердый аргон гидрид (Ar (H 2 ) 2 ) имеет такую же кристаллическую структуру , как MGZN 2 фаза Лавеса . Он образует при давлении между 4,3 и 220 ГПа, хотя измерения комбинационного рассеяния свидетельствуют о том , что H 2 молекулы в Ar (H 2 ) 2 диссоциируют выше 175 ГПа.
производство
промышленные
Аргон получают промышленно с помощью фракционной перегонки из жидкого воздуха в криогенной сепарации воздуха блока; процесс , который отделяет жидкий азот , который кипит при 77,3 K, из аргона, который кипит при 87,3 K, и жидкий кислород , который кипит при 90,2 К. Примерно 700 000 тонн в год аргона произведены во всем мире.
В радиоактивных распадах
40 Ar , наиболее распространенным изотопом аргона, получают при распаде 40 K сполураспада 1,25 × 10 9 лет путем захвата электрона или позитронов . Изза этого, он используется в калий-аргонового датирования для определения возраста пород.
Приложения
 Цилиндры, содержащие газ аргон для использования в тушении пожара, не повредив серверного оборудования
Цилиндры, содержащие газ аргон для использования в тушении пожара, не повредив серверного оборудованияАргон имеет несколько желательных свойств:
- Аргон представляет собой химически инертный газ .
- Аргон является самой дешевой альтернативой , когда азот не является достаточно инертным.
- Аргон имеет низкую теплопроводность .
- Аргон имеет электронные свойства (ионизацию и / или спектр излучения) желательные для некоторых применений.
Другие благородные газы были бы в равной степени подходит для большинства из этих приложений, но аргон является самым дешевым. Аргон является недорогим, так как это происходит естественным образом в воздухе и легко получают в виде побочного продукта при криогенном разделении воздуха в производстве жидкого кислорода и жидкого азота : первичные компоненты воздуха используются в промышленном масштабе. Другие инертные газы (кроме гелия ) получают таким образом , как хорошо, но аргон является наиболее обильным на сегодняшний день. Масса приложений аргона возникает просто потому , что он является инертным и относительно дешево.
Промышленные процессы
Аргон используется в некоторых промышленных высокотемпературных процессах, где обычно неактивные вещества становятся реактивными. Так, например, в атмосфере аргона используется в графитовых электрических печах, чтобы предотвратить графит от горения.
Для некоторых из этих процессов, присутствие азота или кислорода газов может вызвать дефекты в материале. Аргон используется в некоторых типах дуговой сварки , такие как дуговой сварки газа металла и газа вольфрама дуговой сварки , а также при обработке титана и других реактивных элементов. Атмосфере аргона также используется для выращивания кристаллов кремния и германия .
Аргон используется в птицеводстве , чтобы задушить птица, либо для массовых выбраковок следующего вспышек заболеваний, или в качестве средства убоя более гуманного , чем электрическая ванна. Аргон имеет большую плотность , чем воздух и вытесняет кислород близко к земле во время газовыделения . Его нереакционноспособная природа делает его пригодным в пищевом продукте, а поскольку он заменяет кислород в пределах мертвой птицы, аргон также увеличивает срок годности при хранении.
Аргон иногда используется для тушения пожаров , где ценное оборудование может быть повреждены водой или пеной.
Научное исследование
Жидкий аргон используется в качестве мишени для экспериментов нейтрино и прямых темной материи поисков. Взаимодействие между гипотетическим WIMPs и с ядром аргона производит сцинтилляционный свет , который обнаруживается с помощью фотоэлектронных умножителей . Двухфазные детекторы , содержащий газ аргона используются для обнаружения ионизированных электронов , возникающих при рассеянии WIMP-ядре. Как и большинство других сжиженных благородных газов, аргон имеет высокие сцинтилляционный световой выход (около 51 фотонов / к), является прозрачным для своего собственного сцинтилляционного света, и относительно легко очистить. По сравнению с ксеноном , аргон дешевле и имеет ярко выраженный профиль сцинтилляционного времени, что позволяет разделение электронных откатов от ядерных откатов. С другой стороны, присущий фон беты-лучи больше из – за 39
Ar загрязнение, если кто не использует аргон из подземных источников, что имеет гораздо меньше 39
Ар загрязнения. Большая часть аргона в атмосфере Земли был произведен захват электронов долгоживущих 40
К ( 40
К + е – → 40
Ar + ν) присутствует в природном калии в пределах Земли. 39
Ar активность в атмосфере поддерживается космогенного производства за счет реакции нокаута 40
Ар (п, 2п) 39
Ar и аналогичные реакции. Полураспада 39
Ar всего 269 лет. В результате, подземный Ar, экранируется породы и воды, имеет гораздо меньше 39
Ар загрязнения. Детекторы темной материи в настоящее время работающие с жидким аргоном , включают Darkside , WARP , ARDM , MicroClean и ОЭАП . Нейтринные эксперименты включают в себя ICARUS и MicroBooNE , оба из которых используют высокой чистоты жидкого аргона в проекционной камере времени для мелкозернистого трехмерной визуализации взаимодействий нейтрино.
консервант
Образец цезия упакован в атмосфере аргона , чтобы избежать реакций с воздухомАргон используется для вытеснения кислород- и влаги , содержащей воздух в упаковочном материале , чтобы продлить срок годности, жизнь содержимого (аргон имеет европейский код пищевой добавки E938). Воздушное окисление, гидролиз, и другие химические реакции , которые ухудшают продукты замедляется или предотвращается полностью. Химические вещества высокой чистоты и фармацевтические препараты иногда упакованы и запечатаны в атмосфере аргона.
В виноделии аргон используется в различных мероприятиях , чтобы обеспечить барьер против кислорода на поверхности жидкости, которая может испортить вино путем заправки как микробного метаболизма (как в случае с уксуснокислых бактерий ) и стандартного окислительно – восстановительной химии.
Аргон иногда используется в качестве газа – вытеснителя в аэрозольных баллончиках для таких продуктов , как лак , полиуретан , и краски, и для вытеснения воздуха при подготовке контейнера для хранения после открытия.
С 2002 года американский Национальный архив хранит важные национальные документы , такие как Декларация независимости и Конституции в пределах заполненной аргоном случаев для ингибирования их деградации. Аргон предпочтительнее гелия , которые были использованы в предыдущих пяти лет, потому что газообразный гелий выходит через поры в межмолекулярных большинстве контейнеров и должны быть заменены на регулярной основе .
Лабораторное оборудование
 Перчаточные часто заполнены аргоном, который рециркулирует через скрубберы , чтобы поддерживать кислород -, азот – и влаги в атмосфере
Перчаточные часто заполнены аргоном, который рециркулирует через скрубберы , чтобы поддерживать кислород -, азот – и влаги в атмосфереАргон может быть использован в качестве инертного газа в пределах Шленки линий и перчаточных камер . Аргон предпочтительно менее дорогой азота в тех случаях , когда азот может вступать в реакцию с реагентами или аппаратом.
Аргон может быть использован в качестве газа – носителя в газовой хроматографии и в электрораспылении ионизационной масс – спектрометрии ; это газ выбора для плазмы , используемой в ПМС – спектроскопии . Аргон является предпочтительным для распыления покрытия образцов для сканирующей электронной микроскопии . Аргон газ также обычно используется для напыления тонких пленок , как в микроэлектронике и для очистки пластин в микрообработки .
Медицинское использование
Криохирургии процедуры , такие как криоаблация использования жидкого аргона , чтобы разрушить ткани , такие как раковые клетки. Он используется в процедуре под названием «аргон повышенной коагуляции», форма аргона плазменного пучка электрохирургии . Процедура несет в себе риск получения газа эмболии и привела к гибели по меньшей мере , одного пациента.
Синие лазеры аргона используются в хирургии , чтобы сварить артерии, разрушить опухоли и исправить дефекты глаз.
Аргон также экспериментально использован для замены азота в дыхательной смеси или декомпрессионной известной как Argox , чтобы ускорить устранение растворенного азота из крови.
Осветительные приборы

Лампы накаливания заполнены аргоном, чтобы сохранить нити при высокой температуре от окисления. Он используется для конкретного пути он ионизирует и излучает свет, например, в плазменных глобусы и калориметрии в экспериментальной физике элементарных частиц . Газоразрядные лампы , заполненные чистым аргоном обеспечивают сирень / фиолетовый свет; аргоном и некоторой ртути, синим светом. Аргон также используется для синих и зеленых аргонно-ионных лазеров .
Разные виды использования
Аргон используется для теплоизоляции в энергосберегающих окнах . Аргон также используется в техническом аквалангом надуть сухой костюм , потому что он вл етс инертным и имеет низкую теплопроводность.
Аргон используется в качестве пропеллента в развитии переменной удельного импульса Магнитоплазменные Rocket (VASIMR). Сжатый газ аргона это позволило расширить, чтобы охладить ищущую головку некоторых версий AIM-9 Sidewinder ракет и других ракет , которые используют охлаждаемые тепловую ищущую голову. Газ хранят при высоком давлении .
Аргон-39 с периодом полураспада 269 лет, был использован для ряда приложений, в первую очередь льда ядра и грунтовых вод знакомствам. Кроме того , калий-аргоновый знакомства и связанных с ними аргон-аргонового знакомства используется для даты осадочные , метаморфические и магматические породы .
Аргон был использован спортсменами качестве легирующего агента для имитации гипоксических условий. В 2014 году Всемирное антидопинговое агентство (WADA) добавляют аргон и ксенон в список запрещенных веществ и методов, хотя в настоящее время не существует надежного теста для злоупотреблений.
безопасности
Несмотря на то, аргон , не токсичен, он составляет 38% плотнее , чем воздух , и поэтому считается опасным удушающим в закрытых помещениях. Это трудно обнаружить , поскольку он бесцветен, не имеет запаха, вкуса и запаха. В 1994 году инцидента, в котором человек был асфиксии после ввода раздел заполненной аргоном нефтяной трубы в стадии строительства в Аляске , подчеркивает опасность утечки аргона в баллоне в ограниченном пространстве и подчеркивает необходимость правильного использования, хранения и обработки.
Смотрите также
Рекомендации
дальнейшее чтение
- Коричневый, TL; Bursten, BE; LeMay, HE (2006). J. Challice; Н. Folchetti, ред. Химия: Центральная Наука (10 -е изд.). Pearson Education . стр. 276 и 289. ISBN 978-0-13-109686-8 .
- Тройная температура точки: 83,8058 K – Престон-Томас, H. (1990). “Международный Температурный Масштаб 1990 (ITS-90)” . Метрология . 27 (1): 3-10. Bibcode : 1990Metro..27 …. 3P . DOI : 10,1088 / 0026-1394 / 27/1/002 .
- Тройной точечное давление: 69 кПа – Лиде, DR (2005). «Свойства элементов и неорганических соединений; плавления, кипения, тройные и критические температуры элементов». CRC Справочник по химии и физике (восемьдесят шестой ред.). CRC Press . § 4. ISBN 978-0-8493-0486-6 .
внешняя ссылка
Молярная масса любого вещества показывает отношение веса этой субстанции относительно количества молей. Иными словами, зная молярную массу можно знать, сколько будет весить один моль вещества. Каждый элемент и соединение нескольких элементов может отличаться по данному параметру. Эта характеристика необходима в тех случаях, когда нужно смешивать несколько веществ.

Аргон в таблице Менделеева
Аргон относится к одному из самых востребованных газов для современной сварки. Он выполняет защитную функцию, так как создает изоляционный слой для сварочной ванны. Когда используется сварочная проволока, то на ней зачастую не бывает обмазки. Чтобы кислород и другие элементы из атмосферы не влияли на сваривающийся металл, следует оградить их от всех негативных факторов. Свойства аргона обеспечивают лучшую защиту, на которую не способен ни один другой газ из этой области. Несмотря на относительно высокую стоимость, которой обладает материал, его применение оказывается вполне оправданным.
Молярная масса аргона составляет 40 грамм на 1 моль вещества. Это может пригодиться для вычисления количества закачки газа в пустой баллон. Ведь практически все емкости могут использоваться многократно. Чтобы узнать количество заправленного вещества, сначала взвешивают пустую емкость, а затем взвешивают ее уже после заполнения.
Область применения 
Применение аргона в сварочной сфере за последние годы существенно расширилось. В основном, его используют для сложных и ответственных работ. Если для стандартных процедур соединения с обыкновенными металлами подходят и другие, менее дорогостоящие газы, то для сложно свариваемых изделий необходим только аргон. С его помощью можно сваривать алюминий, нержавеющую сталь различных марок, никель и прочие цветные металлы.
В строительной сфере, где нужно получить соединение максимально высокого качества, аргонная сварка является основной. Свою популярность газ получил благодаря минимальному количеству брака, который получается во время сваривания. Тонкие трубопроводы, химическая и пищевая промышленность, машиностроение и прочие места, в которых находит применение сварка аргоном. В частной сфере используется все достаточно редко, так как себестоимость процесса оказывается довольно высокой и зачастую неоправданно. Если в быту возникает необходимость в применении аргона, то чаще всего люди обращаются за услугами специалистов.
Виды аргона 
Существует три основные разновидности этого вещества, которые можно найти на современном рынке. В основном они отличаются по чистоте. Среди них выделяют следующие разновидности:
- Высший сорт. В данной разновидности содержание чистого газа составляет 99,99%. Он пригоден для сварки металлов, обладающих высокой химической активностью, к примеру, титановых сплавов, нержавейки. Им сваривают несущие конструкции на стройках.
- Первый сорт от высшего по чистоте имеет небольшое отклонение на 0,01%. Газом 99,98% можно сваривать алюминиевые сплавы с различными металлами. Это распространенный вариант для промышленности. Им можно работать со многими цветными металлами.
- Второй сорт. Этот газ содержит 99,95% чистого аргона. Основная сфера применения – сварка жаропрочных сталей, алюминия и других металлов. Чистый аргон здесь редко применяется, так как это может привести к образованию пор. Чтобы этого не допустить, применяются дополнительные газы, такие как углекислый и кислород. Дополнительные элементы делают защиту более активной. В чистом виде аргон не дает полной защиты от влаги, включений и других загрязнений. Добавки вступают в реакции со всеми примесями и выжигают их или выталкивают на поверхность сварочной ванны.
Физические и химические свойства 
Физические свойства аргона определяют его как одноатомный газ. Температура кипения составляет -185,9 градусов Цельсия при нормальном давлении. Она выше, чем у азота, но ниже, чем у кислорода. В 100 мл воды может раствориться до 3,3 мл газа. Плотность аргона при нормальных условиях 1,78 кг/м3. Молярная теплоемкость аргона составляет 20,79 Дж/(К*моль).
На данный момент известно только два химических соединения, в которых участвует газ. Первым является CU(Ar)O, а вторым – гидрофторид аргона. Оба варианта существуют только при низких температурах. Помимо этого, аргон способен образовывать эксимерные молекулы. У них неустойчивы нормальные состояния и устойчивые возбуждение состояния. Ученые считают, что очень нестойкое соединение с этим элементом Hg – Ar, которое получается в результате электрического разряда, это и есть валентное соединение. Предполагается, что можно получить также валентные соединения с кислородом и фтором. Они также будут отличаться неустойчивостью.
Электроотрицательность составляет 4,3 пункта по шкале Полинга. Степень окисления равняется нулю, также, как и электродный потенциал. Радиус иона достигает 154 пм, а ковалентный радиус – 106 пм. Энергия ионизации – 1519 кДж/моль
Обозначение 
Формула аргона – Ar. В промышленности применяется аргон по ГОСТ 10157-79. Данный стандарт предназначается для жидкого и газообразного аргона, который получается из остаточных газов на аммиачных производствах и воздуха. Используется он в качестве защитной среды вовремя разки, сварки, плавке и прочих процедур с металлами. Стандарт выдвигает требования по изготовлению аргона для данной сферы. В итоге, полученное вещество должно соответствовать физико-химическим характеристикам, приведенным в самом ГОСТе.
Техника безопасности при работе с аргоном 
Как и любой другой газ, аргон может оказаться очень опасным для здоровья человека, если не применять соответствующие меры безопасности. Чтобы минимизировать вероятность появления несчастных случаев, следует придерживаться следующих пунктов:
- Во время работы с самим аргоном, следует применять шланговые противогазы или специальные изолирующие кислородные приборы, такие как баллоны;

Аргон в баллонах разной емкости
- Контакт с аргоном в жидком состоянии может привести к обморожению слизистых оболочек и кожи, так что для личной безопасности нужно применять спецодежду и защитные приспособления.
«Важно!
Во время работы с газом он может замещать кислород из атмосферы, что приводит к удушью, поэтому, нужно контролировать содержание кислорода дистанционными методами и не допускать его падение ниже 19%.»
Заключение
Несмотря на все преимущества использования газа, на практике он оказывается достаточно сложным в использовании. Основная проблема заключается в его вредности для здоровья человека. При постоянном контакте с ним возникают различные профессиональные болезни, которые проявляются более остро и активно, чем с другими газами. Таким образом, к проблемам безопасности связанными с хранением, добавляются еще и те, которые связаны с использованием.
Вторая сложность заключается в наличии соответствующей техники и умения работать. Ведь в каждом отдельном случае нужны свои навыки. Тем не менее, аргон остается наиболее востребованным веществом для обеспечения защиты во время соединения сложно свариваемых металлов и их сплавов.
Аргон и его характеристики
Общая характеристика аргона
Самый распространенный в природе элемент VIIIA-группы. Содержание аргона в воздухе 0,932% (об.), 1,28% (масс).
Представляет собой бесцветный газ. Плохо растворяется в воде (растворимость понижается в присутствии сильных электролитов), лучше — в органических растворителях. Образует клатрат состава 8Ar×46Н2О. Не реагирует со всеми другими веществами (простыми и сложными).
Атомная и молекулярная масса аргона
Поскольку в свободном состоянии аргон существует в виде одноатомных молекул Ar, значения его атомной и молекулярной масс совпадают. Они равны 39,948.
Изотопы аргона
Известно, что в природе аргон может находиться в виде трех стабильных изотопов 36Ar (0,337%), 38Ar (0,063%) и 40Ar (99,6%). Их массовые числа равны 36, 38 и 40 соответственно. Ядро атома изотопа аргона 36Ar содержит восемнадцать протонов и восемнадцать нейтронов, а изотопов 38Ar и 40Ar– такое же количество протонов, двадцать и двадцать два нейтронов/а соответственно.
Существуют искусственные изотопы аргона с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 39Ar с периодом полураспада равным 269 лет.
Ионы аргона
Как гелий и неон при сильном возбуждении атомов аргон образует молекулярные ионы типа Ar2+.
Молекула и атом аргона
В свободном состоянии аргон существует в виде одноатомных молекул Ar.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Аргон — Циклопедия
Аргон
Химический элемент
Инертный газ без цвета, вкуса и запаха| Символ, номер | Ar, 18 |
| Атомная масса | 39,948 а.е.м. |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Степени окисления | 0 |
| Плотность | 1,784·10−3 г/см³ |
| Температура плавления | -189,35 °C |
| Температура кипения | -185,85 °C |
| Структура кристаллической решетки | кубическая гранецентрированая |
Аргон — химический элемент главной подгруппы восьмой группы периодической системы Менделеева, один из инертных газов. Порядковый номер 18, атомный вес 39,944.
Аргон бесцветный, молекулы одноатомные; t° кип. — 185,83 °C, t° плав. —189,3 °C, критическая температура —122,4 °C; критическое давление — 48 атм. В природе аргон встречается только в свободном состоянии и составляет 0,933 % (по объему) воздуха, из которого впервые его выделили в 1894 году У. Рамзай и Дж. Рэлей. В промышленности аргон добывают фракционированием жидкого воздуха.
Впервые аргон обнаружили в 1894 году английские химики Джон Рэлей (1842—1919) и Уильям Рамзай после того, как весь кислород и водород были изъяты из емкости с воздухом.
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии), Рэлей и Рамзай дали новому газу имя «аргон» (от греч. Αργός — ленивый, медленный, неактивный). Это название подчеркивает важнейшее свойство элемента — его химическую неактивность.
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9 °C аргон конденсируется, при −189,4 °C — кристаллизуется.
Используется в газоразрядных трубках и аргоновых лазерах.
Аргон используют для наполнения ламп накаливания, электронных приборов и др. Как радиоактивный индикатор используют 37Ar, период полураспада которого 34 дня.
Также распространено использование аргона в качестве защитного слоя при сварке цветных металлов и нержавеющих сталей . Для этого используются как сам аргон, так и его смесь с углекислым (82 % Ar, 18 % CO2; 82 % Ar, 16 % CO2, 2 % O2) и другими газами.
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3
- Украинская советская энциклопедия. В 12-ти томах / Под ред. М. Желаемая. — 2-е изд. — К.: Гол. редакция УРЕ, 1974—1985.
Аргон, свойства атома, химические и физические свойства.
Ar 18 Аргон
39,948(1) 1s2 2s2 2p6 3s2 3p6
Аргон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Атом и молекула аргона. Формула аргона. Строение аргона
Изотопы и модификации аргона
Свойства аргона (таблица): температура, плотность, давление и пр.
Физические свойства аргона
Химические свойства аргона. Взаимодействие аргона. Реакции с аргоном
Получение аргона
Применение аргона
Таблица химических элементов Д.И. Менделеева
Атом и молекула аргона. Формула аргона. Строение аргона:
Аргон (лат. Argon, от др.-греч. ἀργός – «ленивый, медленный, неактивный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ar и атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Аргон самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы пниктогенов.
Аргон – химически инертный неметалл. Химически малоактивен.
Как простое вещество аргон (химическая формула Ar) при нормальных условиях представляет собой одноатомный газ без цвета, вкуса и запаха.
Молекула аргона одноатомна.
Химическая формула аргона Ar.
Электронная конфигурация атома аргона 1s2 2s2 2p6 3s2 3p6. Потенциал ионизации атома аргона равен 15,76 эВ (1519,6 кДж/моль).
Строение атома аргона. Атом аргона состоит из положительно заряженного ядра (+18), вокруг которого по трем атомным оболочкам движутся 18 электронов. При этом 10 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку аргон расположен в третьем периоде, оболочки всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. Внешний энергетический уровень атома аргона полностью завершен – 8 спаренных электронов. Поэтому аргон химически малоактивен. В свою очередь ядро атома аргона состоит из 18 протонов и 22 нейтронов. Аргон относится к элементам p-семейства.
Радиус атома аргона составляет 71 пм.
Атомная масса атома аргона составляет 39,948(1) а. е. м.
Аргон – третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,288 % по массе. Аргон – самый распространённый инертный газ в земной атмосфере.
Изотопы и модификации аргона:
Свойства аргона (таблица): температура, плотность, давление и пр.
| Общие сведения | |
| Название | Аргон/ Argon |
| Символ | Ar |
| Номер в таблице | 18 |
| Тип | Неметалл |
| Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Англия, 1894 г. |
| Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха. |
| Содержание в земной коре | 0,00015 % |
| Содержание в океане | 0,000045 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| Радиус атома | 71 пм |
| Химические свойства | |
| Степени окисления | 0 |
| Валентность | 0 |
| Ковалентный радиус | 106 пм |
| Радиус Ван-дер-Ваальса | |
| Радиус иона | 154 пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1519,6 кДж/моль (15,76 эВ) |
| Электродный потенциал | 0 |
| Физические свойства | |
| Плотность (при +20 °C и нормальных условиях, состояние вещества – газ) | 0,0017839 г/см3 |
| Плотность (при -185,7 °C и нормальных условиях, состояние вещества – жидкость) | 0,402 г/см3 |
| Плотность (при -233 °C и нормальных условиях, состояние вещества – твердое тело) | 1,65 г/см3 |
| Температура плавления | -189,35 °C (83,8 К) |
| Температура кипения | -185,85 °C (87,3 К) |
| Уд. теплота плавления | 7,05 кДж/моль |
| Уд. теплота испарения | 6,45 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 24,2 см³/моль |
| Критическая температура | -122,5 °C |
| Критическое давление | 4,86 МПа |
| Критическая плотность | 0,531 г/см3 |
| Давление паров | 1 мм.рт.ст. (при -219,5°C), 10 мм.рт.ст. (при -211,3°C), 100 мм.рт.ст. (при -200,1°C) |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 154,7 Дж/(моль·K) |
| Теплопроводность (при 300 K) | 0,0164 Вт/(м·К) |
| Диэлектрическая проницаемость | 1,000504 (при 25°C), 1,3247 (при -133,2°C) |
| Электропроводность в твердой фазе | |
| Сверхпроводимость при температуре | |
| Твёрдость | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 К |
Физические свойства аргона:
Химические свойства аргона. Взаимодействие аргона. Реакции с аргоном:
Получение аргона:
Применение аргона:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
аргон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле аргона
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 052
аргон – это… Что такое аргон?
АРГО́Н -а; м. [от греч. argon – недеятельный]. Химический элемент (Ar), инертный газ без цвета и запаха, входящий в состав воздуха (применяется для наполнения электрических ламп, в металлургии, химии и т.п.).
◁ Арго́новый, -ая, -ое. А-ые трубки реклам.
АРГО́Н (лат. Аrgon), Ar (читается «аргон»), химический элемент с атомным номером 18, атомная масса 39,948. Относится к группе инертных, или благородных (см. БЛАГОРОДНЫЕ ГАЗЫ), газов (восьмая группа периодической системы), замыкает третий период. Природный аргон состоит из трех стабильных нуклидов (см. НУКЛИД) : 36Ar (0,337%), 38Ar(0,063%) и 40Ar(99,600%).Радиус нейтрального атома аргона 0,192 нм. Электронная конфигурация нейтрального невозбужденного атома 1s22s2p63s2p6. Энергии последовательной ионизации нейтрального атома равны, соответственно, 15,759, 27,63, 40,91, 59,8 и 75 эВ. Простое вещество аргон — газ без запаха, цвета и вкуса.
История открытия
К открытию аргона привело обнаруженное в 1892 году английским физиком Дж. Рэлеем (см. РЭЛЕЙ Джон Уильям) небольшое (всего на 0,13%) превышение плотности азота, выделяемого из воздуха, над плотностью «химического» азота, возникающего при термическом разложении нитрита аммония NH4NO2.
Вместе с другим английским физиком У. Рамзаем (см. РАМЗАЙ Уильям) Дж. Рэлей в 1894 году выделил из воздуха примесь более тяжелого (по сравнению с азотом) газа, который отличался одноатомным составом молекул и практически полной химической недеятельностью (аргон не вступает ни в какие химические реакции). Именно из-за своей удивительной химической инертности новый газ и получил свое название (греч. аrgos — неактивный).
Аргон в природе
Аргон распространен в природе только в свободном виде. В земной коре его содержание составляет 1,2·10-4%, в морской воде — 0,45·10-4%. В атмосферном воздухе содержится 0,93% аргона по объему (9,34 л в 1м3). Это значительно больше, чем содержание в воздухе всех остальных инертных газов вместе взятых. Воздух служит неиссякаемым источником для получения аргона.
Обращает на себя внимание преобладание в смеси природных нуклидов аргона самого тяжелого — аргона-40. Это связано с тем, что 40Ar постоянно образуется за счет распада радиоактивного калия-40. В 1 т калия за год при радиоактивном распаде калия-40 путем захвата орбитального электрона (так называемый электронный захват (см. ЭЛЕКТРОННЫЙ ЗАХВАТ), или К-захват; на этот тип радиоактивного распада калия-40 приходится 12% от всех актов распада этого природного радионуклида) образуется всего около 3100 атомов аргона-40. Но калий — один из самых распространенных на Земле элементов, да и время, прошедшее за долгую историю Земли, исчисляется миллиардами лет. Поэтому 40Ar накопился в земной атмосфере в значительных количествах.
Преобладание тяжелого аргона-40 в природной смеси изотопов этого элемента приводит к тому, что атомная масса элемента аргона оказывается немного выше, чем следующего за ним в периодической системе элемента калия. Однако, когда Менделеев создавал свою знаменитую таблицу, проблема, как разместить калий и аргон, у него не возникала, так как аргон был открыт спустя почти 30 лет после открытия периодического закона, и в таблицу (в группу, которой тогда присвоили номер ноль) попал только в начале 20-го века. В настоящее время аргон, как и другие инертные газы, включают в восьмую группу периодической системы элементов.
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) –185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота), температура плавления –189,3°C. Критическая температура –122,43 °C, критическое давление 4,86 МПа. Плотность при нормальных условиях 1,7839 кг/м3.
В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Как уже говорилось, химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом (см. ФЕНОЛ), гидрохиноном (см. ГИДРОХИНОН) и другими), образует соединения включения (клатраты (см. КЛАТРАТЫ)), где атом аргона, как своего рода «гость», находится в полости, образованной в кристалической решетке молекулами вещества-хозяина.
Применение
Аргон широко используют для создания инертной и защитной атмосферы, прежде всего при термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка и другие). В атмосфере аргона получают кристаллы полупроводников и многие другие сверхчистые материалы. Аргоном часто заполняют электрические лампочки (для замедления испарения вольфрама (см. ВОЛЬФРАМ) со спирали).
При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение, что широко используется, например, в светящейся рекламе. В геохронологии (см. ГЕОХРОНОЛОГИЯ) по оределению соотношения изотопов 40Ar/40К устанавливают возраст минераллов.
Молекулярный вес аргона
Молярная масса Ar = 39,948 г / моль
Конвертировать граммы аргона в родинки или родинки аргона в граммы
| Элемент | Символ | Атомная масса | # атомов | Массовый процент |
| аргон | Ar | 39,948 | 1 | 100.000% |
В химии формула веса – это величина, вычисленная умножением атомного веса (в атомных единицах массы) каждого элемента в химической формуле на число атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов.
Веса формулы особенно полезны при определении относительных весов реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют уравнительными весами.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и рассчитать молекулярный вес вещества.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная масса формулы представляет собой молекулярную массу.Массовый процент любого атома или группы атомов в соединении может быть вычислен путем деления общего веса атома (или группы атомов) в формуле на вес формулы и умножения на 100.
Нахождение молярной массы начинается с единиц грамма на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моле этого вещества. Вес формулы – это просто вес в атомных единицах массы всех атомов в данной формуле.
Используемые на этом сайте атомные веса получены из NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Это как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая является массой одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Распространенный запрос на этом сайте – конвертировать граммы в родинки. Чтобы завершить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что молярная масса вещества влияет на конверсию. Этот сайт объясняет, как найти молярную массу.
,Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
Аргон (Ar) , химический элемент, инертный газ группы 18 (благородные газы) периодической таблицы, наиболее широко распространенный и наиболее широко используемый в промышленности из благородных газов. Бесцветный, без запаха и вкуса газообразный аргон был выделен (1894 г.) из воздуха британскими учеными лордом Рэлеем и сэром Уильямом Рамсей. Генри Кавендиш, исследуя атмосферный азот («флогизированный воздух»), в 1785 году пришел к выводу, что не более чем 1 / 120 часть азота может являться инертной составляющей.Его работы были забыты до тех пор, пока лорд Рэли, более века спустя, не обнаружил, что азот, получаемый путем удаления кислорода из воздуха, всегда примерно на 0,5% плотнее, чем азот, полученный из химических источников, таких как аммиак. Более тяжелый газ, оставшийся после удаления кислорода и азота из воздуха, был первым из благородных газов, обнаруженных на Земле, и был назван в честь греческого слова argos , «ленивый», из-за его химической инертности. (Гелий был спектроскопически обнаружен на Солнце в 1868 году.)
Encyclopædia Britannica, Inc.Британика Викторина
118 Символы и названия периодической таблицы викторины
Xe
В космическом изобилии аргон занимает приблизительно 12 место среди химических элементов. Аргон составляет 1,288 процента атмосферы по массе и 0.934 процентов по объему и обнаруживается в породах. Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти все следы этого элемента во вселенной, третий стабильный изотоп, аргон-40, составляет 99,60 процента аргона, найденного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента от аргона Земли соответственно.) Большая часть земного аргона была произведена, начиная с образования Земли, в калийсодержащих минералах в результате распада редкого, естественно радиоактивного изотопа. калий-40.Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 из распада калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Аргон в больших масштабах выделяют фракционной перегонкой жидкого воздуха. Он используется в газовых электрических лампочках, радиолампах и счетчиках Гейгера. Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Газообразный аргон конденсируется в бесцветную жидкость при -185,8 ° C (-302,4 ° F) и в кристаллическое твердое вещество при -189,4 ° C (-308,9 ° F). Газ не может быть сжижен давлением выше температуры -122,3 ° C (-188,1 ° F), и в этот момент для его разжижения требуется давление не менее 48 атмосфер. При 12 ° C (53,6 ° F) 3,94 объема газа аргона растворяются в 100 объемах воды. Электрический разряд через аргон при низком давлении кажется бледно-красным, а при высоком давлении – твердо-синим.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской.Подпишитесь сегодняВнешняя (валентная) оболочка аргона имеет восемь электронов, что делает ее чрезвычайно стабильной и, следовательно, химически инертной. Атомы аргона не соединяются друг с другом; и при этом они, как наблюдали, химически не соединяются с атомами любого другого элемента. Атомы аргона были захвачены механически в клетчатых полостях среди молекул других веществ, как в кристаллах льда или органического соединения гидрохинона (так называемые клатраты аргона).
| атомный номер | 18 |
|---|---|
| атомный вес | 39.948 |
| температура плавления | −189,2 ° C (-308,6 ° F) |
| точка кипения | −185,7 ° C (-302,3 ° F) |
| плотность (1 атм, 0 ° C) | 1.784 г / литр |
| степень окисления | 0 |
| электронная конфигурация. | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 6 |
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра


