Где применяют медь и серебро: Сплав серебра и меди: виды и применение
alexxlab | 10.05.1990 | 0 | Разное
Медь. Серебро. Золото | АЛХИМИК
Автор Jeremiah На чтение 11 мин Просмотров 1.1к. Опубликовано
Медь, серебро и золото – эти металлы были в числе первых, освоенных человеком. Из них чеканили монеты, изготовляли предметы домашнего обихода, орудия труда и украшения.
Со временем серебро и особенно золото стали универсальным мерилом материальных ценностей. Получение золота из других металлов составляло предмет алхимии – ярчайшей страницы в истории человеческой мысли, давшей начало современной химии. С тех пор жизнь людей почти до неузнаваемости изменилась, а золото по-прежнему является символом богатства и эталоном ценности…
Содержание
МедьМедьЛатинское наименование меди – Cuprum – происходит от названия острова Кипр, где уже в III в до н.э. существовали медные рудники. Русское «медь», вероятно, восходит к слову «смида», обозначавшему металл у древних германцев.
Хоть медь иногда встречается в природе в виде самородков (самый большой из найденных весил 420 т), основная её часть входит в состав сульфидных руд, например халькопирита CuFeS2. Реже встречается минерал малахит – зеленый основной карбонат меди (CuOH)2CO3.
В первых металлургических процессах использовались не сульфидные руды, а именно малахит, не требующий предварительного обжига. Восстановительную плавку проводили в глиняных сосудах, заполненных рудой и углем и помещенных в небольшую яму. Оксид углерода (II), образуется при неполном сгорании угля, восстанавливая малахитовую руду:
2CO + (CuOH)2CO3 → 3CO2 + 2Cu + H2O.
Развивающаяся при этом температура (1100 – 1200оС) позволяет получить расплавленную медь (tпл = 1083оС).
Медь весьма мягкий металл, поэтому начиная с III тысячелетия до н.э. на смену медным изделиям стали приходить бронзовые – более твёрдые и прочные. Скорее всего, бронзу (сплав меди с оловом) впервые получили случайно, при обработке руды, содержащей оба металла. На протяжении двух тысяч лет (до начала I тысячелетия до н.э.) бронза являлась основным материалом для производства орудий труда. Археологи называют эту эпоху бронзовым веком.
Скорее всего, бронзу (сплав меди с оловом) впервые получили случайно, при обработке руды, содержащей оба металла. На протяжении двух тысяч лет (до начала I тысячелетия до н.э.) бронза являлась основным материалом для производства орудий труда. Археологи называют эту эпоху бронзовым веком.
Чистая медь очень хорошо проводит электрический ток, уступая в этом лишь серебру, поэтому из нее делают провода. Сплав меди с никелем – константан (60% Cu,40% Ni), напротив, отличается высоким сопротивлением – он служит основой реостатов. Бронзы (90% Cu, 10% Sn) и латуни (20 – 80% Cu, остальное Zn) твёрже меди, стойки к окислению, обладают малым коэффициентом трения. Они используются в химическом машиностроении и для изготовления подшипников, шестерен, редукторов. Нейзильбер — сплав состава 50% Cu, 25% Zn, 25% Ni – применяется в производстве медицинского оборудования и в ювелирном деле. Медно-никелевый сплав мельхиор (80% Cu, 20% Ni) идет на изготовление медицинских инструментов, монет, посуды.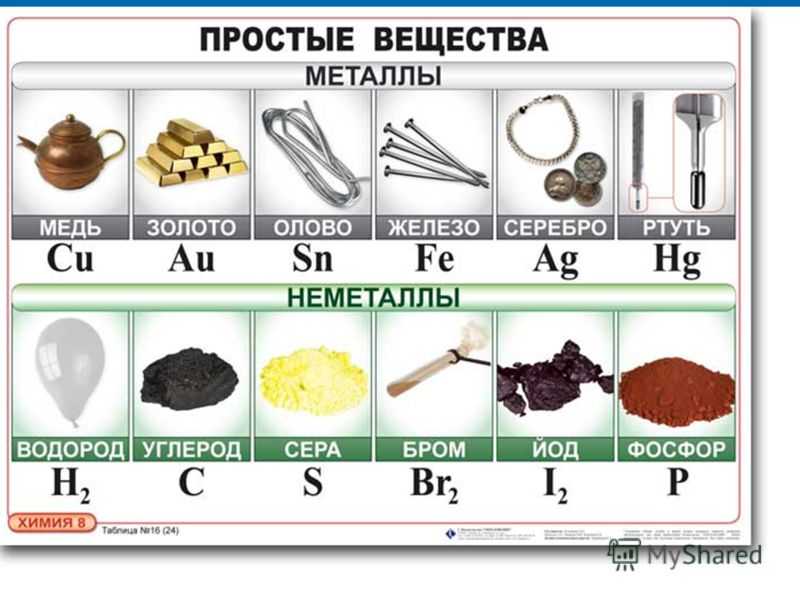
Медь применяют в гальванопластике – получении точных металлических копий различных предметов путем электролитического осаждения металла на поверхности гипсовой формы.
Ежегодно в мире выплавляют приблизительно 10 млн тонн меди, и потребность в этом металле постоянно возрастает.
В отличие от своих соседей по подгруппе – серебра и золота,- медь непосредственно реагирует с кислородом. При нагревании на воздухе изделия чернеют, покрываясь слоем оксида меди (II) CuO. А при температуре свыше 1000оС образуется другой оксид – Cu2O.
Находясь долгое время на воздухе, медь покрывается плёнкой малахита, образующегося по реакции 2Cu + O2 + H2O + CO2 = (CuOH)2CO3. Именно этому веществу обязаны своим цветом бронзовые памятники и старые крыши городов Западной Европы.
В ряду напряжений медь стоит правее водорода, поэтому реагирует только с кислотами-окислителями: азотной, концентрированной серной. Исключение составляет йодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I) H[CuI2].
Исключение составляет йодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I) H[CuI2].
Пожалуй, самое известное соединение меди – медный купорос, или пятиводный сульфат меди (II), CuSO4∙5H2O. В древности это вещество получали при кристаллизации растворов, образующихся в медных рудниках во время дождя. Медный купорос применяли для чернения кожи, в медицине, производстве окрашенных стекол. В наше время медный купорос используется в сельском хозяйстве для борьбы с вредителями растений, вытеснив значительно более ядовитую соль 3Cu(AsO2)2∙Cu(CH3COO)2 – швейнфуртскую зелень.
Медь играет важную роль в процессах жизнедеятельности организмов – она входит в состав некоторых ферментов, участвующих в реакциях окисления органических соединений. Медьсодержащий фермент цитохромоксидаза катализирует процессы тканевого дыхания. Белки, в состав которых входит медь, оказывают влияние на углеводный обмен, синтез жиров, образование витаминов Р и В. Ежедневная потребность меди для человека составляет около 2 -3 мг. Особенно богаты этим элементом молоко и дрожжи. Однако в больших количествах соединения меди вредны: приём внутрь 2 г медного купороса может привести к смерти.
Ежедневная потребность меди для человека составляет около 2 -3 мг. Особенно богаты этим элементом молоко и дрожжи. Однако в больших количествах соединения меди вредны: приём внутрь 2 г медного купороса может привести к смерти.
Латинское название серебра – Argentum – связано с цветом этого металла; оно восходит к греческому «аргос» — «белый», «блестящий». Русское слово «серебро», как считают учёные, происходит от слова «серп» (серп луны). Блеск серебра напоминает таинственное лунное сияние и алхимикам, использовавшим в качестве символа элемента знак луны.
Древнейшие серебряные изделия, обнаруженные в Передней Азии, датируются V тысячелетием до н.э. Они изготовлены из самородного серебра. Часто такие самородки окрашены в светло-желтый цвет, так как представляют собой не чистое серебро, а сплав с золотом (греки называли его «электрон»). Находки серебряных самородков чрезвычайно редки, поэтому неудивительно, что вплоть до конца I тысячелетия до н. э. серебро стоило дороже остальных металлов, даже золота. Ситуация изменилась лишь после того, как примерно в VI в. до н.э. древние умельцы освоили процесс выделения серебра из свинцовых руд.
э. серебро стоило дороже остальных металлов, даже золота. Ситуация изменилась лишь после того, как примерно в VI в. до н.э. древние умельцы освоили процесс выделения серебра из свинцовых руд.
Некоторые свинцовые сульфидные руды, например галенит PbS, содержат значительные примеси сульфида серебра Ag2S. При обжиге такой руды на воздухе PbS переходит в оксид Pb3O4, а серебро выделяется в свободном виде:
Ag2S + O2 = 2Ag + SO2↑.
В наши дни основную массу серебра также получают при переработке свинцово-цинковых и медных руд. Часто такая руда содержит всего 0,15 – 0,25% Ag. Выплавленный из свинцово-цинковой руды жидкий металл разделяется на два слоя: в нижнем содержится свинец, а в верхнем – цинк с примесью серебра. При нагревании этого слоя летучий цинк отгоняется в виде паров, а серебро остается.
Серебро – блестящий, серебристо-белый металл (tпл = 962оС), ковкий и пластичный, легко поддающийся обработке, лучший среди металлов проводник тепла и электричества. В старину из него изготовляли монеты, вазы, кубки, ювелирные изделия, тончайшими серебряными пластинами украшали ларцы и одеяния. На Руси из серебра делали церковные сосуды, оклады икон. В настоящее время применение серебра не ограничивается ювелирным делом – оно идет на производство зеркал, электрических контактов, аккумуляторов, используется в стоматологии.
В старину из него изготовляли монеты, вазы, кубки, ювелирные изделия, тончайшими серебряными пластинами украшали ларцы и одеяния. На Руси из серебра делали церковные сосуды, оклады икон. В настоящее время применение серебра не ограничивается ювелирным делом – оно идет на производство зеркал, электрических контактов, аккумуляторов, используется в стоматологии.
Серебро не окисляется кислородом, однако, по словам Плиния Старшего, «тускнеет от лечебных вод и от солёных ветров», покрываясь чёрным слоем сульфида серебра:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
В ряду напряжений серебро стоит правее водорода, поэтому оно взаимодействует лишь с кислотами-окислителями, легче всего – с азотной кислотой:
Ag + 2HNO3(конц) = AgNO3 + NO2↑ + H2O
Нитрат серебра (ляпис) прекрасно растворим в воде и является исходным веществом для получения других соединений серебра. При 209оС он плавится, а при нагревании до 300оС разлагается, образуя серебро: 2AgNO3 = 2Ag + 2NO2↑ + O2↑. Ляпис оказывает на кожу прижигающее и вяжущее действие, его используют в медицине в виде ляписных карандашей.
Ляпис оказывает на кожу прижигающее и вяжущее действие, его используют в медицине в виде ляписных карандашей.
Гидроксид серебра AgOH является сильным основанием, однако, он настолько неустойчив, что при действии на раствор AgNO3 щёлочи выпадает не AgOH, а бурый осадок оксида Ag2O. Бесцветный раствор, образующийся при взаимодействии Ag2O с раствором аммиака: Ag2O + 2NH3 + H2O = 2[Ag(NH3)2]OH, уже в XVII в. использовали для серебрения зеркал.
В 1727 г. немецкий учёный И.Г.Шульце обнаружил, что некоторые соли серебра, например хлорид AgCl, на свету разлагаются с образованием металла. Еще легче этому подвержены AgI и AgBr – они входили в состав эмульсии чёрно-белой фотопленки.
Замечено, что болезнетворные бактерии в воде погибают уже при содержании в ней серебра 10-9 г/л – такая концентрация ионов Ag+ создаётся при внесении в воду серебряных предметов.
ЗолотоЗолотой самородокЕще в глубокой древности золотистый цвет металла ассоциировался в сознании людей с цветом солнца. Так, по одной из версий, русское название металла происходит от слова «солнце». Латинское название элемента (Aurum) в переводе означает «жёлтый».
Так, по одной из версий, русское название металла происходит от слова «солнце». Латинское название элемента (Aurum) в переводе означает «жёлтый».
Золото, не изменяющееся при хранении на воздухе, не поддающееся ржавлению, являлось символом вечности. Алхимики называли его царем металлов, совершеннейшим из всех веществ. Превращение неблагородным металлов в золото было заманчивой мечтой многих средневековых ученых. Интересно, что сегодня это превращение стало возможным с помощью ядерных реакций, однако искусственное золото оказывается намного дороже природного. Образец такого золота, полученный при облучении нейтронами изотопа ртути 196Hg, хранится в Чикаго в Музее науки и промышленности. Алхимики удивились бы еще сильней, узнай они, что само золото в ядерных реакциях служит сырьем для получения изотопов франция и астата – элементов, которых практически нет в природе.
Золото представляет собой золотисто-желтый металл (tпл = 1064оС), настолько мягкий и пластичный, что легко раскатывается в тончайшую фольгу, которую можно растереть в порошок. «Золото через свой изрядно жёлтый цвет и блещущую светлость от прочих металлов отлично», — писал о нем М.В.Ломоносов.
«Золото через свой изрядно жёлтый цвет и блещущую светлость от прочих металлов отлично», — писал о нем М.В.Ломоносов.
В природе золото встречается в виде мелких зёрен, перемешанных с песком или гравием – продуктами разрушения золотоносных пород. Правда, иногда находят и крупные самородки – массой несколько десятков килограммов.
Древние египтяне выделяли золото из золотоносных жил, пронизывающих кварцевые породы. Многократно раскаляя скалу в огне и обливая ее холодной водой, люди дробили камень, затем толкли его в ступах, мололи и лишь после этого промывали водой, раскладывая на наклонной плоскости. Отмытое золото сплавляли в слитки. Во времена Древнего Рима главным поставщиком золота была Испания, где его вымывали из земли, извлекаемой из рудников.
Золотая маска ТутанхамонаДобычу золота в Средние века подробно описал немецкий ученый Георг Агрикола. Золотоносную руду перемалывали в муку и перемешивали в специальных бочках, на дне которых находилась ртуть. Ртуть смачивала и частично растворяла золото с образованием амальгамы. Её отделяли от остальной породы и разлагали нагреванием. Ртуть при этом улетучивалась, а золото оставалось в перегонном аппарате.
Её отделяли от остальной породы и разлагали нагреванием. Ртуть при этом улетучивалась, а золото оставалось в перегонном аппарате.
С XIX в. для извдечения драгоценного металла стали применять цианистый метод: на воздухе золото взаимодействует с раствором цианида натрия, образуя комплексную соль – дицианоаурат (I) натрия:
4Au + 8NaCN + 2H2O + O2 = 4Na[Au(CN)2] + 4NaOH,
а при обработке такого раствора цинком выделяется в свободном виде:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au↓.
Сегодня золотоносными считаются породы с содержанием золота более 0,0001%. Ученые установили, что некоторые микроорганизмы способны поглощать золото. На этом открытии основан перспективный биохимический метод извлечения золота из отвальных пород.
Около половины производимого в мире золота используется в ювелирном деле. Ювелиры никогда не работают с чистым металлом, ведь он настолько мягок, что легко царапается и деформируется. Золото, содержащее примеси других металлов – меди, серебра, железа, — часто имеет тот или иной цветовой оттенок: от жёлтого и красновато-коричневого до розоватого или даже зеленоватого.
Золото, содержащее примеси других металлов – меди, серебра, железа, — часто имеет тот или иной цветовой оттенок: от жёлтого и красновато-коричневого до розоватого или даже зеленоватого.
Благодаря высокой электропроводности и химической инертности золото активно используется в современной технике: тонким слоем этого металла покрывают контакты, электронагреватели, корпусы часов. На изготовление американского космического корабля «Колумбия» было израсходовано около 40 кг золота.
Еще одна область применения этого металла – медицина. В конце XIX в. немецкий микробиолог Роберт Кох обнаружил, что тетрацианоаурат (III) калия K[Au(CN)4] прекращает рост туберкулезных бактерий, а с 20-х гг. XX в. препараты золота, например санокризин Na3[Au(S2O3)2]∙2H2O, стали применять для лечения туберкулёза, артрита, а также в качестве противоспалительного средства.
Золото необычайно устойчиво к действию большинства окислителей: оно не реагирует с кислородом и не вытесняет водород из кислот. Однако говорить о полной инертности золота неверно: о его способности взаимодействовать с царской водкой знали уже алхимики. Наиболее традиционным методом окисления золота является обработка золотой фольги хлором в среде концентрированной соляной кислоты: 2Au + 3Cl2 + 2HCl = 2H[AuCl4]. Из образующейся при этом золотохлороводородной кислоты получают другие соединения золота. Все они легко могут быть восстановлены до металла.
Однако говорить о полной инертности золота неверно: о его способности взаимодействовать с царской водкой знали уже алхимики. Наиболее традиционным методом окисления золота является обработка золотой фольги хлором в среде концентрированной соляной кислоты: 2Au + 3Cl2 + 2HCl = 2H[AuCl4]. Из образующейся при этом золотохлороводородной кислоты получают другие соединения золота. Все они легко могут быть восстановлены до металла.
Скачать:
Скачать бесплатно реферат на тему: «Медь» [download id=»1549″]
Скачать бесплатно реферат на тему: «Золото» [download id=»1418″]
Скачать бесплатно реферат на тему: «Золото и его переработка» [download id=»1415″]
Скачать бесплатно реферат на тему: «Серебро» [download id=»1741″]
Скачать рефераты по другим темам можно здесь
Серебряный ватерблок литьем
Эта работа была прислана на наш “бессрочный” конкурс статей и автор получил награду – фирменную футболку сайта и материнскую плату Soltek SL-865Pro-775.
Данный материал может послужить кратким пособием по литью металлов для ватерблока, при этом какие-либо архитектурные особенности конструкции рассматриваться не будут. Я считаю, что каждый сам для себя решит, какая конструкция ватерблока ему необходима: канал, ребра, иглы или комбинация всего этого. Поэтому расскажу только о способе получения заготовок для ватерблока из меди и серебра. Также хочу обратить внимание на незначительные расхождения в разных справочниках: некоторые данные о свойствах металлов могут не совпадать.
Какие металлы используются чаще для изготовления радиаторов и теплообменников? Обычно это алюминий и медь, в редких случаях применяют серебро. Какими свойствами обладают эти металлы?
Алюминий. Серебристо-белый металл, удельный вес которого составляет 2.7 г/см3. Температура плавления алюминия составляет 658 градусов Цельсия. Теплопроводность 205 Вт/м*С, теплоемкость 920 Дж/кг*С. В системах охлаждения этот металл используется, несмотря на низкую теплопроводность, довольно часто.
Медь. Тягучий, вязкий металл светло-розового цвета, удельный вес которого составляет 8.9 г/см3. Температура плавления 1083 градуса Цельсия, теплопроводность 390 Вт/м*С, теплоемкость 400 Дж/кг*С. Медь наиболее распространена в эффективных системах охлаждения, поэтому остановимся на ней подробнее. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка окислов, придающая меди более темный цвет, хорошо защищает ее от дальнейшего окисления. В присутствии влаги и углекислого газа поверхность меди покрывается зеленым налетом карбоната меди. При нагревании на воздухе медь превращается в черную окись меди, которая при более высокой температуре разлагается, теряя кислород и переходя в закись меди. Химически чистая медь – явление довольно редкое и дорогое:
Это чистая бескислородная медь для изготовления сплавов драгметаллов. Ее стоимость составляет порядка 15-20 долларов за килограмм. Но чаще мы имеем дело с технически чистой медью: например, трубы для кондиционеров и водопроводов, высоковольтные шины делают из меди марки М1. Теплопроводность такой меди составляет 305–339 Вт/м*С, смотри
здесь
. Это тоже весьма неплохой показатель.
Ее стоимость составляет порядка 15-20 долларов за килограмм. Но чаще мы имеем дело с технически чистой медью: например, трубы для кондиционеров и водопроводов, высоковольтные шины делают из меди марки М1. Теплопроводность такой меди составляет 305–339 Вт/м*С, смотри
здесь
. Это тоже весьма неплохой показатель.
рекомендации
Серебро. Мягкий, тягучий металл удельного веса 10.5 г/см3, плавящийся при температуре 960 градусов Цельсия. Обладает самой большой теплопроводностью среди металлов – 420 Вт/м*С. Удельная теплоемкость серебра составляет 250 Дж/кг*С. Химически малоактивно, не окисляется на воздухе ни при обычной температуре, ни при нагревании. Это вызвано тем, что окись серебра – неустойчивое соединение, которое при нагревании разлагается. Бывает, что на серебряных предметах появляется темный налет – это сульфид серебра, образующийся под влиянием содержащегося в воздухе сероводорода или при контакте с веществами, содержащими сернистые соединения. Серебро гораздо дороже меди.
Чистое серебро (проба 999.9) бывает в виде мерных слитков:
И в австралийских монетах (проба 999):
Теперь, выяснив свойства металлов, можно приступать к изготовлению ватерблока.
Хорошо, если есть цельный кусок меди, из которого можно сделать ватерблок, а если такого куска нет? Я столкнулся с этой проблемой, когда решил сделать себе водяное охлаждение. Значит, сначала надо получить кусок меди. Как можно изготовить большой кусок меди из маленьких кусочков? Только литьем! Ну, а если отливать, то можно попробовать и серебро, а также сплавы меди и серебра.
Большинство серебряных изделий, например ювелирных, делается не из чистого серебра, а из сплавов серебро-медь. Такие сплавы обладают повышенной механической прочностью, чем и объясняется их широкое применение. В актуальности применения таких сплавов в ватерблоках я не уверен: они уступают по теплопроводности чистому серебру, а стоят примерно столько же. Единственный, на мой взгляд, заслуживающий внимания сплав состоит из 72% серебра и 28% меди. Объясню почему: этот сплав обладает самой низкой (779 градусов Цельсия) температурой плавления среди сплавов серебро-медь, поэтому с ним работать легче, чем, скажем, с медью. Теплопроводность у этого так называемого кусила меньше, чем у чистого серебра, и составляет 371 Вт/м*С, по данным
производителя
.
Единственный, на мой взгляд, заслуживающий внимания сплав состоит из 72% серебра и 28% меди. Объясню почему: этот сплав обладает самой низкой (779 градусов Цельсия) температурой плавления среди сплавов серебро-медь, поэтому с ним работать легче, чем, скажем, с медью. Теплопроводность у этого так называемого кусила меньше, чем у чистого серебра, и составляет 371 Вт/м*С, по данным
производителя
.
Где чаще всего мы встречаем литые изделия? В ювелирном магазине: большая часть ювелирных изделий изготавливается литьем из сплавов серебра, золота, платины. В современном ювелирном деле используется литье по выплавляемым моделям. При этом сложность будущего изделия ограничена только фантазией ювелира:
О процессе литья по выплавляемым моделям можно почитать
здесь
. Довольно сложно, но такой способ позволил бы получить отливку, требующую минимальной обработки, то есть практически готовое основание ватерблока с рельефом любой сложности. Но есть способ получения отливок гораздо более простой, чем литье по выплавляемым моделям. Это литье в кокиль.
Это литье в кокиль.
Кокиль – это многоразовая металлическая литейная форма, позволяющая получать отливки простейшей формы. Вот пример ватерблока, основание которого получено литьем в кокиль:
Это процессорный ватерблок. Материал основания – серебро, крышка вырезана из листовой меди толщиной 3 мм, штуцеры сделаны из медной трубки с внешним диаметром 10 мм. Конструкция полностью паяная, все медные детали луженые. Следующим я решил сделать ватерблок на чипсет материнской платы. Теперь о том, как я его делал.
Самый главный вопрос: чем расплавить металл? Можно воспользоваться горелкой для пайки твердыми припоями:
Но такие горелки подходят для плавки очень небольшого количества металла – около 30 грамм. Можно, конечно, попробовать ацетиленовую горелку, но газосварочный аппарат явно не впишется в интерьер квартиры. А чем плавят большое количество металла ювелиры? Вот этим:
Это плавильная электропечь с максимальной температурой нагрева 1200 градусов Цельсия. Работает она от обычной розетки на 220 В и имеет максимальное потребление мощности 1300 Вт (хороший электрочайник кушает больше). Печь удобней в использовании, чем горелка, потому что она позволяет не только расплавить металл, но и нагреть расплав до точно заданной температуры: в печи есть термопара и цифровой контроллер, который регулирует нагрев согласно заданной программе. Таким образом, процесс плавки выглядит довольно просто: задается температура нагрева, скорость нагрева, время выдержки заданной температуры. Естественно, печь позволяет делать любые сплавы серебра и меди. Для этого необходимо отмерить нужные количества чистых металлов и сплавить их вот с таким флюсом:
Работает она от обычной розетки на 220 В и имеет максимальное потребление мощности 1300 Вт (хороший электрочайник кушает больше). Печь удобней в использовании, чем горелка, потому что она позволяет не только расплавить металл, но и нагреть расплав до точно заданной температуры: в печи есть термопара и цифровой контроллер, который регулирует нагрев согласно заданной программе. Таким образом, процесс плавки выглядит довольно просто: задается температура нагрева, скорость нагрева, время выдержки заданной температуры. Естественно, печь позволяет делать любые сплавы серебра и меди. Для этого необходимо отмерить нужные количества чистых металлов и сплавить их вот с таким флюсом:
Это флюс на основе буры, применяется также при пайке твердыми припоями. Он необходим при плавке меди. Чистое серебро, благодаря его свойствам, можно плавить без флюса.
Теперь займемся кокилем. Со времен создания процессорного ватерблока у меня остался вот такой небольшой кусочек серебра:
Этот кусок получен переплавкой опилок серебра в печи.
Раструб на рамке – это прибыль, она ограничивает расположение усадочных раковин этой областью. Усадочные раковины – это пустоты, образующиеся внутри или на поверхности отливки вследствие уменьшения объема металла при затвердевании. Для чистого серебра усадка составляет 5%, а для чистой меди – 4.25%.
Затем рамка ставится между двух кусков профиля, и вся конструкция стягивается струбциной:
Толщина железа в этом профиле составляет 2 мм, соответственно, габариты отливки будут ограничены внутренними размерами рамки: 36 x 5 мм и высотой около 50 мм с учетом прибыли. Всё, кокиль готов. Можно приступать к плавке. Серебро загружается в тигель печи, температура нагрева устанавливается в 1150 градусов, процесс плавки начался:
Всё, кокиль готов. Можно приступать к плавке. Серебро загружается в тигель печи, температура нагрева устанавливается в 1150 градусов, процесс плавки начался:
Пока печь набирает температуру, кокиль подогревается на газовой плите:
Делается это для того, чтобы расплавленный металл при заливке в форму не подвергался внезапному охлаждению. Также обратите внимание на весьма значительный перегрев металла, который составляет 1150–960=190 градусов. Причина такого перегрева – маленькая теплоемкость серебра: из-за небольшой теплоемкости серебро очень быстро застывает при заливке в металлическую форму.
Примерно через 15 минут печь достигла заданной температуры, серебро расплавилось:
Пора заливать. Кокиль устанавливается на большой кусок железного профиля:
Программа нагрева отключается, металл заливается в форму:
Серебро застывает в считанные секунды – мне не удалось сфотографировать расплавленный металл в форме. На снимке видно, что форма не залита полностью. Возможно, в отливке будут дефекты. Теперь необходимо охладить кокиль. Для этого он опускается в ведро с холодной водой, через некоторое время вынимается оттуда и разбирается:
На снимке видно, что форма не залита полностью. Возможно, в отливке будут дефекты. Теперь необходимо охладить кокиль. Для этого он опускается в ведро с холодной водой, через некоторое время вынимается оттуда и разбирается:
Да, действительно, отливка имеет небольшие дефекты: видны пузыри в поверхностном слое металла. Но это не страшно, главное, что нет значительных дефектов, а поверхностный слой можно сточить. Прибыль отпиливается и, после обработки напильником, получается вот такой небольшой серебряный слиток:
Слиток имеет размеры 41 x 32 x 4.5 мм. Что можно из него сделать? Я решил особо не мудрить, ведь нужен ватерблок на чипсет. Вырезал из 3 мм меди рамку и крышку:
После этого медные части лудились, и вся конструкция, собранная в бутерброд, паялась. Теперь у меня уже два серебряных ватерблока, на процессор и на чипсет:
Литье металлов открывает весьма заманчивые перспективы. Реально доступным становится изготовление ватерблоков из серебра и его сплавов. Возможности кокилей не ограничены только отливкой слитка: возможно изготовление кокилей с М-образным выступом на одной из его стенок. Отливка, сделанная в такой кокиль, будет иметь М-образный канал. Или, например, можно сделать кокиль, в одной из стенок которого будет углубление 20 x 20 x 5 мм. В этом случае отливка будет иметь выступ, который можно будет превратить в ребра или иглы.
Реально доступным становится изготовление ватерблоков из серебра и его сплавов. Возможности кокилей не ограничены только отливкой слитка: возможно изготовление кокилей с М-образным выступом на одной из его стенок. Отливка, сделанная в такой кокиль, будет иметь М-образный канал. Или, например, можно сделать кокиль, в одной из стенок которого будет углубление 20 x 20 x 5 мм. В этом случае отливка будет иметь выступ, который можно будет превратить в ребра или иглы.
Да, есть еще над чем работать.
AG-cool
Подпишитесь на наш канал в Яндекс.Дзен или telegram-канал @overclockers_news – это удобные способы следить за новыми материалами на сайте. С картинками, расширенными описаниями и без рекламы.
11.Медь получение и свойства
Медь Элементы
подгруппы меди. Общая характеристика
простых веществ. Медь, серебро и золото.
Нахождение в природе. Физические и
химические свойства. Получение. Подгруппа
меди — химические элементы побочной
подгруппы I группы. В группу входят
переходные металлы, из которых традиционно
изготавливают монеты:медь Cu, серебро
Ag и золото Au.
В группу входят
переходные металлы, из которых традиционно
изготавливают монеты:медь Cu, серебро
Ag и золото Au.
Все элементы подгруппы являются относительно химически инертными металлами. Характерны также высокие значения плотности, но оносительно небольшиетемператур плавления и кипения, высокая тепло- и электропроводность. Особенностью элементов подгруппы является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами. Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4.
Медь — золотисто-розовый пластичный металл,
на воздухе быстро покрывается оксидной
плёнкой, которая придаёт ей характерный
интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют
зеленовато-голубой цвет.
Наряду с
осмием, цезием и золотом, медь — один
из четырёх металлов, имеющих явную
цветовую окраску, отличную отсерой или
серебристой у прочих металлов. Этот
цветовой оттенок объясняется наличием
электронных переходов между заполненной
третьей и полупустой четвёртой атомными
орбиталями: энергетическая разница
между ними соответствует длине волны
оранжевого света. Тот же механизм
отвечает за характерный цвет золота.
Медь
обладает высокой тепло- и электропроводностью
(занимает второе место по электропроводности
среди металлов после серебра).
Медь
является диамагнетиком.
Тонкие плёнки меди на просвет имеют
зеленовато-голубой цвет.
Наряду с
осмием, цезием и золотом, медь — один
из четырёх металлов, имеющих явную
цветовую окраску, отличную отсерой или
серебристой у прочих металлов. Этот
цветовой оттенок объясняется наличием
электронных переходов между заполненной
третьей и полупустой четвёртой атомными
орбиталями: энергетическая разница
между ними соответствует длине волны
оранжевого света. Тот же механизм
отвечает за характерный цвет золота.
Медь
обладает высокой тепло- и электропроводностью
(занимает второе место по электропроводности
среди металлов после серебра).
Медь
является диамагнетиком.
Химические
свойства меди. Образуя
химические соединения, атом может
отдавать один, два или три электрона,
проявляя степень окисления соответственно
+1, +2 и +3. При этом наиболее устойчивыми
являются соединения меди (II), а наименее
устойчивыми – соединения меди (III).
Медь
относится к малоактивным металлам.
Стандартный электродныйпотенциал меди
равен +0,34 В, что определяет ее место в
ряду стандартных электродных потенциалов:
оно находится правее водорода. При
обычных условиях она не взаимодействует
с водой, растворами щелочей, соляной и
разбавленной серной кислотой.
Однако
в кислотах-сильных окислителях (например,
азотной и концентрированной серной)-медь
растворяется:
Сu + 8HN03 = 3Cu(N03 )2 + 2NO +
4Н20
разбавленная
Сu + 4HN03 = Cu(N03)2 + 2N02+
2Н20
концентрированная
Сu+ 2h3S04 = CuS04 +
S02 + 2 Н20
концентрированная
При
обычных условиях она не взаимодействует
с водой, растворами щелочей, соляной и
разбавленной серной кислотой.
Однако
в кислотах-сильных окислителях (например,
азотной и концентрированной серной)-медь
растворяется:
Сu + 8HN03 = 3Cu(N03 )2 + 2NO +
4Н20
разбавленная
Сu + 4HN03 = Cu(N03)2 + 2N02+
2Н20
концентрированная
Сu+ 2h3S04 = CuS04 +
S02 + 2 Н20
концентрированная
Как
малоактивный металл медь обладает
достаточно высокой стойкостью к коррозии,
влажной атмосфере, содержащей углекислый
газ, медь покрывается зеленоватым
налетом карбоната меди:
2 Сu + O2 + С02 +
Н20 =Сu (ОН)2 • СuС02.В большинстве известных
соединений медь проявляет степень
окисления + 2.
Соединения меди
(II)-оксид СиО и гидроксид Си(ОН)2-довольно
устойчивы. Этот гидроксид амфотерен,хорошо
растворяется в кислотах:
Cu(OH)2 + 2НС1 =
СuСl2 + 2Н20
и в концентрированных
щелочах.
Гидроксид меди (II)-труднорасворимое
в воде вещество голубого цвета.
Приьнагреванииразлагается,образуя
оксид меди (II) черного цвета:
Сu(ОН)2
=СuО + Н20
Темный цвет окисленных
медных изделий обусловлен наличием на
их поверхности этого оксида. Для ионов
меди (II) Сu2+ характерно образование
комплексных соединений, например
K2[Cu(CN)4]-тетрацианокупрат (II) калия:
CuCl2
+ 4KCN = К2 [Cu(CN)4] + 2КСl
Из других комплексных
соединений меди (II) отметим соединение
с аммиаком. Если к раствору хлорида меди
(II) прилить небольшое количество раствора
аммиака, то выпадет осадок гидроксида
меди (II):
CuCl2 + 2Nh4 + 2Н20 = Сu(ОН)2 + 2Nh5Cl
Если
добавить избыток аммиака, то гидроксид
растворится с образованием комплексного
соединения темно-синей окраски,
характерной для аммиачного комплекса
меди:
Си(ОН)2+ 4Nh4 = [Cu(Nh4)4] (ОН)2
Эта реакция
является качественной на ион меди
(II).
Растворимость гидроксида меди
(II) в щелочах также связана с образованием
комплексных соединений:
Cu(OH)2 + 2NaOH = Na2
[Cu(OH)4]
Образованием комплексных
соединений объясняется цвет растворов
солей
меди (II). Почему, например,
безводный сульфат меди (II)-вещество
белого цвета, а раствор этой соли имеет
голубую окраску? При растворении
происходит химическое взаимодействие
ионов соли с водой, и образуются так
называемые аквакомплексы меди, имеющие
голубую окраску:
CuS04 + 6Н20 = [Сu (Н20)6]
SO4
Соединения меди (III), например Cu203
или KCu02, встречаются редко, они
малоустойчивы.
Для ионов
меди (II) Сu2+ характерно образование
комплексных соединений, например
K2[Cu(CN)4]-тетрацианокупрат (II) калия:
CuCl2
+ 4KCN = К2 [Cu(CN)4] + 2КСl
Из других комплексных
соединений меди (II) отметим соединение
с аммиаком. Если к раствору хлорида меди
(II) прилить небольшое количество раствора
аммиака, то выпадет осадок гидроксида
меди (II):
CuCl2 + 2Nh4 + 2Н20 = Сu(ОН)2 + 2Nh5Cl
Если
добавить избыток аммиака, то гидроксид
растворится с образованием комплексного
соединения темно-синей окраски,
характерной для аммиачного комплекса
меди:
Си(ОН)2+ 4Nh4 = [Cu(Nh4)4] (ОН)2
Эта реакция
является качественной на ион меди
(II).
Растворимость гидроксида меди
(II) в щелочах также связана с образованием
комплексных соединений:
Cu(OH)2 + 2NaOH = Na2
[Cu(OH)4]
Образованием комплексных
соединений объясняется цвет растворов
солей
меди (II). Почему, например,
безводный сульфат меди (II)-вещество
белого цвета, а раствор этой соли имеет
голубую окраску? При растворении
происходит химическое взаимодействие
ионов соли с водой, и образуются так
называемые аквакомплексы меди, имеющие
голубую окраску:
CuS04 + 6Н20 = [Сu (Н20)6]
SO4
Соединения меди (III), например Cu203
или KCu02, встречаются редко, они
малоустойчивы. Устойчивость соединений меди (I) выше,
однако и они в водных растворах легко
подвергаются диспролорциог нированию
(реакции самоокисления-самовосстановления):
2Сu+
= Сu + Сu2+
Устойчивость соединений меди (I) выше,
однако и они в водных растворах легко
подвергаются диспролорциог нированию
(реакции самоокисления-самовосстановления):
2Сu+
= Сu + Сu2+
Получение меди. Его можно упрощенно представить следующим образом: вначале сульфид меди (например, Cu2S) подвергают окислительному обжигу: Cu2S + 202 =2CuO+S02 К образовавшемуся оксиду, меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция: 2CuO + Cu2S = 4 Сu + S02
Серебро
Химические
свойства серебра.
Серебро
относится к группе переходных металлов
и обладает всеми свойствами металлов.
Однако химическая активность серебра
невелика – в электрохимическом ряду
напряжений металлов оно находится
правее водорода, почти в самом конце. В
соединениях серебро чаще всего проявляет
степень окисления +1.
При обычных
условиях серебро не реагирует с
кислородом, водородом, азотом, углеродом,
кремнием, но взаимодействует с серой,
образуя сульфид серебра: 2Ag+S=Ag2S. При
нагревании серебро взаимодействует с
галогенами: 2Ag+Cl2=2AgCl↓.
Растворимый
нитрат серебра AgNO3 используется для
качественного определения галогенид-ионов
в растворе – (Cl-), (Br-), (I-): (Ag+)+(Hal-)=AgHal↓. К
примеру, при взаимодействии с анионами
хлора серебро дает нерастворимый белый
осадок AgCl↓.
Почему серебряные изделия
темнеют на воздухе?
Причина
постепенного потемнения изделий из
серебра объясняется тем, что серебро
реагирует с содержащимся в воздухе
сероводородом. В результате этого на
поверхности металла образуется пленка
Ag2S: 4Ag+2h3S+O2=2Ag2S+2h3O.
Как серебро
взаимодействует с кислотами?
С
разбавленными соляной и серной кислотами
серебро, как и медь, не взаимодействует,
поскольку является металлом низкой
активности и не может вытеснять из них
водород. Кислоты-окислители, азотная и
концентрированная серная кислоты,
растворяют серебро:
2Ag+2h3SO4(конц.)=Ag2SO4+SO2↑+2h3O;
Ag+2HNO3(конц.)=AgNO3+NO2↑+h3O;
3Ag+4HNO3(разб.)=3AgNO3+NO↑+2h3O.
Если к раствору
нитрата серебра добавить щелочь,
получится темно-коричневый осадок
оксида серебра Ag2O: 2AgNO3+2NaOH=Ag2O↓+2NaNO3+h3O.
При
нагревании серебро взаимодействует с
галогенами: 2Ag+Cl2=2AgCl↓.
Растворимый
нитрат серебра AgNO3 используется для
качественного определения галогенид-ионов
в растворе – (Cl-), (Br-), (I-): (Ag+)+(Hal-)=AgHal↓. К
примеру, при взаимодействии с анионами
хлора серебро дает нерастворимый белый
осадок AgCl↓.
Почему серебряные изделия
темнеют на воздухе?
Причина
постепенного потемнения изделий из
серебра объясняется тем, что серебро
реагирует с содержащимся в воздухе
сероводородом. В результате этого на
поверхности металла образуется пленка
Ag2S: 4Ag+2h3S+O2=2Ag2S+2h3O.
Как серебро
взаимодействует с кислотами?
С
разбавленными соляной и серной кислотами
серебро, как и медь, не взаимодействует,
поскольку является металлом низкой
активности и не может вытеснять из них
водород. Кислоты-окислители, азотная и
концентрированная серная кислоты,
растворяют серебро:
2Ag+2h3SO4(конц.)=Ag2SO4+SO2↑+2h3O;
Ag+2HNO3(конц.)=AgNO3+NO2↑+h3O;
3Ag+4HNO3(разб.)=3AgNO3+NO↑+2h3O.
Если к раствору
нитрата серебра добавить щелочь,
получится темно-коричневый осадок
оксида серебра Ag2O: 2AgNO3+2NaOH=Ag2O↓+2NaNO3+h3O. Как
и соединения одновалентной меди,
нерастворимые осадки AgCl и Ag2O способны
растворяться в растворах аммиака, давая
комплексные соединения: AgCl+2Nh4=[Ag(Nh4)2]Cl;
Ag2O+4Nh4+h3O=2[Ag(Nh4)2]OH. Последнее соединение
часто применяют в органической химии
в реакции «серебряного зеркала» –
качественной реакции на альдегидную
группу.
Как
и соединения одновалентной меди,
нерастворимые осадки AgCl и Ag2O способны
растворяться в растворах аммиака, давая
комплексные соединения: AgCl+2Nh4=[Ag(Nh4)2]Cl;
Ag2O+4Nh4+h3O=2[Ag(Nh4)2]OH. Последнее соединение
часто применяют в органической химии
в реакции «серебряного зеркала» –
качественной реакции на альдегидную
группу.
Получение Серебра. Большая часть Серебра (около 80%) извлекается попутно из полиметаллических руд, а также из руд золота и меди. При извлечении Серебра из серебряных и золотых руд применяют метод цианирования – растворения Серебра в щелочном растворе цианида натрия при доступе воздуха: 2Ag + 4NaCN + ½O2 + h3O = 2Na[Ag(CN)2] + 2NaOH. Из полученных растворов комплексных цианидов Серебро выделяют восстановлением цинком или алюминием: 2[Ag(CN)2]-+ Zn = [2Zn(CN)4]2- + 2Ag.
Золото
Конфигурация
внешней и предвнешней электронных
оболочек 5s2p6d106s1. Расположено в IВ группе
и 6-м периоде периодической системы,
относится к благородным металлам. Степени окисления 0, +1, +3, +5 (валентности
от I, III, V). Металлический радиус атома
золота 0,137 нм, радиус иона Au+ — 0,151 нм для
координационного числа 6, иона Au3+ —
0,084 нм и 0,099 нм для координационных чисел
4 и 6. Энергии ионизации Au0 — Au+ — Au2+ —
Au3+
Степени окисления 0, +1, +3, +5 (валентности
от I, III, V). Металлический радиус атома
золота 0,137 нм, радиус иона Au+ — 0,151 нм для
координационного числа 6, иона Au3+ —
0,084 нм и 0,099 нм для координационных чисел
4 и 6. Энергии ионизации Au0 — Au+ — Au2+ —
Au3+
Получение Применяют и цианидный способ извлечения золота из руд. В этом случае золотоносную руду обрабатывают раствором цианида натрия NaCN. В присутствии кислорода воздуха золото переходит в раствор: 4Au + O2 + 8NaCN + 2h3O = 4Na[Au(CN)2] + 4NaOH Далее полученный раствор комплекса золота обрабатывают цинковой пылью: 2Na[Au(CN)2] + Zn = Na2[Zn(CN)4) + 2AuЇ Очищают золото растворением в царской водке (см. ЦАРСКАЯ ВОДКА): Au + HNO3 + 4HCl = H[AuCl4] + NO +h3O с последующим избирательным осаждением золота из раствора, например, с помощью FeSO4.
Физические
и химические свойства Золото
— желтый металл с кубической
гранецентрированной решеткой (a = 0,40786
нм). Температура плавления 1064,4 °C,
температура кипения 2880 °C, плотность
19,32 кг/дм3. Обладает исключительной
пластичностью, теплопроводностью и
электропроводимостью. Шарик золота
диаметром в 1 мм можно расплющить в
тончайший лист, просвечивающий
голубовато-зеленым цветом, площадью 50
м2. Толщина самых тонких листочков золота
0,1 мкм. Из золота можно вытянуть тончайшие
нити.
Золото устойчиво на воздухе
и в воде. С кислородом, азотом, водородом,
фосфором, сурьмой и углеродом
непосредственно не взаимодействует.
Антимонид AuSb2 и фосфид золота Au2P3 получают
косвенными путями.
В ряду стандартных
потенциалов золото расположено правее
водорода, поэтому с неокисляющими
кислотами в реакции не вступает.
Растворяется в горячей селеновой
кислоте:
2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 +
3h3O,
в концентрированной соляной
кислоте при пропускании через раствор
хлора:
2Au + 3Cl2 + 2HCl = 2H[AuCl4]
При
аккуратном упаривании получаемого
раствора можно получить желтые кристаллы
золотохлористоводородной кислоты
HAuCl4·3h3O.
С галогенами (см. ГАЛОГЕНЫ)
без нагревания в отсутствие влаги золото
не реагирует.
Обладает исключительной
пластичностью, теплопроводностью и
электропроводимостью. Шарик золота
диаметром в 1 мм можно расплющить в
тончайший лист, просвечивающий
голубовато-зеленым цветом, площадью 50
м2. Толщина самых тонких листочков золота
0,1 мкм. Из золота можно вытянуть тончайшие
нити.
Золото устойчиво на воздухе
и в воде. С кислородом, азотом, водородом,
фосфором, сурьмой и углеродом
непосредственно не взаимодействует.
Антимонид AuSb2 и фосфид золота Au2P3 получают
косвенными путями.
В ряду стандартных
потенциалов золото расположено правее
водорода, поэтому с неокисляющими
кислотами в реакции не вступает.
Растворяется в горячей селеновой
кислоте:
2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 +
3h3O,
в концентрированной соляной
кислоте при пропускании через раствор
хлора:
2Au + 3Cl2 + 2HCl = 2H[AuCl4]
При
аккуратном упаривании получаемого
раствора можно получить желтые кристаллы
золотохлористоводородной кислоты
HAuCl4·3h3O.
С галогенами (см. ГАЛОГЕНЫ)
без нагревания в отсутствие влаги золото
не реагирует. При нагревании порошка
золота с галогенами или с дифторидом
ксенона образуются галогениды золота:
2Au
+ 3Cl2 = 2AuCl3,
2Au + 3XeF2 = 2AuF3 + 3Xe
В воде
растворимы только AuCl3 и AuBr3, состоящие
из димерных молекул:
Термическим
разложением гексафторауратов (V),
например, O2+[AuF6]– получены фториды золота
AuF5 и AuF7. Их также можно получить, окисляя
золото или его трифторид с помощью KrF2
и XeF6.
Моногалогениды золота AuCl, AuBr и
AuI образуются при нагревании в вакууме
соответствующих высших галогенидов.
При нагревании они или разлагаются:
2AuCl
= 2Au + Cl2
или диспропорционируют:
3AuBr
= AuBr3 + 2Au.
Соединения золота неустойчивы
и в водных растворах гидролизуются,
легко восстанавливаясь до металла.
Гидроксид
золота (III) Au(OH)3 образуется при добавлении
щелочи или Mg(OH)2 к раствору H[AuCl4]:
H[AuCl4]
+ 2Mg(OH)2 = Au(OH)3Ї + 2MgCl2 + h3O
При нагревании
Au(OH)3 легко дегидратируется, образуя
оксид золота (III):
2Au(OH)3 = Au2O3 +
3h3O
Гидроксид золота (III) проявляет
амфотерные свойства, реагируя с растворами
кислот и щелочей:
Au(OH)3 + 4HCl = H[AuCl4] +
3h3O,
Au(OH)3 + NaOH = Na[Au(OH)4]
Другие
кислородные соединения золота неустойчивы
и легко образуют взрывчатые смеси.
При нагревании порошка
золота с галогенами или с дифторидом
ксенона образуются галогениды золота:
2Au
+ 3Cl2 = 2AuCl3,
2Au + 3XeF2 = 2AuF3 + 3Xe
В воде
растворимы только AuCl3 и AuBr3, состоящие
из димерных молекул:
Термическим
разложением гексафторауратов (V),
например, O2+[AuF6]– получены фториды золота
AuF5 и AuF7. Их также можно получить, окисляя
золото или его трифторид с помощью KrF2
и XeF6.
Моногалогениды золота AuCl, AuBr и
AuI образуются при нагревании в вакууме
соответствующих высших галогенидов.
При нагревании они или разлагаются:
2AuCl
= 2Au + Cl2
или диспропорционируют:
3AuBr
= AuBr3 + 2Au.
Соединения золота неустойчивы
и в водных растворах гидролизуются,
легко восстанавливаясь до металла.
Гидроксид
золота (III) Au(OH)3 образуется при добавлении
щелочи или Mg(OH)2 к раствору H[AuCl4]:
H[AuCl4]
+ 2Mg(OH)2 = Au(OH)3Ї + 2MgCl2 + h3O
При нагревании
Au(OH)3 легко дегидратируется, образуя
оксид золота (III):
2Au(OH)3 = Au2O3 +
3h3O
Гидроксид золота (III) проявляет
амфотерные свойства, реагируя с растворами
кислот и щелочей:
Au(OH)3 + 4HCl = H[AuCl4] +
3h3O,
Au(OH)3 + NaOH = Na[Au(OH)4]
Другие
кислородные соединения золота неустойчивы
и легко образуют взрывчатые смеси. Соединение оксида золота (III) с аммиаком
Au2O3·4Nh4 — «гремучее золото», взрывается
при нагревании.
При восстановлении
золота из разбавленных растворов его
солей, а также при электрическом
распылении золота в воде образуется
стойкий коллоидный раствор золота:
2AuCl3
+ 3SnCl2 = 3SnCl4 +2Au
Окраска коллоидных
растворов золота зависит от степени
дисперсности частиц золота, а интенсивность
от их концентрации. Частицы золота в
растворе всегда отрицательно
заряжены.
Соединение оксида золота (III) с аммиаком
Au2O3·4Nh4 — «гремучее золото», взрывается
при нагревании.
При восстановлении
золота из разбавленных растворов его
солей, а также при электрическом
распылении золота в воде образуется
стойкий коллоидный раствор золота:
2AuCl3
+ 3SnCl2 = 3SnCl4 +2Au
Окраска коллоидных
растворов золота зависит от степени
дисперсности частиц золота, а интенсивность
от их концентрации. Частицы золота в
растворе всегда отрицательно
заряжены.
| Британника
- Похожие темы:
- обработка материалов Серебряный
См. все связанные материалы →
обработка серебра , подготовка руды для использования в различных продуктах.
Серебро издавна ценится за его белый металлический блеск, легкость обработки и устойчивость к коррозионному воздействию влаги и кислорода. Блеск чистого металла обусловлен его электронной конфигурацией, в результате чего он отражает все электромагнитное излучение с длинами волн более 3000 ангстрем (3000 ангстрем находятся в ультрафиолетовом диапазоне). Таким образом, весь видимый свет (то есть свет с длинами волн от 4000 до 7000 ангстрем) эффективно отражается, придавая белый цвет.
Таким образом, весь видимый свет (то есть свет с длинами волн от 4000 до 7000 ангстрем) эффективно отражается, придавая белый цвет.
Серебро (Ag), как и золото, кристаллизуется в гранецентрированной кубической системе. Он плавится при нагревании до 962 ° C (1764 ° F). При плотности 10,49 грамма на кубический сантиметр это самый легкий из драгоценных металлов. Это также наименее благородный из драгоценных металлов, легко реагирующий со многими обычными реагентами, такими как азотная кислота и серная кислота. Металлическое серебро можно растворить из золотых сплавов, содержащих менее 30 процентов золота, путем кипячения с 30-процентной азотной кислотой в процессе, называемом разделением. Кипячение с концентрированной серной кислотой для разделения серебра и золота называется аффинацией. Оба эти процесса используются в промышленных масштабах для разделения серебра и золота.
История
Серебро было обнаружено после золота и меди около 4000 г. до н.э., когда оно использовалось в ювелирных изделиях и в качестве средства обмена. Самыми ранними известными работами значительных размеров были работы дохеттов Каппадокии в восточной Анатолии. Серебро обычно встречается в природе в связанном состоянии, обычно в медной или свинцовой минерализации, и к 2000 г. до н.э. уже шла добыча и выплавка серебросодержащих свинцовых руд. Свинцовые руды выплавляли для получения нечистого свинцово-серебряного сплава, который затем подвергали плавлению путем купелирования. Самые известные из древних рудников находились на серебряно-свинцовом месторождении Лауриум в Греции; это активно добывалось с 500 г. до н.э. до 100 г. н.э. Испанские мины также были крупным источником.
Самыми ранними известными работами значительных размеров были работы дохеттов Каппадокии в восточной Анатолии. Серебро обычно встречается в природе в связанном состоянии, обычно в медной или свинцовой минерализации, и к 2000 г. до н.э. уже шла добыча и выплавка серебросодержащих свинцовых руд. Свинцовые руды выплавляли для получения нечистого свинцово-серебряного сплава, который затем подвергали плавлению путем купелирования. Самые известные из древних рудников находились на серебряно-свинцовом месторождении Лауриум в Греции; это активно добывалось с 500 г. до н.э. до 100 г. н.э. Испанские мины также были крупным источником.
К XVI веку испанские конкистадоры открыли и разработали серебряные рудники в Мексике, Боливии и Перу. Эти рудники Нового Света, гораздо более богатые серебром, привели к тому, что Южная и Центральная Америка стали крупнейшими в мире районами добычи серебра. Для извлечения серебра Нового Света использовался процесс Патио. Серебросодержащую руду измельчали, а затем смешивали с солью, обожженной медной рудой и ртутью. Смешивание осуществлялось путем привязывания мулов к центральному столбу на мощеной террасе (отсюда и название процесса) и принуждения их ходить по кругу через смесь. Серебро постепенно переходило в элементарное состояние в очень тонкоизмельченной форме, из которой растворялось ртутью. Периодически ртуть собирали и перегоняли для извлечения серебра, которое впоследствии очищали купелированием. Процессы цианирования вытеснили процесс патио в конце 19 века.век; к тому времени были внедрены процессы электрорафинирования Мебиуса и Тума Бальбаха.
Смешивание осуществлялось путем привязывания мулов к центральному столбу на мощеной террасе (отсюда и название процесса) и принуждения их ходить по кругу через смесь. Серебро постепенно переходило в элементарное состояние в очень тонкоизмельченной форме, из которой растворялось ртутью. Периодически ртуть собирали и перегоняли для извлечения серебра, которое впоследствии очищали купелированием. Процессы цианирования вытеснили процесс патио в конце 19 века.век; к тому времени были внедрены процессы электрорафинирования Мебиуса и Тума Бальбаха.
В середине 19 века в Неваде было обнаружено крупное месторождение серебра. Это привело к тому, что Соединенные Штаты стали крупнейшим производителем серебра в мире до 20 века, когда их обогнали Мексика и Южная Америка (особенно Перу). К началу 21 века Мексика, Китай, Перу, Австралия и Россия стали ведущими мировыми производителями серебра.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Хотя некоторые серебросодержащие руды содержат серебро в качестве основного металла, практически ни одна из них не содержит серебра в качестве основного компонента. Типичная руда может содержать 0,085% серебра, 0,5% свинца, 0,5% меди и 0,3% сурьмы. После флотационного разделения концентрат будет содержать 1,7% серебра, 10-15% свинца, 10-15% меди и 6% сурьмы. Приблизительно 25 процентов произведенного серебра поступает из руд, фактически добытых по их стоимости серебра; остальные 75 процентов приходятся на руды, которые в качестве основного металла содержат свинец, медь или цинк. Все эти рудные минералы представляют собой сульфиды; обычно свинец присутствует в виде галенита (PbS), цинк в виде сфалерита (ZnS) и медь в виде халькопирита (CuFeS 2 ). Кроме того, минерализация обычно включает большое количество пирита (FeS 2 ) и арсенопирита (FeAsS). Минерализация серебра обычно представлена аргентитом (Ag 2 S), пруститом (Ag 3 AsS 3 ) и полибазитом [(Ag,Cu) 16 Sb 2 S 11 ].
Типичная руда может содержать 0,085% серебра, 0,5% свинца, 0,5% меди и 0,3% сурьмы. После флотационного разделения концентрат будет содержать 1,7% серебра, 10-15% свинца, 10-15% меди и 6% сурьмы. Приблизительно 25 процентов произведенного серебра поступает из руд, фактически добытых по их стоимости серебра; остальные 75 процентов приходятся на руды, которые в качестве основного металла содержат свинец, медь или цинк. Все эти рудные минералы представляют собой сульфиды; обычно свинец присутствует в виде галенита (PbS), цинк в виде сфалерита (ZnS) и медь в виде халькопирита (CuFeS 2 ). Кроме того, минерализация обычно включает большое количество пирита (FeS 2 ) и арсенопирита (FeAsS). Минерализация серебра обычно представлена аргентитом (Ag 2 S), пруститом (Ag 3 AsS 3 ) и полибазитом [(Ag,Cu) 16 Sb 2 S 11 ].
Из мировых запасов серебряного оруденения более половины приходится на США, Канаду, Мексику, Перу, Казахстан и Россию.
Добыча и обогащение
Серебросодержащие руды добывают открытым или подземным способом с последующим дроблением и измельчением. Так как практически все руды сульфидные, они поддаются флотации, при которой обычно достигается 30-40-кратное обогащение полезных ископаемых. Из трех основных типов минерализации свинцовые концентраты содержат больше всего серебра, а цинковые — меньше всего.
Добыча и очистка
Конкретные процессы экстракционной металлургии, применяемые к серебросодержащему минеральному концентрату, зависят от того, является ли основным металлом медь, цинк или свинец.
Из медных концентратов
В результате плавки и преобразования концентратов сульфида меди получается «черновая» медь, содержащая от 97 до 99 процентов серебра, присутствующего в исходном концентрате. При электролитическом рафинировании меди нерастворимые примеси, называемые шламами, постепенно скапливаются на дне рафинировочного резервуара. Они содержат серебро, изначально присутствующее в концентрате, но в гораздо более высокой концентрации; например, содержание серебра в сульфидном концентрате 0,2 процента может привести к образованию шлама, содержащего 20 процентов серебра. Его плавят в небольшой печи для окисления практически всех присутствующих металлов, кроме серебра, золота и металлов платиновой группы. Извлекаемый металл, называемый Доре, обычно содержит от 0,5 до 5 процентов золота, от 0,1 до 1 процента платиновых металлов и остальное серебро. Этот металл отливают в виде анодов и подвергают электролизу в растворе нитрата серебра и меди. Используются два различных метода электрорафинирования: системы Мебиуса и Тума Бальбаха. Основное различие между ними состоит в том, что в системе Мёбиуса электроды расположены вертикально, а в системе Тум-Бальбаха – горизонтально. Серебро, полученное электролизом, обычно имеет чистоту три девятки; иногда это может быть четыре девятки или 99,99% серебра.
Его плавят в небольшой печи для окисления практически всех присутствующих металлов, кроме серебра, золота и металлов платиновой группы. Извлекаемый металл, называемый Доре, обычно содержит от 0,5 до 5 процентов золота, от 0,1 до 1 процента платиновых металлов и остальное серебро. Этот металл отливают в виде анодов и подвергают электролизу в растворе нитрата серебра и меди. Используются два различных метода электрорафинирования: системы Мебиуса и Тума Бальбаха. Основное различие между ними состоит в том, что в системе Мёбиуса электроды расположены вертикально, а в системе Тум-Бальбаха – горизонтально. Серебро, полученное электролизом, обычно имеет чистоту три девятки; иногда это может быть четыре девятки или 99,99% серебра.
Из свинцовых концентратов
Свинцовые концентраты сначала обжигают, а затем плавят для получения слитков свинца, из которых необходимо удалить такие примеси, как сурьма, мышьяк, олово и серебро. Серебро удаляется с помощью процесса Паркса, который заключается в добавлении цинка в расплавленный слиток свинца. Цинк быстро и полностью реагирует с золотом и серебром, образуя очень нерастворимые соединения, которые всплывают на поверхность слитка. Они снимаются, а содержание цинка в них восстанавливается путем вакуумной автоклавной перегонки. Оставшийся остаток свинца-золота-серебра обрабатывается купелированием – процессом, при котором остаток нагревается до высокой температуры (около 800 ° C или 1450 ° F) в сильно окислительных условиях. Благородное серебро и золото остаются в элементарной форме, а свинец окисляется и удаляется. Полученный таким образом золотой и серебряный сплав очищают с помощью процессов Мебиуса или Тум-Бальбаха. Остаток от аффинажа серебра подвергается аффинации или разделению для концентрирования содержания золота, которое очищается по процессу Вольвилла.
Цинк быстро и полностью реагирует с золотом и серебром, образуя очень нерастворимые соединения, которые всплывают на поверхность слитка. Они снимаются, а содержание цинка в них восстанавливается путем вакуумной автоклавной перегонки. Оставшийся остаток свинца-золота-серебра обрабатывается купелированием – процессом, при котором остаток нагревается до высокой температуры (около 800 ° C или 1450 ° F) в сильно окислительных условиях. Благородное серебро и золото остаются в элементарной форме, а свинец окисляется и удаляется. Полученный таким образом золотой и серебряный сплав очищают с помощью процессов Мебиуса или Тум-Бальбаха. Остаток от аффинажа серебра подвергается аффинации или разделению для концентрирования содержания золота, которое очищается по процессу Вольвилла.
Из цинковых концентратов
Цинковые концентраты обжигают, а затем выщелачивают серной кислотой для растворения содержащегося в них цинка, оставляя остаток, содержащий свинец, серебро и золото, а также от 5 до 10 процентов содержания цинка в концентратах. Это происходит путем выпаривания шлака, процесса, при котором остаток расплавляется с образованием шлака, через который вместе с воздухом продувается порошкообразный уголь или кокс. Цинк восстанавливается до металлической формы и испаряется из шлака, а свинец переходит в металлическую форму и растворяет серебро и золото. Этот слиток свинца периодически собирают и отправляют на рафинирование свинца, как описано выше.
Это происходит путем выпаривания шлака, процесса, при котором остаток расплавляется с образованием шлака, через который вместе с воздухом продувается порошкообразный уголь или кокс. Цинк восстанавливается до металлической формы и испаряется из шлака, а свинец переходит в металлическую форму и растворяет серебро и золото. Этот слиток свинца периодически собирают и отправляют на рафинирование свинца, как описано выше.
Приблизительно 60 процентов всего производимого серебра используется в фотоиндустрии, а металл может быть переработан из отработанных растворов для обработки фотографий и фотопленки. Растворы обрабатываются на месте электролитически, при этом пленка сжигается, а зола выщелачивается для извлечения содержания серебра.
Высококачественный ювелирный лом обычно переплавляется на месте, а не очищается. Мелкая пыль, образующаяся при полировке и шлифовке драгоценных металлов, обычно переплавляется для получения нечистого серебра, которое подвергается электрорафинированию. Из-за гораздо более низкой стоимости серебряного лома методы переработки, применимые к золоту (например, цианирование низкосортного лома), нерентабельны для серебра. Вместо этого низкосортный серебряный лом возвращается на плавильный завод для переработки.
Из-за гораздо более низкой стоимости серебряного лома методы переработки, применимые к золоту (например, цианирование низкосортного лома), нерентабельны для серебра. Вместо этого низкосортный серебряный лом возвращается на плавильный завод для переработки.
Методы пробирного анализа, описанные выше для золота, в равной степени применимы и к серебру. Чтобы определить содержание серебра в пробирном шарике, шарик сначала взвешивают, затем кипятят с 35-процентной азотной кислотой для растворения содержащегося в нем серебра, а затем снова взвешивают. Потеря веса определяет содержание серебра, а оставшийся остаток содержит золото. Чтобы обеспечить полное растворение серебра, содержание серебра в шарике должно быть не менее 60–70 процентов. Процесс, обычно используемый при пробирном анализе золотых руд, заключается в добавлении серебра перед плавлением руды, чтобы гарантировать, что содержание серебра в конечном шарике будет достаточно высоким для растворения. Это называется инквартацией, а разделение серебра и золота выщелачиванием азотной кислотой — разделением.
Ионизация меди и серебра в качестве дезинфицирующего средства
Такие металлы, как медь и серебро, можно использовать для дезинфекции воды, если они ионизированы.
Когда был открыт механизм обеззараживания меди и серебра?
Археологические раскопки показывают, что люди используют медь более 11 000 лет, а серебро – более 5 000 лет. Медь легко извлекается и обрабатывается. Более 7000 лет назад люди разработали механизм извлечения меди из медных руд. Римская империя получала большую часть своей меди с Кипра, острова, который дал название меди.
В настоящее время медь добывается в основном из руд, таких как куприт (CuO 2 ), тенорит (CuO), малахит (CuO 3 ·Cu(OH) 2 ), халькоцит (Cu 2 S), ковелит (CuS) и борнит (Cu 6 FeS 4 ). Крупные месторождения медных руд обнаружены в США, Чили, Замбии, Заире, Перу и Канаде.
Серебро можно получить из чистых месторождений, из серебряных руд, таких как аргенит (Ag 2 S) и роговое серебро (AgCl), и в сочетании с рудными месторождениями, содержащими свинец, золото или медь.
И медь, и серебро применялись веками из-за их биоцидного механизма. Викинги использовали медные струны на своих кораблях, чтобы предотвратить рост водорослей и ракушек. Современные корабли по-прежнему используют ту же технологию.
Большинство противообрастающих красок содержат медь, что снижает количество морских видов, растущих на стенках кораблей. Благодаря этой мере корабли могут быстрее добраться до места назначения.
Кочевники использовали серебряные монеты для улучшения качества питьевой воды. Колодезная вода, содержащая медные и серебряные монеты, очень яркая из-за биоцидного действия этих металлов.
С 1869 г. появляются различные публикации о дезинфицирующих свойствах серебра. Некоторые европейские и российские деревни уже много лет используют серебро для очистки питьевой воды.
Ионизация медь-серебро была разработана в Европе и США в 1950-х годах.
Рисунок 1: компания Vickings использовала медные струны для предотвращения роста водорослей на кораблях
Как образуются ионы меди-серебра?
Ионизация медь-серебро осуществляется электролизом. Электрический ток создается через медь-серебро, вызывая образование положительно заряженных ионов меди и серебра.
Электрический ток создается через медь-серебро, вызывая образование положительно заряженных ионов меди и серебра.
Ионизация медь-серебро возвращает нас к основам химии: иону; электрически заряженный атом имеет положительный заряд, когда он отдает электрон, и отрицательный заряд, когда он принимает электрон. Положительно заряженный ион называется катионом, а отрицательно заряженный ион – анионом. При ионизации атомы превращаются в катионы или анионы. При ионизации медь-серебро образуются положительно заряженные ионы меди (Cu + и Cu 2+ ) и серебра (Ag + ).
Электроды расположены близко друг к другу. Обеззараженная вода течет мимо электродов. Создается электрический ток, в результате чего внешние атомы электродов теряют электрон и становятся положительно заряженными. Большая часть ионов утекает через воду, прежде чем достичь противоположного электрода. Обычно количество ионов серебра при концентрации ионов меди от 0,15 до 0,40 частей на миллион составляет от 5 до 50 частей на миллиард.
Концентрация ионов определяется расходом воды. Количество высвобождаемых ионов увеличивается, когда электрические заряды выше.
Когда ионы меди (Cu + ) растворяются в воде, они немедленно окисляются с образованием ионов Cu 2+ . Медь можно найти в воде в свободном виде. Обычно он связан с частицами воды. Ионы меди (Cu + ) нестабильны в воде, если не присутствует стабилизирующий лиганд.
Каковы области применения ионизации медь-серебро?
Ионизация медь-серебро подходит для большого количества применений. Интерес к ней возник, когда НАСА использовало медно-серебряную ионизацию для производства питьевой воды на борту космических кораблей «Аполлон» в 1919 году.60. Генератор ионов, который использовался, был размером со спичечный коробок.
Благодаря ионизации медь-серебро питьевую воду можно безопасно производить в космосе без использования хлора.
Рис. 2. НАСА использовало полеты Аполлона для одной из первых ионизаций меди и серебра
В Англии ионизация медью и серебром успешно применяется примерно в 120 больницах для дезактивации бактерий Legionella.
В Соединенных Штатах ионизация медь-серебро в основном используется для дезинфекции воды в плавательных бассейнах. Медь-серебро часто используется для ограничения образования побочных продуктов дезинфекции во время дезинфекции хлором.
Из-за своих специфических свойств медно-серебряная ионизация очень подходит для дезинфекции рыбных прудов. Ионизация медь-серебро не зависит от температуры. Он активен во всей водной системе.
Ионизация медь-серебро используется компаниями по розливу воды и компаниями, перерабатывающими воду по всей территории Соединенных Штатов.
Каков механизм дезинфекции медно-серебряной ионизации?
Электрически заряженные ионы меди (Cu 2+ ) ищут в воде частицы противоположной полярности, такие как бактерии, вирусы и грибки. Положительно заряженные ионы меди образуют электростатические соединения с отрицательно заряженными клеточными стенками микроорганизмов. Эти соединения нарушают проницаемость клеточных стенок и приводят к нарушению усвоения питательных веществ. Ионы меди проникают через клеточную стенку и в результате создают вход для ионов серебра (Ag + ). Они проникают в ядро микроорганизма. Ионы серебра связываются с различными частями клетки, такими как ДНК и РНК, клеточные белки и дыхательные ферменты, вызывая иммобилизацию всех систем жизнеобеспечения в клетке. В результате больше не происходит роста или деления клеток, в результате чего бактерии больше не размножаются и в конечном итоге вымирают. Ионы остаются активными до тех пор, пока они не будут поглощены микроорганизмом.
Ионы меди проникают через клеточную стенку и в результате создают вход для ионов серебра (Ag + ). Они проникают в ядро микроорганизма. Ионы серебра связываются с различными частями клетки, такими как ДНК и РНК, клеточные белки и дыхательные ферменты, вызывая иммобилизацию всех систем жизнеобеспечения в клетке. В результате больше не происходит роста или деления клеток, в результате чего бактерии больше не размножаются и в конечном итоге вымирают. Ионы остаются активными до тех пор, пока они не будут поглощены микроорганизмом.
Каково применение ионизации медь-серебро для дезинфекции?
Плавательные бассейны и ионизация медь-серебро
В Соединенных Штатах ионизация медь-серебро применяется в качестве альтернативы дезинфекции хлором. Использование хлора можно сократить на 80%. Однако помимо медно-серебряного следует добавить еще одно дезинфицирующее средство. Это связано с тем, что медь-серебро не может удалить органические вещества, такие как ткани кожи, волосы, моча и чешуйки кожи, из воды плавательного бассейна.
Градирни и медно-серебряные ионизаторы
Вода в градирнях требует дезинфекции, чтобы предотвратить рост микроорганизмов. Это может быть достигнуто за счет комбинации ионизации медью и серебром и дезинфекции хлором. Требуемые концентрации хлора намного ниже.
Ионизация медь-серебро также может использоваться для уничтожения бактерий Legionella в градирнях.
Legionella в больницах и домах престарелых и ионизация медь-серебро
Ионизация медь-серебро применяется в больницах и домах престарелых для предотвращения распространения бактерий Legionella. Основным источником распространения легионелл является система горячего водоснабжения. Условия в системах теплой воды идеальны для роста и размножения бактерий Legionella. Заражение в основном происходит через душевой пар. Ионизация медь-серебро может в достаточной степени убить бактерии Legionella. Медь-серебро также может активно деактивировать Legionella.
Питьевая вода и ионизация медь-серебро
В Соединенных Штатах несколько компаний по производству питьевой воды используют ионизацию медь-серебро в качестве альтернативы дезинфекции хлором и для предотвращения образования побочных продуктов дезинфекции. Стандарт для тригалометанов был снижен EPA со 100 до 80 мкг/л.
Стандарт для тригалометанов был снижен EPA со 100 до 80 мкг/л.
Когда ионизация медь-серебро сочетается с дезинфекцией хлором, это отличный механизм дезинфекции для деактивации вирусов и бактерий.
Каковы условия ионизации медь-серебро?
Эффективность медно-серебряной дезинфекции зависит от ряда факторов:
Во-первых, концентрация ионов меди и серебра в воде должна быть достаточной. Требуемая концентрация определяется расходом воды, объемом воды в системе, проводимостью воды и имеющейся концентрацией микроорганизмов.
Во-вторых, электроды должны быть в хорошем состоянии. Когда вода жесткая или имеет место загрязнение из-за жесткости и качества воды, будет уменьшаться выброс электрода, и дополнительный эффект будет уменьшаться. Используя чистое серебро и чистую медь, поступление ионов меди и серебра можно регулировать отдельно. Эти электроды страдают от меньшего образования известняка и загрязнения.
В-третьих, эффективность медно-серебряной ионизации зависит от значения рН воды. При высоких значениях pH ионы меди менее эффективны. Когда значение pH превышает 6, нерастворимые комплексы меди выпадают в осадок. Когда значение pH равно 5, ионы меди в основном существуют в виде Cu(HCO 3 ) + ; когда значение pH равно 7, как Cu(CO 3 ), а когда значение pH равно 9, как Cu(CO 3 ) 2 2- .
При высоких значениях pH ионы меди менее эффективны. Когда значение pH превышает 6, нерастворимые комплексы меди выпадают в осадок. Когда значение pH равно 5, ионы меди в основном существуют в виде Cu(HCO 3 ) + ; когда значение pH равно 7, как Cu(CO 3 ), а когда значение pH равно 9, как Cu(CO 3 ) 2 2- .
В-четвертых, эффективность ионизации меди и серебра определяется наличием хлора. Хлор вызывает образование комплексов с хлором серебра. Когда это происходит, ионы серебра становятся недоступными для дезинфекции.
Насколько эффективна ионизация медь-серебро?
Ионизация медь-серебро может дезактивировать бактерии Legionella и другие микроорганизмы в медленно текущей и стоячей воде. Бактерии Legionella очень чувствительны к ионизации медь-серебро. Ионизация медь-серебро также заботится о биопленке. Медь остается внутри биопленки, вызывая остаточный эффект.
По-видимому, добавка ионизации меди и серебра приводит к уменьшению количества бактерий Legionella. Однако через короткий промежуток времени количество бактерий Legionella снова возрастет, поскольку они также могут быть обнаружены в биопленке. Медь, которая остается в биопленке, заботится об этих бактериях. При постоянном добавлении в воду ионов меди и серебра концентрация бактерий Legionella остается низкой.
Однако через короткий промежуток времени количество бактерий Legionella снова возрастет, поскольку они также могут быть обнаружены в биопленке. Медь, которая остается в биопленке, заботится об этих бактериях. При постоянном добавлении в воду ионов меди и серебра концентрация бактерий Legionella остается низкой.
Скорость дезактивации ионизации медь-серебро ниже, чем у озона или УФ. Преимущество ионизации медь-серебро заключается в том, что ионы остаются в воде в течение длительного периода времени. Это обеспечивает длительную дезинфекцию и защиту от повторного заражения. Ионы меди и серебра остаются в воде до тех пор, пока не выпадут в осадок или не абсорбируются бактериями или водорослями, после чего удаляются из воды путем фильтрации.
Каковы преимущества и недостатки ионизации медь-серебро?
Преимущества
Ионизация медью и серебром эффективно дезактивирует бактерии Legionella и биопленку и улучшает качество воды. Ионизация медь-серебро имеет больший остаточный эффект, чем большинство других дезинфицирующих средств. Ионы меди и серебра остаются в воде в течение длительного периода времени. Из-за его местного воздействия эффект больше, чем у УФ. Медь-серебро эффективно во всей системе водоснабжения, даже в тупиковых точках и частях системы, содержащих медленно протекающую воду. Эффективность медно-серебряного применения не зависит от температуры воды. Когда используется медь-серебро, требуется меньше обслуживания системы водоснабжения. Медь-серебро не вызывает коррозии; это вызывает меньшую нагрузку на систему распределения. Из-за уменьшения использования химикатов крышки и насосы не пострадали. Кроме того, не загрязняются душевые лейки, баки и краны. При применении медно-серебряной ионизации не возникает трудностей при транспортировке и хранении.
Ионы меди и серебра остаются в воде в течение длительного периода времени. Из-за его местного воздействия эффект больше, чем у УФ. Медь-серебро эффективно во всей системе водоснабжения, даже в тупиковых точках и частях системы, содержащих медленно протекающую воду. Эффективность медно-серебряного применения не зависит от температуры воды. Когда используется медь-серебро, требуется меньше обслуживания системы водоснабжения. Медь-серебро не вызывает коррозии; это вызывает меньшую нагрузку на систему распределения. Из-за уменьшения использования химикатов крышки и насосы не пострадали. Кроме того, не загрязняются душевые лейки, баки и краны. При применении медно-серебряной ионизации не возникает трудностей при транспортировке и хранении.
Недостатки
Медно-серебряная эффективность зависит от значения рН воды. При значении pH 9 удаляется только одна десятая часть всех бактерий Legionella. Когда концентрации растворенных твердых веществ высоки, серебро выпадает в осадок. Это означает, что ионы серебра больше не доступны для дезинфекции.
Это означает, что ионы серебра больше не доступны для дезинфекции.
Ионы серебра легко вступают в реакцию с хлором и нитратами, присутствующими в воде, в результате чего они перестают действовать.
Некоторые виды микроорганизмов могут стать устойчивыми к ионам серебра. Они могут удалять металл из своих систем или превращать его в менее токсичный продукт. Эти микроорганизмы могут стать устойчивыми к ионизации медь-серебро.
Несмотря на то, что предполагается, что бактерии Legionella могут вырабатывать устойчивость к ионизации медь-серебро, это дезинфицирующее средство по-прежнему эффективно для дезактивации Legionella.
Для эффективного уничтожения патогенных микроорганизмов во всей системе водоснабжения должны присутствовать ионы меди и серебра. Когда система мало используется и поток воды довольно медленный, или когда в системе есть тупиковые точки, это может вызвать проблемы при дезинфекции.
Каковы последствия для здоровья ионизации медь-серебро?
Недостаточно данных о возможных последствиях для здоровья при длительном воздействии ионизации медь-серебро. Мало что известно об общем влиянии ионизации медь-серебро на здоровье.
Мало что известно об общем влиянии ионизации медь-серебро на здоровье.
Законодательство по ионизации медь-серебро
ЕС
Европейский Союз не устанавливает никаких стандартов относительно концентрации серебра в воде. Медь, однако, имеет максимальное значение 20 мкг/л, потому что она разъедает водопроводные сооружения. Концентрацию меди следует измерять в кранах. (Директива ЕС по питьевой воде 98/83/ЕС, 1998 г.)
ВОЗ
ВОЗ не устанавливает каких-либо стандартов, касающихся концентрации серебра в качестве дезинфицирующего средства для питьевой воды, поскольку организация сочла имеющиеся данные недостаточными для порекомендуйте стандарт здоровья. (ВОЗ, Руководство по качеству питьевой воды, издание 3е)
США
В США установлено максимальное значение 1 мг/л меди и максимальное значение 0,1 мг/л серебра. (EPA, Национальные правила вторичной питьевой воды, 2002 г.)
Как контролируется ионизация меди и серебра?
При применении ионизации медь-серебро необходимо вести журнал всей системы. Анализ воды и тесты должны быть проведены для подтверждения эффективности системы, поскольку речь идет об альтернативном дезинфицирующем средстве. Первый раунд анализа проводится перед применением ионизации медь-серебро. Измеряют концентрации меди и серебра в воде и определяют количество бактерий легионеллы и число аэробного роста при 22 ˚C и 37 ˚C. Когда система установлена, результаты анализа воды должны проверяться и сообщаться ежемесячно.
Анализ воды и тесты должны быть проведены для подтверждения эффективности системы, поскольку речь идет об альтернативном дезинфицирующем средстве. Первый раунд анализа проводится перед применением ионизации медь-серебро. Измеряют концентрации меди и серебра в воде и определяют количество бактерий легионеллы и число аэробного роста при 22 ˚C и 37 ˚C. Когда система установлена, результаты анализа воды должны проверяться и сообщаться ежемесячно.
Дополнительная информация по обеззараживанию воды?:
Введение обеззараживание воды Необходимость очистки воды История обработки питьевой воды
Что такое обеззараживание воды? Необходимость дезинфекции питьевой воды История дезинфекции воды Заболевания, передающиеся через воду Факторы, влияющие на дезинфекцию Условия дезинфекции воды Регулирование дезинфекции питьевой воды ЕС США
Обработка плавательных бассейнов Загрязнение плавательных бассейнов Дезинфекция плавательных бассейнов Дезинфекция и здоровье плавательных бассейнов
Вода градирни Загрязнение воды градирни Дезинфекция воды градирни Законодательство о воде градирни
Химические дезинфицирующие средства Хлор Гипохлорит натрия Хлорамины Двуокись хлора Медь ионизация серебра Перекись водорода Бром Пероксон Перуксусная кислота
Побочные продукты дезинфекции Типы побочных продуктов дезинфекции Исследование воздействия дезинфекции на здоровье побочные продукты
Опасность токсичных ионов поливной воды
Система хлорирования
Серебро замечено в связи с повышением цен на медь
Я полагаю, что причина в том, что как медь, так и серебро пользуются все большим спросом в экологически чистых источниках энергии. Более тесная корреляция видна ниже на линейных графиках аналогичной формы для 6-месячного спот серебра и меди.
Более тесная корреляция видна ниже на линейных графиках аналогичной формы для 6-месячного спот серебра и меди.
Это то, что мы в AOTH обязательно будем смотреть.
Цена на серебро за шесть месяцев Цена на медь за шесть месяцев Серебро и медьЗа последние несколько месяцев мы покрыли рост цен на промышленные металлы, такие как медь, никель, цинк и свинец.
Источник: KitcoПоскольку страны продолжают вакцинировать свое население, экономика возвращается к росту, стимулируя спрос на автомобили, электронику, одежду и инфраструктуру для обновления городов. Это означает больше никеля для конструкций из нержавеющей стали, оцинкованной стали (цинка) для подвесных мостов, меди для электропроводки и водопровода, свинца для аккумуляторов и т. д.
По данным ОЭСР, в этом году ожидается рост мировой экономики на 5,8%. , резкий пересмотр в сторону повышения по сравнению с декабрьской оценкой 2020 года в 4,1%.
Экономика США находится на подъеме из-за массивных федеральных стимулов, увеличения числа вакансий и роста потребительских расходов, что привело к тому, что спрос на многие товары и услуги превысил возможности компаний по их поставке.
Добавьте к этому связанные с вирусом узкие места в цепочках поставок, в том числе нехватку рабочей силы в некоторых отраслях, что приводит к росту заработной платы, и у нас самая высокая инфляция более чем за десятилетие — 5,4% в июне и июле. Прибыль корпораций США выросла до нового рекордного уровня во втором квартале, а рост ВВП во втором квартале увеличился до 6,6 % по сравнению с 6,5 %, о которых сообщалось в июле.
Фундаментальные бычьи рынки сырьевых товаров подтолкнули индекс Bloomberg Commodity Spot к 10-летнему максимуму, и индекс близок к рекорду, установленному в 2011 году, пику последнего суперцикла сырьевых товаров. Материалы с отличными ценовыми характеристиками включают медь, которая в мае достигла рекордно высокой отметки в 10 460 долларов за тонну (4,74 доллара за фунт) и продолжает торговаться выше 4,00 долларов; сырая нефть марки Brent, которая с ноября 2020 года подорожала вдвое; и ряд сельскохозяйственных товаров, таких как кукуруза, соевые бобы, кофе и пшеница.
С экономической точки зрения это время перехода, поскольку технологии старой школы, такие как угольные электростанции и потребляющие газ легковые и грузовые автомобили, уступают место электромобилям и конкурентоспособным по цене возобновляемым источникам энергии, в основном ветровой и солнечной.
Некоторые, в том числе инвестиционный банк Goldman Sachs, указывают на формирование нового суперцикла сырьевых товаров, обусловленного не ископаемым топливом и подъемом Китая, как это произошло в 2000-х годах, а так называемыми «зелеными» металлами, необходимыми для электрификации. и обезуглерожить, чтобы избежать наихудших последствий изменения климата.
Согласно недавнему отчету Wood Mackenzie, горнодобывающим компаниям потребуется потратить 1,7 триллиона долларов в течение следующих 15 лет, чтобы обеспечить достаточное количество лития, графита, кобальта, меди и никеля для перехода к низкоуглеродному миру.
Консультационная компания по сырьевым товарам сообщает, что достижение новых целей по выбросам, установленных такими странами, как Канада, США, Великобритания, Китай и Япония, будет означать широкомасштабное внедрение электромобилей, возобновляемых источников энергии и электропередачи, все из которых потребуют большого количества металла.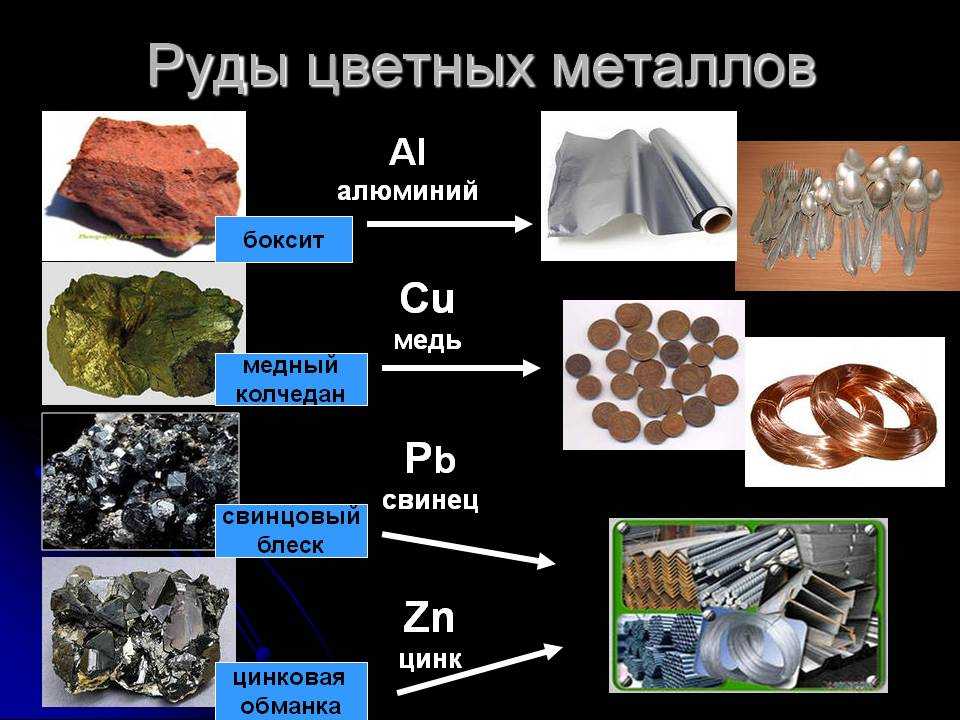 .
.
Двумя металлами, иллюстрирующими этот сдвиг, являются серебро и медь.
Спрос на сереброЗначительная часть стоимости серебра определяется его промышленным спросом и фундаментальными показателями предложения. По оценкам, около 60% серебра используется в промышленных целях, таких как солнечные панели и электроника, и только 40% остается для инвестиций.
Применение серебра, данные по состоянию на январь 2020 г. Источник: GFMS Definitive, Metals Focus, The Silver Institute, UBSВсе больше и больше серебра требуется для использования в солнечных фотоэлектрических (PV) элементах, поскольку страны движутся к внедрению возобновляемых источников энергии. источники.
Как металл с самой высокой электро- и теплопроводностью, серебро идеально подходит для солнечных панелей. Серебряная паста в солнечных элементах обеспечивает движение электронов в хранилище или к потреблению, в зависимости от необходимости. Подсчитано, что только для этой цели в год расходуется около 100 миллионов унций серебра.
Ожидается, что в ближайшие годы эта цифра вырастет, поскольку продолжающийся рост спроса на электроэнергию и стремление к возобновляемым источникам энергии указывают на растущее проникновение солнечной энергии.
Историческая и прогнозная солнечная мощность по регионам, 2006-2025 гг.Источник: Институт серебра и CRU Consulting
Согласно одному из прогнозов, ежегодное потребление серебра в солнечной промышленности вырастет на 85% до примерно 185 миллионов унций в течение десятилетия, согласно отчету BMO Capital Markets.
Год стал рекордным, несмотря на пандемию. Солнечная промышленность США, вероятно, станет одним из ведущих драйверов спроса на серебро. В 2020 году количество установок выросло на 43% по сравнению с аналогичным периодом прошлого года, достигнув рекордных 19.2 гигаватт новой мощности. Согласно отчету Ассоциации производителей солнечной энергии и Wood Mackenzie, к 2030 году количество солнечных установок вырастет в четыре раза по сравнению с нынешним уровнем.
Поскольку большинство солнечных панелей, используемых в США, поступают из Азии, недавний запрет администрации Байдена на солнечные панели из Китая из-за проблем с принудительным трудом ставит солнечную промышленность США в безвыходное положение, что потенциально может вызвать всплеск разведки серебра внутри страны.
Технология 5G должна стать еще одним крупным драйвером спроса на серебро.
Среди компонентов 5G, требующих серебра, полупроводниковые микросхемы, кабели, микроэлектромеханические системы (MEMS) и устройства с поддержкой Интернета вещей (IoT).
Институт серебра ожидает, что спрос на серебро для 5G вырастет более чем в два раза, с нынешних ~7,5 млн унций, примерно до 16 млн унций к 2025 году и до 23 млн унций к 2030 году, что представляет собой увеличение на 206% по сравнению с текущими уровнями.
Третьим основным драйвером промышленного спроса на серебро является автомобильная промышленность.
Серебро также содержится во многих компонентах автомобилей, включая электронные системы транспортных средств, и, несмотря на то, что оно не используется в батареях, его превосходные электрические свойства затрудняют замену в широком и растущем диапазоне автомобильных приложений.
. В недавнем отчете Института серебра говорится, что аккумуляторные электромобили содержат в два раза больше серебра, чем автомобили с ДВС, а для автономных транспортных средств требуется еще больше из-за их сложности. Ожидается, что зарядные станции и зарядные станции также будут требовать гораздо больше серебра.
По данным SI, использование серебра на автомобильном рынке резко возрастет в 2021 году и составит чуть более 60 млн унций. По оценкам, спрос сектора на серебро вырастет до 88 млн унций через пять лет по мере ускорения перехода от традиционных легковых и грузовых автомобилей к электромобилям. По другим оценкам, к 2040 году электромобили будут потреблять почти половину годового предложения серебра.
Наконец, спрос на серебро для «печатной и гибкой электроники», по прогнозам, вырастет на 54% в течение следующих девяти лет, увеличившись с 48 млн унций в 2021 году до 74 млн унций в 2030 году, что означает потребление 615 млн унций в течение этого периода времени.
В недавнем выпуске новостей Института Серебра они описываются как «опорные» в различных электронных продуктах, включая датчики, которые измеряют все, от температуры, давления и движения до влажности, относительной влажности и угарного газа. Они также используются в медицинских устройствах, мобильных телефонах, дисплеях бытовой техники и бытовой электронике.
Печатная и гибкая электроника спрос на рынке серебра.Источник: Precious Metals Commodity Management LLC.
Ранее в этом году в всеобъемлющем отчете Sprott под названием «Будущее чистой энергии серебра» было обнаружено, что три области растущего спроса на серебро — солнечная, автомобильная и 5G — потенциально составляют более 125 миллионов унций в 10 лет. Это не включает рост инвестиционного спроса на серебро, которое, как уже упоминалось, составляет около 40% использования.
Общий объем добытого серебра в 2020 году составил 25 000 тонн или 881,8 млн унций.
Более широкое использование серебра в промышленных целях, а также спрос на драгоценные металлы в качестве убежища во время пандемии, которая случается раз в столетие, в прошлом году значительно подняли цены на серебро.
Спот-серебро подскочило до 28,32 доллара за унцию в августе 2020 года, что стало лучшим показателем за семь лет, завершив год впечатляющим ростом на 47%, более чем вдвое увеличив прирост золота на 25%.
Серебро выросло на 47,8% в 2020 году. Источник:Bloomberg через Sprott Insights
Несмотря на то, что цены на серебро снизились за последний год, прогноз положительный благодаря сочетанию сильных факторов монетарного и промышленного спроса.
Согласно 2021 World Silver Survey, мировой спрос на серебро в этом году, как ожидается, превысит предложение на 7% (+8% предложения против +15% спроса).
Спрос будет обусловлен инвестициями в физическое серебро промышленного и инвестиционного класса в результате восстановления экономики после пандемии, а также активными покупками монет и слитков, основанными на прибыли 2020 года.
Предложение серебраБычий сценарий серебра также имеет измерение предложения.
Серебро уязвимо к перебоям в поставках, в большей степени, чем золото, потому что чисто серебряных рудников относительно немного.
Только около 30% годового предложения приходится на первичные серебряные рудники. Более двух третей приходится на месторождения полиметаллических руд, включая свинцово-цинковые и медные рудники.
В 2020 году добыча серебра упала больше всего за десятилетие из-за закрытия ряда шахт, связанных с коронавирусом, в Латинской Америке, где производится большая часть серебра. Он упал на 5,9% до 784,4 млн унций, по данным World Silver Survey 2021 года.
«Самородное серебро», находящееся в земной коре само по себе, относительно редко. Чаще всего его добывают вместе с золотом или как побочный продукт цинково-свинцовой руды.
В то время как большая часть добытого золота все еще существует, либо отлита в качестве ювелирных изделий, либо переплавлена в слитки и хранится для инвестиционных целей, этого нельзя сказать о серебре. Как уже упоминалось, по оценкам, около 60% серебра используется в промышленности, и только 40% остается для инвестиций. Из 60% отходов, используемых в промышленности, почти 80% попадает на свалки.
Несмотря на то, что серебра примерно в 17,5 раз больше, чем золота в земной коре, серебро и золото имеют примерно одинаковое количество, ~ 2,5 миллиарда унций, доступных для инвестиционных целей.
Однако, поскольку золото используется в промышленности очень мало, оно торгуется как инвестиционный товар — цены меняются вверх и вниз в зависимости от таких факторов, как курс доллара США, инфляция, процентные ставки и доходность государственных облигаций.
Для сравнения, серебро требует относительно небольшой суммы для инвестиций, всего 40% предложения. Поскольку более половины предложения приходится на промышленное применение, серебро обычно торгуется скорее как промышленный металл, чем как инвестиционный товар.
Это также объясняет волатильность серебра. Поскольку инвестиционный рынок серебра очень мал (60% занято в промышленных целях), цены резко колеблются вверх и вниз при относительно небольших объемах. По этой причине инвесторы прозвали серебро «дьявольским металлом».
Сможет ли добытое серебро удовлетворить взрывной спрос на серебро, описанный в предыдущем разделе? Мне не нравятся его шансы. В предыдущей статье мы показали, что уже достигли пика добычи серебра.
В 2020 году добыча серебра упала больше всего за десятилетие из-за закрытия нескольких шахт из-за коронавируса в Латинской Америке, где добывается большая часть серебра. По данным World Silver Survey 2021, он упал на 5,9% до 784,4 млн унций.
Однако в результате более высоких цен на серебро во второй половине года мировая переработка серебра выросла на 7%, достигнув 7-летнего максимума в 182,1 млн унций. Металлолом, полученный от конечного промышленного использования, также вырос в прошлом году.
В совокупности, таким образом, общее предложение серебра достигает 966,5 млн унций в 2020 году.
Как насчет спроса? Согласно World Silver Survey, после роста в течение двух лет в 2020 году спрос на серебро ослаб на 10%, при этом большая часть потерь связана с падением промышленного спроса в результате пандемии.
Промышленное производство упало до пятилетнего минимума в 2020 году, в результате чего общий спрос на серебро составил 896,1 млн унций.
Здесь нет пикового серебра, верно? Спрос в 896,1 млн унций более чем удовлетворяется предложением в 966,5 млн унций.
Но если исключить из уравнения переработку, то есть 182,1 млн унций, мы получим совершенно другой результат. т.е. 896,1 млн унций спроса минус 784,4 млн унций горнодобывающего производства оставляет дефицит в размере 111,7 млн унций .
Это важно, потому что это говорит о том, что, несмотря на то, что промышленный спрос на серебро, который составляет около 60% использования, в прошлом году резко упал из-за пандемии, общий спрос, промышленный плюс инвестиции, был выше, чем добыча полезных ископаемых (которые, по общему признанию, был плохой год из-за простоев) примерно на 100 млн унций.
Только за счет переработки 182,1 млн унций можно удовлетворить спрос на серебро в 2020 году.
Любопытно, что при подсчете металлов, необходимых для перехода к экологически чистой энергии и электрификации, часто упускается из виду медь. Переход от ископаемого топлива к зеленой энергии невозможен без меди, которая не имеет замены для использования в электромобилях, ветровой и солнечной энергии.
Широкое использование меди в строительной электропроводке и трубопроводах, а также в линиях электропередачи делает ее ключевым металлом для обновления гражданской инфраструктуры.
В отчете Roskill прогнозируется, что к 2035 году общее потребление меди превысит 43 миллиона тонн, что обусловлено ростом населения и ВВП, урбанизацией и спросом на электроэнергию. Общая мировая добыча полезных ископаемых в 2020 году составила всего 20 млн тонн.
Производство меди в 2020 году в миллионах тонн. Источник: USGS Продолжающееся движение в сторону электромобилей — огромный медный драйвер. Электромобили используют примерно в четыре раза больше меди, чем обычные автомобили с двигателем внутреннего сгорания.
Электрификация включает не только автомобили, но и грузовики, поезда, автофургоны, строительную технику и двухколесные транспортные средства, такие как электровелосипеды и скутеры.
В последнее время медь используется в электромобилях и их зарядных станциях, возобновляемых источниках энергии, особенно в фотогальванических элементах, используемых для солнечной энергии, и ветряных турбинах. Основной металл также является ключевым компонентом глобального построения 5G. Несмотря на то, что 5G является беспроводной сетью, для ее развертывания требуется гораздо больше оптоволоконных и медных кабелей для подключения оборудования, расположенного внутри здания.
Поставка медиНо этот мчащийся грузовой поезд спроса на медь вот-вот врежется в неподвижный объект кризиса предложения.
Запасы некоторых крупнейших медных рудников истощаются; им приходится резко замедлять производство из-за крупных капиталоемких проектов по переводу производства с открытого карьера на подземный. Примеры включают Грасберг в Индонезии, второй по величине медный рудник в мире. Рудник начинался как большой открытый карьер, но после десятилетий его добычи легкодоступная руда исчезла, и ожидается, что будущая добыча будет осуществляться из глубокого пещерного месторождения, известного как зона уровня глубокой мельницы. Экспорт медного концентрата резко сократился, поскольку операции переходят с открытого карьера на подземный.
Примеры включают Грасберг в Индонезии, второй по величине медный рудник в мире. Рудник начинался как большой открытый карьер, но после десятилетий его добычи легкодоступная руда исчезла, и ожидается, что будущая добыча будет осуществляться из глубокого пещерного месторождения, известного как зона уровня глубокой мельницы. Экспорт медного концентрата резко сократился, поскольку операции переходят с открытого карьера на подземный.
В Чили расширение Чукикамата стоимостью 5 миллиардов долларов, а также перевод операций с открытого карьера на подземный, займет пять лет, чтобы достичь полной производительности в 300 000 тонн в год — это не новое производство.
В 2019 году поставки из Escondida компании BHP пострадали из-за того, что операции переместились под землю. Ожидается, что крупнейшему медному руднику на планете потребуется до 2022 года, чтобы восстановить полную производительность, опять же, не новое производство.
Эти сокращения имеют важное значение для мирового рынка меди, поскольку Чили является крупнейшим производителем меди в мире, поставляя 30% мирового красного металла. Вдобавок ко всему, содержание меди в Чили снизилось примерно на 25% за последнее десятилетие, в результате чего на рынок поступило меньше руды.
Вдобавок ко всему, содержание меди в Чили снизилось примерно на 25% за последнее десятилетие, в результате чего на рынок поступило меньше руды.
На самом деле мир может столкнуться с большим дефицитом в следующем десятилетии, если медная горнодобывающая промышленность не сделает крупных инвестиций.
По данным CRU Group через Bloomberg, отрасли необходимо потратить более 100 миллиардов долларов, чтобы закрыть потенциальный ежегодный дефицит предложения в размере 4,7 миллиона тонн к 2030 году, поскольку чистый энергетический и транспортный секторы требуют гораздо более высокого спроса.
Чтобы закрыть этот пробел, потребуется построить восемь «Эскондид», что соответствует крупнейшему в мире медному руднику в Чили.
StoneX, компания, предоставляющая финансовые услуги из списка Fortune 100, прогнозирует, что спрос на медь в 2021 году вырастет примерно на 5% по сравнению с прошлым годом, в результате чего глобальное предложение меди сместится с небольшого профицита в 2020 году на более чем 200 000 тонн дефицита.
Одна из проблем с медью заключается в том, что ее трудно найти в достаточно больших количествах близко к поверхности, где ее добыча экономически выгодна. Кроме того, требуется много лет, чтобы ввести в эксплуатацию месторождение меди, особенно в таких странах, как США и Канада, где горняки сталкиваются со строгими правилами выдачи разрешений, что может привести к задержкам. По данным Bloomberg Intelligence, среднее время от первого открытия до первого металла увеличилось на четыре года по сравнению с предыдущими циклами, до почти 14 лет.
«Увеличение технической сложности и задержек с утверждением может привести к нехватке готовых проектов в 2025–2030 годах», — написали в недавнем отчете аналитики Bloomberg Intelligence Грант Спорре и Эндрю Косгроув.
По данным Goehring & Rozencwajg Associates, количество новых открытий мирового класса, которые появятся в сети в этом десятилетии, «существенно сократится, а проблемы истощения на существующих рудниках ускорятся».
Кроме того, геологические ограничения, окружающие месторождения медного порфира, которые понимают лишь немногие отраслевые аналитики, не говоря уже об инвесторах, будут способствовать возникновению проблем, говорится в отчете компании с Уолл-стрит за 2021 год.
К 2015 г. основное содержание в отрасли было уже на 30% ниже, чем в 2001 г., а капитальные затраты на тонну годового производства за это время выросли в четыре раза — оба признака истощения.
По данным G&R, отрасль «приближается к нижним пределам бортового содержания», и расширение существующих месторождений больше не является жизнеспособным решением.
«Если это так, то мы быстро приближаемся к точке, когда запасы вообще нельзя будет выращивать», — заключал отчет.
Можем ли мы столкнуться с пиковой медью? Ну да. На самом деле мы доказали это.
Определение пика меди (или пика чего-либо еще) – это когда производство перестает расти. Если запасы не увеличиваются, в конечном итоге нечего будет добывать. Производство должно будет достичь пика, а затем снизится.
Производство должно будет достичь пика, а затем снизится.
Это само по себе шокирующее откровение. Это говорит о том, что медедобывающая промышленность зашла настолько далеко, насколько это возможно, в дальнейшем снижении бортового содержания, а это означает, что больше невозможно добавлять большие объемы запасов, особенно с учетом того, что месторождения порфира обычно имеют низкое содержание, от 0,3 до 0,4. Диапазон % Cu. Отрасль, на которую ссылается отчет, приближается к своему пику производства:
Согласно нашим моделям, в этом десятилетии рост предложения медных рудников прекратится. Количество новых открытий мирового класса, открываемых онлайн, существенно сократится, а проблемы истощения на существующих рудниках обострятся. Кроме того, геологические ограничения вокруг медно-порфировых месторождений, из которых мы получаем 80% нашей меди, – предмет, который понимают немногие аналитики и инвесторы, – усугубят проблемы.
Ожидается, что увеличение запасов новых и старых месторождений в течение десятилетия разочарует, согласно отчету. По оценкам S&P Global Market Intelligence, новые открытия в среднем составляли почти 50 млн тонн в год в период между 1990 и 2010. С тех пор новые открытия упали на 80% и составили всего 8 млн тонн в год.
По оценкам S&P Global Market Intelligence, новые открытия в среднем составляли почти 50 млн тонн в год в период между 1990 и 2010. С тех пор новые открытия упали на 80% и составили всего 8 млн тонн в год.
Компания Goehring & Rozencwajg прогнозирует, что стагнация поставок медных рудников, уже столкнувшаяся с высоким спросом, подтолкнет цены на медь намного выше, чем кто-либо ожидает.
«Предыдущий бычий рынок меди имел место между 2001 и 2011 годами, когда цены выросли в семь раз: с 0,60 доллара до 4,62 доллара за фунт. Сегодня фундаментальные показатели еще более оптимистичны», — заявляет фирма, добавляя:
«Мы не удивимся, увидев, что цены на медь снова вырастут как минимум в семь раз, прежде чем этот бычий рынок закончится. Используя 1,95 доллара в качестве отправной точки, мы ожидаем, что цены на медь потенциально достигнут пика около 15 долларов за фунт во второй половине этого десятилетия».
Спот-медь почти удвоилась между пандемическим минимумом в марте 2020 года и мартом 2021 года; он вырос на 21% с начала года.
Основными факторами роста цен являются увеличение заказов в Китае на фоне сильного производственного сектора; ожидания возвращения к росту после катастрофического 2020 года; триллионы обещанных расходов на зеленую и асфальтированную инфраструктуру, особенно в США, Европе и Китае; и перебои с поставками в результате закрытия шахт из-за вируса.
Золото и серебро Серебро как деньгиСеребро в настоящее время в основном используется в промышленности, но так было не всегда. На протяжении большей части 19 века серебро играло важную роль в денежной системе США. До этого серебряные монеты использовались тысячи лет по всему миру.
Около 700 года до н. э. серебро стало использоваться в качестве валюты – роль, которую оно сохранило почти во всех древних и современных культурах. Около 85% мирового серебра было добыто на рудниках в Боливии, Перу и Мексике в период с 1500 по 1800 год. Монета драхма древней Греции, римский денарий и британский фунт стерлингов содержали определенное количество серебра.
Многие ученые считают, что торговля серебром положила начало мировой экономике, а один историк отмечает, что серебро «обошло весь мир и заставило мир вращаться».
Драгоценный металл оставил неизгладимый след в истории Китая, помогая как построить империю, так и разрушить ее.
Серебро способствовало «экономическому чуду» в Поднебесной после налоговой реформы единого кнута.
Ремесленники начали разрабатывать и производить товары для иностранных покупателей в Европе и Испанской Америке (к этому времени испанцы также завоевали Мексику) — в прелюдии к тому, что должно было произойти столетия спустя, когда Китай стал «мастерской мира».
Но не только серебро привело династию Мин к новым высотам. За океаном, в Новом Свете, начинала формироваться ранняя глобальная экономика.
В 1573 году монетный двор, открывшийся в Потоси, на территории современной Боливии, стал бьющимся сердцем мировой торговли, производя первую глобальную валюту, которая стала известна как «Восьмерки».
Сначала использовавшиеся в испанских колониях, со временем восьмерки, или испанский доллар, стали приниматься в качестве валюты во всех уголках мира.
(Монеты назывались так потому, что для получения сдачи их буквально разрезали на восемь частей или кусочков. Когда что-то стоило «два бита», это означало четверть испанского доллара или две восьмерки. оставались законным платежным средством в Соединенных Штатах до принятия Закона о чеканке монет 1857 г.)
Впервые в истории страны стали соединяться, связываться вместе одним решающим элементом: серебром.
Серебряный песо Филиппа V Испанского, Монетный двор Мексики. г. Когда страны перешли на бумажные деньги, они привязали одну денежную единицу к весу в золоте, система, которая стала известна как золотой стандарт. Великобритания первой приняла золотой стандарт в 1717 году, и вскоре этому примеру последовали и другие страны. В 19 веке его использовали все страны, кроме Китая. Внутренние валюты свободно конвертировались в золото по фиксированной цене, и не было никаких ограничений на ввоз или вывоз золота.
В 1784 году Томас Джефферсон сказал: «Если мы решим, что нашей единицей измерения будет доллар, мы должны будем с точностью сказать, что такое доллар».
Отцы-основатели последовали его совету и в 1792 году определили один доллар — местную версию популярного испанского доллара — как 371 гран серебра. Биметаллический золотой и серебряный стандарт для недавно отчеканенной национальной валюты оценивал золото в 19,30 доллара за унцию.
В 1873 году Конгресс США исключил серебряный доллар из списка разрешенных монет (так называемое «Преступление 73-го»), что спровоцировало подъем Движения за свободное серебро.
Как объясняет Википедия, «сильвериты» выступали за экспансионистскую денежно-кредитную политику, предполагающую неограниченную чеканку серебра в деньги по требованию, в отличие от строгого соблюдения тщательно фиксированной денежной массы, заложенной в золотом стандарте.
В число сторонников входили добытчики серебра на Западе; фермеры, которые считали, что расширенная валюта помимо золота и доллара США, ставшего законным платежным средством в 1862 году, повысит цены на урожай; и должники, которые надеялись, что это позволит им легче выплатить свои долги.
Приверженцы видели, что серебро занимает важное место в биметаллической денежной системе, согласно которой серебряные доллары будут фиксированы в соотношении 16:1 по отношению к долларовым монетам, сделанным из золота.
Первым успехом движения стал Закон Блэнда-Эллисона 1878 года. Закон восстановил серебряный доллар в качестве законного платежного средства и потребовал, чтобы Казначейство США ежемесячно покупало серебро на сумму от 2 до 4 миллионов долларов и чеканило его в доллары.
Когда в 1887 году цены на землю и сельскохозяйственные угодья рухнули, фермеры настаивали на неограниченной чеканке серебряных монет. Закон Шермана о закупке серебра 1890 г. увеличил ежемесячные закупки серебра правительством на 50%, но в последующие годы, как поясняет Британская энциклопедия, сочетание факторов давления резко сократило количество золота в Казначействе США, спровоцировав панику весной 1893 г. Консерваторы обвинили закон Шермана в том, что он стал причиной паники, и летом 1893 г. Конгресс отменил этот закон. Фермеры Юга и Запада осудили эту акцию, обвинили жадность восточных банкиров в депрессивном состоянии экономики и возобновили свои требования неограниченной чеканки серебра.
Конгресс отменил этот закон. Фермеры Юга и Запада осудили эту акцию, обвинили жадность восточных банкиров в депрессивном состоянии экономики и возобновили свои требования неограниченной чеканки серебра.
Это было важной целью Популистской партии на выборах 1892 года, а в 1896 году демократы, несмотря на сильную оппозицию со стороны президента Гровера Кливленда, сделали неограниченную чеканку серебряных монет основным пунктом своей платформы. Затем они выдвинули Уильяма Дженнингса Брайана, самого эффективного борца за бесплатное серебро (см. Речь о Кресте золота), своим кандидатом в президенты. Республиканцы победили на выборах, и в 1900 году республиканское большинство в Конгрессе приняло Закон о золотом стандарте, который сделал золото единственным стандартом для всей валюты.
Движение за бесплатное серебро вызвало разногласия, поскольку оно использовало классовые различия и разрыв между владельцами и рабочими. В статье Википедии
Бесплатное серебро все больше ассоциировалось с популизмом, профсоюзами и борьбой простых американцев против банкиров, железнодорожных монополистов и грабителей эпохи капитализма позолоченного века и именовалось «народными деньгами» ( в отличие от основанной на золоте валюты, которую народники изображали как деньги «эксплуатации» и «угнетения»)…
Дебаты о «бесплатном серебре» столкнули финансовый истеблишмент Северо-Востока, выступавший за золото, наряду с железными дорогами, фабриками и бизнесменами, которые были кредиторами, извлекающими выгоду из дефляции и погашения кредитов ценными золотыми долларами, против фермеров, которые выгоду от более высоких цен на свой урожай и облегчения кредитного бремени. Бесплатное серебро было особенно популярно среди фермеров в Пшеничном и Хлопковом поясах (Глубокий Юг), а также среди добытчиков серебра на Западе. Он не имел большой поддержки среди фермеров на Северо-Востоке и в Кукурузном поясе (восточная часть Среднего Запада).
Бесплатное серебро было особенно популярно среди фермеров в Пшеничном и Хлопковом поясах (Глубокий Юг), а также среди добытчиков серебра на Западе. Он не имел большой поддержки среди фермеров на Северо-Востоке и в Кукурузном поясе (восточная часть Среднего Запада).
Бесплатное серебро стало важным вопросом для демократов на президентских выборах 1896 и 1900 годов, хотя дважды терпело поражение. Республиканцы в то время обычно предпочитали «надежные деньги» в золоте (за исключением недолговечной Серебряной республиканской партии во главе с сенатором Генри Теллером от Колорадо) демократам, которые, как правило, больше поддерживали серебро.
Согласно Википедии, последующее объединение популистской партии бесплатного серебра с Демократической партией переместило последнюю от поддержки золотого стандарта, которая была отличительной чертой администрации Кливленда , к позиции бесплатного серебра, воплощенной 1896 кандидат в президенты Уильям Дженнингс Брайан в своей речи «Золотой крест». Кандидатуру Брайана в 1896 году поддержали популисты и «серебряные республиканцы», а также большинство демократов.
Кандидатуру Брайана в 1896 году поддержали популисты и «серебряные республиканцы», а также большинство демократов.
Проблема заключалась в том, что поддержит американскую валюту. Было два варианта: золото (разыскивается Голдбагами и Уильямом МакКинли) и серебро (разыскивается Сильверитами и Брайаном).6, затем исчез после провала кампании. В их число входили Ассоциация защиты серебра свободных людей, Серебряные рыцари Америки и Патриоты Америки.
Источник: Библиотека Конгресса Отношение золота к серебруЦены на золото и серебро часто сравнивают, чтобы понять, в каком направлении движется каждый из них. Отношение золота к серебру — это количество серебра, которое можно купить за унцию золота. Просто разделите текущую цену золота на цену серебра, чтобы найти соотношение.
Когда золото переоценено по сравнению с серебром, инвесторы пользуются возможностью арбитража, продавая часть своих золотых запасов для покупки серебра. Обратное происходит, когда серебро переоценено по сравнению с золотом. В этой ситуации инвесторы в драгоценные металлы продают серебро, чтобы купить золото.
Обратное происходит, когда серебро переоценено по сравнению с золотом. В этой ситуации инвесторы в драгоценные металлы продают серебро, чтобы купить золото.
Чем выше число, тем более недооценено серебро.
12 июня 2019 г. соотношение золота и серебра достигло 26-летнего максимума, преодолев отметку в 90 унций, то есть превысив 90 унций серебра для покупки одной унции золота. Чем выше число, тем более недооценено серебро или, другими словами, тем дальше золото отдаляется от серебра, оцениваемого в долларах за унцию.
Текущее отношение золота к серебру, 74:1, выше, чем историческое соотношение 50-60 унций серебра к одной унции золота, а это означает, что серебро несколько недооценено по сравнению с золотом. Это означает, что инвестор с унцией золота может продать свое золото за 74 унции серебра.
Иногда серебро реагирует на изменения цены золота, а иногда оно прыгает вперед, но это почти как если бы золото тянуло за собой серебро, хочет оно уйти или нет. В качестве доказательства посмотрите на исторический график серебра по сравнению с графиком золота. Схема в обоих очень похожа.
Схема в обоих очень похожа.
Как указано выше, корреляция между золотом и серебром с 1975 года составляет 0,8876. 10-летний коэффициент корреляции равен 0,7511 . Однако в этом году корреляция значительно снизилась до 0,1959.
Несмотря на более слабую корреляцию между ценами на серебро и золото в этом году, всего 0,19 по сравнению с обычными 0,88, серебро последовало за золотом в июне после того, как заседание ФРС США предположило, что ФРС может сократить свою ежемесячную программу покупки облигаций на 120 миллиардов долларов. Акции компаний, занимающихся добычей серебра, особенно производителей, состояние которых тесно связано с ценой на серебро, претерпели коррекцию.
Они остаются сильно недооцененными. Насколько недооценен?
Комментатор по драгоценным металлам Адам Гамильтон недавно подсчитал цифры. Анализируя прибыль во втором квартале от 15 ведущих производителей серебра в ведущем ETF SIL Global X Silver Miners, Гамильтон обнаружил, что производство выросло на 16,9% в годовом исчислении, увеличив прибыль во втором квартале на поразительные 472,9%! Он пишет:
Такая невероятно высокая прибыль в условиях падения цен на акции вызвала чрезвычайно низкие оценки в некоторых из этих серебряных рудников.

