Смесь цинка и меди: Сплав меди с цинком – как называется такой состав? + Видео
alexxlab | 05.03.2023 | 0 | Разное
Содержание цинка, меди, кадмия и свинца в молочных смесях и грудном молоке жительниц г. Омска
Please use this identifier to cite or link to this item: http://elib.usma.ru/handle/usma/1310
| Title: | Содержание цинка, меди, кадмия и свинца в молочных смесях и грудном молоке жительниц г. Омска |
| Other Titles: | The contents of zinc, copper, cadmium and lead in milk formula and breast milk of residents of the city of Omsk |
| Authors: | Krasovskaya, M. A. Красовская, М. А. |
| Issue Date: | 2019 |
| Publisher: | Федеральное государственное бюджетное образовательное учреждение высшего образования «Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации |
| Citation: | Красовская, М. А. Содержание цинка, меди, кадмия и свинца в молочных смесях и грудном молоке жительниц г. Омска / М. А. Красовская // Вестник Уральского государственного медицинского университета. — 2019. — № 1. — С. 49-51. Омска / М. А. Красовская // Вестник Уральского государственного медицинского университета. — 2019. — № 1. — С. 49-51. |
| Abstract: | In studies to determine the content of essential metals zinc and copper and toxic heavy metals cadmium and lead in milk mixtures and women’s breast milk residents of the city of Omsk were identified milk mixtures with a content of lead and cadmium exceeding the maximum permissible concentration, and a mixture with the lowest content of cadmium and lead. The optimal amount of zinc and copper contained in the milk mixture Similac (Denmark). In women’s breast milk of Omsk residents the content of heavy metals did not exceed the maximum permissible concentration and is comparable with the level of these metals in milk mixtures. The milk mixture with the optimal content of zinc and copper, as well as the lowest content of cadmium and lead was established. В исследованиях по определению содержания эссенциальных металлов цинка и меди и токсичных тяжелых металлов кадмия и свинца в молочных смесях и женском грудном молоке жительниц города Омска были выявлены молочные смеси с содержанием свинца и кадмия, превышающим предельно допустимую концентрацию, и смесь с наименьшим содержанием кадмия и свинца.  Оптимальное количество цинка и меди содержится в молочной смеси Similac (Дания). В женском грудном молоке жительниц г. Омска содержание тяжелых металлов не превышало предельно допустимую концентрацию и сопоставимо с уровнем данных металлов в молочных смесях. Установлена молочная смесь с оптимальным содержанием цинка и меди, а также самым низким содержанием кадмия и свинца. Оптимальное количество цинка и меди содержится в молочной смеси Similac (Дания). В женском грудном молоке жительниц г. Омска содержание тяжелых металлов не превышало предельно допустимую концентрацию и сопоставимо с уровнем данных металлов в молочных смесях. Установлена молочная смесь с оптимальным содержанием цинка и меди, а также самым низким содержанием кадмия и свинца. |
| Keywords: | ZINC COPPER CADMIUM LEAD BREAST MILK MILK MIXTURES ЦИНК МЕДЬ КАДМИЙ СВИНЕЦ ГРУДНОЕ МОЛОКО МОЛОЧНЫЕ СМЕСИ |
| URI: | http://elib.usma.ru/handle/usma/1310 |
| Вестник Уральского государственного медицинского университета. 2019. №1 | |
| Appears in Collections: | Журнал “Вестник Уральского государственного медицинского университета” |
Show full item record Google Scholar
Items in DSpace are protected by copyright, with all rights reserved, unless otherwise indicated.
16 Г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.У.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
Задачи на смеси и сплавы металлов.
Задачи на смеси — очень частый вид задач в химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет. О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
Попытка записать оба вещества в одну реакцию. Получается примерно так: «Смесь оксидов кальция и бария растворили в соляной кислоте…» Уравнение реакции составляется так: СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2H2O. Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида.
 А в
приведенном уравнении предполагается,
что их равное
количество.
А в
приведенном уравнении предполагается,
что их равное
количество.Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например: Zn + 2HCl = ZnCl2 + H2 2Al + 6HCl = 2AlCl3 + 3H2 Количество цинка принимается за х, а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны.
Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов. Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто
в таких задачах используется реакция
металлов с кислотами. Для решения таких
задач надо точно знать, какие металлы
с какими кислотами взаимодействуют, а
какие — нет.
Необходимые теоретические сведения.
Способы выражения состава смесей.
ω [«омега»] = mкомпонента / mсмеси
Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
χ [«хи»] компонента А = nкомпонента А / (n(A) + n(B) + n(С))
nкомпонента А : nкомпонента В = 2 : 3
φ [«фи»] = Vкомпонента / Vсмеси
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Реакции металлов с кислотами.
С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.

При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2.
Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
Продукты восстановления азотной кислоты.
Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
NO2 | NO | N2O | N2 | NH4 NO3 |
Неактивные
металлы (правее железа) + конц. | Неактивные металлы (правее железа) + разб. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления | Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота |
Пассивация: с холодной концентрированной азотной кислотой не реагируют: Al, Cr, Fe, Be, Co. | ||||
Не реагируют с азотной кислотой ни при какой концентрации: Au, Pt, Pd. | ||||
Продукты восстановления серной кислоты.
SO2 | S | H2S | H2 |
Неактивные
металлы (правее железа) + конц. | Щелочноземельные металлы + конц. кислота | Щелочные металлы и цинк + концентрированная кислота. | Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная) |
Пассивация: с холодной концентрированной серной кислотой не реагируют: Al, Cr, Fe, Be, Co. | |||
| Не реагируют с серной кислотой ни при какой концентрации: Au, Pt, Pd. | |||
Реакции металлов с водой и со щелочами.
В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (Li, Na, K, Rb, Cs), а также металлы IIA группы: Са, Sr, Ba. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.

В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
Решение примера 1.
Находим количество водорода: n = V / Vm n = 5,6 / 22,4 = 0,25 моль.
По уравнению реакции:
0,25 моль
0,25 моль
Fe +
2HCl = FeCl2 +
H2
1 моль
1 моль
Cu +
HCl = не идет
Количество железа тоже 0,25 моль.
 Можно найти его
массу:
mFe = 0,25 • 56 = 14 г.
Можно найти его
массу:
mFe = 0,25 • 56 = 14 г.Теперь можно рассчитать массовые доли металлов в смеси: ωFe = mFe/mвсей смеси ωFe = 14 / 20 = 0,7 = 70%
Ответ: 70% железа, 30% меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
Решение примера 2.
Находим количество водорода: n = V / Vm n = 8,96 / 22,4 = 0,4 моль.
Пусть количество алюминия — х моль, а железа у моль.
 Тогда можно выразить через х и
у количество выделившегося
водорода:
Тогда можно выразить через х и
у количество выделившегося
водорода:x моль
1,5x моль (мольное соотношение Al:Н2 = 2:3)
2Al
+ 6HCl = 2AlCl3 +
3H2
y моль
y моль
Fe
+ 2HCl = FeCl2 +
H2
Нам известно общее количество водорода: 0,4 моль. Значит, 1,5х + у = 0,4 (это первое уравнение в системе).

Для смеси металлов нужно выразить массы через количества веществ. m = M • n Значит, масса алюминия mAl = 27x, масса железа mFe = 56у, а масса всей смеси 27х + 56у = 11 (это второе уравнение в системе).
Итак, мы имеем систему из двух уравнений:
{
1,5x + y = 0,4
27x + 56y = 11
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18: 27х + 18у = 7,2 и вычитая первое уравнение из второго:
(56 − 18)у = 11 − 7,2 у = 3,8 / 38 = 0,1 моль (Fe) х = 0,2 моль (Al)
Дальше находим массы металлов и их массовые доли в смеси:
mFe = n • M = 0,1 • 56 = 5,6 г ωFe = mFe / mсмеси = 5,6 / 11 = 0,50909 (50,91%),
соответственно, ωAl = 100% − 50,91% = 49,09%
Ответ:
50,91% железа, 49,09% алюминия.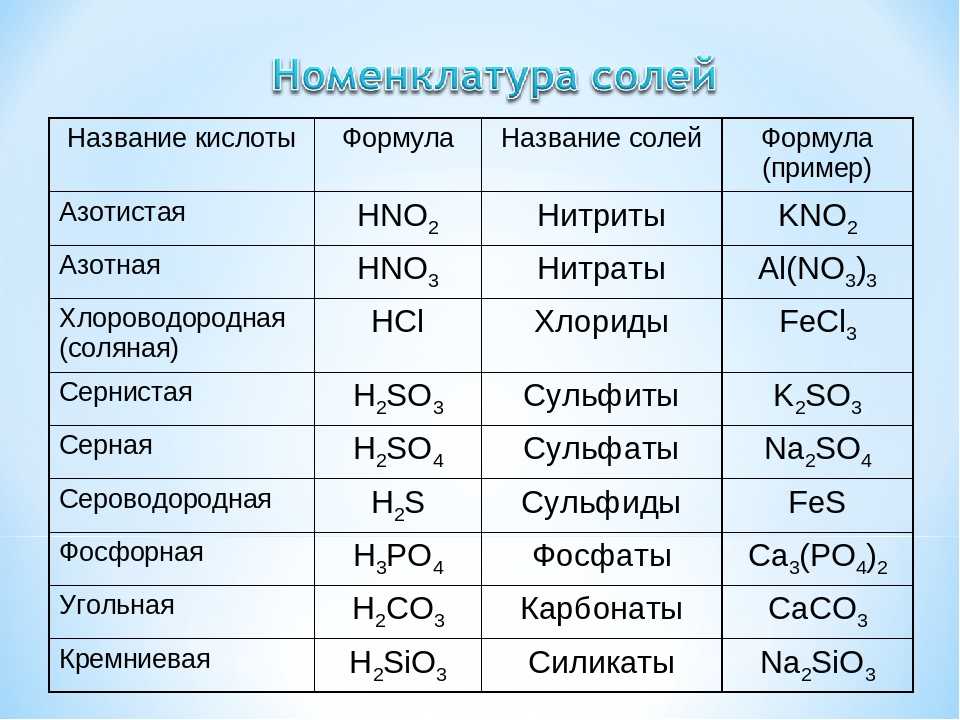
Пример 3.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В
этом примере надо помнить, что холодная
концентрированная серная кислота не реагирует с железом
и алюминием (пассивация), но реагирует
с медью. При этом выделяется оксид серы
(IV). Со
щелочью реагирует только
алюминий — амфотерный металл (кроме алюминия, в
щелочах растворяются ещё цинк и олово,
в горячей концентрированной щелочи —
ещё можно растворить бериллий).
При этом выделяется оксид серы
(IV). Со
щелочью реагирует только
алюминий — амфотерный металл (кроме алюминия, в
щелочах растворяются ещё цинк и олово,
в горячей концентрированной щелочи —
ещё можно растворить бериллий).
Решение примера 4.
С концентрированной серной кислотой реагирует только медь, число моль газа: nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль
0,25
0,25
Cu +
2H2SO4 (конц.) = CuSO4 +
SO2 + 2H2O
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль.
 Можно найти
массу меди:
mCu = n • M = 0,25 • 64 = 16 г.
Можно найти
массу меди:
mCu = n • M = 0,25 • 64 = 16 г.В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Al0 − 3e = Al3+
|
2
2H+ + 2e = H2
3
Число моль водорода: nh3 = 3,36 / 22,4 = 0,15 моль, мольное соотношение алюминия и водорода 2:3 и, следовательно, nAl = 0,15 / 1,5 = 0,1 моль. Масса алюминия: mAl = n • M = 0,1 • 27= 2,7 г
Остаток — это железо, массой 3 г. Можно найти массу смеси: mсмеси = 16 + 2,7 + 3 = 21,7 г.
Массовые доли металлов:
ωCu = mCu / mсмеси = 16 / 21,7 = 0,7373 (73,73%) ωAl = 2,7 / 21,7 = 0,1244 (12,44%) ωFe = 13,83%
Ответ:
73,73% меди, 12,44% алюминия, 13,83% железа.
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте. В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
Решение примера 5.
Определяем количество вещества газа: nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль.
Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
mраствора = ρ • V = 1,115 • 565 = 630,3 г mHNO3 = ω • mраствора = 0,2 • 630,3 = 126,06 г nHNO3 = m / M = 126,06 / 63 = 2 моль
Обратите
внимание, что так как металлы полностью
растворились, значит — кислоты
точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не
оказалась ли кислота в избытке,
и сколько ее осталось после реакции в
полученном растворе.
Соответственно, надо будет проверить, не
оказалась ли кислота в избытке,
и сколько ее осталось после реакции в
полученном растворе.
Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за 5х — количество цинка, а за 10у — количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй — 3у моль:
5x
x
5Zn
+ 12HNO3 = 5Zn(NO3)2 +
N2
+ 6H2O
Zn0 − 2e = Zn2+
|
5
2N+5 + 10e = N2
1
10y
3y
10Al
+ 36HNO3 = 10Al(NO3)3 +
3N2
+ 18H2O
Al0 − 3e = Al3+
|
10
2N+5 + 10e = N2
3
Тогда, учитывая, что масса смеси металлов 21,1 г, их молярные массы — 65 г/моль у цинка и 27 г/моль у алюминия, получим следующую систему уравнений:
{
х + 3у = 0,13 (количество азота)
65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов)
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.

х = 0,04, значит, nZn = 0,04 • 5 = 0,2 моль у = 0,03, значит, nAl = 0,03 • 10 = 0,3 моль
Проверим массу смеси: 0,2 • 65 + 0,3 • 27 = 21,1 г.
Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
0,2
0,48
0,2
0,03
5Zn
+ 12HNO3 =
5Zn(NO3)2
+ N2 +
6H2O
0,3
1,08
0,3
0,09
10Al
+ 36HNO3 =
10Al(NO3)3
+ 3N2 +
18H2O
Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось? По уравнениям реакций, количество кислоты, вступившей в реакцию: nHNO3 = 0,48 + 1,08 = 1,56 моль, т.
 е.
кислота была в избытке и можно вычислить
её остаток в растворе:
nHNO3ост.
= 2 − 1,56 = 0,44 моль.
е.
кислота была в избытке и можно вычислить
её остаток в растворе:
nHNO3ост.
= 2 − 1,56 = 0,44 моль.Итак, в итоговом растворе содержатся:
нитрат цинка в количестве 0,2 моль: mZn(NO3)2 = n • M = 0,2 • 189 = 37,8 г нитрат алюминия в количестве 0,3 моль: mAl(NO3)3 = n • M = 0,3 • 213 = 63,9 г избыток азотной кислоты в количестве 0,44 моль: mHNO3ост. = n • M = 0,44 • 63 = 27,72 г
Какова масса итогового раствора? Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
Масса нового раствора
=
Сумма масс смешиваемых растворов и/или веществ
–
Масса осадков
–
Масса газов
Тогда для нашей задачи:
mнов.
 раствора = масса раствора кислоты + масса сплава
металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов.
раствора = 630,3 + 21,1 − 3,36 = 648,04 г
раствора = масса раствора кислоты + масса сплава
металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов.
раствора = 630,3 + 21,1 − 3,36 = 648,04 гТеперь можно рассчитать массовые доли веществ в получившемся растворе:
ωZn(NO3)2 = mв-ва / mр-ра = 37,8 / 648,04 = 0,0583 ωAl(NO3)3 = mв-ва / mр-ра = 63,9 / 648,04 = 0,0986 ωHNO3ост. = mв-ва / mр-ра = 27,72 / 648,04 = 0,0428
Ответ: 5,83% нитрата цинка, 9,86% нитрата алюминия, 4,28% азотной кислоты.
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — 8,96 л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При
решении этой задачи надо вспомнить,
во-первых, что концентрированная азотная
кислота с неактивным металлом (медь)
даёт NO2,
а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует
с медью.
Соляная кислота, напротив, не реагирует
с медью.
Ответ к примеру 6: 36,8% меди, 32,2% железа, 31% алюминия.
Задачи для самостоятельного решения.
Реакция оксида цинка и меди(II) | Эксперимент
В этой демонстрации учащиеся могут наблюдать за экзотермической реакцией между оксидом меди(II) и металлическим цинком и определять образующиеся продукты. Они исследуют разницу в реакционной способности между цинком и медью и идею конкурирующих реакций.
Оксид меди(II) и металлический цинк реагируют вместе в экзотермической реакции с образованием оксида цинка и меди. Наблюдая за этой реакцией и ее продуктами и отмечая разницу в реакционной способности цинка и меди, учащиеся могут ознакомиться с идеей реакций конкуренции.
Оборудование
Аппаратура
- Средства защиты глаз
- Горелка Бунзена
- Жестяная крышка, сидящая на штативе (или на полоске керамической бумаги)
- Стакан, 100 см 3
- Тестер цепи (аккумулятор, лампа и провода) (дополнительно)
- Защитные экраны (дополнительно)
- Пробирки x2 (дополнительно – см.
 процедуру, шаг 7)
процедуру, шаг 7) - Штатив для пробирок
- Доступ к взвешиванию весов с точностью до 0,1 г
Химикаты
- Порошок оксида меди(II) (ВРЕДЕН, ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), 2 г
- Цинковый порошок (ЛЕГКОВОСПЛАМЕНЯЕМЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), 1,6 г
- Разбавленная соляная кислота, приблизительно 2 М (РАЗДРАЖАЮЩЕЕ), 20 см 3
- Оксид цинка (ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), несколько граммов
- Медный порошок, несколько граммов
- Концентрированная азотная кислота (КОРРОЗИОННАЯ, ОКИСЛЯЮЩАЯ), 5 см 3 (опционально – см. Процедуру, шаг 7)
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки. Рассмотрите возможность установки защитных экранов вокруг эксперимента (образцы цинка могут значительно различаться по реакционной способности в зависимости от размера частиц и степени окисления поверхности).

- Порошок оксида меди(II), CuO(s), (ВРЕДЕН, ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC026.
- Цинковый порошок, Zn(s), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. карточку опасности CLEAPSS HC107.
- Разбавленная соляная кислота, HCl (водн.), (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043.
- Концентрированная азотная кислота, HNO 3 (водн.), (КОРРОЗИОННОЕ, ОКИСЛЯЮЩЕЕ) – см. карточку опасности CLEAPSS HC067.
- Медный порошок, Cu(s) – см. карточку опасности CLEAPSS HC026.
- Оксид цинка, ZnO(s), (ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC108b.
Процедура
- Взвесьте 2 г (0,025 моль) оксида меди(II) и 1,6 г (0,025 моль) порошка цинка.
- Тщательно перемешайте, чтобы получить однородный порошок серого цвета.
- Налейте смесь в форме «колбаски» длиной около 5 см на чистую жестяную крышку, установленную на штативе (или на полоску керамической бумаги, сложенную вдоль в форме буквы V).

- Нагрейте один конец «колбасы» сверху с ревущим пламенем Бунзена, пока он не начнет светиться, затем уберите пламя. По «колбасе» будет распространяться свечение, пока она вся не отреагирует. Бело-серая смесь останется.
- Нагрейте это, чтобы показать, что белый порошок (оксид цинка) становится желтым в горячем состоянии и белым в холодном.
- Перелейте остывший остаток в стакан 3 объемом 100 см и добавьте немного разбавленной соляной кислоты для растворения оксида цинка (а также любых непрореагировавших оксидов цинка и меди), нагревая при необходимости. Останется красно-коричневая медь. Его можно промыть водой и раздать классу для наблюдения. Покажите, что порошок проводит электричество, с помощью тестера электрических цепей.
- Если требуется дополнительное подтверждение личности, обработайте небольшое количество красно-коричневого порошка несколькими каплями концентрированной азотной кислоты в пробирке в вытяжном шкафу. Коричневый газ, диоксид азота, NO 2 (g) (ОЧЕНЬ ТОКСИЧНЫЙ), выделяется, когда медь вступает в реакцию и растворяется.
 После реакции добавление небольшого количества воды делает видимым раствор нитрата меди(II) синего цвета.
После реакции добавление небольшого количества воды делает видимым раствор нитрата меди(II) синего цвета.
Учебные заметки
Глубина обсуждения зависит от уровня вовлеченных учащихся. По сути, это конкуренция между металлом (1) и металлом (2) за кислород в реакции, представленной:
Металл(1) + оксид металла(2) → оксид металла(1) + металл(2)
Более активный металл вытесняет менее активный металл из его оксида, как в случае оксидов цинка и меди(II) , например:
Zn(s) + CuO(s) → ZnO(s) + Cu(s)
Продемонстрируйте, что оксид цинка желтеет при нагревании и снова становится белым при охлаждении, чтобы подтвердить подлинность этого продукта. (Это явление вызвано изменением кристаллической структуры — подлинный пример физического изменения.)
Там, где это уместно, можно указать, что эти реакции являются окислительно-восстановительными, при этом более реакционноспособный металл действует как восстановитель, а оксид металла действует как окислитель. Это можно расширить, чтобы рассмотреть эти окислительно-восстановительные реакции с точки зрения потери и приобретения электронов металлами.
Это можно расширить, чтобы рассмотреть эти окислительно-восстановительные реакции с точки зрения потери и приобретения электронов металлами.
Можно использовать и другие металлы, но сравните подобное с подобным. Крупный порошок магния, например, дает менее бурную реакцию, чем порошок цинка. Мелкодисперсный порошок магния дает очень бурную реакцию, и пробовать его следует с большой осторожностью. Реакция между алюминиевым порошком и оксидом меди почти взрывоопасна, и ее нельзя проводить.
Дополнительная информация
Это ресурс проекта “Практическая химия”, разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое занятие содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: Химия для неспециалистов.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, 2016 г.
Медь и цинк в растворе почвенно-шламовой смеси
Сохранить цитату в файл
Формат: Резюме (текст) PubMedPMIDAbstract (текст) CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый будний день
Который день? воскресеньепонедельниквторниксредачетвергпятницасуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 2002 г., январь-февраль; 31(1):193-203.
Р Вулкан 1 , У. Мингельгрин, Дж. Бен-Ашер, Х. Френкель
Бен-Ашер, Х. Френкель
принадлежность
- 1 Департамент земледелия в засушливых районах Вайлера, Институт исследования пустынь Джейкоба Блауштайна, Университет Бен-Гуриона, Седе-Бокер, Израиль. [email protected]
- PMID: 11837423
R Вулкан и др. J Environ Qual. 2002 январь-февраль.
. 2002 г., январь-февраль; 31(1):193-203.
Авторы
Р Вулкан 1 , У. Мингельгрин, Дж. Бен-Ашер, Х. Френкель
принадлежность
- 1 Департамент земледелия в засушливых районах Вайлера, Институт исследования пустынь Джейкоба Блауштайна, Университет Бен-Гуриона, Седе-Бокер, Израиль.
 [email protected]
[email protected]
- PMID: 11837423
Абстрактный
Только небольшая часть содержания переходных металлов в почвах с илом является растворимой, и все же эта фракция вносит основной вклад в подвижность и биодоступность металлов. Химические формы цинка (Zn) и меди (Cu) в растворимых фракциях почвенно-шламовых смесей охарактеризованы в отношении их заряда, молекулярной массы и стехиометрии с использованием методов ионообменной смолы и гель-хроматографии. Изменение формы металлов во времени после нанесения шлама прослежено в течение 100 сут. Медь в водных вытяжках илово-песчаных смесей обнаружена почти исключительно в низкомолекулярных (менее 1000 Да) комплексах. Растворенный органический углерод (РОУ) с более высокой молекулярной массой (около 2500 Да) также присутствовал в экстрактах, но эта фракция РОУ демонстрировала небольшое комплексообразование. Медь присутствовала в экстрактах в основном в виде отрицательно заряженных частиц в течение всего периода инкубации, а цинк имел тенденцию к образованию цвиттер-ионов. По мере инкубации относительное содержание положительно заряженного Zn в растворе увеличивалось. Комплексообразующая способность РОУ в водном экстракте ила, экстраполированная на бесконечное разбавление, составила 8,75 мМ Ca г(-1) РОУ. Когда способность экстракта к комплексообразованию близка к насыщению, можно определить средний комплекс Cu-DOC. Он состоит из 1,9Атомы Cu присоединены к частицам DOC, содержащим 5,6 атомов C. Таким образом, органические комплексы Cu состоят в основном из примерно двух ионов Cu, присоединенных к разновидностям DOC, содержащим только пять или шесть атомов C. Аминокислоты и малые пептиды или поликарбоновые кислоты, такие как лимонная кислота, таким образом, могут быть важными комплексообразователями металла.
Медь присутствовала в экстрактах в основном в виде отрицательно заряженных частиц в течение всего периода инкубации, а цинк имел тенденцию к образованию цвиттер-ионов. По мере инкубации относительное содержание положительно заряженного Zn в растворе увеличивалось. Комплексообразующая способность РОУ в водном экстракте ила, экстраполированная на бесконечное разбавление, составила 8,75 мМ Ca г(-1) РОУ. Когда способность экстракта к комплексообразованию близка к насыщению, можно определить средний комплекс Cu-DOC. Он состоит из 1,9Атомы Cu присоединены к частицам DOC, содержащим 5,6 атомов C. Таким образом, органические комплексы Cu состоят в основном из примерно двух ионов Cu, присоединенных к разновидностям DOC, содержащим только пять или шесть атомов C. Аминокислоты и малые пептиды или поликарбоновые кислоты, такие как лимонная кислота, таким образом, могут быть важными комплексообразователями металла.
Похожие статьи
Оценка нагрузки ила на почву на основе сорбции микроэлементов в почве: влияние растворенных металлоорганических комплексов.

Бертон Э.Д., Хоукер Д.В., Реддинг М.Р. Бертон ЭД и соавт. Вода Res. 2003 март; 37(6):1394-400. doi: 10.1016/S0043-1354(02)00495-5. Вода Res. 2003. PMID: 12598202
Использование последовательной экстракции для оценки влияния осадка сточных вод на подвижность металлов в чилийских почвах.
Ахумада И., Эскудеро П., Карраско М.А., Кастильо Г., Аскар Л., Фуэнтес Э. Ахумада I и др. J Мониторинг окружающей среды. 2004 апр; 6 (4): 327-34. дои: 10.1039/b313272b. Epub 2004, 16 февраля. J Мониторинг окружающей среды. 2004. PMID: 15054542
Влияние растворенного органического вещества на конкурентную адсорбцию меди и цинка песчаной почвой при различных значениях рН.
Мескита, Мэн, Карранка С.
 Мескита М.Е. и др.
Экологические технологии. 2005 Сентябрь; 26 (9): 1065-72. дои: 10.1080/09593332608618493.
Экологические технологии. 2005.
PMID: 16196414
Мескита М.Е. и др.
Экологические технологии. 2005 Сентябрь; 26 (9): 1065-72. дои: 10.1080/09593332608618493.
Экологические технологии. 2005.
PMID: 16196414Специфические химические взаимодействия между ионами металлов и твердыми биологическими веществами на примере частиц ила.
Хуан С.П., Ван Дж. Хуанг С.П. и др. Биоресурсная технология. 2014 Май; 160:32-42. doi: 10.1016/j.biortech.2014.01.043. Epub 2014 22 января. Биоресурсная технология. 2014. PMID: 24495800 Обзор.
На стыке антибиотиков и металлов: влияние Cu и Zn на активность и устойчивость к антибиотикам.
Пул К. Пул К. Тенденции микробиол. 2017 Октябрь; 25 (10): 820-832. doi: 10.1016/j.tim.2017.04.010. Эпаб 2017 17 мая.
 Тенденции микробиол. 2017.
PMID: 28526548
Обзор.
Тенденции микробиол. 2017.
PMID: 28526548
Обзор.
Посмотреть все похожие статьи
Цитируется
Моделирование поверхностного комплексообразования при адсорбции Cu(II) на смесях водного оксида железа и каолинита.
Лунд Т.Дж., Корецкий С.М., Ландри С.Дж., Шаллер М.С., Дас С. Лунд Т.Дж. и соавт. Геохим транс. 2008 10 сентября; 9:9. дои: 10.1186/1467-4866-9-9. Геохим транс. 2008. PMID: 18783619 Бесплатная статья ЧВК.
Уровни и составы тяжелых металлов в почвах промышленной Южной Нигерии.
Оладжире А.А., Айоделе Э.Т., Ойедирдан Г.О., Олуйеми Э.А. Оладжире А.А. и соавт. Оценка окружающей среды. 2003 г., июнь; 85 (2): 135–55. дои: 10.1023/а:1023613418727.



 А в
приведенном уравнении предполагается,
что их равное
количество.
А в
приведенном уравнении предполагается,
что их равное
количество.
 кислота
Неметаллы + конц. кислота
кислота
Неметаллы + конц. кислота кислота
Неметаллы + конц. кислота
кислота
Неметаллы + конц. кислота
 Можно найти его
массу:
mFe = 0,25 • 56 = 14 г.
Можно найти его
массу:
mFe = 0,25 • 56 = 14 г. Тогда можно выразить через х и
у количество выделившегося
водорода:
Тогда можно выразить через х и
у количество выделившегося
водорода:
 Можно найти
массу меди:
mCu = n • M = 0,25 • 64 = 16 г.
Можно найти
массу меди:
mCu = n • M = 0,25 • 64 = 16 г.
 е.
кислота была в избытке и можно вычислить
её остаток в растворе:
nHNO3ост.
= 2 − 1,56 = 0,44 моль.
е.
кислота была в избытке и можно вычислить
её остаток в растворе:
nHNO3ост.
= 2 − 1,56 = 0,44 моль. раствора = масса раствора кислоты + масса сплава
металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов.
раствора = 630,3 + 21,1 − 3,36 = 648,04 г
раствора = масса раствора кислоты + масса сплава
металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов.
раствора = 630,3 + 21,1 − 3,36 = 648,04 г процедуру, шаг 7)
процедуру, шаг 7)

 После реакции добавление небольшого количества воды делает видимым раствор нитрата меди(II) синего цвета.
После реакции добавление небольшого количества воды делает видимым раствор нитрата меди(II) синего цвета.

 Мескита М.Е. и др.
Экологические технологии. 2005 Сентябрь; 26 (9): 1065-72. дои: 10.1080/09593332608618493.
Экологические технологии. 2005.
PMID: 16196414
Мескита М.Е. и др.
Экологические технологии. 2005 Сентябрь; 26 (9): 1065-72. дои: 10.1080/09593332608618493.
Экологические технологии. 2005.
PMID: 16196414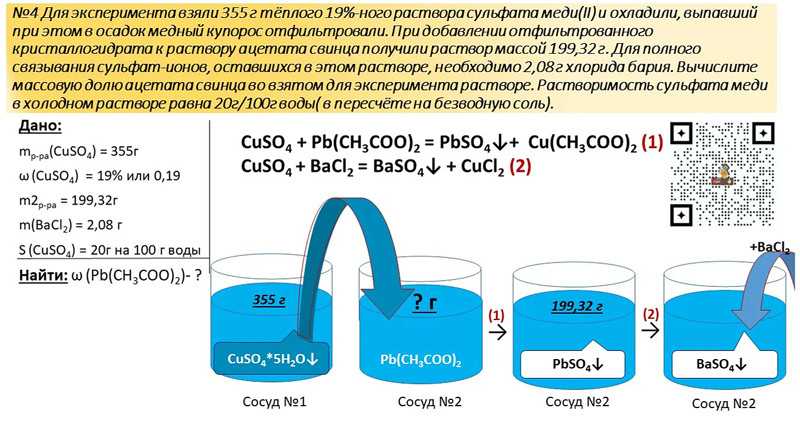 Тенденции микробиол. 2017.
PMID: 28526548
Обзор.
Тенденции микробиол. 2017.
PMID: 28526548
Обзор.