Строение кристаллической решетки – . ., ,
alexxlab | 03.02.2020 | 0 | Разное
1.3 Понятие кристаллической решётки
Для описания упорядоченного расположения частиц вещества в кристаллах используют некую геометрическую модель, называемую кристаллической решёткой. Кристаллическая решёткапредставляет собой воображаемую пространственную координатную сетку, узлы которой показывают расположение в пространстве центров тяжести атомов, молекул или ионов кристалла. Поскольку частицы в кристаллах располагаются закономерно, нет необходимости изображать всю пространственную сетку, достаточно ограничиться изображением системы координат и минимальной группы повторяющихся в ней узлов. Такую минимальную группу узлов, периодически повторяющихся в пространстве, называютэлементарной ячейкой. В общем случае элементарная ячейка имеет вид параллелепипеда, частным случаем которого является куб (рис. 1).
Z
узлы – центры тяжести
частиц вещества,
в частности, атомов
c
атомы
α
β
Y
b
a
γ
X
Рис. 1. Простая кубическая элементарная ячейка.
Рёбра элементарного параллелепипеда (a,b,c) и его углы (α, β, γ) называютпараметрами элементарной ячейки. Соотношения между этими параметрами определяют форму элементарной ячейки и соответствующую систему симметрии. Всего существует 7 систем симметрии:
триклинная a≠b≠c, α ≠ β ≠ γ ≠ 90°;
моноклинная a≠b≠c, α = β = 90°, γ ≠ 90°;
ромбическая a≠b≠c, α = β = γ = 90°;
ромбоэдрическая a=b=c, α = β = γ ≠ 90°;
- гексагональная a=b≠c, α = β = 90°, γ = 120°;
тетрагональная a=b≠c, α = β = γ = 90°;
кубическая a=b=c, α = β = γ = 90°.
Если элементарную ячейку перемещать (транслировать) вдоль координатных осей OX,OYиOZс шагом, соответственноa,bиc, то можно воспроизвести всю пространственную координатную сетку, т.е. кристаллическую решётку. Параметры элементарной ячейкиa,bиcназывают также периодами кристаллической решётки. По своему физическому смыслу это расстояния между центрами тяжести соседних частиц, в частности атомов, сближенных в кристаллах до соприкосновения. По порядку величиныa,bиcсоставляют 0,1 нанометра (1нм это 10-9м), или 1 Ангстрем (1Å = 10-10м).
Элементарная ячейка, изображённая на рис. 1, относится к числу простых (примитивных) ячеек. Но возможны и более сложные ячейки, содержащие дополнительные узлы, расположенные либо в центре всех граней элементарного параллелепипеда (
1.4 Структура кристаллов
Следует различать понятия кристаллическая решёткаиструктура кристалла. Структура кристалла – это физическая реальность, конкретное расположение в пространстве различных атомов. Кристаллическая решётка – это геометрический образ структуры, отражающий лишь симметрию расположения частиц кристалла. Для более полного описания структуры кристаллов используют понятие базис. Базисомкристаллической структурыназывают совокупность определённым образом расположенных в пространстве различных атомов, приходящихся на одну элементарную ячейку. Т.е. перечисляются все полностью принадлежащие одной элементарной ячейке атомы, вместе с их координатами в этой ячейке. Таким образом, если элементарная ячейка определяет размер и форму «элементарных кирпичиков», из которых построен кристалл, то базис определяет «материал» этих кирпичиков. Другими словами, базис это тот «элементарный блок вещества», периодическим повторением которого в пространстве воспроизводится весь рассматриваемый кристалл.
Базис сложных органических кристаллов, состоящих из больших молекул, может включать в себя несколько тысяч различных атомов. В простейшем случае, когда в узлах кристаллической решётки расположены однотипные атомы или ионы, базис состоит только из одной или нескольких таких частиц. Подобная ситуация характерна, в частности, для металлов. Если структуру металла описывает кристаллическая решётка с примитивной ячейкой (рис. 1), то базис такой структуры состоит только из одного атома данного металла. (Действительно, в данном случае, каждый атом металла, расположенный в узле кристаллической решётки, находится на пересечении 8 аналогичных ячеек и принадлежит рассматриваемой ячейке только на ⅛ часть. Но поскольку таких узлов в ячейке 8, то полностью принадлежит ей ровно один атом, составляющий по определению базис. Перемещая этот атом–базис вдоль координатных осей с шагом, соответствующим периодам кристаллической решётки, воспроизводится вся пространственная структура металла). В случае объёмоцентрированной ячейки базис составляют 2 атома металла (атом в центре ячейки полностью принадлежит данной ячейке, плюс один атом дают узлы, расположенные в вершинах ячейки), а гранецентрированной – 4 (каждый из 6 атомов, расположенных в центрах граней, принадлежит рассматриваемой ячейке только на ½ часть).
Система симметрии, величина периодов решётки и базис полностью определяют кристаллическую структуру конкретного материала. Если известны эти параметры, то известной считается и структура кристалла. Однако для более полного описания структуры иногда используют такие дополнительные параметры как координационное число и коэффициент компактности. Координационным числомназывают число ближайших равноудалённых соседей любого атома. Если в качестве примера рассматривать структуру, изображенную на рис. 1, то для неё координационное число равно шести.Коэффициент компактности(степень компактности) представляет собой отношение объёма, занятого атомами, ко всему объёму элементарной ячейки. В случае чистых металлов коэффициент компактности может достигать величины 0,74. Это означает, что 74 % объёма металла занято атомами, а остальную его часть составляют пустоты (поры).
studfiles.net
КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛОВ
Типы кристаллических решеток. Твердые тела делят на кристаллические и аморфные. Кристаллические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. Аморфные тела при нагреве размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь затем переходят в жидкое состояние.
Все металлы и их сплавы – тела кристаллические. Металлами называют химические элементы, характерными признаками которых являются непрозрачность, блеск, хорошая электро- и теплопроводность, пластичность, а для многих металлов также способность свариваться. Не потеряло своего научного значения определение металлов, данное более 200 лет назад великим русским ученым М. В. Ломоносовым: “Металлы суть светлые тела, которые ковать можно”. Для металлов характерно то, что, вступая в химические реакции с элементами, являющимися неметаллами, они отдают последним свои внешние валентные электроны. Это объясняется тем, что у атомов металла внешние электроны непрочно связаны с его ядром. Металлы имеют на наружных оболочках всего 1 -2 электрона, тогда как у неметаллов таких электронов много (5-8).
Чистые химические элементы металлов (например, железо, медь, алюминий и др.) могут образовывать более сложные вещества, в состав которых могут входить несколько элементов-металлов, часто с примесью заметных количеств элементов-неметаллов. Такие вещества называются металлическими сплавами. Простые вещества, образующие сплав, называют компонентами сплава.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка- это воображаемая пространственная сетка, в узлах которой располагаются атомы (ионы), образующие металл. Частицы вещества (ионы, атомы), из которых построен кристалл, расположены в определенном геометрическом порядке, который периодически повторяется в пространстве. В отличие от кристаллов в аморфных телах (стекло, пластмассы) атомы располагаются в пространстве беспорядочно, хаотично.
Формирование кристаллической решетки в металле происходит следующим образом. При переходе металла из жидкого в твердое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают. Характер взаимодействия атомов определяется строением их внешних электронных оболочек. При сближении атомов электроны, находящиеся на внешних оболочках теряют связь со своими атомами вследствие отрыва валентного электрона одного атома положительно заряженным ядром другого и т. д. Происходит образование свободных электронов, так как они не принадлежат отдельным атомам. Таким образом, в твердом состоянии металл представляет собой структуру, состоящую из положительно заряженных ионов, омываемых свободными электронами.
Связь в металле осуществляется электростатическими силами. Между ионами и свободными электронами возникают электростатические силы притяжения, которые стягивают ионы. Такую связь между частицами металла называют металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Ионы находятся на таком расстоянии один от другого, при котором потенциальная энергия взаимодействия минимальна. В металле ионы располагаются в определенном порядке, образуя кристаллическую решетку. Такое расположение ионов обеспечивает взаимодействие их с валентными электронами, которые связывают ионы в кристаллической решетке.
| Элементарные ячейки кристаллических решеток:
1 — кубическая объемно-центрированная (а-железо), II— кубическая гранецентрированная (медь), III — гексагональная плотноупакованная; а и с — параметры решеток. |
Типы кристаллических решеток у различных металлов различны. Наиболее часто встречаются решетки: объемно-центрированная кубическая (ОЦК) — α-Fе, Сг, W, гранецентрированная кубическая (ГЦК) — γ-Fе, А1, Сu и гексагональная плотноупакованная (ГПУ) – Мg, Zn и др. Наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, называют элементарной кристаллической ячейкой (рис. 1). Кристаллическая решетка характеризуется ее параметрами, например длиной ребра куба для ОЦК и ГЦК, которая составляет для металлов 2,8-6 • 10ˆ(-8) см.
Дефекты в кристаллах. В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки..
Дефекты в кристаллах:
а — вакансия, б — внедренный атом, в — краевая линейная дислокация, г — неправильное расположение атомов на границе зерен 1 и 2
Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные. Атомы совершают колебательные движения возле узлов решетки, а с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией значительно большей средней энергии и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а). На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замешенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки.
Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстра-плоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой или линейной дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Ширина дислокации мала и составляет несколько атомных расстояний.
Кристаллическая решетка в зоне дислокации упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокации характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов (см. гл. 1, 2), а также при пластической деформации, термической обработке и других процессах.
Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами(рис. 2, г ).На границе раздела атомы расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов.При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться в следствии искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
Анизотропия кристаллов. Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны, аморфные тела (стекло, смола) изотропны, т. е. имеют одинаковую плотность атомов в различных направлениях.
Анизотропия свойств важна при использовании монокристаллов— одиночных кристаллов, частицы которых расположены единообразно по всему их объему. Монокристаллы имеют правильную кристаллическую огранку (в форме естественных многогранников), анизотропны по механическим, электрическим и другим физическим свойствам. Так, для монокристалла меди предел прочности δв изменяется от 120 до 360 МПа в зависимости от направления приложения нагрузки.
Металлы и сплавы, применяемые в технике, обычно имеют поликристаллическую структуру, т. е. состоят из множества мелких и различно ориентированных кристаллов, не имеющих правильной кристаллической огранки и называемых кристаллитами (или зернами). В каждом зерне поликристалла наблюдается анизотропия. Однако вследствии разнообразной, беспорядочной ориентировки кристаллографических плоскостей в различных зернах поликристалл может иметь одинаковые свойства по разным направлениям и не обнаруживать анизотропию (когда размеры зерен значительно меньше размеров поликристалла и количество их весьма велико). Это обстоятельство во многих случаях позволяет рассматривать поликристаллическое тело как подобное изотропному, несмотря на анизотропию свойств отдельных составляющих его зерен.
КРИСТАЛЛИЗАЦИЯ
Переход из жидкого состояния в твердое (кристаллическое) называют кристаллизацией. Процессы кристаллизации зависят от температуры и протекают во времени, поэтому кривые охлаждения строятся в координатах температура – время (рис. 3). Теоретический, т.е. идеальный, процесс кристаллизации металла без переохлаждения протекает при температуре Тs (рис. 3). При достижении идеальной температуры затвердевания Тs падение температуры прекращается. Это объясняется тем, что перегруппировка атомов при формировании кристаллической решетки идет с выделением тепла (выделяется скрытая теплота кристаллизации). Каждый чистый металл (не сплав) кристаллизуется при строго индивидуальной постоянной температуре. По окончании затвердевания металла температура его снова понижается.
Практически кристаллизация протекает при более низкой температуре, т.е. при переохлаждении металла до температур Тn, Тn1, Тn2, (например, кривые 1,2). Степень переохлаждения (ΔТ=Тs-Тn) зависит от природы и чистоты металла и скорости охлаждения. Чем чище жидкий металл, тем он более склонен к переохлаждению. При увеличении скорости охлаждения степень переохлаждения возрастает, а зерна металла становятся мельче, что улучшает его качество. Для большинства металлов степень переохлаждения при кристаллизации в производственных условиях составляет от 10 до 30°С. При больших скоростях охлаждения она может достигать сотен градусов.
Кривые кристаллизации металла при охлаждении с разной скоростью
Процесс кристализации состоит из двух стадий: зарождения кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров. При переохлаждении сплава ниже Тп на многих участках жидкого металла (рис. 4, а, б) образуются способные к росту кристаллические зародыши. Сначала образовавшиеся кристаллы растут свободно и имеют более или менее правильную геометрическую форму (рис. 4, в, г, д). Затем при соприкосновении растущих кристалов их правильная форма нарушается, так как в этих участках рост граней прекращается. 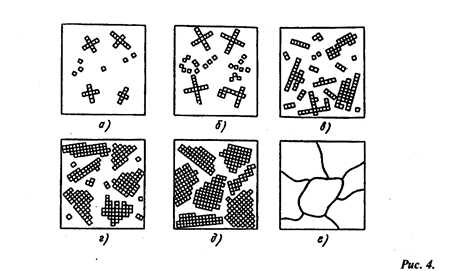
Последовательные этапы процесса кристаллизации металла
Рост кристалла продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате кристаллы, имевшие сначала геометрически правильную форму, после затвердевания получают неправильную форму, их называют кристаллитами или зернами (рис.4, е).
Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зерно металла.
Величина зерен, образующихся при кристаллизации, зависит не только от количества самопроизвольно зарождающихся центров кристаллизации, но также и от количества нерастворимых примесей, всегда имеющихся в жидком металле. Такие нерастворимые примеси являются готовыми центрами кристаллизации. Ими являются оксиды (например, Аl2O3,), нитриды, сульфиды и другие соединения. Центрами кристаллизации в данном металле или сплаве могут быть только такие твердые частицы, которые соизмеримы с размерами атомов основного металла. Кристаллическая решетка таких твердых частиц должна быть близка по своему строению и параметрам решетке кристаллизующегося металла. Чем больше таких частичек, тем мельче будут зерна закристаллизовавшегося металла.
На образование центров кристаллизации влияет и скорость охлаждения. Чем выше скорость охлаждения, тем больше возникает центров кристаллизации и, следовательно, мельче зерно металла Схема дендритного роста кристалла
Чтобы получить мелкое зерно, создают искусственные центры кристаллизации. Для этого в расплавленный металл .(расплав) вводят специальные вещества,называемые модификаторами.Так, при модифицировании магниевых сплавов зерно уменьшается от 0,2—0,3 до 0,01-0,02 мм, т.е. в 15-20 раз. Модифицирование отливок проводят введением в расплав добавок, которые образуют тугоплавкие соединения (карбиды, оксиды). При модифицировании, например, стали применяют алюминий, титан, ванадий; алюминиевых сплавов — марганец, титан, ванадий.
Иногда в качестве модификаторов применяют поверхностно-активные вещества. Они растворяются в жидком металле. Эти модификаторы осаждаются на поверхности растущих кристаллов, образуя очень тонкий слой. Этот слой препятствует дальнейшему росту кристаллов, придавая металлу мелкозернистое строение.
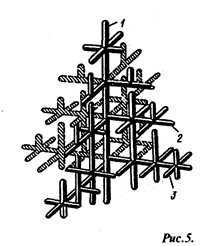
Строение металлического слитка. Форма растущих кристаллов определяется не только условиями их касания друг с другом, но и составом сплава, наличием примесей и режимом охлаждения. Обычно механизм образования кристаллов носит дендритный (древовидный) характер (рис. 5). Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет в тех плоскостях и направлениях решетки, которые имеют наибольшую плотность у паковки атомов и минимальное расстояние между ними. В этих направлениях образуются длинные ветви будущего кристалла — так называемые оси (1) первого порядка (рис. 5). В дальнейшем от осей первого порядка начинают расти новые оси (2) — оси второго порядка, от осей второго порядка- оси (3) – третьего порядка и т.д. По мере кристаллизации образуются оси более высокого порядка, которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
Рассмотрим реальный процесс получения стального слитка. Стальные слитки получают охлаждением в металлических формах (изложницах) или на установках непрерывной разливки. В изложнице сталь не может затвердеть одновременно во всем объеме из-за невозможности создания равномерной скорости отвода тепла. Поэтому процесс кристаллизации стали начинается у холодных стенок и дна изложницы, а затем распространяется внутрь жидкого металла.
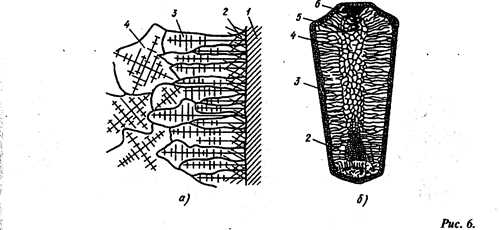
Схема строения стального слитка:
а – расположение дендритов в наружных частях слитка, б – строение слитка; 1 — стенки изложницы, 2 – мелкие равноосные кристаллы, 3 ~ древовидные кристаллы, 4 – равноосные неориентированные кристаллы больших размеров, 5 – усадочная рыхлость, 6 — усадочная раковина
При соприкосновении жидкого металла со стенками изложницы 1 (рис. 6) в начальный момент образуется зона мелких равноосные кристаллов 2. Так как объем твердого металла меньше жидкого, между стенкой изложницы и застывшим металлом образуется воздушная прослойка и сама стенка нагревается от соприкосновения с металлом. Поэтому скорость охлаждения металла снижается, и кристаллы растут в направлении отвода теплоты. При этом образуется зона 3, Состоящая из древовидных или столбчатых кристаллов. Во внутренней зоне слитка 4 образуются равноосные, неориентированные кристаллы больших размеров в результате замедленного охлаждения.
В верхней части слитка, которая затвердевает в последнюю очередь, образуется усадочная раковина 6 вследствие уменьшения объема металла при охлаждении. Под усадочной раковиной металл в зоне 5 получается рыхлым из-за большого количества усадочных пор. Для получения изделий используют только часть слитка, удаляя усадочную раковину и рыхлый металл слитка для последующего переплава.
Слиток имеет неоднородный химический состав, который тем больше, чем крупнее слиток. Например, в стальном слитке концентрация серы и фосфора увеличивается от поверхности к центру и снизу вверх. Химическую неоднородность по отдельным зонам слитка называют зональной ликвацией. Она отрицательно влияет на механические свойства металла.
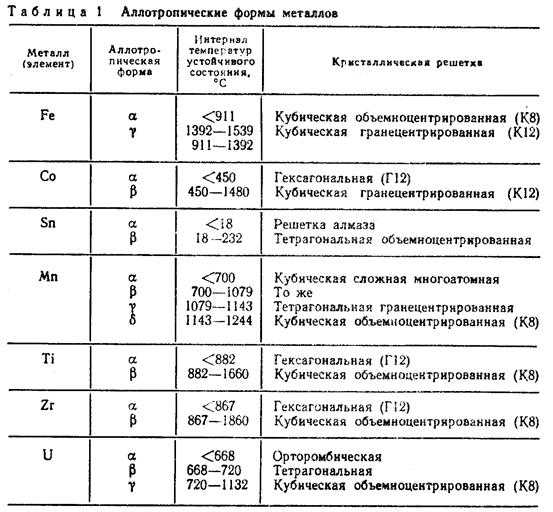
Аллотропия металлов. Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные, кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы: железо, олово, титан и др. Например, железо в интервале температур 911—1392°С имеет гранецентрированную кубическую решетку (ГКЦ) γ-Fе (рис.7). В интерпалах до 911˚С и от 1392 до 1539˚С железо имеет объемно-центрированную кубическую решетку (ОЦК) — α-Fе. Аллотропические формы металла обозначаются буквами α, β, γ и т. д. Существующая при самой низкой температуре аллотропическая форма металла обозначается через букву а, которая в виде индекса добавляется к символу химического элемента металла и т. д.
Аллотропические превращения в железе.
При аллотропических превращениях происходит изменение свойств металлов — изменение объема металлов (особенно характерно для олова) и растворимости углерода (характерно для железа).
Методы изучения строения металлов. Изучение строения металлов и сплавов производится методами макро- и микроанализа, рентгеновского, а также дефектоскопии (рентгеновской, магнитной, ультразвуковой). Методом макроанализа изучается макроструктура, т.е. структура, видимая невооруженным глазом или с помощью лупы, при этом выявляются крупные дефекты: трещины, усадочные раковины, газовые пузыри и т. д., а также неравномерность распределения примесей в металле. Макроструктуру определяют по изломам металла, по макрошлифам. Макрошлиф — это образец металла или сплава, одна из сторон которого отшлифована, тщательно обезжирена, протравлена и рассматривается с помощью лупы с увеличением в 5—10х.
Микроанализ выявляет структуру металла или сплава по микрошлифам, приготовленным так же, как и для макроанализа, но дополнительно отполированным до зеркального блеска. Шлифы рассматриваются в отраженном свете под оптическим микроскопом при увеличении до 3000х . Из-за различной ориентировки зерен металла они травятся не в одинаковой степени и под микроскопом свет также отражается неодинаково. Границы зерен, благодаря примесям, травятся сильнее, чем основной металл, и выявляются более рельефно. В сплаве структурные составляющие травятся также различно.
В электронном микроскопе рассматривают реплику — слепок с особо тонкой структуры металла при увеличениях до 100 000х. Этот важнейший анализ определяет размеры и форму зерен, структурные составляющие, неметаллические включения и их характер — трещины, пористость и т. д., качество термической обработки. Зная микроструктуру, можно объяснить причины изменения свойств металла.
С помощью рентгеновского анализа изучают атомную структуру металлов, типы и параметры кристаллических решеток, а также дефекты, лежащие в глубине. Этот анализ, основанный на дифракции рентгеновских лучей рядами атомов кристаллической решетки, позволяет обнаружить дефекты (пористость, трещины, газовые пузыри, шлаковые включения и т. д.), не разрушая металла. В местах дефектов рентгеновские лучи поглощаются меньше, чем в сплошном металле, и поэтому на фотопленке такие лучи образуют темные пятна, соответствующие форме дефекта.
Для исследования структуры металла и дефектов изделий широко применяют гамма-лучи, которые проникают в изделие набольшую глубину, чем рентгеновские.
Магнитным методом исследуют дефекты в магнитных металлах (сталь, никель и др.) на глубине до 2 мм (трещины различного происхождения, неметаллические включения и т. д.). Для этого испытуемое изделие намагничивают, покрывают его поверхность порошком железа; осматривают его поверхность и размагничивают изделие. Вокруг дефекта образуется неоднородное поле, вследствие чего магнитный порошок повторяет очертания дефекта. Другой метод – магнитный индукционный -часто используют для оценки полноты структурных превращений в сплавах (изделиях) после их термической обработки.
Ультразвуковым методом осуществляется эффективный контроль качества металла изделий и заготовок практически любых размеров. В импульсных ультразвуковых дефектоскопах ультразвуковая волна от щупа-излучателя распространяется в контролируемом изделии и при встрече с каким-либо дефектом отражается от него. При этом отраженные волны принимаются, усиливаются и передаются на показывающий индикатор. Ультразвук используют для контроля качества роторов, рельсов, поковок, проката и других изделий при необходимости сохранения целостности изделий.
3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Физические свойства. К физическим свойствам металлов относят цвет, плотность, температуру плавления, теплопроводность, тепловое расширение, теплоемкость, электропроводность, магнитные свойства и др.
Цветом называют способность металлов отражать световое излучение с определенной длиной волны. Например, медь имеет розово-красный цвет, алюминий – серебристо-белый.
Плотность металла характеризуется его массой, заключенной в единице объема. По плотности все металлы делят на легкие (менее 4500кг/м1) и тяжелые. Плотность имеет большое значение при создании различных изделий. Например, в самолето- и ракетостроении стремятся использовать более легкие металлы и сплавы (алюминиевые, магниевые, титановые), что способствует снижению массы изделий.
Температурой плавления называют температуру, при которой металл переходит из твердого состояния в жидкое. По температуре плавления различают тугоплавкие металлы (вольфрам 3416°С, тантал 2950°С, титан 1725°С и др.) и легкоплавкие (олово 232°С, свинец 327°С, цинк 419,5°С, алюминий 660°С). Температура плавления имеет большое значение при выборе металлов для изготовления литых изделий, сварных и паяных соединений, термоэлектрических приборов и других изделий. В системе СИ температуру плавления выражают в градусах Кельвина (К).
Теплопроводностью называют способность металлов передавать тепло от более нагретых к менее нагретым участкам тела. Серебро, медь, алюминий обладают большой теплопроводностью. Железо имеет теплопроводность примерно в три раза меньше, чем алюминий, и в пять раз меньше, чем медь. Теплопроводность имеет большое значение при выборе металла для деталей. Например, если металл плохо проводит тепло, то при нагреве и быстром охлаждении (термическая обработка, сварка) в нем образуются трещины. Некоторые детали машин (поршни двигателей, лопатки турбин) должны быть изготовлены из материалов с хорошей теплопроводностью. В системе СИ теплопроводность имеет размерность Вт/ (м • К).
Тепловым расширением называют способность металлов увеличиваться в размерах при нагревании и уменьшаться при охлаждении. Тепловое расширение характеризуется коэффициентом линейного расширения α =(l2-l1)/[l1(t2-t1)], где l1 и l2 длины тела при температурах t1 и t2. Коэффициент объемного расширения равен 3α. Тепловые расширения должны учитываться при сварке, ковке и горячей объемной штамповке, изготовлении литейных форм, штампов, прокатных валков, калибров, выполнении точных соединений и сборке приборов, при строительстве мостовых ферм, укладке железнодорожных рельсов.
Теплоемкостью называют способность металла при нагревании поглощать определенное количество тепла. В системе СИ имеет размерность Дж/К. Теплоемкость различных металлов сравнивают по величине удельной теплоемкости — количеству тепла, выраженному в больших калориях, которое требуется для повышения температуры 1 кг металла на 1°С (в системе СИ — Дж/(кгК)).
Способность металлов проводить электрический ток оценивают двумя взаимно противоположными характеристиками —электропроводимостью и электросопротивлением. Электрическая проводимость оценивается в системе СИ в сименсах (См), а удельная электропроводимость—в См/м, аналогично электросопротивление выражают в омах (Ом), а удельное электросопротивление – в Ом/м. Хорошая электропроводимость необходима, например, для токонесущих проводов (медь, алюминий). При изготовлении электронагревательных приборов и печей необходимы сплавы с высоким электросопротивлением (нихром, константан, манганин). С повышением температуры металла его электропроводимость уменьшается, а с понижением — увеличивается.
Магнитные свойства характеризуются абсолютной магнитной проницаемостью или магнитной постоянной, т. е. способностью металлов намагничиваться. В системе СИ магнитная постоянная имеет размерность Гн/м. Высокими магнитными свойствами обладают железо, никель, кобальт и их сплавы, называемые ферромагнитными. Материалы с магнитными свойствами применяют в электротехнической аппаратуре и для изготовления магнитов.
Химические свойства. Химические свойства характеризуют способность металлов и сплавов сопротивляться окислению или вступать в соединение с различными веществами: кислородом воздуха, растворами кислот, щелочей и др. Чем легче металл вступает в соединение с другими элементами, тем быстрее он разрушается. Химическое разрушение металлов под действием на их поверхность внешней агрессивной среды называют коррозией.
Металлы, стойкие к окислению при сильном нагреве, называют жаростойкими или окалиностойкими. Такие металлы применяют для изготовления деталей, которые эксплуатируются в зоне высоких температур.
Сопротивление металлов коррозии, окалинообразованию и растворению определяют по изменению массы испытуемых образцов на единицу поверхности за единицу времени.
Химические свойства металлов обязательно учитываются при изготовлении тех или иных изделий. Особенно это относится к изделиям или деталям, работающим в химически агрессивных средах.
Похожие статьи:
poznayka.org
Атомно-кристаллическое строение металлов
Министерство образования и науки Украины
Донбасский государственный технический университет
Кафедра ОМД
ЛЕКЦИЯ
по дисциплине Металловедение
на тему
«Атомно-кристаллическое строение металлов»
Ст.преп. Горецкий Ю.В.
Алчевск 2009
«Атомно-кристаллическое строение металлов»
1. Строение металлов в твердом состоянии
Все металлы и металлические сплавы – тела кристаллические, атомы (ионы) расположены в металле закономерно в отличие от аморфных тел, в которых атомы расположены хаотично.
Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т.е. коллективизируются и свободно перемещаются между положительно заряженными и периодически расположенными ионами.
Устойчивость металла определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами (такое взаимодействие получило название металлической связи).
Сила связи в металлах определяется силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной (рис. 1)
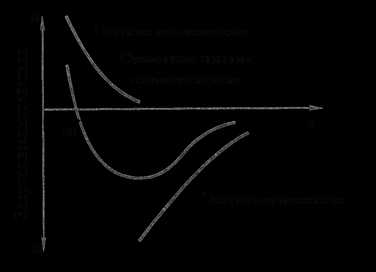
Рисунок 1. Энергетические условия взаимодействия атомов в кристаллической решетке вещества
Величина а соответствует расстояние между атомами в кристаллической решетке, а а0 соответствует равновесному расстоянию между атомами. В связи с этим в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Металлические состояния характеризуются высокой энергией связи между атомами. Мерой ее служит теплота сублимации (сумма энергии необходимой для перехода твердого металла к парообразному состоянию, для металла – от 20 до 200 ккал/(г·атом)).
2. Атомно-кристаллическое строение металлов
Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Атомы в кристалле расположены в определенном порядке, который периодически повторяется в трех измерениях.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узле которой располагаются атомы (ионы), образующие металл.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки (решетки).
Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки a, b, c и три угла между ними α, β, γ. Эти величины называют параметрами кристаллической решетки.
Кристаллические решетки бывают простыми (атомы только в вершинах решетки) и сложными.
Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГПУ) (рис. 2).
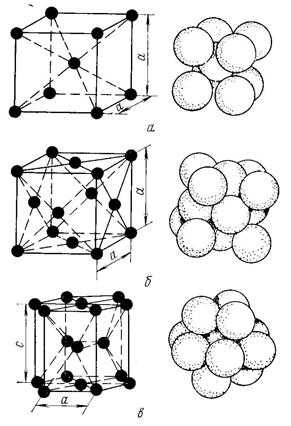
ОЦК: Rb, K, Na, Li, Tiβ , Tlβ , Zrβ , Ta, W, V, Feα , Cr, Nb, Ba, и др.
ГЦК: Cu, Al, Pt, Pb, Ni, Ag, Au, Pd, Rh, Ir, Feγ , Coα , Caα , Ce, Srα , Th, Sc и др.
ГПУ: Mg, Cd, Re, Os, Ru, Zn, Be, Coβ , Caα , Zrα , Laα , Tiα и др.
Рисунок 2. Кристаллические решетки металлов и схемы упаковки атомов
Расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку, называют периодом решетки, измеряется в нанометрах (1нм = 10-9 см = Å= 10-8 см).
Периоды решетки металлов находятся в пределах 0,2 – 0,7 нм.
ДляОЦК: a, b, c; a = b = c.
ДляГЦК: a, b, c; a = b = c.
Для ГПУ: а, с; с/а = 1,633 (к Zn не относится)
Число атомов в каждой элементарной ячейке (плотность упаковки – равняется числу атомов, приходящихся на одну элементарную ячейку):
ОЦК: ПУ (плотноупакованная) =
;ГЦК: ПУ =
;ГПУ: ПУ =
.Координационное число – под ним понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов:
ОЦК: расстояние (min) между атомами
, на этом расстоянии от рассматриваемого атома находится 8 соседей – К8 .ГЦК:
, К12.ГПУ: Г12 (с/а = 1,633).
Коэффициент заполнения ячейки (плотность укладки) – определяется как отношение объема, занятого атомами к объему ячейки:
ОЦК: 68%
ГЦК: 74%
ГПУ: 74%
Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Атомный радиус возрастает при уменьшении координационного числа.
3. Полиморфные (аллотропические) превращения
Атомы металла – исходя из геометрических соображений, могут образовать любую кристаллическую решетку.
Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах (т.н. полиморфных (аллотропических) модификациях). В результате полиморфного превращения атомы кристаллического тела, имеющего решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа.
Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой α, при более высокой температуре β, затем γ и т.д.
Полиморфное превращение протекает при постоянной температуре (например, при нагреве идет поглощение теплоты).
Известные полиморфные превращения: Feα ↔ Feβ ; Coα ↔ Coβ ; Tiα ↔ Tiβ ; Mnα ↔ Mnβ ↔ Mnγ ↔ Mnδ ; Snα ↔ Snβ , а также для Ca, Li, N, Cs, Sr, Te, Zr, V и др.
Металл с данной кристаллической решеткой должен обладать меньшим запасом свободной энергии.

Рисунок 3. Полиморфизм железа и его связь со свободной энергией системы
Полиморфизм железа. Из рис. 3, видно, что в интервале температур 911 – 1392°С устойчивым является γ-железо (К 12) (имеет min свободную энергию), а при температурах ниже 911°С и выше 1392°С устойчиво α-железо (К 8).
В твердом металле полиморфные превращения происходят в результате зарождения и роста кристаллов аналогично кристаллизации из жидкого состояния. Зародыши новой модификации наиболее часто возникают на границах зерна исходных кристаллов.
В результате полиморфного превращения образуется новые кристаллические зерна, имеющие другой размер и форму, поэтому превращение также называют перекристаллизацией.
Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов и сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических и химических свойств и т.д.
Высокотемпературная модификация имеет высокую пластичность.
В таблице № 1 показан интервал температур существования различных аллотропических форм некоторых, имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.
4. Анизотропия свойств металлов
Из атомно-кристаллического строения металлов видно, что плотность расположения атомов по различным плоскостям в кристаллических решетках неодинакова (рис. 4).
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки многие свойства (химические, физические, механические) каждого кристалла зависят от направления решетки. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
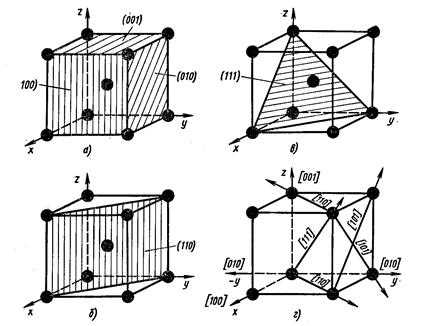
Рисунок 4. Расположение атомов в различных плоскостях и направлениях в кубической решетке (ОЦК)
Кристалл – тело анизотропное в отличие от аморфных тел (стекло, пластмассы и т.д.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т.е. состоят из большого числа анизотропных кристаллов. В большинстве случаев, как уже указывалось выше, кристаллы статистически неупорядоченно ориентированы один по отношению к другому, поэтому во всех направлениях свойства более или менее одинаковы, т.е. поликристаллическое тело является изотропным (вернее – квазиизотропным (ложная изотропия)). Такая мнимая изотропность не будет наблюдаться, если кристаллы имеют одинаковую преимущественную ориентировку в каких-то направлениях. Эта ориентированность, или текстура, создается в известной степени, но не полностью в результате значительной холодной деформации; в этом случае поликристаллический металл приобретает анизотропию свойств.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980.
2. Гуляев А.П. Металловедение. М., 1986.
3. Новиков И.И. Дефекты кристаллического строения металлов. М., 1983.
mirznanii.com
Строение кристаллической решетки – Справочник химика 21
Сочетание специфического строения кристаллической решетки и химического модифицирования цеолитов ионным обменом или нанесением на но- [c.310]Если предположить, что первый этап, так называемая объемная диффузия, не является определяющим, можно сосредоточить внимание на остальных двух этапах. Если на поверхности уже имеется ступень, процесс роста поверхности хорошо описывается методом, предложенным впервые в [51]. Этот метод, однако, не дает достаточно удовлетворительного ответа на вопрос о природе возникновения первичной ступени на поверхности. Эта трудность была преодолена в 1949 г. Франком, который высказал предположение, что источником ступеней при росте плоскостей кристалла являются дислокации. Дислокация представляет собой оц-ределенный тип дефекта в строении кристаллической решетки. В точке дефекта энергетический барьер значительно меньше, поэтому захват частиц и, следовательно, возникновение новой плоскости облегчаются. Дислокация, которая возникает в некоторой [c.266]
В свободном виде углерод существует как графит, алмаз и карбин (аллотропия углерода) это-твердые вещества с различным строением кристаллической решетки. [c.147]
Свойства силикатов зависят от их состава, строения кристаллической решетки, природы сил, действующих между ионами, [c.304]
Главное влияние на физические свойства металлов оказывает электронное строение атомов элемента и строение кристаллической решетки металла. Важными характеристиками кристаллической решетки являются ее симметрия и координационное число металла. Кристаллические решетки металлов бывают различной симметрии, но наиболее часто встречаются объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и плотнейшая гексагональная (Г) кристаллическая решетка (рис. 11.1). [c.319]
При равной степени дефектности кристаллов прочнее из них оказываются те, у которых выше теоретическая прочность, обусловленная их химическим составом и строением кристаллической решетки. Поэтому во всех случаях наиболее прочными элементами кристаллической структуры цементного камня являются в первую очередь игольчатые кристаллы низкоосновных гидросиликатов кальция типа SH. Увеличение их доли в твердеющей системе способствует упрочнению цементного камня. [c.342]
Изменение радиусов атомов -металлов в зависимости от заполнения подуровня -электронами показано на рис. 162. Для элементов всех периодов характерен минимум, лежащий приблизительно в середине ряда -металлов данного периода. Снижение металличности атомов данного элемента сказывается и на строении кристаллической решетки. Типы кристаллических решеток для -металлов, многие из которых обладают полиморфизмом или аллотропическими модификациями, приведены в табл. 12.2. Как видно из таблицы, низкотемпературные модификации марганца не имеют типичной для металлов структуры, а при высоких температурах его структура приближается к структуре железа. [c.312]
Различие в величинах энергий связи можно объяснить на основе методов квантовой химии как различие в степени гибридизации молекулярных орбиталей. Для однородных по составу кристаллических тел (модификаций) энергию связей катиона р анионом можно рассчитать, если известны теплота возгонки (сублимации) тела и строение кристаллической решетки. [c.73]
Эти разновидности активного окснда алюминия при одном и том же химическом составе несколько различаются по строению кристаллической решетки (разный порядок чередования слоев, состоящих из плотно упакованных атомов кислорода и расположенных между ними атомов алюминия п гидроксилов) 1126, 128]. [c.65]
В молекуле фтора этих дополнительных связей нет (фтор не имеет ( -орбиталей) и поэтому его молекула менее прочна. Сродство к электрону у фтора несколько меньше, чем у хлора, но больше, чем у брома, и составляет 350 кДж/моль атомов. Стандартный окислительно-восстановительный потенциал фтора очень высок ( + 2,85 В) фтор — сильнейший окислитель, способный оттягивать электроны даже от атома кислорода. Ион фтора по размерам почти точно равен иону кислорода О -, поэтому оба иона образуют соединения, похожие друг на друга. Между фторидами ионного тина, например фторидом натрия, и оксидами, например оксидом кальция, наблюдается сходство в строении кристаллической решетки. По ряду свойств фториды металлов резко отличаются от хлоридов и бромидов. Так, фторид серебра растворим в воде, в то время как его хлориды и бромиды почти нерастворимы. [c.194]
Образование твердых растворов и изоморфных смесей. Явления изоморфизма давно известны и являются важной характеристикой многих элементов и их соединений. Изоморфизм способствует выделению с.мешан-ных кристаллов, когда две различные по составу соли, наиример алюминиевые и железные квасцы, образуют общую кристаллическую решетку. Известно, что Д. И. Менделеев считал изоморфизм одной из важных характеристик элементов. Такие кристаллы образуют не только вещества, имеющие близкую ио строению кристаллическую решетку. В более широком смысле такие системы называют твердыми растворами. Хорошо известны твердые растворы разнообразных металлических сплавов, силикатов, соленых систем и т. д. В ряде случаев соосаждение также обусловлено образованием твердых растворов. [c.63]
Для дальнейшего изучения электронного строения кристаллической решетки металлов необходимо обратиться к специальной литературе. [c.582]
Изменение энергии при переходе атома в междуузлие в значительной степени зависит от строения кристаллической решетки и от свойств этого атома. При высокой энергии перехода иона в междуузлие дефекты по Френкелю не образуются в заметных количествах. Если в решетке имеются крупные пустоты-междуузлия, то энергия образования таких дефектов ниже и они встречаются чаще. Кроме того, дефекты по Френкелю часто обнаруживаются у кристаллов, ионы которых имеют сильную поляризуемость, и редко наблюдаются у оксидов и ковалентных веществ. [c.168]
Объяснение. В зависимости от внутреннего строения кристаллической решетки глинистые минералы обладают различной набухае-мостью при смачивании их водой. Ниже приведены результаты определения набухания при полном смачивании разных глинистых минералов и почв. [c.33]
В некоторых материалах (железо, титан) могут происходить аллотропические превращения, т. е. изменение строения кристаллической решетки (см. 1.2, а также кн. 1 данной серии). В результате внутри первичного зерна появляются более мелкие вто- ричные кристаллиты. Понятие зерна в этом случае обычно относят [c.257]
С помощью координационного числа можно охарактеризовать строение кристаллической решетки вещества. Эти, так на- [c.31]
Любая кристаллическая решетка, а значит, и любой кристалл имеют
www.chem21.info
Кристаллическая решетка — wiki.web.ru
Кристаллическая решётка – присущее находящемуся в кристаллическом состоянии веществу правильное пространственное расположение атомов (ионов, молекул), характеризующееся периодической повторяемостью в трёх измерениях.
Нельзя смешивать понятия кристаллическая структура и кристаллическая решетка. Первый термин относится к реальной картине атомного строения кристалла, второй – к геометрическому образу, описывающему трехмерную периодичность в размещении атомов (или иных частиц) в кристаллическом пространстве. Различие между ними вытекает хотя бы из того, что существует огромное количество разнообразных кристаллических структур, которым соответствует всего лишь 14 решеток Бравэ. Необходимым следствием этого является то, что одна и та же ячейка Бравэ может описывать различные на первый взгляд кристаллические структуры.
Благодаря такой периодичности для описания кристаллической структуры достаточно знать размещение атомов в элементарной ячейке. Её повторением путём параллельных дискретных переносов (трансляций) образуется вся структура кристалла. В соответствии с симметрией кристалла его элементарная ячейка имеет форму косоугольного или прямоугольного параллелепипеда, трехугольной, четырехугольной или шестиугольной призмы, куба.
Наличием у кристаллов кристаллической решётки объясняются анизотропия свойств кристаллов, плоская форма их граней, постоянство углов и другие законы кристаллографии. Изучение геометрии и измерение углов кристалла даёт информацию о параметрах углов его элементарной ячейки.
Кристаллическая структура не является статической конструкцией. Образующие её атомы или молекулы колеблются около определённых положений равновесия. Характер этих колебаний зависит от симметрии, координации атомов, энергии межатомных связей. С повышением температуры колебания частиц усиливаются, что приводит к разрушению кристаллической решётки и к переходу вещества из кристаллического в жидкое состояние.
Структура реального кристалла всегда отличается от идеальной схемы его кристаллической структуры. Грани кристаллов соответствуют плоским сеткам, рёбра – рядам, а вершины углов – узлам пространственной решётки. Пространственная решётка имеет бесконечное множество плоских сеток, рядов и узлов. Но реальным граням могут соответствовать лишь те плоскости кристаллической решётки, которые имеют наибольшую ретикулярную плотность, т.е. на которых на единицу площади приходится наибольшее число составляющих её частиц (атомов, ионов). Таких плоских сеток сравнительно немного, поэтому кристаллы имеют ограничения в отношении числа возможных граней и простых форм.
Помимо всегда имеющих место тепловых колебаний атомов, трансляционно «равные» атомы могут в действительности отличаться по атомному номеру (изоморфизм) или по массе ядра. Кроме того, в реальном кристалле всегда имеются многочисленные разного рода дефекты: примесные атомы, вакансии, дислокации и проч., что приводит к формированию блочно-мозаичного строения или к расщеплению кристалла во время роста.
Более подробное рассмотрение понятий “структура” и “решетка” проведено в обзоре Ю.К.Егорова-Тисменко
Литература:
- Шубников А. В., Флинт Е. Е., Бокий Г. Б., Основы кристаллографии. М.— Л., 1940.
- Белов Н. В. Структура ионных кристаллов и металлических фаз, М., 1947.
wiki.web.ru
Строение кристаллической решетки. Элементарные ячейки | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Кристаллическая решетка может быть представлена как совокупность повторяющихся в пространстве элементарных ячеек, имеющих форму параллелепипеда с ребрами a1, a2, a3, называемыми периодами кристаллической решетки. В зависимости от соотношений между периодами элементарной ячейки и углами между ребрами параллелепипеда различают 7 типов, или сингоний: кубическую, тетрагональную, гексагональную, тригональную, ромбическую, моноклинную и триклинную.
Идея о том, что кристалл представляет собой объединение микроскопических «примитивных форм» — элементарных ячеек, была высказана в 1800 г. Гаюи. Случайно уронив и разбив кристалл известкового шпата, он заметил, что осколки являются миниатюрными копиями первоначального кристалла. Осколки можно было дробить и дальше, но все более мелкие части сохраняли ту же форму. Отсюда и возникла «гипотеза Гаюи» о существовании элементарных ячеек. Только в 1912 г. Лауэ, обнаружив дифракцию рентгеновских лучей на кристаллах, косвенным образом подтвердил эту гипотезу.
Число атомов в элементарной ячейке составляет от одного (химический элемент) до 102 (химическое соединение) и 106 (белки, вирусы). Периоды кристаллических решеток меняются в пределах от нескольких ангстрем до 102 — 103Å. (1 Å = 10-10 м.)
Строение кристаллической решетки можно полностью описать, задав элементарную ячейку и указав расположение атомов в ней. При переносе ячейки в пространстве, параллельно самой себе, в некоторое новое положение, заданное вектором
T̅ = n1a̅1 + n2a̅2 + n3a̅3,
перенесенная ячейка полностью совпадает с ячейкой кристалла, уже существующей в точке переноса. Математики называют такую операцию трансляцией на вектор T̅, а соответствующую симметрию — трансляционной.
| Элементарная ячейка кристаллической решетки |
Существуют и иные способы совмещения решетки с собой, отличные от параллельного переноса. Это самые различные вращения, отражения, инверсии и комбинации этих движений с трансляцией.
Природа перепробовала в кристаллах все возможные группы дискретных симметрий. Методами теории групп были исследованы пространственные (федоровские) симметрии кристаллических решеток — их оказалось 230! Материал с сайта http://worldofschool.ru
Среди исследованных более чем 30 тысяч кристаллических веществ встречаются и кристаллы с симметриями, отличными от федоровских. Это связано с расширением понятия совпадения ячеек. После совмещения ячеек может оказаться, что совпадающие атомы решетки находятся в различных состояниях, например, имеют несовпадающие значения магнитных моментов или неодинаковые значения некоторых других непространственных переменных.
Для учета таких различий вводятся обобщенные симметрии. Это 1651 — шубниковская группа, 2942 — беловские группы и т. д. Они интенсивно исследуются в кристаллофизике — разделе физики твердого тела, занимающемся изучением связей между структурой решетки и физическими свойствами вещества.
На этой странице материал по темам:Элементарная ячейка доклад
Строение элементарных ячеек
Строение кристаллической решетки доклад
worldofschool.ru

