Таблица свойства и применение алюминия: Химические свойства алюминия, его применение
alexxlab | 07.06.2021 | 0 | Разное
Свойства алюминия
Характерными свойствами чистого алюминия являются его малый удельный вес, низкая температура плавления, высокая тепловая и электрическая проводимость, высокая пластичность, очень большая скрытая теплота плавления и прочная, хотя и очень тонкая пленка окиси, покрывающая поверхности металла и защищающая его от проникновения кислорода внутрь.
Малая плотность делает алюминий основой легких конструкционных материалов; большая пластичность позволяет применять к алюминию все виды обработки давлением и получать из него листы, прутки, проволоку, трубы, тончайшую фольгу, штампованные детали с глубокой вытяжкой и др. Хорошая электрическая проводимость обеспечивает широкое применение алюминия в электротехнике. Так как плотность алюминия в 3,3 раза ниже, чем у меди, а удельное сопротивление лишь в 1,7 раза выше, чем у меди, то алюминий, на единицу массы имеет вдвое более высокую проводимость, чем медь. Прочная пленка окиси быстро покрывает свежий разрез металла уже при комнатной температуре, обеспечивая алюминию высокую устойчивость против коррозии в атмосферных условиях.
Сернистый газ, сероводород, аммиак и другие газы, находящиеся в воздухе промышленных районов, не оказывают заметного влияния на скорость коррозии алюминия. Действие пара на алюминий также не-значительно. Алюминий, не содержащий меди, достаточно стоек (в отсутствие электрического тока) в естественной морской воде. В концентрированных азотной и серной кислотах алюминий также практически устойчив. В разбавленных кислотах и растворах едких щелочей алюминий быстро разрушается. Однако в растворах аммиака он достаточно стоек. В контакте с большинством металлов и сплавов, являющихся благородными по электрохимическому ряду потенциалов, алюминий служит анодом и, следовательно, коррозия его в электролитах будет прогрессировать. Чтобы избежать образования гальванопар во влажной атмосфере, место соединения алюминия, с другими металлами герметизируется лакировкой или другим путем.
Длительные испытания проводов из алюминия показали, что они в отношении устойчивости против коррозии не уступают медным.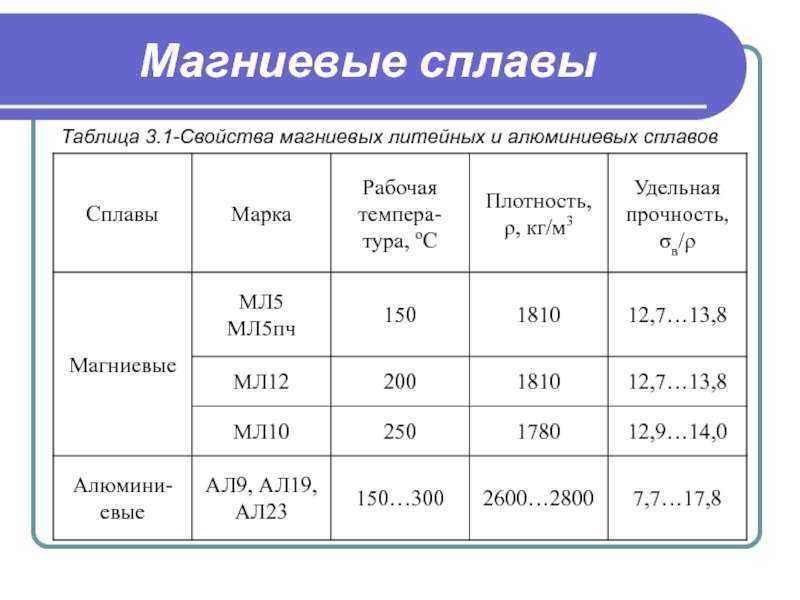
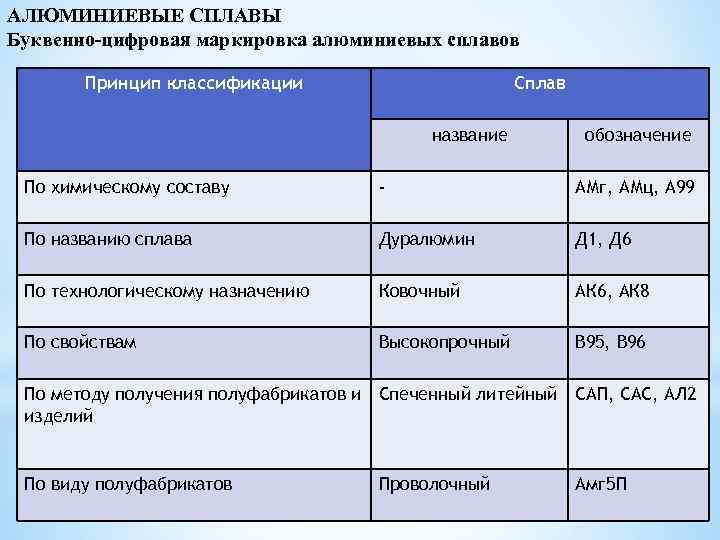
В табл. 8-16 приведены классификация и химический состав алюминия.
Влияние примесей на электрическую проводимость алюминия различно. Примеси, образующие с алюминием твердые растворы, сильно снижают электропроводность; примеси, не входящие в твердые растворы, почти не оказывают влияния на снижение проводимости. На рис. 8-4 показано изменение проводимости алюминия в зависимости от содержания примесей.
Физические свойства алюминия марок А5; А6 и АЕ, предназначенного для изготовления шин и проводов, приведены ниже:
Плотность при 20 °С, кг/м3 …………………….9700
Удельное электрическое сопротивление при 20 °С (не более), мкОм м:
проволока твердая и полутвердая …………. 0,0283
мягкая ……………………………………………….0,0280
шины …………………………………………………0,0290
Температурный коэффициент сопротивления в интервале 0-150 °С,
…… 0,004
Температурный коэффициент линейного расширения (20-100 °С), ……….
Теплопроводность, Вт/(м °С)………………………………………………………………. 2,05
2,05
Температура плавления, °С …………………………………………………………………..660-647
Теплота плавления, Дж/кг ………………………………………………………………..
Температура отжига, °С ………………………………………………………………………350-400
Средняя теплоемкость (0-100 °С), Дж/(кг °С)…………………………………………….240
В табл. 8-17 приведена ориентировочная зависимость механических свойств алюминия от температуры.
Рис. 8-4
Изменение проводимости алюминия в зависимости от содержания примесей
| Таблица 8-16 Химический состав технического алюминия (ГОСТ 11069-64) | ||||||
|---|---|---|---|---|---|---|
| Марка алюминия | Химический состав, % | |||||
| Алюминий (не менее) | Примеси (не более) | |||||
| Железо | Кремний | Медь | Цинк | Титан | ||
| Особой чистоты | ||||||
| А999 | 99,999 | – | – | – | – | – |
| Высокой чистоты | ||||||
| А995 | 99,995 | 0,0015 | 0,0015 | 0,001 | 0,001 | 0,001 |
| А99 | 99,99 | 0,003 | 0,003 | 0,003 | 0,003 | 0,002 |
| А97 | 99,97 | 0,015 | 0,015 | 0,005 | 0,004 | 0,002 |
| А95 | 99,95 | 0,030 | 0,030 | 0,010 | 0,005 | 0,002 |
| Технической чистоты | ||||||
| A85 | 99,85 | 0,08 | 0,06 | 0,01 | 0,02 | 0,01 |
| A85 | 99,80 | 0,12 | 0,10 | 0,01 | 0,04 | 0,02 |
| А7 | 99,70 | 0,16 | 0,16 | 0,01 | 0,05 | 0,02 |
| А6 | 99,60 | 0,25 | 0,20 | 0,01 | 0,06 | 0,03 |
| А5 | 99,50 | 0,30 | 0,30 | 0,02 | 0,06 | 0,03 |
| А0 | 99,00 | 0,50 | 0,50 | 0,02 | 0,08 | 0,03 |
| А | 99,00 | 0,80 | 0,50 | 0,03 | 0,08 | 0,03 |
| АЕ | 99,50 | 0,35* | 0,12 | 0,02 | 0,05 | 0,01 ** |
| Таблица 8-17 Механические свойства проводникового алюминия в зависимости от температуры | ||||||||
|---|---|---|---|---|---|---|---|---|
| Механические свойства | Температура, °С | |||||||
| 20 | 100 | 200 | 300 | 20 | 100 | 200 | 300 | |
| Твердотянутый | Отожженный (300°С, 2 ч в масле) | |||||||
| Предел прочности при растяжении, МПа Истинный предел прочности при растяжении, МПа Относительное удлинение, % Сужение площади поперечного сечения, % Предел текучести, МПа Предел вибрационной усталости, МПа | 145 390 14 77,5 130 74 | 130 300 9,5 74,3 118 65 | 81 155 12,2 81,7 64 28 | 28 – 46 95,7 17 – | 88 330 33,1 84,4 44 26,5 | 76 270 32,8 78,2 41 25 | 49 170 35,1 82,8 30 19 | 38 185 33,3 83,7 24,5 15 |
Все страницы раздела на websor
Алюминий и его соединения.
 Свойства и применение алюминия
Свойства и применение алюминияУрок химии 13 — Алюминий и его соединения. Свойства и применение алюминия.
В периодической таблице алюминий находится в третьем периоде, в главной подгруппе третьей группы. Заряд ядра +13. Электронное строение атома 1s22s22p63s23p1.
Наиболее характерная степень окисления атома алюминия +3. Отрицательная степень окисления проявляется редко. Во внешнем электронном слое атома существуют свободные d-подуровни. Благодаря этому его координационное число в соединениях может равняться не только 4 ([AlCl4]—, [AlH4]—, алюмосиликаты), но и 6 (Al2O3,[Al(OH2)6]3+).
Алюминий — типичный амфотерный элемент. Для него характерны не только анионные, но и катионные комплексы. Так, в кислой среде существует катионный аквакомплекс [Al(OH2)6]3+, а в щелочной — анионный гидроксокомплекс [Al(OH)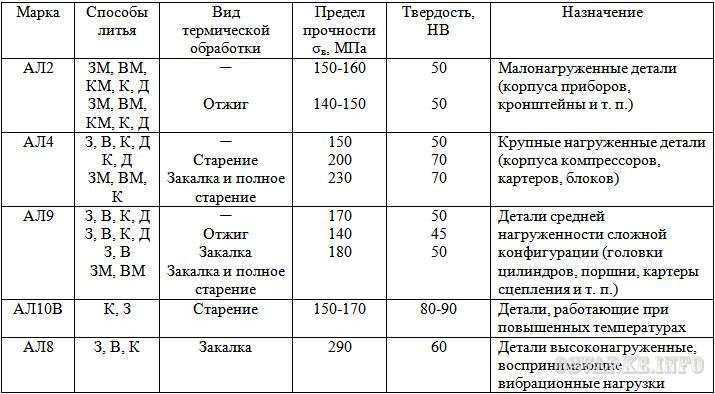
В виде простого вещества алюминий — серебристо-белый, довольно твердый металл с плотностью 2,7 г/см3 (т. пл. 660 оС, т. кип. ~2500 оС). Кристаллизуется в гранецентрированной кубической решетке. Характеризуется высокой тягучестью, теплопроводностью и электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов. При одинаковой электрической проводимости алюминиевый провод весит вдвое меньше медного.
На воздухе алюминий покрывается тончайшей (0,00001 мм), но очень плотной пленкой оксида, предохраняющей металл от дальнейшего окисления и придающей ему матовый вид. При обработке поверхности алюминия сильными окислителями (конц. HNO3, K2Cr2O7) или анодным окислением толщина защитной пленки возрастает. Устойчивость алюминия позволяет изготавливать из него химическую аппаратуру и емкости для хранения и транспортировки азотной кислоты.
Алюминий легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминиевая фольга (толщиной0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Основную массу алюминия используют для получения различных сплавов, наряду с хорошими механическими качествами характеризующихся своей легкостью. Важнейшие из них — дюралюминий (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумин (85 — 90% Al, 10 — 14% Si, 0,1% Na) и др. Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды и во многих других отраслях промышленности. По объему применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий, кроме того, применяется как легирующая добавка ко многим сплавам для придания им жаростойкости.
Химические свойства. Реагирует с неметаллами:
4Al + 3O2 → 2Al2O3 ; 2Al + 3Br2 → 2AlBr3
c оксидами металлов:
2Al + Fe2O3 → Al2O3 + 2Fe (алюмотермия)
c водой (если удалить оксидную пленку):
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
c кислотами ( HCl и Н2SO4 пассивируется конц. HNO3 ):
HNO3 ):
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
c щелочами:
2Al + 2NaOH + 6H2О → 2Na [Al(OH)4] + 3H2↑
Соединения алюминия.
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050 оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Ввиду нерастворимости Al2O3 в воде, отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH— постепенно замещаются в аквокомплексах [Al(OH2)6]3+молекулы воды:
[Al(OH2)6]3+ + OH— = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH— = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH— = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al2O3 с оксидами соответствующих металлов).
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Галогениды алюминия в обычных условиях — бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Он тугоплавок, мало растворяется в воде, химически неактивен. Основной способ получения AlF3 основан на действии безводного HF на Al2O3 или Al:
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. Взаимодействие галогенидов алюминия с водой сопровождается значительным выделением теплоты. В водном растворе все они сильно гидролизованы, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый.
Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12H2O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующиеся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсордбируя краситель, прочно удерживает его на волокне.
Из остальных производных алюминия следует упомянуть его ацетат (иначе — уксуснокислую соль) Al(CH3COO)3, используемый при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах.
Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах.
Это был урок химии 13 — Алюминий и его соединения. Свойства и применение алюминия.
Поделитесь этим постом со своими друзьями:
↑Как установить такие кнопки?↑
Подружитесь со мной:
1100-х24 | Коммерчески чистый алюминий, устойчивый к химическому воздействию и атмосферным воздействиям,
низкая стоимость, пластичность для глубокой вытяжки и легкость сварки, используется в химическом оборудовании,
лопасти вентилятора, обработка листового металла. |
2014-Т4, Т451 2014-Т6, Т651 | Рамы грузовиков, конструкции самолетов, автомобильные детали, цилиндры и поршни, детали машин, конструкции |
| Крепеж, фурнитура | |
2024-Т3, Т4 2024 -T351 Алклад | Высокопрочные конструкционные применения, отличная обрабатываемость в Т-состоянии, Хорошая удобоукладываемость и коррозионная стойкость, Alclad сочетает в себе высокую прочность и коррозионная стойкость, используемые в колесах грузовых автомобилей, конструкциях самолетов, автомобильных детали, крепеж, оборудование для отдыха, винты и заклепки |
3003-х22 3003-х24 3003-х26 | Самый популярный сплав общего назначения, прочнее 1100 с таким же хорошим качеством. формуемость и свариваемость, используемые в кухонной утвари, химическом оборудовании,
сосуды под давлением, изделия из листового металла, строительная фурнитура, резервуары для хранения,
грузовики и прицепы архитектурные формуемость и свариваемость, используемые в кухонной утвари, химическом оборудовании,
сосуды под давлением, изделия из листового металла, строительная фурнитура, резервуары для хранения,
грузовики и прицепы архитектурные |
3004-х48 | Обработка листового металла, резервуары для хранения, сельскохозяйственное применение, строительство продукты, контейнеры, электрические устройства, мебель, грузовики и прицепы |
3150-х24 3150-х28 3150-х35 | Сайдинг, изделия из листового металла, автозапчасти, строительные изделия, электроника, мебель, грузовики и прицепы |
3150-х24 3150-х28 3150-х35 | Сайдинг, изделия из листового металла, автозапчасти, строительные изделия, электроника, мебель, грузовики и прицепы |
| Приборы, посуда архитектурная, электрические проводники общего назначения листовой металл, скобяные изделия, морское применение | |
5052-х212 5052-х42 5052-х44 | Прочнее, чем 3003, легко формуется, хорошая свариваемость и стойкость к коррозии, используется в работе с листовым металлом, гидравлические трубы, приборы, давление суда, аппаратные знаки, морские приложения, грузовики |
6061-Т4 6061-Т6, Т651 | Хорошая формуемость, свариваемость, коррозионная стойкость и прочность в Т-состояние, хороший сплав общего назначения, используемый для широкого спектра конструкционных применения и сварные узлы, трубопроводы, морские применения, мебель, сельскохозяйственное применение, самолеты, архитектурные, строительные изделия, химическое оборудование, электрические и электронные детали, крепежные детали, общие листовой металл, оборудование для отдыха, резервуары для хранения |
6063-Т6 | Трубчатые перила, мебель, архитектурные профили, морское применение, грузовик и прицеп, оборудование для отдыха, строительные товары, электрические и электронные детали |
| Высокопрочный сплав для самолетов и конструкций, оборудования для отдыха | |
Свойства алюминия | bartleby
Что такое алюминий?Алюминий (или алюминий) — металл серебристо-белого цвета. Химическим символом алюминия является Al, и он имеет атомный номер (Z) 13 в периодической таблице. Название алюминия для этого металла происходит от латинского слова «alumen», что означает «горькая соль». Алюминий был открыт в 1825 году Гансом Эрстедом, а позже Фридрих Вёлер выделил алюминий. Это наиболее часто встречающийся металл в ядре Земли, который составляет около 8% от общей массы ядра. Более того, это третий по распространенности элемент на Земле после кислорода и кремния. Электронное распределение алюминия на оболочку составляет 2, 8 и 3 с валентностью 3. Атомный вес составляет около 26,9.815 у.е.
Промышленное производство алюминия впервые началось в 1856 году, а затем, в 1954 году, алюминий, обогнав медь, стал самым производимым цветным искробезопасным металлом. Алюминий встречается в изверженных породах в виде полевого шпата и слюды. В результате выветривания образуется гидратированный оксид алюминия, боксит, который является основной рудой алюминия. Глинозем не растворяется в воде, но растворяется в расплавленном криолите.
В результате выветривания образуется гидратированный оксид алюминия, боксит, который является основной рудой алюминия. Глинозем не растворяется в воде, но растворяется в расплавленном криолите.
Плотность алюминия 2710 кг/м 3 с удельным весом 2,71. Алюминий в чистом виде имеет серебристо-белый цвет. Элемент чистого алюминия (Al) находится в p-блоке периодической таблицы. Чистый алюминий — очень мягкий, ковкий металл, а также отражает свет. Алюминий легко связывается с другими элементами и, следовательно, не встречается в чистом виде. Сульфаты алюминия являются наиболее распространенной формой алюминия в природе.
Алюминий легкий и немагнитный. Это второй по пластичности и шестой по пластичности металл. Ковкость – это свойство металла, которое позволяет его ковать или раскатывать в тонкие листы. С другой стороны, пластичность — это свойство, указывающее на способность металла деформироваться в тонкие проволоки. Другими словами, податливость — это способность деформироваться под действием сжимающих напряжений, а пластичность — под действием растягивающих напряжений.
Другими словами, податливость — это способность деформироваться под действием сжимающих напряжений, а пластичность — под действием растягивающих напряжений.
Алюминий имеет следующие химические свойства, а именно, он имеет температуру плавления 660,323°C (933,47 K и 1220,58°F) и температуру кипения 2470°C (2743 K и 4478°F). Следовательно, при стандартной температуре 20°С в природе он находится в твердом состоянии. Модуль Юнга, модуль сдвига и объемный модуль алюминия составляют 70 ГПа, 26 ГПа и 76 ГПа соответственно.
Алюминий естественным образом обладает хорошей коррозионной стойкостью ко многим химическим веществам, но имеет большое сродство к кислороду, что приводит к образованию оксидного слоя на поверхности металла при воздействии атмосферы. Этот оксидный слой образует защитное покрытие, предотвращающее дальнейшую коррозию.
Алюминий имеет стабильную кубическую структуру, которая остается стабильной до тех пор, пока не будет нагрета до температуры плавления.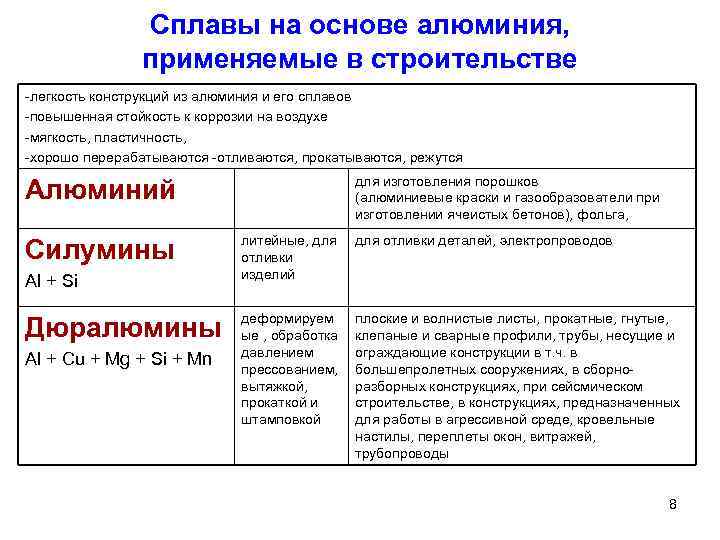 Поверхность этого металла менее блестящая и хорошо отражает свет. Коэффициент расширения алюминия при нагреве равен 23,2.
Поверхность этого металла менее блестящая и хорошо отражает свет. Коэффициент расширения алюминия при нагреве равен 23,2.
Механические свойства алюминия также заслуживают внимания. Его эластичность составляет около 10 000 фунтов на квадратный дюйм, а прочность на растяжение составляет около 13 000 фунтов на квадратный дюйм. Предел текучести алюминия составляет 5000 фунтов на квадратный дюйм, а предел текучести его подшипников составляет около 23 100 фунтов на квадратный дюйм. Прочность алюминия на сдвиг составляет около 9000 фунтов на квадратный дюйм, а усталостная прочность имеет значение 5000 фунтов на квадратный дюйм. Коэффициент Пуассона алюминия равен 0,35.
Различное промышленное использование алюминия Наиболее важным применением алюминия является строительство самолетов, в которых используется алюминий, легированный медью, марганцем, магнием и кремнием, что делает сплав легким, но прочным, как чистый алюминий, который не отличается особой силой.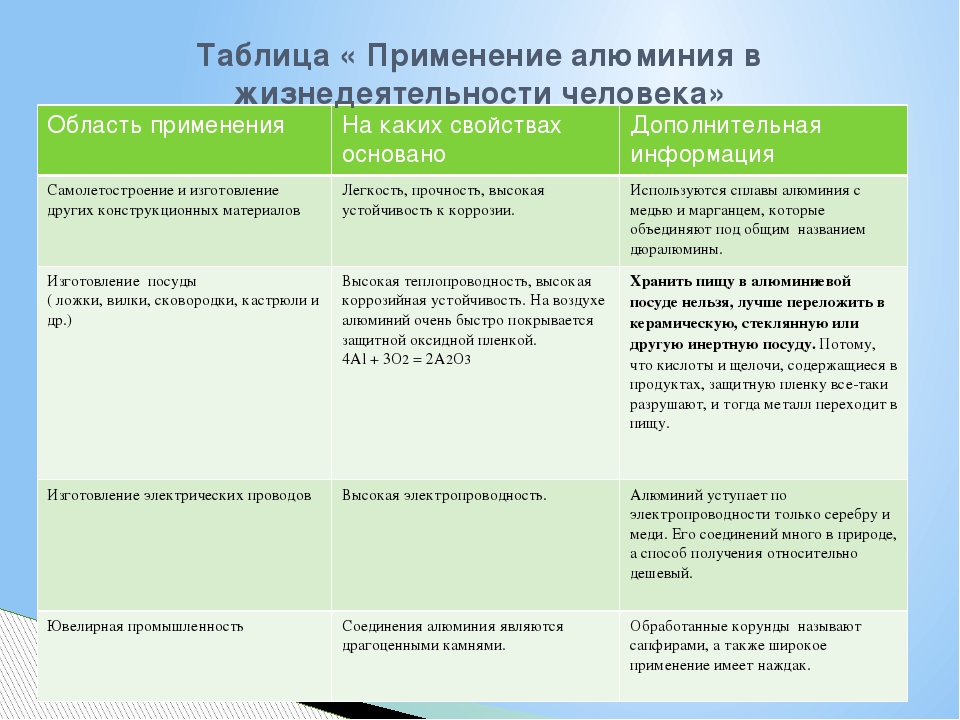
Алюминий — легкий металл с плотностью 2,71 г/см 3 , что составляет всего 1/3 rd от стали, а также намного ниже, чем у других металлов. Он выделяется как большой потенциал для применения в местах, где необходимы легкие детали, например, в самолетах.
Кроме того, алюминий также используется в строительстве кораблей из-за его коррозионной стойкости. Он также используется в оконных рамах, высотных зданиях, поездах, компонентах космических кораблей и так далее. Кровельные листы для домов состоят из алюминия.
Алюминиевый сплав Алюминий также сплавляется с другими металлами, которые еще больше улучшают свойства алюминия. В алюминиевом сплаве алюминий сочетается с магнием, марганцем, оловом, кремнием и цинком с преобладанием самого алюминия (около 85%). Термообрабатываемые алюминиевые сплавы состоят из чистого алюминия, нагретого до определенной температуры. При повышенных температурах алюминиевые сплавы становятся все слабее и слабее.
Алюминиевые сплавы легче по сравнению с медью, латунью, никелем и сталью. Он также обладает хорошей коррозионной стойкостью. Благодаря хорошей теплопроводности и электропроводности он находит применение в кухонной технике, а также для электропроводки электронных приборов. Электропроводность алюминия примерно равна 36,9× 106 Сименс/метр. Алюминий также дешевле меди и почти так же хорош в электропроводности, как медь, поэтому он используется в линиях электропередачи.
Дюралюминий представляет собой сплав алюминия и меди и широко используется. Химический состав дюралюминия, алюминия 94%, меди 4%, марганца и магния 0,4 – 0,7%. Алюминий в смеси с магнием обеспечивает легкий сплав с более высокой огнестойкостью. Другими алюминиевыми сплавами являются Al-Li (сочетание алюминия и лития), альнико (алюминий + никель + медь), магналий (алюминий + магний), силумин (алюминий + кремний) и так далее.
Алюминиевая фольга Одним из основных применений алюминия является производство алюминиевой фольги, которая используется для упаковки пищевых продуктов. Металлический алюминий прокатывается под большим давлением на фольгопрокатных станах для получения тонкой и очень тонкой фольги толщиной почти с бумагу (толщина > 25 мкм).
Металлический алюминий прокатывается под большим давлением на фольгопрокатных станах для получения тонкой и очень тонкой фольги толщиной почти с бумагу (толщина > 25 мкм).
Алюминий обладает высокой пластичностью и не пропускает свет, кислород, влагу и бактерии, дополнительно выступая в качестве барьера. Эти характеристики алюминия делают его пригодным для использования в фольге для упаковки пищевых продуктов, а также для фармацевтической упаковки таблеток и пилюль. Алюминиевая фольга, будучи блестящей, также используется в художественных и декоративных целях.
Контекст и приложенияЭта концепция актуальна для различных дипломов, курсов для студентов и аспирантов, таких как
- Бакалавр наук в области машиностроения
- Магистр наук в области машиностроения
- Обучение литью металлов Американским литейным обществом
1. Каков предел текучести алюминия? (Данный 1psi = 6,894 × 10-9 мкм)
- 6,894 × 10-9 мкм
- 3,447 × 10-6 мкм
- 4,447 × 10-5 мкм
- 4,447 × 10-6 мкм
Ответ-Вариант B
. 6,894 × 10-9 мкм. Таким образом, 5000 фунтов на квадратный дюйм становится 3,447 × 10-6 мкм.
6,894 × 10-9 мкм. Таким образом, 5000 фунтов на квадратный дюйм становится 3,447 × 10-6 мкм.
2. Как ведет себя алюминий при высоких температурах?
- В целом слабое
- Самое плотное
- Самое сильное
- Никаких изменений не наблюдается
Ответ- Вариант а
Пояснение- Температура плавления алюминия составляет около 1,260 o F и он теряет свою прочность на 50% при нагревании до 600 o F. Кроме того, можно сделать вывод, что по мере изменения температуры увеличивается, прочность алюминия снижается.
3. Какова температура плавления алюминия?
- 100 ° C
- 550,323 ° C
- 660,323 ° C
- 1000 ° C
Ответ- Вариант c
Пояснение- Температура плавления алюминия около 1,260 o F, то есть 660 o C.
4 . Какое химическое свойство алюминия является наиболее важным?
- хрупкая
- Soft
- Hard
- Магнитный
Ответ- Вариант B
объяснение- алюмин не является блинчиком/твердым.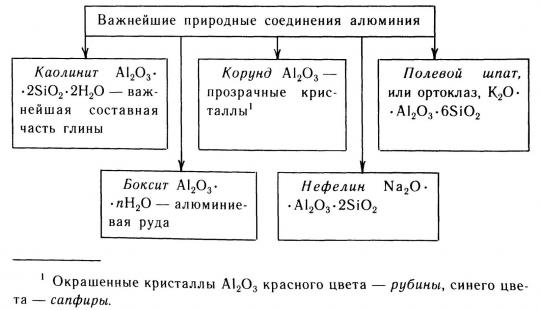 Он очень мягкий, и это не является магнитным.
Он очень мягкий, и это не является магнитным.
5. Какова масса алюминия по сравнению со сталью?
- Lighter than steel
- Equal in weight
- Heavier than steel
- Depends upon alloyed metal
Answer- Option a
Explanation- Aluminum is a lightweight metal with a density of 2.71 gm/cm 3 , что составляет всего 1/3 rd от стали.
Распространенные ошибки
Студенты могут запутаться между алюминием и сталью, потому что они оба выглядят одинаково; но когда дело доходит до использования, алюминий нуждается в большем уходе. Это один из лучших вариантов использования для наружных вывесок, а также он лучше устойчив к атмосферным воздействиям, чем сталь. Они также могут запутаться между различными изотопами алюминия, так как он имеет девять изотопов, масса которых колеблется от 23 до 30, но 27 Al (который является стабильным изотопом) и 26 Al (который является радиоактивным изотопом) являются только природные.


 edu.
edu.