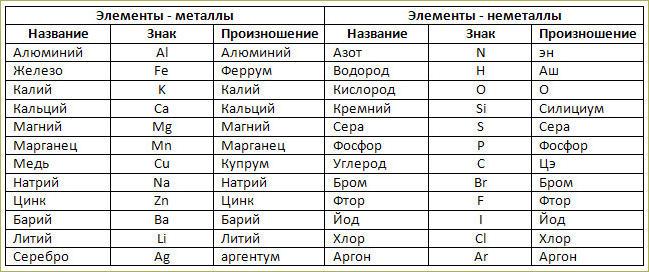
Ядро аргона 18 40 ar содержит: Ядро аргона содержит 1) 40 протонов и 22 нейтрона 2) 40 протонов и 18 нейтронов 3) 18 протонов и 40 нейтронов 4) 18 протонов и 22 нейтрона
alexxlab | 02.02.2023 | 0 | Разное
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Подготовка к егэ по физике задание 19.
 Подборка задач с решениями и ответами
Подборка задач с решениями и ответами1. Укажите число протонов и число нейтронов в ядре изотопа аргона .
Решение.
Для изотопа аргона имеем массовое число, равное 39 и порядковый номер, равный 18. Известно, что массовое число – это число протонов и нейтронов в атоме изотопа. Порядковый номер – это число протонов в атоме. Таким образом, имеем 18 протонов и 39-18=21 нейтронов.
Ответ: 1821.
2. Укажите число протонов и число нейтронов в ядре изотопа меди .
Решение.
Верхний индекс у изотопа показывает массовое число, то есть сумму протонов и нейтронов в ядре изотопа. Нижний индекс – это порядковый номер, показывающий число протонов в ядре. Таким образом, изотоп имеем 29 протонов и 63-29=34 нейтронов.
Ответ: 2934.
3. На рисунке представлен фрагмент Периодической системы элементов Д. И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наименее распространённого из основных стабильных изотопов меди.
Решение.
Медь обозначается значком Cu и имеет порядковый номер 29. Наименее распространенный изотоп имеет массовое число 65. Так как порядковый номер показывает число протонов в атоме изотопа, а массовое число сумму протонов и нейтронов в атоме, то для данного изотопа имеем:
29 – число протонов;
65-29=36 – число нейтронов.
Ответ: 2936.
4. На рисунке представлен фрагмент Периодической системы элементов Д. И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наиболее распространённого стабильного изотопа цинка.
Решение.
Цинк, обозначение Zn имеет порядковый номер 30. Это означает, что в атоме цинка находится 30 протонов. Из таблицы видно, что наиболее распространенный изотоп цинка имеет массовое число 64, то есть сумма протонов и нейтронов в ядре этого изотопа равна 64. Отсюда получаем число нейтронов: 64-30=34.
Ответ: 3034.
5. Укажите массовое и зарядовое число частицы, которая вызывает ядерную реакцию .
Решение.
При ядерных реакциях сумма массовых чисел и зарядовых чисел до реакции равно сумме массовых чисел и зарядовых чисел после реакции. Пользуясь этим правило, можно записать следующие уравнения:
где x – неизвестное массовое число частицы; y – неизвестное зарядовое число частицы. Отсюда находим:
Ответ: 21.
6. Укажите массовое и зарядовое число частицы, которая рождается в результате ядерной реакции: .
Решение.
При ядерных реакциях сумма массовых чисел и зарядовых чисел до реакции равно сумме массовых чисел и зарядовых чисел после реакции. Пользуясь этим правило, можно записать следующие уравнения:
Пользуясь этим правило, можно записать следующие уравнения:
откуда получаем, что
Ответ: 10.
7. Укажите массовое и зарядовое число ядра, из которого в результате двух последовательных альфа-распадов образуется ядро .
Решение.
Учитывая, что при альфа-распаде порядковый номер уменьшается на 2 единицы, а массовое число на 4 единицы, то при двух альфа-распадах имеем уменьшение порядкового номера на 4, а массового числа на 8. В результирующем изотопе массовое число равно 216, а порядковое число 84. Следовательно, изначально массовое число равнялось 216+8=224, а порядковое число 84+4=88.
Ответ: 22488.
8. Укажите массовое и зарядовое число ядра, которое образовалось в результате двух последовательных альфа-распадов ядра радия .
Решение.
При альфа-распаде порядковый номер изотопа уменьшается на 2 единицы, а массовое число на 4 единицы. Соответственно, при двух альфа-распадах порядковый номер уменьшается на 4, а массовое число на 8.
Изначально в изотопе массовое число равно 224, а порядковый номер 88. После двух альфа-распадов имеем массовое число 224-8=216, а порядковый номер 88-4=84.
Ответ: 21684.
9. Укажите массовое и зарядовое число ядра, которое образовалось вместе с нейтроном в результате столкновения ядра бора и а-частицы.
Решение.
Изотоп бора сталкивается с альфа-частицей в результате чего получается нейтрон и еще одна частица. Учитывая, что альфа-частица содержит два протона и два нейтрона, имеем реакцию вида
Используя закон сохранения массовых и порядковых чисел до ядерной реакции и после нее, получаем для неизвестной частицы:
откуда следует, что
то есть массовое число частицы равно 14, а порядковый номер 7.
Ответ: 147.
10. Укажите массовое и зарядовое число ядра, которое образовалось вместе с протоном в результате столкновения ядра лития и а-частицы.
Решение.
Известно, что альфа-частица содержит 2 протона и 2 нейтрона, то есть ее массовое число равно 4, а зарядовое число 2. В результате ядерной реакции получается протон, у которого массовое число 1 и зарядовое число 1, имеем:
.
В силу закона сохранения массовых и зарядовых чисел до и после реакции, для неизвестных x и y можно записать уравнения:
откуда
то есть массовое число неизвестного элемента равно 10, а зарядовое 4.
Ответ: 104.
11. Определите число протонов и число нейтронов в ядре изотопа криптона .
Решение.
В изотопе криптона верхний индекс – это массовое число, а нижний индекс – порядковый номер. Массовое число равно сумме протонов и нейтронов в ядре, а порядковый номер показывает число протонов. Таким образом, в данном изотопе 36 протонов и 88-36=52 нейтрона.
Ответ: 3652.
12. Определите число протонов и число нейтронов в ядре изотопа циркония .
Решение.
В изотопе криптона верхний индекс – это массовое число, а нижний индекс – порядковый номер. Массовое число равно сумме протонов и нейтронов в ядре, а порядковый номер показывает число протонов. Таким образом, в данном изотопе 40 протонов и 92-40=52 нейтрона.
Ответ: 4052.
13. Определите число электронов в электронной оболочке нейтрального атома бериллия и число нейтронов в его ядре.
Решение.
Верхний индекс показывает массовое число изотопа, то есть число протонов и нейтронов в атоме. Нижний индекс – это порядковый номер, равный числу протонов в ядре атома. Отсюда следует, что число нейтронов в атоме бериллия равно 7-4=3, а число электронов равно 4, так как атом нейтрален и 4 электрона компенсируют положительный заряд 4-х протонов.
Ответ: 43.
14 Определите число электронов в электронной оболочке нейтрального атома кислорода и число нейтронов в его ядре.
Решение.
Верхний индекс показывает массовое число изотопа, то есть число протонов и нейтронов в атоме. Нижний индекс – это порядковый номер, равный числу протонов в ядре атома. Отсюда следует, что число нейтронов в атоме кислорода равно 21-8=13, а число электронов равно 8, так как атом нейтрален и 8 электронов компенсируют положительный заряд 8-ми протонов.
Нижний индекс – это порядковый номер, равный числу протонов в ядре атома. Отсюда следует, что число нейтронов в атоме кислорода равно 21-8=13, а число электронов равно 8, так как атом нейтрален и 8 электронов компенсируют положительный заряд 8-ми протонов.
Ответ: 813.
15. Элемент менделевий был получен при бомбардировке a-частицами ядер элемента X в соответствии с реакцией . Определите зарядовое число и массовое число элемента X.
Решение.
При ядерных реакциях сумма массовых и зарядовых чисел до реакции равны соответствующим суммам массовых и зарядовых чисел после реакции. То есть для данной ядерной реакции можно записать равенства
откуда массовое число , а зарядовое число .
Ответ: 99253.
16. Деление ядра урана тепловыми нейтронами описывается реакцией . При этом образовалось ядро химического элемента . Определите зарядовое число X и массовое число Y элемента Z.
Решение.
Определим зарядовое и массовое число элемента Z из условия сохранения суммы массовых и зарядовых чисел до реакции и после нее, то есть для данной реакции можно записать равенства:
Здесь учтено, что гамма-квант не имеет ни заряда ни массы, следовательно, его зарядовое и массовое числа равны нулю. Получаем:
Получаем:
Ответ: 3694.
17. Ядро фтора захватило электрон. Определите зарядовое число и массовое число ядра, образовавшегося в результате этой реакции.
Решение.
Данную ядерную реакцию можно записать в виде
,
то есть при захвате электрона (отрицательно заряженной частицы), зарядовое число атома фтора уменьшается на 1 и становится равным 9-1=8. Массовое число, равное, числу протонов и нейтронов в ядре остается неизменным 18.
Ответ: 818.
18. Радиоактивный изотоп натрия испытал бета-распад. Определите зарядовое число и массовое число ядра, образовавшегося в результате этой реакции.
Решение.
При бета-распаде ядро испускает бета-частицу. При этом порядковый номер изотопа увеличивается на 1, а массовое число остается без изменений. Ядерная реакция такого распада может быть записана в виде
,
откуда
то есть в результате зарядовое число стало 12, а массовое число осталось равным 24.
Ответ: 1224.
19. Определите число протонов и число нейтронов в ядре изотопа неона .
Решение.
Верхний индекс изотопа – это массовое число, то есть число протонов и нейтронов в ядре изотопа. Нижний индекс – это порядковый номер (зарядовое число), то есть число протонов в ядре. Таким образом, в изотопе неона 10 протонов и 18-10=8 нейтронов.
Ответ: 108.
20. Определите число протонов и число нейтронов в ядре изотопа натрия .
Решение.
Верхний индекс изотопа – это массовое число, то есть число протонов и нейтронов в ядре изотопа. Нижний индекс – это порядковый номер (зарядовое число), то есть число протонов в ядре. Таким образом, в изотопе натрия 11 протонов и 24-11=13 нейтронов.
Ответ: 1113.
21. На рисунке представлен фрагмент Периодической системы элементов Д. И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Определите число протонов и число нейтронов в ядре самого распространённого изотопа калия.
Решение.
Из таблицы видно, что самый распространенный изотоп калия имеет массовое число 39 и порядковый номер 19. Порядковый номер – это число протонов в ядре, а массовое число – это сумма протонов и нейтронов в ядре. Таким образом, в ядре самого распространенного изотопа калия 19 протонов и 39-19=20 нейтронов.
Ответ: 1920.
22. На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Определите число протонов и число нейтронов в ядре самого распространённого изотопа галлия.
Решение.
Из таблицы видно, что массовое число самого распространенного изотопа галлия равно 69, а его порядковый номер – 31. Массовое число показывает число протонов и нейтронов в ядре изотопа, а порядковый номер – число протонов в ядре. Таким образом в изотопе галлия имеется 31 протон и 69-31=38 нейтронов.
Таким образом в изотопе галлия имеется 31 протон и 69-31=38 нейтронов.
Ответ: 3138.
23. В результате реакции синтеза ядра дейтерия с ядром образуется ядро бора и нейтрон в соответствии с реакцией: . Определите зарядовое число Y и массовое число X ядра Z.
Решение.
Величина X представляет собой массовое число ядра Z, а величина Y – ее порядковый номер (зарядовое число). Учитывая закон сохранения массовых и зарядовых чисел до реакции и после нее, можно записать равенства:
откуда
Ответ: 49.
24. В результате столкновения ядра урана с частицей произошло деление ядра урана, описываемое реакцией . Определите зарядовое число X и массовое число Y частицы Z.
Решение.
Величина X представляет собой массовое число ядра Z, а величина Y – ее порядковый номер (зарядовое число). Учитывая закон сохранения массовых и зарядовых чисел до реакции и после нее, можно записать равенства:
откуда
Ответ: 01.
25. Укажите число протонов и число нейтронов в ядре изотопа индия .
Решение.
Верхний индекс у изотопа – это массовое число, то есть число протонов и нейтронов в ядре, а нижний индекс – это порядковый номер – число протонов в ядре. Для данного изотопа имеем 49 протонов и 115-49=66 нейтронов.
Ответ: 4966.
26. Укажите число протонов и число нейтронов в ядре изотопа ксенона .
Решение.
Верхний индекс у изотопа означает массовое число, то есть сумму протонов и нейтронов в ядре изотопа. Нижний индекс – это зарядовый номер, то есть число протонов в ядре. Таким образом, у приведенного изотопа ксенона 54 протонов и 112-54=58 нейтронов.
Ответ: 5458.
27. Укажите число электронов в электронной оболочке нейтрального атома бария и число нейтронов в его ядре.
Решение.
Верхний индекс атома бария является массовым числом, показывающий сумму протонов и нейтронов в ядре. Нижний индекс – это зарядовое число, показывающее число протонов в ядре. То есть в ядре бария 56 протонов и 145-56=89 нейтронов. Так как атом бария нейтрален, то число электронов на его электронной оболочке равно числу протонов, то есть их 56.
То есть в ядре бария 56 протонов и 145-56=89 нейтронов. Так как атом бария нейтрален, то число электронов на его электронной оболочке равно числу протонов, то есть их 56.
Ответ: 5689.
28. Укажите число электронов в электронной оболочке нейтрального атома и число нейтронов в его ядре.
Решение.
Верхний индекс атома бария является массовым числом, показывающий сумму протонов и нейтронов в ядре. Нижний индекс – это зарядовое число, показывающее число протонов в ядре. То есть в ядре цезия 55 протонов и 112-55=57 нейтронов. Так как атом бария нейтрален, то число электронов на его электронной оболочке равно числу протонов, то есть их 55.
Ответ: 5557.
29. Укажите число протонов и число нейтронов в ядре .
Решение.
Верхний индекс у изотопа – это массовое число, то есть сумма протонов и нейтронов в ядре. Нижний индекс – это порядковый номер, означающий число протонов в ядре атома изотопа. Таким образом, для изотопа аргона имеем 18 протонов и 37-18=19 нейтронов.
Ответ: 1819.
30. Укажите число протонов и число нейтронов в ядре ?
Решение.
Верхний индекс у изотопа – это массовое число, то есть сумма протонов и нейтронов в ядре. Нижний индекс – это порядковый номер, означающий число протонов в ядре атома изотопа. Таким образом, для данного изотопа имеем 20 протонов и 48-20=28 нейтронов.
Ответ: 2028.
Аргон – Лунарпедия
| Аргон | |
|---|---|
| Ар | |
| Наличие на месте : | |
| Необходимость: | |
| Атомный номер: | 18 |
| Атомная масса: | 39.948 |
| группа: | 18 |
| период: | 3 |
| нормальная фаза: | Газ |
| серия: | Благородные газы |
| плотность: | 1,784 г/л |
| температура плавления: | 83,80К, -189,35°С, -308,83°F |
| температура кипения: | 87,30 К, -185,85°С, -302,53°F |
| F ← Ne → Н/Д | |
| Cl ← Ar → K | |
| Br ← Kr → Н/Д | |
| Атомный радиус (пм): | 71 |
| Боровский радиус (м): | 71 |
| Ковалентный радиус (пм): | 97 |
| Радиус Ван-дер-Ваальса (м): | 188 |
| ионный радиус (пм): | – |
| 1-й ионный потенциал (эВ): | 15,76 |
| Электронная конфигурация | |
| 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| 2, 8, 8 | |
| Электроотрицательность: | |
| Электронное сродство: | Нестабильный анион |
| Степени окисления: | – |
| Магнетизм: | Немагнитный |
| Кристаллическая структура: | Гранецентрированный куб |
Аргон — благородный газ группы 18. Он имеет гранецентрированную кубическую кристаллическую структуру.
Этот элемент имеет 3 стабильных изотопа: 36, 38 и 40.
Он имеет гранецентрированную кубическую кристаллическую структуру.
Этот элемент имеет 3 стабильных изотопа: 36, 38 и 40.
Большая часть летучих веществ была отложена в верхних слоях поверхности Луны солнечным ветром в течение геологического времени. Заметным исключением является Аргон. Концентрация аргона в лунном грунте намного выше, чем в солнечном ветре, поэтому он должен поступать из другого источника. Особенно изотоп Аргон-40. В настоящее время считается, что Аргон-40 возникает в результате радиоактивного распада калия-40 глубоко внутри лунной мантии или ядра и что Аргон-40 просачивается на поверхность через трещины. Это лунное выделение газа продолжается и сегодня. Этот вентилируемый аргон входит в лунную атмосферу; затем аргон внедряется в реголит за счет взаимодействия с ионами солнечного ветра.
Информация из общественного достояния, полученная от НАСА:
Информация о Луне
http://nssdc.gsfc.nasa.gov/planetary/factsheet/moonfact.html
Расчетный состав лунной атмосферы (частиц на кубический см):
- Гелий-4 (4He) – 40 000
- Неон 20 (20Ne) – 40 000
- Водород (ч3) – 35 000
- Аргон 40 (40Ar) – 30 000
- Неон 22 (22Ne) – 5000
- Аргон 36 (36Ar) – 2000
Эта статья представляет собой автоматически созданную заготовку. |
Аргон – 3D Elements
Эта статья о химическом элементе. Чтобы узнать о других значениях, см. Аргон (значения).
Не путать с Аргонном (значения).
Аргон — это химический элемент с символом Ar и атомным номером 18. Он находится в группе 18 периодической таблицы и является благородным газом. [6] Аргон является третьим по распространенности газом в атмосфере Земли с содержанием 0,934% (9340 частей на миллион по объему). Его более чем в два раза больше, чем водяного пара (который в среднем составляет около 4000 частей на миллион по объему, но сильно варьируется), в 23 раза больше, чем углекислого газа (400 частей на миллион по объему), и более чем в 500 раз больше, чем у неона (18 частей на миллион по объему). Аргон – самый распространенный благородный газ в земной коре, составляющий 0,00015% земной коры.
Почти весь аргон в атмосфере Земли представляет собой радиогенный аргон-40, полученный в результате распада калия-40 в земной коре. Во Вселенной аргон-36, безусловно, является наиболее распространенным изотопом аргона, поскольку он является предпочтительным изотопом аргона, образующимся в результате звездного нуклеосинтеза в сверхновых.
Название «аргон» происходит от греческого слова ἀργόν, среднего рода формы единственного числа от ἀργός, означающего «ленивый» или «неактивный», в связи с тем, что этот элемент почти не вступает в химические реакции. Полный октет (восемь электронов) во внешней атомной оболочке делает аргон стабильным и устойчивым к связыванию с другими элементами. Его температура тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 1990 года.
Аргон производится в промышленных масштабах путем фракционной перегонки жидкого воздуха. Аргон в основном используется в качестве инертного защитного газа при сварке и других высокотемпературных промышленных процессах, где обычно нереакционноспособные вещества становятся реактивными; например, атмосфера аргона используется в графитовых электропечах для предотвращения горения графита. Аргон также используется в лампах накаливания, люминесцентных и других газоразрядных лампах. Аргон производит характерный сине-зеленый газовый лазер. Аргон также используется в люминесцентных пусковых установках.
Аргон также используется в лампах накаливания, люминесцентных и других газоразрядных лампах. Аргон производит характерный сине-зеленый газовый лазер. Аргон также используется в люминесцентных пусковых установках.
Содержание
- 1 Характеристики
- 2 История
- 3 Возникновение
- 4 изотопов
- 5 соединений
- 6 Производство
- 6.1 Промышленный
- 6.2 При радиоактивном распаде
- 7 приложений
- 7.1 Промышленные процессы
- 7.2 Научные исследования
- 7.3 Консервант
- 7.4 Лабораторное оборудование
- 7.5 Медицинское использование
- 7.6 Освещение
- 7.7 Разное использование
- 8 Безопасность
- 9 См. также
- 11 Дополнительная литература
Характеристики
Небольшой кусочек быстроплавкого твердого аргона
Аргон имеет примерно такую же растворимость в воде, как и кислород, и в 2,5 раза более растворим в воде, чем азот. Аргон бесцветен, не имеет запаха, негорюч и нетоксичен в твердом, жидком или газообразном состоянии. [7] Аргон химически инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Аргон бесцветен, не имеет запаха, негорюч и нетоксичен в твердом, жидком или газообразном состоянии. [7] Аргон химически инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Хотя аргон является инертным газом, в экстремальных условиях он может образовывать некоторые соединения. Был продемонстрирован фторгидрид аргона (HArF), соединение аргона с фтором и водородом, стабильное при температуре ниже 17 К (-256,1 ° C; -429,1 ° F). [8] [9] Хотя нейтральные химические соединения аргона в основном состоянии в настоящее время ограничиваются HArF, аргон может образовывать клатраты с водой, когда атомы аргона захвачены решеткой молекул воды. [10] Ионы, такие как ArH+
, и комплексы в возбужденном состоянии, такие как ArF, были продемонстрированы. Теоретический расчет предсказывает еще несколько соединений аргона, которые должны быть стабильными [11] , но еще не синтезированы.
История
Метод лорда Рэлея для выделения аргона, основанный на эксперименте Генри Кавендиша. Газы находятся в пробирке (А), стоящей над большим количеством слабой щелочи (В), а ток передается по проводам, изолированным U-образными стеклянными трубками (СС), проходящими через жидкость и огибающими горловину пробирки. пробирка. На внутренние платиновые концы (DD) провода подается ток от батареи из пяти ячеек Гроува и катушки Румкорфа средних размеров.
Аргон (греч. ‘αργόν, форма среднего рода единственного числа от ‘αργός, что означает «неактивный» в связи с его химической неактивностью) [12] [13] подозревался Генри как компонент воздуха Кавендишем в 1785 году. Аргон был впервые выделен из воздуха в 1894 году лордом Рэлеем и сэром Уильямом Рамзи в Университетском колледже Лондона путем удаления кислорода, углекислого газа, воды и азота из образца чистого воздуха. [14] [15] [16] Они определили, что азот, полученный из химических соединений, на 0,5% легче азота из атмосферы. Разница была незначительной, но достаточно важной, чтобы привлечь их внимание на многие месяцы. Они пришли к выводу, что в воздухе был другой газ, смешанный с азотом. [17] Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и У. Н. Хартли. [ citation required ] Каждый наблюдал новые линии в эмиссионном спектре воздуха, которые не соответствовали известным элементам. Аргон был первым обнаруженным благородным газом. До 1957 года аргон обозначался буквой «А», а теперь — «Ar». [18]
Разница была незначительной, но достаточно важной, чтобы привлечь их внимание на многие месяцы. Они пришли к выводу, что в воздухе был другой газ, смешанный с азотом. [17] Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и У. Н. Хартли. [ citation required ] Каждый наблюдал новые линии в эмиссионном спектре воздуха, которые не соответствовали известным элементам. Аргон был первым обнаруженным благородным газом. До 1957 года аргон обозначался буквой «А», а теперь — «Ar». [18]
Распространенность
Аргон составляет 0,934 % по объему и 1,288 % по массе атмосферы Земли, [19] , а воздух является основным промышленным источником продуктов очищенного аргона. Аргон выделяют из воздуха путем фракционирования, чаще всего путем криогенной фракционной перегонки — процесса, в ходе которого также получают очищенный азот, кислород, неон, криптон и ксенон. [20] Земная кора и морская вода содержат 1,2 ppm и 0,45 ppm аргона соответственно. [21]
[21]
Изотопы
Основная статья: Изотопы аргона
Основными изотопами аргона, обнаруженными на Земле, являются 40
Ar (99,6%), 36
Ar (0,34%) и 38
Ar (0,06%). Встречающийся в природе 40
К с периодом полураспада 1,25×10 9 лет распадается до стабильного 40
Ar (11,2%) за счет захвата электронов или испускания позитронов, а также до стабильного 40
Ca (88,8%) за счет бета-излучения. разлагаться. Эти свойства и соотношения используются для определения возраста пород методом K-Ar датирования. [21] [22]
В атмосфере Земли 39
Ar образуется под действием космических лучей, главным образом, при захвате нейтронов 40
Ar с последующим испусканием двух нейтронов. В подземной среде он также образуется за счет захвата нейтронов при температуре 39
К с последующим испусканием протонов. 37
Ar образуется в результате захвата нейтронов 40
Ca с последующим испусканием альфа-частиц в результате подземных ядерных взрывов. Период полувыведения составляет 35 дней. [22]
Период полувыведения составляет 35 дней. [22]
В разных точках Солнечной системы изотопный состав аргона сильно различается. Где основным источником аргона является распад 40
K в горных породах, 40
Ar будет преобладающим изотопом, как и на Земле. В аргоне, полученном непосредственно в результате звездного нуклеосинтеза, преобладает нуклид альфа-процесса 36
Ar. Соответственно солнечный аргон содержит 84,6% 36
Ar (по измерениям солнечного ветра), [23] и соотношение трех изотопов 36 Ar : 38 Ar : 40 Ar в атмосферах внешней планет составляет 8400 : 1600 : 1. [24] Это контрастирует с низким содержанием первичных 36
Ar в атмосфере Земли, что составляет всего 31,5 частей на миллион по объему (= 9340 частей на миллион по объему × 0,337%), что сравнимо с содержанием неона (18,18 частей на миллион по объему) на Земле и с межпланетными газами, измеренными зондами.
Атмосферы Марса, Меркурия и Титана (самого большого спутника Сатурна) содержат аргон, преимущественно в виде 40
Ar, и его содержание может достигать 1,93% (Марс). [25]
[25]
Преобладание радиогенного 40
Ar является причиной того, что стандартный атомный вес земного аргона больше, чем у следующего элемента, калия, факт, который вызвал недоумение, когда был открыт аргон. Менделеев расположил элементы в своей периодической таблице в порядке атомного веса, но инертность аргона предполагала размещение до реактивный щелочной металл. Позже Генри Мозли решил эту проблему, показав, что периодическая таблица на самом деле упорядочена по атомному номеру (см. Историю периодической таблицы).
Соединения
Основная статья: Соединения аргона
Полный октет электронов аргона указывает на полные подоболочки s и p. Эта полновалентная оболочка делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962 года аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. Первое соединение аргона с пентакарбонилом вольфрама, W(CO) 5 Ar, был выделен в 1975 г. Однако в то время он не получил широкого признания. [26] В августе 2000 г. исследователями Хельсинкского университета было получено другое соединение аргона, фторгидрид аргона (HArF), путем облучения ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода с йодидом цезия. Это открытие вызвало признание того, что аргон может образовывать слабосвязанные соединения, хотя оно и не было первым. [9] [27] [28] Стабилен до 17 кельвинов (-256 °C). Метастабильный дикатион ArCF2+
Первое соединение аргона с пентакарбонилом вольфрама, W(CO) 5 Ar, был выделен в 1975 г. Однако в то время он не получил широкого признания. [26] В августе 2000 г. исследователями Хельсинкского университета было получено другое соединение аргона, фторгидрид аргона (HArF), путем облучения ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода с йодидом цезия. Это открытие вызвало признание того, что аргон может образовывать слабосвязанные соединения, хотя оно и не было первым. [9] [27] [28] Стабилен до 17 кельвинов (-256 °C). Метастабильный дикатион ArCF2+
2, изоэлектронный по валентности карбонилфториду и фосгену, наблюдался в 2010 г. [29] Аргон-36 в виде ионов гидрида аргона (аргония) был со сверхновой Крабовидной туманностью; это была первая молекула благородного газа, обнаруженная в космосе. [30] [31]
Твердый гидрид аргона (Ar(H 2 ) 2 ) имеет ту же кристаллическую структуру, что и фаза Лавеса MgZn 2 . Он образуется при давлении от 4,3 до 220 ГПа, хотя измерения комбинационного рассеяния предполагают, что молекулы H 2 в Ar (H 2 ) 2 диссоциируют при давлении выше 175 ГПа. [32]
Он образуется при давлении от 4,3 до 220 ГПа, хотя измерения комбинационного рассеяния предполагают, что молекулы H 2 в Ar (H 2 ) 2 диссоциируют при давлении выше 175 ГПа. [32]
Производственный
Промышленный
Аргон получают в промышленности путем фракционной перегонки жидкого воздуха в криогенной воздухоразделительной установке; процесс, при котором жидкий азот, кипящий при 77,3 К, отделяется от аргона, кипящего при 87,3 К, и жидкого кислорода, кипящего при 90,2 К. Ежегодно в мире производится около 700 000 тонн аргона. [21] [33]
При радиоактивном распаде
40 Ar, наиболее распространенный изотоп аргона, образуется при распаде 40 К с периодом полураспада 1,2514810 9 лет за счет захвата электронов или испускания позитронов. Из-за этого он используется при датировании калием и аргоном для определения возраста горных пород.
Области применения
Аргон обладает несколькими полезными свойствами:
- Аргон – химически инертный газ.

- Аргон является самой дешевой альтернативой, когда азот недостаточно инертен.
- Аргон имеет низкую теплопроводность.
- Аргон обладает электронными свойствами (ионизация и/или эмиссионный спектр), желательными для некоторых применений.
Другие инертные газы также подходят для большинства этих применений, но аргон намного дешевле. Аргон недорог, так как он встречается в природе в воздухе и его легко получить как побочный продукт криогенного разделения воздуха при производстве жидкого кислорода и жидкого азота: основные составляющие воздуха используются в больших промышленных масштабах. Другие благородные газы (кроме гелия) также производятся таким же образом, но аргон на сегодняшний день является самым распространенным. Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев.
Промышленные процессы
Аргон используется в некоторых высокотемпературных промышленных процессах, где обычно нереакционноспособные вещества становятся реактивными. Например, в графитовых электропечах используется атмосфера аргона для предотвращения горения графита.
Например, в графитовых электропечах используется атмосфера аргона для предотвращения горения графита.
Для некоторых из этих процессов присутствие газообразного азота или кислорода может вызвать дефекты в материале. Аргон используется в некоторых видах дуговой сварки, таких как дуговая сварка металлическим газом и дуговая сварка вольфрамовым электродом, а также при обработке титана и других реактивных элементов. Атмосфера аргона используется также для выращивания кристаллов кремния и германия.
См. также: защитный газ
Аргон используется в птицеводстве для удушения птиц, либо для массовой выбраковки после вспышек болезней, либо как средство убоя, более гуманное, чем электрическая баня. Аргон плотнее воздуха и при газировании вытесняет кислород у земли. [34] [35] Его нереакционная природа делает его пригодным для пищевых продуктов, а поскольку он заменяет кислород в мертвой птице, аргон также увеличивает срок хранения. [36]
Аргон иногда используется для тушения пожаров, когда ценное оборудование может быть повреждено водой или пеной. [37]
[37]
Научные исследования
Жидкий аргон используется в качестве мишени для нейтринных экспериментов и прямого поиска темной материи. Взаимодействие между гипотетическими вимпами и ядром аргона производит сцинтилляционный свет, который регистрируется фотоумножителями. Двухфазные детекторы, содержащие газообразный аргон, используются для обнаружения ионизированных электронов, возникающих при рассеянии вимпов на ядрах. Как и большинство других сжиженных инертных газов, аргон имеет высокий световыход сцинтилляций (около 51 фотон/кэВ [38] ), прозрачен для собственного сцинтилляционного света и относительно легко поддается очистке. По сравнению с ксеноном аргон дешевле и имеет четкий временной профиль сцинтилляций, что позволяет отделить электронные отдачи от ядерных. С другой стороны, его собственный фон бета-излучения больше из-за загрязнения 39
Ar, если только не используется аргон из подземных источников, который имеет гораздо меньшее загрязнение 39
Ar. Большая часть аргона в атмосфере Земли образовалась за счет электронного захвата долгоживущего 40
Большая часть аргона в атмосфере Земли образовалась за счет электронного захвата долгоживущего 40
K (40
K + e – → 40
Ar + ν), присутствующий в природном калии на Земле. Активность 39
Ar в атмосфере поддерживается космогенным образованием в результате реакции нокаута 40
Ar(n,2n)39
Ar и подобных реакций. Период полураспада 39
Ar составляет всего 269 лет. В результате подземный аргон, экранированный скалами и водой, имеет гораздо меньшее загрязнение 39
аргоном. [39] Детекторы темной материи, в настоящее время работающие с жидким аргоном, включают DarkSide, WArP, ArDM, microCLEAN и DEAP. Нейтринные эксперименты включают ICARUS и MicroBooNE, оба из которых используют высокочистый жидкий аргон в камере временной проекции для получения мелкозернистых трехмерных изображений взаимодействий нейтрино.
Консервант
Аргон используется для вытеснения кислородо- и влагосодержащего воздуха в упаковочном материале с целью продления срока годности содержимого (аргон имеет европейский код пищевой добавки E938). Воздушное окисление, гидролиз и другие химические реакции, разлагающие продукты, замедляются или полностью предотвращаются. Химикаты высокой чистоты и фармацевтические препараты иногда упаковываются и запечатываются в аргоне.
Воздушное окисление, гидролиз и другие химические реакции, разлагающие продукты, замедляются или полностью предотвращаются. Химикаты высокой чистоты и фармацевтические препараты иногда упаковываются и запечатываются в аргоне.
В виноделии аргон используется в различных целях для создания барьера против кислорода на поверхности жидкости, который может испортить вино, стимулируя как микробный метаболизм (как в случае с уксуснокислыми бактериями), так и стандартную окислительно-восстановительную химию.
Аргон иногда используется в качестве пропеллента в аэрозольных баллончиках для таких продуктов, как лак, полиуретан и краска, а также для вытеснения воздуха при подготовке контейнера к хранению после вскрытия. [40]
С 2002 года Американский национальный архив хранит важные национальные документы, такие как Декларация независимости и Конституция, в контейнерах, заполненных аргоном, чтобы предотвратить их деградацию. Аргон предпочтительнее гелия, который использовался в предыдущие пять десятилетий, потому что газообразный гелий выходит через межмолекулярные поры в большинстве контейнеров и должен регулярно заменяться. [41]
[41]
Лабораторное оборудование
См. также: Безвоздушная техника
Аргон может использоваться в качестве инертного газа в линиях Шленка и перчаточных боксах. Аргон предпочтительнее менее дорогого азота в тех случаях, когда азот может реагировать с реагентами или аппаратурой.
Аргон может использоваться в качестве газа-носителя в газовой хроматографии и масс-спектрометрии с ионизацией электрораспылением; это предпочтительный газ для плазмы, используемой в ICP-спектроскопии. Аргон предпочтителен для покрытия распылением образцов для сканирующей электронной микроскопии. Газообразный аргон также широко используется для напыления тонких пленок, например, в микроэлектронике, и для очистки пластин при микрообработке.
Медицинское применение
Процедуры криохирургии, такие как криоабляция, используют жидкий аргон для разрушения тканей, таких как раковые клетки. Он используется в процедуре, называемой «коагуляция с усилением аргона», форме электрохирургии с помощью аргонно-плазменного луча. Процедура сопряжена с риском газовой эмболии и привела к смерти по крайней мере одного пациента. [42]
Процедура сопряжена с риском газовой эмболии и привела к смерти по крайней мере одного пациента. [42]
Синие аргоновые лазеры используются в хирургии для сварки артерий, разрушения опухолей и исправления дефектов глаз. [21]
Аргон также использовался экспериментально для замены азота в дыхательной или декомпрессионной смеси, известной как Argox, для ускорения выведения растворенного азота из крови. [43]
Освещение
Аргоновая газоразрядная лампа с символом аргона “Ar”
Лампы накаливания заполнены аргоном, чтобы предохранить нити накала при высокой температуре от окисления. Он используется для особого способа ионизации и излучения света, например, в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц. Газоразрядные лампы, наполненные чистым аргоном, дают сиренево-фиолетовый свет; с аргоном и небольшим количеством ртути синий свет. Аргон также используется для синих и зеленых аргон-ионных лазеров.
Разное применение
Аргон используется для теплоизоляции в энергосберегающих окнах. [44] Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и имеет низкую теплопроводность. [45]
Аргон используется в качестве топлива при разработке магнитоплазменной ракеты с переменным удельным импульсом (VASIMR). Сжатому аргону разрешено расширяться для охлаждения головок ГСН некоторых версий ракеты AIM-9 Sidewinder и других ракет, в которых используются охлаждаемые головки ГСН. Газ хранится под высоким давлением. [46]
Аргон-39 с периодом полураспада 269 лет использовался для ряда приложений, в первую очередь для датирования ледяных кернов и грунтовых вод. Кроме того, калий-аргоновое датирование используется для датирования магматических пород. [21]
Аргон использовался спортсменами в качестве допинга для имитации гипоксических состояний.


 Таким образом, он может содержать серьезные ошибки.
Таким образом, он может содержать серьезные ошибки.