Алюминий какое это вещество – Алюминий – общая характеристика элемента, химические свойства » HimEge.ru
alexxlab | 06.08.2020 | 0 | Вопросы и ответы
Алюминий как химический элемент и простое вещество – ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ІА — ІІІА ГРУПП – МЕТАЛЛИЧЕСКИЕ ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ – Химия 10 класс – Н.М. Буринская
РАЗДЕЛ 3 МЕТАЛЛИЧЕСКИЕ ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ІА — ІІІА ГРУПП
§ 65. Алюминий как химический элемент и простое вещество
Осознание содержания этого пункта позволяет:
характеризовать Алюминий по месту в периодической системе и электронному строению атома, распространенность в природе; физические и химические свойства, добыча, применение его простого вещества; составлять уравнения, схемы электронного баланса соответствующих реакций;
оценивать биологическую роль.
Алюминий как химический элемент. Его название происходит от латинского слова alumen (aluminis) — квасцы, название двойной соли К2SO4 • Al2(SO4)3, в состав которой входит Алюминий. Соединение известная еще с V века. к н. е., использовалась для окрашивания тканей и как кровоостанавливающее средство.
Алюминий — химический элемент ІІІА группы. Согласно с местом Алюминия в ІІІА группе периодической системы на внешнем энергетическом уровне его атома содержатся три валентные электроны, электронная конфигурация которых 3ѕ23р1. Алюминий — металлический г-элемент. В химических реакциях атомы Алюминия легко теряют три электроны и превращаются в тризарядні катионы:
В соединениях всегда степень окисления Алюминия +3, валентность III. Сравнивая химические элементы одного периода Na—”Mg—”Al, отметим, что металлические свойства элементов этого ряда постепенно ослабляются, а неметаллические — усиливаются. Об этом свидетельствует увеличение их электроотрицательности. У Алюминия это проявляется в том, что его оксид Al2O3 и гидроксид Al(OH)3 являются амфотерными, то есть в зависимости от реагентов могут проявлять как основные, так и кислотные свойства.
Распространенность в природе. Алюминий — третий элемент за распространением в природе после Кислорода и Кремния: его атомная доля в земной коре составляет 6,4 %. Случается всегда в составе соединений, преимущественно алюмосиликатов (рис. 119).
Биологическая роль. Алюминий вместе с Силіцієм и Оксигеном является основой неорганического мира, в небольшом количестве встречается в живых организмах: 50 — 140 мг у человека массой 70 кг. Распределяется во всех тканях и органах: сердце, легких, мозге, трубчатых костях, волосах и т. п; влияет на активность некоторых ферментов. Его избыток, предотвращая поступлению до костей Фосфора, вызывает так называемый алюминиевый рахит костей.
Алюминий как простое вещество. Это серебристо-белый металл (рис. 120), достаточно легкоплавкий (tпл = 660 °С), очень легкий (р = 2,7 г/см3), но твердый (твердость 2,5). Имеет высокую электропроводность, однако уступает в этом меди.
Рис. 120. Алюминий
Благодаря чрезвычайной пластичности хорошо поддается механической обработке: прокатывается в фольгу толщиной до 0,01 мм, вытягивается в тонкую проволоку, отливается; образует сплавы.
Относится к химически активных металлов. В витискувальному ряде металлов содержится в начале, за магнием. Как активный металл алюминий реагирует с неметаллами, водой, кислотами. Немета – личный характер его свойств проявляется в реакциях со щелочами. Во всех реакциях выполняет роль восстановителя.
Однако как на воздухе, так и в воде алюминий не обнаруживает прогнозируемой химической активности, потому что его поверхность покрыта оксидной пленкой Al2O3, которая защищает металл от дальнейшего окисления и обусловливает его высокую коррозионную стойкость. Хотя толщина этой пленки составляет всего 1 10-5 мм, она прочная, твердая и гибкая, не разрушается при растяжении, закручивании и изгибе, проводит ток, плавится при температуре 2050 °С (сравните с температурой плавления алюминия). Придает поверхности алюминия матового вида.
Взаимодействие с неметаллами. Алюминий легко реагирует с неметаллами (галогенами, кислородом, серой, азотом, углеродом), особенно в порошкообразном состоянии. Образуются соответственно оксид, галогениды, нитриды, карбид. Для начала реакций необходимо предварительное нагревание за исключением реакций с галогенами. Зато дальше ход реакций очень бурное, с выделением большого количества теплоты. Вспомните реакцию алюминия с йодом, с которой вы ознакомились при изучении свойств галогенов:
Взаимодействие с водой. Алюминий устойчив к воздействию воды, даже кипящей, благодаря оксидной пленке на его поверхности. Если эту пленку разрушить (потереть поверхность алюминия наждачной бумагой или погрузить ненадолго в горячий раствор щелочи), то алюминий активно взаимодействует с водой с выделением водорода. На рисунке 121 видим две пробирки: в первой — выделение водорода в начале реакции, во второй — образование осадка Аl(ОН)3 после окончания реакции:
– Составьте схемы электронного баланса.
Взаимодействие с оксидами металлических элементов. Алюминий взаимодействует с оксидами большинства металлических элементов, даже щелочных:
2Al + 3К2О = Аl2О3 + 6К; 8Al + 3Fe3O4 = 4Аl2О3 + 9Fe
Рис. 121. Реакция алюминия с водой
Все вещества эти реакции находятся в твердом состоянии, поэтому к реакции нельзя применить известное правило витискувального ряда металлов. В этом случае реакция становится возможной благодаря прочности кристаллической решетки алюминий оксида. При ее образовании выделяется значительное количество энергии и температура достигает 3500 °С, что является достаточным для разрушения кристаллов другого оксида и восстановления металла. При этих условиях восстановленный металл находится в жидком состоянии, а алюминий оксид всплывает на поверхность в виде шлака.
Смесь порошкообразных алюминия и оксида металлического элемента называется термітом (от греч. терме — теплота), а способ добывания металлов — алюмотермією. Этим способом добывают хром, марганец, титан и тому подобное.
Способ извлечения металлов при помощи алюминия предложил в середине XIX века. известный ученый Н. М. Бекетов.
Взаимодействие с кислотами. При стандартных условиях алюминий взаимодействует с кислотами — хлоридной и разбавленной сульфатной, восстанавливая Водород и образуя соли:
Стоит помнить, что концентрированная сульфатная кислота и любой концентрации азотная кислота на холоде пассивируют алюминий: при действии этих кислот увеличивается толщина оксидной пленки, и металл не взаимодействует с ними. Вот почему эти кислоты можно хранить и перевозить в алюминиевых цистернах.
Однако при нагревании реакции происходят:
Взаимодействие с щелочами. Алюминий легко растворяется в водных растворах щелочей, выделяя водород в зависимости от молярного соотношения веществ:
Эта реакция применяется для получения в лаборатории водорода и предостерегает не хранить щелочи в алюминиевой посуде.
Добывания. В промышленности алюминий получают электролизом раствора алюминий оксида в расплавленном криолите Na3l(AlF6)с добавкой кальций флуориду. Алюминий оксид Al2O3 добывают из боксита и нефелина.
Порошкообразный алюминий впервые получил немецкий химик Ф. Велер (1827). Лишь 18 лет спустя он получил алюминий в виде маленьких гранул. Новый металл был похож на серебро, но легче. Такие ценные свойства обусловили его стоимость: с середины XIX века. алюминий ценили больше, чем золото.
Технически доступным металлом алюминий стал после того, как был найден способ снижения температуры плавления алюминий оксида при помощи криолита Na3[AlF6]. Алюминий начали добывать в больших количествах, поэтому он быстро подешевел. В настоящее время по объему производства среди металлов алюминий занимает второе место после железа.Применение. Основная масса алюминия идет на изготовление алюминиевых сплавов: дюралюминий, силумин для авиационной и космической техники, водного и наземного транспорта. Из алюминия изготавливают электрические провода, осветительные ракеты, посуда, применяют для получения металлов. Порошок алюминия является пигментом для краски («срібнянки»), которая защищает железо от коррозии. Алюминиевую фольгу используют в радиотехнике для изготовления конденсаторов, как оберточный материал в пищевой промышленности.
Коротко о главном
Алюминий — металлический элемент ІІІА группы периодической системы. Имеет три валентные электроны. В реакциях проявляет только восстановительные свойства. Степень окисления Алюминия в соединениях +3. Его оксид и гидроксид являются амфотерными.
За распространением в природе Алюминий занимает третье место после Кислорода и Кремния. Случается в составе соединений, преимущественно алюмосиликатов.
Простое вещество алюминий — это серебристо-белый металл, легкоплавкий, легкий, пластичный, хорошо проводит теплоту и электрический ток. Является химически активным металлом. Способ восстановления оксидов металлических элементов алюминием называется алюмотермією.
Алюминий добывают электролизом расплава его оксида Al2O3 в криолите Na3[AlF6]. Находит широкое применение.
schooled.ru
Алюминий как химический элемент и простое вещество
Осознание содержания этого пункта позволяет:
характеризовать Алюминий по месту в периодической системе и электронным строением атома, распространенность в природе; физические и химические свойства, получение, применение его простого вещества; составлять уравнения, схемы электронного баланса соответствующих реакций;
оценивать биологическую роль.
Алюминий как химический элемент. Его название происходит от латинского слова alumen (aluminis) — квасцы, название двойной соли К2SO4 • Al2 (SO4) 3, в состав которой входит Алюминий. Соединение известна еще с V в. до н. е., использовалась для окраски тканей и как кровоостанавливающее средство.
Алюминий — химический элемент Ша группы. Согласно месту Алюминия в Ша группе периодической системы на внешнем энергетическом уровне его атома содержатся три валентные электроны, электронная конфигурация которых 3s23р1. Алюминий — металлический р- элемент. В химических реакциях атомы алюминия легко теряют три электрона и превращаются в трехзарядных катионы.
В соединениях всегда степень окисления алюминия +3, валентность ИИИ. Сравнивая химические элементы одного периода Na- > Mg — > Al, отметим, что металлические свойства элементов этого ряда постепенно ослабляются, а неметаллические — усиливаются. Об этом свидетельствует увеличение их электроотрицательности. В Алюминия это проявляется в том, что его оксид Al2O3 и гидроксид Al (OH) 3 являются амфотерными, т.е. в зависимости от реагентов могут проявлять как основные, так и кислотные свойства.
Распространенность в природе. Алюминий — третий элемент с распространением в природе после кислорода и кремния: его атомная доля в земной коре составляет 6,4 %. Случается всегда в составе соединений, преимущественно алюмосиликатов (рис. 119).
Биологическая роль. Алюминий вместе с кремния и кислорода является основой неорганического мира, в небольшом количестве встречается в живых организмах: 50 — 140 мг в человека массой 70 кг. Распределяется во всех тканях и органах: сердце, легких, мозга, трубчатых костях, волосах и т.п.; влияет на активность некоторых ферментов. Его избыток, предотвращая поступление в кости фосфора, вызывает так называемый алюминиевый рахит костей.
Алюминий как простое вещество. Это серебристо — белый металл (рис. 120), достаточно легкоплавкий (tпл = 660 ° С), очень легкий (р = 2,7 г/см3), но твердый (твердость 2,5). Обладает высокой электропроводностью, однако уступает в этом меди.
Благодаря чрезвычайной пластичности хорошо поддается механической обработке: прокатывается в фольгу толщиной до 0,01 мм, вытягивается в тонкую проволоку, отливается; образует сплавы.
Относится к химически активных металлов. В вытеснительный ряде металлов содержится в начале, за магнием. Как активный металл алюминий реагирует с неметаллами, водой, кислотами. Немета — лично характер его свойств проявляется в реакциях со щелочами. Во всех реакциях выполняет роль восстановителя.
Однако как на воздухе, так и в воде алюминий не обнаруживает прогнозируемой химической активности, потому что его поверхность покрыта оксидной пленкой Al2O3, которая защищает металл от дальнейшего окисления и обусловливает его высокую коррозионную стойкость. Хотя толщина этой пленки составляет всего 1 10-5 мм, она прочная, твердая и гибкая, не разрушается при растяжении, закручивании и сгибании, проводит электрический ток, плавится при температуре 2050 ° С (сравните с температурой плавления алюминия). Придает поверхности алюминия матового вида.
Взаимодействие с неметаллами. Алюминий легко реагирует с неметаллами (галогенами, кислородом, серой, азотом, углеродом), особенно в порошкообразном состоянии. Образуются соответственно оксид, галогениды, нитрид, карбид. Для начала реакций необходимо предварительный нагрев за исключением реакций с галогенами. Зато дальше ход реакций очень бурное, с выделением большого количества теплоты.
Все вещества этих реакции находятся в твердом состоянии, поэтому реакции нельзя применить известное правило вытеснительный ряда металлов. В этом случае реакция становится возможной благодаря прочности кристаллической решетки оксида алюминия. При ее образовании выделяется значительное количество энергии и температура достигает 3500 ° С, что является достаточным для разрушения кристаллов другого оксида и восстановления металла. В этих условиях восстановлен металл находится в жидком состоянии, а оксид алюминия всплывает на поверхность в виде шлака.
Смесь порошкообразных алюминия и оксида металлического элемента называется термитом (от греч. Терм — теплота), а способ получения металлов — Алюмотермией. Этим способом добывают хром, марганец, титан и т.д..
Способ получения металлов с помощью алюминия предложил в середине XIX в. известный ученый Н. Н. Бекетов.
Порошкообразный алюминий впервые добыл немецкий химик Ф. Велер (1827). Только 18 лет спустя он получил алюминий в виде маленьких гранул. Новый металл был похож на серебро, но легче. Такие ценные свойства обусловили его стоимость: с середины XIX в. алюминий ценили больше, чем золото.
Технически доступным металлом алюминий стал после того, как был найден способ снижения температуры плавления оксида алюминия с помощью криолита Na3 [ AlF6 ]. Алюминий начали добывать в больших количествах, поэтому он быстро подешевел. Сейчас по объему производства среди металлов алюминий занимает второе место после железа.
Применение. Основная масса алюминия идет на изготовление алюминиевых сплавов: дюралюминий, силумин для авиационной и космической техники, водного и наземного транспорта. Из алюминия изготовляют электрические провода, осветительные ракеты, посуда, применяют для получения металлов. Порошок алюминия является пигментом для краски («срибнянкы»), которая защищает железо от коррозии. Алюминиевую фольгу используют в радиотехнике для изготовления конденсаторов, как оберточный материал — в пищевой промышленности.
Коротко о главном
Алюминий — металлический элемент Ша группы периодической системы. Имеет три валентные электроны. В реакциях проявляет только восстановительные свойства. Степень окисления алюминия в соединениях +3. Его оксид и гидроксид являются амфотерными.
По распространению в природе Алюминий занимает третье место после кислорода и кремния. Встречается в составе соединений, преимущественно алюмосиликатов.
Простое вещество алюминий — это серебристо — белый металл, легкоплавкий, легкий, пластичный, хорошо проводит теплоту и электрический ток. Есть химически активным металлом. Способ восстановления оксидов металлических элементов алюминием называется Алюмотермией.
Алюминий добывают электролизом расплава его оксида Al2O3 в криолите Na3 [ AlF6 ]. Находит широкое применение.
категория: Химияmoykonspekt.ru
алюминий – это… Что такое алюминий?
АЛЮМИ́НИЙ -я; м. [от лат. alumen (aluminis) – квасцы]. Химический элемент (Al), серебристо-белый лёгкий ковкий металл с высокой электропроводностью (применяемый в авиации, электротехнике, строительстве, быту и т.п.). Сульфат алюминия. Сплавы алюминия.
АЛЮМИ́НИЙ (лат. Aluminium), Al (читается «алюминий»), химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3s2p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III).Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
История открытия
Латинское aluminium происходит от латинского же alumen, означающего квасцы (см. КВАСЦЫ) (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия (см. АЛЮМИНИЯ ОКСИД)) сделал еще в 1754 немецкий химик А. Маргграф (см. МАРГГРАФ Андреас Сигизмунд). Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед (см. ЭРСТЕД Ханс Кристиан). Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль (см. СЕНТ-КЛЕР ДЕВИЛЬ Анри Этьен) в 1854 предложил использовать для получения алюминия металлический натрий (см. НАТРИЙ), и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (см. ЭРУ Поль Луи Туссен) (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Нахождение в природе
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов (см. АЛЮМОСИЛИКАТЫ), и горных пород. Соединения алюминия содержат граниты (см. ГРАНИТ), базальты (см. БАЗАЛЬТ), глины (см. ГЛИНА), полевые шпаты (см. ПОЛЕВЫЕ ШПАТЫ) и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов (см. БОКСИТЫ) — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты (см. АЛУНИТ) и нефелины (см. НЕФЕЛИН).
В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
Промышленное получение
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит (см. КРИОЛИТ) Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:
2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99,7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99,999% и более.
Физические и химические свойства
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты (см. АЛЮМИНАТЫ): Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число (см. КООРДИНАЦИОННОЕ ЧИСЛО) 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].
При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода (см. ИОД) начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:
2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений (см. АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ), можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.
В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Такой способ получения металлов называют алюминотермией (см. АЛЮМИНОТЕРМИЯ).
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3Ї + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3Ї + 3H2O + 3NH4Cl.
Применение
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65,5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (см. ДУРАЛЮМИН) (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумина (85—90% Al, 10—14% Si, 0,1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
Алюминий в организме
В организм человека алюминий ежедневно поступает с пищей (около 2—3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
dic.academic.ru
Характеристика алюминия. Алюминий: общая характеристика
Каждый химический элемент можно рассмотреть с точки зрения трех наук: физики, химии и биологии. И в этой статье мы постараемся как можно точнее дать характеристику алюминию. Это химический элемент, находящийся в третьей группе и третьем периоде, согласно таблице Менделеева. Алюминий – металл, который обладает средней химической активностью. Также в его соединениях можно наблюдать амфотерные свойства. Атомная масса алюминия составляет двадцать шесть грамм на моль.
Физическая характеристика алюминия
При нормальных условиях он представляет собой твердое вещество. Формула алюминия очень проста. Он состоит из атомов (не объединятся в молекулы), которые выстроены с помощью кристаллической решетки в сплошное вещество. Цвет алюминия – серебристо-белый. Кроме того, он обладает металлическим блеском, как и все другие вещества данной группы. Цвет алюминия, используемого в промышленности, может быть различным в связи с присутствием в сплаве примесей. Это достаточно легкий металл. Его плотность равняется 2,7 г/см3, то есть он приблизительно в три раза легче, чем железо. В этом он может уступить разве что магнию, который еще легче рассматриваемого металла. Твердость алюминия довольно низкая. В ней он уступает большинству металлов. Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Его плотность равняется 2,7 г/см3, то есть он приблизительно в три раза легче, чем железо. В этом он может уступить разве что магнию, который еще легче рассматриваемого металла. Твердость алюминия довольно низкая. В ней он уступает большинству металлов. Твердость алюминия составляет всего два по шкале Мооса. Поэтому для ее усиления в сплавы на основе данного металла добавляют более твердые.
Плавление алюминия происходит при температуре всего в 660 градусов по шкале Цельсия. А закипает он при нагревании до температуры две тысячи четыреста пятьдесят два градуса по Цельсию. Это очень пластичный и легкоплавкий металл. На этом физическая характеристика алюминия не заканчивается. Еще хотелось бы отметить, что данный металл обладает самой лучшей после меди и серебра электропроводностью.
Распространенность в природе
Алюминий, технические характеристики которого мы только что рассмотрели, достаточно часто встречается в окружающей среде. Его можно наблюдать в составе многих минералов. Элемент алюминий – четвертый среди всех по распространенности в природе. Его массовая доля в земной коре составляет почти девять процентов. Основные минералы, в составе которых присутствуют его атомы, это боксит, корунд, криолит. Первый – это горная порода, которая состоит из оксидов железа, кремния и рассматриваемого металла, также в структуре присутствуют молекулы воды. Он имеет неоднородную окраску: фрагменты серого, красновато-коричневого и других цветов, которые зависят от наличия различных примесей. От тридцати до шестидесяти процентов данной породы – алюминий, фото которого можно увидеть выше. Кроме того, очень распространенным в природе минералом является корунд.

Это оксид алюминия. Его химическая формула – Al2O3. Он может обладать красным, желтым, голубым либо коричневым цветом. Его твердость по шкале Мооса составляет девять единиц. К разновидностям корунда относятся всем известные сапфиры и рубины, лейкосапфиры, а также падпараджа (желтый сапфир).
Криолит – это минерал, имеющий более сложную химическую формулу. Он состоит из фторидов алюминия и натрия – AlF3•3NaF. Выглядит как бесцветный или сероватый камень, обладающий низкой твердостью – всего три по шкале Мооса. В современном мире его синтезируют искусственно в лабораторных условиях. Он применяется в металлургии.
Также алюминий можно встретить в природе в составе глин, основным компонентов которых являются оксиды кремния и рассматриваемого металла, связанные с молекулами воды. Кроме того, данный химический элемент можно наблюдать в составе нефелинов, химическая формула которых выглядит следующим образом: KNa3[AlSiO4]4.
Получение
Характеристика алюминия предусматривает рассмотрение способов его синтеза. Существует несколько методов. Производство алюминия первым способом происходит в три этапа. Последним из них является процедура электролиза на катоде и угольном аноде. Для проведения подобного процесса необходим оксид алюминия, а также такие вспомогательные вещества, как криолит (формула – Na3AlF6) и фторид кальция (CaF2). Для того чтобы произошел процесс разложения растворенного в воде оксида алюминия, нужно его вместе с расплавленным криолитом и кальция фторидом нагреть до температуры минимум в девятьсот пятьдесят градусов по шкале Цельсия, а затем пропустить сквозь эти вещества ток силой в восемьдесят тысяч ампер и напряжением в пять-восемь вольт. Таким образом, вследствие данного процесса на катоде осядет алюминий, а на аноде будут собираться молекулы кислорода, которые, в свою очередь, окисляют анод и превращают его в углекислый газ. Перед проведением данной процедуры боксит, в виде которого добывается алюминия оксид, предварительно очищается от примесей, а также проходит процесс его обезвоживания.

Производство алюминия способом, описанным выше, является очень распространенным в металлургии. Также существует метод, изобретенный в 1827 году Ф. Велером. Он заключается в том, что алюминий можно добыть с помощью химической реакции между его хлоридом и калием. Осуществить подобный процесс можно, только создав специальные условия в виде очень высокой температуры и вакуума. Так, из одного моль хлорида и такого же объема калия можно получить один моль алюминия и три моль хлорида калия как побочного продукта. Данную реакцию можно записать в виде такого уравнения: АІСІ3 + 3К = АІ + 3КСІ. Указанный метод не приобрел большой популярности в металлургии.
Характеристика алюминия с точки зрения химии
Как уже было сказано выше, это простое вещество, которое состоит из атомов, не объединенных в молекулы. Подобные структуры формируют почти все металлы. Алюминий обладает достаточно высокой химической активностью и сильными восстановительными свойствами. Химическая характеристика алюминия начнется с описания его реакций с другими простыми веществами, а далее будут описаны взаимодействия со сложными неорганическими соединениями.
Алюминий и простые вещества
К таковым относится, в первую очередь, кислород – самое распространенное соединение на планете. Из него на двадцать один процент состоит атмосфера Земли. Реакции данного вещества с любыми другими называются окислением, или горением. Оно обычно происходит при высоких температурах. Но в случае с алюминием возможно окисление в нормальных условиях – так образуется пленка оксида. Если же данный металл измельчить, он будет гореть, выделяя при этом большое количество энергии в виде тепла. Для проведения реакции между алюминием и кислородом нужны эти компоненты в молярном соотношении 4:3, в результате чего получим две части оксида.
Данное химическое взаимодействие выражается в виде следующего уравнения: 4АІ + 3О2 = 2АІО3. Также возможны реакции алюминия с галогенами, к которым относятся фтор, йод, бром и хлор. Названия данных процессов происходят от названий соответствующих галогенов: фторирование, йодирование, бромирование и хлорирование. Это типичные реакции присоединения.
Для примера приведем взаимодействие алюминия с хлором. Такого рода процесс может произойти только на холоде.
Так, взяв два моль алюминия и три моль хлора, получим в результате два моль хлорида рассматриваемого металла. Уравнение этой реакции выглядит следующим образом: 2АІ + 3СІ = 2АІСІ3. Таким же способом можно получить фторид алюминия, его бромид и йодид.
С серой рассматриваемое вещество реагирует только при нагревании. Для проведения взаимодействия между этими двумя соединениями нужно взять их в молярных пропорциях два к трем, и образуется одна часть сульфида алюминия. Уравнение реакции имеет такой вид: 2Al + 3S = Al2S3.
Кроме того, при высоких температурах алюминий взаимодействует и с карбоном, образуя карбид, и с азотом, образуя нитрид. Можно привести в пример следующие уравнения химических реакций: 4АІ + 3С = АІ4С3; 2Al + N2 = 2AlN.
Взаимодействие со сложными веществами
К ним относятся вода, соли, кислоты, основания, оксиды. Со всеми этими химическими соединениями алюминий реагирует по-разному. Давайте разберем подробнее каждый случай.
Реакция с водой
С самым распространенным на Земле сложным веществом алюминий взаимодействует при нагревании. Происходит это только в случае предварительного снятия пленки из оксида. В результате взаимодействия образуется амфотерный гидроксид, а также в воздух выделяется водород. Взяв две части алюминия и шесть частей воды, получим гидроксид и водород в молярных пропорциях два к трем. Записывается уравнение этой реакции так: 2АІ + 6Н2О = 2АІ(ОН)3 + 3Н2.
Взаимодействие с кислотами, основаниями и оксидами
Как и другие активные металлы, алюминий способен вступать в реакцию замещения. При этом он может вытеснить водород из кислоты либо катион более пассивного металла из его соли. В результате таких взаимодействий образуется соль алюминия, а также выделяется водород (в случае с кислотой) либо выпадает в осадок чистый металл (тот, который менее активен, чем рассматриваемый). Во втором случае и проявляются восстановительные свойства, которые упоминались выше. В пример можно привести взаимодействие алюминия с соляной кислотой, при котором образуется хлорид алюминия и выделяется в воздух водород. Подобного рода реакция выражается в виде следующего уравнения: 2АІ + 6НСІ = 2АІСІ3 + 3Н2.
Примером взаимодействия алюминия с солью может служить его реакция с сульфатом меди. Взяв эти два компонента, в итоге мы получим сульфат алюминия и чистую медь, которая выпадет в виде осадка. С такими кислотами, как серная и азотная, алюминий реагирует своеобразно. К примеру, при добавлении алюминия в разбавленный раствор нитратной кислоты в молярном соотношении восемь частей к тридцати образуется восемь частей нитрата рассматриваемого металла, три части оксида азота и пятнадцать – воды. Уравнение данной реакции записывают таким образом: 8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15h3O. Указанный процесс происходит только при наличии высокой температуры.
Если же смешать алюминий и слабый раствор сульфатной кислоты в молярных пропорциях два к трем, то получим сульфат рассматриваемого металла и водород в соотношении один к трем. То есть произойдет обыкновенная реакция замещения, как и в случае с другими кислотами. Для наглядности приведем уравнение: 2Al + 3h3SO4 = Al2(SO4)3 + 3h3. Однако с концентрированным раствором этой же кислоты все сложнее. Здесь так же, как и в случае с нитратной, образуется побочный продукт, но уже не в виде оксида, а в виде серы, и вода. Если мы возьмем два необходимых нам компонента в молярном соотношении два к четырем, то в результате получим по одной части соли рассматриваемого металла и серы, а также четыре – воды. Данное химическое взаимодействие можно выразить с помощью следующего уравнения: 2Al + 4h3SO4 = Al2(SO4)3 + S + 4h3O.  Кроме того, алюминий способен реагировать с растворами щелочей. Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
Кроме того, алюминий способен реагировать с растворами щелочей. Для проведения подобного химического взаимодействия нужно взять два моль рассматриваемого металла, столько же гидроксида натрия или калия, а также шесть моль воды. В результате образуются такие вещества, как тетрагидроксоалюминат натрия либо калия, а также водород, который выделяется в виде газа с резким запахом в молярных пропорциях два к трем. Данную химическую реакцию можно представить в виде следующего уравнения: 2АІ + 2КОН + 6Н2О = 2К[АІ(ОН)4] + 3Н2.
И последнее, что нужно рассмотреть, это закономерности взаимодействия алюминия с некоторыми оксидами. Самый распространенный и используемый случай – реакция Бекетова. Она, так же, как и многие другие из рассмотренных выше, происходит только при высоких температурах. Итак, для ее осуществления необходимо взять два моль алюминия и один моль оксида феррума. В результате взаимодействия этих двух веществ получим оксид алюминия и свободное железо в количестве один и два моль соответственно.
Использование рассматриваемого металла в промышленности
Отметим, что применение алюминия – очень частое явление. Прежде всего, в нем нуждается авиационная отрасль. Наряду со сплавами магния, здесь используются и сплавы на основе рассматриваемого металла. Можно сказать, что среднестатистический самолет на 50% состоит из сплавов алюминия, а его двигатель – на 25%. Также применение алюминия осуществляется в процессе изготовления проводов и кабелей благодаря его отличной электропроводности. Кроме того, данный металл и его сплавы широко применяются в автомобилестроении. Из этих материалов состоят корпусы автомобилей, автобусов, троллейбусов, некоторых трамваев, а также вагонов обычных и электропоездов. Также его используют и в менее масштабных целях, например, для производства упаковок для пищевых и других продуктов, посуды. Для того чтобы изготовить серебристую краску, необходим порошок рассматриваемого металла. Такая краска нужна для того, чтобы защитить железо от коррозии. Можно сказать, что алюминий – второй по частоте использования в промышленности металл после феррума. Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Также его используют и в менее масштабных целях, например, для производства упаковок для пищевых и других продуктов, посуды. Для того чтобы изготовить серебристую краску, необходим порошок рассматриваемого металла. Такая краска нужна для того, чтобы защитить железо от коррозии. Можно сказать, что алюминий – второй по частоте использования в промышленности металл после феррума. Его соединения и он сам часто применяются в химической промышленности. Это объясняется особыми химическими качествами алюминия, в том числе его восстановительными свойствами и амфотерностью его соединений. Гидроксид рассматриваемого химического элемента необходим для очистки воды. Кроме того, он используется в медицине в процессе производства вакцин. Также его можно найти в составе некоторых видов пластика и других материалов.
Роль в природе
Как уже было написано выше, алюминий в большом количестве содержится в земной коре. Он особенно важен для живых организмов. Алюминий участвует в регуляции процессов роста, формирует соединительные ткани, такие, как костная, связочная и другие. Благодаря данному микроэлементу быстрее осуществляются процессы регенерации тканей организма. Его нехватка характеризуется следующими симптомами: нарушения развития и роста у детей, у взрослых – хроническая усталость, пониженная работоспособность, нарушение координации движений, снижение темпов регенерации тканей, ослабевание мышц, особенно в конечностях. Такое явление может возникнуть, если вы употребляете слишком мало продуктов с содержанием данного микроэлемента.
Однако более частой проблемой является избыток алюминия в организме. При этом нередко наблюдаются такие симптомы: нервозность, депрессия, нарушения сна, снижение памяти, стрессоустойчивости, размягчение опорно-двигательного аппарата, что может привести к частым переломам и растяжениям. При длительном избытке алюминия в организме часто возникают проблемы в работе практически каждой системы органов.
К такому явлению может привести целый ряд причин. В первую очередь это алюминиевая посуда. Учеными уже давно доказано, что посуда, изготовленная из рассматриваемого металла, непригодна для приготовления в ней пищи, так как при высокой температуре часть алюминия попадает в пищу, и вследствие этого вы употребляете намного больше этого микроэлемента, чем нужно организму.
Вторая причина – регулярное применение косметических средств с содержанием рассматриваемого металла или его солей. Перед применением любого продукта нужно внимательно читать его состав. Не исключением являются и косметические средства.
Третья причина – прием препаратов, в которых содержится много алюминия, на протяжении длительного времени. А также неправильное употребление витаминов и пищевых добавок, в состав которых входит данный микроэлемент.
Теперь давайте разберемся, в каких продуктах содержится алюминий, чтобы регулировать свой рацион и организовывать меню правильно. В первую очередь это морковь, плавленые сыры, пшеница, квасцы, картофель. Из фруктов рекомендуются авокадо и персики. Кроме того, богаты алюминием белокочанная капуста, рис, многие лечебные травы. Также катионы рассматриваемого металла могут содержаться в питьевой воде. Чтобы избежать повышенного или пониженного содержания алюминия в организме (впрочем, так же, как и любого другого микроэлемента), нужно тщательным образом следить за своим питанием и стараться сделать его как можно более сбалансированным.
fb.ru
Алюминий — Мегаэнциклопедия Кирилла и Мефодия — статья
Радиус нейтрального атома алюминия 0, 143 нм, радиус иона Al3+ 0, 057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5, 984, 18, 828, 28, 44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1, 5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
Латинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8, 8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99, 7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99, 999% и более.
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0, 40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2, 6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2, 5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1, 663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты: Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3H2O + 3NH4Cl.
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65, 5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (94% Al, 4% Cu, по 0, 5% Mg, Mn, Fe и Si), силумина (85-90% Al, 10-14% Si, 0, 1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
В организм человека алюминий ежедневно поступает с пищей (около 2-3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
- Беляев А. И. История алюминия, в сб. Труды Института истории естествознания и техники, т. 20, М., 1959.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Промышленные алюминиевые сплавы. М., 1984.
megabook.ru
Химические и физические свойства алюминия. Физические свойства гидроксида алюминия :: SYL.ru
Этот легкий металл с серебристо-белым оттенком в современной жизни встречается почти повсеместно. Физические и химические свойства алюминия позволяют широко использовать его в промышленности. Самые известные месторождения – в Африке, Южной Америке, в Карибском регионе. В России места добычи бокситов имеются на Урале. Мировыми лидерами по производству алюминия являются Китай, РФ, Канада, США.
Добыча Al
В природе этот серебристый металл в силу своей высокой химической активности встречается лишь в виде соединений. Наиболее известные геологические породы, содержащие алюминий, – это бокситы, глиноземы, корунды, полевые шпаты. Промышленное значение имеют бокситы и глиноземы, именно месторождения этих руд позволяют добывать алюминий в чистом виде.
Свойства
Физические свойства алюминия позволяют легко вытягивать заготовки этого металла в проволоку и прокатывать в тонкие листы. Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком. Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии. При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Внутреннее строение алюминия
Физические и химические свойства алюминия во многом зависят от его внутреннего строения. Кристаллическая решетка этого элемента является разновидностью гранецентрированного куба. 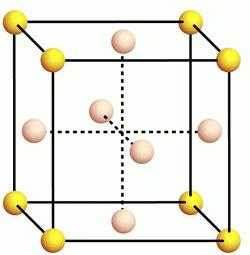 Данный тип решетки присущ многим металлам, таким, как медь, бром, серебро, золото, кобальт и другие. Высокая теплопроводность и способность проводить электричество сделали этот металл одним из самых востребованных в мире. Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.
Данный тип решетки присущ многим металлам, таким, как медь, бром, серебро, золото, кобальт и другие. Высокая теплопроводность и способность проводить электричество сделали этот металл одним из самых востребованных в мире. Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.
Легирование алюминия
Физические свойства меди и алюминия таковы, что при добавлении к алюминиевому сплаву некоторого количества меди его кристаллическая решетка искривляется, и прочность самого сплава повышается. На этом свойстве Al основано легирование легких сплавов для повышения их прочности и стойкости к воздействию агрессивной среды.
Объяснение процесса упрочнения лежит в поведении атомов меди в кристаллической решетке алюминия. Частицы Cu стремятся выпасть из кристаллической решетки Al, группируются на ее особых участках. 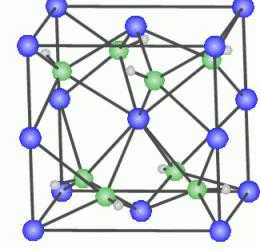 Там, где атомы меди образуют скопления, образуется кристаллическая решетка смешанного типа CuAl2 , в которой частицы серебристого металла одновременно входят в состав и общей кристаллической решетки алюминия, и в состав решетки смешанного типа CuAl2. Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Там, где атомы меди образуют скопления, образуется кристаллическая решетка смешанного типа CuAl2 , в которой частицы серебристого металла одновременно входят в состав и общей кристаллической решетки алюминия, и в состав решетки смешанного типа CuAl2. Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Химические свойства
Известно взаимодействие алюминия с разбавленными серной и соляной кислотой. При нагревании этот металл в них легко растворяется. Холодная концентрированная или сильно разбавленная азотная кислота не растворяет этот элемент. Водные растворы щелочей активно воздействуют на вещество, в процессе реакции образуя алюминаты – соли, в составе которых имеются ионы алюминия. Например:
Al2O3 +3h3O+2NaOH=2Na[Al(OH)4]
Получившееся в результате реакции соединение носит название тетрагидроксоалюминат натрия.
Тонкая пленка на поверхности алюминиевых изделий защищает этот металл не только от воздуха, но и от воды. Если эту тонкую преграду убрать, элемент станет бурно взаимодействовать с водой, выделяя из нее водород.
2AL+6H2O= 2 AL (OH)3+3Н2↑
Образовавшееся вещество называется гидроксидом алюминия.
AL (OH)3 реагирует с щелочью, образуя кристаллы гидроксоалюмината:
Al(OH)2+NaOH=2Na[Al(OH)4]
Если это химическое уравнение сложить с предыдущим, получим формулу растворения элемента в щелочном растворе.
Al(OH)3+2NaOH+6H2O=2Na [Al(OH)4]+3H2↑
Горение алюминия
Физические свойства алюминия позволяют ему вступать в реакцию с кислородом. Если порошок этого металла или алюминиевую фольгу нагреть, то она вспыхивает и горит белым ослепительным пламенем. В конце реакции образуется оксид алюминия Al2O3.
Глинозем
Полученный оксид алюминия имеет геологическое название глинозем. В естественных условиях он встречается в виде корунда – твердых прозрачных кристаллов. Корунд отличается высокой твердостью, в шкале твердых веществ его показатель составляет 9. Сам корунд бесцветен, но различные примеси могут окрасить его в красный и синий цвет, так получаются драгоценные камни, которые в ювелирном деле называются рубинами и сапфирами.
Физические свойства оксида алюминия позволяют выращивать эти драгоценные камни в искусственных условиях. Технические драгоценные камни используются не только для ювелирных украшений, они применяются в точном приборостроении, для изготовления часов и прочего. Широко используются искусственные кристаллы рубина и в лазерных устройствах.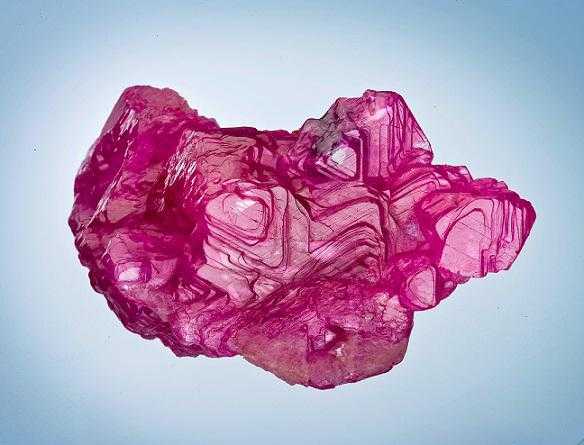
Мелкозернистая разновидность корунда с большим количеством примесей, нанесенная на специальную поверхность, известна всем как наждак. Физические свойства оксида алюминия объясняют высокие абразивные свойства корунда, а также его твердость и устойчивость к трению.
Гидроксид алюминия
Al2 (OH)3 является типичным амфотерным гидроксидом. В соединении с кислотой это вещество образует соль, содержащую положительно заряженные ионы алюминия, в щелочах образует алюминаты. Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.  В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
Промышленное использование
Алюминий был открыт в 1825 году. Поначалу данный металл ценился выше золота и серебра. Это объяснялось сложностью его извлечения из руды. Физические свойства алюминия и его способность быстро образовывать защитную пленку на своей поверхности затрудняли исследование этого элемента. Лишь в конце 19 века был открыт удобный способ плавки чистого элемента, пригодный для использования в промышленных масштабах.
Легкость и способность сопротивляться коррозии – уникальные физические свойства алюминия. Сплавы этого серебристого металла применяются в ракетной технике, в авто-, судо-, авиа- и приборостроении, в производстве столовых приборов и посуды.
Как чистый металл Al используется при изготовлении деталей для химической аппаратуры, электропроводов и конденсаторов. Физические свойства алюминия таковы, что его электропроводность не так высока, как у меди, но этот недостаток компенсируется легкостью рассматриваемого металла, что позволяет делать провода из алюминия более толстыми. Так, при одинаковой электропроводности алюминиевый провод весит в два раза меньше медного.
Не менее важным является применение Al в процессе алитирования. Так называется реакция насыщения поверхности чугунного или стального изделия алюминием с целью защиты основного металла от коррозии при нагревании.
В настоящее время изведанные запасы алюминиевых руд вполне сопоставимы с потребностями людей в этом серебристом металле. Физические свойства алюминия могут преподнести еще немало сюрпризов его исследователям, а сферы применения этого металла гораздо шире, чем можно представить.
www.syl.ru
Алюминий в природе (7,5% в Земной коре)
Алюминий был выделен в ходе эксперимента по воздействию калиевых соединений ртути на природные бокситы. Учитывая всю сложность процесса, алюминий на протяжении нескольких десятилетий оставался самым дорогим металлом на земле.
Научные изыскания привели к открытию относительно дешевого способа получения алюминия по методу поэтапного электролиза с дальнейшей очисткой и осаждением металла. Повсеместное распространение этого метода позволило получать чистый алюминий в промышленных масштабах. Текущие показатели среднесуточного производства этого металла превышают 130 тысяч тонн.
Основные характеристики

Легкий парамагнитный металл серебристого цвета с мутноватой поверхностью. Хорошо поддается формовке и ковке, практически не подвержен коррозии. На открытом воздухе покрывается естественным защитных слоем из окислов, что предотвращает дальнейшие реакции между алюминием и атмосферным кислородом. Имеет относительно малую прочность на излом, быстро накапливает усталость, что ограничивает его использование в чистом виде.
Хорошо проводит электричество и тепловую энергию, уступая по этим показателям лишь меди и металлам платиновой подгруппы. Относительная дешевизна алюминия обеспечили ему широкое распространение в качестве конструкционного металла и универсального диэлектрика.
Физические свойства

Металл пластичный, со сравнительно низкой плотностью при высоких конструкционных показателях (высокая тепло- и электропроводимость, устойчивость к коррозионному воздействию). Основные физические свойства алюминия можно выделить в виде следующего списка:
- Плотность — 2,7 г/см3;
- Температура плавления — 659 0С;
- Коэффициент пластичности — 50%;
- Коэффициент электропроводности — 32*106 См/м;
- Средний показатель теплопроводности — 204 Вт/м;
В отличие от таких металлов, как свинец или медь, при нагревании до отметки в 600 градусов Цельсия алюминий становится хрупким, разбивается на отдельные гранулы или зерна. Отлично проводит тепло, легко нагревается и также легко остывает без каких-либо последствий для кристаллической решетки металла.
Алюминий — довольно активный метал, легко сплавляется с другими металлами и неметаллами, образуя равномерную кристаллическую решетку с высокими конструктивными качествами.
Химические свойства

Химически активный амфотерный элемент:
- Реагирует с хлором, бромом и другими галогенами, образуя соответствующие соли;
- Вступает в реакции с неметаллами;
- Растворяется в сильных кислотах;
- Обладает свойством восстанавливать другие металлы, что используется при очистке железа и хрома;
Все вышеперечисленные реакции требуют наличия дополнительных катализаторов и проводятся при нагревании.
Содержание алюминия в природе
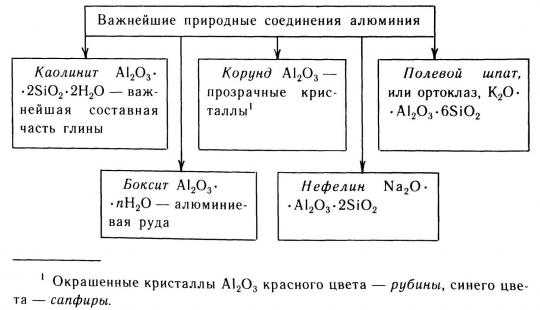
Относительное содержание алюминия определено в пределах от 7% до 8% (в среднем — 7,5% по массе). Количественная оценка включает в себя все минералы и соли алюминия. Металл входит в состав огромного количества природных соединений. Основным промышленным сырьем для получения чистого алюминия являются бокситы, алюмосиликаты и другие природные минералы, содержащие оксид алюминия.
Сфера применения
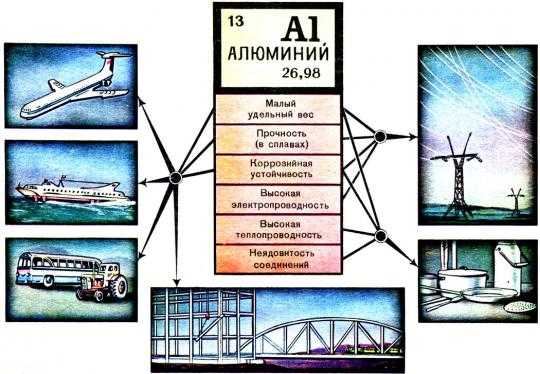
Сочетание низкой стоимости, устойчивости к коррозии и высокой реактивной способности вывели алюминий в лидеры среди всех металлов, используемых современной промышленностью. Алюминий — самая распространенная легирующая добавка для изготовления сплавов на основе меди, магния, титана и никеля. Повышает показатели упругости и прочности, придает сплаву антикоррозионные свойства.
Алюминий несильно уступает меди по электропроводности, при этом имеет в 4-5 раз меньшую стоимость и значительно более легкий процесс очистки, что объясняет его распространение для изготовления проводниковых элементов, конденсаторов и электронных компонентов.
Также алюминий используется в качестве химического катализатора (в составе комбинированных соединений), при производстве зеркал и взрывчатых веществ. Нейтральность алюминия позволяет использовать его в пищевой промышленности для изготовления упаковочных материалов и посуды.
xn—-8sbiecm6bhdx8i.xn--p1ai

